Меню сайта |
| Новые файлы Статистика Онлайн всего: 1 Гостей: 1 Пользователей: 0 | ||||||||||||||||||||||||||||||||
Элементы которые проявляют только положительную степень окисления. Понятие о степени окисления
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи : NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
Такие условные заряды называются степенью окисления .
— это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород , второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,
II группы равна +2. III группы — +3, например:
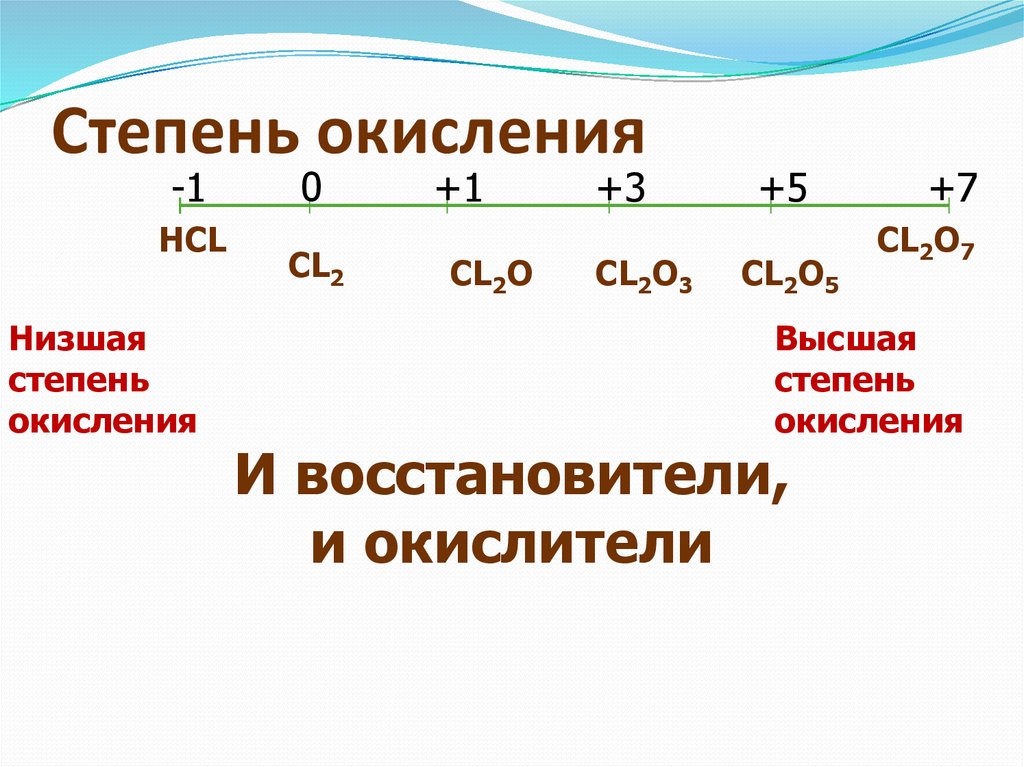
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2
кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.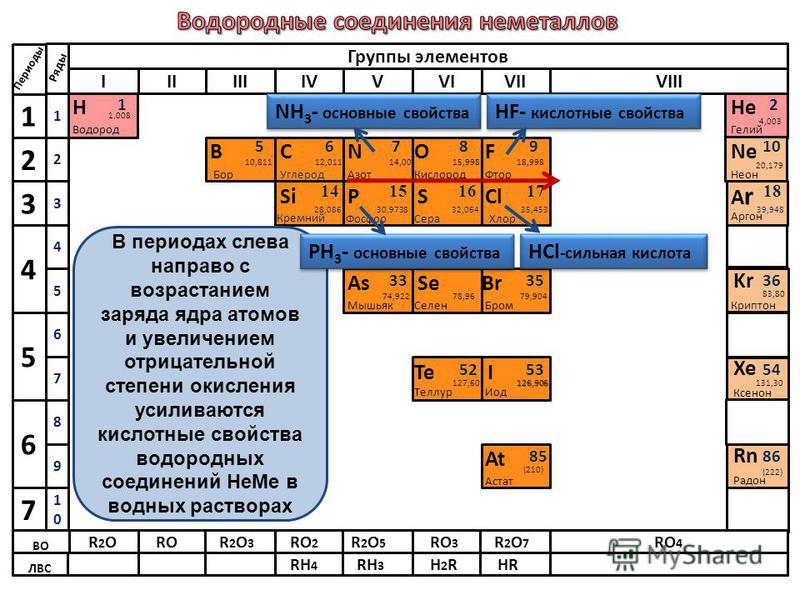
Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
При определении этого понятия условно полагают, что связующие (валентные) электроны переходят к более электроотрицательным атомам (см. Электроотрицательность), а потому соединения состоят как бы из положительно и отрицательно заряженных ионов . Степень окисления может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху.
Нулевое значение степени окисления приписывается атомам элементов, находящихся в свободном состоянии, например: Cu, H 2 , N 2 , P 4 , S 6 . Отрицательное значение степени окисления имеют те атомы, в сторону которых смещается связующее электронное облако (электронная пара). У фтора во всех его соединениях она равна −1. Положительную степень окисления имеют атомы, отдающие валентные электроны другим атомам. Например, у щелочных и щелочноземельных металлов она соответственно равна +1 и +2. В простых ионах , подобных Cl − , S 2− , K + , Cu 2+ , Al 3+ , она равна заряду иона . В большинстве соединений степень окисления атомов водорода равна +1, но в гидридах металлов (соединениях их с водородом) — NaH, CaH 2 и других — она равна −1. Для кислорода характерна степень окисления −2, но, к примеру, в соединении с фтором OF 2 она будет +2, а в перекисных соединениях (BaO 2 и др.) −1. В некоторых случаях эта величина может быть выражена и дробным числом: для железа в оксиде железа (II, III) Fe 3 O 4 она равна +8/3.
Отрицательное значение степени окисления имеют те атомы, в сторону которых смещается связующее электронное облако (электронная пара). У фтора во всех его соединениях она равна −1. Положительную степень окисления имеют атомы, отдающие валентные электроны другим атомам. Например, у щелочных и щелочноземельных металлов она соответственно равна +1 и +2. В простых ионах , подобных Cl − , S 2− , K + , Cu 2+ , Al 3+ , она равна заряду иона . В большинстве соединений степень окисления атомов водорода равна +1, но в гидридах металлов (соединениях их с водородом) — NaH, CaH 2 и других — она равна −1. Для кислорода характерна степень окисления −2, но, к примеру, в соединении с фтором OF 2 она будет +2, а в перекисных соединениях (BaO 2 и др.) −1. В некоторых случаях эта величина может быть выражена и дробным числом: для железа в оксиде железа (II, III) Fe 3 O 4 она равна +8/3.
Алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе — заряду иона. С помощью этого правила вычислим, например, степень окисления фосфора в ортофосфорной кислоте H 3 PO 4 . Обозначив ее через x и умножив степень окисления для водорода (+1) и кислорода (−2) на число их атомов в соединении, получим уравнение: (+1) 3+x+(−2) 4=0, откуда x=+5. Аналогично вычисляем степень окисления хрома в ионе Cr 2 O 7 2− : 2x+(−2) 7=−2; x=+6. В соединениях MnO, Mn 2 O 3 , MnO 2 , Mn 3 O 4 , K 2 MnO 4 , KMnO 4 степень окисления марганца будет соответственно +2, +3, +4, +8/3, +6, +7.
Обозначив ее через x и умножив степень окисления для водорода (+1) и кислорода (−2) на число их атомов в соединении, получим уравнение: (+1) 3+x+(−2) 4=0, откуда x=+5. Аналогично вычисляем степень окисления хрома в ионе Cr 2 O 7 2− : 2x+(−2) 7=−2; x=+6. В соединениях MnO, Mn 2 O 3 , MnO 2 , Mn 3 O 4 , K 2 MnO 4 , KMnO 4 степень окисления марганца будет соответственно +2, +3, +4, +8/3, +6, +7.
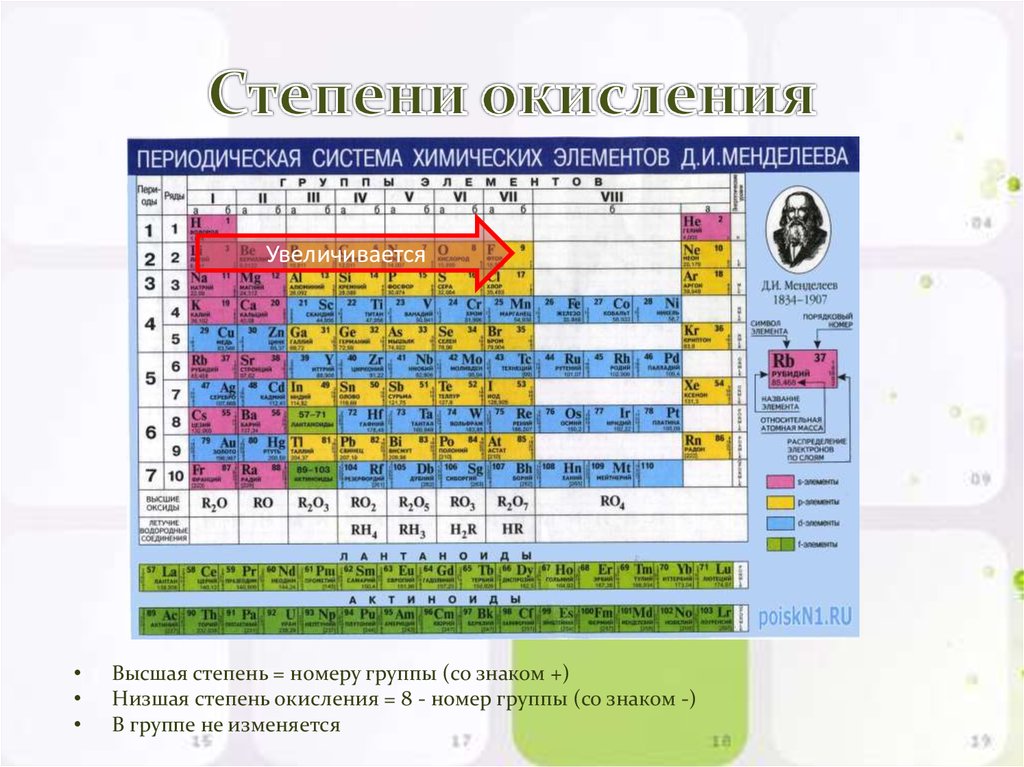
Высшая степень окисления — это наибольшее положительное ее значение. Для большинства элементов она равна номеру группы в периодической системе и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низшей степенью окисления; все остальные — промежуточными. Так, для серы высшая степень окисления равна +6, низшая −2, промежуточная +4.
Изменение степеней окисления элементов по группам периодической системы отражает периодичность изменения их химических свойств с ростом порядкового номера.
Понятие степени окисления элементов используется при классификации веществ, описании их свойств, составлении формул соединений и их международных названий. Но особенно широко оно применяется при изучении окислительно-восстановительных реакций . Понятие «степень окисления» часто используют в неорганической химии вместо понятия «валентность» (см.
Задача по определению степени окисления может оказаться как простой формальностью, так и сложной головоломкой. В первую очередь, это будет зависеть от формулы химического соединения, а также наличия элементарных знаний по химии и математике.
Зная основные правила и алгоритм последовательно-логичных действий, о которых пойдет речь в данной статье, при решении задач подобного типа, каждый с легкостью сможет справиться с этим заданием. А потренировавшись и научившись определять степени окисления разноплановых химических соединений, можно смело браться за уравнивание сложных окислительно-восстановительных реакций методом составления электронного баланса.
Понятие степени окисления
Чтобы научиться определять степень окисления, для начала необходимо разобраться, что это понятие означает?
- Степень окисления применяют при записи в окислительно-восстановительных реакциях, когда происходит передача электронов от атома к атому.
- Степень окисления фиксирует количество перенесенных электронов, обозначая условный заряд атома.
- Степень окисления и валентность зачастую тождественны.
Данное обозначение пишется сверху химического элемента, в его правом углу, и представляет собой целое число со знаком «+» или «-». Нулевое значение степени окисления знака не несет.
Правила определения степени окисления
Рассмотрим основные каноны определения степени окисления:
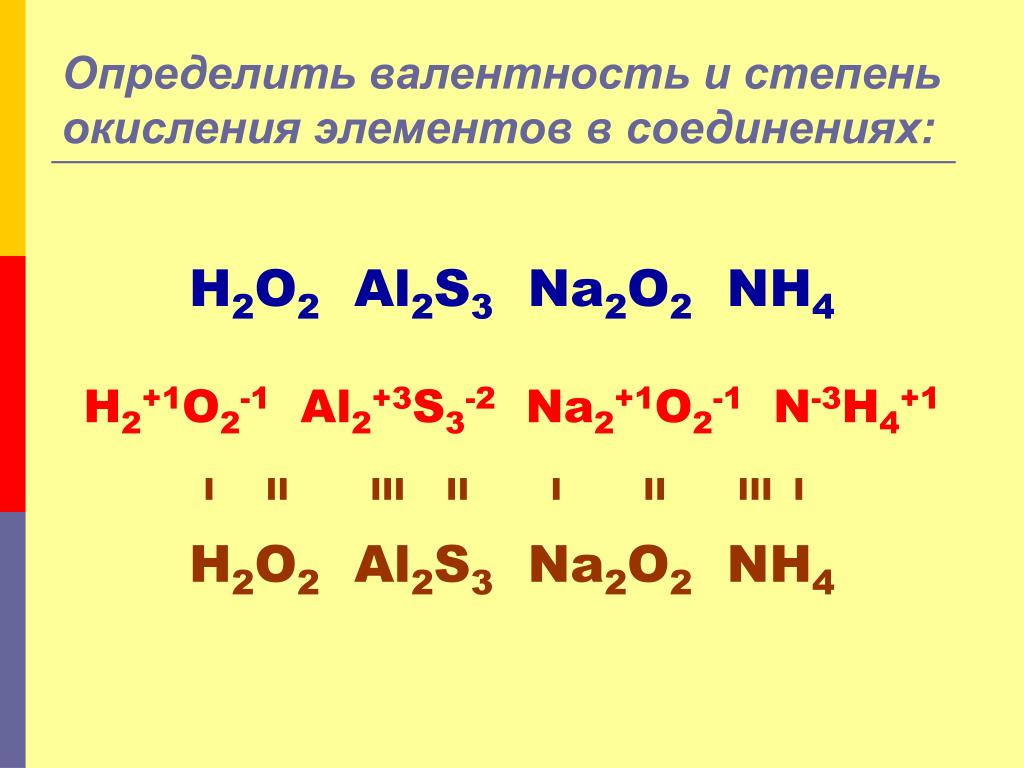
- Простые элементарные вещества, то есть те, которые состоят из одного вида атомов, всегда будут иметь нулевую степень окисления. Например, Na0, H02, P04
- Существует ряд атомов, имеющих всегда одну, постоянную, степень окисления.
 Приведенные в таблице значения лучше запомнить.
Приведенные в таблице значения лучше запомнить.
- Как видно, исключение бывает лишь у водорода в соединении с металлами, где он приобретает не свойственную ему степень окисления «-1».
- Кислород также принимает степень окисления «+2» в химическом соединении с фтором и «-1» в составах перекисей, надперекисей или озонидов, где атомы кислорода соединены друг с другом.
- Ионы металлов имеют несколько значений степени окисления (причем только положительные), поэтому ее определяют по соседним элементам в соединении. Например, в FeCl3, хлор имеет степень окисления «-1», у него 3 атома, значит умножаем -1 на 3, получаем «-3». Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2».
- Математически суммируя степени окисления всех атомов в формуле (с учетом знаков), всегда должно получаться нулевое значение. Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).

- Степень окисления одноатомного иона будет равна его заряду. Например: Na+, Ca+2.
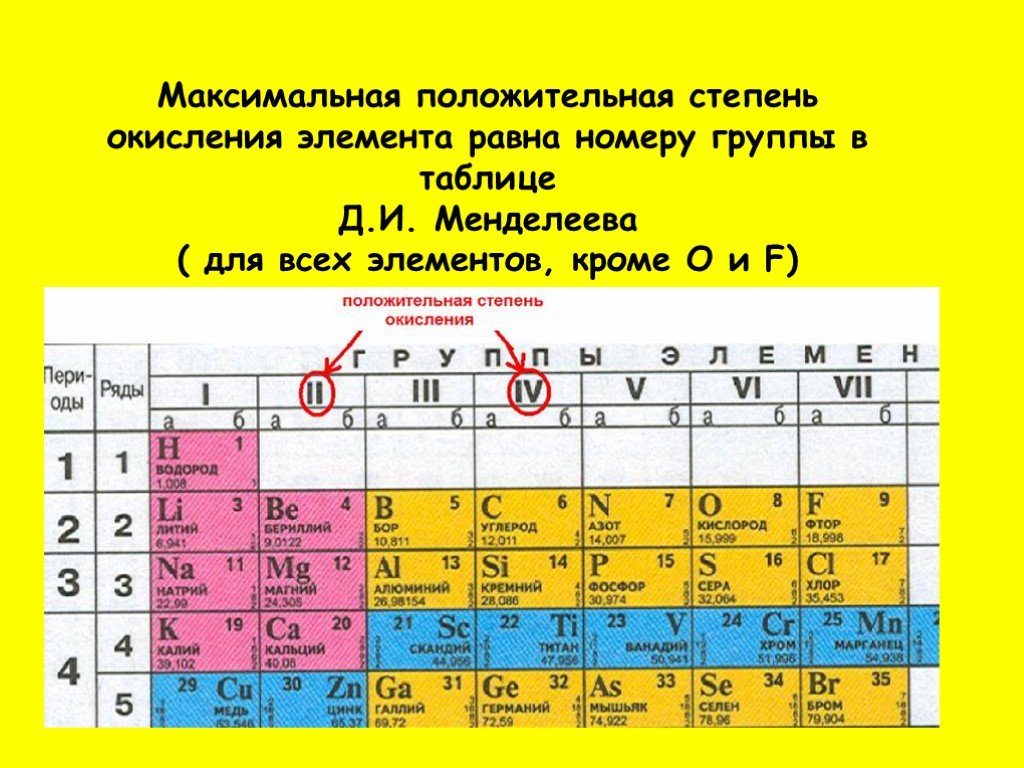
- Наивысшая степень окисления, как правило, соотносится с номером группы в периодической системе Д.И.Менделеева.
Алгоритм действий определения степени окисления
Порядок нахождения степени окисления не сложен, но требует внимания и выполнения определенных действий.
Задача: расставить степени окисления в соединении KMnO4
- Первый элемент – калий, имеет постоянную степень окисления «+1».
Для проверки можно посмотреть в периодическую систему, где калий находится в 1 группе элементов. - Из оставшихся двух элементов, кислород, как правило, принимает степень окисления «-2».
- Получаем следующую формулу: К+1MnхO4-2. Остается определить степень окисления марганца.
Итак, х – неизвестная нам степень окисления марганца. Теперь важно обратить внимание на количество атомов в соединении.
Количество атомов калия – 1, марганца – 1, кислорода – 4.
С учетом электронейтральности молекулы, когда общий (суммарный) заряд равен нулю,
1*(+1) + 1*(х) + 4(-2) = 0,
+1+1х+(-8) = 0,
-7+1х = 0,
(при переносе меняем знак)
1х = +7, х = +7
Таким образом, степень окисления марганца в соединении равна «+7».
Задача: расставить степени окисления в соединении Fe2O3.
- Кислород, как известно, имеет степень окисления «-2» и выступает окислителем. С учетом количества атомов (3), в сумме у кислорода получается значение «-6» (-2*3= -6), т.е. умножаем степень окисления на количество атомов.
- Чтобы уравновесить формулу и привести к нулю, 2 атома железа будут иметь степень окисления «+3» (2*+3=+6).
- В сумме получаем ноль (-6 и +6 = 0).
Задача: расставить степени окисления в соединении Al(NO3)3.
- Атом алюминия – один и имеет постоянную степень окисления «+3».
- Атомов кислорода в молекуле – 9 (3*3), степень окисления кислорода, как известно «-2», значит, умножая эти значения, получаем «-18».

- Осталось уровнять отрицательные и положительные значения, определив таким образом степень окисления азота. -18 и +3, не хватает + 15. А учитывая, что имеется 3 атома азота, легко определить его степень окисления: 15 делим на 3 и получаем 5.
- Степень окисления азота «+5», а формула будет иметь вид: Al+3(N+5O-23)3
- Если сложно таким способом определять искомое значение, можно составлять и решать уравнения:
1*(+3) + 3х + 9*(-2) = 0.
+3+3х-18=0
3х=15
х=5
Итак, степень окисления – достаточно важное понятие в химии, символизирующее состояние атомов в молекуле.
Без знания определенных положений или основ, позволяющих правильно определять степень окисления, невозможно справиться с выполнением этой задачи. Следовательно, вывод один: досконально ознакомиться и изучить правила нахождения степени окисления, четко и лаконично представленные в статье, и смело двигаться дальше по нелегкой стезе химических премудростей.
Степень окисления. Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. Степень окисления может быть положительным, отрицательным или равным нулю. Он обозначается арабской цифрой со знаком «плюс» или «минус» над символом элемента.
2. При определении степеней окисления исходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
3. Если соединение образована атомами одного элемента (в простой веществе), то степень окисления этих атомов равен нулю.
4. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
5. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 (KH, Bah3).
6. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 (h3O2, Na2O2 или +2 (OF2).
7. Атомы многих химических элементов оказывают переменные степени окисления.
8. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
9. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
10. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже отрицательный степень окисления равна разнице между номером группы и цифрой восемь.
11. Степень окисления атома образует простой ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенным правилам, определим степени окисления химических элементов в составе h3SO4. Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равно х.
Составим уравнения, умножив для каждого элемента его индекс в степень окисления и добытую сумму приравняем к нулю: 2 · (+1) + x + 4 · (-2) = 0
2 + X — 8 = 0
x = +8 — 2 = +6
Следовательно, степень окисления серы равна плюс шесть.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов. Составим формулу феррум (III) оксида. Слово «оксид» означает, что справа от символа железа надо записать символ кислорода: FeO.
Отметим степени окисления химических элементов над их символами. Степень окисления железа указана в названии в скобках (III), следовательно, равна +3, степень окисления кислорода в оксидах -2.
Найдем наименьшее общее кратное для чисел 3 и 2, это 6. Разделим число 6 на 3, получим число 2 — это индекс для железа. Разделим число 6 на 2, получим число 3 — это индекс для кислорода.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов и зарядами ионов. Составим формулу кальций ортофосфата. Слово «ортофосфат» означает, что справа от символа Кальция надо записать кислотный остаток ортофосфатнои кислоты: CaPO4.
Отметим степень окисления кальция (правило номер четыре) и заряд кислотного остатка (по таблице растворимости).
Найдем наименьшее общее кратное для чисел 2 и 3, это 6. Разделим число 6 на 2, получим число 3 — это индекс для кальция. Разделим число 6 на 3, получим число 2 — это индекс для кислотного остатка.
Умение находить степень окисления химических элементов является необходимым условием для успешного решения химический уравнений, описывающих окислительно-восстановительные реакции. Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Понятие степени окисления химического элемента
Степень окисления – это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
В окислительно-восcтановительных реакциях понятие степень окисления используется для определения химических формул соединений элементов, получающихся в результате взаимодействия нескольких веществ.
На первый взгляд может показаться, что степень окисления эквивалентна понятию валентности химического элемента, но это не так. Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Как определить степень окисления конкретного химического элемента
Определение степени окисления для конкретного химического элемента подчиняется следующим правилам:
- Степень окисления простых веществ всегда равна нулю.

- Щелочные металлы, которые находятся в первой группе периодической таблицы, имеют степень окисления +1.
- Щелочноземельные металлы, занимающие в периодической таблице вторую группу, имеют степень окисления +2.
- Водород в соединениях с различными неметаллами всегда проявляет степень окисления +1, а в соединениях с металлами +1.
- Степень окисления молекулярного кислорода во всех соединениях, рассматриваемых в школьном курсе неорганической химии, равна -2. Фтора -1.
- При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
- Алюминий во всех соединениях проявляет степень окисления равную +3.
Дальше, как правило, начинаются сложности, так как остальные химические элементы демонстрируют и проявляют переменную степень окисления в зависимости от типов атомов других веществ, участвующих в соединении.
Различают высшую, низшую и промежуточную степени окисления. Высшая степень окисления, как и валентность, соответствует номеру группы химического элемента в периодической таблице, но имеет при этом положительное значение. Низшая степень окисления численно равна разности между числом 8 группой элемента. Промежуточной степенью окисления будет любой число в диапазоне от низшей степени окисления до высшей.
Чтобы помочь вам сориентироваться в многообразии степеней окисления химических элементов предлагаем вашему вниманию следующую вспомогательную таблицу. Выберите в ней интересующий вас элемент и вы получите значения его возможных степеней окисления. В скобках будут указаны редко встречающиеся значения.
СТЕПЕНИ ОКИСЛЕНИЯ (ЧИСЛА ОКИСЛЕНИЯ) На этой странице объясняется, что такое степени окисления (степени окисления), как их рассчитать и использовать. Степени окисления легко определить и использовать, но довольно сложно определить, что они представляют собой каким-либо быстрым способом. Объяснение того, что такое степени окисления (степени окисления) Степени окисления упрощают весь процесс определения того, что окисляется и что восстанавливается в окислительно-восстановительных реакциях. Однако для целей этого введения было бы полезно, если бы вы знали о: | ||||||||||||||||||||||
Примечание: Если вы не уверены ни в одном из этих пунктов, возможно, вам стоит просмотреть страницы, посвященные определениям окислительно-восстановительного потенциала и полууравнениям для электронов. Вероятно, было бы лучше прочитать и вернуться к этим ссылкам, если вы чувствуете, что вам это нужно. | ||||||||||||||||||||||
Мы рассмотрим несколько примеров из химии ванадия. Если вы ничего не знаете о ванадии, это не имеет ни малейшего значения. Ванадий образует ряд различных ионов — например, V 2+ и V 3+ . Если вы думаете о том, как они могут быть получены из металлического ванадия, ион 2+ будет сформирован путем окисления металла путем удаления двух электронов: .
В настоящее время считается, что ванадий находится в степени окисления +2. Удаление другого электрона дает ион V 3+ :
Ванадий теперь имеет степень окисления +3. Удаление другого электрона дает более необычный ион, VO 2+ .
Теперь ванадий имеет степень окисления +4. Обратите внимание, что степень окисления не просто подсчитывает заряд иона (это верно для первых двух случаев, но не для этого). Положительная степень окисления подсчитывает общее количество электронов, которые необходимо удалить, начиная с элемента. Также можно удалить пятый электрон, чтобы получить другой ион (легко спутать с предыдущим!).
Каждый раз, когда вы окисляете ванадий, удаляя из него еще один электрон, его степень окисления увеличивается на 1. Совершенно очевидно, что если вы снова начнете добавлять электроны, степень окисления упадет. В конечном итоге вы могли бы вернуться к элементу ванадия, который имел бы нулевую степень окисления. Что, если бы вы продолжали добавлять электроны к элементу? На самом деле вы не можете сделать это с ванадием, но можете с таким элементом, как сера.
Сера имеет степень окисления -2. Сводка Степень окисления показывает общее количество электронов, которые были удалены из элемента (положительная степень окисления) или добавлены к элементу (отрицательная степень окисления), чтобы получить его текущее состояние.
Распознавание этой простой закономерности — самая важная вещь в концепции степеней окисления. Если вы знаете, как изменяется степень окисления элемента во время реакции, вы можете мгновенно сказать, окисляется он или восстанавливается, без необходимости работать с полууравнениями электронов и переносами электронов. Определение степеней окисления Вы не вычисляете степени окисления, подсчитывая количество переданных электронов. Это заняло бы слишком много времени. Вместо этого вы изучаете несколько простых правил и решаете очень простые задачи!
| ||||||||||||||||||||||
Примечание: Мне было указано, что существует несколько малоизвестных соединений элементов натрия с цезием, где металл образует отрицательный ион, например, Na — . Это дало бы степень окисления -1. Вы можете игнорировать их, если изучаете химию на уровне A или его эквиваленте. Обобщение о том, что металлы группы 1 всегда имеют степень окисления +1, справедливо для всех соединений, которые вы, вероятно, встретите. Если вас интересуют эти необычные соединения, выполните поиск в Интернете по запросу алкалиды . | ||||||||||||||||||||||
Причины исключений Водород в гидридах металлов Гидриды металлов включают такие соединения, как гидрид натрия, NaH. В качестве альтернативы можно представить, что сумма степеней окисления в нейтральном соединении равна нулю. Так как металлы 1 группы в своих соединениях всегда имеют степень окисления +1, то из этого следует, что водород должен иметь степень окисления -1 (+1 -1 = 0). Кислород в пероксидах Пероксиды включают пероксид водорода, H 2 O 2 . Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю. Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его. Кислород в F 2 O Проблема в том, что кислород не самый электроотрицательный элемент.
Фтор более электроотрицательный и имеет степень окисления -1. Хлор в соединениях с фтором или кислородом Существует так много различных степеней окисления, которые может иметь хлор в них, что безопаснее просто помнить, что хлор не имеет степени окисления -1 в них, и определить его фактическую степень окисления, когда вам нужно это. Пример этого вы найдете ниже. Внимание! Не зацикливайтесь на этих исключениях. В большинстве случаев, с которыми вы столкнетесь, они неприменимы!Примеры определения степеней окисления Какова степень окисления хрома в Cr 2+ ? Это просто! Для такого простого иона степень окисления — это заряд иона, другими словами: +2 (не забывайте знак +). Какова степень окисления хрома в CrCl 3 ? Это нейтральное соединение, поэтому сумма степеней окисления равна нулю. Хлор имеет степень окисления -1.
Какова степень окисления хрома в Cr(H 2 O) 6 3+ ? Это ион, поэтому сумма степеней окисления равна заряду иона. Существует короткий путь для определения степеней окисления в таких сложных ионах, когда атом металла окружен электрически нейтральными молекулами, такими как вода или аммиак. Сумма степеней окисления присоединенной нейтральной молекулы должна быть равна нулю. Это означает, что вы можете игнорировать их, когда вычисляете сумму. Это будет по существу то же самое, что и неприсоединенный ион хрома, Cr 3+ . Степень окисления +3. Какова степень окисления хрома в дихромат-ионе, Cr 2 O 7 2- ? Степень окисления кислорода равна -2, а сумма степеней окисления равна заряду иона. Не забывайте, что присутствуют 2 атома хрома.
| ||||||||||||||||||||||
Предупреждение: Поскольку это простые суммы, заманчиво попытаться вычислить их в уме. Если это имеет значение (например, на экзамене), запишите их, используя столько шагов, сколько вам нужно, чтобы не было шансов сделать ошибки по невнимательности. Ваши экзаменаторы не будут впечатлены вашей арифметикой в уме — все, что им нужно, это правильный ответ! Если вам нужны еще примеры для практики, вы найдете их в большинстве учебников, включая мою книгу расчетов по химии. | ||||||||||||||||||||||
Какова степень окисления меди в CuSO 4 ? К сожалению, не всегда возможно вычислить степени окисления, просто используя приведенные выше правила. Проблема в этом случае заключается в том, что соединение содержит два элемента (медь и сера), степень окисления которых может изменяться. Единственный способ обойти это — знать простую химию! Есть два способа приблизиться к этому.
Использование степеней окисления В названиях соединений Вы наверняка встречали такие названия, как сульфат железа(II) и хлорид железа(III). (II) и (III) представляют собой степени окисления железа в двух соединениях: +2 и +3 соответственно. Это говорит о том, что они содержат ионы Fe 2+ и Fe 3+ . Это также может быть распространено на отрицательный ион. Сульфат железа(II) FeSO 4 . Существует также соединение FeSO 3 со старым названием сульфит железа(II). Современные названия отражают степени окисления серы в двух соединениях. Сульфат-ион SO 4 2- . Степень окисления серы +6 (попробуй!). Этот ион правильнее называть ионом сульфата (VI). Сульфит-ион SO 3 2-. Степень окисления серы равна +4 (и это тоже учтите!). Этот ион правильнее называть ионом сульфата (IV). 9Окончание 0006 или просто показывает, что сера находится в отрицательном ионе. Таким образом, FeSO 4 правильно называется сульфатом железа (II) (VI), а FeSO 3 — сульфатом железа (II) (IV). Фактически, из-за того, что эти названия легко спутать, старые названия сульфат и сульфит обычно все еще используются во вводных курсах химии. | ||||||||||||||||||||||
Примечание: Даже это не полное имя! Следует также идентифицировать кислород в отрицательных ионах. 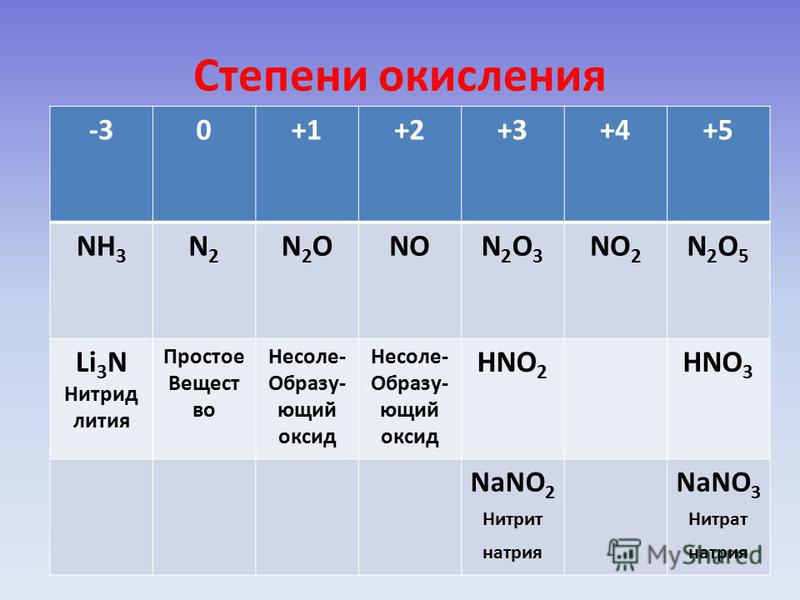 FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов. FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов. | ||||||||||||||||||||||
Использование степеней окисления для определения того, что было окислено, а что восстановлено Это наиболее распространенное использование степеней окисления. Помните:
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный процесс, и если да, то что было окислено, а что восстановлено. Пример 1: Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Изменились ли степени окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и в виде несвязанных элементов с другой. Повысилась степень окисления магния — он окислился. Степень окисления водорода упала — он восстановился. Хлор находится в одинаковой степени окисления в обеих частях уравнения — он не окисляется и не восстанавливается. Пример 2: Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления: Ничего не изменилось. Это не окислительно-восстановительная реакция. Пример 3: Это подлый! Реакция между хлором и холодным разбавленным раствором гидроксида натрия:
Очевидно, хлор изменил степень окисления, потому что он оказался в соединениях, начиная с исходного элемента. Проверка всех степеней окисления показывает: Хлор — это единственная вещь, которая изменила степень окисления. Это хороший пример реакции диспропорционирования . Реакция диспропорционирования – это реакция, при которой одно вещество одновременно окисляется и восстанавливается. Использование степеней окисления для идентификации окислителя и восстановителя Это небольшое дополнение к последнему разделу. Если вы знаете, что окислялось, а что восстанавливалось, то вы можете легко определить, что такое окислитель и восстановитель. Пример 1 Это реакция между ионами хрома (III) и металлическим цинком:
Хром перешел из степени окисления +3 в +2 и таким образом был восстановлен. Цинк перешел от нулевой степени окисления в элементе к +2. Он был окислен. Так что же делает сокращение? Это цинк — цинк отдает электроны ионам хрома (III). Точно так же вы можете решить, что окислителем должны быть ионы хрома (III), потому что они забирают электроны у цинка. Пример 2 Это уравнение реакции между ионами манганата(VII) и ионами железа(II) в кислой среде. Это проработано ниже на странице. MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O+ 5FE 3+ При быстром рассмотрении видно, что ионы железа(II) окислились до ионов железа(III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3. Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились. Если посчитать степень окисления марганца, то она упала с +7 до +2 — восстановление. Итак, ионы железа(II) окислились, а ионы манганата(VII) восстановились. Что восстановило ионы манганата(VII) — однозначно это ионы железа(II). Точно так же ионы манганата(VII) должны быть окислителями. Использование степеней окисления для расчета пропорций реакции Это иногда бывает полезно, когда вам нужно определить реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения. Помните, что каждый раз, когда степень окисления изменяется на одну единицу, передается один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона. Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться таким же повышением степени окисления чем-то другим. Этот пример основан на информации из старого вопроса уровня AQA A’. Ионы, содержащие церий в степени окисления +4, являются окислителями. Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна упасть на 4, чтобы компенсировать это. Но степень окисления церия в каждом из его ионов падает только с +4 до +3 — падение на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия. Реагирующие пропорции: 4 церийсодержащих иона на 1 ион молибдена. Или, если взять более распространенный пример, включающий ионы железа (II) и ионы манганата (VII). . . Раствор манганата калия(VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа(II) до ионов железа(III). При этом ионы манганата(VII) восстанавливаются до ионов марганца(II). Степень окисления марганца в манганат-ионе (VII) равна +7. Название говорит вам об этом, но попробуйте еще раз, просто для практики! При переходе к ионам марганца (II) степень окисления марганца упала на 5. Каждый реагирующий ион железа (II) увеличивает свою степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата(VII). Таким образом, левая часть уравнения будет:
Правая часть будет:
После этого вам придется гадать, как сбалансировать оставшиеся атомы и заряды. В этом случае, например, вполне вероятно, что кислород окажется в воде. Это означает, что вам нужно откуда-то взять водород. Это не проблема, потому что у вас есть реакция в растворе кислоты, так что водород вполне может происходить из ионов водорода. В конце концов, вы получите это: MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O+ 5FE 3+ Лично я предпочел бы вычислить эти уравнения из электронных полууравнений!
В меню Redox . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: ноябрь 2021 г. | ||||||||||||||||||||||
Число окисления элементов в периодической таблице
Степень окисления атома является важным разделом в химии, потому что, согласно степени окисления, свойства соединений изменяются в широких пределах. Некоторые элементы в периодической таблице имеют только одну степень окисления или две степени окисления. числа. Но некоторые элементы, такие как марганец, имеют несколько степеней окисления. Степень окисления элемента в соединении может быть положительной, отрицательной или равной нулю.
- В соединениях натрия только степень окисления +1.
- Но некоторые типы атомов, такие как хлор, образуют различные степени окисления, такие как -1, 0, +1, +3, +5, +7 степени окисления в соединения.
В этом уроке мы обсудим следующие важные факты о степенях окисления и степенях окисления в периодической таблице, включая s блок, блок p и блок d.
- Важные сведения о степенях окисления
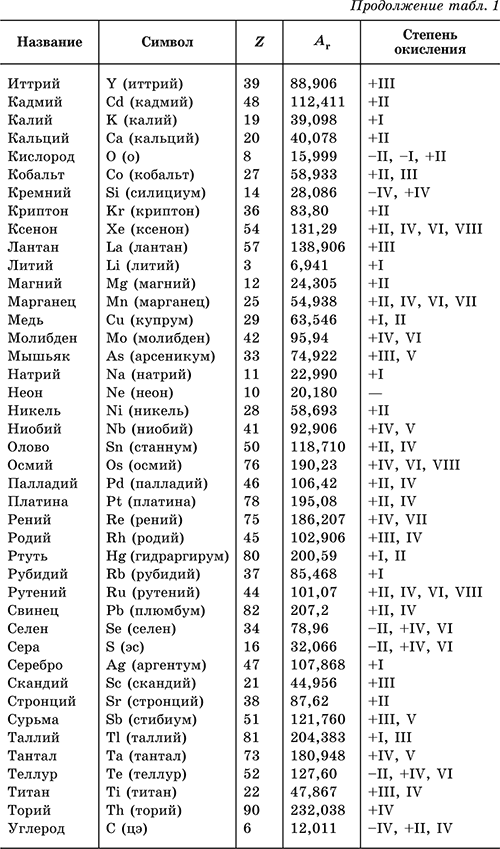
- Таблица: степени окисления по атомному номеру, первые 20 элементов
- Степени окисления s-блока
- Степени окисления элементов p-блока
- Степени окисления 3d-металлов





 Приведенные в таблице значения лучше запомнить.
Приведенные в таблице значения лучше запомнить.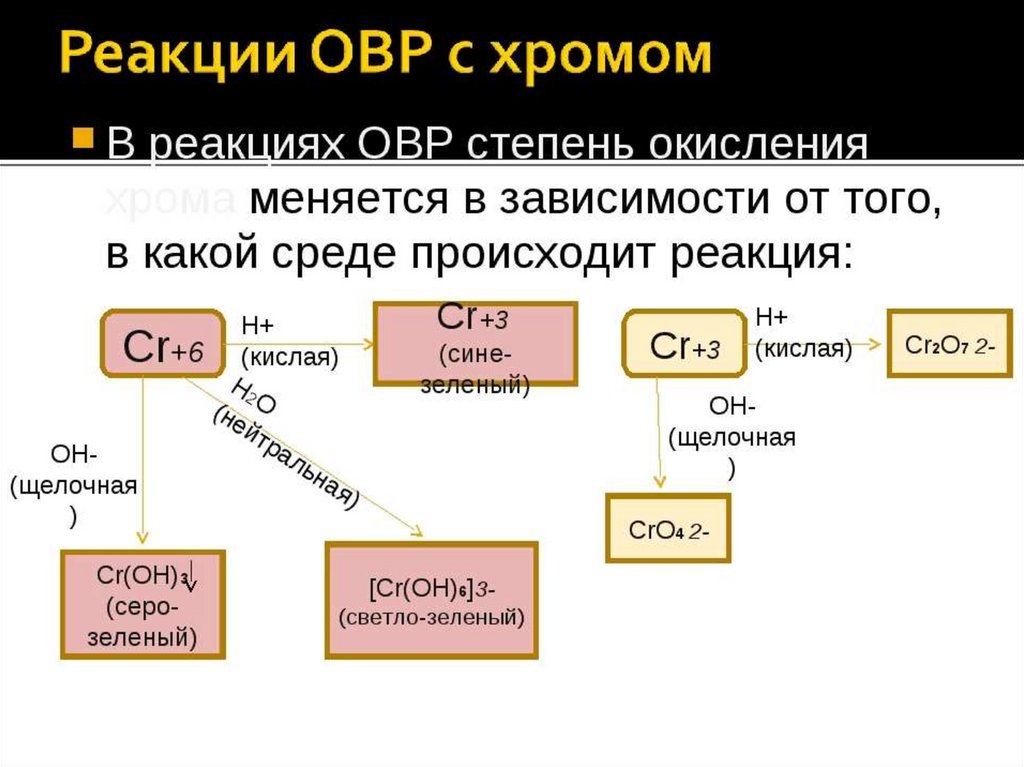




 Степень окисления ванадия теперь +5.
Степень окисления ванадия теперь +5.

 ниже)
ниже)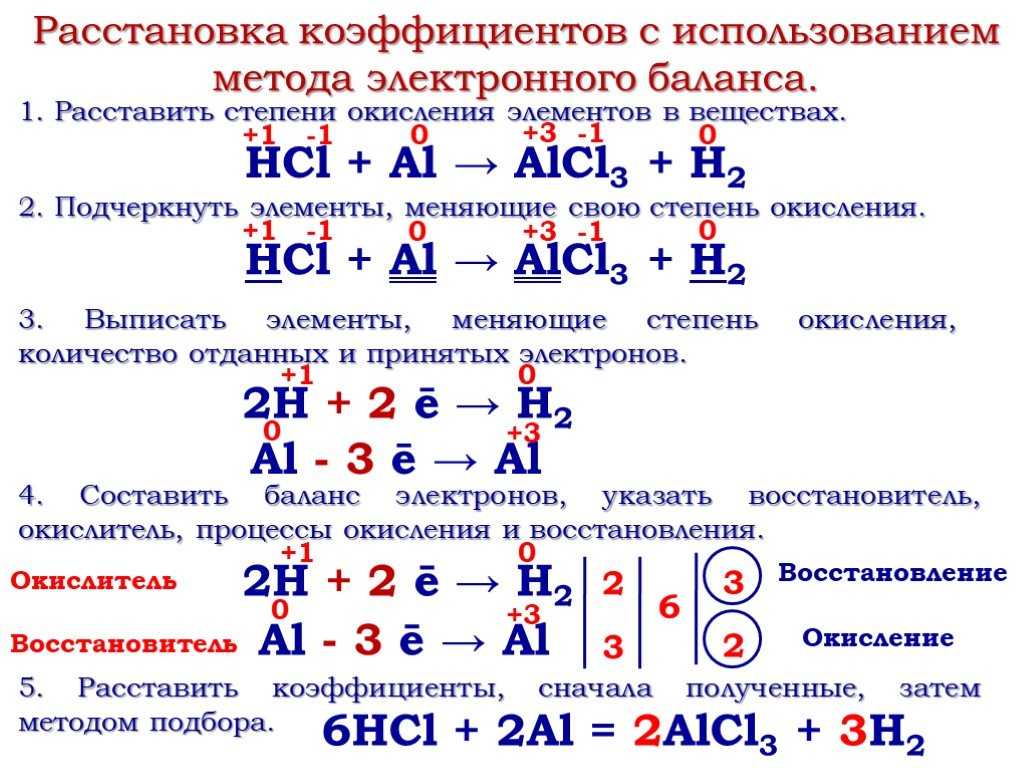 В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1.
В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1. В этом случае кислород имеет степень окисления +2.
В этом случае кислород имеет степень окисления +2. Если степень окисления хрома н :
Если степень окисления хрома н :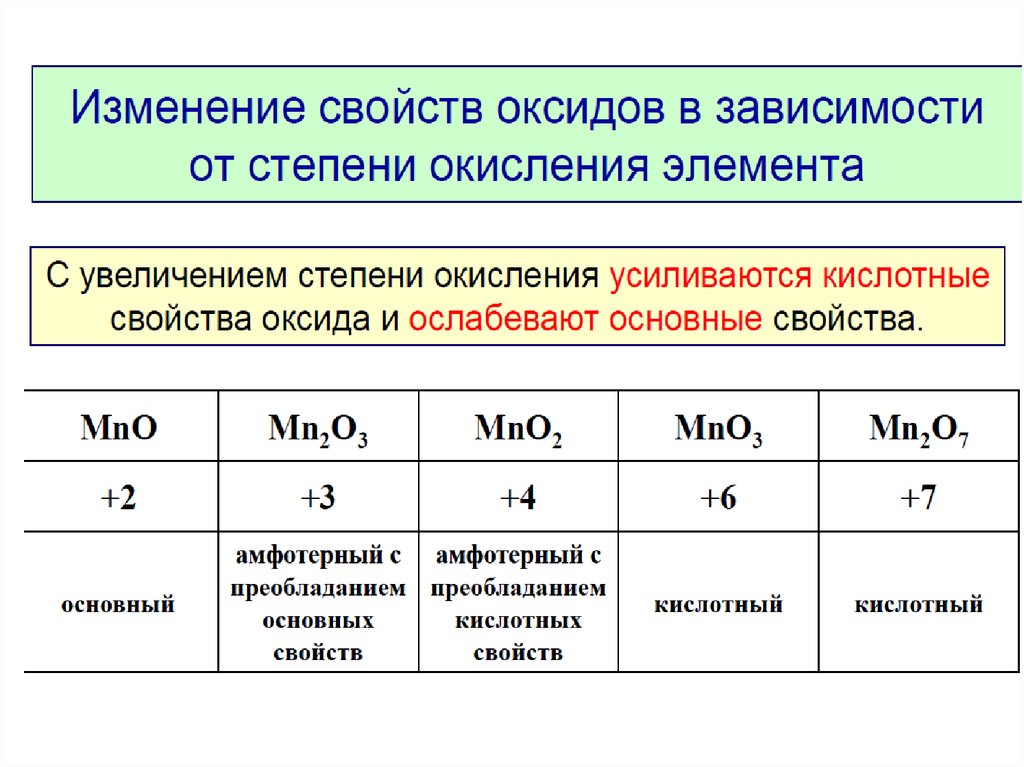
 (Могут быть и другие, но я не могу о них сейчас думать!)
(Могут быть и другие, но я не могу о них сейчас думать!)
 Проверьте все степени окисления, чтобы быть уверенным:.
Проверьте все степени окисления, чтобы быть уверенным:. Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился. Таким образом, цинк является восстановителем.
Таким образом, цинк является восстановителем. Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
(Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?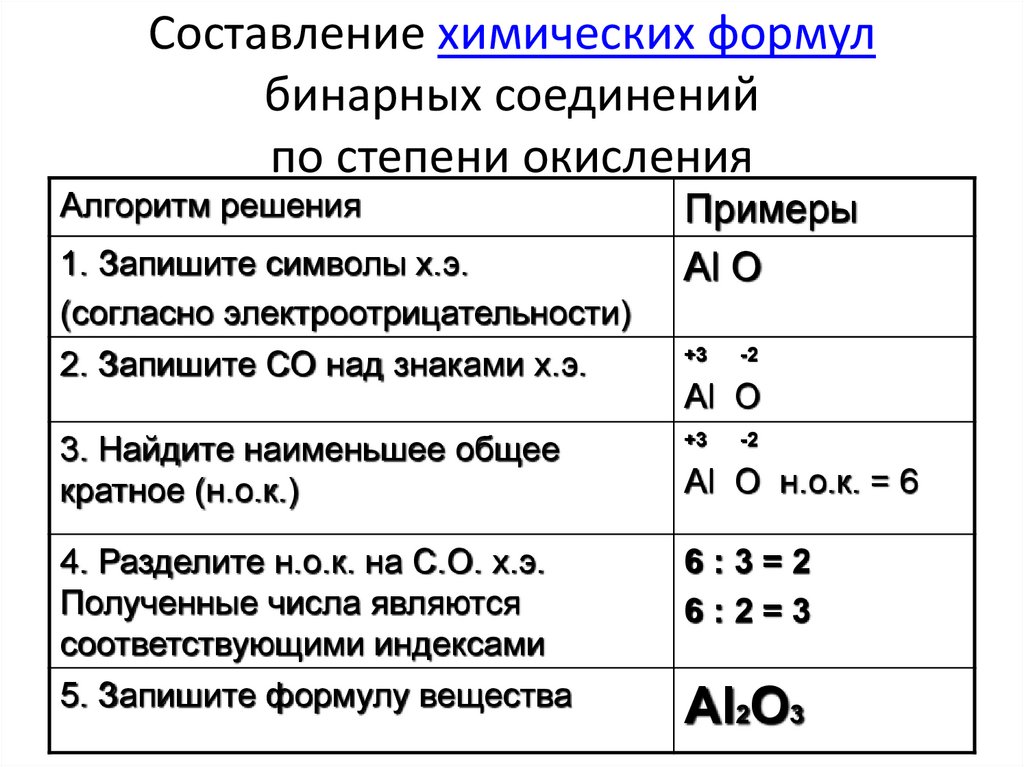 Используя степени окисления, составьте уравнение реакции.
Используя степени окисления, составьте уравнение реакции.
 )
)

 Бериллий, магний, кальций, стронций, барий
имеют степень окисления +2.
Бериллий, магний, кальций, стронций, барий
имеют степень окисления +2. Cl
Cl
 их конечные энергетические уровни соответственно. Эти электроны могут объединяться с кислородом, образуя различные соединения. Некоторые примеры обсуждаются ниже.
их конечные энергетические уровни соответственно. Эти электроны могут объединяться с кислородом, образуя различные соединения. Некоторые примеры обсуждаются ниже.
Leave A Comment