Как определить металлические свойства по таблице Менделеева
Статьи › Находится › Где находятся металлы в таблице менделеева
Металлические свойства усиливаются в группах сверху вниз. В каждой главной подгруппе наиболее выражены металлические свойства у элементов седьмого периода. В периодах происходит ослабление металлических свойств. В каждом периоде самые сильные металлические свойства у элементов IA группы, то есть у щелочных металлов.
- Как определить металлические свойства элементов
- Как усиливаются металлические свойства в таблице
- Как определить свойства химических элементов
- Как по таблице Менделеева определить кислотные свойства
- Как определить у какого элемента наиболее выражены металлические свойства
- Как определять металлические и неметаллические свойства
- Как определить металл в таблице
- Как определить возрастание металлических свойств
- Как определить металл или не металл
- Что такое металлические свойства
- Что определяет химические свойства металлов
- Как определить кислотные или основные свойства
- Как доказать кислотные свойства
- Какие элементы в таблице Менделеева металлы
- Как определить порядок возрастания металлических свойств
- Какой элемент имеет более выраженные металлические свойства
- Какие неметаллы проявляют металлические свойства
Как определить металлические свойства элементов
Металлические свойства — способность атомов отдавать электроны. Именно наличием свободных электронов объясняются общие физические свойства металлов: высокая электропроводность и теплопроводность, характерный металлический блеск, ковкость. Металлические свойства усиливаются в группах сверху вниз.
Именно наличием свободных электронов объясняются общие физические свойства металлов: высокая электропроводность и теплопроводность, характерный металлический блеск, ковкость. Металлические свойства усиливаются в группах сверху вниз.
Как усиливаются металлические свойства в таблице
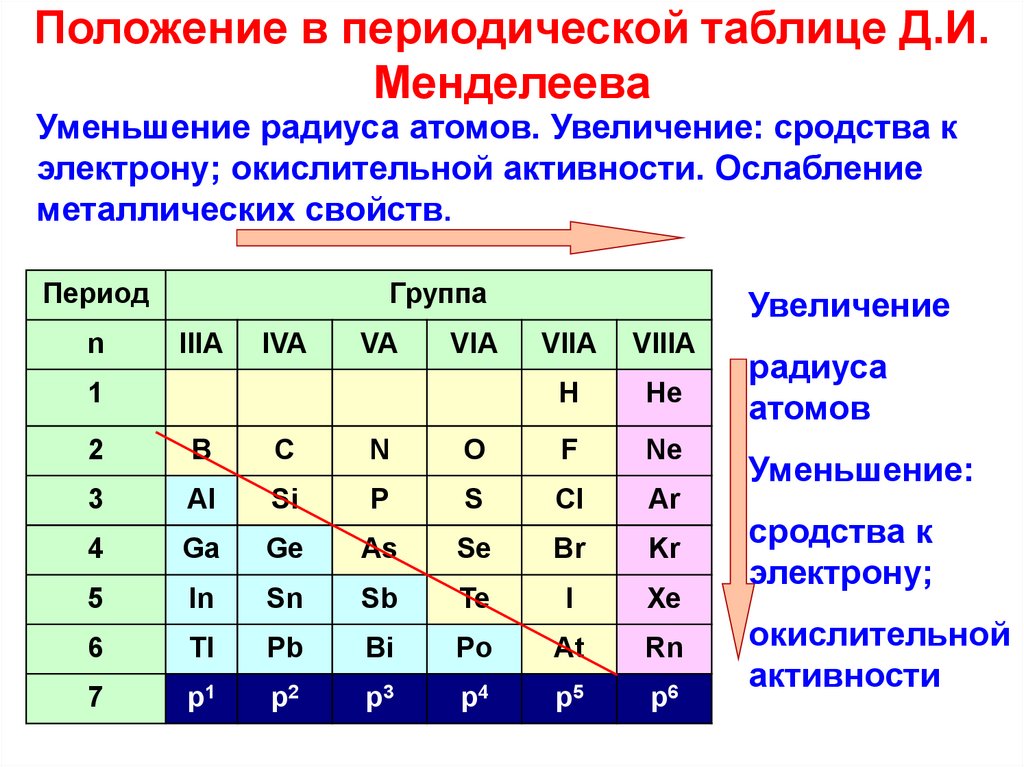
При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Как определить свойства химических элементов
Химические свойства элемента, его способность вступать в реакции с другими веществами и элементами, полностью определяются строением электронной оболочки атома. Именно процессы взаимодействия оболочек и изучает химия. Строение электронной оболочки в свою очередь полностью определяется количеством электронов в атоме.
Как по таблице Менделеева определить кислотные свойства
Основные свойства зависят от металлических свойств и меняются точно так же — в периодах увеличиваются справа налево, а в группах — сверху вниз.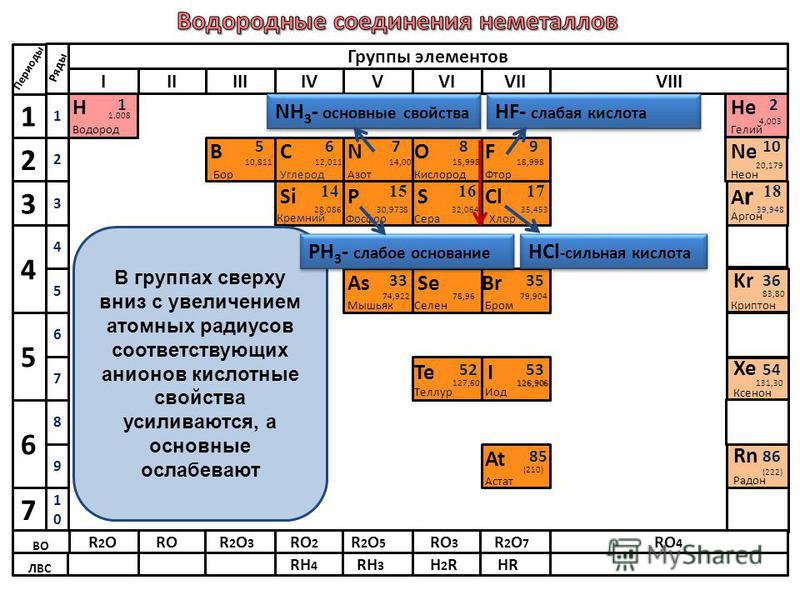 Кислотные свойства зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
Кислотные свойства зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
Как определить у какого элемента наиболее выражены металлические свойства
Наиболее ярко металлические свойства выражены у щелочных металлов (Li, Na, K, Rb, Cs, Fr), что обусловлено низким значением энергий ионизации их атомов. Это очень мягкие металлы (можно резать ножом), обладающие чрезвычайно высокой химической активностью.
Как определять металлические и неметаллические свойства
При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Как определить металл в таблице
В нашей периодической таблице символы неметаллов красные, а металлов — синие. Если провести диагональ примерно из левого верхнего угла в правый нижний, то элементы главных подгрупп выше диагонали будут неметаллами, а ниже — металлами.
Как определить возрастание металлических свойств
Чем выше порядковый номер, тем выше металлические свойства. Записываем в порядке возрастания металлических свойств: B (бор), Mg (магний), Al (алюминий), Ca (кальций), Rb (рубидий), Ba (барий).
Записываем в порядке возрастания металлических свойств: B (бор), Mg (магний), Al (алюминий), Ca (кальций), Rb (рубидий), Ba (барий).
Как определить металл или не металл
Металлы можно ковать, прокатывать в листы, вытягивать в проволоку. Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Как определить в таблице Менделеева металлы и неметаллы
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Что такое металлические свойства
Металлические свойства — способность атомов отдавать электроны. Именно наличием свободных электронов объясняются общие физические свойства металлов: высокая электропроводность и теплопроводность, характерный металлический блеск, ковкость. Металлические свойства усиливаются в группах сверху вниз.
Металлические свойства усиливаются в группах сверху вниз.
Что определяет химические свойства металлов
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т.
Как определить кислотные или основные свойства
По Аррениусу кислотно-основные свойства (КОС) определяются характером диссоциации веществ в водном растворе. Кислотно-основные свойства оксидов определяют по их отношению к кислотам и основаниям. Если оксид реагирует с кислотой, то ему присущи основные свойства, если с основанием − кислотные.
Как доказать кислотные свойства
Для того, что бы доказать ее кислотные свойства нам надо провести реакцию нейтрализацию ее с щелочью. Например с гидроксидом натрия. Если в результате реакции мы получим соль и воду, то можно считать свойства кислотные доказаны.
Какие элементы в таблице Менделеева металлы
Список химических элементов
№ | Название | Атомная масса (а.е.м.) |
|---|---|---|
5 | Бор | |
6 | Углерод | 12,0107 (8) |
7 | Азот | 14,0067 (2) |
8 | Кислород | 15,9994 (3) |
Как определить порядок возрастания металлических свойств
Металлические свойства элементов возрастают сверху вниз если идти по группе и уменьшаются если идти справа налево по периоду, тогда: 1)Na, Ca, Sr, Ba. Неметаллические свойства элементов возрастают справа налево, если идти по периоду, но уменьшаются при движении сверху вниз по группе, тогда: 1)С, N, S, O.
Какой элемент имеет более выраженные металлические свойства
Так как металлические свойства в ряду периодической системы уменьшаются слава на право, то в данном вопросе правильным ответом будет вариант 1- Магний. Уменьшение металлических свойств связано с тем, что число электронов на внешнем энергетическом уровне увеличивается.
Уменьшение металлических свойств связано с тем, что число электронов на внешнем энергетическом уровне увеличивается.
Какие неметаллы проявляют металлические свойства
Углерод, фосфор, селен, иод граничат с металлоидами и проявляют некоторый металлический характер, как и водород. Среди благородных газов радон является наиболее металлическим и начинает проявлять некоторое катионное поведение, что необычно для неметалла.
Задание №2 ЕГЭ по химии
20 мая 2016
В закладки
Обсудить
Жалоба
TG 4ЕГЭ
Химия
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице.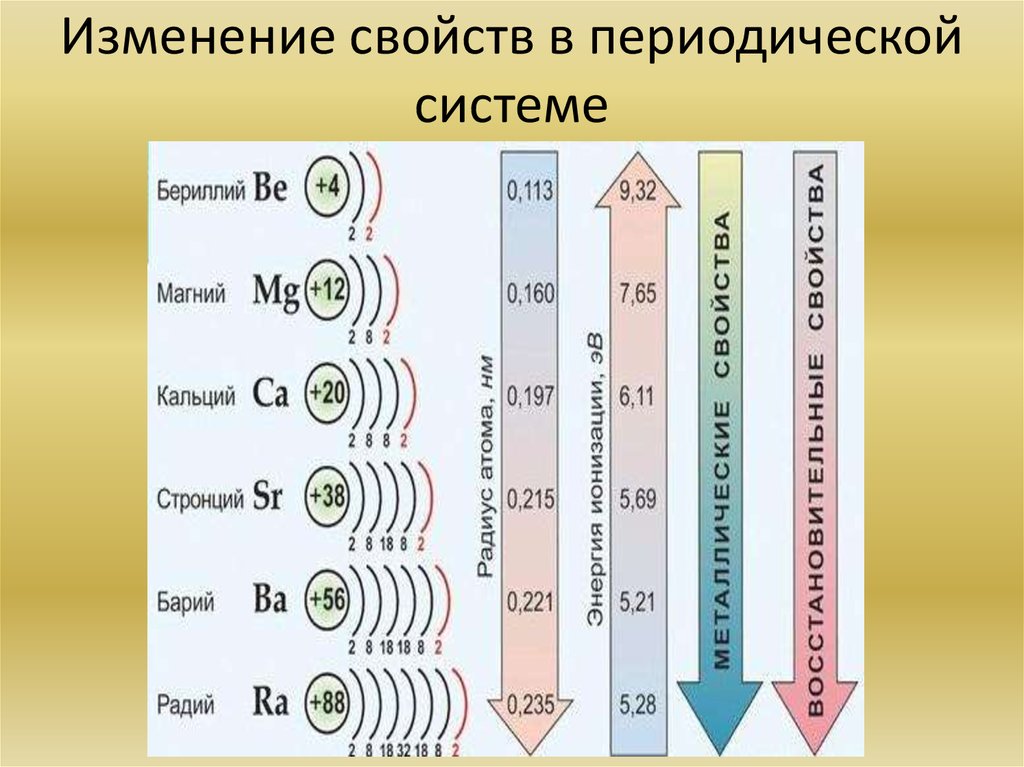
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется.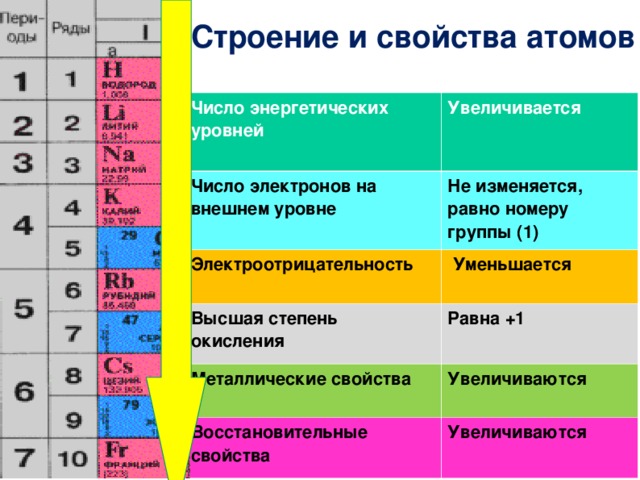
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Периодические тенденции в свойствах элементов
Периодическая таблица представляет собой табличное отображение различных химических элементов, расположенных в соответствии с их электронной конфигурацией, атомным номером и общими химическими свойствами.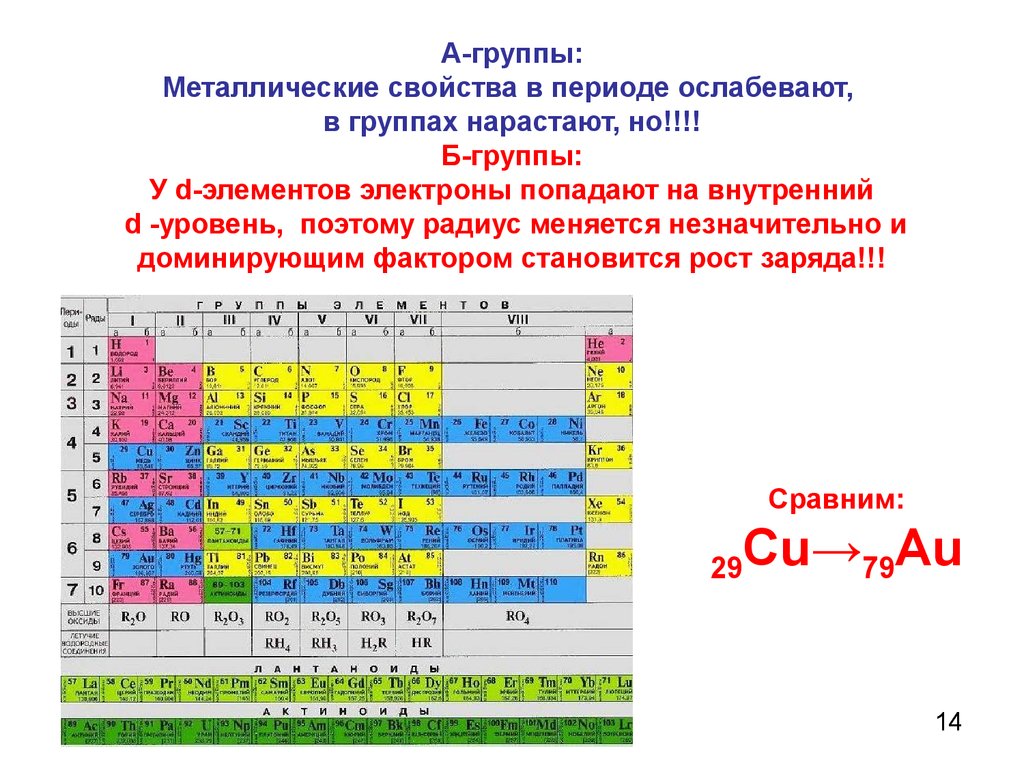 Существуют определенные тенденции, общие для всех групп и периодов.
Существуют определенные тенденции, общие для всех групп и периодов.
Строки называются периодами, а периодическая таблица имеет 7 периодов. Металлы представлены в левых рядах, а ближе к правой стороне — неметаллы. Принимая во внимание, что столбцы называются группами. В группах элементы имеют различное химическое поведение. Существует 18 групп, галогены входят в группу 17, а инертные газы — в группу 18.
Периодические тренды
Особые закономерности свойств химических элементов, присутствующих в периодической таблице, известны как периодические тренды. Важными направлениями являются:
Энергия ионизации
Металлический характер
Атомные радиусы
Электроотрицательность 90 121403 90 12 1403 90 12 403 звуковой радиус
Сродство к электрону
Химическая активность
Экранирующий эффект
Эти тенденции возникают вследствие изменения строения атомов элементов внутри их групп и периодов. Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Периодический закон
Периодический закон формирует основу для периодических трендов. Согласно периодическому закону, «химические элементы расположены в порядке возрастания атомного номера, и основные свойства при этом претерпевают циклические изменения. Элементы, имеющие сходные химические свойства, повторяются через равные промежутки времени»
Этот принцип дал Дмитрий Менделеев. Он также заявил, что периодическая таблица основана не только на атомном весе, но и на различных физических и химических свойствах элементов.
Позже также было обнаружено, что повторение свойств обусловлено повторением сходных электронных конфигураций во внешних оболочках атомов.
1. Энергия ионизации
Потенциал ионизации можно определить как
«Минимальная энергия, необходимая изолированному атому для удаления одного электрона в его нейтральном или газообразном состоянии»
По мере прохождения периода энергия ионизации увеличивается.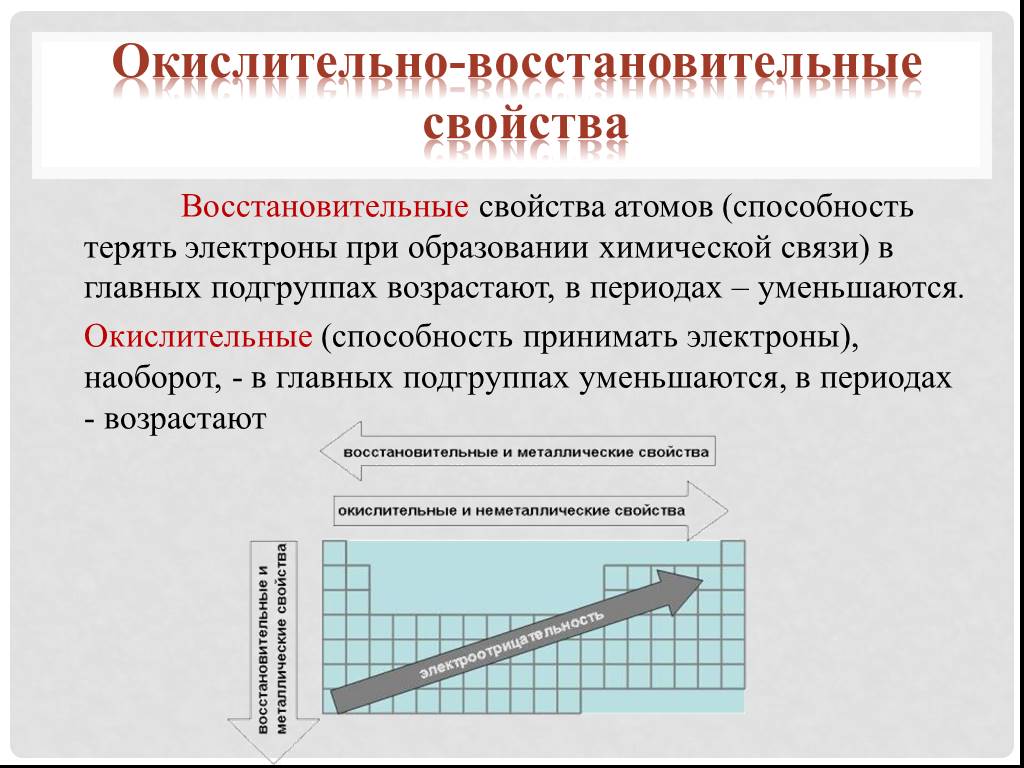 Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Но по мере продвижения вниз по группе энергия ионизации уменьшается по группе. Причина этого в том, что по группе валентные электроны удаляются дальше от ядра, поэтому заряд ядра уменьшается.
Факторы, влияющие на энергию ионизации
Различные факторы, влияющие на уровни энергии ионизации
Заряд ядра
Чем ниже заряд ядра, тем ниже сила притяжения между ядром и валентными электронами, поэтому энергия ионизации ниже.
Экранирующий эффект
Экранирующий эффект увеличивается по мере увеличения заряда ядра, таким образом, с увеличением экранирующего эффекта увеличивается и энергия ионизации.
Атомный радиус
По мере увеличения атомного радиуса сила притяжения между ядром и валентными электронами также уменьшается. Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Наполовину заполненные валентные оболочки
Псевдозаполненные или наполовину заполненные валентные оболочки имеют высокую энергию ионизации.
Простой принцип, который можно использовать, заключается в том, что если главное квантовое число низкое, то число ионизации для электрона, присутствующего в этой оболочке, будет высоким.
Исключения
Все элементы семейства кислорода и бора являются исключением из указанной выше периодической тенденции. Они требуют немного меньше энергии, чем обычный тренд.
2. Металлическое свойство
Металлическое свойство элемента можно определить как его способность проводить электричество. Металлические свойства увеличиваются вниз по группе по мере уменьшения заряда ядра вниз по группе. Поскольку валентный электрон слабо связан с ядрами, они способны хорошо проводить электричество.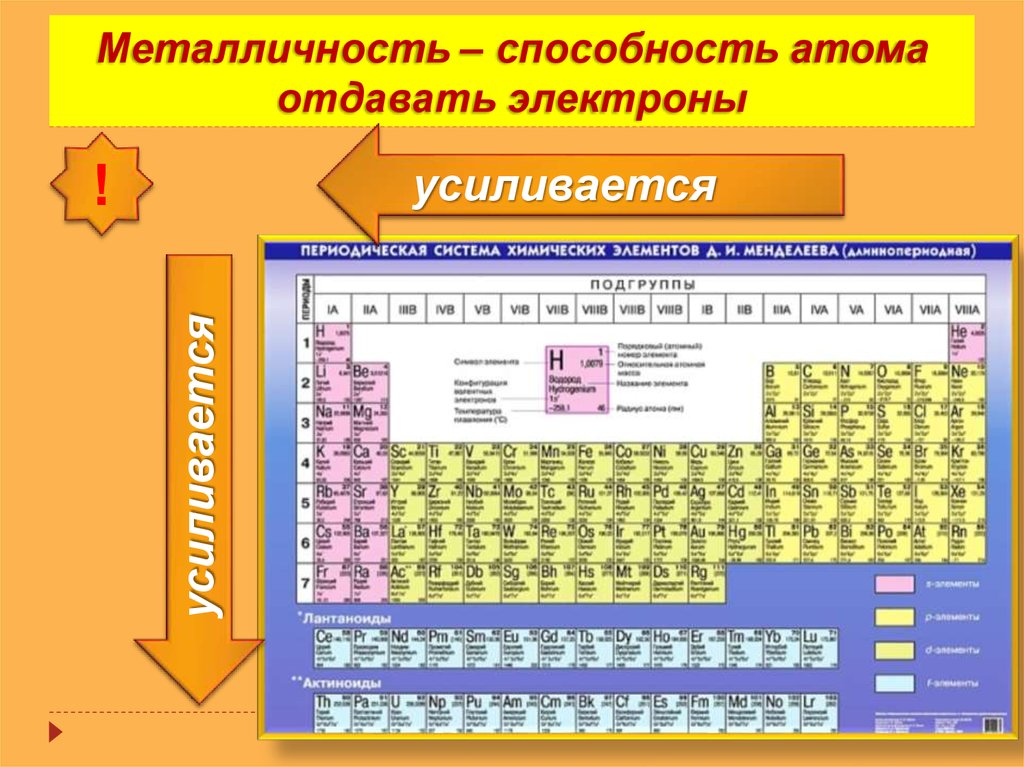
Но с течением времени металлический характер уменьшается по мере увеличения заряда ядра. Это вызывает увеличение силы притяжения между валентными электронами и ядрами, тем самым препятствуя их проведению электричества или тепла.
3. Атомные радиусы
Атомный радиус – это расстояние между атомным ядром и внешней стабильной электронной орбиталью атома, находящегося в равновесии. В течение периода радиус атома уменьшается по мере увеличения заряда ядра. Причина уменьшения заключается в том, что по мере увеличения заряда ядра сила притяжения между ядром и валентными электронами также увеличивается, и ядро крепко удерживает электрон, тем самым уменьшая атомные радиусы.
В группе атомный радиус увеличивается вниз по группе. Причина в том, что добавляются новые снаряды и таким образом уменьшается ядерный заряд. Но атомные радиусы также увеличиваются по диагонали, вызывая некоторые исключения.
Пример:
Вдоль периода – Li> Be > B > C > N > O > F
Вниз по Grp – Li < Na < K < Rb < Cs
4.
 Электроотрицательность
ЭлектроотрицательностьЭлектроотрицательность можно определить как способность атома или молекулы притягивать пару электронов. Образующаяся за счет этого связь в основном определяется разницей между электроотрицательностью атомов.
В течение периода электроотрицательность увеличивается по мере увеличения заряда ядра. Двигаясь вниз по группе, электроотрицательность уменьшается по мере уменьшения заряда ядра. Причина в том, что расстояние между ядром атома и валентными электронами велико, и поэтому электроны легко теряются.
Пример:
Вдоль периода — Li < Be < B < C < N < O < F
Вниз по Grp — Li > Na > K > Rb > Cs
Исключение
Элементы группы 13 являются исключением, поэтому электроотрицательность увеличивается от алюминия к таллию. Также в группе 14 электроотрицательность олова выше, чем у свинца.
5. Сродство к электрону
Сродство к электрону можно определить как тенденцию атома принимать электрон или электронную пару.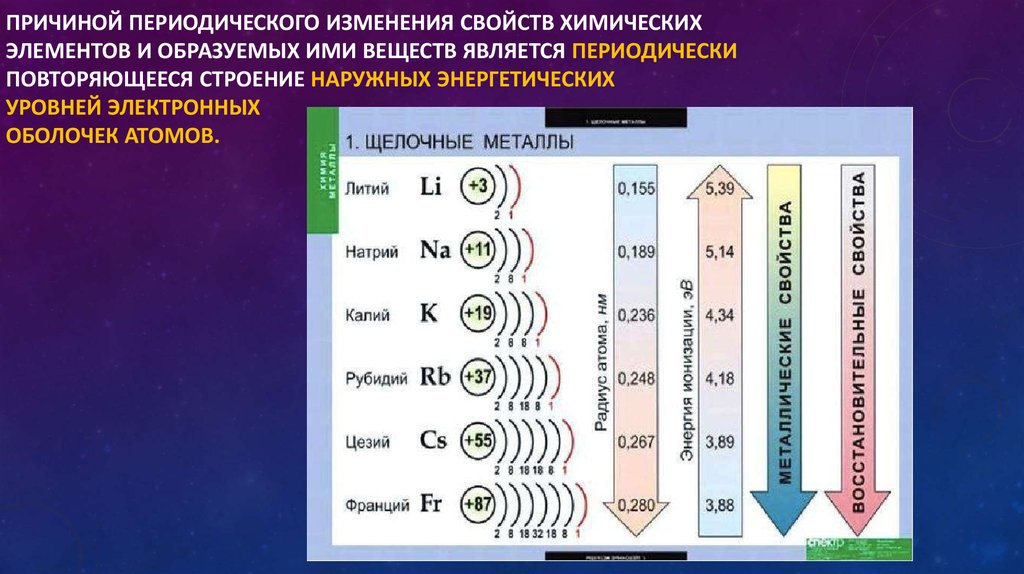 Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Вниз по группе уменьшается, так как уменьшается заряд ядра. Фтор имеет самую высокую электроотрицательность, и благородные газы в него не входят. Причина в том, что они имеют полную валентную оболочку и поэтому не могут ни приобретать, ни терять электроны.
6. Экранирующий эффект
Его можно определить как отталкивание внешнего электрона внутренними электронами. Его также можно использовать для объяснения того, сколько ядер могут управлять внешними электронами. Эффективный заряд ядра уменьшается вниз по группе из-за увеличения экранирующего эффекта. В течение периода эффективный заряд ядра увеличивается по мере увеличения заряда ядра.
Подводя итог, можно сделать следующие выводы.
Характеристика | Период | Группа 30156 Энергия ионизации | Увеличивается | Уменьшается |
Металлические свойства | Уменьшается | Увеличивается | ||
Атомный радиус | Уменьшается | Увеличивается | ||
| 9000 Электроотрицательность 9 | Возрастает | Уменьшается | ||
Сродство к электрону | Возрастает | Уменьшается | ||
Защитный эффект | Увеличивается | Уменьшается |
7.
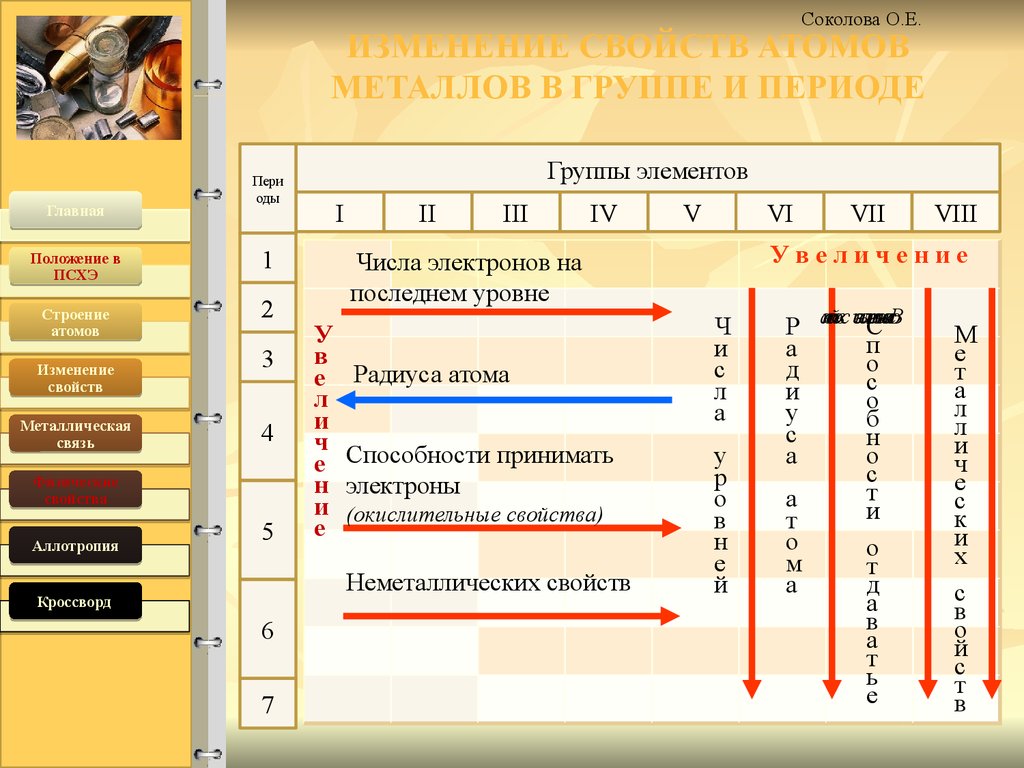 Ионный радиус
Ионный радиусИон состоит из электронов в своих многочисленных оболочках и ядра. Расстояние между ядром и электроном в последней самой внешней оболочке иона известно как ионный радиус иона. Основываясь на ионном радиусе различных элементов, можно определить тенденцию в периодической таблице. По сути, эту тенденцию можно рассматривать как;
Если мы перейдем от вершины таблицы Менделеева к ее основанию, ионный радиус элементов увеличится. Это происходит потому, что по мере продвижения вниз по периодической таблице количество слоев или оболочек электронов увеличивается.
Если двигаться в периодической таблице слева направо, то ионный радиус имеет тенденцию к уменьшению. Хотя кажется странным, что размер иона будет уменьшаться по мере добавления большего количества протонов, электронов и нейтронов. Однако это происходит потому, что когда мы двигаемся боком по периодической таблице, металл сбрасывает свои внешние электронные слои, чтобы сформировать катионы.
 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Эта тенденция относится не только к ионному радиусу, но и к атомному радиусу; однако они отличаются друг от друга.
8. Химическая реактивность
Реакционная способность элемента относится к способности атома вступать в реакцию с любым другим веществом. Химическая активность часто регулируется энергией ионизации (как просто электроны сбрасываются с самого внешнего слоя) и электроотрицательностью (насколько быстро атом принимает электроны другого атома). Этот процесс переноса и обмена электронами является принципом, по которому происходит тенденция химической активности в периодической таблице.
В металлах химическая активность уменьшается по мере того, как мы перемещаемся по периодической таблице слева направо.
 Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.В неметаллах все наоборот. Химическая активность увеличивается по мере продвижения слева направо по таблице. И реактивность уменьшается по мере продвижения к нижним группам от верхних групп. Чем дальше вверх или вправо, тем легче атомам сбрасывать свои электроны в обмен на другие электроны, увеличивая электроотрицательность, что, в свою очередь, делает химическую реактивность элементов более строгой.
Факты, основанные на тенденциях периода и периодических таблицах
Наиболее благородные газы — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). )- имеют нулевую электроотрицательность, потому что они чрезвычайно стабильны.
 У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.Из 118 элементов таблицы Менделеева 90 можно найти в природе, а остальные 28 созданы человеком.
В то время как водород (H) является самым легким элементом в периодической таблице (его можно найти в верхнем левом углу), оганесон (Og) является самым тяжелым элементом (можно найти в правом нижнем углу)
Почти 75% элементов периодической таблицы — это металлы. В то время как есть только несколько неметаллов.
Единственными двумя элементами, которые являются жидкими при комнатной температуре, являются бром и ртуть.
Если периодическую таблицу сложить пополам вдоль ее группы 4 элементов, то группы, лежащие друг над другом, могут идеально слиться друг с другом, потому что они имеют гармонирующую электронную структуру.
 Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.
Periodic Trends — College Chemistry
All College Chemistry Resources
1 диагностический тест 100 практических тестов Вопрос дня Карточки Learn by Concept
College Chemistry Help » Вводные темы » Атомы и элементы » Periodic Trends
Какой из следующих элементов имеет наиболее металлический характер: ?
Возможные ответы:
Правильный ответ:
Пояснение:
Металлический характер элементов усиливается по мере продвижения вниз по группе. Все перечисленные элементы относятся к группе 5. Поскольку это самый нижний элемент, он должен иметь самый металлический характер.
Сообщить об ошибке
Какой из следующих элементов имеет наибольший атомный радиус: ?
Возможные ответы:
Правильный ответ:
Объяснение:
При просмотре периодической таблицы вы должны заметить, что все эти элементы относятся к одному и тому же периоду. Вспомним, что атомные радиусы уменьшаются по мере продвижения вправо по периоду. Таким образом, это порядок элементов по уменьшению радиуса:
Вспомним, что атомные радиусы уменьшаются по мере продвижения вправо по периоду. Таким образом, это порядок элементов по уменьшению радиуса:
, или галлий, имеет самый большой радиус, потому что он самый дальний слева в периодической таблице.
Сообщить об ошибке
Какой из перечисленных элементов известен как набор элементов с наивысшей энергией первой ионизации?
Возможные ответы:
Металлоиды
Благородные газы
Щелочноземельные металлы
Щелочные металлы
7 Галогены
33 0325Благородные газы
Пояснение:
Благородные газы содержат полный октет электронов. Они имеют самые большие энергии первой ионизации из-за их тенденции сохранять все свои валентные электроны. Галогены имеют самое высокое сродство к электрону; следовательно, они имеют высокие, но не самые высокие энергии ионизации.
Сообщить об ошибке
Расположите в порядке возрастания металлического характера:
Возможные ответы:
Правильный ответ:
Объяснение:
Правильный ответ:
имеет наибольшее количество неметаллических характеристик, а имеет наибольшее количество металлических характеристик. В соответствии с периодическими тенденциями металлический характер уменьшается слева направо по периоду и увеличивается сверху вниз. Следовательно, проявит менее металлический характер, чем .
Сообщить об ошибке
Какой из этих атомов самый маленький?
Возможные ответы:
Бериллий
Барий
Кальций
Магний
Стронций
7 2 Правильный ответ: 90 3031 B эриллий
Пояснение:
Атомный радиус — это размер атома, когда он не связан ни с какими другими атомами. Периодическую таблицу можно использовать для оценки размера атомных радиусов атомов. При движении вниз по периодической таблице атомные радиусы увеличиваются, но при движении слева направо по периодической таблице размер атомных радиусов уменьшается.
Периодическую таблицу можно использовать для оценки размера атомных радиусов атомов. При движении вниз по периодической таблице атомные радиусы увеличиваются, но при движении слева направо по периодической таблице размер атомных радиусов уменьшается.
Бериллий, магний, кальций, стронций и барий находятся в одной и той же группе в периодической таблице, поэтому самый маленький элемент — это элемент, ближайший к вершине таблицы Менделеева, поскольку атомы становятся больше по мере продвижения вниз по таблице Менделеева . Следовательно, наименьший атом этой группы — бериллий.
Сообщить об ошибке
Какой атом является наиболее электроотрицательным?
Возможные ответы:
Фосфор
Хлор
Сера
Алюминий
Кремний
Правильный ответ:
Хлор
Пояснение:
Электроотрицательность относится к способности атома притягивать и связывать электроны. Если валентные электроны заполнены менее чем наполовину, то для потери электрона требуется меньше энергии, чем для приобретения электрона, что делает эти атомы менее электроотрицательными. Если валентные электроны заполнены более чем наполовину, то для приобретения электронов требуется меньше энергии, чем для потери электрона; поэтому эти электроны более электроотрицательны. Периодическую таблицу можно использовать для предсказания электроотрицательности атома и ее сравнения с другими атомами. Когда вы двигаетесь слева направо по периодической таблице, электроотрицательность увеличивается, потому что атомы в правой части периодической таблицы имеют больше валентных электронов и меньшие радиусы. По мере продвижения вниз по периодической таблице электроотрицательность уменьшается, потому что атомный номер увеличивается, что приводит к большему расстоянию между валентными электронами и ядром, вызывая меньшее притяжение валентных электронов.
Если валентные электроны заполнены менее чем наполовину, то для потери электрона требуется меньше энергии, чем для приобретения электрона, что делает эти атомы менее электроотрицательными. Если валентные электроны заполнены более чем наполовину, то для приобретения электронов требуется меньше энергии, чем для потери электрона; поэтому эти электроны более электроотрицательны. Периодическую таблицу можно использовать для предсказания электроотрицательности атома и ее сравнения с другими атомами. Когда вы двигаетесь слева направо по периодической таблице, электроотрицательность увеличивается, потому что атомы в правой части периодической таблицы имеют больше валентных электронов и меньшие радиусы. По мере продвижения вниз по периодической таблице электроотрицательность уменьшается, потому что атомный номер увеличивается, что приводит к большему расстоянию между валентными электронами и ядром, вызывая меньшее притяжение валентных электронов.
Используя периодический тренд электроотрицательности, мы можем предсказать, какой из атомов является наиболее электроотрицательным. Алюминий, кремний, фосфор, сера и хлор находятся в одной строке периодической таблицы. Следовательно, хлор является наиболее электроотрицательным, потому что он находится дальше всего в периодической таблице, поэтому у него больше всего валентных электронов, и чтобы получить электрон, потребуется меньше энергии, чем потерять электрон.
Алюминий, кремний, фосфор, сера и хлор находятся в одной строке периодической таблицы. Следовательно, хлор является наиболее электроотрицательным, потому что он находится дальше всего в периодической таблице, поэтому у него больше всего валентных электронов, и чтобы получить электрон, потребуется меньше энергии, чем потерять электрон.
Сообщить об ошибке
Какой из следующих атомов самый большой? 9
Фосфор
Хлор
7 Натрий Правильный ответ: 003 Пояснение: Атомный радиус — это размер атома, когда он не связан ни с какими другими атомами. Периодическую таблицу можно использовать для оценки размера атомных радиусов атомов. При движении вниз по периодической таблице атомные радиусы увеличиваются, но при движении слева направо по периодической таблице размер атомных радиусов уменьшается. Натрий, алюминий, фосфор, сера и хлор находятся в одной строке периодической таблицы. Сообщить об ошибке Какой элемент является наименее электроотрицательным? Возможные ответы: Сера Селен Теллур Кислород Полоний Правильный ответ: Полоний Пояснение: Электроотрицательность относится к способности атома притягивать и связывать электроны. Если валентные электроны заполнены менее чем наполовину, то для потери электрона требуется меньше энергии, чем для приобретения электрона, что делает эти атомы менее электроотрицательными. Если валентные электроны заполнены более чем наполовину, то для приобретения электронов требуется меньше энергии, чем для потери электрона; поэтому эти электроны более электроотрицательны. Используя периодический тренд электроотрицательности, мы можем предсказать, какой из атомов является наименее электроотрицательным. Кислород, сера, селен, теллур и полоний находятся в одной группе периодической таблицы. Следовательно, полоний является наименее электроотрицательным, потому что он находится ближе всего к основанию таблицы Менделеева и имеет самые большие атомные номера. Поскольку у полония самый большой атомный номер, расстояние между валентными электронами и ядром больше, что приводит к уменьшению притяжения валентных электронов. Поскольку размер атомных радиусов уменьшается при движении слева направо по таблице Менделеева, элемент, самый дальний слева, будет самым большим. Следовательно, натрий является самым большим атомом из группы.
Поскольку размер атомных радиусов уменьшается при движении слева направо по таблице Менделеева, элемент, самый дальний слева, будет самым большим. Следовательно, натрий является самым большим атомом из группы. Периодическую таблицу можно использовать для предсказания электроотрицательности атома и ее сравнения с другими атомами. Когда вы двигаетесь слева направо в периодической таблице, электроотрицательность увеличивается, потому что атомы в правой части периодической таблицы имеют больше валентных электронов. По мере продвижения вниз по периодической таблице электроотрицательность уменьшается, потому что атомный номер увеличивается, что приводит к большему расстоянию между валентными электронами и ядром, вызывая меньшее притяжение валентных электронов.
Периодическую таблицу можно использовать для предсказания электроотрицательности атома и ее сравнения с другими атомами. Когда вы двигаетесь слева направо в периодической таблице, электроотрицательность увеличивается, потому что атомы в правой части периодической таблицы имеют больше валентных электронов. По мере продвижения вниз по периодической таблице электроотрицательность уменьшается, потому что атомный номер увеличивается, что приводит к большему расстоянию между валентными электронами и ядром, вызывая меньшее притяжение валентных электронов.

 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра. Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов. У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.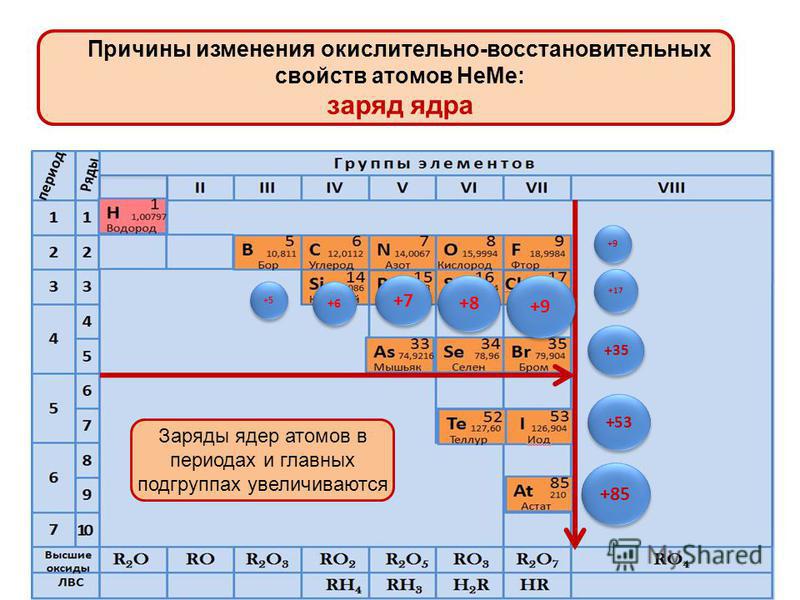 Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.
Leave A Comment