Перемешивание жидкостей
Жидкости можно перемешивать как вручную, так и механическим путем. Перемешивание бывает необходимо при растворении твердых веществ в жидкости, при растворении жидкости в жидкости, при проведении многих работ.
Перемешивание вручную. При смешивании небольших объемов жидкостей перемешивание можно проводить при помощи стеклянной палочки, например в стакане. На рис. 333 показано, как нужно проводить эту операцию.
При перемешивании в колбе ее вращают, придерживая за горло. В закрытом сосуде перемешивают путем встряхивания или многократного перевертывания его. Перемешивать вручную легко только не вязкие жидкости. Чем выше вязкость жидкости, тем труднее ее перемешивать, и обычно в подобных случаях прибегают к механическим способам перемешивания. Однако вязкость жидкости можно уменьшить нагреванием. Горячую жидкость перемешивают, обернув сосуд полотенцем, чтобы не об? жечься.
Если приходится перемешивать вручную в закрытом сосуде жидкости с низкой температурой кипения, обязательно нужно придерживать пробку, так как в сосуде развивается повышенное давление вследствие испарения растворителя и пробка может выскочить.
Для перемешивания жидкостей, а иногда и для растворения твердых веществ применяют также цилиндр для смешивания, снабженный притертой пробкой (рис. 334). Он напоминает мерный цилиндр, но не имеет делений. Жидкости, подлежащие смешиванию, наливают в цилиндр так, чтобы суммарный объем их составлял не более 3/4 — 4/5 емкости цилиндра. Взбалтывание проводят, придерживая одной рукой пробку, а другой — основание цилиндра. Если смешивают органические растворители со сравнительно низкой температурой кипения, рекомендуется время от времени спускать давление, развивающееся внутри цилиндра в результате испарения жидкостей.
Рис. 335. Лабораторный электромотор и водяная турбина.
Для этого нужно слегка освободить стеклянную пробку, не вынимая ее совсем, а затем снова притереть ее.
Механическое перемешивание. Механическое перемешивание предпочтительнее ручного. Для вращения мешалок применяют электрические моторы, водяные турблны (рис. 335) и воздушные моторы, приводимые в движение нагретым воздухом (рис. 336).
335) и воздушные моторы, приводимые в движение нагретым воздухом (рис. 336).
На рис. 337 показано, как монтируют мешалку с водяной турбиной. Чтобы пустить в работу водяную турбину, ее прочно укрепляют в штативе. Затем один из отростков ее при помощи шланга соединяют с водопроводным краном, а на другой надевают водоотводную трубку, которую опускают в раковину или в водосток. Открывая водопроводный кран, приводят в движение турбинку. Чем сильнее струя воды, тем быстрее вращается ротор турбинки, поэтому число оборотов ее можно регулировать.
Применяются также водяные турбины из стекла (рис. 338).Воздушный мотор работает под действием нагретого на горелке воздуха. Через несколько секунд после того, как горелка зажжена, следует рукой повернуть один из маховиков.
На рис. 339 показана лабораторная мешалка с приводом от электромотора, укрепленного на штативе. При необходимости ось мотора может быть расположена не только по вертикали, но’ и наклонно. Мотор можно передвигать по штативу вверх и вниз, В ось мотора вставляют и закрепляют стеклянные мешалки (лопасти)’, имеющие самую разнообразную форму.
Рис. 336. Мотор, приводимый в движение нагретым воздухом.
Рис. 337. Установка для растворения с водяной турбиной.
Удобную мешалку можно сделать из куска резиновой трубки, надетой на стеклянную палочку, служащую осью мешалки (рис. 340). На резиновой трубке, предварительно надетой на стеклянную палочку, делают четыре надреза по образующей, а затем сближают верхний и нижний концы трубки.
Рис. 338. Стеклянная водяная турбина
Рис. 339. Лабораторная мешалка с электрическим мотором.
Форму стеклянной мешалки выбирают в зависимости от вязкости жидкости, которую применяют, например, при растворении, и от вязкости полученного раствора. Надо учитывать, что вязкие жидкости нельзя перемешивать с большой скоростью, и приходится ограничиваться малым числом оборотов мешалки, иначе стеклянные мешалки ломаются.
На рис. 341 показана механическая мешалка, у которой электромотор вынесен, и мешалка вращается от гибкого вала, как у бормашины.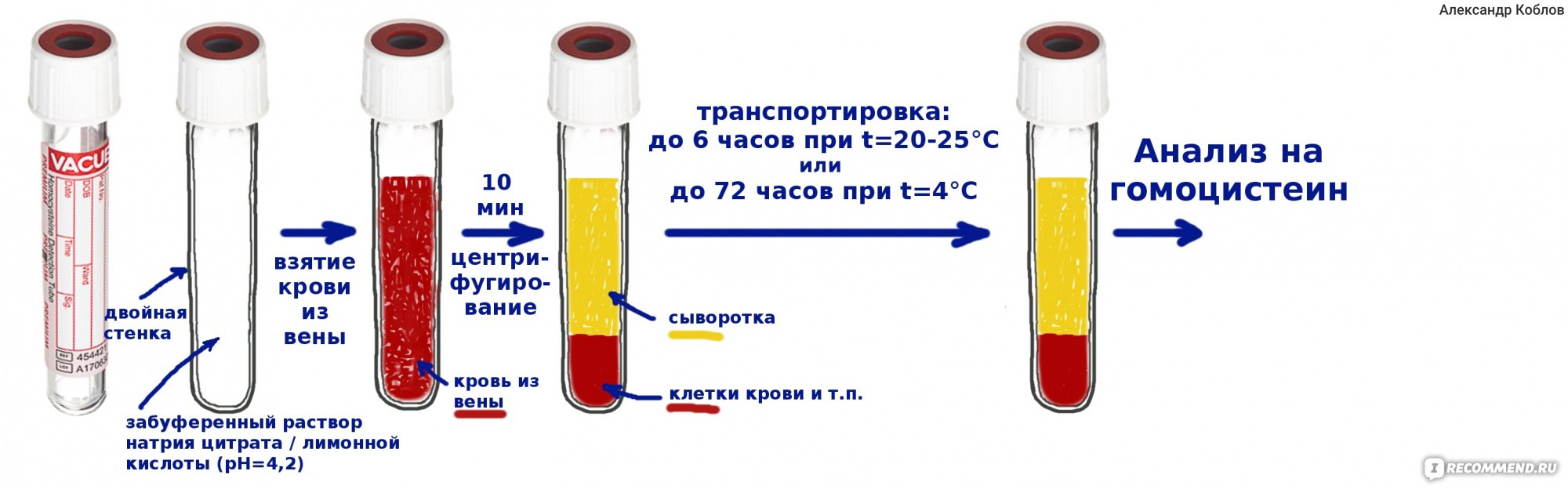
Электромотор применяют также в групповых мешал* ках, например при перемешивании в 3—4 стаканах. В этом случае каждая мешалка имеет свой привод от шкива, связанного с электромотором.
В настоящее время большое применение находят электромагнитные мешалки (рис. 342). Принцип их действия основан на том, что электромагнит, укрепленный на оси
вертикально расположенного мотора, при вращении приводит в движение якорь из мягкого железа. Якорь помещают в стеклянную или кварцевую ампулу, которую запаивают. Ампулу кладут на дно сосуда, в котором проводят перемешивание. Электромагнитные мешалки можно применять во всех случаях, когда требуется перемешивать маловязкие жидкости (при электролизе, титровании и пр.). Прибор работает без шума, спокойно. Имеются модели электромагнитных мешалок, снабженных штативами, что позволяет укреплять на них бюретки и другие приборы или приспособления, необходимые при проведении какой-либо работы.
Рис.343. Встряхиватель Сокслета.
С якорем нужно обращаться осторожно и стараться не разбить стеклянную трубочку, в которой он запаян. Если же трубочка разобьется, якорь нужно сначала вытереть насухо и снова запаять в новую стеклянную или кварцевую трубочку подходящего диаметра.
Перемешивание, например при растворении, можно проводить, пользуясь так называемыми встряхивателями. Встряхиватель Сокслета (рис. 343) приводится в движение мотором. Так как пробка, которой закрыта бутыль с перемешиваемой жидкостью, может быть хорошо замазана и прикреплена-к горлу бутыли, то при таком способе перемешивания растворитель не испаряется и в него не попадает влага.
Встряхиватель Сокслета (рис. 343) приводится в движение мотором. Так как пробка, которой закрыта бутыль с перемешиваемой жидкостью, может быть хорошо замазана и прикреплена-к горлу бутыли, то при таком способе перемешивания растворитель не испаряется и в него не попадает влага.
Большим распространением в лабораториях пользуется встряхиватель Вагнера (рис. 344). Он служит для перемешивания содержимого бутылей, колб и других аналогичных сосудов. При работе с ним очень важно надежно прижать выдвижной колпачок к пробке или к горлу сосуда и неподвижно закрепить последний. Если сосуд плохо закреплен, то при вращении встряхивателя он может выпасть. Прибор приводится в движение как вручную, так и от мотора. Если нужно медленное перемешивание или взбалтывание, между мотором и приводным колесом встряхивателя устанавливают передаточные-шкивы.
Рис. 344. Встряхиватель Вагнера.
Кроме горизонтальных встряхивателей, очень удобны, особенно для встряхивания делительных воронок, вертикальные встряхиватели (рис.
Современный универсальный электронный вибратор (рис. 346) имеет приставные детали, например для крепления одной бутыли или для крепления пробирок, делительных воронок разной емкости, пипеток для смешивания крови и др. Прибор снабжен регулятором частоты колебаний и контрольной лампой.
Перемешивание воздухом или газом. Удобным приемом механического перемешивания жидкостей является пропускание через них воздуха или какого-нибудь инертного газа под небольшим давлением. Этот процесс называют барботированием, и его можно проводить, исполь-
Рис. 345. Вертикальный встряхиватель.
Рис. 346. Универсальный электронный вибратор.
зуя любой газопромыватель или любую предохранительную склянку, или даже промывалку, присоединив их к вакуум-насосу, к нагнетательному насосу или используя сжатый газ. Естественно, что барботирование воздухом можно проводить, только когда он не будет оказывать какого-либо химического воздействия на жидкость или растворенные в ней вещества.
Естественно, что барботирование воздухом можно проводить, только когда он не будет оказывать какого-либо химического воздействия на жидкость или растворенные в ней вещества.
При барботировании не нужно пускать очень сильную струю воздуха или инертного газа, так как это всегда вызывает разбрызгивание перемешиваемой жидкости. Кроме того, очень важно, чтобы отверстия, через которые поступает воздух или инертный газ, были бы мелкими и их было бы. много. При выполнении этих условий создается более равномерное и спокойное перемешивание.
Для барботироваиия очень удобны трубки, снабженные пластинкой различной формы, из пористого прессованного стекла (см. гл. 11 «Фильтрование»). Удобны так же пальцевидные насадки (бужи) длиной от 80 до 250 мм и диаметром от 30 до 85 мм. Они обычно сплавлены со стеклянной трубкой, через которую пропускают газ. Пористость пластинок может быть разной, от № 1 до № 4.
К оглавлению
см также
- Измельчение
- Ручное измельчение
- Механическое измельчение
- Смешивание
- Смешивание твердых веществ
- Перемешивание жидкостей
Реальный вариант ОГЭ по химии — 2021 № 4
Реальный вариант ОГЭ по химии-2021. Реальный КИМ ОГЭ по химии 2021 с ответами и решениями.
Реальный КИМ ОГЭ по химии 2021 с ответами и решениями.
В 2021 году централизованный ОГЭ по химии отменили. Вместо этого провели контрольные работы в формате ОГЭ. Но КИМ остались те же самые (не пропадать же им).
Вариант 4
Часть 1
| Ответами к заданиям 1–17 являются цифра или последовательность цифр (чисел). Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов. Каждую цифру пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. |
1. Выберите два утверждения, в которых говорится о хлоре как о простом веществе:
1) Поваренная соль содержит хлор.
2) Хлор — сильный окислитель.
3) Хлор реагирует даже с золотом
4) Хлор входит в состав минерала галита.
5) В хлориде железа(III) по сравнению с хлоридом железа(II) содержится больше хлора.
Запишите номера выбранных ответов.
2. На рисунке изображена схема распределения электронов по электронным слоям атома некоторого химического элемента.
Запишите в таблицу номер периода (X) и номер группы (Y), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева. (Для записи ответа используйте арабские цифры).
3. Расположите химические элементы:
1) кислород 2) кремний З) азот
в порядке уменьшения радиусов их атомов.
Запишите номера элементов в соответствующем порядке.
4. Установите соответствие между формулой вещества и степенью окисления марганца в данном веществе: к каждой позиции, обозначенной буквой подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ МАРГАНЦА |
| А) MnSO4 | 1) +2 |
| Б) K2MnO4 | 2) +7 |
| В) MnO2 | 3) +4 |
| 4) +6 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества с ионной связью.
1) Li2O
2) Al
3) NH4I
4) HNO3
5) SO2
Запишите номера выбранных ответов.
6. Какие два утверждения верны для характеристики как алюминия, так и бора?
1) Все электроны в атоме элемента в основном состоянии находятся на трёх энергетических уровнях.
2) Атомный радиус элемента больше атомного радиуса лития.
3) Электроотрицательность меньше, чем у углерода,
4) Образуемый элементом высший оксид относится к кислотным.
5) Элемент образует высший оксид состава Э2О3
Запишите номера выбранных ответов.
7. Из предложенного перечня веществ выберите основание и двухоснóвную кислоту
1) Al2O3 2) Cu(OH)2 3) H2SiO3 4) MgO 5) HNO3
Запишите в поле ответа сначала номер основания, а затем номер двухоснóвной кислоты.
8. Какие два из перечисленных веществ вступают в реакцию с оксидом железа(II)?
1) HCl
2) Ba(NO3)2
3) Al
4) O2
5) H2O
Запишите номера выбранных ответов.
9. Установите соответствие между реагирующими веществами и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ |
| А) Al + KOH + H2O → | 1) → KAlO2 |
| Б) AlCl3(изб.) + KOH → | 2) → KAlO2 + H2 |
| В) AlCl3 + KOH(изб) → | 3) → K[Al(OH)]4 + KCl |
| 4) → Al(OH)3 + KCl | |
| 5) → K[Al(OH)]4 + H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) C | 1) HCl, CuSO4 |
| Б) Cl2 | 2) KOH, H2 |
| В) Fe | 3) Al2O3, NaCl |
| 4) CuO, O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
1) магний и нитрат железа (III)
2) оксид серы (VI) и оксид кальция
3) оксид меди (II) и соляная кислота
4) железо и хлор
5) кальций и вода
Запишите номера выбранных ответов.
12. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) CuSO4 и BaCl2 | 1) выпадение белого осадка |
| Б) CuSO4 и NaOH | 2) выпадение желтого осадка |
| В) FeSO4 и NaOH | 3) выпадение голубого осадка |
| 4) выпадение серо — зеленого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
13. При полной диссоциации 1 моль каких двух из представленных веществ образуется 3 моль ионов?
1) сульфат железа(III)
2) бромид меди(II)
3) нитрат хрома(III)
4) гидроксид кальция
5) хлорид аммония
Запишите номера выбранных ответов.
14. Выберите два исходных вещества, взаимодействию которых соответствует сокращенное ионное уравнение реакции
Выберите два исходных вещества, взаимодействию которых соответствует сокращенное ионное уравнение реакции
S2- + 2H+ = H2S
1) FeS
2) Al2S3
3) Na2S
4) H2CO3
5) HBr
6) HNO2
Запишите номера выбранных ответов.
15. Установите соответствие между схемой процесса, происходящего в окислительно — восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) 2O-2 → O20 | 1) окисление |
| Б) Cr+6 → Cr+3 | 2) восстановление |
| В) Cl-1 → Cl+1 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Из перечисленных суждений о правилах работы с веществами и оборудованием в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Пробиркодержатель закрепляют в нижней части пробирки.
2) При отборе избытка раствора соляной кислоты запрещается возвращать его в исходную ёмкость.
3) При использовании в быту чистящих растворов, содержащих едкий натр, необходимо использовать защитные перчатки.
4) Перемешивание растворов, находящихся в пробирке, осуществляют лёгким постукиванием пальцев по нижней части пробирки.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й).
17. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) KCl и NH3 | 1) HI |
| Б) Al(NO3)3 и KNO3 | 2) Na3PO4 |
| В) BaBr2 и Na2SO4 | 3) фенолфталеин |
4) HNO3(разб. ) ) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| Ответом к заданиям 18, 19 является целое число или конечная десятичная дробь. Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно. |
| Задания 18 и 19 выполняются с использованием следующего текста. |
| Дигидроортофосфат калия (техническое название — монофосфат калия) — соединение, имеющее химическую формулу КН2РО4. Это вещество широко используется в сельском хозяйстве в качестве комплексного калийно — фосфорного удобрения, одновременно восполняющего недостаток этих очень важных для нормального развития растений элементов.  При подкормках овощных и цветочных культур в почву вносят 68 г дигидроортофосфата калия на 40 м2. При подкормках овощных и цветочных культур в почву вносят 68 г дигидроортофосфата калия на 40 м2. |
18. Вычислите массовую долю (в процентах) фосфора в дигидроортофосфате калия, Запишите число с точностью до десятых.
19. Вычислите массу (в граммах) фосфора, который будет внесён в составе этого удобрения в почву на участке площадью 400 м2. Запишите число с точностью до целых.
Часть 2
| Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво. |
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HNO2 + HI → I2 + NO + H2O
Определите окислитель и восстановитель.
21. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
22. К 250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Практическая часть
Прочитайте текст и выполните задания 23 и 24. Для ответа на задание 23 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (23), а затем развёрнутый ответ к нему. Ответ записывайте чётко и разборчиво. Задание 24 выполняйте только под наблюдением экспертов. При выполнении задания 24 или сразу после выполнения можно делать записи в черновике, после чего вернуться к выполнению письменной части экзаменационной работы до момента окончания экзамена. Задание 24 выполняйте только под наблюдением экспертов. При выполнении задания 24 или сразу после выполнения можно делать записи в черновике, после чего вернуться к выполнению письменной части экзаменационной работы до момента окончания экзамена. |
| Дан раствор хлорида аммония, а также набор следующих реактивов: растворы гидроксида калия, сульфата алюминия, фосфата натрия, нитрата серебра, серной кислоты, лакмуса. |
23. Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства хлорида аммония, и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня.
| Ознакомьтесь с инструкцией по выполнению задания 24, прилагаемой к заданиям КИМ. Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24. Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. |
24. Проведите химические реакции между хлоридом аммония и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции
к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Инструкция по выполнению задания 24
| Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку и попросите организатора в аудитории пригласить экспертов для оценивания проводимого Вами эксперимента. |
Понравилось это:
Нравится Загрузка…
13.7: Разбавление раствора — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47557
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Цели обучения
- Объяснить, как можно изменить концентрацию в лаборатории.

- Понимать, как в лаборатории используются стандартные растворы.
Нас часто интересует, сколько растворенного вещества растворено в заданном количестве раствора. Мы начнем обсуждение концентрации раствора с двух родственных и относительных терминов: разбавленный и концентрированный .
- Разбавленный раствор — это раствор, в котором растворено относительно небольшое количество растворенного вещества.
- Концентрированный раствор содержит относительно большое количество растворенного вещества.
Эти два термина не предоставляют никакой количественной информации (фактических чисел), но они часто полезны для сравнения решений в более общем смысле. Эти термины также не говорят нам, является ли раствор насыщенным или ненасыщенным, является ли раствор «сильным» или «слабым». Эти два последних термина будут иметь особое значение, когда мы будем обсуждать кислоты и основания, поэтому будьте осторожны, чтобы не перепутать их.
Стандартные растворы
Часто необходимо иметь раствор с очень точно известной концентрацией. Растворы, содержащие точную массу растворенного вещества в точном объеме раствора, называются маточными (или стандартными) растворами . Для приготовления стандартного раствора следует использовать такое лабораторное оборудование, как мерная колба. Эти колбы имеют объем от 10 мл до 2000 мл и тщательно откалиброваны до единого объема. На узком стержне имеется калибровочная метка 9.0041 . Точную массу растворенного вещества растворяют в небольшом количестве растворителя и добавляют в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Часто бывает удобно приготовить серию растворов известных концентраций, сначала приготовив один исходный раствор , как описано в предыдущем разделе. Аликвоты (тщательно измеренные объемы) исходного раствора можно затем разбавить до любого желаемого объема. В других случаях может быть неудобно достаточно точно взвешивать небольшую массу образца для приготовления небольшого объема разбавленного раствора. Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
В других случаях может быть неудобно достаточно точно взвешивать небольшую массу образца для приготовления небольшого объема разбавленного раствора. Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
Разведения стандартных (или стандартных) растворов
Представьте, что у нас есть раствор соленой воды определенной концентрации. Это означает, что у нас есть определенное количество соли (определенная масса или определенное количество молей), растворенное в определенном объеме раствора. Далее мы разбавим этот раствор. Для этого нужно добавить больше воды, а не соли:
\(\rightarrow\)
Перед разбавлением и после разбавления
Молярность раствора 1 равна
\[ M_1 = \dfrac{\text{моли}_1}{\text{литр}_1} \nonumber \]
, а молярность раствора 2 равна
\[ M_2 = \dfrac{\text{моли}_2 }{\text{литр}_2} \nonumber \]
переставьте уравнения, чтобы найти родинки:
\[ \text{moles}_1 = M_1 \text{liter}_1 \nonumber \]
и
\ [ \text{моль}_2 = M_2 \text{литр}_2 \nonumber \]
Что осталось прежним, а что изменилось между двумя решениями? Добавляя больше воды, мы изменяли объем раствора. Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
\[moles_1 = moles_2 \nonnumber \]
Следовательно
\[ \boxed{M_1V_1= M_2V_2 } \label{diluteEq} \]
где
- 90 003 \(M_1\) и \(M_2 \) — концентрации исходного и разбавленного растворов
- \(V_1\) и \(V_2\) — объемы двух растворов
Приготовление разбавлений — обычное дело в химической лаборатории и в других местах. Как только вы поймете приведенную выше взаимосвязь, расчеты станут простыми.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \dfrac{M_1 \times V_1}{V_2} = \dfrac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl} \nonumber \]
Раствор разбавлен на одну пятую, так как новый объем в пять раз превышает исходный. оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения.
оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения.
Еще одна распространенная проблема с разбавлением заключается в расчете количества высококонцентрированного раствора, необходимого для получения желаемого количества раствора меньшей концентрации. Высококонцентрированный раствор обычно называют исходным раствором.
Пример \(\PageIndex{1}\): Разбавление азотной кислоты
Азотная кислота \(\left( \ce{HNO_3} \right)\) является сильной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение
| Действия по устранению неполадок | |
|---|---|
Определите «данную» информацию и то, что проблема просит вас «найти».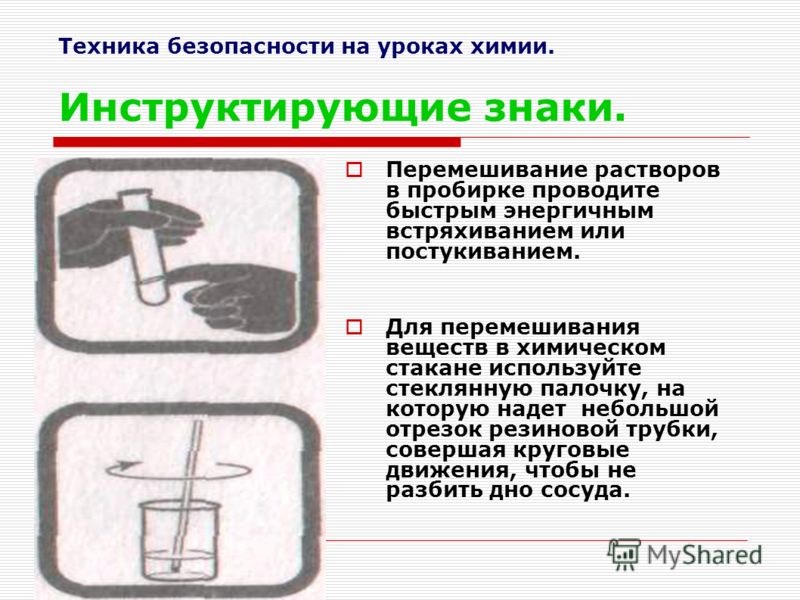 | Дано: M 1 , Запас \(\ce{HNO_3} = 16 \: \text{M}\) \(V_2 = 8.00 \: \text{L}\) \(М_2 = 0,50 \: \текст{М}\) Найти: Объем запаса \(\ce{HNO_3} \left( V_1 \right) = ? \: \text{L}\) |
| Перечислите другие известные количества. | нет |
| Спланируйте задачу. | Сначала перестройте уравнение алгебраически, чтобы найти \(V_1\). \[V_1 = \dfrac{M_2 \times V_2}{M_1} \номер\] |
| Расчет и отмена единиц измерения. | Теперь подставьте известные величины в уравнение и решите. \[V_1 = \dfrac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M}} = 0,25 \: \text{L}\] |
Подумайте о своем результате. | \( 0,25 \: \text{L} \: (250 \: \text{мл})\) исходного раствора \(\ce{HNO_3}\) необходимо разбавить водой до конечного объема \( 8.00 \: \text{L}\). Разведение производится в 32 раза, чтобы перейти от \(16 \: \text{M}\) до \(0,5 \: \text{M}\). |
Упражнение \(\PageIndex{1}\)
К 0,885 М раствору KBr с начальным объемом 76,5 мл добавляют воду до тех пор, пока его концентрация не станет 0,500 М. Каков новый объем раствора?
Ответ
135,4 мл
Обратите внимание, что расчетный объем будет иметь те же размеры, что и входной объем, и анализ размерностей говорит нам, что в этом случае нам не нужно преобразовывать в литры, так как L сокращается при делении М (моль/л) на М (моль/л).
Растворы для разведения и смешивания
| Как развести раствор от CarolinaBiological |
|---|
Эта страница под названием 13. 7: Solution Dilution распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
7: Solution Dilution распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Стиль цитирования
- Гарвард
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- разбавление
3.12: Растворы для разбавления и смешивания
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49285
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
| Как развести раствор от CarolinaBiological | На рисунке показана пипетка на двадцать пять миллилитров, получающая двадцать пять миллилитров маточного раствора из мерной колбы. Содержимое пипетки сливают в пустую мерную колбу. Затем раствор разбавляют водой до горлышка мерной колбы. Ниже на диаграмме показаны шаги, необходимые для расчета молярности разбавленного раствора. Объем исходного раствора умножается на молярность исходного раствора, чтобы получить количество молей растворенного вещества в исходном растворе. Это равно количеству молей растворенного вещества в разбавленном растворе. Затем это значение делится на общий объем разбавленного раствора, чтобы получить молярность разбавленного раствора. Содержимое пипетки сливают в пустую мерную колбу. Затем раствор разбавляют водой до горлышка мерной колбы. Ниже на диаграмме показаны шаги, необходимые для расчета молярности разбавленного раствора. Объем исходного раствора умножается на молярность исходного раствора, чтобы получить количество молей растворенного вещества в исходном растворе. Это равно количеству молей растворенного вещества в разбавленном растворе. Затем это значение делится на общий объем разбавленного раствора, чтобы получить молярность разбавленного раствора. |
Часто бывает удобно приготовить ряд растворов известных концентраций, сначала приготовив один исходный раствор , как описано в примере 1 из раздела «Концентрации раствора». Аликвоты (тщательно измеренные объемы) исходного раствора можно затем разбавить до любого желаемого объема. В других случаях может быть неудобно точно взвешивать достаточно небольшую массу образца для приготовления небольшого объема разбавленного раствора.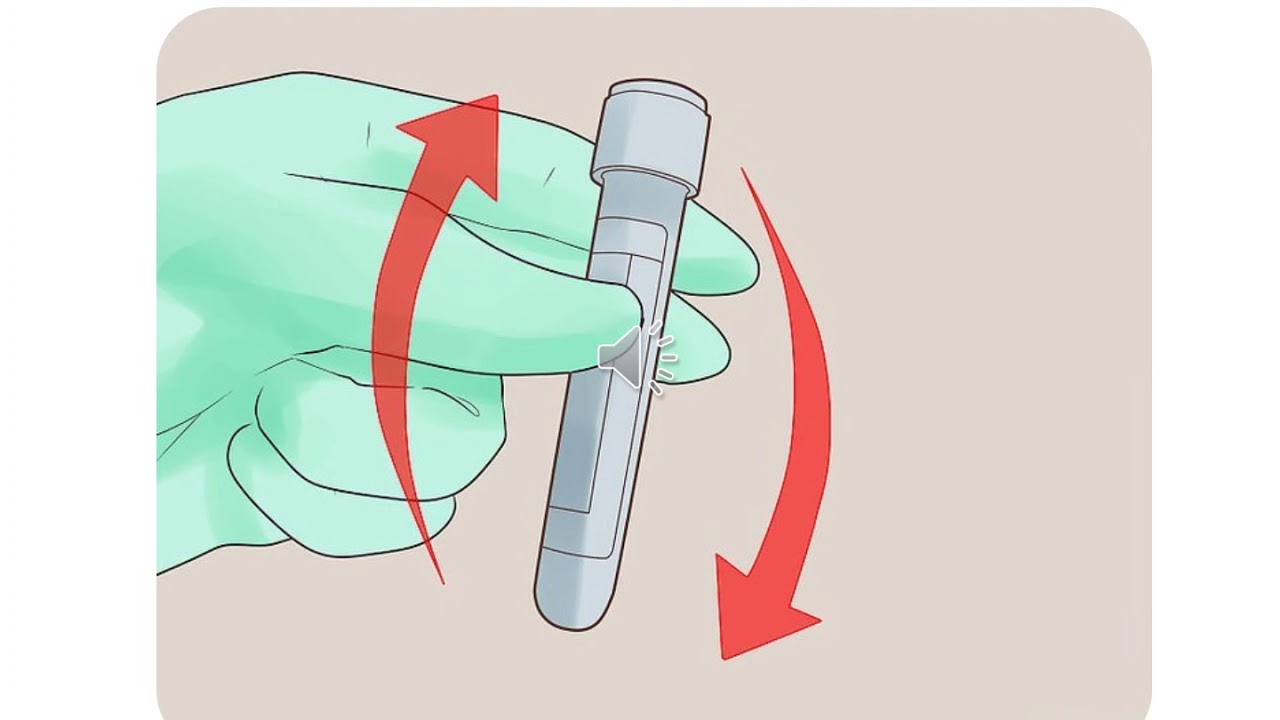 {\text{3}}}=\text{5}\text{0,14 ммоль} \nonumber \] 9{-3}\text{L}}} \nonumber \]
{\text{3}}}=\text{5}\text{0,14 ммоль} \nonumber \] 9{-3}\text{L}}} \nonumber \]
\[~ = ~ \text{0,0205 моль/л} \nonumber \]
Пример \(\PageIndex{2}\) : Концентрация Solution
Какой объем раствора 0,316 46 M KI, приготовленного в примере 1 из Solution Concentrations, потребуется для получения 50,00 мл 0,0500 M KI?
Раствор
Используя объем и концентрацию желаемого раствора, мы можем рассчитать необходимое количество KI. Тогда концентрация исходного раствора (0,316 46 9{\text{3}} \\ \end{align} \nonumber \]
Таким образом, мы должны разбавить аликвоту 7,90 мл маточного раствора до 50,00 мл. Это можно сделать, отмерив 7,90 мл из бюретки в мерную колбу вместимостью 50,00 мл и добавив воды до метки.
Обратите внимание, что приведенный выше расчет может быть упрощен, поскольку концентрация и объем концентрированного раствора (C conc и V conc ) использовались для расчета количества растворенного вещества, и это количество было полностью перенесено в разбавленный раствор :
\[ C_{conc} \times V_{conc} = n_{conc} = n_{dil} = C_{dil} \times V_{dil} \nonumber \]
Так
\[ C_{conc} \times V_{conc} = C_{dil} \times V_{dil} \nonumber \]
Например, \(\PageIndex{2}\),
\[( 0,316 46 M ) \times (V_{conc}) = (50,00 \text{ml} ) \times ( 0,0500 M) \nonumber \]
\[ V_{conc} = 7,90 \text{мл} \номер \] , который будет разбавлен до 50,00 мл, как и раньше.
Обратите внимание, что расчетный объем будет иметь те же размеры, что и исходный объем, и анализ размерностей говорит нам, что в этом случае нам не нужно преобразовывать в литры, так как L сокращается при делении M (моль/л) на M ( Молл).
Эта страница под названием 3.12: Растворы для разбавления и смешивания распространяется под лицензией CC BY-NC-SA 4.0, ее авторами, ремикшированием и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.



 При обнаружении
При обнаружении Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя. После проведения каждой реакции или обоих опытов записывайте в черновик свои наблюдения за изменениями, происходящими с веществами.
После проведения каждой реакции или обоих опытов записывайте в черновик свои наблюдения за изменениями, происходящими с веществами.


Leave A Comment