Хлорэтан, C2H5Cl, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задание 12 ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 59.5%
Ответом к заданию 12 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Посмотреть
Задачи для практики
Задача 1
Из предложенного перечня выберите два вещества, которые использовались для получения каучука, формула которого
- винилхлорид
- дивинил
- изопрен
- стирол
- 2-хлорбутадиен-1,3
Запишите в поле ответа номера выбранных веществ.
Решение
Однозначно, один из изомеров — стирол, только он имеет в составе бензольное кольцо. Это означает, что второй мономер состоит из четырех атомов углерода и не имеет в своем углеродном скелете заместителей — дивинил.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 2
Из предложенного перечня выберите формулы двух веществ, с которыми фенол не реагирует.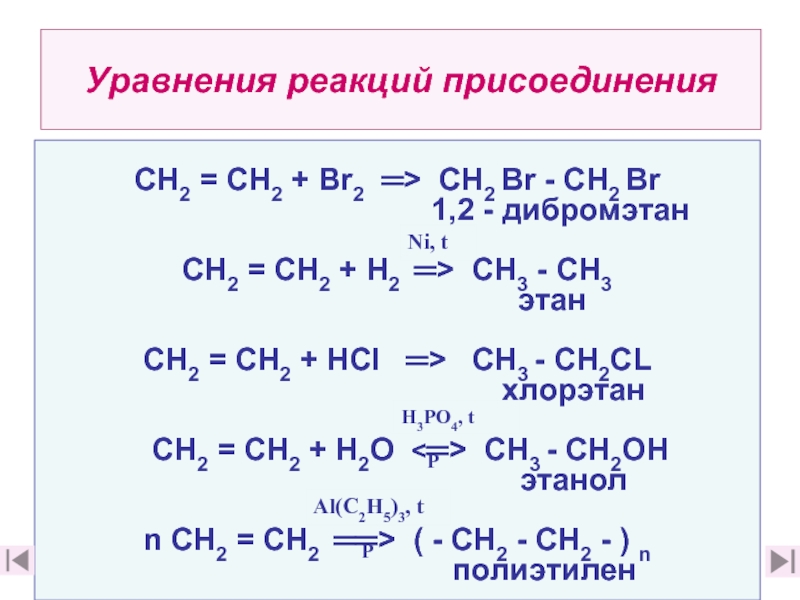
- $FeCl_3$
- NaOH
- $C_3H_7COOH$
- $HNO_3$
- HC1
Запишите в поле ответа номера выбранных веществ.
Решение
Фенол мог быть реагировать с кислотами, если бы был спиртом, но он относится к отдельному классу соединений, а из-зи своего строения, являются более сильными кислотами, чем спирты, поэтому такие реакции и не идут.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 3
Из предложенного перечня выберите две реакции, которые происходят в соответствии со схемой реакции
R–COOH + HO–R1 ⇄ R–COOR1 + H2O
- серная кислота и пропанол-1
- метилпропионат и этанол
- масляная кислота и пропанол-1
- метанол и этанол
- бутанол-1 и олеиновая кислота
Запишите в поле ответа номера выбранных реакций.
Решение
Данная схема описывает реакцию этерификации — взаимодействие органических кислот со спиртами. Следует искать пару веществ, в которой есть карбоновая кислота и спирт.
Следует искать пару веществ, в которой есть карбоновая кислота и спирт.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 4
Бутен-1 (преимущественно) образуется при взаимодействии
- бутанола-1 и концентрированной $H_2SO_4$ (при t > 140 °C)
- 2-хлорбутана со спиртовым раствором KOH
- 1-хлорбутана и водного раствора NaOH
- диметилацетилена с водородом
- 1,2-дибромбутана и цинка (при нагревании)
Запишите в поле ответа номера двух выбранных реакций.
Решение
Формула бутена-1 — $CH_3CH_2–CH=CH_2$. Составляем уравнения реакций:
1) $CH_3CH_2CH_2CH_2OH {→}↙{t > 140°С}↖{H_2SO_{4(конц.)}} CH_3CH_2–CH=CH_2 + H_2O$
Дегидратация спиртов может происходить межмолекулярно при t <140 °C с образованием простых эфиров или внутримолекулярно с образованием алкенов.
2) $CH_3–CH_2–CHCl–CH_3 + KOH_{(спирт. )} → CH_3–CH=CH–CH_3 + KCl + H_2O$
)} → CH_3–CH=CH–CH_3 + KCl + H_2O$
Отщепление галогеноводородов и воды происходит в соответствии с правилом А. М. Зайцева: атом водорода отщепляется от наименее богатого водородом атома углерода, соседнего с атомом углерода, имеющего заместитель (галоген, OH).
3) $CH_3CH_2CH_2CH_2Cl + NaOH_{(водн.)} → CH_3CH_2CH_2CH_2OH + NaCl$
При взаимодействии галогеналканов с водным раствором щёлочи происходит гидролиз и образуется соответствующий спирт.
4) $CH_3–C≡C–CH_3 + H_2 {→}↙{Ni}↖{t°} CH_3–CH=CH–CH_3$
5) $CH_3CH_2CHBr–CH_2Br + Zn →↖{t°} CH_3CH_2CH=CH_2 + ZnBr_2$
Нагревание 1,2-дигалогеналканов с цинковой пылью является способом образования кратной углерод-углеродной связи.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 5
Из предложенного перечня выберите два ряда веществ, при взаимодействии каждого из которых с раствором перманганата калия будет наблюдаться изменение окраски раствора.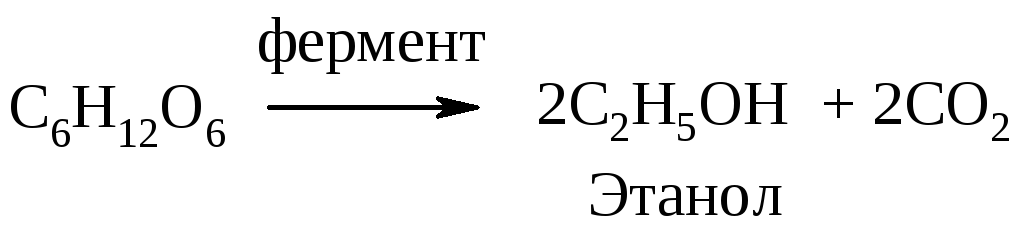
- ацетилен, п-ксилол, пропилен
- хлорэтан, пропан, бензол
- циклопентан, этилен, ацетилен
- этан, этилен, ацетилен
- пропилбензол, дивинил, пропин
Запишите в поле ответа номера выбранных рядов веществ.
Решение
Раствор перманганата калия $KMnO_4$ способен окислять спирты, альдегиды, непредельные углеводороды (алкены, алкины, диены) и их производные, боковые цепи ароматических углеводородов.
1) Ацетилен CH≡CH, пропилен $CH_3–CH=CH_2$ — непредельные углеводороды, должны обесцвечивать раствор перманганата калия; п-ксилол $C_6H_4(CH_3)_2$ окисляется раствором перманганата калия до терефталевой кислоты.
Вывод: все вещества удовлетворяют условию.
2) Хлорэтан $C_2H_5Cl$ — хлорпроизводное алкана, устойчив по отношению к раствору $KMnO_4$.
Вывод: не удовлетворяет условию задания.
3) Циклопентан $C_5H_{10}$ — циклический предельный углеводород, с раствором $KMnO_4$ не взаимодействует.
Вывод: не удовлетворяет условию задания.
4) Этан $C_2H_6$ — предельный углеводород, с раствором $KMnO_4$ не взаимодействует.
Вывод: не удовлетворяет условию задания.
5) Пропилбензол $C_6H_5CH_2CH_2CH_3$ — гомолог бензола, окисляется раствором $KMnO_4$ с образованием бензойной кислоты $C_6H_5COOH$.
1,3-Бутадиен (дивинил) — непредельный углеводород класса диенов, окисляется раствором $KMnO_4$. Пропин $CH≡C–CH_3$ — непредельный углеводород, окисляется раствором $KMnO_4$.
Вывод: все вещества удовлетворяют условию задания.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 6
Из предложенного перечня выберите два вещества, которые могут образоваться при нагревании бутанола-1 в присутствии концентрированной серной кислоты.
- простой эфир
- алкан
- альдегид
- алкен
- алкоголят
Запишите в поле ответа номера выбранных веществ.
Решение
При нагревании спиртов в присутствии концентрированной $H_2SO_4$ может происходить внутримолекулярная дегидратация с образованием алкена и воды (при t > 140 °C) или межмолекулярная дегидратация с образованием простого эфира и воды (при t < 140 °C).
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 7
Из предложенного перечня выберите два вещества, которые могут реагировать с бромоводородом.
- метан
- полиэтилен
- бензол
- изобутилен
- циклопропан
Запишите в поле ответа номера выбранных веществ.
Решение
С бромоводородом могут реагировать вещества, в молекулах которых имеются кратные углерод-углеродные связи (C=C и C≡C), циклические углеводороды с напряжёнными циклами (циклопропан и циклобутан) и соли более слабых кислот.
1) Метан $CH_4$ — предельный углеводород, все связи одинарные, в реакции присоединения не вступает.
Вывод: ответ неверный.
2) Полиэтилен $(–CH_2–CH_2–)_n$ — высокомолекулярное вещество, в молекулах которого кратные связи отсутствуют.
Вывод: ответ неверный.
3) Бензол $C_6H_6$ — ароматический углеводород, в молекулах отсутствуют кратные связи, бромоводород присоединять не может.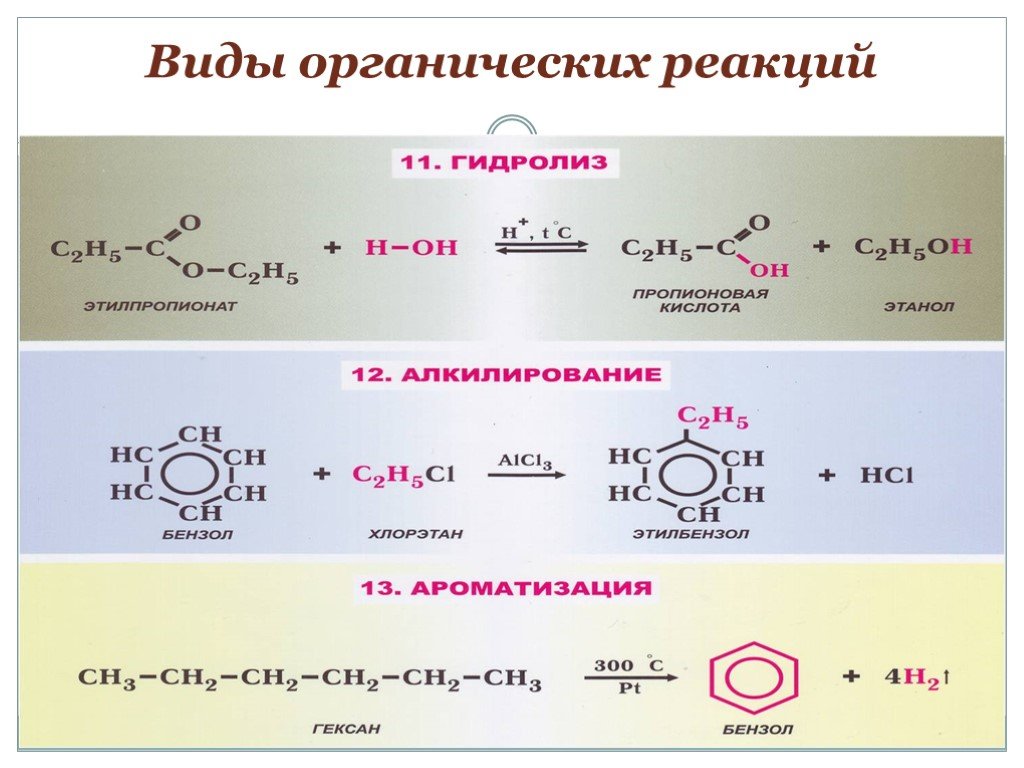
Вывод: ответ неверный; ответы 4 и 5 — правильные («по остатку»).
Ответ: 45
Показать решение
Бесплатный интенсив
Задача 8
Из предложенного перечня выберите два вещества, с которыми, в отличие от этанола, реагирует фенол.
- металлический натрий
- гидроксид натрия (р-р)
- бромная вода
- хлористый водород
- кислород
Запишите в поле ответа номера выбранных веществ.
Решение
Фенол проявляет более сильные кислотные свойства, чем алифатические спирты — в отличие от них, он способен реагировать с растворами щелочей, например, с раствором гидроксида натрия. Также фенол способен реагировать с бромной водой — бром замещает водород бензольного кольца, в осадок выпадает трибромфенол (качественная реакция на фенолы). Этанол же не реагирует с бромной водой, его галогенирование может протекать только в жёстких условиях, по радикальному механизму.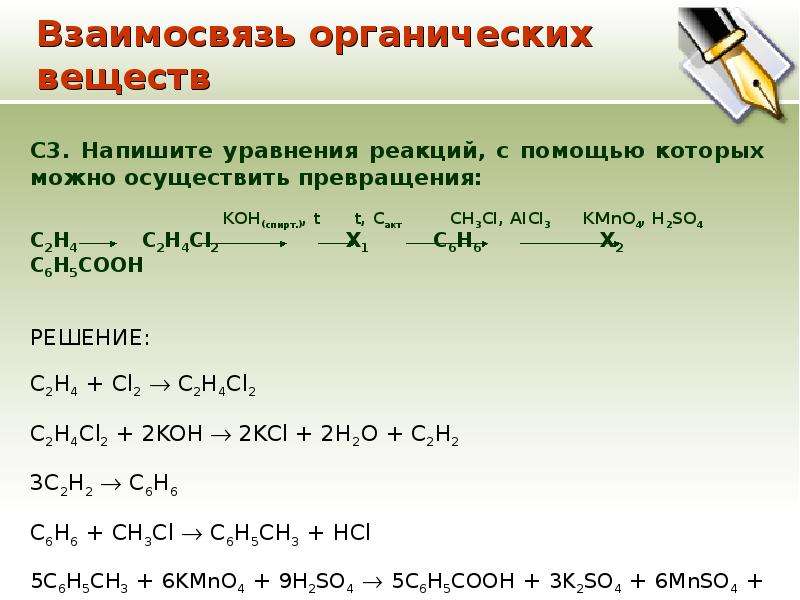
Ответ: 23
Показать решение
Бесплатный интенсив
Задача 9
Из предложенного перечня выберите два вещества, которые можно получить гидратацией алкина.
- бензол
- изопрен
- этаналь
- ацетон
- каучук
Запишите в поле ответа номера выбранных веществ.
Решение
При гидратации алкинов (в реакции Кучерова) из ацетилена образуется альдегид этаналь, а из алкинов с более длинной углеродной цепочкой — кетоны, так из пропина получается пропанон, также называемый ацетоном. В общем случае мы получаем карбонильные соединения — альдегид или кетоны
Ответ: 34
Показать решение
Бесплатный интенсив
Задача 10
Из предложенного перечня выберите два вещества, из которых в одну стадию можно получить диэтиловый эфир.
- диметиловый эфир
- бутадиен-1,3
- дихлорэтан
- этанол
- этилат натрия
Запишите в поле ответа номера выбранных веществ.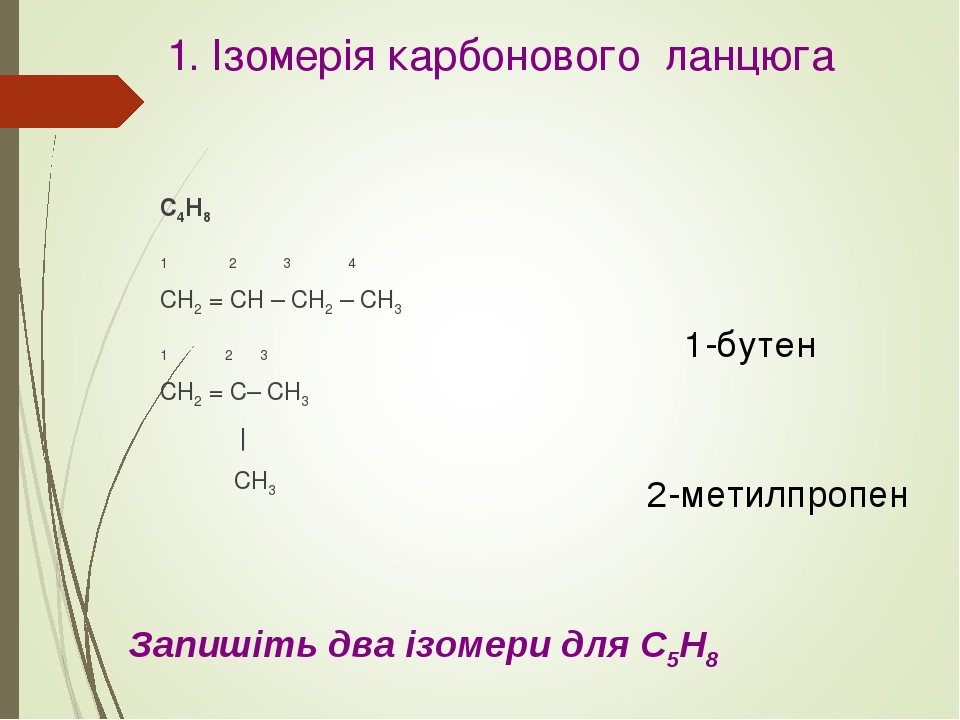
Решение
Простые эфиры получают двумя путями:
—> Дегидратация спиртов (4)
—> Реакция алкоголятов с галогенуглеводородами (5)
Ответ: 45
Показать решение
Бесплатный интенсив
Задача 11
Из предложенного перечня выберите две реакции, которые можно использовать для получения этанола из этилена и уксусного альдегида соответственно.
- гидратация
- галогенирование
- гидрирование
- гидрогалогенирование
- изомеризация
Запишите в поле ответа номера выбранных реакций.
Решение
Спирты из алкенов получаются методом гидратации (реакция с $H_2O$), следовательно, этанол получается при гидратации алкена. Спирты из альдегидов получаются методом гидрирования (реакция с $H_2$), следовательно, этанол получается при гидрировании этаналя(уксусного альдегида).
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 12
Из предложенного перечня выберите две реакции, которые можно использовать для получения пентана.
- пентен-2 с водородом
- $C_5H_{11}Cl$ с $Na$
- $C_5H_{11}COONa$ с $NaOH$
- циклопентан с хлороводородом
- $C_5H_{11}Cl$ с $KOH$
Запишите в поле ответа номера выбранных реакций.
Решение
1) Гидрирование алкенов — способ получения алканов. При гидрировании пентена-2 образуется пентан.
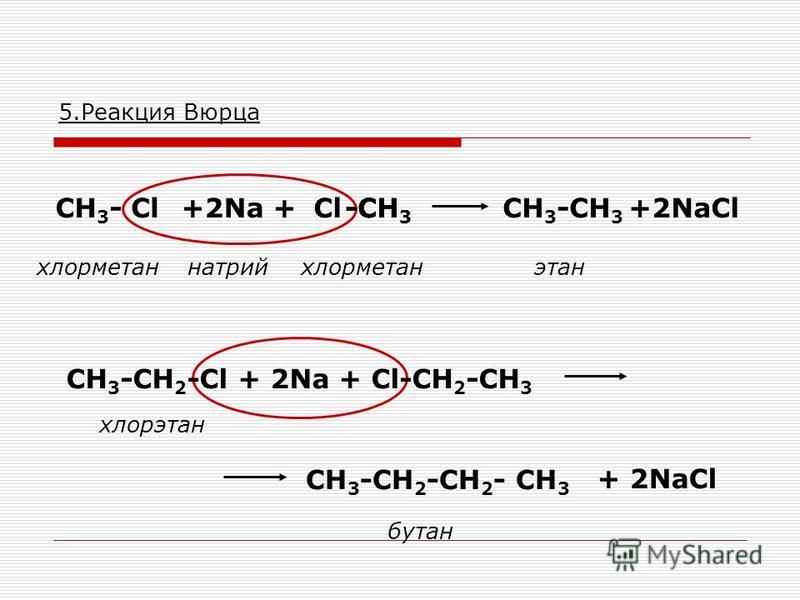
2) Между хлорпентаном и натрием протекает реакция Вюрца — образуется декан (понятно почему? Два пентильных радикала C5h21- встречаются и образуют C10h32).
3) Между натриевой солью карбоновой кислоты и гидроксидом натрия протекает реакция декарбоксилирования (реакция Дюма), продуктом которой является пентан.
4) При гидрогалогенировании циклопентана образуется хлорпентан.
5) В реакциях хлорпроизводных алканов с щелочами образуются алкены или спирты.
Таким образом, пентан образуется в реакции 1 и 3.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 13
Из предложенного перечня выберите два вещества, с которыми реагируют как фенол, так и бензол.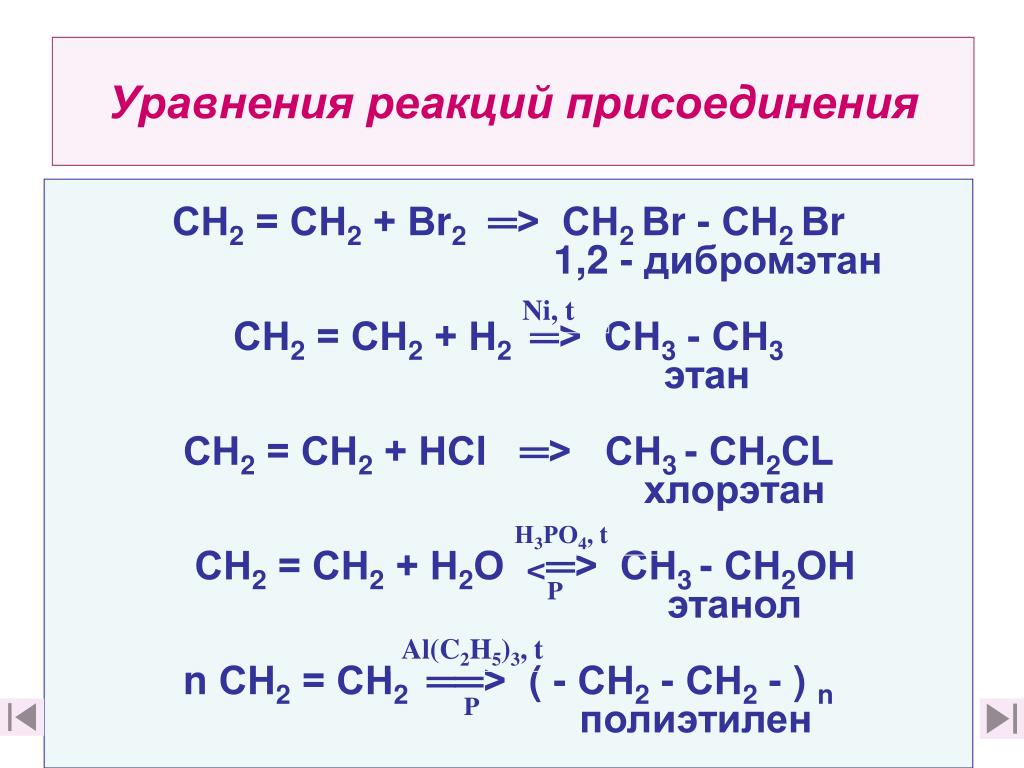
- бром
- соляная кислота
- натрий
- водный раствор гидроксида натрия
- азотная кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Ароматические соединения вступают в реакции замещения с бромом и азотной кислотой.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 14
Из предложенного перечня выберите две реакции, в которые, в отличие от бутана, может вступать циклобутан.
- гидрирование
- горение
- этерификация
- гидрогалогенирование
- дегидрирование
Запишите в поле ответа номера выбранных реакций.
Решение
Циклобутан, в отличие от бутана, является циклическим углеводородом с неустойчивым циклом, а значит может подвергаться гидрированию, образуя бутан, а также гидрогалогенированию, получится 1-хлорбутан.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 15
Из предложенного перечня выберите два вещества, с которыми уксусная кислота не реагирует.
- этанол
- хлор
- фосфат калия
- фенол
- железо
Запишите в поле ответа номера выбранных веществ.
Решение
Уксусная кислота $СН_3-СООН$ — слабая кислота, она не способна вытеснять из солей более сильные кислоты, поэтому не реагирует с фосфатом калия. Также карбоновые кислоты не реагируют с фенолами, проявляющими слабые кислотные свойства.
Ответ: 34
Показать решение
Бесплатный интенсив
Задача 16
Из предложенного перечня выберите два вещества, которые могут преимущественно образовываться при действии спиртового и водного растворов гидроксида калия на 2-бромбутан.
- бутен-1
- бутен-2
- циклобутан
- бутиловый спирт
- бутанол-2
Запишите в поле ответа номера выбранных веществ.
Решение
Взаимодействие 2-бромбутана $CH_3-CHBr-CH_2-CH_3$ c водным раствором КОН атом брома меняется на гидроксильную группу — образуется бутанол-2 (реакция идёт по ионному механизму). Если используется спиртовой раствор, то идет отщепление, а не замещение, образуется бутен-2 (работает правило Зайцева).
Если используется спиртовой раствор, то идет отщепление, а не замещение, образуется бутен-2 (работает правило Зайцева).
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 17
Из предложенного перечня выберите два вещества, с которыми может взаимодействовать натрий.
- этилен
- этан
- хлорэтан
- ацетилен
- полиэтилен
Запишите в поле ответа номера выбранных веществ.
Решение
Натрий может реагировать с галогенпроизводными, а также с алкинами, у которых тройная связь находится у конца цепочки.
Ответ: 34
Показать решение
Бесплатный интенсив
Задача 18
Из предложенного перечня выберите два ряда, каждое вещество которых взаимодействует с пропеном.
- $H_2, KOH, H_2O$
- $H_2O, H_2O_2, I_2$
- $H_2, O_2, CH_4$
- $HBr, NaMnO_4, Cl_2$
- $C_2H_6, H_2O, HBr$
Запишите в поле ответа номера выбранных рядов веществ.
Решение
Пропен $СН_3-СН=СН_2$ — алкен, вступает в реакции присоединения по двойной связи с галогенами, водородом, галогенводородами, водой. Проходят реакции замещения по sp3 гибридным атомам углерода (фрагмент Сh4-) — с галогенами, также окисляется сильными окислителями, например перманганатом или пероксидом водорода. Под номером 2 даны вода, перекись водорода и йод, под номером 4 — бромоводород, перманганат натрия и хлор.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 19
Из предложенного перечня выберите два вещества, которые соответственно образуются при взаимодействии 1,2-дихлорпропана с водным и спиртовым растворами щёлочи.
- пропен
- пропаналь
- пропанон
- пропиленгликоль
- метилацетилен
Запишите в поле ответа номера выбранных веществ.
Решение
При взаимодействии 1,2-дихлорпропана с щелочью в водном растворе хлор замещается группой OH сразу в двух позициях и образуется пропиленгликоль.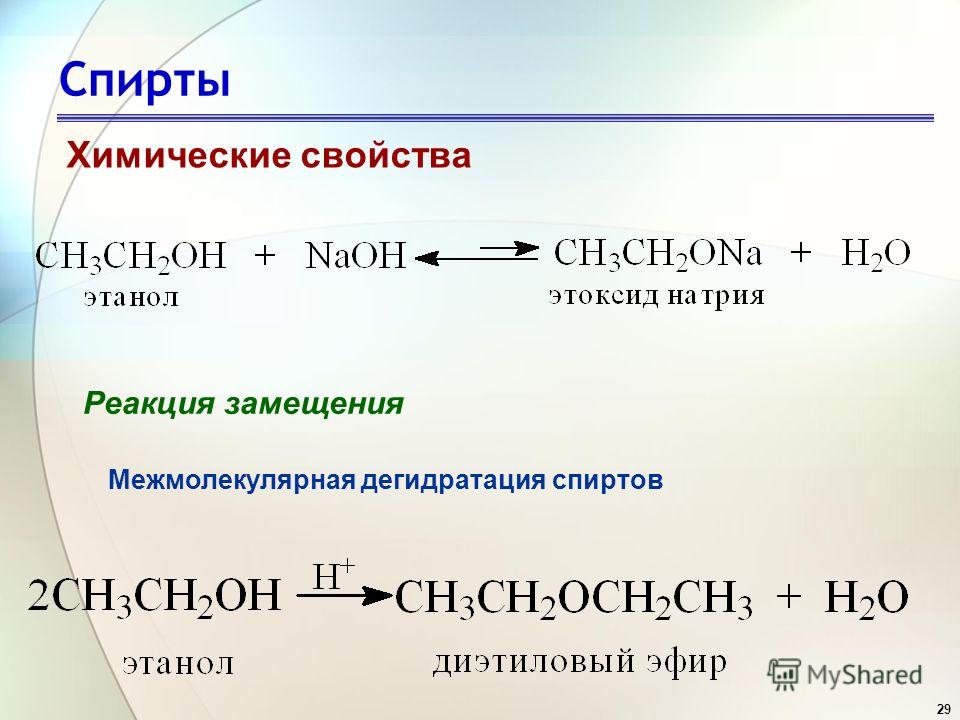 В спиртовом же растворе идет отщепление молекул хлороводорода и образуется алкин (метилацетилен).
В спиртовом же растворе идет отщепление молекул хлороводорода и образуется алкин (метилацетилен).
Ответ: 45
Показать решение
Бесплатный интенсив
Задача 20
Из предложенного перечня выберите два типа реакций, в каждую из которых вступают как н-гептан, так и метилциклогексан.
- дегидрирование
- замещение атома водорода на гидроксогруппу
- присоединение галогеноводородов
- замещение с галогеноводородами
- риформинг
Запишите в поле ответа номера выбранных типов реакций.
Решение
Перед нами алкан и циклоалкан, они оба могут вступать в риформинг, потому что входят в состав нефти. Также все алканы и устойчивые циклоалканы вступают в реакцию дегидрирования.
Ответ: 15
Показать решение
Бесплатный интенсив
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк —
это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить
уведомления.
Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить
уведомления.
Включить уведомления
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.
Курс стартует 27 марта. Бесплатный интенсив
Хлорэтан или монохлорэтан , широко известный под своим старым названием этилхлорид , представляет собой химическое соединение, когда-то широко использовавшееся для производства тетраэтилсвинца, присадки к бензину. Дополнительные рекомендуемые знания
ПроизводствоЭтилхлорид получают реакцией этилена и хлористого водорода на катализаторе из хлорида алюминия при температуре от 130 до 250°C. В этих условиях хлористый этил получают по химическому уравнению.
В прошлом этилхлорид также производился из этанола и соляной кислоты или из этана и хлора, но эти способы больше не являются экономичными. Некоторое количество этилхлорида образуется как побочный продукт производства поливинилхлорида. Если спрос на этилхлорид продолжит падать до такой степени, что производство его само по себе нерентабельно, он может стать основным источником химического вещества. ИспользованиеНачиная с 1922 года и на протяжении большей части 20-го века этилхлорид в основном использовался для производства тетраэтилсвинца (TEL), антидетонационной присадки к бензину. Однако из-за растущей осведомленности о загрязнении воздуха TEL был или постепенно прекращается в большинстве промышленно развитых стран, и спрос на этилхлорид резко упал. Как и другие хлорированные углеводороды, этилхлорид используется в качестве хладагента, пропеллента для аэрозольных распылителей, анестетика и вспенивателя для упаковки из пеноматериала. Некоторое время он использовался в качестве промотора в катализируемом хлоридом алюминия процессе производства этилбензола, предшественника мономера стирола. Однако в настоящее время он широко не используется ни в одной из этих ролей. Единственным важным промышленным применением этилхлорида остается обработка целлюлозы для получения этилцеллюлозы, загустителя и связующего в красках, косметике и подобных продуктах. Этилхлорид — лекарство, отпускаемое по рецепту в США, поставляемое в виде жидкости в аэрозольном баллончике, приводимом в движение давлением собственного пара. Он действует как мягкий местный анестетик благодаря охлаждающему эффекту при распылении на кожу, например, при удалении осколков в клинических условиях. Тепло, поглощаемое кипящей жидкостью на тканях, вызывает глубокий и быстрый озноб, но поскольку температура кипения значительно выше точки замерзания, опасность обморожения отсутствует. Пар легковоспламеняющийся и наркотический, что требует осторожности. Этилхлорид является наркотическим ингаляционным препаратом, иногда называемым «Duster». Подобно попперсу, хлористый этил используется в качестве ингалятора (вдох) во время сексуальной активности для интенсивного кайфа продолжительностью в несколько минут, который приводит к продолжительному оргазму. В Бразилии это традиционный (хотя и незаконный) наркотик, который принимают во время карнавальных парадов, известный как «духи lança». БезопасностьЭтилхлорид является наименее токсичным из хлорэтанов. Как и другие хлорированные углеводороды, он является депрессантом центральной нервной системы, хотя и менее сильным, чем многие подобные соединения. Люди, вдыхающие его пары при концентрации в воздухе менее 1%, обычно не испытывают никаких симптомов. При более высоких концентрациях у пострадавших обычно проявляются симптомы, сходные с симптомами алкогольного опьянения. Вдыхание его паров при концентрации 15% и выше часто приводит к летальному исходу. Исследования воздействия хронического воздействия этилхлорида на животных дали противоречивые результаты, и отсутствуют данные о его долгосрочном воздействии на человека. В некоторых исследованиях сообщалось, что длительное воздействие может вызвать повреждение печени или почек или рак матки у мышей, но эти данные трудно воспроизвести. Последние данные свидетельствуют о канцерогенном потенциале; он был отнесен к категории IARC A3, Подтвержденный канцероген для животных с неизвестной значимостью для человека . Каталожные номера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Хлорэтан». Список авторов есть в Википедии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Для приготовления хлорэтана-турито
Вы уверены, что хотите выйти?
Вопрос
- Газ HCl пропускают через этанол
- Этанол обрабатывают тионилхлоридом в присутствии диметиламина или пиридина
Правильный ответ: Этанол обрабатывают тионилхлоридом в присутствии диметиламина или пиридина 9
Химия-
Какое из следующих утверждений о реакции неверно?
Какое из следующих утверждений о реакции неверно?
Общая химия
Общая
Химия-
В следующей реакции конечный продукт может быть получен двумя путями (I) и (II).

Какое из следующих утверждений верно?
В следующей реакции конечный продукт может быть получен двумя путями (I) и (II).
Какое из следующих утверждений верно?
Chemistry-General
General
Chemistry-
Конечный продукт (X) в следующей реакции:
Конечный продукт (X) в следующей реакции: Общие
Химия-
Этилмеркаптан получают по следующей реакции с последующим гидролизом
Этилмеркаптан получают по следующей реакции с последующим гидролизом
Общая химия
Общая
Математика-
Две смежные стороны параллелограмма даны и . Сторона поворачивается на острый угол в плоскости параллелограмма так, что становится AD’. Если образует прямой угол со стороной AB, то косинус угла равен
Две смежные стороны параллелограмма равны и . Сторона поворачивается на острый угол в плоскости параллелограмма так, что становится AD’. Если угол АВ образует прямой угол, то косинус угла равен 9.
 0205
0205Генерал по математике
Общий
Математика-
, если тогда
IF, то тогда
Maths-General
General
Maths-
IF IF не Coplanar VECT VECT VECT VECTER VECTER VECT VECTERS. векторы, то корни уравнения0205
Если квадраты длин касательных из точки P к окружностям и находятся в A.P, то равны
Математика-Общая
Общая
В следующей окислительно-восстановительной реакции число молей , восстановленное 1 молем , равно
Chemistry-General
General
Maths-
Вектор равен
Вектор равен
Вектор равен
0205
Maths-General
General
Maths-
Пусть будут три ненулевых вектора,
такие, что угол между и равен , перпендикулярен обоим и . (где Наибольшая целочисленная функция и Дробная часть . Если , то что из следующего верно для
Позвольте быть три ненулевых вектора,
таких, что угол между и , перпендикулярен обоим и .

 Это бесцветный легковоспламеняющийся газ или охлажденная жидкость со слабым сладковатым запахом.
Это бесцветный легковоспламеняющийся газ или охлажденная жидкость со слабым сладковатым запахом.

 В результате штат Калифорния включил его в Предложение 65 как известный канцероген. Тем не менее, он до сих пор используется в медицине в качестве местного анестетика.
В результате штат Калифорния включил его в Предложение 65 как известный канцероген. Тем не менее, он до сих пор используется в медицине в качестве местного анестетика.
Leave A Comment