Углекислый газ (диоксид углерода) — Актуальные публикации на сайте компании «НИИ КМ»
Он не пригоден для поддержания жизни. Однако именно им «питаются» растения, превращая его в органические вещества. К тому же он является своеобразным «одеялом» Земли. Если этот газ вдруг исчезнет из атмосферы, на Земле станет гораздо прохладнее, а дожди практически исчезнут.
«Одеяло Земли»
Углекислый газ (двуокись углерода, диоксид углерода, CO2) формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород.
Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Правда, такая катастрофа нам пока еще не грозит. Скорее даже, наоборот. Сжигание органических веществ: нефти, угля, природного газа, древесины – постепенно увеличивает содержание углекислого газа в атмосфере. Значит, со временем надо ждать значительного потепления и увлажнения земного климата. Кстати, старожилы считают, что уже сейчас заметно теплее, чем было во времена их молодости…
Двуокись углерода выпускается жидкая низкотемпературная, жидкая высокого давления и газообразная. Ее получают из отбросных газов производств аммиака, спиртов, а также на базе специального сжигания топлива и других производств. Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека — она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Получение двуокиси углерода
В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.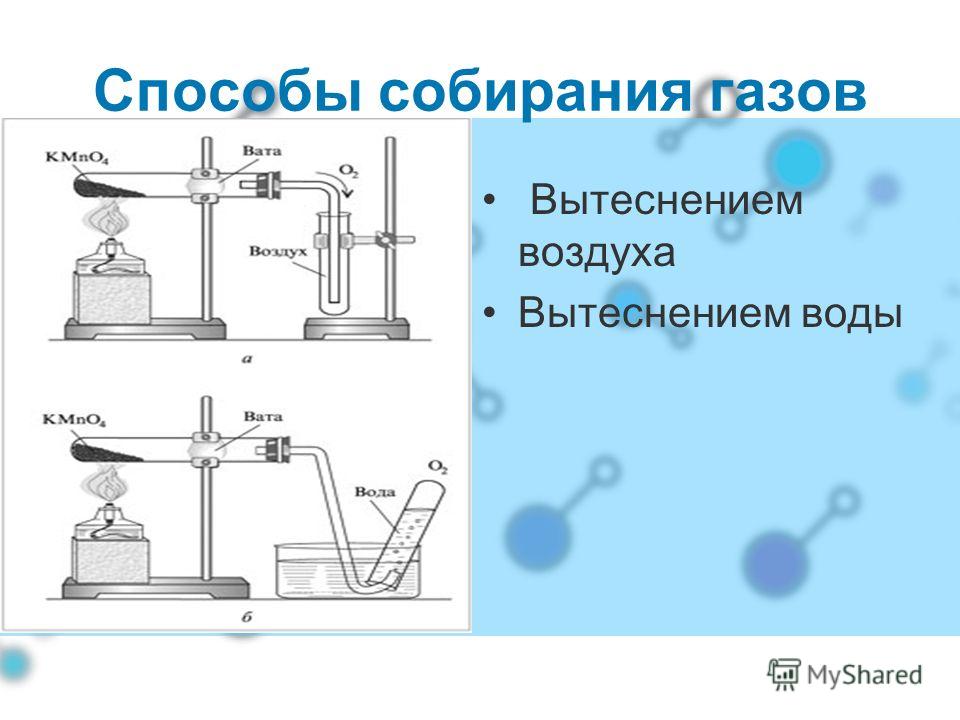
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
«Сухой лед» и прочие полезные свойства диоксида углерода
В повседневной практике углекислый газ используется достаточно широко. Например, газированная вода с добавками ароматных эссенций – прекрасный освежающий напиток. В пищевой промышленности диоксид углерода используется и как консервант — он обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Углекислотными огнетушителями пользуются при пожарах. Биохимики нашли, что удобрение… воздуха углекислым газом весьма эффективное средство для увеличения урожайности различных культур. Пожалуй, такое удобрение имеет единственный, но существенный недостаток: применять его можно только в оранжереях. На заводах, производящих диоксид углерода, сжиженный газ расфасовывают в стальные баллоны и отправляют потребителям. Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Все объясняется просто. Работа, затраченная на сжатие газа, оказывается значительно меньше той, которая требуется на его расширение. И чтобы как-то компенсировать возникающий дефицит, углекислый газ резко охлаждается, превращаясь в «сухой лед». Он широко используется для сохранения пищевых продуктов и перед обычным льдом имеет значительные преимущества: во-первых, «хладопроизводительность» его вдвое выше на единицу веса; во-вторых, он испаряется без остатка.
Углекислый газ используется в качестве активной среды при сварке проволокой, так как при температуре дуги углекислота разлагается на угарный газ СО и кислород, который, в свою очередь, и входит во взаимодействие с жидким металлом, окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
«Получение углекислого газа и его свойства». Урок – практическая работа
Цели:
- Расширить представления об истории открытия, свойствах и практическом применении углекислого газа.
- Познакомить учащихся с лабораторными способами получения углекислого газа.
- Продолжить формирование экспериментальных навыков учащихся.
Используемые приемы: “верные и неверные утверждения”, “зигзаг-1”, кластеры.
Лабораторное оборудование: лабораторный штатив, прибор для получения газов, стакан на 50 мл, кусочки мрамора, соляная кислота (1:2), известковая вода, зажим Мора.
I. Стадия вызова
На стадии вызова используется прием “верные и неверные утверждения”.
Утверждения |
| |
1. | – | |
| 2. В морях и океанах содержится в 60 раз больше углекислого газа, чем в земной атмосфере. | + | |
| 3. Природные источники углекислого газа называются мофетами. | – | |
| 4. В окрестностях Неаполя находится “Собачья пещера”, в которой не могут находиться собаки. | + | |
| 5. В лабораториях углекислый газ получают действием серной кислоты на куски мрамора. | + | |
| 6. Углекислый газ – это газ без цвета и запаха, легче воздуха, хорошо растворим в воде. | + | |
| 7. Твёрдый углекислый газ получил название “сухого льда”. | – | |
8. Известковая вода – это раствор гидроксида
кальция в воде. Известковая вода – это раствор гидроксида
кальция в воде. | + |
II. Стадия осмысления
1. Организация деятельности в рабочих группах, участники которых получают тексты по пяти основным темам “зигзага”:
- История открытия углекислого газа
- Углекислый газ в природе
- Получение углекислого газа
- Свойства углекислого газа
- Практическое применение углекислого газа
Идет первоначальное знакомство с текстом, первичное чтение.
2. Работа в экспертных группах.
В экспертные группы объединяются “специалисты” по отдельным вопросам. Их задача – внимательное чтение текста, выделение ключевых фраз и новых понятий либо использование кластеров и различных схем для графического изображения содержания текста (работа ведется индивидуально).
3. Отбор материала, его структурирование и дополнение (групповая работа)
4. Подготовка к трансляции текста в рабочих
группах
Подготовка к трансляции текста в рабочих
группах
- 1-я группа экспертов составляет опорный конспект “История открытия углекислого газа”
- 2-я группа экспертов составляет схему распространения углекислого газа в природе
- 3-я группа экспертов составляет схему получения углекислого газа и рисунок установки для его получения
- 4-я группа экспертов составляет классификацию свойств углекислого газа
- 5-я группа экспертов составляет схему практического применения углекислого газа
5. Подготовка к презентации (плакат)
III. Стадия рефлексии
Возвращение в рабочие группы
- Трансляция в группе тем 1–5 последовательно. Сбор установки для получения углекислого газа. Получение углекислого газа и исследование его свойств.
- Обсуждение результатов эксперимента.
- Презентация отдельных тем.
- Возвращение к “верным и неверным
утверждениям”.
 Проверка своих первоначальных
предположений. Расстановка новых значков.
Проверка своих первоначальных
предположений. Расстановка новых значков.
Это может выглядеть так:
Утверждения | ||
| 1. Углекислый газ – это “дикий газ”. | + | |
| 2. В морях и океанах содержится в 60 раз больше углекислого газа, чем в земной атмосфере. | + | |
| 3. Природные источники углекислого газа называются мофетами. | + | |
| 4. В окрестностях Неаполя находится “Собачья пещера”, в которой не могут находиться собаки. | + | |
5. В лабораториях углекислый газ получают
действием серной кислоты на куски мрамора. | – | |
| 6. Углекислый газ – это газ без цвета и запаха, легче воздуха, хорошо растворим в воде. | – | |
| 7. Твёрдый углекислый газ получил название “сухого льда”. | ||
| 8. Известковая вода – это раствор гидроксида кальция в воде. | + |
Тексты по пяти основным темам “зигзага”
1. История открытия углекислого газа
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием “дикого газа” алхимиком XVI в. Вант Гельмонтом.
Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728 – 1799 г.г.) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO3 CaO + CO2
карбонат кальция оксид кальция углекислый
газ
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция :
CaO + CO2 CaCO3
оксид кальция углекислый газ карбонат
кальция
Этот газ был идентичен открытому Ван Гельмонтом “дикому газу”, но Блэк дал ему новое название – “связанный воздух” – так как этот газ можно было связать и вновь получить твердую субстанцию, а также он обладал способностью притягиваться известковой водой (гидроксидом кальция) и вызывать её помутнение:
CO2 + Ca(OH)2 CaCO3 + H2O
углекислый газ гидроксид кальция карбонат
кальция вода
Несколько лет спустя Кавендиш обнаружил еще
два характерных физических свойства углекислого
газа – его высокую плотность и значительную
растворимость в воде.
2. Углекислый газ в природе
Содержание углекислого газа в атмосфере
относительно небольшое, всего 0,04–0,03% (по объему).
CO2, сосредоточенный в атмосфере, имеет
массу 2200 биллионов тонн.
В 60 раз больше углекислого газа содержится в
растворенном виде в морях и океанах.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях. Несколько столетий функционирует в качестве постоянно действующего генератора CO2
 Она знаменита тем, что собаки в ней не
могут находиться, а человек может там пребывать в
нормальном состоянии. Дело в том, что в этой
пещере углекислый газ выделяется из земли, а так
как он в 1,5 раза тяжелее воздуха, то располагается
внизу, примерно на высоте роста собаки (0,5 м). В
таком воздухе, где углекислого газа 14% , собаки (и
другие животные, разумеется) дышать не могут, но
стоящий на ногах взрослый человек не ощущает
избытка углекислого газа в этой пещере. Такие же
пещеры существуют в Йеллоустонском национальном
парке (США).
Она знаменита тем, что собаки в ней не
могут находиться, а человек может там пребывать в
нормальном состоянии. Дело в том, что в этой
пещере углекислый газ выделяется из земли, а так
как он в 1,5 раза тяжелее воздуха, то располагается
внизу, примерно на высоте роста собаки (0,5 м). В
таком воздухе, где углекислого газа 14% , собаки (и
другие животные, разумеется) дышать не могут, но
стоящий на ногах взрослый человек не ощущает
избытка углекислого газа в этой пещере. Такие же
пещеры существуют в Йеллоустонском национальном
парке (США). Природные источники углекислого газа называются мофетами. Мофеты характерны для последней, поздней стадии затухания вулканов в которой находится, в частности, знаменитый вулкан Эльбрус. Поэтому там наблюдаются многочисленные выходы пробивающихся сквозь снега и льды горячих источников, насыщенных углекислым газом.
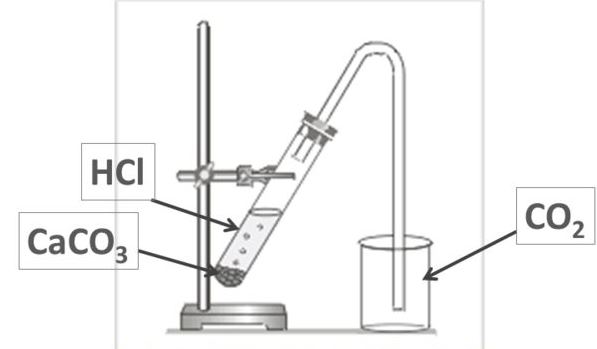
3. Получение углекислого газа
В промышленности углекислый газ получается
главным образом как побочный продукт обжига
известняка спиртового брожения и др.
В химических лабораториях либо пользуются
готовыми баллонами с жидким углекислым газом,
либо получают CO2 в аппаратах Киппа или
приборе для получения газов действием соляной
кислоты на куски мрамора:
CaCO3 + 2HCl CaCl2 + CO2 + H2O
карбонат кальция соляная кислота хлорид
кальция углекислый газ вода
Пользоваться серной кислотой вместо соляной
при этом нельзя, потому что тогда вместо
растворимого в воде хлорида кальция получался бы
гипс – сульфат кальция (CaSO4) – соль,
малорастворимая в воде. Отлагаясь на кусках
мрамора, гипс крайне затрудняет доступ к ним
кислоты и тем самым очень замедляет течение
реакции.
Для получения углекислого газа:
- Закрепите в лапке лабораторного штатива прибор для получения газов
- Выньте из пробирки с отростком пробку с воронкой
- Поместите в насадку 2–3 кусочка мрамора величиной ? горошины
- Вставьте пробку с воронкой в пробирку снова.
 Откройте зажим
Откройте зажим - Прилейте в воронку (осторожно!) соляную кислоту (1:2) так, чтобы кислота слегка покрывала мрамор
- Наполните оксидом углерода (IV) химический стакан и закройте зажим.
4. Свойства углекислого газа
CO2 – это бесцветный газ, не имеет запаха,
тяжелее воздуха в 1,5 раза, с трудом смешивается с
ним (по выражению Д.И. Менделеева, “тонет” в
воздухе), что можно доказать следующим опытом:
над стаканом, в котором закреплена горящая
свечка, опрокидывают стакан, наполненный
углекислым газом. Свечка мгновенно гаснет.
Оксид углерода (IV) обладает кислотными
свойствами и при растворении этого газа в воде
образуется угольная кислота. При пропускании CO2 через подкрашенную лакмусом воду можно
наблюдать изменение цвета индикатора с
фиолетового на красный.
Хорошая растворимость углекислого газа в воде
делает невозможным собирание его методом
“вытеснения воды”.
Качественной реакцией на содержание углекислого
газа в воздухе является пропускание газа через
разбавленный раствор гидроксида кальция
(известковую воду). Углекислый газ вызывает
образование в этом растворе нерастворимого
карбоната кальция, в результате чего раствор
становится мутным:
Углекислый газ вызывает
образование в этом растворе нерастворимого
карбоната кальция, в результате чего раствор
становится мутным:
CO2 + Ca(OH)2 CaCO3+ H2O
углекислый газ гидроксид кальция
карбонат кальция вода
При добавлении избыточного количества CO2 мутный раствор снова становится прозрачным из-за превращения нерастворимого карбоната в растворимый гидрокарбонат кальция:
CaCO3 + H2O + CO2 Ca(HCO3)2
карбонат кальция вода углекислый газ
гидрокарбонат кальция
5. Практическое применение углекислого газа
Прессованный твердый углекислый газ получил
название “сухого льда”.
Твердый CO2 скорее похож на спрессованный
плотный снег, по твердости напоминающий мел.
Температура “сухого льда” –78оС. Сухой
лед, в отличие от водяного льда, плотный. Он тонет
в воде, резко охлаждая её. Горящий бензин можно
быстро потушить, бросив в пламя несколько
кусочков сухого льда.
Горящий бензин можно
быстро потушить, бросив в пламя несколько
кусочков сухого льда.
Главное применение сухого льда – хранение и
перевозка продуктов питания: рыбы, мяса,
мороженого и др. Ценность сухого льда
заключается не только в его охлаждающем
действии, но и в том, что продукты в углекислом
газе не плесневеют и не гниют.
Сухим льдом испытывают в лабораториях детали,
приборы, механизмы, которые будут служить в
условиях пониженных температур. С помощью сухого
льда испытывают морозоустойчивость резиновых
покрышек автомобилей.
Углекислый газ применяют для газирования
фруктовых и минеральных вод, а в медицине – для
углекислотных ванн.
Жидкий углекислый газ используют в
углекислотных огнетушителях, огнетушительных
системах самолетов и кораблей и в пожарных
углекислотных машинах. Он особенно эффективен в
тех случаях, когда вода непригодна, например, при
тушении загоревшихся огнеопасных жидкостей или
при наличии в помещении невыключенной
электропроводки или уникального оборудования,
которое от воды может пострадать.
Во многих случаях CO2 используют не в
готовом виде, а получают в процессе
использования, например, хлебопекарных порошков,
содержащих смесь бикарбоната натрия с кислым
виннокислым калием. При смешивании таких
порошков с тестом соли растворяются и возникает
реакция с выделением CO2 . В результате тесто
всходит, наполняясь пузырьками углекислого газа,
и выпеченный из него продукт получается мягким и
вкусным.
Литература
- Перемена // Международный журнал о развитии мышления через чтение и письмо. – 2000. – №№ 1, 2.
- Современный студент в поле информации и коммуникации: Учебно-методическое пособие. – СПб.: PETROC, 2000.
- Загашев И.О., Заир-Бек С.И. Критическое мышление: технология развития. – СПб.: Издательство “Альянс “Дельта”, 2003.
Знать методы получения двуокиси углерода
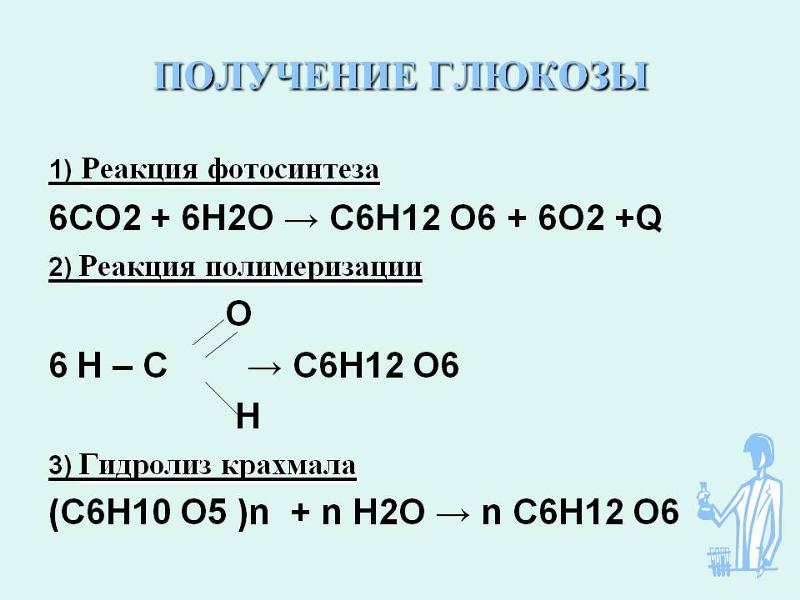
Научная формула двуокиси углерода – CO2. Углекислый газ широко используется в промышленности, на заводах и в лабораториях для проведения различных экспериментов. Это тип химического соединения, которое возникло в виде бесцветного кислого газа. Его плотность примерно на 53% выше, чем у других газов, присутствующих в атмосфере. 0,04% всего газа в атмосфере содержит углекислый газ. Наряду с атмосферой он извлекается вручную для промышленных и лабораторных целей. Он добывается из природы и может быть приготовлен в лабораториях. Также можно приготовить углекислый газ в домашних условиях, но только в меньшем количестве.
Это тип химического соединения, которое возникло в виде бесцветного кислого газа. Его плотность примерно на 53% выше, чем у других газов, присутствующих в атмосфере. 0,04% всего газа в атмосфере содержит углекислый газ. Наряду с атмосферой он извлекается вручную для промышленных и лабораторных целей. Он добывается из природы и может быть приготовлен в лабораториях. Также можно приготовить углекислый газ в домашних условиях, но только в меньшем количестве.
Двуокись углерода представляет собой бесцветный кислый газ с молярной массой 44,009 г·моль-1. Структура углекислого газа тригональная. Теплоемкость углекислого газа 37,135 Дж/К·моль. Его растворимость при температуре 25 °С составляет 1,45 г/л.
Углекислый газ выдыхается человеком в процессе дыхания. Затем, далее, он поглощается растениями и используется ими для синтеза пищи в процессе фотосинтеза. Наряду с этим, он имеет различные методы получения и использование двуокиси углерода.
Существуют различные методы получения диоксида углерода. Разберем их по отдельности.
Естественный методУглекислый газ содержится в пещерах и шахтах. Эти пещеры и шахты представлены минералоподобным магнезитом, доломитом и известняком. Его извлекают из этих полезных ископаемых и хранят.
Наряду с этим, естественно, в процессе ферментации образуется и углекислый газ. В этом процессе органические сахаросодержащие продукты, такие как виноград, хранятся в течение многих лет для приготовления алкоголя, вин и пива. Во время этого процесса также производится и собирается углекислый газ для будущего использования.
Углекислый газ также выделяется в процессе распада.
Это несколько естественных методов получения углекислого газа.
Промышленный метод В промышленности двуокись углерода получают путем взаимодействия карбонатов с кислотами. Так, при промышленных способах получения карбонат кальция реагирует с соляной кислотой.
Когда мы смешиваем карбонат кальция с разбавленной соляной кислотой, образуется хлорид кальция; вместе с этим выделяются углекислый газ и газообразный водород. Из-за легкости водорода он быстро уходит в атмосферу, а углекислый газ собирается в воронке. Уравнение этой реакции написано ниже.
CaCO3 + dil 2HCl → CaCl2 + CO2↑ + h3↑
Карбонат кальция + разбавленная соляная кислота → хлорид кальция + диоксид углерода + вода
Дома Уксус. Во-первых, возьмите одну чайную ложку пищевой соды в стеклянную трубку и добавьте в нее ¼ стакана уксуса. После смешивания вы увидите пузырьки в стеклянной трубке, и это пузырьки углекислого газа. Вы можете собрать углекислый газ в баллон или воронку. С метаном Углекислый газ также можно получить с использованием метана в процессе сжигания. При сгорании метана или углерода выделяется углекислый газ. Когда мы реагируем на углерод с кислородом, вместе с этим выделяется углекислый газ. Высвобожденный углекислый газ собирается для дальнейшего использования. Уравнения этих реакций написаны ниже.
Высвобожденный углекислый газ собирается для дальнейшего использования. Уравнения этих реакций написаны ниже.
C + O2 → CO2 + Тепло
Углерод + кислород → углекислый газ + Тепло
Ch5 + 2O2 → CO2 + 2h3O
Метан + кислород → двуокись углерода + вода
Разложение карбоната кальцияПри разложении карбоната кальция выделяется углекислый газ. Уравнение записывается так:
CaCO3 → CaO + CO2
Карбонат кальция → оксид кальция + диоксид углерода
Разложение карбоната магнияПри разложении карбоната магния выделяется углекислый газ. Уравнение записывается как:
MgCo3 → MgO + CO2
Карбонат магния → оксид магния + диоксид углерода
С карбонатами металловКогда карбонаты металлов, такие как карбонат натрия, реагируют с серной кислотой, выделяется углекислый газ. Уравнение записывается следующим образом:
Na2CO3 + h3SO4 → Na2SO4 + h30 + CO2
Карбонат натрия + серная кислота → сульфат натрия + вода + диоксид углерода
С бикарбонатами металлов Когда металлические бикарбонаты, такие как бикарбонат натрия, реагируют с серной кислотой, выделяется углекислый газ. Уравнение записывается так:
Уравнение записывается так:
Na2HCO3 + h3SO4 → Na2SO4 + h30 + CO2
Гидрокарбонат натрия + серная кислота → сульфат натрия + вода + диоксид углерода
Физические свойства диоксида углеродаДавайте изучим некоторые физические свойства углерода. двуокись углерода:
- Углекислый газ — бесцветный кислый газ.
- Углекислый газ имеет слабый запах (без запаха).
- На 53% тяжелее воздуха. Благодаря этому он находит больше вблизи поверхности земли.
- Твердая двуокись углерода называется сухим льдом.
- Углекислый газ может стать твердым при комнатной температуре, но при давлении 70 атмосфер.
Давайте узнаем некоторые химические свойства двуокиси углерода:
- Вода реагирует с двуокисью углерода с образованием угольной кислоты.
CO2 + h3O → h3CO3
- Реагирует с гидроксидом натрия с образованием карбоната натрия.

- Реагирует с гидроксидом кальция, в результате чего образуется водный карбонат кальция.
- Образует оксиды металлов при взаимодействии с металлами.
Существует несколько способов получения углекислого газа. Его можно приготовить в лабораториях, на производстве, в домашних условиях и с использованием различных химических веществ, таких как метан, углекислый газ, бикарбонат и т.д. Наряду с этим углекислый газ широко используется при приготовлении холодных напитков, газированных напитков и других пакетированных продуктов. Он также используется в огнетушителях, потому что он останавливает подачу кислорода и останавливает горение огня. Он также используется в лабораториях для различных химических веществ, таких как пищевая сода, мочевина, стиральный порошок и т. д. Он также используется при сварке металлов, таких как железо, медь, для предотвращения коррозии.
Физиология, задержка углекислого газа – StatPearls
Шивани Патель; Джулия Х.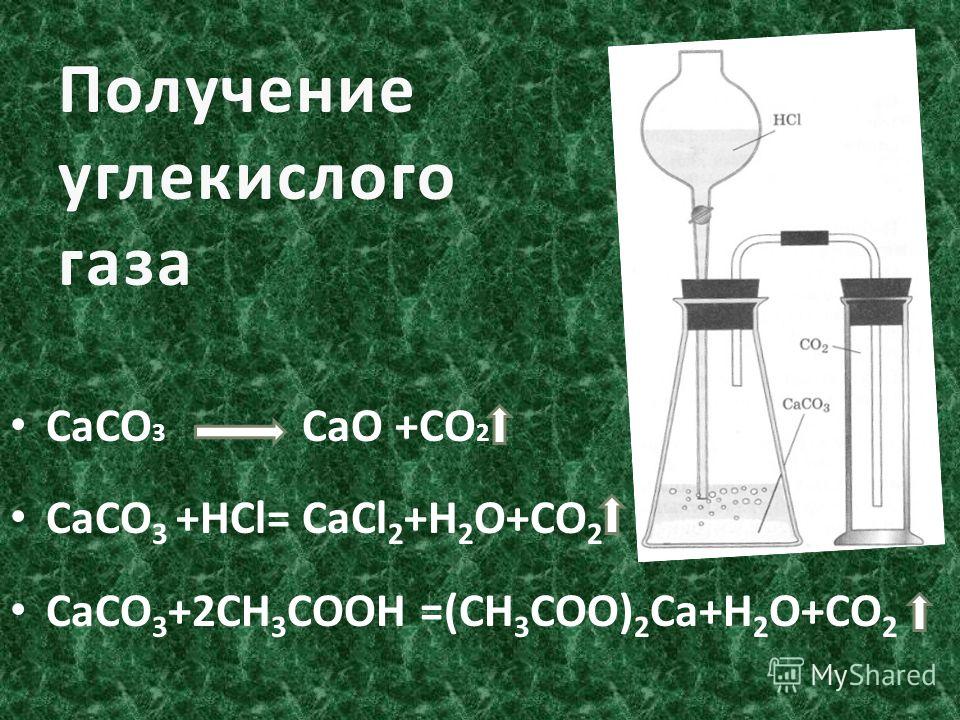 Мяо; Экрем Йетискул; Аня Анохина; Сапан Х. Маймундар.
Мяо; Экрем Йетискул; Аня Анохина; Сапан Х. Маймундар.
Информация об авторе и организациях
Последнее обновление: 26 декабря 2022 г.
Введение
В организме человека двуокись углерода образуется внутриклеточно как побочный продукт метаболизма. СО2 транспортируется кровотоком в легкие, где он в конечном итоге удаляется из организма с выдохом. CO2 играет различные роли в организме человека, включая регуляцию pH крови, дыхательную активность и сродство гемоглобина к кислороду (O2). Колебания уровня CO2 строго регулируются и могут вызывать нарушения в организме человека, если не поддерживать нормальный уровень.
Проблемы, вызывающие озабоченность
Задержка CO2 известна как гиперкапния или гиперкарбия. Гиперкапния часто вызывается гиповентиляцией или неспособностью удалить избыток CO2 и может быть диагностирована по газам артериальной или венозной крови. Повышение уровня СО2 в кровотоке может привести к респираторному ацидозу. Нормальный дыхательный драйв и, следовательно, выдыхание СО2 в основном поддерживаются рефлексом хеморецепторов. Рефлекс хеморецепторов важен для того, чтобы организм мог реагировать на изменения рО2, рСО2 и рН. Хеморецепторы можно разделить на периферические и центральные. Периферические хеморецепторы расположены в каротидных и аортальных телах. Каротидное тело является основным датчиком повышенного рСО2, пониженного рО2 и общего пониженного рН. Гломусные клетки каротидного тела передают изменения рН периферических артерий в центральную нервную систему через языкоглоточный нерв. [1]
Нормальный дыхательный драйв и, следовательно, выдыхание СО2 в основном поддерживаются рефлексом хеморецепторов. Рефлекс хеморецепторов важен для того, чтобы организм мог реагировать на изменения рО2, рСО2 и рН. Хеморецепторы можно разделить на периферические и центральные. Периферические хеморецепторы расположены в каротидных и аортальных телах. Каротидное тело является основным датчиком повышенного рСО2, пониженного рО2 и общего пониженного рН. Гломусные клетки каротидного тела передают изменения рН периферических артерий в центральную нервную систему через языкоглоточный нерв. [1]
Центральные хеморецепторы расположены вблизи вентролатеральных поверхностей продолговатого мозга. В то время как периферические хеморецепторы в первую очередь чувствительны к изменениям O2 и CO2, центральные хеморецепторы реагируют на изменения pCO2 и pH. Центральные хеморецепторы способны быстро обнаруживать изменения PCO2. Гематоэнцефалический барьер проницаем для СО2, что позволяет химически чувствительным клеткам в мозговом веществе реагировать на повышение уровня СО2 в крови и последующее снижение рН. Снижение рН спинномозговой жидкости в конечном итоге увеличивает минутную вентиляцию, определяемую произведением частоты дыхания на дыхательный объем. Интересно, что центральные хеморецепторы больше реагируют на гиперкапнический ацидоз, чем на изокапнический ацидоз, отчасти, вероятно, из-за непроницаемости гематоэнцефалического барьера для ионов H+. [2] В результате симпатический отток в сосудистую сеть увеличивается, и предпринимаются усилия для увеличения частоты дыхания.[3][4][5]
Снижение рН спинномозговой жидкости в конечном итоге увеличивает минутную вентиляцию, определяемую произведением частоты дыхания на дыхательный объем. Интересно, что центральные хеморецепторы больше реагируют на гиперкапнический ацидоз, чем на изокапнический ацидоз, отчасти, вероятно, из-за непроницаемости гематоэнцефалического барьера для ионов H+. [2] В результате симпатический отток в сосудистую сеть увеличивается, и предпринимаются усилия для увеличения частоты дыхания.[3][4][5]
Сотовый уровень
Клеточное дыхание преобразует поглощенные питательные вещества в виде глюкозы (C6h22O6) и кислорода в энергию в виде аденозинтрифосфата (АТФ). CO2 образуется как побочный продукт этой реакции.
О2, необходимый для клеточного дыхания, получают при вдыхании. Образовавшийся CO2 удаляется из организма с выдохом.
Вовлеченные системы органов
Вместе дыхательная и кровеносная системы играют заметную роль в регуляции CO2. В то время как дыхательная система отвечает за газообмен, система кровообращения отвечает за транспортировку крови и ее компонентов в ткани и из них. Газообмен происходит в легких и тканях. Во время вдоха воздух проходит в альвеолы, основное место газообмена в легких. На альвеолярно-капиллярной границе О2 свободно диффундирует в кровь, а СО2 диффундирует из крови в альвеолярные пространства. Напротив, газообмен в тканях приводит к диффузии СО2, образующегося при дыхании, из тканей в кровь, в то время как О2 удаляется из гемоглобина в эритроцитах для пополнения запасов кислорода в тканях. [6][7]
Газообмен происходит в легких и тканях. Во время вдоха воздух проходит в альвеолы, основное место газообмена в легких. На альвеолярно-капиллярной границе О2 свободно диффундирует в кровь, а СО2 диффундирует из крови в альвеолярные пространства. Напротив, газообмен в тканях приводит к диффузии СО2, образующегося при дыхании, из тканей в кровь, в то время как О2 удаляется из гемоглобина в эритроцитах для пополнения запасов кислорода в тканях. [6][7]
В долгосрочной перспективе респираторный ацидоз компенсируется задержкой бикарбонатов в почках, что повышает рН до нормальных значений.
Функция
CO2 является регулятором рН крови. В крови СО2 переносится в нескольких различных формах. Приблизительно 80–90 % растворяется в воде, 5–10 % растворяется в плазме и 5–10 % связывается с гемоглобином.
Сопутствующее тестирование
Анализ газов артериальной крови (ABG) необходим для оценки пациентов с подозрением на гиперкапнию. Гиперкапния определяется как PaCO2 выше 42 мм рт. Если PaCO2 больше 45 мм рт. ст., а PaO2 меньше 60 мм рт. ст., говорят о гиперкапнической дыхательной недостаточности.
Если PaCO2 больше 45 мм рт. ст., а PaO2 меньше 60 мм рт. ст., говорят о гиперкапнической дыхательной недостаточности.
Патофизиология
В кровотоке растворенный CO2 нейтрализуется бикарбонатно-углекислотной буферной системой, где он образует слабую углекислоту, угольную кислоту (h3CO3). h3CO3 может диссоциировать на ион водорода и ион бикарбоната. Эта буферная система позволяет организму поддерживать физиологический рН.[8][9][10][11]
Когда уровни CO2 высоки, происходит сдвиг вправо в упомянутой выше реакции. В результате повышается концентрация ионов Н+ в кровотоке, снижается рН и возникает состояние ацидоза. Напротив, при низком уровне СО2 в реакции происходит сдвиг влево, что приводит к алкалотическому состоянию.
Карбоангидраза катализирует превращение CO2 и воды в H+ и бикарбонат.
Карбоангидраза помогает поддерживать кислотно-щелочной баланс в кровотоке и присутствует в высоких концентрациях в эритроцитах. Когда уровень CO2 в крови начинает расти, организм может реагировать гипервентиляцией или гиповентиляцией соответственно.
CO2, связанный с гемоглобином, образует карбаминосоединение. В условиях, когда концентрации CO2 и H+ высоки, сродство гемоглобина к O2 снижается. Когда концентрация СО2 низкая, сродство гемоглобина к О2 увеличивается. Это известно как эффект Бора. Наоборот, если концентрация О2 высока, увеличивается выброс СО2 из тканей. Это известно как эффект Холдейна.
Клиническое значение
Необходимо тщательно собрать анамнез, чтобы понять любые факторы, которые могут ускорить появление признаков и симптомов гиперкапнии. У пациентов с гиперкапнией могут наблюдаться тахикардия, одышка, гиперемия кожи, спутанность сознания, головные боли и головокружение. Если гиперкапния развивается постепенно с течением времени, симптомы могут быть слабыми или могут отсутствовать совсем. Другие случаи гиперкапнии могут быть более тяжелыми и приводить к дыхательной недостаточности. В этих случаях могут наблюдаться такие симптомы, как судороги, отек диска зрительного нерва, депрессия и мышечные подергивания. Если у пациента с ХОБЛ проявляются признаки и симптомы гиперкапнии, следует немедленно обратиться за медицинской помощью до того, как уровень CO2 достигнет опасного для жизни уровня.[12][13]
Если у пациента с ХОБЛ проявляются признаки и симптомы гиперкапнии, следует немедленно обратиться за медицинской помощью до того, как уровень CO2 достигнет опасного для жизни уровня.[12][13]
Гиперкапнию следует лечить путем устранения ее основной причины. Неинвазивный аппарат ИВЛ с положительным давлением может оказать поддержку пациентам с неадекватным дыхательным приводом. Если неинвазивная вентиляция неэффективна, может быть показана интубация. Бронхолитики также могут быть использованы у пациентов, страдающих обструктивным заболеванием дыхательных путей.
В недавних исследованиях также была показана эффективность использования пищеводного баллона для лечения гиперкапнии у пациентов с острым респираторным дистресс-синдромом.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Wong-Riley MT, Liu Q, Gao XP.
 Взаимодействие периферических и центральных хеморецепторов и значение критического периода в развитии контроля дыхания. Респир Физиол Нейробиол. 2013 01 января; 185 (1): 156-69. [Бесплатная статья PMC: PMC3467325] [PubMed: 22684042]
Взаимодействие периферических и центральных хеморецепторов и значение критического периода в развитии контроля дыхания. Респир Физиол Нейробиол. 2013 01 января; 185 (1): 156-69. [Бесплатная статья PMC: PMC3467325] [PubMed: 22684042]- 2.
Патнэм Р.В., Филоса Дж.А., Ритуччи Н.А. Клеточные механизмы, участвующие в передаче сигналов CO (2) и кислоты в химиочувствительных нейронах. Am J Physiol Cell Physiol. 2004 г., декабрь; 287 (6): C1493-526. [PubMed: 15525685]
- 3.
Василеядис И., Алевракис Э., Ампелиоти С., Вагионас Д., Ровина Н., Куцуку А. Нарушения кислотно-щелочного баланса у пациентов с астмой: обзор литературы и комментарии к их патофизиологии. Дж. Клин Мед. 25 апреля 2019 г.; 8(4) [бесплатная статья PMC: PMC6518237] [PubMed: 31027265]
- 4.
Baillieul S, Revol B, Jullian-Desayes I, Joyeux-Faure M, Tamisier R, Pépin JL. Диагностика и лечение синдрома центрального апноэ сна. Эксперт Respir Med. 2019 июнь; 13 (6): 545-557.
 [PubMed: 31014146]
[PubMed: 31014146]- 5.
Bigatello L, Pesenti A. Физиология дыхания для анестезиолога. Анестезиология. 2019 июнь; 130 (6): 1064-1077. [PubMed: 30998510]
- 6.
де Карвалью М., Свош М., Пинто С. Диафрагмальная нейрофизиология и респираторные маркеры при БАС. Фронт Нейрол. 2019;10:143. [Бесплатная статья PMC: PMC6393326] [PubMed: 30846968]
- 7.
Eikermann M, Santer P, Ramachandran SK, Pandit J. Последние достижения в понимании и лечении послеоперационных респираторных заболеваний. F1000рез. 2019; 8 [Бесплатная статья PMC: PMC6381803] [PubMed: 30828433]
- 8.
Атайде RAB, Оливейра Филью JRB, Лоренци Филью Г, Джента PR. Синдром гиповентиляции ожирения: текущий обзор. J Брас Пневмол. 2018 ноябрь-декабрь;44(6):510-518. [Бесплатная статья PMC: PMC6459748] [PubMed: 30726328]
- 9.
Comellini V, Pacilli AMG, Nava S. Преимущества неинвазивной вентиляции при острой гиперкапнической дыхательной недостаточности.
 Респирология. 2019 апр; 24(4):308-317. [PubMed: 30636373]
Респирология. 2019 апр; 24(4):308-317. [PubMed: 30636373]- 10.
Frat JP, Coudroy R, Thille AW. Неинвазивная вентиляция легких или высокопоточная оксигенотерапия: когда лучше выбрать одно, а какое другое? Респирология. 2019 августа; 24 (8): 724-731. [PubMed: 30406954]
- 11.
Thille AW, Frat JP. Неинвазивная вентиляция как неотложная терапия. Curr Opin Crit Care. 2018 дек;24(6):519-524. [PubMed: 30299309]
- 12.
Berbenetz N, Wang Y, Brown J, Godfrey C, Ahmad M, Vital FM, Lambiase P, Banerjee A, Bahhai A, Chong M. Неинвазивная вентиляция с положительным давлением ( CPAP или bilevel NPPV) при кардиогенном отеке легких. Cochrane Database Syst Rev. 2019 Apr 05;4(4):CD005351. [Бесплатная статья PMC: PMC6449889] [PubMed: 30950507]
- 13.
Диас Милиан Р., Фоли Э., Бауэр М., Мартинес-Велес А., Кастресана М.Р. Экспираторный коллапс центральных дыхательных путей у взрослых: последствия анестезии (часть 1).


 Проверка своих первоначальных
предположений. Расстановка новых значков.
Проверка своих первоначальных
предположений. Расстановка новых значков. Откройте зажим
Откройте зажим
 Взаимодействие периферических и центральных хеморецепторов и значение критического периода в развитии контроля дыхания. Респир Физиол Нейробиол. 2013 01 января; 185 (1): 156-69. [Бесплатная статья PMC: PMC3467325] [PubMed: 22684042]
Взаимодействие периферических и центральных хеморецепторов и значение критического периода в развитии контроля дыхания. Респир Физиол Нейробиол. 2013 01 января; 185 (1): 156-69. [Бесплатная статья PMC: PMC3467325] [PubMed: 22684042]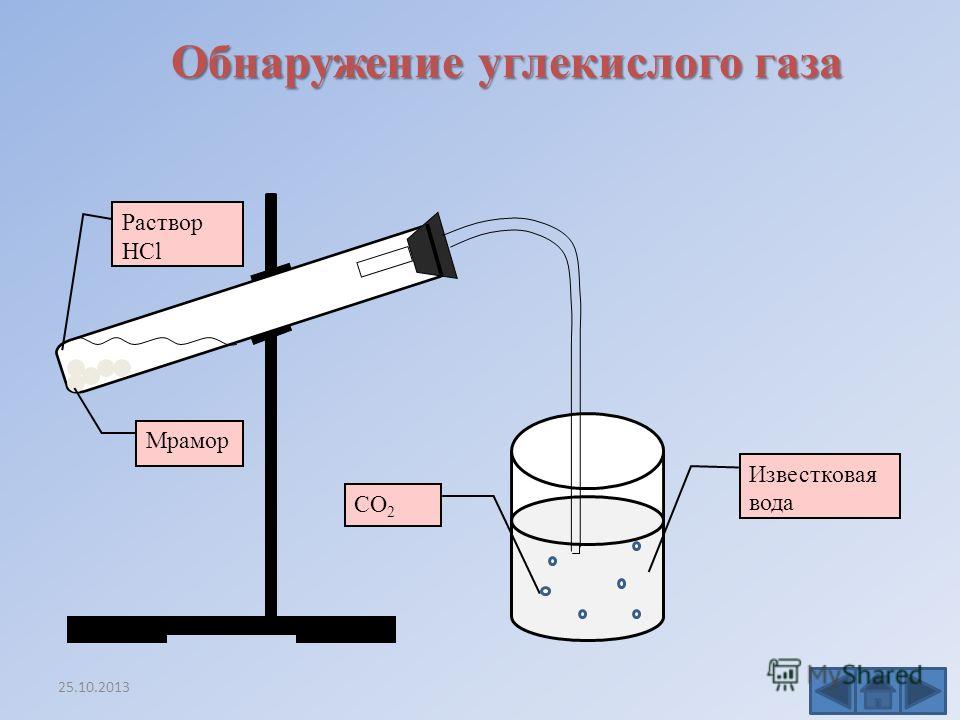 [PubMed: 31014146]
[PubMed: 31014146] Респирология. 2019 апр; 24(4):308-317. [PubMed: 30636373]
Респирология. 2019 апр; 24(4):308-317. [PubMed: 30636373]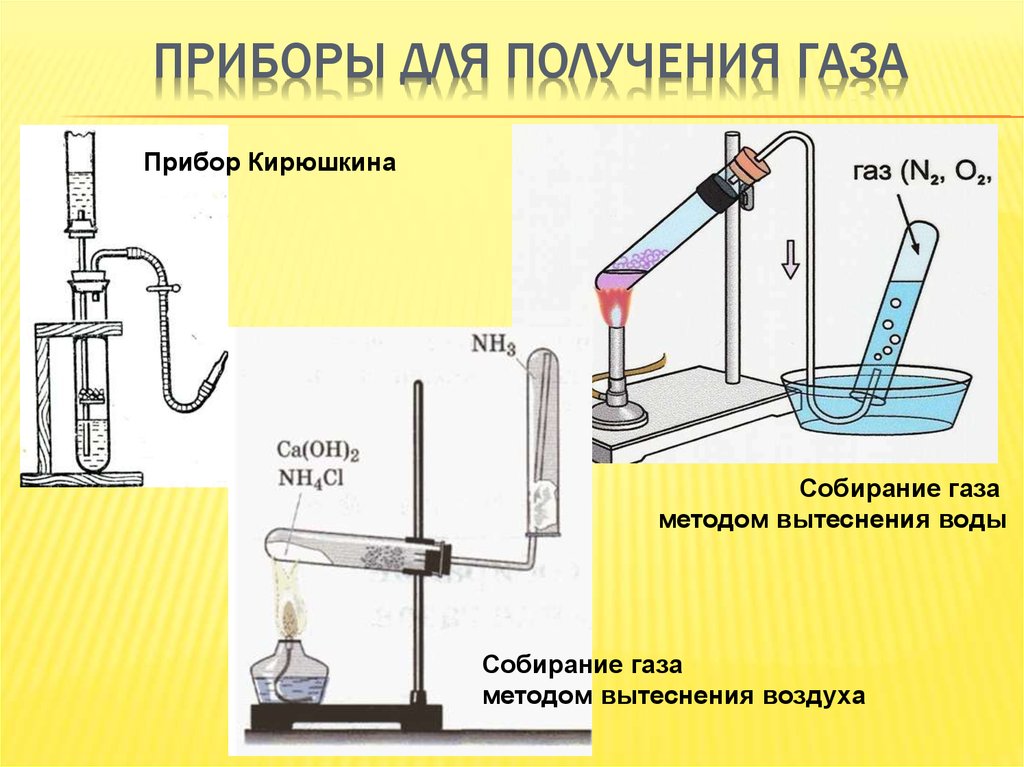
Leave A Comment