химическое строение, горение. Реакция полимеризации
Химическим строением называют последовательность соединения атомов в молекуле и их расположение в пространстве. Химическое строение изображают с помощью структурных формул. Черточка изображает ковалентную химическую связь. Если связь кратная: двойная, тройная, — то ставят две (не путать со знаком «равно») или три черточки. Углы между связями изображают по возможности.
Чтобы правильно составлять структурные формулы органических веществ, нужно помнить, что атомы углерода образуют по 4 связи
(т. е. валентность углерода по числу связей равна четырем. В органической химии преимущественно используется именно валентность по числу связей).
Метан (его также называют болотный, рудничный газ) состоит из одного атома углерода, связанного ковалентными связями с четырьмя атомами водорода. Молекулярная формула CH4. Структурная формула:
H
l
H – C – H
l
H
Угол между связями в молекуле метана составляет около 109° — электронные пары, образующие ковалентные связи атома углерода (в центре) с атомами водорода, располагаются в пространстве на максимальном удалении друг от друга.
В 10–11 классах изучается, что молекула метана имеет форму треугольной пирамиды — тетраэдра, подобно знаменитым египетским пирамидам.
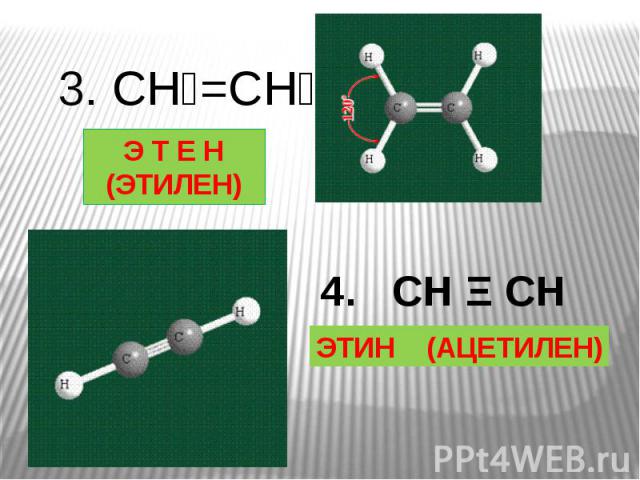
Этилен C2H4 содержит два атома углерода, соединенных двойной связью:
Угол между связями составляет 120° (электронные пары отталкиваются и располагаются на максимальном расстоянии друг от друга). Атомы располагаются в одной плоскости.
Если не изображать отдельно каждый атом водорода, то получаем сокращенную структурную формулу:
CH2 = CH2
Ацетилен C2H2 содержит тройную связь:
H – C ≡ C – H
Угол между связями 180°, молекула имеет линейную форму.
При горении углеводородов образуются оксиды углерода (IV) и водорода, т. е. углекислый газ и вода, при этом выделяется много тепла:
CH4 + 2O2 → CO2 + 2H2O
C2H4 + 3O2 → 2CO2 + 2H2O
2C2H2 + 5O2 → 4CO2 + 2H2O (в уравнении с ацетиленом перед формулой ацетилена ставим коэффициент 2, чтобы число атомов кислорода в правой части было чётным)
Большое практическое значение имеет реакция полимеризации этилена — соединение большого числа молекул с образованием макромолекул полимера — полиэтилена. Связи между молекулами образуются за счет разрыва одной из связей двойной связи. В общем виде это можно записать так:
Связи между молекулами образуются за счет разрыва одной из связей двойной связи. В общем виде это можно записать так:
nCH2 = CH2 → (- CH2 – CH2 -)n
где n — число соединившихся молекул, называемое степенью полимеризации. Реакция происходит при повышенном давлении и температуре, в присутствии катализатора.
Из полиэтилена изготавливают пленку для парников, покрышки для банок и пр.
Образование бензола из ацетилена тоже относят к реакциям полимеризации:
3C2H2 → C6H6
автор: Владимир Соколов
2) Реакции замещения
Ацетиленовые атомы
водорода легко замещаются, поскольку
являются подвижными (кислыми). При
взаимодействии ацетилена с аммиачным
раствором оксида серебра или меди
выпадает осадок нерастворимых ацетиленидов
серебра AgCCAg
(белый цвет) или меди CuCCCu
(вишнево-бурый цвет). Эти ацетилениды
взрывчаты. Нижеприведенная реакция
является качественной на ацетилен.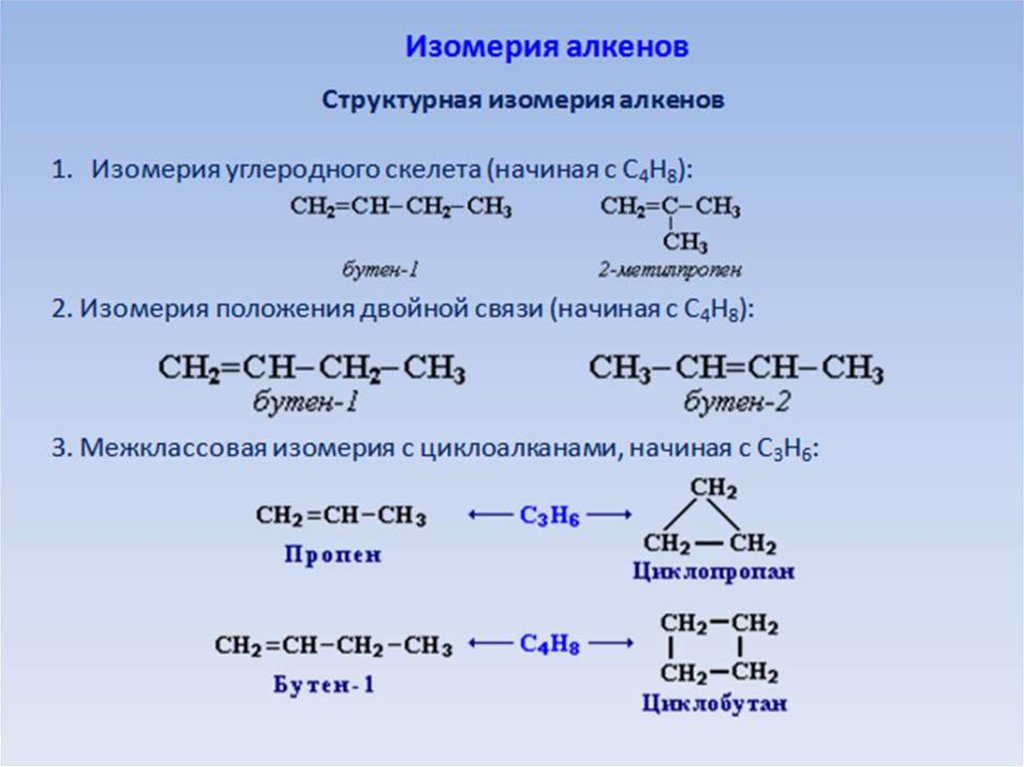
Раствор металлического натрия в жидком аммиаке также замещает подвижные атомы водорода в ацетилене.
3) Реакции полимеризации
Исключительно важны реакции полимеризации ацетилена. Под действием различных катализаторов эти реакции идут с образованием разных продуктов.
а) При нагревании в присутствии активированного угля (Н.Д. Зелинский) или в присутствии Ni(CO)4, [(C6H5)3 P]2 ацетилен образует бензол (В. Peппe) :
б) Под действием комплексных солей меди происходит линейная полимеризация с образованием винилацетилена (I) и дивинилацетилена (2).
в) при действии на ацетилен комплексным соединением никеля образуются циклические соединения с большим числом углеродных атомов, чем в бензоле (B. Peппe):
Все эти процессы
имеют практическое значение.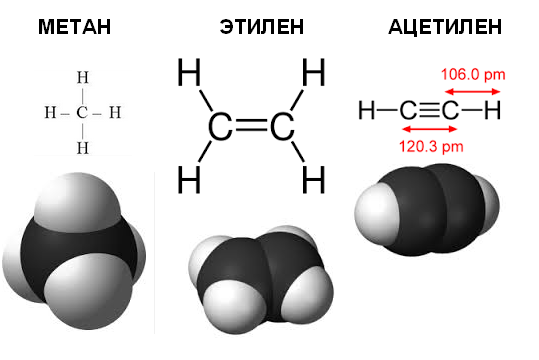
4) Реакции конденсации
Ацетилен и его монозамещенные в присутствии щелочей присоединяются к карбонильной группе кетонов с образованием ацетиленовых спиртов (А.Е. Фаворский). Реакцию конденсации ацетилена с ацетоном проводят в абсолютном эфире в присутствии сухого KOH:
Широко применяется реакция ацетилена с формальдегидом в водном растворе в присутствии ацетиленида меди под давлением (В. Реппе):
5) Реакция окисления
Ацетиленовые углеводороды горят и подвержены действию окислителей. Раствор KMnO4 обесцвечивается при прохождении через него ацетилена. Эта реакция является качественной на СС связь.
4. Экологические аспекты химии алкинов
Антропогенными
источниками поступления в окружающую
средy
алкинов являются предприятия, использующие
их в качестве сырья. Важнейшим
из алкинов является ацетилен.
Его мировое производство достигает 6
млн т/год.
В организм алкины поступают через легкие, наркотическое действие их нарастает с увеличением молекулярной массы соединения. Длительные контакты с ацетиленом в производственных условиях вызывают функциональные нарушения нервной системы. Его высокие концентрации при небольшом содержании кислорода приводят к потере сознания и отеку легких.
5. Вопросы и задачи по теме «алкины»
1) Напишите структурные формулы ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов и назовите их.
2) Напишите
структурные формулы всех ацетиленовых
углеводородов, образующих при гидрировании
2-метилпентана. Назовите их.
Назовите их.
3) Назовите по систематической номенклатуре следующее соединение:
4) Перекрыванием каких орбиталей образуются и — связи в ацетилене?
Напишите, с помощью каких реактивов и в каких условиях можно осуществить следующие превращения:
а) пентена-1 в пропилацетилен;
б) 3-метилбутена-1 в 3-метилбутин-1;
в) бутина-1 в бутин-2;
г) гексена-1 в бутилацетилен;
д) 3,3–диметилбутанола-1 в трет-бутилацетилен.
6) Какие соединения образуются в следующей цепи превращений:
Назовите продукты превращений.
7) В каких условиях и какими способами можно осуществить следующие превращения:
8) Напишите структурные формулы карбоновых кислот, образующихся при окислении хромовой смесью ацетиленовых углеводородов:
9) Какие соединения можно получить при димеризации, тримеризации, тетрамеризации ацетилена?
10) При помощи каких реакций можно симметричный диметилэтилен через стадию образования ацетиленового углеводорода превратить в метилэтилкетон?
Какой реагент пригоден для того, чтобы отличить этилен от ацетилена (КМnО4 водн.

Напишите реакции:
13) Напишите формулы строения промежуточных и конечных продуктов в следующих схемах:
14) Углеводород состава С5Н8 обесцвечивает бромную воду и водный раствор перманганата калия, окисляется с образованием уксусной и пропионовой кислот. Напишите его структурную формулу.
Разница между ацетиленом и этиленом
Ключевая разница — ацетилен против этиленаКлючевое различие между ацетиленом и этиленом заключается в том, что ацетилен имеет тройную связь между двумя атомами углерода, тогда как этилен имеет двойную связь между двумя атомы углерода .
Названия ацетилен и этилен звучат одинаково, но это разные углеводородные соединения. Тем не менее, они также имеют некоторые сходства. В этой статье описаны как сходства, так и различия между ацетиленом и этиленом.
В этой статье описаны как сходства, так и различия между ацетиленом и этиленом.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое ацетилен
3. Что такое этилен
4. Сходство между ацетиленом и этиленом
5. Сравнение бок о бок – ацетилен и этилен в табличной форме
6. Резюме
Что такое ацетилен?
Ацетилен представляет собой органическое соединение, имеющее химическую формулу C 2 H 2 . Кроме того, это самый простой алкин среди углеводородов. Алкин представляет собой соединение, имеющее тройную связь между двумя атомами углерода. Следовательно, ацетилен имеет тройную связь между двумя имеющимися у него атомами углерода. Между этими атомами углерода имеется две пи-связи и одна сигма-связь. Молекула имеет линейную геометрию, потому что один атом углерода может образовывать только четыре ковалентные связи (ацетилен имеет тройную связь и одинарную связь С-Н, что делает молекулу линейной).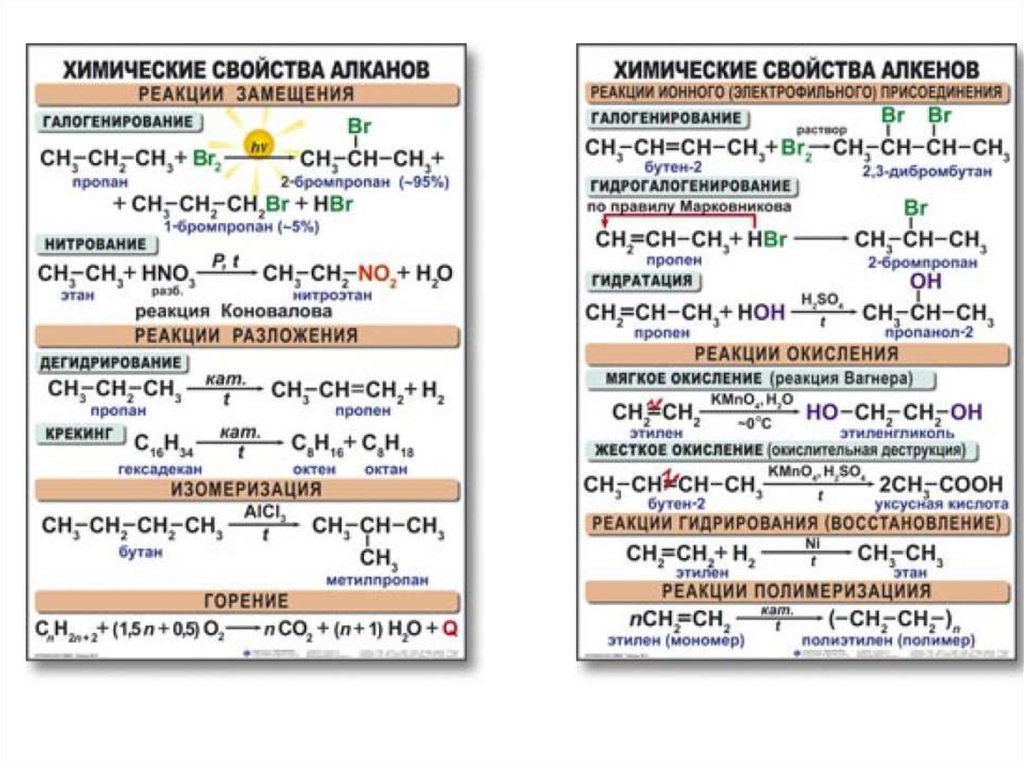 Следовательно, атомы углерода молекулы ацетилена находятся в состоянии sp-гибридизации.
Следовательно, атомы углерода молекулы ацетилена находятся в состоянии sp-гибридизации.
Химические свойства ацетилена
Вот некоторые химические факты об ацетилене:
- Химическая формула = C 2 H 2
- Молярная масса = 26,04 г/моль
- Физическое состояние при комнатной температуре = бесцветный газ
- Запах = без запаха
- Температура плавления = -80,8°C
- Температура кипения = -84°C
- Растворимость в воде = слабо растворим
- Название ИЮПАК = Этин
Кроме того, ацетилен не существует в виде жидкости при атмосферном давлении. Таким образом, он не имеет фактической точки плавления. Приведенная выше температура плавления на самом деле является тройной точкой ацетилена. Поэтому твердая форма ацетилена подвергается сублимации, а не плавлению. Там твердый ацетилен превращается в пар.
Рисунок 01: Использование кислородно-ацетиленового пламени
Ацетилен в основном применяется в сварочных процессах.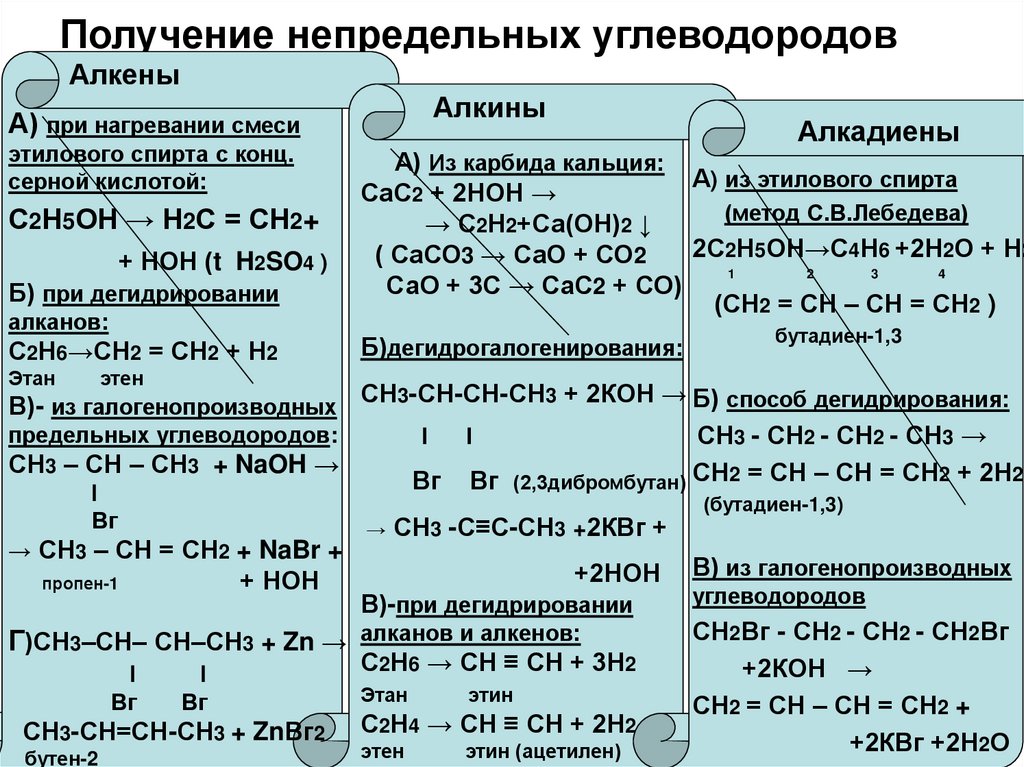 Кислородно-ацетиленовое пламя представляет собой высокотемпературное пламя, которое важно при сварке и резке. Мы можем получить это пламя при сгорании ацетилена с кислородом.
Кислородно-ацетиленовое пламя представляет собой высокотемпературное пламя, которое важно при сварке и резке. Мы можем получить это пламя при сгорании ацетилена с кислородом.
Что такое этилен?
Этилен представляет собой органическое соединение, имеющее химическую формулу C 2 H 4 . Два атома углерода связаны друг с другом двойной связью (пи-связь и сигма-связь). Следовательно, молекула этилена имеет два sp2-гибридизированных атома углерода. Поскольку атом углерода способен образовывать четыре химические связи, с каждым атомом углерода одинарными связями связаны два атома водорода. Тогда молекула этилена имеет плоскую структуру.
Рисунок 02: Химическая структура этилена
Вот некоторые химические факты об этилене:
- Химическая формула = C 2 H 4
- Молярная масса = 28,05 г/моль
- Физическое состояние при комнатной температуре = бесцветный легковоспламеняющийся газ
- Запах = сладкий запах
- Температура плавления = -169,2°C
- Температура кипения = −103,7°C
- Растворимость в воде = слабо растворим
- Название ИЮПАК = Этен
Основным источником этилена является сырая нефть и природный газ. Для производства этилена из этих источников используются три основных процесса. Они есть;
Для производства этилена из этих источников используются три основных процесса. Они есть;
- Паровой крекинг этана и пропана
- Паровой крекинг нафты
- Каталитический крекинг газойля
Этилен имеет важные применения в качестве мономеров для производства полимеров, таких как полиэтилен, путем аддитивной полимеризации. Полиэтилен – распространенный упаковочный материал. Кроме того, в биологических системах этилен важен как растительный гормон, поскольку он стимулирует процесс созревания плодов.
В чем сходство ацетилена и этилена?
- Оба являются небольшими углеводородами.
- Ацетилен и этилен состоят только из атомов углерода и атомов водорода.
- Оба бесцветные газы.
- И ацетилен, и этилен являются легковоспламеняющимися газами.
- Ацетилен и Этилен представляют собой плоские структуры.
В чем разница между ацетиленом и этиленом?
Ацетилен против этилена | |
Ацетилен представляет собой органическое соединение, имеющее химическую формулу C 2 H 2 .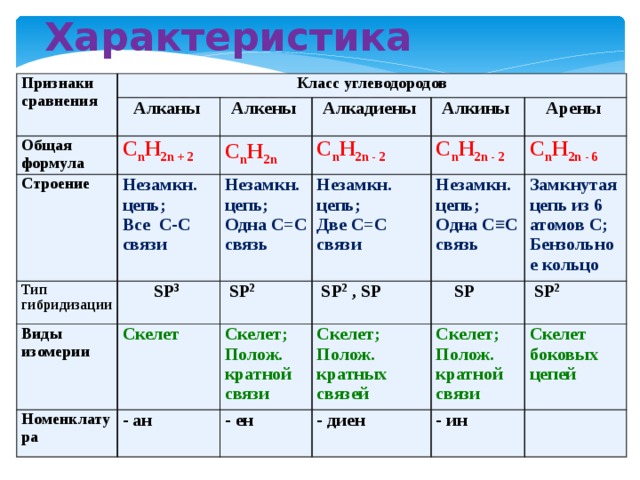 | Этилен представляет собой органическое соединение, имеющее химическую формулу C 2 H 4 . |
| Число атомов водорода | |
| Ацетилен имеет два атома водорода в одной молекуле ацетилена. | Этилен имеет четыре атома водорода в одной молекуле этилена. |
| Молярная масса | |
| Молярная масса ацетилена 26,04 г/моль. | Молярная масса этилена 28,05 г/моль. |
| Химическая связка | |
| Ацетилен имеет тройную связь между двумя атомами углерода и две одинарные связи C-H. | Этилен имеет двойную связь между двумя атомами углерода и четырьмя одинарными связями C-H. |
| Гибридизация атомов углерода | |
| Атомы углерода молекулы ацетилена находятся в состоянии sp-гибридизации. | Атомы углерода молекулы этилена находятся в состоянии sp2-гибридизации.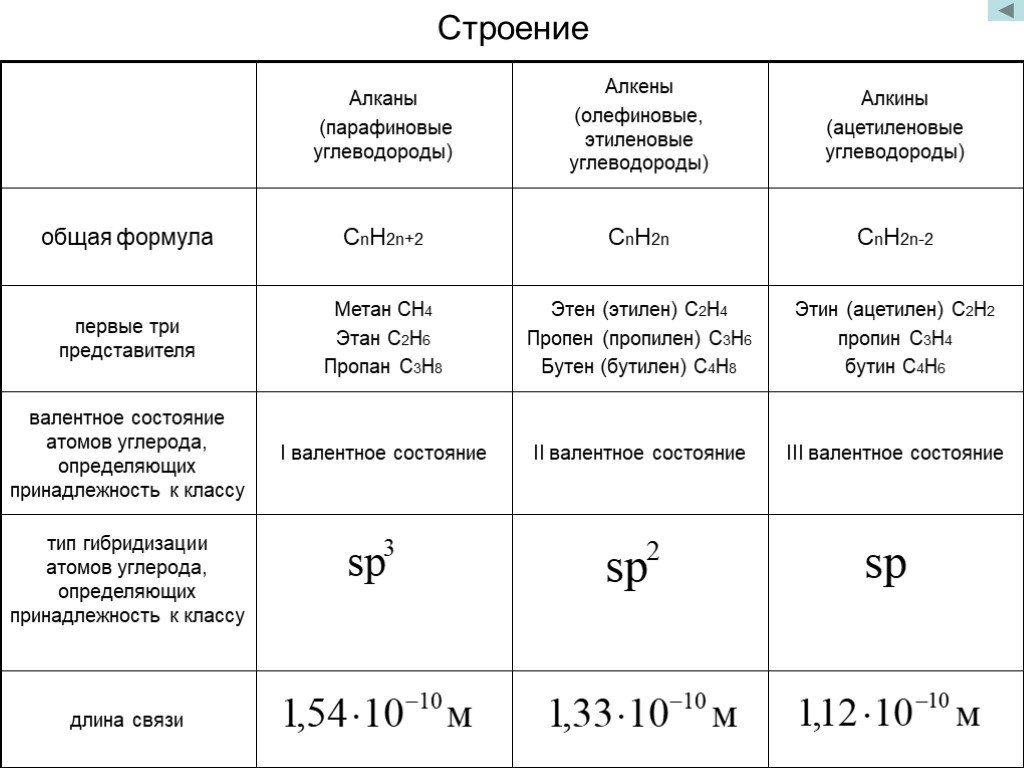 |
Резюме –
Ацетилен против ЭтиленАцетилен и этилен являются очень важными углеводородными соединениями из-за их широкого спектра применения. Разница между ацетиленом и этиленом заключается в том, что ацетилен имеет тройную связь между двумя атомами углерода, тогда как этилен имеет двойную связь между двумя атомами углерода.
Артикул:
1. «Ацетилен». Википедия, Фонд Викимедиа, 14 апреля 2018 г. Доступно здесь
2. «Этилен». Википедия, Фонд Викимедиа, 18 апреля 2018 г. Доступно здесь
3. «Ацетилен». Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США. Доступно здесь
Изображение предоставлено:
1. «ВМС США 070413-N-2943C-001 Техник по корпусу пожарный Трой Хеффнер зажигает кислородно-ацетиловую горелку перед сварочными работами в ремонтной мастерской». Фото ВМС США, предоставленное Mass Communication. Специалист Карлос Сепеда (общественное достояние) через Commons Wikimedia
2. ’Ethylene-3D-balls’By Benjah-bmm27 – собственная работа, (общественное достояние) через Commons Wikimedia
’Ethylene-3D-balls’By Benjah-bmm27 – собственная работа, (общественное достояние) через Commons Wikimedia
Разница между этиленом и ацетиленом с. Они сильно различаются по своим химическим и физическим свойствам. Этилен можно найти в природе в сырой нефти и природном газе; он также содержится в растениях как растительный гормон, вызывающий созревание плодов. Ацетилен является алкином. Это линейная молекула, легко воспламеняющаяся. Поэтому его используют в качестве топлива. Ацетилен в основном производится в процессах термического крекинга на нефтеперерабатывающих заводах. Основное различие между этиленом и ацетиленом состоит в том, что
Этилен является алкеном, тогда как ацетилен является алкином.Ключевые области применения
1. Что такое этилен
– определение, химические свойства, производство, применение
2. Что такое ацетилен 9000 6 – определение, химические свойства, производство
3. Сходства Между этиленом и ацетиленом
Сходства Между этиленом и ацетиленом
– Общие черты
4. В чем разница между этиленом и ацетиленом
– Сравнение основных различий
Ключевые термины: ацетилен, каталитический крекинг, сырая нефть, этан, этилен, этин, природный газ, термический крекинг
Что такое этилен
Этилен — простейший алкен, имеющий химическая формула H 2 C=CH 2 . В нем два атома углерода связаны друг с другом двойной связью. Это бесцветный легковоспламеняющийся газ. Название этилена по классификации ИЮПАК: , этан . Молярная масса этого соединения составляет 28,05 г/моль. Его температура плавления составляет -169.0,2 °С, а температура кипения -103,7 °С.
Рис. 1: Шарико-стержневая модель этилена. Черный – атомы углерода, Белый – атомы водорода
Этилен имеет сладкий вкус и запах. Природными источниками этилена являются сырая нефть и природный газ. Этилен используется для получения важных соединений, таких как полимеры; полимеры, полученные полимеризацией этилена, включают поли(этилен), поли(хлорэтен) и поли(фенилэтен). Другие химические вещества, получаемые из этилена, включают этанол и эпоксиэтан.
Этилен используется для получения важных соединений, таких как полимеры; полимеры, полученные полимеризацией этилена, включают поли(этилен), поли(хлорэтен) и поли(фенилэтен). Другие химические вещества, получаемые из этилена, включают этанол и эпоксиэтан.
Этилен имеет два атома углерода, которые находятся в состоянии sp 2 гибридизации. Атомы углерода связаны сигма-связью и пи-связью. Каждый атом углерода связан с 2 атомами водорода. Это плоская молекула. Геометрия вокруг одного атома углерода тригонально-плоская. Пи-связь отвечает за реакционную способность молекулы этилена.
Производственный процесс
Этилен получают в результате реакций крекинга. Фракции, полученные в результате перегонки природного газа и сырой нефти, подвергают следующим трем основным реакциям крекинга.
- Паровой крекинг этана и пропана из природного газа и сырой нефти
- Паровой крекинг лигроина из сырой нефти
- Каталитический крекинг газойля из сырой нефти
Использование этилена
В основном этилен используется в качестве мономера для производства полимеров. Полиэтилен, который используется для упаковки, является одним из наиболее широко используемых продуктов этилена. Этилен также используется для производства оксида этилена, который является основным сырьем для производства поверхностно-активных веществ. Кроме того, этилен важен как растительный гормон. Он регулирует созревание плодов, раскрытие цветков и т. д.
Полиэтилен, который используется для упаковки, является одним из наиболее широко используемых продуктов этилена. Этилен также используется для производства оксида этилена, который является основным сырьем для производства поверхностно-активных веществ. Кроме того, этилен важен как растительный гормон. Он регулирует созревание плодов, раскрытие цветков и т. д.
Что такое ацетилен
Ацетилен — простейший алкин, имеющий химическую формулу C 2 H 2 . Он содержит два атома углерода, связанные друг с другом тройной связью. Между атомами углерода имеется две пи-связи и одна сигма-связь. Каждый атом углерода связан с атомом водорода одинарной связью. Молекула плоская, а геометрия вокруг одного атома углерода линейная.
Рис. 2. Шарико-стержневая модель для ацетилена. Черный – атомы углерода, белый – атомы водорода
Молярная масса ацетилена 26,04 г/моль. Его название ИЮПАК — этин . Это бесцветный горючий газ. Поэтому он широко используется в качестве газа. Однако он не имеет запаха (в отличие от этилена). Температура плавления ацетилена составляет -80,8 °С, а температура кипения составляет -84 °С.
Поэтому он широко используется в качестве газа. Однако он не имеет запаха (в отличие от этилена). Температура плавления ацетилена составляет -80,8 °С, а температура кипения составляет -84 °С.
При атмосферном давлении ацетилен не может существовать в виде жидкости. Следовательно, у него фактически нет точки плавления. Следовательно, тройная точка ацетилена считается точкой его плавления. Тройная точка вещества – это температура, при которой все три фазы вещества находятся в термодинамическом равновесии. При температурах ниже тройной точки твердый ацетилен может подвергаться сублимации, при которой твердый ацетилен непосредственно превращается в паровую фазу.
Производство ацетилена
Самый простой процесс производства ацетилена — это реакция карбида кальция с водой. Получается газообразный ацетилен и шлам карбоната кальция (гашеная известь). В промышленных нуждах используют два основных способа получения ацетилена.
- Процесс химической реакции, который проводится при комнатной температуре
- Процесс термического крекинга, происходящий при чрезвычайно высоких температурах
Процесс химической реакции представляет собой производство ацетилена из карбида кальция, как указано выше. Процесс термического крекинга представляет собой метод, который включает растрескивание или разрыв связей и повторное связывание для получения нового соединения.
Процесс термического крекинга представляет собой метод, который включает растрескивание или разрыв связей и повторное связывание для получения нового соединения.
Сходства между этиленом и ацетиленом
- Оба являются углеводородными соединениями.
- Оба являются бесцветными газами при комнатной температуре.
- Оба легко воспламеняются.
- Оба состоят из связей C-H.
- Оба являются ненасыщенными соединениями.
- Оба являются плоскими структурами.
Разница между этиленом и ацетиленом
Определение
Этилен: Этилен является простейшим алкеном, имеющим химическую формулу H 2 С=СН 2 .
Ацетилен: Ацетилен — простейший алкин, имеющий химическую формулу C 2 H 2 .
Категория
Этилен: Этилен представляет собой алкен.
Ацетилен: Ацетилен представляет собой алкин.
Химическая связь между атомами углерода
Этилен: В этилене имеется двойная связь между двумя атомами углерода.
Ацетилен: В ацетилене имеется тройная связь между двумя атомами углерода.
Молярная масса
Этилен: Молярная масса этилена составляет 28,05 г/моль.
Ацетилен: Молярная масса ацетилена 26,04 г/моль.
Наименование ИЮПАК
Этилен: Название этилена по ИЮПАК — этан.
Ацетилен: ИЮПАК название ацетилена — этин.
Температура плавления и температура кипения
Этилен: Температура плавления этилена составляет -169,2 °C, а температура кипения составляет -103,7 °C.
Ацетилен: Температура плавления ацетилена составляет -80,8 °C, а температура кипения составляет -84 °C.
Запах
Этилен: Этилен имеет сладкий запах.


Leave A Comment