Из-за испарения уровень воды в цилиндрическом стакане понижается со скоростью 1,2 дюйма в неделю . Выразительные эту скорость в мм/ч . Определите через какое время из стакана искрится вода , если изначально в нём было налить 2 вершка воды.
Последние вопросы
Другие предметы
4 минуты назад
Кубановеденье 8 классМатематика
4 минуты назад
5. Не виконуючи побудови, знайдіть координати точок пе ретину з осями координат графіка функції у=3|x|-6.Математика
4 минуты назад
Розв’язати графічно рівняння х2 – 5х +1 = 0Русский язык
4 минуты назад
окно стоит или висит?4 минуты назад
Предпринимательство: понятие, сущность, основные виды и организационные формы. Выбор и реализация бизнес-идей для начинающих
Выбор и реализация бизнес-идей для начинающихГеометрия
9 минут назад
Нужно сделать чертёж!!!!!!!!Алгебра
9 минут назад
При каких значениях а значения трехчлена ах2-2х+4 неотрицательны ни для какого х? История
9 минут назад
В связи с чем возникла необходимость принятия страдает «Казахстан-2030»?История
14 минут назад
1. Назвiть наслідки війни для США, Великої Британії, Франції.
История
14 минут назад
2.Дайте характеристику добi «проспериті» в США.История
14 минут назад
3.Охарактеризуйте президенство В.Гардинга.Алгебра
14 минут назад
Самостійна робота Мережа кондитерських до річниці свого відкриття да- рувала відвідувачам набори солодощів торгових марок «Добре», «Солодко» та «Смачно». Наприкінці святкування з’ясувалося, що наборів «Солодко» було подаровано на 12 більше, ніж набо- рів «Добре», а наборів «Смачно» на 31 більше, ніж «Солодко». По скільки наборів кожної марки було подаровано, якщо від- відувачів було 430 і кожен з них отримав по одному набору?История
14 минут назад
4. Охарактеризуйте особливості президенства К.Куліджа.
Охарактеризуйте особливості президенства К.Куліджа.14 минут назад
Яка мораль байки вовк і кітИстория
14 минут назад
7.Назвіть основні політичні сили Великої Британії у повоєнний період. Охарактеризуйте ïхню ідеологію.
Все предметы
Выберите язык и регион
English
United States
Polski
Polska
Português
Brasil
India
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
Насыщенный и ненасыщенный пар — определение, свойства, формулы
Покажем, как применять знание физики в жизни
Начать учиться
Оказывается, у насыщенного пара и бизнес-центра много общего, а чтобы вскипятить чайник при температуре меньше 100°C, нужно забраться на Эльбрус.
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.

На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Пятерка по физике у тебя в кармане!
Решай домашку по физике на изи. Подробные решения помогут разобраться в сложной теме и получить пятерку!
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости.
 Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
|
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
Испарение | Кипение |
|---|---|
|
|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
t, °C | Вещество |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 | водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. |
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.

Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.

В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.

Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Карина Хачатурян
К предыдущей статье
Закон Паскаля
К следующей статье
108.6K
Архимедова сила
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
В: В чем разница между испарением и кипением?
Наука 101
Наука и дети — февраль 2020 г. (Том 57, Выпуск 6)
(Том 57, Выпуск 6)
Мэтт Бобровски
А: В дополнение к статье о конденсации, опубликованной в прошлом месяце, мы обсудим испарение (противоположное конденсации) и тесно связанное с ним явление кипения. И испарение, и кипение связаны с превращением жидкости в газ, но между ними есть ряд различий.
РАЗЛИЧИЯ ИСПАРЕНИЯ И КИПЕНИЯ
Скорость: Испарение — более медленный процесс, а кипение — более быстрое. Попробуйте следующее: за несколько недель до урока о круговороте воды (включая испарение и конденсацию) поставьте на полку высокий стакан с водой и предложите учащимся измерять высоту воды каждые несколько дней и ведите таблицу, показывающую изменение уровня (рис. 1). Если студенты еще не знают, что произойдет, не говорите им; пусть обнаружат. Они также могут отображать высоту воды с течением времени. Затем, когда вы будете готовы говорить об испарении, спросите: «Что случилось с водой, которая была в стакане? Куда оно делось? (Это исследование также можно провести, когда учащиеся считывают количество воды, оставшейся в градуированном цилиндре, но вы можете предпочесть, чтобы учащиеся попрактиковались в измерении с помощью линейки.) Напротив, вы можете вскипятить воду на плите и наблюдать, как уровень ниже за считанные минуты, а не дни и недели, которые требуются для испарения воды.
Они также могут отображать высоту воды с течением времени. Затем, когда вы будете готовы говорить об испарении, спросите: «Что случилось с водой, которая была в стакане? Куда оно делось? (Это исследование также можно провести, когда учащиеся считывают количество воды, оставшейся в градуированном цилиндре, но вы можете предпочесть, чтобы учащиеся попрактиковались в измерении с помощью линейки.) Напротив, вы можете вскипятить воду на плите и наблюдать, как уровень ниже за считанные минуты, а не дни и недели, которые требуются для испарения воды.
Требуемая температура: Жидкость испаряется при температуре выше точки замерзания. В предыдущем примере вода была комнатной температуры и медленно испарялась. Если бы вода была теплее, она испарялась бы быстрее. Напротив, кипение происходит только тогда, когда жидкость достигает определенной температуры, которую мы называем точкой кипения. Температура кипения воды на уровне моря составляет 100°C (212°F).
Пузырьки: При испарении не образуются пузырьки. Когда жидкость испаряется, отдельные молекулы покидают жидкость и становятся частью воздуха. На рисунке 2 точки представляют молекулы. Те, что покидают жидкость и становятся частью газа (воздуха), испаряются. Те, которые переходят из газа в жидкость, конденсируются. Когда вода в вашем стакане испарялась, молекулы должны были перемещаться из воды в воздух чаще, чем молекулы из воздуха в воду. Таким образом, имел место чистый перенос молекул воды из жидкости в стакане в воздух. Как видно из рисунка 2, в этом процессе пузырьков нет. Напротив, когда вы кипятите воду, жидкость превращается в газ так быстро, что образуются пузырьки водяного пара. Вот вопрос для учащихся: когда вы кипятите воду и видите пузырьки, есть ли что-нибудь в пузырьках? Если да, то из чего сделаны пузыри? Некоторые ученики могут подумать, что это пузырьки воздуха. Но теперь вы понимаете, что это не пузырьки воздуха; это пузырьки водяного пара — вода, которая превратилась из жидкости в газ. Есть ли простой способ продемонстрировать, что пузырьки содержат молекулы воды? Да! Доведите кастрюлю с водой до кипения.
Когда жидкость испаряется, отдельные молекулы покидают жидкость и становятся частью воздуха. На рисунке 2 точки представляют молекулы. Те, что покидают жидкость и становятся частью газа (воздуха), испаряются. Те, которые переходят из газа в жидкость, конденсируются. Когда вода в вашем стакане испарялась, молекулы должны были перемещаться из воды в воздух чаще, чем молекулы из воздуха в воду. Таким образом, имел место чистый перенос молекул воды из жидкости в стакане в воздух. Как видно из рисунка 2, в этом процессе пузырьков нет. Напротив, когда вы кипятите воду, жидкость превращается в газ так быстро, что образуются пузырьки водяного пара. Вот вопрос для учащихся: когда вы кипятите воду и видите пузырьки, есть ли что-нибудь в пузырьках? Если да, то из чего сделаны пузыри? Некоторые ученики могут подумать, что это пузырьки воздуха. Но теперь вы понимаете, что это не пузырьки воздуха; это пузырьки водяного пара — вода, которая превратилась из жидкости в газ. Есть ли простой способ продемонстрировать, что пузырьки содержат молекулы воды? Да! Доведите кастрюлю с водой до кипения. Накройте его крышкой примерно на 20 секунд, а затем снимите крышку и осмотрите ее изнутри. Он покрыт каплями воды из тех пузырьков, которые сконденсировались на крышке кулера (рис. 3).
Накройте его крышкой примерно на 20 секунд, а затем снимите крышку и осмотрите ее изнутри. Он покрыт каплями воды из тех пузырьков, которые сконденсировались на крышке кулера (рис. 3).
Место перехода на газ: Вы, наверное, замечали, что когда вы нагреваете воду до кипения, сначала на дне кастрюли образуются пузырьки. (Студенты в защитных очках могут наблюдать это крупным планом.) Это потому, что дно кастрюли — единственное место, где вода достаточно горячая, чтобы нагреть воду до точки кипения и превратить ее в газ. Но как только у вас закипит, вся кастрюля с водой достигает точки кипения (100°C), и по всей массе воды образуются пузырьки. Испарение, с другой стороны, происходит только на поверхности воды. (Вспомните рисунок 2, на котором показаны испаряющиеся молекулы, покидающие поверхность воды.)
Источник энергии: Для варки обычно требуется внешний источник энергии, например, горелка под кастрюлей с водой, в которой вы варите яйца. Однако испарение использует энергию, уже содержащуюся в жидкости. Если у вас есть лужа с водой, в ней есть некоторое количество тепловой энергии, которая обычно поступает из окружающей среды. Тепло в этой воде приводит к тому, что некоторые молекулы движутся достаточно быстро, чтобы уйти в воздух, то есть испариться. Для испарения не требуется дополнительного источника энергии, и воде не нужно достигать точки кипения, чтобы испариться. Как мы видели, вода испаряется при комнатной температуре. То, что вы только что прочитали, подразумевает, что испарение, а не кипение, является естественным процессом. Ваша лужа воды или вода на ваших волосах, которые вы только что вымыли, испарится, и вы ничего особенного не сделаете. Просто подождите, и он высохнет. Но кипячение обычно не происходит естественным путем. Мы должны намеренно нагревать жидкость, чтобы она закипела.
Однако испарение использует энергию, уже содержащуюся в жидкости. Если у вас есть лужа с водой, в ней есть некоторое количество тепловой энергии, которая обычно поступает из окружающей среды. Тепло в этой воде приводит к тому, что некоторые молекулы движутся достаточно быстро, чтобы уйти в воздух, то есть испариться. Для испарения не требуется дополнительного источника энергии, и воде не нужно достигать точки кипения, чтобы испариться. Как мы видели, вода испаряется при комнатной температуре. То, что вы только что прочитали, подразумевает, что испарение, а не кипение, является естественным процессом. Ваша лужа воды или вода на ваших волосах, которые вы только что вымыли, испарится, и вы ничего особенного не сделаете. Просто подождите, и он высохнет. Но кипячение обычно не происходит естественным путем. Мы должны намеренно нагревать жидкость, чтобы она закипела.

Изменение температуры жидкости: Пока вода кипит, ее температура остается постоянной на уровне 100°C. Быстрое кипение не делает воду горячее, чем среднее кипячение. Ваши яйца приготовятся так же быстро в любом случае. С другой стороны, испарение воды охлаждает воду и любую поверхность, с которой вода испаряется. Вот почему, если вы ждете, пока высохнете после того, как выйдете из душа, вы почувствуете холод. Испаряющиеся молекулы воды уносят тепло с вашей кожи. Вот почему вы потеете в жаркий летний день. Дополнительная влага на вашей коже приводит к большему испарению, которое охлаждает вашу кожу. Так что не вытирай пот со лба; дайте ему испариться, и вам станет прохладнее!
ВЫСОТЫ И ДАВЛЕНИЕ Почему я сказал «на уровне моря»? Потому что на больших высотах атмосферное давление ниже. При более низком давлении воздуха у воды меньше «крышки», и она может перейти в газообразное состояние при более низкой температуре. Есть тут повара? Я только что взял свою старую книгу «Радость кулинарии», в которой авторы рассказывают о том, как следует изменять инструкции по приготовлению пищи на больших высотах. Например, в разделе супов они говорят: «На высоте более 2500 футов супы требуют более длительного времени приготовления, чем требуется в обычных рецептах, поскольку жидкости кипят при более низкой температуре». В кулинарии столько крутой науки! Напомните мне сделать статью об этом.
Например, в разделе супов они говорят: «На высоте более 2500 футов супы требуют более длительного времени приготовления, чем требуется в обычных рецептах, поскольку жидкости кипят при более низкой температуре». В кулинарии столько крутой науки! Напомните мне сделать статью об этом.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ИСПАРЕНИЯ
Спросите учащихся: «Что мы можем сделать, чтобы вода испарялась быстрее?» Вот некоторые факторы, влияющие на скорость испарения жидкости:
Тепло. Одежда, сушащаяся на бельевой веревке, в летний день сохнет быстрее, чем зимой.
Ветер. Если вы выходите из открытого бассейна, когда дует ветер, вы чувствуете себя холоднее, потому что ветер заставляет воду быстрее испаряться с вашей кожи, быстрее унося тепловую энергию от вашей кожи, оставляя вашу кожу более холодной (рис. 4). Этот эффект также является причиной «фактора охлаждения ветром», о котором мы слышим в прогнозах погоды в холодные зимние дни. Вы не были в бассейне, но на вашей коже всегда есть немного влаги. Ветер заставляет эту влагу быстрее испаряться, унося больше тепла с вашей кожи. Вот почему так важно оставаться укрытым в холодные и ветреные дни.
Вы не были в бассейне, но на вашей коже всегда есть немного влаги. Ветер заставляет эту влагу быстрее испаряться, унося больше тепла с вашей кожи. Вот почему так важно оставаться укрытым в холодные и ветреные дни.
Влажность. Вода испаряется быстрее, когда воздух сухой. Когда воздух сухой, в нем меньше молекул воды, возвращающихся в жидкость, поэтому вода испаряется быстрее. Когда в воздухе много молекул воды (то есть он влажный), например, в дождливый день, испарение происходит медленнее, потому что больше молекул воды возвращается в жидкость. Попробуйте провести такое исследование: налейте равное количество воды в три одинаковые банки. Одну банку оставьте открытой, накройте другую алюминиевой фольгой и накройте последнюю банку плотно прилегающей крышкой (рис. 5). Основываясь на том, что мы узнали, что вы ожидаете увидеть через несколько дней или неделю? Чем плотнее крышка, тем меньше испарения. Но почему именно? Студенты могут предположить, что с крышкой на банке молекулам воды некуда деться. Вы можете ответить: «Да, но разве молекулы воды не могут по-прежнему подниматься в воздух над водой в банке?» Могут, но это приведет к тому, что в воздухе в банке будет намного больше молекул воды (более высокая влажность), и гораздо больше молекул воды вернется в жидкость (как на рис. 2). Он быстро достигает точки, когда количество молекул воды, возвращающихся в жидкость, равно количеству молекул, покидающих жидкость, поэтому чистого изменения количества жидкой воды не происходит (то есть испарения нет). Это гораздо более сложное объяснение, чем крышка, просто удерживающая воду. Вам, вероятно, не нужно будет вдаваться в такие подробности со своими учениками, но вы будете гораздо более уверены в своих знаниях контента, если глубоко поймете процесс.
Но почему именно? Студенты могут предположить, что с крышкой на банке молекулам воды некуда деться. Вы можете ответить: «Да, но разве молекулы воды не могут по-прежнему подниматься в воздух над водой в банке?» Могут, но это приведет к тому, что в воздухе в банке будет намного больше молекул воды (более высокая влажность), и гораздо больше молекул воды вернется в жидкость (как на рис. 2). Он быстро достигает точки, когда количество молекул воды, возвращающихся в жидкость, равно количеству молекул, покидающих жидкость, поэтому чистого изменения количества жидкой воды не происходит (то есть испарения нет). Это гораздо более сложное объяснение, чем крышка, просто удерживающая воду. Вам, вероятно, не нужно будет вдаваться в такие подробности со своими учениками, но вы будете гораздо более уверены в своих знаниях контента, если глубоко поймете процесс.
Площадь поверхности. Увеличение площади поверхности обеспечит большую поверхность, с которой может испаряться вода. Таким образом, влажное полотенце высохнет быстрее, если его разложить, а не свернуть или свернуть в кучу.
Таким образом, влажное полотенце высохнет быстрее, если его разложить, а не свернуть или свернуть в кучу.
Подводя итог, можно сказать, что испарение происходит медленнее, происходит только с поверхности жидкости, не образует пузырьков и приводит к охлаждению. Кипение происходит быстрее, может происходить во всей жидкости, образует много пузырьков и не приводит к охлаждению.
Между статьей прошлого месяца и этой вы готовы обсудить круговорот воды. В своей простейшей форме круговорот воды представляет собой превращение воды из водяного пара (газа) в жидкую воду (конденсация), а затем обратно в газ (испарение). Боже мой, меня просто поразило, сколько реальных применений мы нашли для этой простой темы. В нашей повседневной деятельности так много открытий. Вот почему я всегда говорю: «Никогда не прекращайте учиться!»
Мэтт Бобровски — ведущий автор серии книг NSTA Press, Обучение на основе явлений: использование гаджетов и приспособлений для физических наук . Вы можете сообщить ему, если есть научная концепция, о которой вы хотели бы услышать больше. Свяжитесь с ним по адресу: [email protected]
Вы можете сообщить ему, если есть научная концепция, о которой вы хотели бы услышать больше. Свяжитесь с ним по адресу: [email protected]
Лаборатории Физическая наука элементарный
Лаборатории-Физические науки-Элементарные
Вам также может понравиться
Сообщение в блоге
Качество воздуха в лаборатории — не повод чихать
Отчеты Статья
Бесплатные подарки и возможности для учителей естественных наук и STEM, 28 марта 2023 г.
Журнальная статья
Наблюдение за школьным сообществом на рубеже прошлого века
Журнальная статья
Инженер по системным технологиям Ребекка Херольд
Когезионные и адгезионные силы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1499
Силы сцепления и адгезии связаны с объемными (или макроскопическими) свойствами, и, следовательно, эти термины неприменимы к обсуждению атомарных и молекулярных свойств. Когда жидкость вступает в контакт с поверхностью (например, со стенками градуированного цилиндра или столешницей), на нее действуют как силы сцепления, так и силы сцепления. Эти силы управляют формой, которую принимает жидкость. Из-за действия сил сцепления жидкость на поверхности может растекаться, образуя тонкую, относительно однородную пленку по поверхности, этот процесс известен как смачивание. В качестве альтернативы, при наличии сильных когезионных сил, жидкость может разделиться на несколько небольших, примерно сферических шариков, которые стоят на поверхности, сохраняя минимальный контакт с поверхностью.
Когда жидкость вступает в контакт с поверхностью (например, со стенками градуированного цилиндра или столешницей), на нее действуют как силы сцепления, так и силы сцепления. Эти силы управляют формой, которую принимает жидкость. Из-за действия сил сцепления жидкость на поверхности может растекаться, образуя тонкую, относительно однородную пленку по поверхности, этот процесс известен как смачивание. В качестве альтернативы, при наличии сильных когезионных сил, жидкость может разделиться на несколько небольших, примерно сферических шариков, которые стоят на поверхности, сохраняя минимальный контакт с поверхностью.
Адгезивные и когезионные силы
Термин «когезионные силы» является общим термином для коллективных межмолекулярных сил (например, водородных связей и сил Ван-дер-Ваальса), ответственных за объемное свойство жидкостей, сопротивляющихся разделению. Именно эти силы притяжения существуют между молекулами одного и того же вещества . Например, дождь падает каплями, а не мелким туманом, потому что вода обладает сильным сцеплением, которое плотно стягивает ее молекулы, образуя капли.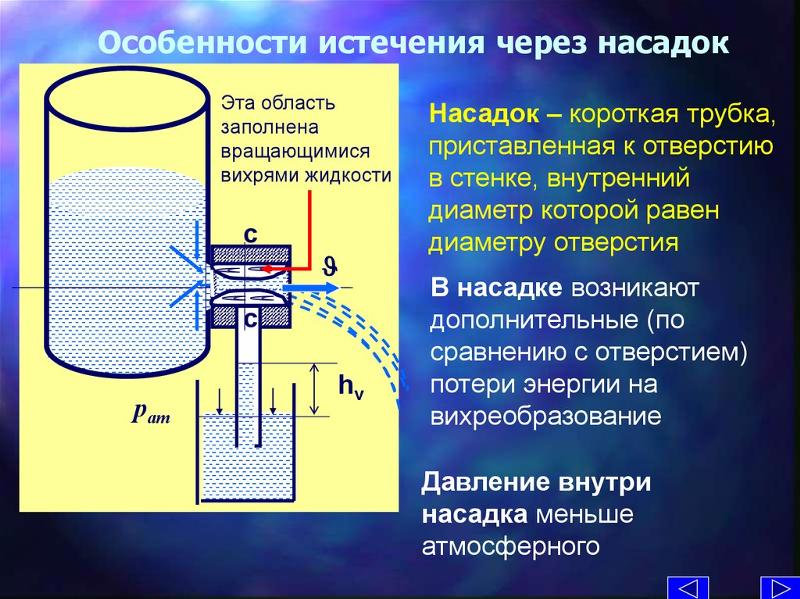 Эта сила стремится объединить молекулы жидкости, собирая их в относительно большие кластеры из-за неприязни молекул к окружающей среде.
Эта сила стремится объединить молекулы жидкости, собирая их в относительно большие кластеры из-за неприязни молекул к окружающей среде.
Аналогичным образом, термин «силы сцепления» относится к силам притяжения между разнородными веществами, таким как механические силы (слипание) и электростатические силы (притяжение из-за противоположных зарядов). В случае жидкого смачивающего агента адгезия заставляет жидкость прилипать к поверхности, на которой она находится. Когда воду наливают на чистое стекло, она имеет тенденцию растекаться, образуя тонкую равномерную пленку на поверхности стекла. Это связано с тем, что силы сцепления между водой и стеклом достаточно сильны, чтобы вытащить молекулы воды из их сферического образования и удержать их на поверхности стекла, тем самым избегая отталкивания между подобными молекулами.
Макроскопические эффекты когезионных и адгезионных сил
Когда жидкость помещается на гладкую поверхность, относительная сила когезионных и адгезионных сил, действующих на эту жидкость, определяет форму, которую она примет (и будет ли она смачивать поверхность или нет ).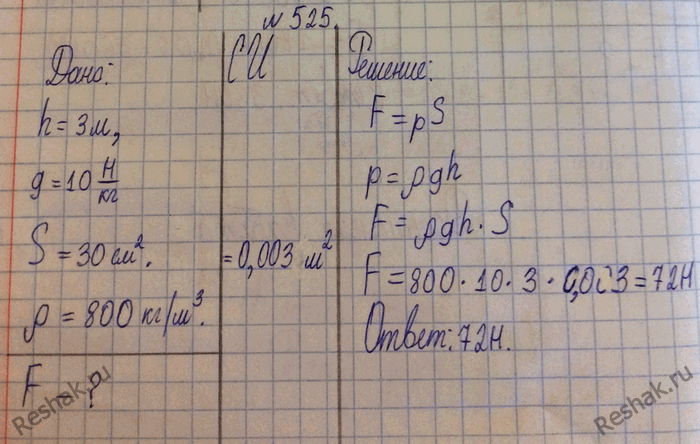 Если силы сцепления между жидкостью и поверхностью сильнее, они будут тянуть жидкость вниз, заставляя ее смачивать поверхность. Однако, если силы сцепления между самой жидкостью сильнее, они будут препятствовать такому слипанию и заставят жидкость сохранять сферическую форму и выпуклость на поверхности.
Если силы сцепления между жидкостью и поверхностью сильнее, они будут тянуть жидкость вниз, заставляя ее смачивать поверхность. Однако, если силы сцепления между самой жидкостью сильнее, они будут препятствовать такому слипанию и заставят жидкость сохранять сферическую форму и выпуклость на поверхности.
Случай I: Мениск
Мениск представляет собой кривизну поверхности жидкости внутри сосуда, такого как градуированный цилиндр. Однако, прежде чем мы объясним, почему некоторые жидкости имеют мениск вогнутый вверх, а другие — вогнутый вниз мениск, мы должны понять силы сцепления при работе поверхностного натяжения. Вода, например, представляет собой полярную молекулу, состоящую из частичного положительного заряда атомов водорода и частичного отрицательного заряда кислорода. Таким образом, в жидкой воде частичный положительный заряд каждой молекулы притягивается к частичному отрицательному заряду соседней молекулы. Это источник сил сцепления в воде. Молекулы воды, погруженные в жидкость, затем вытягиваются и равномерно выталкиваются во всех направлениях, не создавая чистого притяжения. Между тем, молекулы на поверхности жидкости, лишенные сил притяжения в восходящем направлении, таким образом охватывают результирующее притяжение вниз.
Между тем, молекулы на поверхности жидкости, лишенные сил притяжения в восходящем направлении, таким образом охватывают результирующее притяжение вниз.
Каким образом эта сила сцепления создает одновременно вогнутую вверх и вогнутую вниз поверхность? Ответ заключается в его отношении к силе сцепления между молекулами воды и поверхностью контейнера. Когда сила сцепления жидкости больше, чем сила сцепления жидкости со стенкой, жидкость вогнута вниз, чтобы уменьшить контакт с поверхностью стенки. Когда сила сцепления жидкости со стенкой больше, чем сила сцепления жидкости, жидкость сильнее притягивается к стенке, чем ее соседи, вызывая вогнутость вверх.
Дело II: Слезы вина
В встряхиваемых бокалах вина капли вина как бы «плавают» над мениском жидкости и образуют «слезы». Это вековое явление является результатом поверхностного натяжения и когезионных и адгезионных сил. Спирт более летуч, чем вода. В результате «испарение спирта создает градиент поверхностного натяжения, поднимающий тонкую пленку вдоль стенок бокала» (Адамсон). Этот процесс называется «солютным эффектом Марангони». 2 За счет сил сцепления часть воды прилипает к стенкам стакана. «Слезы» образуются из-за сил сцепления внутри воды, удерживающих ее вместе. Важно отметить, что градиент поверхностного натяжения является «движущей силой движения жидкости» (Гульотти), но фактическое образование разрывов является результатом когезионных и адгезионных сил.
Этот процесс называется «солютным эффектом Марангони». 2 За счет сил сцепления часть воды прилипает к стенкам стакана. «Слезы» образуются из-за сил сцепления внутри воды, удерживающих ее вместе. Важно отметить, что градиент поверхностного натяжения является «движущей силой движения жидкости» (Гульотти), но фактическое образование разрывов является результатом когезионных и адгезионных сил.
Задачи
- Назовите два примера, где сила сцепления преобладает над силой сцепления и наоборот.
- В стеклянном градуированном цилиндре вода представляет собой вогнутый вверх мениск. Однако, когда вода заполнена до кончика цилиндра, уровень воды может поддерживаться выше стенки цилиндра, не выливаясь, напоминая вогнутый вниз мениск.
 Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию.
Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию. - Объясните, почему водомер может скользить по воде, зная сцепление в воде.
- Предложите различные типы сил, на которых могут основываться силы сцепления.
Ответы
- Когда сила сцепления больше, чем сила сцепления: вогнутый мениск, вода образует капли на поверхности. Когда сила сцепления больше, чем сила сцепления: мениск вогнут вниз, поверхности покрыты смачивающим веществом, последние капли жидкости в бутылке всегда отказываются выходить.
- Поскольку вода образует вогнутый мениск, сцепление молекул со стеклом сильнее, чем сцепление между молекулами. Однако при отсутствии силы сцепления (когда вода достигает кончика стакана) сила сцепления остается. Таким образом, сила сцепления сама по себе доказывает, что она еще может удерживать себя на месте, не вытекая из цилиндра. Этот пример подчеркивает важность того, что силы сцепления и силы сцепления не просто компенсируют друг друга, но именно разница между ними определяет характеристики жидкости.

- Эта задача еще раз обращается к концепции поверхностного натяжения. Поскольку сцепление воды основано на слабых межмолекулярных силах воды, когда водомерка выходит на поверхность, потребуется дополнительная энергия, чтобы преодолеть эти связи, чтобы увеличить площадь поверхности. Более того, поскольку гравитационное притяжение водомерки не может преодолеть энергию активации, чтобы разрушить эти межмолекулярные силы, водомерка может свободно скользить по воде.
- Дополнительная форма, образование химических связей, слабые межмолекулярные силы, такие как Н-связь или силы Ван-дер-Ваальса.
Ссылки
- Петруччи и др. Общая химия: принципы и современные приложения: AIE (твердый переплет). Река Аппер-Сэдл: Пирсон / Прентис-Холл, 2007 г. .
- Гуглиотти, Маркос. «Слезы вина». Журнал химического образования 81.1 (2004): 67-68. Веб. 9 марта 2010 г.
- Адамсон, А. В.; Гаст, А. П. Физическая химия поверхностей , 6-е изд.


 Выбор и реализация бизнес-идей для начинающих
Выбор и реализация бизнес-идей для начинающих
 Охарактеризуйте особливості президенства К.Куліджа.
Охарактеризуйте особливості президенства К.Куліджа.
 Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.


 Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию.
Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию.
Leave A Comment