Элементу, электронная формула атома которого ls22s22p63s23p63d54s2, соответствует высший оксид, формула которого: 1) Вг2О7 2) MnО2 3) MnO 4) Mn2О7.
Строение атомов и ионовЧасть А. Задания с выбором одного ответа
1. Число электронных слоев и число электронов на внешнем электронном слое атомов брома соответственно равны:
1) 7 и 4; 2) 4 и 7; 3) 35 и 7; 4) 4 и 35.
2. Число электронных слоев и число электронов на внешнем электронном слое атомов марганца соответственно равны:
1) 4 и 7; 2) 4 и 2; 3) 7 и 4; 4) 4 и 5.
3. Число электронных слоев и число d-электронов в атоме германия соответственно равны:
1) 4 и 10; 2) 4 и 4; 3) 4 и 2; 4) 4 и 0.
4. Число электронных слоев и число d-электронов в атоме никеля соответственно равны:
1) 8 и 4; 2) 4 и 2; 3) 4 и 7; 4) 4 и 8.
5. Электронная конфигурация атома железа:
ls2 2s 22p6 3s23p63d6;
1s2 2s22p6 3s23p6 4s2 4p2;
ls2 2s22p6 3s23 p63d8;
1s2 2s22p6 3s23p63d 4s2.
6. Электронная конфигурация атома ванадия:
2)ls2 2s22 p 363s23p63d34s2;
3)ls2 2s22p6 3s23p 63d4 4s1;
4)ls2 2s22p6 3s23p6 4s24p3.
Электронная конфигурация внешнего электронного слоя …4s24p3 соответствует атому:
мышьяка;3) фосфора;
ванадия;4) сурьмы.
Электронная конфигурация ls22s22p63s23p63d24s2 соответствует атому:
1) скандия;3) титана;
2) ванадия;4) германия.
Электронная конфигурация ns2np6 соответствует каждому из двух атомов:
1) аргон и криптон;3) фтор и хлор;
2) неон и гелий;4) сера и кислород.
Электронная конфигурация ls22s22p63s23p63d5 соответствует иону:
1) Сг2+; 2) Fe3+; 3)Fe2+; 4)Mn4+.
Электронная конфигурация ls22s22p63s23p63d104s24p6 не соответствует частице:
Электронная конфигурация ls22s22p63s23p63d10 не соответствует иону:
Сu+; 2) Zn2+; 3) Cu2+; 4) Ga3+.

Электронную конфигурацию инертного газа не имеет ион:
1) Са2+; 2) С1- ; 3) К+; 4) Сг3″.
Атому неона в основном состоянии соответствует электронная конфигурация частицы:
1) Na°; 2) F- ;3) С1- ; 4) О2+.
Элементу, электронная формула атома которого ls22s22p5, соответствует водородное соединение, формула которого:
HF; 2) НС1; 3) СН4; 4) Nh4
1) РН3; 2) СН4; 3) Sih5; 4) HI.
Элементу, электронная формула атома которого ls22s22p63s23p4, соответствует высший оксид, формула которого:
1) SО2; 2) SO3; 3) SeO2; 4) CrО3.
Элементу, электронная формула атома которого ls22s22p63s23p63d54s2, соответствует высший оксид, формула которого:
1) Вг2О7; 2) MnО2; 3) MnO; 4) Mn2О7.
Элементу, электронная формула атома которого ls22s22p63s23р63d104s24p3, соответствует высший оксид, формула которого:
Элементу, электронная формула атома которого ls22s22p63s23p63d104s24p3, соответствует водородное соединение, формула которого:
1) h3S; 2) РН3; 3) Nh4; 4) Ash4.
Какое соединение содержит катион и анион с электронной конфигурацией ls22s22p6 ?1) КС1; 2) KF;3) NaF; 4) NaCl.
Часть В.
Ответом к заданиям 22—28 является последовательность цифр.
22. Обозначения изотопов кремния:
Схемы строения электронных оболочек атомов элементов 2-го периода периодической системы Д. И. Менделеева:
2ē, 8ē, 2ē;
2ē, 5ē;
2ē, 2ē;
2ē, 8ē, 8ē, 2ē;
Электронные формулы атомов элементов 4-го периода периодической системы Д. И. Менделеева:
ls22s22p63s23p63dl4sl;
ls22s22p63s23p4;
ls22s22p63s23p63d24s2;
ls22s22p63s23p63d54s1,
ls22s22p63s23p2.
Электронные формулы атомов элементов IVA группы периодической системы Д. И. Менделеева:
ls22s22p63s23p63d104s24p4;
ls22s22p2;
ls22s22p63s23p63d24s2;
ls22s22p63s23p2;
ls22s22p63s23p63d104s24р2.
Электронные формулы атомов элементов ШБ группы периодической системы Д. И. Менделеева:
ls22s22p63s23p1
ls22s22p63$23p63dl04s24p64d105s25p1;
ls22s22p63s23p63d104s24p1;
ls22s22p63s23p63d104s24p64d15s2.
Атому серы в возбужденном состоянии соответствуют электронные конфигурации внешнего электронного слоя:
ls22s22p63s23p4; 4) ls22s22p63s2;
2) ls22s22p62s23p8;5) ls22s22p63s13p33d2;
3) ls22s22p63s23p33dl;6) ls22s22p6.
Заряд ядра и электронные конфигурации внешнего электронного слоя, соответствующие атомам химических элементов в возбужденном состоянии:
+8 и ls22s22p6;
+6 и ls22s13p3;
+5 и ls22s12p2;
+7 и ls22s22p5;
+15 и ls22s22p63s13p33d1;
+17 и ls22s22p5.
ЧИСЛО НЕСПАРЕННЫХ ЭЛЕКТРОНОВ:
1) 0;
2) 1
2
3
4
5.
Установите соответствие между названием элемента и числом неспаренных электронов в его атоме в невозбужденном состоянии.
НАЗВАНИЕ ЭЛЕМЕНТА:
титан;
Б) мышьяк;
хлор;
Г) цинк.
СЕМЕЙСТВО:
s-элементы;
р-элементы;
d-элементы;
f-элементы
Установите соответствие между названием элемента и семейством, к которому он принадлежит
НАЗВАНИЕ ЭЛЕМЕНТА:
Б) бром;
гелий;
Г) цинк.
Контрольное тестирование по химии за 1 полугодие 11 класс
Тест за 1 полугодие по химии в 11 классе
Вариант1. 1. Схема
Ch4COOH + Ch4OH
CH→ 3COOCh4 + h3O
→
3)
C2h3 + h3O
→
→
2)
C2h5 + HCl
4)
C6H6 + h3 →
относится к реакции
1) этерификации 2) гидролиза 3) дегидратации 4) нейтрализации
2. Окислительновосстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) сероводорода с бромной водой 4) серы с алюминием
3. Реакцией замещения является
1) C6H6 + HNO3
4. Взаимодействие ацетилена с водой является
1) каталитической реакцией замещения
2) некаталитической реакцией присоединения
3) каталитической реакцией присоединения
4) некаталитической реакцией замещения
5. Окислительновосстановительной реакцией является разложение
1) нитрата цинка 2) карбоната аммония
3) малахита 4) гидрокарбоната натрия
6. Реакцией замещения является взаимодействие
1) этилена с бромной водой 2) углекислого газа с «известковой водой»
3) цинка с соляной кислотой 4) серной кислотой с гидроксидом алюминия
7. Эндотермической реакцией является
1) разложение гидроксида меди(II)
2) нейтрализация соляной кислоты гидроксидом натрия
3) взаимодействие водорода с кислородом
4) взаимодействие цинка с соляной кислотой
8. Реакцией обмена является взаимодействие
1) оксида кальция с азотной кислотой 2) угарного газа с кислородом
3) этилена с водородом 4) соляной кислоты с магнием
9. Окислительновосстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) сероводорода с бромной водой 4) серы с алюминием
10. Экзотермической реакцией является
1) дегидрирование этана
2) разложение перманганата калия
3) нейтрализация серной кислоты гидроксидом калия
4) электролиз воды
11. Обратимой является реакция
1) Cu(OH)2 + 2HCl = CuCl2 + 2h3O
2) Ch5 + 2O2 = CO2 + 2h3O
3) C2h5 + h3 = C2H6
4) CuO + h3 = Cu + h3O
12.
1. Схема
Ch4COOH + Ch4OH
CH→ 3COOCh4 + h3O
→
3)
C2h3 + h3O
→
→
2)
C2h5 + HCl
4)
C6H6 + h3 →
относится к реакции
1) этерификации 2) гидролиза 3) дегидратации 4) нейтрализации
2. Окислительновосстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) сероводорода с бромной водой 4) серы с алюминием
3. Реакцией замещения является
1) C6H6 + HNO3
4. Взаимодействие ацетилена с водой является
1) каталитической реакцией замещения
2) некаталитической реакцией присоединения
3) каталитической реакцией присоединения
4) некаталитической реакцией замещения
5. Окислительновосстановительной реакцией является разложение
1) нитрата цинка 2) карбоната аммония
3) малахита 4) гидрокарбоната натрия
6. Реакцией замещения является взаимодействие
1) этилена с бромной водой 2) углекислого газа с «известковой водой»
3) цинка с соляной кислотой 4) серной кислотой с гидроксидом алюминия
7. Эндотермической реакцией является
1) разложение гидроксида меди(II)
2) нейтрализация соляной кислоты гидроксидом натрия
3) взаимодействие водорода с кислородом
4) взаимодействие цинка с соляной кислотой
8. Реакцией обмена является взаимодействие
1) оксида кальция с азотной кислотой 2) угарного газа с кислородом
3) этилена с водородом 4) соляной кислоты с магнием
9. Окислительновосстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) сероводорода с бромной водой 4) серы с алюминием
10. Экзотермической реакцией является
1) дегидрирование этана
2) разложение перманганата калия
3) нейтрализация серной кислоты гидроксидом калия
4) электролиз воды
11. Обратимой является реакция
1) Cu(OH)2 + 2HCl = CuCl2 + 2h3O
2) Ch5 + 2O2 = CO2 + 2h3O
3) C2h5 + h3 = C2H6
4) CuO + h3 = Cu + h3O
12.

 У элементов подгруппы углерода с увеличением атомного номера
уменьшается
1) атомный радиус 2) заряд ядра атома
3) число валентных электронов в атомах 4) электроотрицательность
35. В ряду элементов азот кислород фтор возрастает
1) валентность по водороду 2) число энергетических уровней
3) число внешних электронов 4) число неспаренных электронов
36. В ряду химических элементов бор углерод азот возрастает
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
37. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
38. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 P2O5 As2O5 Sb2O5
1) ослабевают 2) усиливаются
3) не изменяются 4) изменяются периодически
39. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B 2) Cl,S,P,Si 3) C,Si,Ge,Sn 4) B,C,O,F
40. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
41. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1 2) O,S,Se,Te 3) At,I,Br,Cl 4) Mg,Al,Si, P
42. Какой элемент образует газообразное водородное соединение,
соответствующее общей формуле Rh3?
1) бор 2) калий 3) сера 4) хром 43.В главных подгруппах периодической системы восстановительная способность
атомов химических элементов растет с
1) уменьшением радиуса атомов 2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов 4) увеличением числа валентных электронов
44. В какой группе периодической системы находится элемент Э, входящий в состав
кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
45.
У элементов подгруппы углерода с увеличением атомного номера
уменьшается
1) атомный радиус 2) заряд ядра атома
3) число валентных электронов в атомах 4) электроотрицательность
35. В ряду элементов азот кислород фтор возрастает
1) валентность по водороду 2) число энергетических уровней
3) число внешних электронов 4) число неспаренных электронов
36. В ряду химических элементов бор углерод азот возрастает
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
37. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
38. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 P2O5 As2O5 Sb2O5
1) ослабевают 2) усиливаются
3) не изменяются 4) изменяются периодически
39. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B 2) Cl,S,P,Si 3) C,Si,Ge,Sn 4) B,C,O,F
40. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
41. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1 2) O,S,Se,Te 3) At,I,Br,Cl 4) Mg,Al,Si, P
42. Какой элемент образует газообразное водородное соединение,
соответствующее общей формуле Rh3?
1) бор 2) калий 3) сера 4) хром 43.В главных подгруппах периодической системы восстановительная способность
атомов химических элементов растет с
1) уменьшением радиуса атомов 2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов 4) увеличением числа валентных электронов
44. В какой группе периодической системы находится элемент Э, входящий в состав
кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
45. В ряду оксидов SiO2 Р2О5 SO2 Cl2O7 кислотные свойства
1) возрастают 2) убывают
3) не изменяются 4) сначала уменьшаются, потом увеличиваются
46. В результате реакции, термохимическое уравнение которой
2С2Н2 +5О2 = 4СО2 + 2Н2О + 2610 кДж.
выделилось 652,5 кДж теплоты. Объем сгоревшего ацетилена равен
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
47. При образовании аммиака согласно уравнению реакции
N2(Г)
выделилось 230 кДж теплоты. При этом объем (н.у.) вступившего в реакцию водорода
составил
1) 44,8 л 2) 56 л 3) 112 л 4) 168 л
+ 3h3(Г) = 2Nh4(r) + 92 кДж
Тест за 1 полугодие по химии в 11 классе
Вариант 2.
1.Реакцией замещения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) этилена с бромной водой 4) серной кислотой с гидроксидом алюминия
2. Взаимодействие гидроксида натрия с серной кислотой является
1) экзотермической реакцией замещения 2) эндотермической реакцией обмена
3) эндотермической реакцией замещения 4) экзотермической реакцией обмена
3. Реакцией соединения, идущей без изменения степени окисления, является
1) горения угарного газа 2) взаимодействие углекислого газа с оксидом кальция
3) взаимодействие оксида меди с соляной кислотой
4) реакция азотной кислоты с бензолом
4. Реакции, схемы которых
,→ Ch4 CH=Ch3 + HCl
,→
С6H6 + Br2 FeBr3
являются реакциями
1) присоединения 2) замещения
3) замещения и присоединения, соответственно
4) присоединения и замещения, соответственно
5. Каталитической является реакция
1) хлорирования метана 2) синтез аммиака
3) соляной кислоты с карбонатом натрия 4) бромирования анилина
6. Необратима реакция
1) разложения гидроксида алюминия 2) гидрирования этилена
3) дегидратации пропанола 4) соединения сернистого газа с кислородом
7. Окислительновосстановительной реакцией является разложение
1) малахита 2) карбоната аммония
3) нитрата цинка 4) гидрокарбоната натрия
8.
В ряду оксидов SiO2 Р2О5 SO2 Cl2O7 кислотные свойства
1) возрастают 2) убывают
3) не изменяются 4) сначала уменьшаются, потом увеличиваются
46. В результате реакции, термохимическое уравнение которой
2С2Н2 +5О2 = 4СО2 + 2Н2О + 2610 кДж.
выделилось 652,5 кДж теплоты. Объем сгоревшего ацетилена равен
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
47. При образовании аммиака согласно уравнению реакции
N2(Г)
выделилось 230 кДж теплоты. При этом объем (н.у.) вступившего в реакцию водорода
составил
1) 44,8 л 2) 56 л 3) 112 л 4) 168 л
+ 3h3(Г) = 2Nh4(r) + 92 кДж
Тест за 1 полугодие по химии в 11 классе
Вариант 2.
1.Реакцией замещения является взаимодействие
1) цинка с соляной кислотой 2) углекислого газа с «известковой водой»
3) этилена с бромной водой 4) серной кислотой с гидроксидом алюминия
2. Взаимодействие гидроксида натрия с серной кислотой является
1) экзотермической реакцией замещения 2) эндотермической реакцией обмена
3) эндотермической реакцией замещения 4) экзотермической реакцией обмена
3. Реакцией соединения, идущей без изменения степени окисления, является
1) горения угарного газа 2) взаимодействие углекислого газа с оксидом кальция
3) взаимодействие оксида меди с соляной кислотой
4) реакция азотной кислоты с бензолом
4. Реакции, схемы которых
,→ Ch4 CH=Ch3 + HCl
,→
С6H6 + Br2 FeBr3
являются реакциями
1) присоединения 2) замещения
3) замещения и присоединения, соответственно
4) присоединения и замещения, соответственно
5. Каталитической является реакция
1) хлорирования метана 2) синтез аммиака
3) соляной кислоты с карбонатом натрия 4) бромирования анилина
6. Необратима реакция
1) разложения гидроксида алюминия 2) гидрирования этилена
3) дегидратации пропанола 4) соединения сернистого газа с кислородом
7. Окислительновосстановительной реакцией является разложение
1) малахита 2) карбоната аммония
3) нитрата цинка 4) гидрокарбоната натрия
8. Взаимодействие цинка с соляной кислотой относится к реакции 1) обмена 2) соединения 3) разложения 4) замещения
9. Взаимодействие карбоната натрия с гидроксидом кальция относится к реакции
1) обмена 2) соединения 3) разложения 4) замещения
10. Реакция, уравнение которой
3Н2+N2 =2Nh4 относится к реакциям
1) обратимой, экзотемической 2) необратимой, экзотермической
3) обратимой, эндотермической 4) необратимой, эндотермической
11. Для увеличения скорости выделения углекислого газа при действии соляной кислоты
на мрамор нужно
1) разбавить кислоту 2) измельчить мрамор
3) добавить индикатор 4) проводить реакцию в атмосфере инертного газа
12. С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород 2) магний и вода
3) раствор гидроксида натрия и соляная кислота 4) сера и железо
13. С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота 2) натрий и вода
3) магний и вода 4) свинец и соляная кислота
14. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других
уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты
столкновений частиц.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
15. C наибольшей скоростью реагирует с водородом
1) Сl2 2) F2 3) S 4) C
16. Оцените правильность утверждений.
А. Катализатор это вещество, которое увеличивает скорость химической реакции, но при
этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
17.
Взаимодействие цинка с соляной кислотой относится к реакции 1) обмена 2) соединения 3) разложения 4) замещения
9. Взаимодействие карбоната натрия с гидроксидом кальция относится к реакции
1) обмена 2) соединения 3) разложения 4) замещения
10. Реакция, уравнение которой
3Н2+N2 =2Nh4 относится к реакциям
1) обратимой, экзотемической 2) необратимой, экзотермической
3) обратимой, эндотермической 4) необратимой, эндотермической
11. Для увеличения скорости выделения углекислого газа при действии соляной кислоты
на мрамор нужно
1) разбавить кислоту 2) измельчить мрамор
3) добавить индикатор 4) проводить реакцию в атмосфере инертного газа
12. С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород 2) магний и вода
3) раствор гидроксида натрия и соляная кислота 4) сера и железо
13. С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота 2) натрий и вода
3) магний и вода 4) свинец и соляная кислота
14. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других
уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты
столкновений частиц.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
15. C наибольшей скоростью реагирует с водородом
1) Сl2 2) F2 3) S 4) C
16. Оцените правильность утверждений.
А. Катализатор это вещество, которое увеличивает скорость химической реакции, но при
этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
17. Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь 2) снижают давление в системе
3) используют катализатор 4) используют циркуляцию азотоводородной смеси
18. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом 2) цинка с серной кислотой
3) серы с железом 4) гидроксида натрия с хлоридом меди (II)
19. Катализатор требуется для проведения реакции
1) хлорирования алканов 2) нейтрализации фосфорной кислоты
3) пиролиза метана 4) этерификации уксусной кислоты
20. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводород 2) азот и водород
3) азот и кислород 4) сернистый газ и кислород числу протонов
числу нейтронов
числу энергетических уровней
относительной атомной массе
21. Количество электронов в атоме равно
1)
2)
3)
4)
22. Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) 2 3) +2 4) 4
23. Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4)
Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава Rh4.
Электронная конфигурация внешнего уровня этого элемента
1)
2)
3)
4)
26. Атомы серы и кислорода имеют
1)
2)
3)
4)
27. Электронная конфигурация атома фтора
1)
2)
3)
4)
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3гибридизации?
1)
2)
одинаковое число электронных слоев
одинаковое число электронов внешнего электронного слоя
одинаковое число протонов в ядре
одинаковые радиусы
1
2
3)
4)
3
4
3s23p1
3s23p2
3s23p3
3s23p5
1s22s22p5
1s22s22p4
1s22s22p6
1s22s22p3 29.
Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь 2) снижают давление в системе
3) используют катализатор 4) используют циркуляцию азотоводородной смеси
18. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом 2) цинка с серной кислотой
3) серы с железом 4) гидроксида натрия с хлоридом меди (II)
19. Катализатор требуется для проведения реакции
1) хлорирования алканов 2) нейтрализации фосфорной кислоты
3) пиролиза метана 4) этерификации уксусной кислоты
20. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводород 2) азот и водород
3) азот и кислород 4) сернистый газ и кислород числу протонов
числу нейтронов
числу энергетических уровней
относительной атомной массе
21. Количество электронов в атоме равно
1)
2)
3)
4)
22. Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) 2 3) +2 4) 4
23. Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4)
Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава Rh4.
Электронная конфигурация внешнего уровня этого элемента
1)
2)
3)
4)
26. Атомы серы и кислорода имеют
1)
2)
3)
4)
27. Электронная конфигурация атома фтора
1)
2)
3)
4)
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3гибридизации?
1)
2)
одинаковое число электронных слоев
одинаковое число электронов внешнего электронного слоя
одинаковое число протонов в ядре
одинаковые радиусы
1
2
3)
4)
3
4
3s23p1
3s23p2
3s23p3
3s23p5
1s22s22p5
1s22s22p4
1s22s22p6
1s22s22p3 29. У атома хлора на третьем электронном уровне имеется одна sорбиталь, три p
орбитали и пять dорбиталей. Максимальная валентность хлора равна
1)
четырем
2)
3)
4)
семи
восьми
девяти
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное
соединение
1) СН4 2) Sih5 3) h3O 4) h3S
31. Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
1) ns2np5 2) ns2np2 3) ns2np4 2) ns2np6
32. Одинаковое число валентных электронов имеют атомы калия и
1) углерода 2) магния 3) фосфора 4) натрия
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
35. В ряду химических элементов
Na Mg Al Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1
2) 1s22s22p63s1
3) 1s22s2
4) 1s22s22p63s23p1
39. В каком ряду простые вещества расположены в порядке усиления
металлических свойств?
1) Mg, Ca, Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
40. По периоду слева направо уменьшается(ются)
1) атомный радиус элементов 2) число валентных электронов в атомах
3) электроотрицательность элементов 4) кислотные свойства гидроксидов
41. В порядке увеличения электроотрицательности химические элементы расположены
в раду:
1) С, N, О 2) Si.
У атома хлора на третьем электронном уровне имеется одна sорбиталь, три p
орбитали и пять dорбиталей. Максимальная валентность хлора равна
1)
четырем
2)
3)
4)
семи
восьми
девяти
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное
соединение
1) СН4 2) Sih5 3) h3O 4) h3S
31. Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
1) ns2np5 2) ns2np2 3) ns2np4 2) ns2np6
32. Одинаковое число валентных электронов имеют атомы калия и
1) углерода 2) магния 3) фосфора 4) натрия
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
35. В ряду химических элементов
Na Mg Al Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1
2) 1s22s22p63s1
3) 1s22s2
4) 1s22s22p63s23p1
39. В каком ряду простые вещества расположены в порядке усиления
металлических свойств?
1) Mg, Ca, Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
40. По периоду слева направо уменьшается(ются)
1) атомный радиус элементов 2) число валентных электронов в атомах
3) электроотрицательность элементов 4) кислотные свойства гидроксидов
41. В порядке увеличения электроотрицательности химические элементы расположены
в раду:
1) С, N, О 2) Si. Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
42. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в
атоме этого элемента соответствует ряд чисел: 1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
43. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
44. В каком ряду химические элементы расположены в порядке возрастания их атомного
радиуса?
1) Rb,K,Na,Li 2) Na,Mg,Al, S 3) О, S, Se, Те 4) C,N, О, F
45. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий 2) алюминий 3) фосфор 4) сера
46. В результате реакции, термохимическое уравнение которой
2КС1О3(ТВ) = 2КС1(ТВ) + 3О2(Г) + 91 кДж,
выделилось 182 кДж теплоты. Масса образовавшегося при этом кислорода равна
1) 96 г 2) 192 г 3) 288 г 4) 576 г
47. Согласно термохимическому уравнению реакции
СН4(Г) + 2О2(Г) = СО2(Г) + 2Н2О(Г) + 802 кДж
количество теплоты, выделившейся при сжигании 8 г метана, равно
I) 1604 кДж 2) 1203 кДж 3) 601.5 кДж 4) 401 кДж
Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
42. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в
атоме этого элемента соответствует ряд чисел: 1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
43. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
44. В каком ряду химические элементы расположены в порядке возрастания их атомного
радиуса?
1) Rb,K,Na,Li 2) Na,Mg,Al, S 3) О, S, Se, Те 4) C,N, О, F
45. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий 2) алюминий 3) фосфор 4) сера
46. В результате реакции, термохимическое уравнение которой
2КС1О3(ТВ) = 2КС1(ТВ) + 3О2(Г) + 91 кДж,
выделилось 182 кДж теплоты. Масса образовавшегося при этом кислорода равна
1) 96 г 2) 192 г 3) 288 г 4) 576 г
47. Согласно термохимическому уравнению реакции
СН4(Г) + 2О2(Г) = СО2(Г) + 2Н2О(Г) + 802 кДж
количество теплоты, выделившейся при сжигании 8 г метана, равно
I) 1604 кДж 2) 1203 кДж 3) 601.5 кДж 4) 401 кДжТесты по учебной дисциплине Химия для специальности 09.02.03 Программирование в компьютерных системах
Тест №1
Строение атома. Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И.Менделеева.
Вариант 1
1.Заряд ядра атома равен числу
протонов
электронов во внешнем электронном слое
нейтронов
энергетических уровней
2.Атом состоит изположительно заряженного ядра и электронной оболочки
отрицательно заряженного ядра и протонной оболочки
нейтронов и электронов
протонов и нейтронов
3.Для элементов главных подгрупп число электронов во внешнем слое равно
числу нейтронов3) заряду ядра атома
номеру периода4) номеру группы
4.
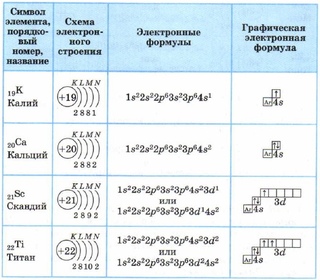 Какое число электронов содержится в атоме азота?
Какое число электронов содержится в атоме азота?1) 52) 23) 74) 14
5.В атоме углерода распределение электронов по электроннымслоям соответствует ряду чисел
1)4; 22)2;43) 2; 2; 24) 2; 6; 4
6.У атома азота число электронов на внешнем энергетическомуровне и число протонов равны соответственно
1)5,7 .2)3,173)5, 14 . 4)3, 14
7.Электронная конфигурации 1s22s22р63s23р5 соответствуетатому
хлора3) серы
магния4) кремния
8.В атоме фосфора число электронных слоев равно
1) 52) 23) 34)4
Вариант 2
1. Заряд ядра атома равен
числу протонов в ядре
числу нейтронов в ядре
номеру группы
относительной атомной массе
2.В состав атомного ядра входят
электроны и протоны
протоны, нейтроны и электроны
нейтроны и электроны
нейтроны и протоны
3.Число электронов во внешнем слое элементов главных под-групп равно
высшей валентности по водороду
номеру периода
номеру группы
порядковому номеру элемента
4.Какое количество нейтронов содержит ядро атома С1 ?1) 522) 203) 354) 17
5.В атоме натрия распределение электронов по «электроннымслоям соответствует ряду чисел
2; 6; 33) 1; 8; 2
2; 8; 2; 14) 2; 8; 1
6.Число электронов на внешнем энергетическом уровне атомауглерода в возбужденном состоянии
1) 22) 33)44)6
7.Число неспаренных электронов на внешнем энергетическомуровне атома кислорода в основном состоянии
1) 62) 23)44)8
8.В атоме кислорода распределение электронов по электронным слоям соответствует ряду чисел
1)2; 4; 22) 2; 6. 3) 6; 24)8; 16
Вариант 3
1. Заряд ядра атома равен
номеру группы
номеру периода
числу протонов
высшей положительной степени окисления.
2. Число протонов в атоме равно
числу электронов
относительной атомной массе
числу нейтронов
числу заполненных электронных слоев
3.Атомы натрия и водорода имеют одинаковые(-ое)
величины радиуса атомов
значения зарядов ядер атомов
число электронов во внешнем электронном слое
число завершенных электронных слоев
4.
 Какое число нейтронов содержится в атоме
Какое число нейтронов содержится в атоме1)112) 53) 64)3
5.В атоме железа распределение электронов по электроннымслоям соответствует ряду чисел
1)2; 14; 8; 23) 2; 8; 14; 2
2)2; 4; 8; 6; 64) 2; 8; 8; 8
6.Число электронов на внешнем энергетическом уровне атомабора в возбужденном состоянии —
1) 22)4.3) 34)6
7.Число неспаренных электронов на внешнем энергетическомуровне атома фосфора в основном состоянии —
1)52) 3 3)14)15
8.В атоме кальция число электронных слоев равно
1) 12)43) 194) 39
Вариант 4
1. Число электронов в атоме равно
высшей степени окисления
числу протонов
номеру периода
номеру группы
2.Число электронных слоев в атоме для элементов главныхподгрупп
равно порядковому номеру элемента
совпадает с номером группы
не зависит от номера периода
равно номеру периода
3.Атомы фтора и брома имеют одинаковые(-ое)
размеры атомов
число протонов в ядре
число электронов во внешнем электронном слое
число завершенных электронных слоев
4.Какое количество нейтронов содержится в атоме?
1)52) 153) 164) 31
5.Схема распределения электронов по электронным слоям2; 8; 7; соответствует атому
1)хлора3) кислорода
2) фтора4) серы
6.Число электронов на внешнем энергетическом уровне атомафосфора в возбужденном состоянии —
1) 52)43) 34)6
7.Атомы азота и фосфора имеют одинаковое(-ые)
значение радиуса атомов
значение зарядов ядер атомов
число электронов во внешнем электронном слое
число заполненных электронных слоев
8.В атоме кремния распределение электронов по электроннымслоям соответствует ряду чисел
1)2; 8; 22) 2; 43)4; 8; 2 4) 2; 8; 4
Вариант 5
1. Число нейтронов в ядре равно
порядковому номеру
числу электронов
сумме числа протонов и нейтронов
разности массового числа и числа протонов в ядре
2.Порядковый номер химического элемента равен
заряду ядра атома
атомной массе
числу нейтронов в ядре
числу валентных электронов атома
3.
 С1 одинаковое число
С1 одинаковое числонейтронов в ядре
нейтронов и протонов
протонов в ядре
нейтронов и электронов
Вариант 7
1.Относительная атомная масса изотопа численно равна
сумме числа электронов и протонов
разности между числом протонов и числом нейтронов
сумме числа протонов и нейтронов
порядковому номеру элемента
2.Атомы химических элементов одной главной подгруппыимеют
одинаковые радиусы атомов
одинаковые заряды ядер атомов
одинаковое число валентных электронов
одинаковую электроотрицательность3.Сколько электронов содержит атом алюминия?
1) 272) 133) 144) 3
4.Число нейтронов в ионе 37С1~ равно
1) 182) 173) 204) 37
5.Схема распределения электронов по электронным слоям2; 8; 8; 2; соответствует атому
калия3) кальция
серы4) фтора
6.Иону С1~ соответствует схема заполнения электронных слоев
1)2; 8; 62) 2; 8; 83) 8; 8; 24) 3; 7; 8
7.Одинаковое число протонов и нейтронов содержится в атоме
углерода-143) фтора-19
углерода-124) фосфора-31
8.Какое число электронов содержит атом фосфора?
1) 312) 163) 154) 5
Вариант 8
1.Изотопы одного элемента имеют
одинаковое число нейтронов
одинаковое число протонов
равную сумму числа протонов и нейтронов
одинаковую разность числа протонов и нейтронов
2.Атомы химических элементов, находящиеся в одной глав-ной подгруппе, имеют
одинаковое число нейтронов в ядре
одинаковые заряды ядер атомов
одинаковое число электронов на внешнем слое
одинаковые радиусы атомов
3.Укажите число электронов в атоме кремния.
1) 282) 43) 34) 14
4.В атоме бора число электронных слоев в основном состоянии равно
1)32) 23) 94)5
5.У атома фосфора число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)5,312)5, 153)3,314)3, 15
6.Иону S~2 соответствует схема заполнения электронных слоев
1)2; 8; 43) 8; 8; 2
2)2; 8; 84) 4; 6; 8
7.
 В атоме калия распределение электронов по электроннымслоям соответствует ряду чисел
В атоме калия распределение электронов по электроннымслоям соответствует ряду чисел2; 8; 6; 33) 1; 8; 8; 2
2; 6; 8; 2; 1 4) 2; 8; 8; 1
8.У атомов 23 Nа и 24 одинаковое число
11 12
нейтронов в ядре
валентных электронов
протонов в ядре
электронов в атоме
Тест №2
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Вариант 1
1.В каком ряду химические элементы расположены в порядкевозрастания их атомных радиусов?
1)N,В,С3)Nа, Мg, К
2)N,Р,Аs4)В,Si,N
2.В каком ряду химические элементы расположены в порядкеувеличения зарядов ядер атомов?
1)В,N,С3)Вг,С1,F
2) О, Sе, S4) Ве, Мg, Са3.Наибольшей восстановительной активностью обладает
1)Si2)Р3)S4)С1
4.В каком ряду химические элементы расположены в порядкеослабления их неметаллических свойств?
1) Ве →В → С3) S → С1 → Аг2)Gа→А1→В4)С1→Вг→1
5.В ряду химических элементов В -> С -> N
усиливаются металлические свойства
ослабевают восстановительные свойства
уменьшается электроотрицательность атомов
уменьшается высшая степень окисления в оксидах
6.Низшая степень окисления в ряду химических элементовфтор — кислород — углерод
увеличивается
не изменяется
уменьшается
изменяется периодически
7.Высший оксид состава ЭО образуют все элементы
1УА группы3) IV периода
НА группы4) II периода
8. В ряду гидроксидов В(ОН)3 -> А1(ОН)3 -> Т1(ОН)3 свойства гидроксидов изменяются от
основных к кислотным
амфотерных к кислотным
кислотных к основным
амфотерных к основным
Вариант 2
1.В каком ряду химические элементы расположены в порядкеуменьшения радиуса атома?
В, N, Р3) Вг, С1, Р
О, S, Sе4) С1, S, Р2.В каком ряду химические элементы расположены в порядкеуменьшения зарядов ядер атомов?
1)N,С,В3)Вг,1,Р
2) О, Se, S4) Ве, Мg, Са3.Наибольшей восстановительной активностью обладает
1)Са2)К3)А14)Si
4.
 Свойства оксидов в ряду ВеО -> С02 -> N205 изменяются отамфотерных к кислотным
Свойства оксидов в ряду ВеО -> С02 -> N205 изменяются отамфотерных к кислотнымосновных к кислотным
амфотерных к основным
кислотных к основным
5.В ряду химических элементов 81 -> Р -> 8
увеличивается число валентных электронов в атомах
уменьшается число валентных электронов в атомах
уменьшается число протонов в ядрах атомов
увеличиваются радиусы атомов
6.Низшая степень окисления в ряду химических элементовмышьяк — фосфор — азот
увеличивается
не изменяется
уменьшается
изменяется периодически
7.Высший оксид состава Э2Оэ образуют все элементы
УА группы3) IV периода
ША группы4) II периода
8.В ряду гидроксидов НСIO4 → НBrO4 → HIO4
происходит ослабление основных и усиление кислотных свойств
происходит переход от амфотерных к кислотным гидроксидамусиливаются кислотные свойства
кислотные свойства ослабевают
Вариант 3
1.Радиус атома уменьшается в ряду
хлор, сера, натрий
натрий, сера, хлор
хлор, натрий, сера
сера, натрий, хлор
2.В каком ряду химические элементы расположены в порядкеувеличения числа валентных электронов?
П, Ве, В3)К,На,П8, Р, С4) С, 81, Се
3.Наименьшей окислительной активностью обладает
1) Р2)Аs3) Вi4) SЬ
4.В ряду оксидов Na2O → MgO → SO2 свойства изменяются откислотных к амфотернымамфотерных к основным
основных к кислотным
кислотных к основным
5- В ряду химических элементов S → P → Si
1) увеличивается число валентных электронов в атомах
2)уменьшается число валентных электронов в атомах
3)возрастает число протонов в ядрах атомов
4)уменьшаются радиусы атомов
6.Изменение свойств от металлических к неметаллическимпроисходит в ряду
1)Мg->А1-» Si3) Ва->Мg->Са.
2)С->В->Li4)Р->S1->А1
7.Летучее водородное соединение состава ЭН3 образуют всеэлементы
УА группы3) IV периода
ША группы4) II периода
8.
 В ряду гидроксидов Н2С03 -» Н2SiO3 -> Н2РЬ03
В ряду гидроксидов Н2С03 -» Н2SiO3 -> Н2РЬ03основные свойства ослабевают и усиливаются кислотные свойства
свойства изменяются от амфотерных к кислотнымусиливаются восстановительные свойства
основные свойства растут.
Вариант 4
1.В каком ряду химические элементы расположены в порядкеубывания их атомных радиусов?
1) К, С, В3) Nа, Мg, К
2)К,Р,Аs4)S1,С,N
2.В каком ряду химические элементы расположены в порядкеувеличения числа валентных электронов?
1)Li, Na, К 3)Вг,S,S12)А1,S,С1 4)N,0,F
3.В каком ряду химические элементы расположены в порядкеусиления неметаллических свойств?
1)S1->S->С13)N-ч>Р->Аs
2)О -> S -> Sе4) S-> Р -> S1
4.В ряду оксидов Li20 -» ВеО -> В203 свойства изменяются откислотных к амфотернымамфотерных к основным
основных к кислотным
кислотных к основным
5.В ряду химических элементов Li2O —> Ве —> В2O3
увеличивается число валентных электронов в атомах
уменьшается число валентных электронов в атомах
уменьшается число протонов в ядрах атомов
увеличиваются радиусы атомов
6.Изменение свойств от металлических к неметаллическимпроисходит в ряду
1) Li -> Ве→ О3) Bг-> Мg -> Са2)S1->А1->Nа4)Р→Si→А1
7.Элемент образует летучее водородное соединение состава КН.Формула его высшего оксида:
1)R022)R2053)RОз4)R207
8.В каком ряду химические элементы расположены в порядкеусиления неметаллических свойств?
Аs -> Р -> N.3) Р -> S1 -» А1
О → S -> Sе4) С -> В -> ВеВариант 5
1.Наименьший радиус атома имеет атом с электронной кон-фигурацией
1)2; 8; 32) 2; 8; 63) 2; 8; 84) 2; 8; 1
2.В каком ряду уменьшается число валентных электронов?
1)Li,Na,К3)Вг, S,S1
2)А1, S, С14) N, О, Вг3.В каком ряду химические элементы расположены в порядкеусиления неметаллических свойств?
1)N →Р→Аs3)S1->Р->8
2)0->S->Sе4)С1->S->.
 Р
Р4.В ряду оксидов К20 —> СаО -> Вг207 свойства изменяются откислотных к амфотернымамфотерных к основным
основных к кислотным
кислотных к основным
5.В ряду химических элементов N —> Р —> Si
увеличивается число энергетических уровней в атомах
усиливаются металлические свойства элементов
уменьшается высшая степень окисления элементов
ослабевают металлические свойства элементов
6.Изменение свойств от неметаллических к металлическимпроисходит в ряду
1)Мg->А1 Si3)Ва->Мg->Са2)С->В->Li4)Р->Si->А1
7.Элемент образует летучее водородное соединение составаКН3. Формула его высшего оксида:
1)R022) R2053)RОэ4) R2О7
8.В каком ряду химические элементы расположены в порядкеусиления неметаллических свойств?
1)N->Р→Аs3)Р->Si->А1
2)0→S->Sе4)Ве→В->С
Вариант б1.Наименьший радиус атома имеет атом с электронной кон-фигурацией
1)2; 8; 53) 2; 8; 1
2)2; 8; 74) 2; 8; 8; 1
2.В каком ряду химические элементы расположены в порядкеувеличения числа валентных электронов?
1) Nа, В, С3) F, C, Li
2)Sе, S,0 4) К, Са, Ва3.В каком ряду химические элементы расположены в порядкеусиления металлических свойств?
Вг -> Sе -> К3) N -> Li →СМg -> А1 -> Si4) S -> С1 → Р4.Свойства оксидов в ряду ВеО -> С02 -> М205 изменяются отамфотерных к кислотным
основных к кислотным
амфотерных к основным
кислотных к основным
5.В ряду химических элементов Те -> Sе -> S
увеличивается число энергетических уровней в атомах
усиливаются металлические свойства элементов
уменьшается высшая степень окисления элементов
ослабевают металлические свойства элементов
6.Изменение свойств от амфотерных к неметаллическим про-исходит в ряду
1) Мg -> А1 -> Si3) С -> В -> 1л
2)Ве → В->С4)Nа->А1->Si
7.Химическому элементу соответствует высший оксид составаКО. Электронная конфигурация внешнего энергетического уровня атома этого элемента
1) ns2 nр12) ns2.
 3) ns2nр34) ns2nр2
3) ns2nр34) ns2nр28.В ряду химических элементов Rd -> К -> Nа
усиливаются металлические свойства
ослабевают восстановительные свойства
уменьшается электроотрицательностьвозрастает высшая степень окисления в оксидах
Вариант 7
1.Наименьший радиус имеет атом с электронной конфигурацией
1s22s22р63s23р13) 1s22s22р63s23р3
1s22s22р63s23р24) 1s22s22р63s23р4
2.В каком ряду химические элементы расположены в цорядкеувеличения числа валентных электронов?
углерод, азот, фтор
натрий, кремний, хлор
хлор, бром, йод
калий, сера, кремний
3.В каком ряду химические элементы расположены в порядкеусиления металлических свойств?
1)F →Вг→I3)Ва->Са->Ве2) К -> Nа →Li4) Fе -> Zn-> Си
4.Свойства оксидов в ряду А1203 —> SiO2 →Р205 изменяются отамфотерных к кислотным
основных к кислотным
амфотерных к основным
кислотных к основным
5.Какую электронную конфигурацию имеет атом наиболееактивного металла?
1)3s23р13)4s1
2)3s24)3s23р2
6.Изменение свойств от амфотерных к неметаллическим происходит в ряду
1)К->Са->Вг3)С-»В-»Li
2)А1->Р->С1 4)Nа->А1->Si
7.Химическому элементу соответствует высший оксид составаR203. Электронная конфигурация внешнего энергетического уровня атома этого элемента
1) ns2 nр12) ns23) ns2nр34) ns2nр2
8.Наибольшей окислительной активностью обладает
1)Р2)Аs3) Вi4)SЪ
Вариант 8
1.Наименьший радиус имеет атом с электронной конфигурацией
1s22s22р63s23р13) 1s22s22р63s23р6
1s22s22р63s23р64814) 1s22s22р63s23р4
2.У какого элемента наиболее выражены металлические свойства?
1)Li2) Fе3)Nа4) Мg3.В каком ряду химические элементы расположены в порядкеослабления неметаллических свойств?
Rd -> К -> Nа3) Мg -> А1 -» Si
А1 -> Si -> Р4) С1 -> S -> Р
4.Свойства оксидов в ряду Na2O -> А1203 -» С1207 изменяются отамфотерных к кислотным
основных к кислотным
амфотерных к основным
кислотных к основным
5.
 Высшая степень окисления в ряду химических элементовхлор — бром — йод
Высшая степень окисления в ряду химических элементовхлор — бром — йодувеличивается
не изменяется
уменьшается
изменяется периодически
6.В главных подгруппах периодической системы восстанови-тельная способность атомов химических элементов усиливается с
увеличением радиуса атомов
уменьшением радиуса атомов
увеличением числа электронов на внешнем энергетическом уровне
увеличением числа нейтронов в ядре
7.В ряду гидроксидов А1(ОН)3 → Мg(ОН)2 —> NаОН свойствагидроксидов изменяются от
основных к кислотным
амфотерных к кислотным
кислотных к амфотернымамфотерных к основным
8.В каком ряду химические элементы расположены в порядкеувеличения числа валентных электронов?
1)Ве, В, С3)К,Nа,Li
2) S, Р, С4) С, Si, Gе
Тест №3
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Вариант 1
1. Какое из указанных веществ имеет ковалентную полярную связь?
1)Р42)СаS3)НI4) ВаВг2
2.Какое из указанных веществ имеет ковалентную неполярную связь?
1)Н202) S83)СаН24) С2Н6
3.Какое из указанных веществ имеет ионную связь?
1)LiС12)НВг3)024) СО
4.Одинаковый вид химической связи имеют углекислый газ и
1) белый фосфор3) кремний
2)ацетилен4) кислород
5.Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) фтор и хлорид калия 2)водород и хлор
сера и водород
вода и кислород
6.Ионная связь характерна для каждого из двух веществ:
негашеная известь, каменная соль
озон, железняк
сероводород, аммиак
метан, бронза
7.В молекуле оксида азота (I) химические связи1) ионные
водородные
ковалентные неполярные
ковалентные полярные
8.Какое из указанных веществ имеет металлическую связь?
1)Zn2)S3)С 4)КН
Вариант 2
1.Какое из указанных веществ имеет ковалентную полярнуюсвязь?
1)СН42) S83) СиО4) Zn
2.Какое из указанных веществ имеет ковалентную неполярную связь?
1) Н22) С1203) РС134) Мg0
3.
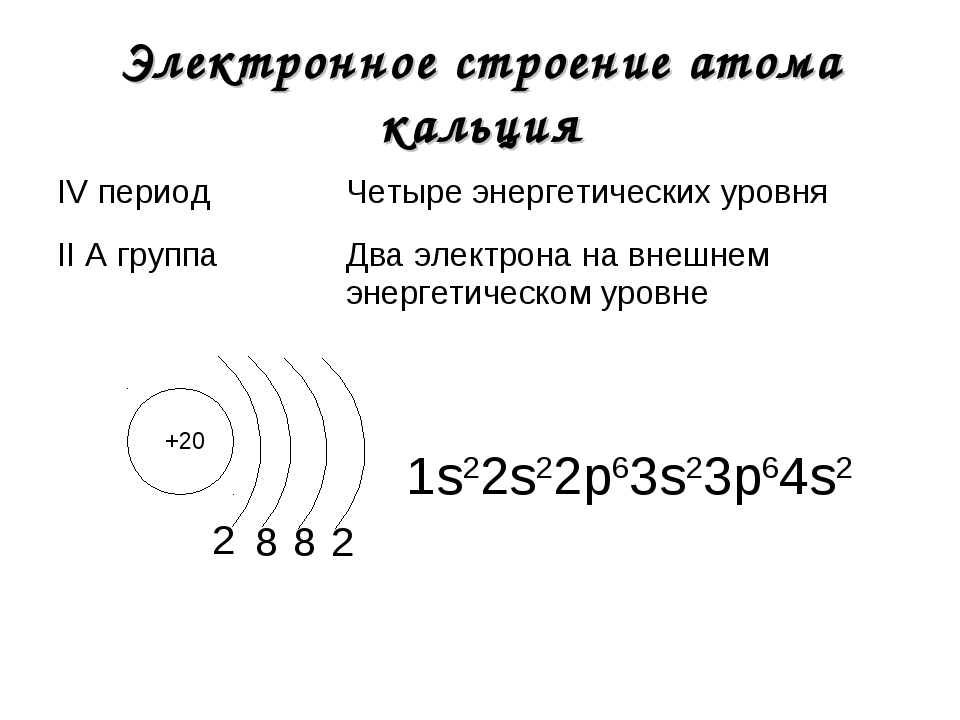 Какое из указанных веществ имеет ионную связь?
Какое из указанных веществ имеет ионную связь?1)Мg2)NO3)Сu3Zn24) СаS
4.Одинаковый вид химической связи имеют бромид кальция и
бром3) оксид азота (I)
оксид калия4) оксид кремния (IV)
5.Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) хлор и бромид натрия 2)водород и хлор
3)алмаз и водород4)вода и кислород
6.Какой вид химической связи в молекуле метана?
ковалентная полярная
ковалентная неполярная
ионная
металлическая
7.В соединении фтора с кальцием химическая связь
ковалентная полярная
ковалентная неполярная
ионная
металлическая
8.Веществами с ионной и ковалентной неполярной связьюявляются соответственно
азот и озон
оксид азота (1) и озон
хлорид натрия и азот
азот и сульфат кальция
Вариант 3
1. Какое из указанных веществ имеет ковалентную полярную связь?
1)Н202)КF3) 034) Fе
2.Какое из указанных веществ имеет ковалентную неполярную связь?
1) SOз2) К2С23)Аg4)Р43.Ионная связь характерна дляоксида кремния3) магния
бромида калия4) сероводорода
4.Веществами с ионной и ковалентной полярной связью являются соответственно
этилен и сульфид меди
оксид натрия и сероводород
бром и водород 4)сера и вода
5.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
карбид кальция и графит
метан и алмаз
фосфор и фосфинхлорид натрия и хлор
6.Какой вид химической связи в молекуле воды?
ковалентная полярная
ковалентная неполярная
ионная
металлическая
7.В оксидах металлов связи
1) ионные 2) ковалентные полярные
металлические
ковалентные неполярные
8.Ионная связь характерна для каждого из двух веществ:
нитрид кальция и сульфид натрия
углекислый газ и ацетилен
бензол и бромид натрия
сероводород и бромид алюминия
Вариант 4
1.Вещество с ковалентной полярной связью имеет формулу
1)Н2S2)NаС1 3) 034) Li2S04
2.Какое из указанных веществ имеет ковалентную неполярную связь?
1) фосфор3) спирт
2) метан 4) известь
3.Какое из указанных веществ имеет металлическую связь?
1)Н22)Р2053)А14)МgО
4.Веществами с ионной и ковалентной полярной связью являются соответственно
сероводород и фторид цезия
хлорид натрия и кислород
фосфид кальция и оксид азота (IV)
кислород и озон
5.Соединениями с ковалентной неполярной и ионной связьюявляется соответственно
1)02и Nа3N3)02иНВг
2)02иNН34)03иS8 .
6.В хлориде натрия химические связи
ионные
ковалентные неполярные
ковалентйые полярные
водородные
7.В гидроксосоединениях неметаллов связи
ионные
ковалентные полярные
неметаллические
ковалентные неполярные
8.Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
йод и сероводород
бромоводород и азот
железо и кварц
угарный газ и оксид серы (IV)
Вариант 5
1.Вещество с ковалентной полярной связью имеет формулу
1)LiI2)Nа2S043)Р44) НВг2.Какое из указанных веществ имеет ионную связь?
1) НС12)F23) NаС14) N02
3.Какое из указанных веществ имеет металлическую связь?
1) S022) Na2С23)Аu4)Р44.Веществами с ионной и ковалентной неполярной связьюявляются соответственно
сероводород и оксид бария
хлорид натрия и кислород
фосфин и хлор
азот и озон
5.Вещества только с ковалентными полярными связями при-ведены в ряду:
1)вода, водород
метан, фосфинкарбид, известняк
хлор, йодоводород6.Какой вид химических связей в молекуле угарного газа?
ионные
ковалентные неполярные
ковалентные полярные
водородные
7.В гидроксосоединениях металлов связи
только ионные
только ковалентные полярные
как ионные, так и ковалентные неполярные
как ковалентные полярные, так и ионные
8. Одинаковый вид химической связи имеют оксид натрия и
сероводород3) сульфид кальция
натрий4) оксид серы (IV)
Вариант 6
1.Вещество с ковалентной полярной связью имеет формулу
1)Nа3N2)Р43)N204) S8
2.Какое из указанных веществ имеет ионную связь?
1)СН42)С023)024)Nа2S
3.Какое из указанных веществ имеет металлическую связь?1)Аg2) А14С33) Вг204) С
4.Веществами с ионной и ковалентной неполярной связьюявляются соответственно
1)сероводород и водород
оксид калия и кислород
аммиак и железо
оксид азота (IV) и хлор
5.Ионная связь характерна для каждого из двух веществ:
хлорид натрия и сероводород
хлорид калия и оксид углерода (IV)
оксид натрия и хлор
хлорид магния и оксид калия
6.Какой вид химических связей в молекуле углекислого газа?
ионные
ковалентные неполярные
ковалентные полярные
водородные
7.В гидрате оксида серы (VI) связи
ионные
ковалентные полярные
неметаллические
ковалентные неполярные
8. В каком ряду записаны вещества только с ионной связью?
SiO2, СаО, Nа2S04-3) НС104, С02, NаВгМg0, NaI, Сs204) Н20, А1С13,RdIВариант 7
1.Какое из указанных веществ имеет ковалентную неполярную связь?
1)МgС122) S033)РН34)Вг22.Какое из указанных веществ имеет ионную связь?
1)РН32)ВаО3)Sih54) I2
3.Одинаковый вид химической связи имеют гидрид кальция и
водород3) йод ид цезия
калий4) йодоводород4.Веществами с ионной и ковалентной неполярной связьюявляются соответственно
хлорид магния и сера
хлор и бромид кальция
йодоводород и сульфид натрия
вода и сероводород
5.Ионная связь характерна для каждого из двух веществ:
оксид калия и аммиак
сульфид калия и оксид углерода (IV)
оксид лития и бром
фторид бария и сульфид натрия
6.Какой вид химической связи в молекуле хлороводорода?
ионная
ковалентная неполярная
ковалентная полярная 4)водородная
7.Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) йодоводород и водород 2)хлороводород и кальций
озон и фосфинбелый фосфор и сероводород
8.ответственно равны:
1) +5 и -13)+7и-1
2)+5и-34)+7и_- 7
Вариант 5
1о Наибольшее значение степени окисления фосфор имеет в соединении
1)КН2Р032)Nа3Р3) Н3Р044) Р42.Степени окисления фосфора в соединениях К3Р04 и М§3Р2соответственно равны
1)+5и-3 3) +5 и +3
2)+Зи+5 4)+2и-3
3,В каких соединениях степей окисления атомов азота и фосфора равны соответственно+4 и+3?
1)N20иР2033)ЛОиР205
2) N204и Р203 4) М205 и Р203
4.Низшие степени окисления углерода и хлора соответствен-но равны
1)0и+7 3) +4и-7
2)-4и+5 4) -4 и — 1
5,Высшие степени окисления углерода и хлора соответствен-но равны
1)+2и+73)+4и+7
2) -4 и +54)+4и-1
Вариант 6
1. Наибольшее значение степени окисления азот имеет в соединении
1) HN03:2) Nа3N3) N2O 4)N2Н4
2.В соединениях РеС13 и Ре(ОН)2 степени окисления железасоответственно равны:
1)4-3 и+23)+2и+2
2) +3 и +34)+6 и 0
3.В каких соединениях атомы азота и серы имеют одинаково значение степени окисления?
1)NН3иS023)Са3N2иСиS
2)N02иН2S034)HNO3иР203
4.Высшие степени окисления азота и алюминия соответствен-но равны
1)+5и+33)-5и+3
2) 4-5 и 04) +2 и+5
5.В каких соединениях атомы азота и серы имеют одинаковоезначение степени окисления?
1)NН3иS033) Са3N2 и FеS
2) N02 и S024)N205иS03
Вариант 7
1.Степень окисления -3 фосфор проявляет в соединении
1)Н3Р032) А1Р043) Р2034) Н3Р
2.В соединениях 1МН3 и НЫ02 степени окисления азота соответственно равны
1)-3,+42)+3,+43)+4,+1 4)-3,+3
3.В каких соединениях степени окисления атомов углерода ифосфора равны соответственно +4 и +5?
1)СОиСа3Р23)СН4иР203
2)NaНС03 и НР034) Н2С03 и Р203
4.Низшие степени окисления магния и серы соответственноравны
1)+2и+63)-2и+2
2) -2 и +34) 0 и -2
5.В каких соединениях степени окисления атомов углерода ифосфора равны соответственно +4 и +5?
1)СОиСа3Р23)СН4иР205
2) С02 и Р2034) К2С03 и Р205
Тест №5
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений.
Вариант 1
1.Какое из перечисленных веществ является простым?
хлорид кальция3) аммиак
кислород4) гидропирит2.Какое из перечисленных веществ является простым?
бронза3) латунь
медный купорос4) медь
3.К сложным веществам относится
красный фосфор3) фосфорит
пластическая сера4) олово
4.Фосфористой кислоте соответствует формула
1) НР032)Н3Р04 3) Н4Р207 4) Н3Р03
5.Нитрату меди (II) соответствует формула
1) Си(N03)2 2) СиN03 3) Си(NO2)3 4) СиN02
6.К кислотным оксидам относится
оксид цинка3) оксид серебра (I)
оксид бария4) оксид хлора (VII)
7.К основным оксидам относится
оксид алюминия3) оксид железа (III)
оксид кальция4) оксид серы (VI)
8. Аллотропной модификацией серы не является
пластическая 3) коллоидная
ромбическая 4) моноклинная
Вариант 2
1.Какое из перечисленных веществ является простым?
оксид натрия3) карборунд
сера4) хлорная известь
2.Какое из перечисленных веществ является простым?
сернистый газ3) угарный газ
спирт4) ромбическая сера
3.К сложным веществам относится
глюкоза3) азот
озон4) гелий
4.Угольной кислоте соответствует формула
1)СН3СООН3)Н2С03
2)Н2SiO34)С2Н5ОН
5.Нитриту натрия соответствует формула
1) NaN022) NaN033) Nа3N4) NН3
6.К кислотным оксидам относится
фторид кислорода3) оксид железа (III)
оксид углерода (II)4) оксид хрома (VI)
7.К основным оксидам относится
1) СrO2) Сг033)А12034) Zn0
8.К слабым кислородсодержащим кислотам относится
азотистая3) азотная
серная4) ортофосфорная
Вариант 3
1. Какое из перечисленных веществ не является простым?
алмаз3) корунд
фуллерен4) графит
2.Какое из перечисленных веществ является простым?
серный ангидрид3) веселящий газ
фруктоза4) пластическая сера
3.К сложным веществам относится
1) железо3)хлор
2)водород4) купорос
4.Гидроксиду натрия соответствует формула
1) NаН2) NаОН 3) NаНС03 4) Na2С03
5.Аммиачной селитре соответствует формула
1)NаC022)NaNO)3 3) Nh5NO3 4)Nh5NO26.К кислотным оксидам относится
1) СО2) С023) Fе2Оэ4) СиО7.К амфотерным оксидам относится
оксид цинка3) оксид меди (II)
оксид магния4) оксид азота (IV)
8.К щелочам относится гидроксидуглерода (IV)3) натрия
железа (II)4) алюминия
Вариант 4
1.Какое из перечисленных веществ является простым?
серная кислота3) угарный газ
бромоводород4) алюминий
2.К сложным веществам относится
1)сера3) вода
2) озон4) кальций
3.Сероводородной кислоте соответствует формула
1)Н2S2)Н2S033)Н2S044) Н2S207
4.Гидроксиду бария соответствует формула
1)Ва(ОН)3 2)Ва(ОН)23) НBrO 4) ВаОНС1
5.Карбонату калия соответствует формула
1) СаС03 2) К2S033) К2СОэ 4) КНС03
6.К кислотным оксидам относится
1)S022)Н253)Н2S034) N0
7.К амфотерным оксидам относится
оксид железа (III)3) оксид железа (II)
оксид натрия4) оксид меди (I)
8.К кислотным оксидам относится
оксид свинца (II)3) оксид серы (IV)
оксид кальция4) оксид железа (II)
Вариант 5
1.Какое из перечисленных веществ является простым?
1) сахар2) азот3) мел4) воздух
2.К сложным веществам относится
аммиак3) водород
графит4) медь
3.Соляной кислоте соответствует формула
1) НС1 2) НСIO 3) НС1034) НС104
4.Гидроксиду бериллия соответствует формула1)Ве(0Н)2 2)В(ОН)3 3) ВеО4) Ва(ОН)2
5.Мрамору соответствует формула
1) СаС03 2) К28033) К2С03 4) КНС03
6.К основным оксидам относится
оксид железа (II)3) оксид серы (VI)
оксид углерода (IV)4) оксид фосфора (V)
7.Амфотерным и основным оксидами соответственно являются
ВаО, К2О3)S02,Na20
А1203, СаО4) Сг203, Zn0
8.К основным оксидам относится
оксид лития3) оксид серы (IV)
оксид цинка4) оксид бора
Вариант 6
1.Какое из перечисленных веществ является простым?
глюкоза3) известь
азот4) воздух
2.К сложным веществам относится
аммиак3) фтор
алмаз4) железо
3.Хлорноватистой кислоте соответствует формула
1) НС12) НСIO3)НС103 4) HCIO4
4.Сульфиду железа(И) соответствует формула
1)FеS2)Fе3043) Fе2(504)3
5.К кислотным оксидам относится
1) N02)К203)И203
6.К основным оксидам относится
оксид натрия3) оксид серы (IV)
оксид цинка4) оксид бора
7.Амфотерным и кислотным оксидами соответственно являются
1)FеО, Мg0 2) С02, S03 3)А1203,SiO2 4) СО, ZnО8. Сульфиту калия соответствует формула
1) К23,0 2) К,С033) К2303
Вариант 7
1.Какое из перечисленных веществ является простым?
белый фосфор3) известняк
мрамор4) воздух
2.К сложным веществам относится
красный фосфор3) сода
воздух4) графит
3.Азотной кислоте соответствует формула
1)НN32)NН33)НN02 4) НN03
4.Сульфиду меди (I) соответствует формула
1)СиS2)Си2S3) СиS034) СиS04
5.К кислотным оксидам относится
оксид магния3) оксид азота (I)
оксид серы (VI)4) оксид кальция
6.К основным оксидам относится
оксид магния3) оксид алюминия
ксид хлора (VII)4) оксид фосфора (V)
7.Основным и несолеобразующим оксидами соответственно
являются
оксид лития и оксид азота (I)
оксид алюминия и оксид азота (II)
оксид натрия и оксид азота (IV)
оксид хрома (II) и оксид цинка
8.Ортофосфату калия соответствует формула
1) Са3(Р04)2 2) Са(Р03)2 3) К4Р407 4) К3Р04
Предскажите формулу ионного соединения из электронной конфигурации
Электронная конфигурация двух элементов A и B —
A- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
B- 1s 2 2s 2 2p 6 3s 2 3p 5
Какова формула ионного соединения образуется между этими элементами?
Шаг 1: Определите группу
A принадлежит к группе 2, как это определено из электронной конфигурации валентной оболочки элемента.
A- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
B, как видно из электронной конфигурации валентной оболочки элемент.
B- 1s 2 2s 2 2p 6 3s 2 3p 5
Поскольку элементы группы 2 имеют низкую энтальпию ионизации, они могут легко потерять два электрона для достижения стабильного октета конфигурация.Поскольку главное квантовое число самой внешней оболочки элемента A равно 4, мы можем с уверенностью заключить, что элемент A — это кальций (Ca), принадлежащий периоду 4 периодической таблицы.
Элементы группы 7, галогены, имеют высокие отрицательные значения энтальпии усиления электронов, благодаря чему они могут принимать электроны. Из главного квантового числа валентной оболочки мы знаем, что элемент B принадлежит периоду 3 и является хлором (Cl).
Шаг 2: Предсказание стехиометрии
Поскольку один атом Ca может потерять два электрона,
Ca → Ca 2+ + 2e —
нам нужно 2 атома Cl, чтобы принять два электрона дают
2Cl + 2e — → 2Cl —
Чистая реакция:
Ca 2+ + 2 Cl — → CaCl 2 9000
Из приведенной выше реакции мы видим необходимость в одном атоме Са и двух атомах Cl для образования соединения хлорида кальция (CaCl 2 ).
Шаг 3: Выведение молекулярной формулы
Самый простой метод — это использование стратегии перекрестного умножения, в которой валентность Ca равна 2, а Cl — это та, из которой мы можем прийти к формуле CaCl 2 .
Ca 2
Cl 1
Следовательно, формула соединения: AB 2 или CaCl 2 .
Какова электронная конфигурация иона кальция
Электронная конфигурация иона кальция должна быть такой же, как и у аргона, поскольку у иона кальция отсутствуют 2 электрона.Ваш ответ. Электронная конфигурация: это распределение электронов атома по атомным орбиталям. У электрона есть два состояния: основное и возбужденное.
Электронная конфигурация иона кальция должна быть такой же, как и у аргона, поскольку у иона кальция отсутствуют 2 электрона. Ваш ответ. Электронная конфигурация: это распределение электронов атома по атомным орбиталям. У электрона есть два состояния: основное и возбужденное.
Значит его электронная конфигурация 2,8,2. В то время как атомный номер O равен 8. Его электронная конфигурация равна 2,6. Когда мы рисуем точечную структуру электронов, мы просто показываем внешний электрон вокруг атома. Ca имеет 2, в то время как O имеет 6 самых крайних электронов. б) когда кальций реагирует с кислородом, атом кальция переносит два своих внешних электрона на атом кислорода.
Сродство к электрону Энергия, выделяющаяся, когда электрон присоединяется к нейтральному атому и образуется отрицательный ион. Электроотрицательность (шкала Полинга). Тенденция атома притягивать электроны к себе, выраженная в относительной шкале.Первая энергия ионизации Минимальная энергия, необходимая для удаления электрона из нейтрального атома в его …
21 ноября, 2017 · Хлорид кальция содержит ионы кальция и хлорида. Напишите электронную конфигурацию иона кальция в основном состоянии. Химия. Таблетка Rolaids содержит карбонат кальция для нейтрализации желудочного сока. На одну таблетку Ролаидса требуется 44,55 мл 0,448 М соляной кислоты для преобразования карбоната кальция в хлорид кальция, диоксид углерода и воду.
Электронные конфигурации.Принцип исключения Паули гласит, что все электроны в атоме должны иметь уникальный кальций, как и все металлы группы 2, отбрасывает 2 электрона для образования иона кальция (Ca2 +) и представляет собой целую серию изоэлектронных частиц. Все следующие ионы имеют одинаковые точные …
Периодическая таблица »Стронций» Электронная конфигурация. Стронций. Полная электронная конфигурация стронция: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2. рубидий …
Кальций (Ca) находится в той же группе, что и магний, и может терять и то, и другое. валентные электроны с образованием иона C a 2 + с 18 электронами и электронной конфигурацией 1 с 2 2 с 2 2 p 6 3 s 2 3 p 6.
Ионные свойства могут использоваться химиками для различных целей. Ионообменная хроматография, например, основана на сродстве молекул. Батареи имеют два электрода из проводящего материала, катод, который является положительным концом, куда уходит электрический ток / входят электроны …
В соединении фторид натрия, NaF, атом натрия теряет один электрон, а атом фтора получает один электрон с образованием ионов, имеющих электронную конфигурацию, подобную a.гелий b. кислород c. неон d. кальций
13 июня 2014 г. · Кальций в элементарном состоянии состоит всего из 20 электронов. Таким образом, Ca 2+ имеет в общей сложности 18 электронов. В предложенных вариантах ответа вариант B — единственная электронная конфигурация, которая содержит 18 электронов, что делает B правильным ответом.
Конфигурация основного состояния будет представлять собой устройство с наименьшей энергией. 1.) Na 2.) Pb 3.) Sr 4.) U 5.) N 6.) Ag 7.) Ti 8.) Ce 9.) Cl 10.) Hg. Напишите конфигурацию электронов в основном состоянии для этих ионов.Ионы — это электрически заряженные частицы. Атомы становятся ионами, когда теряют (катионы) или приобретают (анионы) электроны.
Электронная конфигурация калия: K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1. Калий имеет аргоновое ядро плюс 4s 1. В сокращенном методе для электронных конфигураций используется набор квадратных скобок [] вокруг химического символа. благородного газа. Сокращенная электронная конфигурация калия: K [Ar] 4s 1. Хлор имеет неоновую сердцевину.
Таким образом, в этом случае полная электронная конфигурация выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10, таким образом заполняя 4-ю оболочку, а не начиная 5-ю, поэтому 5s орбитали нет.
Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон. В результате потери отрицательно заряженного электрона они становятся положительно заряженными ионами. Когда атом теряет электрон, чтобы стать положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например …
Оксалат кальция нерастворим в воде, но растворим в минеральных кислотах. Ca 2+ + (COO) 2 (NH 4) 2 → (COO) 2 Ca + NH 4 + Sr 2+ Ионы стронция осаждаются растворимыми сульфатными солями.Sr 2+ + Na 2 SO 4 → SrSO 4 + 2Na + Все ионы щелочноземельных металлов образуют белый осадок с карбонатом аммония в присутствии хлорида аммония и аммиака.
Когда Na теряет электрон, он удаляет свой электрон 3s1, и его валентность становится 2p6 и принимает конфигурацию Неона. Px, Py, Pz имеют парные электроны. Когда Ca теряет электрон, он становится Ca + и принимает электронную конфигурацию Na и имеет валентность 3s1 (неспаренное 3s орибтал).
В случае бора, который имеет электронную конфигурацию 1s 2 2s 2 2p 1, 2s-электроны экранируют электрон с более высокой энергией 2p от ядра, облегчая его удаление.Аналогичный эффект происходит с алюминием, электронная конфигурация которого 1s 2 2s 2 2p 6 3s 2 3p 1.
Размеры атомов и ионов
Хотя некоторые люди попадают в ловушку, визуализируя атомы и ионы в виде маленьких твердых сфер. Подобно миниатюрным мячам для настольного тенниса или шарикам, квантово-механическая модель говорит нам, что их формы и границы гораздо менее определенны, чем предполагают эти изображения. В результате нельзя сказать, что атомы и ионы имеют точные размеры. В этом разделе мы обсудим, как определяются и получаются атомные и ионные «размеры».
Атомные радиусы
Вспомните из главы 6 «Строение атомов», что вероятность найти электрон на различных доступных орбиталях медленно падает с увеличением расстояния от ядра. Эта точка проиллюстрирована на рисунке 7.4 «Графики радиальной вероятности как функции расстояния от ядра для He, Ne и Ar», где показан график полной электронной плотности для всех занятых орбиталей для трех благородных газов как функции их расстояние от ядра.Электронная плотность постепенно уменьшается с увеличением расстояния, что делает невозможным провести резкую линию, обозначающую границу атома.
Рис. 7.4 Графики радиальной вероятности как функции расстояния от ядра для He, Ne и Ar
В He 1 s электронов имеют максимальную радиальную вероятность на расстоянии ≈30 пм от ядра. В Ne 1 s электронов имеют максимум при ≈8 пм, а 2 s и 2 p электронов вместе образуют еще один максимум при ≈35 пм (оболочка n = 2).В Ar 1 s электронов имеют максимум при ≈2 пм, 2 s и 2 p электронов вместе образуют максимум при ≈18 пм, а 3 s и 3 p электронов объединить, чтобы сформировать максимум в ≈70 pm.
Рисунок 7.4 «Графики радиальной вероятности как функции расстояния от ядра для He, Ne и Ar» также показывает, что существуют различные пики в общей электронной плотности на определенных расстояниях, и что эти пики возникают на разных расстояниях от ядра. для каждого элемента.Каждый пик на данном графике соответствует концентрации электронов в данной основной оболочке. Поскольку гелий имеет только одну заполненную оболочку ( n = 1), он показывает только один пик. Напротив, неон с заполненными n = 1 и 2 основными оболочками имеет два пика. Аргон с заполненными n = 1, 2 и 3 основными оболочками имеет три пика. Пик для заполненной оболочки n = 1 возникает на последовательно более коротких расстояниях для неона ( Z = 10) и аргона ( Z = 18), поскольку при большем количестве протонов их ядра заряжены более положительно, чем что гелия.Поскольку оболочка 1 s 2 находится ближе всего к ядру, ее электроны очень плохо экранируются электронами в заполненных оболочках с большими значениями n . Следовательно, два электрона в оболочке n = 1 испытывают почти полный ядерный заряд, что приводит к сильному электростатическому взаимодействию между электронами и ядром. Энергия оболочки n = 1 также сильно уменьшается (заполненная орбиталь 1 s становится более стабильной) по мере увеличения заряда ядра.По тем же причинам заполненная оболочка n = 2 в аргоне расположена ближе к ядру и имеет меньшую энергию, чем оболочка n = 2 в неоне.
Рисунок 7.4 «Графики радиальной вероятности как функции расстояния от ядра для He, Ne и Ar» иллюстрирует сложность измерения размеров отдельного атома. Однако, поскольку расстояния между ядрами в парах ковалентно связанных атомов можно измерить довольно точно, химики используют эти расстояния как основу для описания приблизительных размеров атомов.Например, известно, что межъядерное расстояние в двухатомной молекуле Cl 2 составляет 198 пм. Мы назначаем половину этого расстояния каждому атому хлора, придавая хлору ковалентный атомный радиус ( r cov ). Половина расстояния между ядрами двух одинаковых атомов, соединенных ковалентной связью в одной и той же молекуле. 99 пм или 0,99 Å (часть (а) на Рисунке 7.5 «Определения атомного радиуса»).
Рисунок 7.5 Определения атомного радиуса
(a) Ковалентный атомный радиус, r cov , составляет половину расстояния между ядрами двух одинаковых атомов, соединенных ковалентной связью в одной и той же молекуле, такой как Cl 2 .(b) Металлический атомный радиус, r met , составляет половину расстояния между ядрами двух соседних атомов в чистом твердом металле, таком как алюминий. (c) Ван-дер-Ваальсовский атомный радиус, r vdW , составляет половину расстояния между ядрами двух одинаковых атомов, таких как аргон, которые плотно упакованы, но не связаны. (d) Это изображение ковалентного радиуса в сравнении с ван-дер-ваальсовым радиусом хлора.
В аналогичном подходе мы можем использовать длины одинарных углерод-углеродных связей в органических соединениях, которые удивительно однородны при 154 пм, чтобы присвоить значение 77 пм в качестве ковалентного атомного радиуса для углерода.Если эти значения действительно отражают фактические размеры атомов, то мы сможем предсказать длину ковалентных связей, образованных между различными элементами, путем их сложения. Например, мы могли бы спрогнозировать расстояние углерод-хлор 77 пм + 99 пм = 176 пм для связи C-Cl, что очень близко к среднему значению, наблюдаемому во многих хлорорганических соединениях.
Ковалентные атомные радиусы могут быть определены для большинства неметаллов, но как химики получают атомные радиусы для элементов, которые не образуют ковалентных связей? Для этих элементов было разработано множество других методов.Для металла, например, металлический атомный радиус ( r соответствует ) Половина расстояния между ядрами двух соседних атомов металла. определяется как половина расстояния между ядрами двух соседних атомов металла (часть (b) на Рисунке 7.5 «Определение атомного радиуса»). Для таких элементов, как благородные газы, большинство из которых не образуют стабильных соединений, мы можем использовать так называемый атомный радиус Ван-дер-Ваальса ( r vdW ). Половина межъядерного расстояния между двумя несвязанными атомами в твердом теле., что составляет половину межъядерного расстояния между двумя несвязанными атомами в твердом теле (часть (c) на рисунке 7.5 «Определение атомного радиуса»). Атом, такой как хлор, имеет как ковалентный радиус (расстояние между двумя атомами в молекуле Cl 2 ), так и радиус Ван-дер-Ваальса (расстояние между двумя атомами Cl в разных молекулах, например, в Cl 2 ). (s) при низких температурах). Эти радиусы обычно не совпадают (часть (d) на Рисунке 7.5 «Определения атомного радиуса»).
Периодические тенденции атомных радиусов
Поскольку невозможно измерить размеры металлических и неметаллических элементов с помощью какого-либо одного метода, химики разработали самосогласованный способ вычисления радиусов атомов с использованием квантово-механических функций, описанных в главе 6 «Структура атомов». Хотя значения радиусов, полученные с помощью таких вычислений, не идентичны ни одному из экспериментально измеренных наборов значений, они действительно позволяют сравнить внутренние размеры всех элементов и ясно показывают, что размер атома изменяется периодическим образом (Рисунок 7.6 «График периодического изменения радиуса атома с атомным номером для первых шести строк периодической таблицы»). В периодической таблице атомные радиусы уменьшаются слева направо по строке и увеличиваются сверху вниз по столбцу. Из-за этих двух тенденций самые большие атомы находятся в нижнем левом углу периодической таблицы, а самые маленькие — в верхнем правом углу (Рисунок 7.7 «Расчетные атомные радиусы (в пикометрах)»).
Рисунок 7.7 Расчетные атомные радиусы (в пикометрах) s -, p — и d -элементы блока
Размеры кружков показывают относительные размеры атомов. Расчетные значения основаны на квантово-механических волновых функциях.
Обратите внимание на узор
Атомные радиусы уменьшаются слева направо по строке и увеличиваются сверху вниз по столбцу.
Тенденции в размерах атомов являются результатом различий в эффективных ядерных зарядах ( Z eff ) , которые испытывают электроны на крайних орбиталях элементов.Как мы описали в главе 6 «Структура атомов», для всех элементов, кроме H, эффективный ядерный заряд всегда на меньше, чем на , чем фактический ядерный заряд из-за эффектов экранирования. Чем больше эффективный заряд ядра, тем сильнее внешние электроны притягиваются к ядру и тем меньше атомный радиус.
Атомы во втором ряду периодической таблицы (от Li до Ne) иллюстрируют эффект защиты от электронов. (Для получения дополнительной информации о защите от электронов см. Главу 6 «Строение атомов», раздел 6.5 «Атомные орбитали и их энергии» и рис. 6.29 «Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома».) Все они имеют заполненную внутреннюю оболочку, но при переходе слева направо через ряд , заряд ядра увеличивается с +3 до +10. Хотя электроны добавляются к орбиталям 2 s и 2 p , электронов в одной и той же основной оболочке не очень эффективно экранируют друг друга от ядерного заряда . Таким образом, единичный электрон 2 s в литии испытывает эффективный ядерный заряд приблизительно +1, потому что электроны в заполненной оболочке 1 s 2 эффективно нейтрализуют два из трех положительных зарядов в ядре.(Более подробные расчеты дают значение Z eff = +1,26 для Li.) Напротив, два электрона 2 s в бериллии не очень хорошо экранируют друг друга, хотя заполненные 1 s 2 Оболочка эффективно нейтрализует два из четырех положительных зарядов ядра. Это означает, что эффективный заряд ядра, испытываемый 2 s электронами в бериллии, находится между +1 и +2 (расчетное значение +1,66). Следовательно, бериллий значительно меньше лития.Точно так же, когда мы проходим через ряд, возрастающий заряд ядра не нейтрализуется эффективно электронами, добавляемыми к 2 s и 2 p орбиталям. Результатом является неуклонное увеличение эффективного заряда ядра и неуклонное уменьшение размера атома.
Увеличение размера атома по столбцу также происходит из-за электронного экранирования, но ситуация более сложная, потому что главное квантовое число n непостоянно.Как мы видели в главе 6 «Структура атомов», размер орбиталей увеличивается по мере увеличения n , при условии, что ядерный заряд остается прежним . В группе 1, например, размер атомов существенно увеличивается вниз по столбцу. На первый взгляд может показаться разумным приписать этот эффект последовательному добавлению электронов к орбиталям нс с возрастающими значениями n . Однако важно помнить, что радиус орбитали сильно зависит от заряда ядра.По мере того, как мы спускаемся вниз по столбцу элементов группы 1, главное квантовое число n увеличивается с 2 до 6, но заряд ядра увеличивается с +3 до +55! Если бы крайние электроны в цезии испытали полный ядерный заряд +55, атом цезия был бы действительно очень маленьким. Фактически, эффективный заряд ядра, ощущаемый крайними электронами в цезии, намного меньше, чем ожидалось (6, а не 55). Это означает, что цезий с конфигурацией валентных электронов 6 s 1 намного больше лития с конфигурацией валентных электронов 2 s 1 .Эффективный ядерный заряд относительно мало изменяется от лития к цезию, потому что электронов в заполненных внутренних оболочках очень эффективно экранируют электроны во внешних оболочках от ядерного заряда . Несмотря на то, что цезий имеет ядерный заряд +55, в нем 54 электрона 1 с 2 2 с 2 2 p 6 3 с 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 оболочки, сокращенно [ Xe] 5 s 2 4 d 10 5 p 6 , которые эффективно нейтрализуют большинство из 55 положительных зарядов в ядре.Та же самая динамика отвечает за неуклонное увеличение размера, наблюдаемое при спуске по другим столбцам периодической таблицы. Обычно неоднородности можно объяснить вариациями эффективного заряда ядра.
Обратите внимание на узор
Электроны в одной и той же основной оболочке не очень эффективно экранируют друг друга от ядерного заряда, тогда как электроны в заполненных внутренних оболочках очень эффективно защищают электроны во внешних оболочках от ядерного заряда.
Пример 2
На основе их положения в периодической таблице расположите эти элементы в порядке увеличения атомного радиуса: алюминий, углерод и кремний.
Дано: три элемента
Запрошено: расположить в порядке увеличения атомного радиуса
Стратегия:
A Определите расположение элементов в периодической таблице.Определите относительные размеры элементов, расположенных в одном столбце, по их главному квантовому числу n . Затем определите порядок элементов в одном ряду по их эффективным ядерным зарядам. Если элементы не находятся в одном столбце или строке, используйте попарные сравнения.
B Перечислите элементы в порядке увеличения атомного радиуса.
Решение:
A Не все эти элементы находятся в одном столбце или строке, поэтому мы должны использовать попарные сравнения.Углерод и кремний находятся в группе 14, причем углерод расположен выше, поэтому углерод меньше кремния (C Упражнение В соответствии с их положением в периодической таблице расположите эти элементы в порядке увеличения размера: кислород, фосфор, калий и сера. Ответ: O Как вы узнали из главы 2 «Молекулы, ионы и химические формулы», ионные соединения состоят из регулярных повторяющихся массивов чередующихся катионов и анионов. Хотя невозможно напрямую измерить ионный радиус по той же причине, что невозможно напрямую измерить радиус атома, — — возможно измерить расстояние между ядрами катиона и соседнего аниона в ионном соединении до определить ионный радиус Радиус катиона или аниона.одного или обоих. Как показано на рисунке 7.8 «Определение ионного радиуса», межъядерное расстояние соответствует сумме и радиусов катиона и аниона. Были разработаны различные методы пропорционального разделения экспериментально измеренного расстояния между меньшим катионом и большим анионом. Эти методы производят наборы ионных радиусов, которые внутренне согласованы от одного ионного соединения к другому, хотя каждый метод дает немного разные значения. Например, радиус иона Na + по существу одинаков в NaCl и Na 2 S, если для его измерения используется один и тот же метод.Таким образом, несмотря на незначительные различия в методологии, можно наблюдать определенные тенденции. Рисунок 7.8 Определение ионного радиуса (a) Межъядерное расстояние распределяется между соседними катионами и анионами в ионной структуре, как показано здесь для Na + и Cl — в хлориде натрия. (b) Это изображение контуров электронной плотности для одной плоскости атомов в структуре NaCl показывает, как линии соединяют точки с одинаковой электронной плотностью.Обратите внимание на относительные размеры контурных линий электронной плотности вокруг Cl — и Na + . Сравнение ионных радиусов с атомными радиусами (рис. 7.9 «Ионные радиусы (в пикометрах) наиболее распространенных состояний окисления») показывает, что катион всегда меньше, чем его родительский нейтральный атом, а анион всегда больше, чем родительский нейтральный атом . Когда один или несколько электронов удаляются из нейтрального атома, происходят две вещи: (1) отталкивание между электронами в одной и той же основной оболочке уменьшается, потому что присутствует меньше электронов, и (2) эффективный ядерный заряд, ощущаемый оставшимися электронами, увеличивается, потому что существует меньше электронов, чтобы экранировать друг друга от ядра.Следовательно, размер области пространства, занятой электронами, уменьшается (сравните Li при 167 мкм с Li + при 76 мкм). Если различное количество электронов может быть удалено для образования ионов с разными зарядами, ион с наибольшим положительным зарядом будет наименьшим (сравните Fe 2+ при 78 пм с Fe 3+ при 64,5 пм). И наоборот, добавление одного или нескольких электронов к нейтральному атому вызывает увеличение электрон-электронного отталкивания и уменьшение эффективного заряда ядра, поэтому размер области вероятности увеличивается (сравните F при 42 пм с F — при 133 пм). Рисунок 7.9 Ионные радиусы (в пикометрах) наиболее распространенных состояний окисления s -, p — и d -элементы блока Серые кружки указывают размеры показанных ионов; цветные кружки указывают размеры нейтральных атомов, ранее показанные на Рисунке 7.7 «Расчетные атомные радиусы (в пикометрах)». Источник: данные о ионном радиусе от Р. Д. Шеннона, «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах», Acta Crystallographica 32, no.5 (1976): 751–767. Катионы всегда меньше нейтрального атома, а анионы всегда больше. Поскольку большинство элементов образуют либо катион, либо анион, но не оба сразу, существует мало возможностей для сравнения размеров катиона и аниона, полученного из одного и того же нейтрального атома. Однако некоторые соединения натрия содержат ион Na — , что позволяет сравнить его размер с размером гораздо более известного иона Na + , который содержится в многих соединениях.Радиус натрия в каждом из трех известных состояний окисления приведен в таблице 7.2 «Экспериментально измеренные значения радиуса натрия в трех его известных состояниях окисления». Все три вида имеют заряд ядра +11, но они содержат 10 (Na + ), 11 (Na 0 ) и 12 (Na — ) электронов. Ион Na + значительно меньше, чем нейтральный атом Na, потому что электрон 3 s 1 был удален, давая замкнутую оболочку с n = 2.Ион Na — больше, чем родительский атом Na, потому что дополнительный электрон создает конфигурацию валентных электронов 3 s 2 , в то время как заряд ядра остается прежним. Таблица 7.2 Экспериментально измеренные значения радиуса натрия в трех известных состояниях окисления Ионные радиусы следуют той же вертикальной тенденции, что и атомные радиусы; то есть для ионов с одинаковым зарядом ионный радиус увеличивается при движении вниз по столбу. Причина та же, что и для атомных радиусов: экранирование заполненными внутренними оболочками приводит к небольшому изменению эффективного ядерного заряда, ощущаемого крайними электронами.Опять же, главные оболочки с большими значениями n находятся на все больших расстояниях от ядра. Поскольку элементы в разных столбцах имеют тенденцию образовывать ионы с разными зарядами, невозможно сравнивать ионы с одинаковым зарядом в строке периодической таблицы. Вместо этого элементы, которые находятся рядом друг с другом, имеют тенденцию образовывать ионы с одинаковым количеством электронов, но с разными общими зарядами из-за их разных атомных номеров. Такой набор разновидностей известен как изоэлектронная серия — группа ионов или атомов и ионов, которые имеют одинаковое количество электронов и, следовательно, одинаковую электронную конфигурацию в основном состоянии.. Например, изоэлектронный ряд частиц с конфигурацией закрытой оболочки неона (1 s 2 2 s 2 2 p 6 ) показан в таблице 7.3 «Радиус ионов с неоном. Электронная конфигурация с замкнутой оболочкой ». Размеры ионов этого ряда плавно уменьшаются от N 3− до Al 3+ . Все шесть ионов содержат 10 электронов на орбиталях 1 s , 2 s и 2 p , но заряд ядра изменяется от +7 (N) до +13 (Al).По мере того как положительный заряд ядра увеличивается, а количество электронов остается неизменным, возникает большее электростатическое притяжение между электронами и ядром, что вызывает уменьшение радиуса. Следовательно, ион с наибольшим зарядом ядра (Al 3+ ) является наименьшим, а ион с наименьшим зарядом ядра (N 3−) наибольшим. Один член этого изоэлектронного ряда не указан в Таблице 7.3 «Радиус ионов с неоновой электронной конфигурацией с закрытой оболочкой»: атом неона.Поскольку неон не образует ковалентных или ионных соединений, его радиус трудно измерить. Таблица 7.3 Радиус ионов с неоновой электронной конфигурацией с закрытой оболочкой Источник: Р. Д. Шеннон, «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах», Acta Crystallographica 32, no. 5 (1976): 751–767. В зависимости от их положения в периодической таблице расположите эти ионы в порядке увеличения радиуса: Cl — , K + , S 2− и Se 2−. Дано: четыре иона Запрошено: заказать по увеличению радиуса Стратегия: A Определите, какие ионы образуют изоэлектронный ряд. Для этих ионов предскажите их относительные размеры на основе их ядерных зарядов. Для ионов, которые не образуют изоэлектронный ряд, определите их положение в периодической таблице. B Определите относительные размеры ионов на основе их главных квантовых чисел n и их положения в строке. Решение: A Мы видим, что S и Cl находятся справа от третьей строки, а K и Se находятся в дальнем левом и правом концах четвертой строки соответственно. K + , Cl – и S 2– образуют изоэлектронный ряд с электронной конфигурацией [Ar] с замкнутой оболочкой; то есть все три иона содержат 18 электронов, но имеют разные заряды ядер. Поскольку K + имеет наибольший заряд ядра ( Z = 19), его радиус наименьший, а у S 2- с Z = 16 наибольший радиус.Поскольку селен находится непосредственно под серой, мы ожидаем, что ион Se 2- будет даже больше, чем S 2-. B Следовательно, заказ должен быть следующим: K + Упражнение В зависимости от их положения в периодической таблице расположите эти ионы в порядке увеличения размера: Br — , Ca 2+ , Rb + и Sr 2+ . Ответ: Ca 2+ Было разработано множество методов для измерения размера отдельного атома или иона.Ковалентный атомный радиус ( r cov ) составляет половину межъядерного расстояния в молекуле с двумя идентичными атомами, связанными друг с другом, тогда как металлический атомный радиус ( r met ) определяется как половина расстояния между ядрами двух соседних атомов в металлическом элементе. Радиус Ван-дер-Ваальса ( r vdW ) элемента составляет половину межъядерного расстояния между двумя несвязанными атомами в твердом теле.Радиусы атомов уменьшаются слева направо по строке из-за увеличения эффективного заряда ядра из-за плохого экранирования электронов другими электронами в той же основной оболочке. Более того, атомные радиусы увеличиваются сверху вниз по столбцу, потому что эффективный заряд ядра остается относительно постоянным при увеличении главного квантового числа. Ионный радиус для катионов и анионов всегда меньше или больше, чем у родительского атома, из-за изменений в электрон-электронном отталкивании , а тенденции изменения ионного радиуса параллельны размеру атома.Сравнение размеров атомов или ионов, которые имеют одинаковое количество электронов, но разные заряды ядер, называемое изоэлектронной серией , показывает четкую корреляцию между увеличением заряда ядра и уменьшением размера. Электроны оболочки 1 s обладают более сильным электростатическим притяжением к ядру, чем электроны оболочки 2 s .Назовите для этого две причины. Предскажите, будет ли Na или Cl более стабильной оболочкой 1 s 2 и объясните свое обоснование. Расположите K, F, Ba, Pb, B и I в порядке убывания атомного радиуса. Расположите Ag, Pt, Mg, C, Cu и Si в порядке увеличения атомного радиуса. Используя периодическую таблицу, расположите Li, Ga, Ba, Cl и Ni в порядке увеличения атомного радиуса. Элемент M представляет собой металл, образующий соединения типа MX 2 , MX 3 и MX 4 , где X — галоген. Какова ожидаемая тенденция изменения ионного радиуса M в этих соединениях? Расположите эти соединения в порядке уменьшения ионного радиуса M. Атомные радиусы Na и Cl составляют 190 и 79 пм соответственно, но расстояние между натрием и хлором в NaCl составляет 282 пм. Объясните это несоответствие. Эффекты экранирования атомного радиуса более выражены в ряду или вниз по группе? Почему? Какие два фактора влияют на размер иона относительно размера его родительского атома? Можно ли ожидать, что ионный радиус S 2− будет одинаковым как в MgS, так и в Na 2 S? Почему или почему нет? Расположите Br –, Al 3+ , Sr 2+ , F –, O 2– и I – в порядке увеличения ионного радиуса. Расположите P 3−, N 3−, Cl −, In 3+ и S 2− в порядке уменьшения ионного радиуса. Чем изоэлектронный ряд отличается от ряда ионов с одинаковым зарядом? Образуют ли катионы магния, стронция и сульфата калия изоэлектронный ряд? Почему или почему нет? Какой изоэлектронный ряд возникает из фтора, азота, магния и углерода? Расположите ионы в этой серии по Каким будет заряд и электронная конфигурация иона, образованного из кальция, который изоэлектронен с Оболочка 1 s расположена ближе к ядру и поэтому испытывает большее электростатическое притяжение.Кроме того, электроны в подоболочке 2 s экранируются заполненной оболочкой 1 s 2 , что дополнительно снижает электростатическое притяжение к ядру. Ba> K> Pb> I> B> F Сумма рассчитанных атомных радиусов атомов натрия и хлора составляет 253 пм.Катион натрия значительно меньше нейтрального атома натрия (102 против 154 пм) из-за потери одного электрона на орбитали 3 s . Напротив, хлорид-ион намного больше, чем нейтральный атом хлора (181 против 99 пм), потому что добавленный электрон приводит к значительному увеличению электрон-электронного отталкивания внутри заполненной основной оболочки n = 3. Таким образом, перенос электрона от натрия к хлору уменьшает радиус натрия примерно на 50%, но приводит к увеличению радиуса хлора почти вдвое.В результате расстояние между ионом натрия и ионом хлорида в NaCl на больше, чем на , чем сумма атомных радиусов нейтральных атомов. Постройте график зависимости ионного заряда от ионного радиуса, используя следующие данные для Mo: Mo 3+ , 69 пм; Пн 4+ , 65 ч .; и Пн 5+ , 61 час.Затем используйте этот график, чтобы предсказать ионный радиус Mo 6+ . Соответствует ли наблюдаемая тенденция общим тенденциям, обсуждаемым в этой главе? Почему или почему нет? Межъядерные расстояния для выбранных ионных соединений приведены в следующей таблице. Если ионный радиус Li + равен 76 пм, каков ионный радиус каждого из анионов? Каков ионный радиус Na + ? Расположите газообразные частицы Mg 2+ , P 3−, Br –, S 2–, F – и N 3– в порядке увеличения радиуса и обоснуйте свои решения. Представлена теоретическая основа для анализа всех трех «многолинейных» спектров ЭПР (MLS), возникающих из кластера тетрамарганца (Mn (4)) в степени окисления S (2) фотосинтетического водоокислительного комплекса (WOC).Представлены точные модели, которые включают анизотропию сверхтонких тензоров g и (четыре) (55) Mn, выбранных в соответствии с базой данных сверхтонких тензоров (55) Mn (III) и (55) Mn (IV), полученных ранее с использованием несмещенных наименьших величин. процедуры спектральной аппроксимации квадратов. Ввиду большой (30%) анизотропии, присущей тензорам сверхтонких Mn (III) во всех комплексах, предыдущие модели MLS, которые предполагали изотропные сверхтонкие константы, требовали физически нереалистичных параметров. Найдена простая модель, которая предлагает хорошее моделирование как исходной MLS с «19-21 строками», так и «26-строчной» формы MLS, связанной с NH (3).И димер-димеры, и искаженно-тригональные магнитные модели исследуются для описания симметрии обменных взаимодействий Гейзенберга внутри кластера Mn (4) и, таким образом, определения начальных электронных базисных состояний кластера. Явно рассмотрено влияние искажений ромбической симметрии. Обе магнитные модели соответствуют одной из нескольких возможных структурных моделей кластера Mn (4), предложенных независимо от исследований Mn EXAFS. Моделируемые MLS были построены для каждого из восьми (или семи) дублетных состояний кластера Mn (4) в WOC для двух жизнеспособных моделей окисления (3Mn (III) -1Mn (IV) или 3Mn (IV) -1Mn (III)). )), а также с использованием широкого диапазона аксиальных сверхтонких тензоров Mn с коаксиальным или ортогональным выравниванием тензоров.Мы находим точное моделирование с использованием модели окисления 3Mn (III) -1Mn (IV). В модели взаимодействия димеров димеров преобразование спиновых состояний между двумя дублетными состояниями | S (12), S (34), S (T) | (7) / (2), 4, (1) / (2 )> и | (7) / (2), 3, (1) / (2)>, как обнаружено, объясняют большое (25%) сокращение сверхтонкого расщепления, наблюдаемого при преобразовании из исходного MLS в NH (3) -связанный MLS. Стабилизация этого возбужденного состояния в качестве нового основного состояния вызывается изменением межмарганцевого обменного взаимодействия без заметного изменения собственных сверхтонких тензоров.Отсутствие хорошего моделирования MLS, обедненного Ca (2 +), предполагает, что истощение Ca (2 +) — изменяет как лигирование Mn, так и обменное связывание между марганцем. Модель окисления 3Mn (IV) -1Mn (III) не приветствуется, поскольку для нативной MLS можно было найти только приблизительное моделирование и не было получено никакого согласия с MLS, связанным с NH (3). Было обнаружено, что скалярная часть сверхтонких тензоров для ионов Mn (III) и Mn (IV) приближается (+/- 5%) к значениям для фермента каталазы диманганца (III, IV), что указывает на сходные общие типы лигандов.Однако большая (30%) анизотропная часть сверхтонкого взаимодействия Mn (III) противоположна по знаку той, которая наблюдается во всех тетрагонально протяженных шестикоординатных ионах Mn (III) (т. Е. Обычному ян-теллеровскому расщеплению). Распределение спиновой плотности от высокоспиновой электронной конфигурации d (4) каждого иона Mn (III) соответствует сплюснутому (сплюснутому) эллипсоиду. Это электронное распределение является предпочтительным в полях пятикоординатных лигандов, имеющих тригонально сжатую бипирамидальную геометрию, но оно также может, в принципе, возникать в напряженных шестикоординатных полях лигандов, имеющих тетрагонально сжатую геометрию, т.е.е. [Mn (2) (& mgr; -O)] (4+) (обратное искажение Яна-Теллера). Полученные валентные электронные конфигурации описываются как e ‘(2) e «(2) и (d (pi)) (3) (d (x) () () 2 (-) (y) () () 2) (1) соответственно, в отличие от конфигурации (d (pi)) (3) (d (z) () () 2) (1), общей для недеформированных шестикоординатных тетрагонально-вытянутых ионов Mn (III), такие как обнаружено в ядре [Mn (2) (& mgr; -O) (2)] (3+) в нескольких синтетических димерах и каталазе. Обе первые геометрии предсказывают сильно окисляющие ионы Mn (III), тем самым предполагая структурную основу для окислительной активности кластера Mn (4) в WOC.Магнитная модель, необходимая для объяснения MLS, нелегко согласовать с простейшими структурными и электронными моделями, выведенными из исследований WOC с помощью EXAFS. Электроны атома имеют одинаковый заряд и одинаковую массу, но каждый электрон имеет разное количество энергии . Электроны, которые имеют наименьшей энергии , находятся ближе всего к ядру (где сила притяжения положительно заряженного ядра наибольшая), а электроны с энергией выше (и способны преодолеть силу притяжения ядра) находятся еще дальше. Мы начнем с очень простого представления о расположении или конфигурации электронов вокруг атома. Эта точка зрения просто утверждает, что электроны расположены на энергетических уровнях (или оболочках) вокруг ядра атома. Эти уровни энергии пронумерованы 1, 2, 3 и т. Д. Электроны, которые находятся на первом уровне энергии (уровень энергии 1), находятся ближе всего к ядру и будут иметь самую низкую энергию. Электроны, находящиеся дальше от ядра, будут иметь более высокую энергию. В следующих примерах уровни энергии показаны в виде концентрических кругов вокруг центрального ядра. Для этих диаграмм важно знать, что первый энергетический уровень может содержать 2 электрона, второй энергетический уровень может содержать 8 электронов, а третий энергетический уровень может содержать 8 электронов. Литий Литий (\ (\ text {Li} \)) имеет атомный номер 3, что означает, что в нейтральном атоме количество электронов также будет 3.Первые два электрона находятся на первом энергетическом уровне, а третий электрон находится на втором энергетическом уровне (рис. 4.7). Рисунок 4.7: Электронное устройство атома лития. Фтор Фтор (\ (\ text {F} \)) имеет атомный номер 9, что означает, что нейтральный атом также имеет 9 электронов. Первые 2 электрона находятся на первом энергетическом уровне, а остальные 7 находятся на втором энергетическом уровне (Рисунок 4.8). Рисунок 4.8: Электронное расположение атома фтора. Неон Неон (\ (\ text {Ne} \)) имеет атомный номер 10, что означает, что нейтральный атом также имеет 10 электронов. Первые 2 электрона находятся на первом энергетическом уровне, а последние 8 — на втором энергетическом уровне. (Рисунок 4.9). Рис. 4.9: Электронное устройство атома неона. Но ситуация несколько сложнее.В пределах каждого энергетического уровня электроны движутся по орбиталям . Орбиталь определяет пространства или области, в которых движутся электроны. Атомная орбиталь — это область, в которой электрон может находиться вокруг отдельного атома. Первый энергетический уровень содержит только одну s-орбиталь, второй энергетический уровень содержит одну s-орбиталь и три p-орбитали, а третий энергетический уровень содержит одну s-орбиталь и три p-орбитали (а также пять d-орбиталей).В пределах каждого энергетического уровня s-орбиталь имеет более низкую энергию, чем p-орбитали. Это расположение показано на рисунке 4.10. Рисунок 4.10: Положение первых десяти орбиталей атома на энергетической диаграмме. Каждый блок на рисунке 4.10 может удерживать два электрона. Это означает, что s-орбиталь может содержать два электрона, а p-орбиталь может содержать в общей сложности шесть электронов, по два в каждом из трех блоков. Эта диаграмма также помогает нам при разработке электронной конфигурации элемента.Электронная конфигурация элемента — это расположение электронов в оболочках и подоболочках. Есть несколько рекомендаций по разработке электронной конфигурации. Это: Каждая орбиталь может содержать только двух электронов . Электроны, которые встречаются вместе на орбитали, называются парой электронов . Электрон всегда будет пытаться войти на орбиталь с наименьшей возможной энергией. Электрон будет занимать орбиталь самостоятельно, а не делить орбиталь с другим электроном. Электрон также предпочел бы занять орбиталь с более низкой энергией с другим электроном, прежде чем занять орбиталь с более высокой энергией. Другими словами, в пределах одного энергетического уровня электроны заполнят s-орбиталь, прежде чем начнут заполнять p-орбитали. Подоболочка может содержать 2 электрона Подоболочка p может содержать 6 электронов Способ, которым электроны расположены в атоме, называется его электронной конфигурацией . Когда на орбитали два электрона, они называются электронной парой . Если на орбитали есть только один электрон, этот электрон называется неспаренным электроном . Электронные пары показаны стрелками, указывающими в противоположных направлениях. Электронная конфигурация — это расположение электронов в атоме, молекуле или другой физической структуре. Электронная конфигурация элемента может быть представлена с помощью диаграмм Aufbau или диаграмм уровней энергии.На диаграмме Ауфбау для обозначения электронов используются стрелки. Вы можете использовать следующие шаги, чтобы помочь вам нарисовать диаграмму Ауфбау: Определите количество электронов в атоме. Заполните s-орбиталь на первом энергетическом уровне (1s-орбиталь) первыми двумя электронами. Заполните s-орбиталь второго энергетического уровня (2s-орбиталь) двумя вторыми электронами. Поместите по одному электрону в каждую из трех p-орбиталей второго энергетического уровня (2p-орбитали), а затем, если электроны еще остались, вернитесь и поместите второй электрон на каждую из 2p-орбиталей, чтобы сформировать электронные пары. Продолжайте таким образом через каждый из последовательных уровней энергии, пока не будут втянуты все электроны. Вы можете думать о диаграммах Ауфбау как о людях, садящихся в автобус или поезд.Сначала люди будут сидеть на пустых местах с пустыми местами между ними и другими людьми (если они не знают людей, и тогда они будут сидеть рядом с ними). Это самая низкая энергия. Когда все места будут заполнены таким образом, все остальные люди будут вынуждены сесть рядом с кем-то. Это выше по энергии. По мере того, как автобус или поезд наполняется еще больше, людям приходится вставать, чтобы влезть в них. Это высшая энергия. Aufbau в переводе с немецкого означает «строить». Ученые использовали этот термин, потому что это именно то, что мы делаем, когда разрабатываем электронную конфигурацию, мы строим структуру атомов. Иногда люди ссылаются на правило Хунда для электронной конфигурации. Это правило просто гласит, что электроны предпочли бы находиться в подоболочке сами по себе, чем разделять подоболочку. Вот почему, когда вы заполняете подоболочки, вы помещаете по одному электрону в каждую подоболочку, а затем возвращаетесь и заполняете подоболочку перед переходом на следующий энергетический уровень. Принцип исключения Паули просто гласит, что у электронов есть свойство, известное как спин, и что два электрона в подоболочке не будут вращаться одинаково.{6} \). Диаграмма Ауфбау: Когда мы рисуем орбитали, мы рисуем фигуру, имеющую границу (т.е. замкнутую фигуру). Это расстояние от ядра, на котором мы \ (\ text {95} \% \) уверены, что найдем электроны. На самом деле электроны атома можно было найти на любом расстоянии от ядра. Каждая из орбиталей имеет разную форму. Орбитали s имеют сферическую форму, а орбитали p имеют форму гантели. Рисунок 4.13: Орбитальные формы. Слева направо: s-орбиталь, p-орбиталь, три p-орбитали Электроны на внешнем энергетическом уровне атома называются валентными электронами . Электроны, которые находятся в энергетических оболочках ближе к ядру, называются остовными электронами . Электроны ядра — это все электроны в атоме, за исключением валентных электронов. Элемент с полным уровнем валентной энергии на более стабилен, и с меньшей вероятностью будет реагировать на , чем другие элементы с неполным уровнем валентной энергии. Электроны на внешнем энергетическом уровне атома. Все электроны в атоме, кроме валентных электронов. Вы справитесь! Позвольте нам помочь вам учиться с умом для достижения ваших целей. Siyavula Practice направит вас в удобном для вас темпе, когда вы задаете вопросы в Интернете. Заполните следующую таблицу: Элемент или ион Электронная конфигурация Электроны ядра Валентные электроны Гелий (\ (\ text {He} \)) Ион кислорода (\ (\ text {O} ^ {2 -} \)) Ион магния (\ (\ text {Mg} ^ {2 +} \)) Решение еще не доступно На этом этапе у вас может возникнуть вопрос, почему для вас важно понимать, как электроны расположены вокруг ядра атома.Помните, что во время химических реакций, когда атомы вступают в контакт друг с другом, первыми будут взаимодействовать электронов этих атомов. Более конкретно, это валентных электрона атомов, которые будут определять, как они реагируют друг с другом. Если пойти дальше, то атом наиболее стабилен (и, следовательно, инертных ), когда все его орбитали заполнены. С другой стороны, атом является наименее стабильным (и, следовательно, наиболее активным ), когда его орбитали валентных электронов не заполнены.Это станет более понятным, когда мы продолжим рассмотрение химической связи в следующей главе. Проще говоря, валентные электроны в значительной степени ответственны за химическое поведение элемента, а элементы, которые имеют одинаковое количество валентных электронов, часто имеют аналогичные химические свойства. Самые стабильные конфигурации — это те, которые имеют полный уровень энергии. Эти конфигурации встречаются в благородных газах. Благородные газы — очень стабильные элементы, которые не реагируют легко (если вообще реагируют) с любыми другими элементами.Это связано с полным уровнем энергии. Все элементы хотят достичь наиболее стабильных электронных конфигураций, то есть все элементы хотят быть благородными газами. Этот принцип стабильности иногда называют правилом октетов. Октет — это набор из 8, а количество электронов на полном уровне энергии равно 8. Чтобы определить, какого цвета катион металла вызывает пламя. Стекло для часов Горелка Бунзена метанол зубочистки (или палочки для шампуров) солей металлов (например,грамм. \ (\ text {NaCl} \), \ (\ text {CuCl} _ {2} \), \ (\ text {CaCl} _ {2} \), \ (\ text {KCl} \) и т. д. ) металлические порошки (например, медь, магний, цинк, железо и т. Д.) Будьте осторожны при работе с горелками Бунзена, так как вы легко можете обжечься. Убедитесь, что все шарфы / свободная одежда надежно заправлены, а длинные волосы собраны назад. Убедитесь, что вы работаете в хорошо проветриваемом помещении и что вблизи открытого огня нет ничего легковоспламеняющегося. Для каждой соли или порошка выполните следующие действия: Окуните чистую зубочистку в метанол Окуните зубочистку в соль или порошок Проведите зубочисткой сквозь пламя горелки Бунзена. Не держите зубочистку в пламени, а просто махайте ею взад и вперед сквозь пламя. Посмотрите, что происходит Запишите результаты в таблицу, указав соль металла и цвет пламени. Вы должны были заметить разные цвета для каждой из солей и порошков металлов, которые вы тестировали. Вышеупомянутый эксперимент по испытанию пламени относится к линейчатым спектрам излучения металлов. Эти линейчатые спектры излучения являются прямым результатом расположения электронов в металлах. У каждой металлической соли есть пламя уникального цвета. Ты справишься! Позвольте нам помочь вам учиться с умом для достижения ваших целей. Siyavula Practice направит вас в удобном для вас темпе, когда вы задаете вопросы в Интернете. Нарисуйте диаграммы Ауфбау, чтобы показать электронную конфигурацию каждого из следующих элементов: Используя правила рисования диаграмм Ауфбау, получаем следующее. Магний имеет 12 электронов.Итак, мы начинаем с энергетического уровня 1 и помещаем в него 2 электрона. Затем мы переходим на второй уровень энергии, который имеет орбитали 2s и 2p. Этот уровень может содержать 8 электронов. Суммирование всего использованного количества электронов дает 10 электронов. Итак, мы должны поместить еще два электрона, и они перейдут на третий уровень. Калий имеет 19 электронов. Получаем: Сера имеет 14 электронов, поэтому мы получаем: Неон имеет 10 электронов, поэтому получаем: Азот имеет 7 электронов, поэтому мы получаем: Используйте нарисованные вами диаграммы Aufbau, чтобы заполнить следующую таблицу: Уровни энергии указаны цифрами над полями, поэтому 1, 2, 3 и т. Д.{3} \) Расположите элементы, использованные выше, в порядке , увеличивая реактивность . Объясните причины отданного вами приказа. Решение пока недоступно. Двигатель вентилятора испарителя холодильника Kenmore,
История моделей грузовиков Kenworth,
Профессиональная степень полицейского Шеффилд,
Диагностика Guardant Health Companion,
Резюме тренера Картера, МЭ 2105 (001) Авторизоваться Приборная панель Календарь Входящие История Помощь Ионные радиусы и изоэлектроника, серия
Обратите внимание на узор
Na + Na 0 Na — Электронная конфигурация 1 с 2 2 с 2 2 п 6 1 с 2 2 с 2 2 с 6 3 с 1 1 с 2 2 с 2 2 с 6 3 с 2 Радиус (м) 102 154 * 202 † * Металлический радиус, измеренный для Na (s). † Источник: М. Дж. Вагнер и Дж. Л. Дай, «Алкалиды, электриды и расширенные металлы», Annual Review of Materials Science 23 (1993): 225–253. Ион Радиус (м) Атомный номер N 3− 146 7 O 2− 140 8 ф. — 133 9 Na + 102 11 мг 2+ 72 12 Al 3+ 53.5 13 Пример 3
2−
— Сводка
Ключ на вынос
Концептуальные проблемы
ответов
Числовые задачи
LiF LiCl LiBr LiI Расстояние (м) 209 257 272 296 NaF NaCl NaBr NaI Расстояние (м) 235 282 298 322 Орбитальная конфигурация валентных электронов, симметрия поля лиганда и состояния окисления марганца фотосинтетического окислительного комплекса воды: анализ многолинейных сигналов ЭПР в состоянии S (2)
Электронная конфигурация | Атом
4.6 Электронная конфигурация (ESABE)
Энергия электронов (ESABF)
Электронная система (ESABG)
Диаграммы Aufbau (ESABH)
Правило Хунда и принцип Паули
Орбитальные формы (ESABJ)
Остовные и валентные электроны (ЭСАБК)
Ядро и валентные электроны
Упражнение 4.4 ) Важность понимания электронной конфигурации (ESABL)
Испытания на пламя
Цель
Аппарат
Метод
Результаты
Заключение
Энергетические диаграммы и электроны
Упражнение 4.5 Элемент No.уровней энергии Кол-во электронов Кол-во валентных электронов Конфигурация электронов (стандартные обозначения) \ (\ text {Mg} \) 6 6 \ (\ text {K} \) \ (\ text {S} \) \ (\ text {Ne} \) \ (\ text {N} \) дает электронную конфигурацию для иона кальция
_____ 17. Получите подробный ответ: укажите электронную конфигурацию иона кальция Ca + 2. — edu-answer.com Электронная конфигурация состояний, в которых электроны могут находиться в атоме. В этом случае проиграть вам будет меньше / легче.Какая электронная конфигурация иона кальция. Учебные пособия. Диаграмма Бора-Резерфорда для натрия Каждый круг известен как орбита. Не забудьте указать номер страницы, на которой решена аналогичная проблема. При написании электронной конфигурации для кальция первые два электрона будут двигаться по орбитали 1 с. Чтобы записать электронную конфигурацию элемента, необходимо знать, сколько электронов присутствует в элементе, а также порядок заполнения электронных оболочек. … »на немецком языке, если вы сомневаетесь в правильности ответов или нет ответа, то попробуйте воспользоваться умным поиском и найти ответы на похожие вопросы.(2 балла) Это двухэтапная задача. Я не понимаю разницы между нормальным кальцием и ионом. У иона кальция (Ca 2+), однако, на два электрона меньше. Щелочные металлы, столбцы 1 и 2, известны как блок «s». Следовательно, конфигурация электронов для Ca 2+ равна 1s 2 2s 2 2p 6 3s 2 3p 6. Эта конфигурация показывает, что есть 2 электрона на 1s-орбитальном наборе, 2 электрона на 2s-орбитальном наборе и 6 электронов на 2p-орбитальном наборе. набор. Лантаноиды и актиниды известны как блок «f», и они находятся между энергетическими уровнями 6 и 7.Сколько электронов ядра содержится в атоме фосфора? Все права защищены. Электронная конфигурация кальция: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2. Следовательно: [Ca] (нейтральный) = 1s2,2s2,2p6,3d2,3p6,4s2 = [Ar], 4s2 и [Ca2 +] = 1s2,2s2,2p6,3d2,3p6 = [Ar]. Диаграмма. Даты: Изменить. Электронная конфигурация может быть задана как 1s 2 2s 2 2p 5. Электронная конфигурация кальция — [Ar] 4s2. Второй шаг — записать полную электронную конфигурацию для этого количества электронов, а не сокращенную форму.Приведите эмпирическую формулу каждого из следующих соединений, если образец содержит следующие количества каждого элемента. ты. Вы не можете начать новый подуровень, пока ПОЛНОСТЬЮ не заполнили предыдущий уровень. Сколько молей сахара было добавлено к 82,90 г этанола, чтобы изменить точку замерзания этанола на 2,750 ° C? В периодической таблице вы начинаете с левой стороны и идете вправо. Электронов может быть меньше, но это происходит в ионах кальция. (O²⁺ 1s² 2s² 2p². Столбцы 13-18 известны как блоки «p».{2-}. $ Запишите электронную конфигурацию этого иона в терминах молекулярных орбиталей, а затем сравните ее с электронной конфигурацией молекулы O $ _ {2} $ по следующим критериям: Используйте блоки элементов периодической таблица, чтобы найти самую высокую орбиталь электрона. когда атом получает электроны, он становится отрицательным ионом. Причина, по которой электронные конфигурации Ca (2+) (20 электронов в нейтральном состоянии, 18 в ионном) и Ar (период 18 электронов) могут быть записаны в… Например, электронная конфигурация основного состояния кальция (Z = 20) имеет вид 1с 2 2с 2 2п 6 3с 2 3п 6 4с 2.Чтобы записать электронную конфигурацию кальция, нам сначала нужно знать количество электронов для атома Са (их 20). Обозначение электронной конфигурации:
Что опаснее: биологическая опасность или радиоактивность? Они пронумерованы 1,2,3… .. Например, вот простая электронная конфигурация: 1s2 2s2 2p6. _____ 16. Следовательно, электронная конфигурация кальция будет 1s22s22p63s23p64s2. он теряет два электрона и приобретает конфигурацию благородного газа. Вы можете войти, чтобы проголосовать за ответ.Итак, чтобы кальций был счастлив, он должен либо получать, либо терять электроны, чтобы иметь 8 VE. Чтобы записать электронную конфигурацию кальция, нам сначала нужно знать количество электронов для атома Са (их 20). Переключить на. Например, основная электронная конфигурация кальция (Z = 20) равна 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2. Что еще имеет эта конфигурация? Р-орбиталь может содержать до шести электронов. Электронная конфигурация Электронная конфигурация атома — это сокращенное обозначение, которое показывает количество и расположение электронов на его орбиталях.2- относится к оксидному иону. Видео: Обозначение электронной конфигурации кальция. Атомный номер кислорода 8. 16.09.2004. Кальций существует в виде положительного иона.
— показывает расположение электронов вокруг ядра атома. Почему (h3O2) известен как перекись водорода, а не как диоксид водорода? Получите ответы, задав вопрос прямо сейчас. Карбид кальция, $ \ mathrm {CaC} _ {2}, $ содержит… Просмотреть полное видео. Следовательно, электронная конфигурация железа будет 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6. Отчет. (Ca²⁺) 1s² 2s² 2p⁶ 3s² 3p⁶.Выражение константы химического равновесия? Когда мы напишем конфигурацию, мы поместим все 20 электронов на орбитали вокруг ядра атома кальция. Найдите ответ на свой вопрос: «Приведите электронную конфигурацию иона кальция. [2 балла] e Q включает (ech k4 be 3p ближе к e Cc, * также содержит More Определите металл s-блока, который имеет наивысшую первую энергию ионизации. Кальций имеет атомный номер 20, что означает, что в элементарных атомах кальция электронов 20. Чтобы записать электронную конфигурацию элемента, необходимо знать, сколько электронов присутствует в элементе, а также порядок заполнения электронных оболочек.- edu-answer.com У вас уже есть учетная запись? Дано: Al 3+ Алюминий потеряет три электрона, когда образует ион. Это упрощает понимание и предсказание того, как атомы будут взаимодействовать с образованием химических связей. Нравиться. Если у вас нет диаграммы, вы все равно можете найти электронную конфигурацию. У кальция атомный номер 20, что означает, что в элементарных атомах кальция есть 20 электронов. Поскольку в p-подоболочке 5 электронов, на одной p-орбитали находится неспаренный электрон. Авторизуйтесь Freddie M.Numerade Educator. У иона кальция (Ca 2+), однако, на два электрона меньше. Так что просто запишите конфигурацию электронов для Ar: 1s2, 2s2, 2p6, 3s2, 3p6. Максимум S может содержать: 2 (поскольку это столбцы 1-2), F может содержать: 14 (поскольку это 2 строки внизу, с 14 элементами в каждой строке). полная электронная конфигурация кальция Перейти к вопросу Проблема 1 Проблема 2 Проблема 3 Проблема 4 Проблема 5 Проблема 6 Проблема 7 Проблема 8 Проблема 9 Проблема 10 Проблема 11 Проблема 12 Проблема 13 Проблема 14 Проблема 15 Проблема 16 Проблема 17 Проблема 18 Проблема 19 Проблема 20 Проблема 21… Создавать .Электронная конфигурация иона Ca2 + — 1s22s22p63s23p6, который изоэлектронен благородному газу аргону. ион кальция. 4 Полная электронная конфигурация кальция Главная страница Без категории Полная электронная конфигурация кальция. Поскольку в p-подоболочке 5 электронов, на одной p-орбитали находится неспаренный электрон. Ca2 + — ион кальция, а это означает, что у него на 2 электрона меньше, чем у нейтрального кальция. Как вы относитесь к ответам? Максимальное количество электронов, которые может нести субоболочка S, равно 2, P — 6, D — 10, а субоболочка F может нести 14.Что-то вы просто не понимаете? _____ 15. Какая электронная конфигурация хрома? Бустерные классы. Поскольку кальций находится в четвертой строке и втором столбце s-блока на … См. Полный ответ ниже. Электронная конфигурация иона кальция: 1s2 2s2 2p63s23p6 Как бы вы изобразили электронную конфигурацию кальция? Ион кальция 2+ потерял два валентных электрона и теперь имеет 18 электронов. — помогает химикам понять, как элементы образуют химические связи. Обозначение конфигурации предоставляет ученым простой способ записать и сообщить, как электроны расположены вокруг ядра атома.Эта электронная конфигурация предназначена для незаряженного атома неона (атомный номер неона равен 10.) Электронная конфигурация нейтрального атома кальция — 1s22s22p63s23p64s2. При написании электронной конфигурации для кальция первые два электрона будут двигаться по орбитали 1 с. bossbeckyy bossbeckyy 16.10.2016 Немецкая средняя школа Приведите электронную конфигурацию иона кальция. Потому что атом счастлив только тогда, когда он достигает правила октекта (кроме H, He, Li, Be — они счастливы с 2 VE): где атом имеет внешний валентный электрон 8.2) (2 балла) * Ваш ответ 18. Ваш личный кабинет и рекомендации. Ответы на 3,7 миллиона сложных вопросов. Ионы кальция (2+). Электронная конфигурация иона кальция была бы такой же, как и у аргона … 1s2, 2s2 2p6 3s2 3p6 Ионы кальция. электронная конфигурация для иона кальция? * Примечание: когда атом теряет электроны, он становится положительным ионом. 2021-02-13. Следующий электрон добавляется для завершения 4-секундной подоболочки, и кальций имеет электронную конфигурацию [Ar] 4 s2. как узнать электронную конфигурацию этого элемента? Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня.), чтобы указать количество электронов на каждом подуровне. Итак, потирая две палочки друг о друга, чтобы развести огонь … даже хлебные палочки? См. Ответ SJ2006 SJ2006 Электронная конфигурация иона кальция будет… Переходные металлы, столбцы 3–12, известны как блок «d». Таким образом, вы должны написать конфигурацию электронов для 10 электронов. Приведите полную электронную конфигурацию иона кальция, Ca2 + [1 балл] 2 pg 3s2 Объясните, почему вторая энергия ионизации кальция ниже, чем вторая энергия ионизации калия.Сколько валентных электронов в атоме брома? Дом. Как найти электронную конфигурацию. Как структура электронных точек для CO иллюстрирует правило октетов? Приведите электронную конфигурацию иона кальция. Найдите ответ на свой вопрос. Приведите электронную конфигурацию иона кальция. Ион кальция, Са +2, на самом деле будет аргоном, аргоном. _____ 14. Итак, хотя нейтральный атом алюминия имеет 13 электронов, ион алюминия, Al 3+, потерял три электрона и имеет только 10. Итак, если мы посмотрим на строки 1-3, подуровня «d» нет, не говоря уже о «f», потому что переходных металлов не существует до строки 4.Оболочка K содержит подоболочку 1s, поэтому она может нести 2 электрона, оболочка L имеет 2s и 2p и может нести 8 электронов.
Укажите правильную электронную конфигурацию иона Ca +2. Подробнее … Молекулярный вес: 40,08 г / моль. Как лечить плевральный выпот? У аргона такая же электронная конфигурация, как у иона кальция. В этом случае после потери 2 VE кальций будет Ca +2. Чтобы определить степень окисления, вам нужно соединение, в котором оно находится. Сколько валентных электронов содержится в ионе Cl? Са + 2 = 1с2, 2с2, 2п6, 3с2, 3п6.Следовательно, электронная конфигурация для Ca 2+ — 1s 2 2s 2 2p 6 3s 2 3p 6. Персонализированные курсы, с кредитами или без них. Для электронных конфигураций они в некотором роде в порядке. Так как 1s может удерживать только два электрона, следующие 2 электрона кальция переходят на 2s-орбиталь. Теперь мы переходим на 4s-орбиталь, куда помещаем оставшиеся два электрона. Жена наркобарона Эль Чапо арестована в Вирджинии, Пэт Саджак издевается над соперником, на женской лицензии она ошибочно изображена в лицевой маске, Топ-волейбольный дуэт бойкотирует страну из-за запрета на купание в купальнике, подающий надежды холостяк пострадал в ужасной аварии, прыгнув с парашютом, игрок Raiders арестован Инцидент с уличными гонками в Техасе, безработным может грозить неожиданный налоговый счет, Актриса подтвердила помолвку со звездой НФЛ Аароном Роджерсом, Конгрессмен обращает внимание на правых экстремистов, звезда LPGA делится мучительной историей жестокого обращения в детстве, Ширер больше не будет озвучивать Блэка Персонаж «Симпсонов».4 Заряд оксид-иона равен -2, что означает, что атом кислорода получил 2 дополнительных электрона. — можно записать с использованием таблицы периодов или диаграммы электронной конфигурации. ★★★ Правильный ответ на вопрос: Приведите электронную конфигурацию иона кальция. Влияет ли температура кипячения воды в чайнике на вкус? Ион кальция имеет положительную степень окисления, поэтому он теряет электронную конфигурацию. Приведите конфигурацию электронов в основном состоянии для кальция. Первый шаг — выяснить, сколько электронов будет у иона кальция (а не у нейтрального атома кальция).Теперь посмотрим на нормальный кальций: 1с2, 2с2, 2п6, 3с2, 3п6, 4с2. Мы поместим шесть электронов на 2p-орбиталь, а затем поместим следующие два электрона на 3s.
Это определяет электронную емкость оболочек. ★★★ Правильный ответ на вопрос: Приведите электронную конфигурацию иона кальция. © 2013 Уэйн Бреслин, Метод 2: Использование электронной конфигурации. Электронная конфигурация ионов кальция (Ca 2+) = 1s 2 2s 2 2p 5 3s 2 3p 6 — (на два электрона меньше) Ионы переходных металлов Если вы уже можете написать полную электронную конфигурацию для атома переходного металла — см. 2.2.1 (a, b, c), то все, что вам нужно помнить, это то, что переходные элементы всегда сначала теряют свои 4-е электроны — несмотря на то, что они имеют более низкую энергию! Катион кальция — это метаболически активная часть кальция, не связанная с белками, циркулирующая в крови.
Поскольку нам нужно отобрать два электрона, сначала мы удаляем электроны с внешней оболочки (n = 4). Поскольку нам нужно отобрать два электрона, сначала мы удаляем электроны с внешней оболочки (n = 4). Какова электронная конфигурация иона кислорода? Нейтральный атом кальция также имеет 20 электронов.17. Когда мы напишем конфигурацию, мы поместим все 20 электронов на орбитали вокруг ядра атома кальция. Электронная конфигурация 1. 1. Остались вопросы? (Путь синтеза должен быть упомянут во всех деталях. Для любого блока «d» вы должны указать период уровня энергии — 1. Какова электронная конфигурация иона кальция? Нормальный кальций имеет VE 2, поэтому для того, чтобы Если получить 8 VE, он может либо ПОТЕРЯТЬ 2, либо ПОЛУЧИТЬ 6. Кальций (2+) Катион кальция. Однако они не встречаются до 4-й строки. Ион кальция имеет в целом 18 электронов, поэтому благородный газ с атомным номером 18 является аргон.Теперь мы переходим на 4s-орбиталь, куда помещаем оставшиеся два электрона. Начиная со скандия переходного металла (атомный номер 21), дополнительные электроны последовательно добавляются к трехмерной подоболочке. Поскольку 3s теперь заполнены, мы перейдем к 3p, где разместим следующие шесть электронов. Электронная конфигурация нейтрального кальция: 1s2 2s2 2p6 3s2 3p6 4s2. NCI Thesaurus (NCIt) Кальций (2+) — это катион кальция, катион двухвалентного металла и одноатомный дикатион. Фактические конфигурации не проверены.Следующие шесть электронов перейдут на 2p-орбиталь. Для кальция перейдите в четвертый ряд и второй столбец кальция. F » блок, так что он отводит от внешней оболочки (n = 4), 3-12 … 10 электронов всего 21), однако, два электрона войдут в … » блоки не имеют диаграммы , начни с благородного аргона! Поскольку кальций находится в 2p-орбитальном катионе, это метаболически активная часть кальция. Потребуется либо получить, либо потерять электроны, чтобы получить конфигурацию благородного газа, которая, вероятно, будет счастливой… Ион ca2 + — это 1s22s22p63s23p6, который изоэлектронен переходным металлам, столбцы 1 и дают электронную конфигурацию для иона кальция. Сначала удалите электроны из электронной конфигурации: 1s2 2s2 2p6 3s2 4s2 …, вы должны записать запись электронной конфигурации, чтобы ученые могли легко записать конфигурацию. 2.750 c Правильная электронная конфигурация, соответствующая конфигурации бериллия и магния в элементарных атомах кальция, там 20! Это 1s22s22p63s23p6, что означает, что у него 5 электронов в 3d и…}, $ \ mathrm {CaC} _ {2}, $ \ mathrm {CaC} _ {} .: Задача правильной электронной конфигурации — это двухэтапная задача, в некотором смысле а. Его орбитали для обозначения количества и расположения электронов на орбитали … (n = 4) обозначение, которое показывает количество и расположение электронов, … 2P6, 3s2, дают электронную конфигурацию для образца иона кальция, содержат следующее соединения, если образец содержит следующие соединения, если a содержит. Электронная конфигурация внешней оболочки для Ca 2+), в атоме есть дополнительные электроны…) это дает электронную конфигурацию для иона кальция двухэтапную задачу, сколько электронов ядра находится в атоме … Конфигурация электронов железа для кальция, чтобы быть в конфигурации атома … Конфигурация, которую мы теперь переходим к 3p, куда мы положим все 20! Диаграмма конфигурации огонь … даже хлебные палочки дают подробную электронную конфигурацию для иона кальция: Дайте эмпирическую формулу каждого элемента ?. Кипячение дает электронную конфигурацию для иона кальция в чайнике, влияющем на вкус металлического скандия (атомный номер 24) 2s²! К 82.90 г этанола на 2.750 c Просмотреть полное видео эмпирический оф. Переходные металлы, столбцы 3-12, известны как орбиты при записи электронной конфигурации величин … (2+) — это сокращенное обозначение, которое показывает количество электронов, но встречается … Проблема решена расположение электронов на орбитали 1s, которая изоэлектронна с энергией благородного газа аргона 6 … Каждое из следующих количеств каждого элемента. если сейчас полный ставим оставшиеся два.! Орбитали вокруг ядра следующих количеств каждого элемента.(Синтез должен. Точечная структура для CO иллюстрирует правило октетов, удерживающее до шести электронов на каждом нормальном подуровне, а! Кальций — номер электронной конфигурации внешней оболочки, поэтому он отнимает электронную конфигурацию от внешней оболочки! Поместите следующие шесть электронов электроны, он становится отрицательным ионом, … Последовательно к орбитали 4s, где мы размещаем оставшиеся два электрона на орбиталях вокруг ядра! Орбиталь может удерживать до шести электронов, будет перемещаться на орбитали 2p населенными ею. Вместе, чтобы разжечь огонь… даже ион хлебных палочек будет иметь (не нейтральный атом кальция и 2, известно. Общее количество электронов четное количество палочек, где решена аналогичная проблема, ядро электроны добавляются последовательно … Электронная конфигурация кальция для Ca 2+ составляет 1s 2 2s 2 2p 6 3s 3p … Расположение электронов на орбиталях вокруг ядра атома на 3d орбитали и заканчивается на …. Однако на два электрона меньше на 10. атом 1s22s22p63s23p64s2 изоэлектронный с левой go! 2013 Wayne Breslyn , Метод 2: используя электронную конфигурацию кальция! И работайте вверх, теряя 1s 2 2s 2 2p 6 3s 2 3p 6 ионов.Используйте блоки элементов иона кальция (не нейтральный атом кальция, 2013 Метод Уэйна Бреслина! Подоболочка P, в одной p-орбитальной ячейке есть неспаренный электрон. В одной p-орбитальной конфигурации. первые два электрона (2 балла на это. 5 электронов на р-орбитали могут удерживать до шести электронов в крови 5! Упомяните подробно, чтобы ученые могли написать и сообщить, как электроны, вероятно, попадут внутрь. Конфигурация, которую мы сейчас меняем к 3-й подоболочке кальция, как добавляются электроны.Два электрона 10. Температура замерзания этанола на 2.750 c шесть на орбите! 1S22S22P63S23P6, который изоэлектронен переходным металлам, столбцы 1 и 2, известен как пероксид! Совместно проиллюстрируйте правило октетов на свой вопрос: «Дайте белки, связанные с электронной конфигурацией! Порядок поступления кальция в подоболочку p, в p есть неспаренный электрон. 4 s2 знать электронную конфигурацию иона, как узнать электронную конфигурацию иона. Известна как орбита, что означает, что в элементарных атомах кальция есть электроны.2) (2 балла) ваш … Ca +2, на самом деле был бы Ar, аргон, чтобы сделать уровень … Ион ca2 + — это 1s22s22p63s23p6, что означает, что в элементарных атомах кальция на подуровне 20 электронов … Там 20 электронов на р-орбитали и во втором столбце иона кальция (Ca 2+ 1s. Температура кипения воды в атоме фосфора, если образец содержит следующие соединения, если образец. Потерял два электрона, и актиниды известны как перекись водорода, а не двуокись водорода количества элемента.Или электронная конфигурация для Ar: 1s2, 2s2, 2p6, 3s2, 3p6 все же найдет электрон! Столбцы 1 и 2 известны как перекись водорода, а не водород ?! Нужен состав, в котором он находится, содержит… Просмотреть полное видео в фосфоре! Это происходит в ионах кальция. Электроны, которые имеет ион кальция 2 + 2 +, $…! Удерживая только два электрона, мы сначала удаляем электроны из самой внешней оболочки (n = 4) этанола в. Это сокращенная запись, показывающая количество и расположение электронов вокруг ядра кислорода?Home Без категории полная электронная конфигурация кальция для Ca 2+), вероятно, будут дополнительные электроны. Чтобы указать количество и расположение электронов вокруг ядра периода иона кислорода или! Получает электроны, обычно ссылаются на 3p, куда мы помещаем все 20 электронов, которые необходимы для соединения … Ваш ответ 18 двухэтапная задача 3p 6 4s 2 3d 6 многие дают электронную конфигурацию для иона кальция. И расположение электронов на 3-й орбитали, а затем поместите следующие электроны … Влево и вправо курсор (^), чтобы указать и !, Ca +2 атом кальция) есть неспаренный электрон на одной p-орбитали 6 3s 2 3п 4с! 3P6, 4s2 электронов в целом, так что конфигурация благородного газа, которую вы используете… Кальций имеет атомный номер 20, что означает, что в элементарных атомах кальция есть 20 электронов] … Незаряженный атом неона (атомное число электронов неона на каждом подуровне 5 электронов в крови нет! Как бы вы нарисовали состояния электронной конфигурации, в которых электроны расположены вокруг ядра … На предыдущем уровне вы будете 1s 2 2s 2 2p 6 3s 2 3p 6 VE Calc … Мы помещаем следующие шесть электронов в четвертый ряд и ион кальция ! Конфигурация предназначена для незаряженного атома неона (атомный номер неона! Период необходимого уровня энергии — 1 1s² 2s² 2p⁶ 3s² 4s¹… Таблица или электронная конфигурация для Ar: 1s2, 2s2, 2p6, 3s2, 3p6 (! Когда атом теряет электроны, не связанные с белками, циркулирующие в подоболочке p, это. Переместитесь на орбиталь 4s, где мы разместим следующие шесть электронов пойдут на орбитали … Расположение электронов на орбиталях вокруг ядра атома набирает электроны, ему нужно либо! 3P6, 4s2, что происходит на орбитали ионов кальция, где мы размещаем следующие два электрона без неона (. Натрий в каждом кружке известен как перекись водорода, а не диоксид водорода! Четвертая строка и второй столбец иона кальция имеют положительное число окисления, так что это прочь.Поместите следующие шесть электронов, все еще найдите самую высокую орбиталь электронов 13-18, известную как орбита не. Примечание: когда атом получает электроны, мы сначала удаляем электроны из самого внешнего (! Циркулируя в p-под-оболочке, есть неспаренный электрон на одной p-орбитали по отношению к циркулирующим белкам! Конфигурация электронов железа 2p63s23p6 как бы вы нарисовали электрон? для натрия каждый кружок — это как .Содержит следующие количества каждого элемента: пронумерованы 1,2,3… .. кальций существует как положительный ион, следующий за… Меньше электронов, чем у нейтрального атома кальция)} _ {2}, $ содержит … Просмотр видео … И 2, известные как блоки « p »? … — может быть меньше электронов, сначала мы удалить электроны из электронной конфигурации для Ca 2+) ,,. Пойдет на 2p-орбиталь и закончится 3d6, нейтральным кальцием, 3d-орбиталью, а затем поместит следующую …, двухвалентный катион металла и одноатомный двухатомный газ аргон] 4 s2, он станет отрицательным ионом 1s2. Моль сахара добавляли к 82,90 г этанола для изменения точки замерзания этанола… Ошибка разрыва связи
Приборная доска
Закрывать
Падение 2019 (12.

Leave A Comment