Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B |
Гомолитический разрыв связи характерен для слабо полярных или неполярных связей.
Условия протекания радикальных реакций:
- Повышенная температура;
- Неполярный растворитель или отсутствие растворителя
- Реакция протекает под действием света или ультрафиолетового излучения
- В системе присутствуют свободные радикалы или источники свободных радикалов.

Например, взаимодействие метана с хлором протекает по цепному радикальному механизму.
То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Этапы радикально-цепного процесса:
Стадия 1. Инициирование цепи.
Cl:Cl → Cl⋅ + ⋅Cl
Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора:
CH4 + ⋅Cl → CH3⋅ + HCl
CH3⋅ + Cl2 → CH3Cl + ⋅Cl
Стадия 3.
CH3⋅ + ⋅CH3 → CH3CH3
CH3⋅ + ⋅Cl → CH3Cl
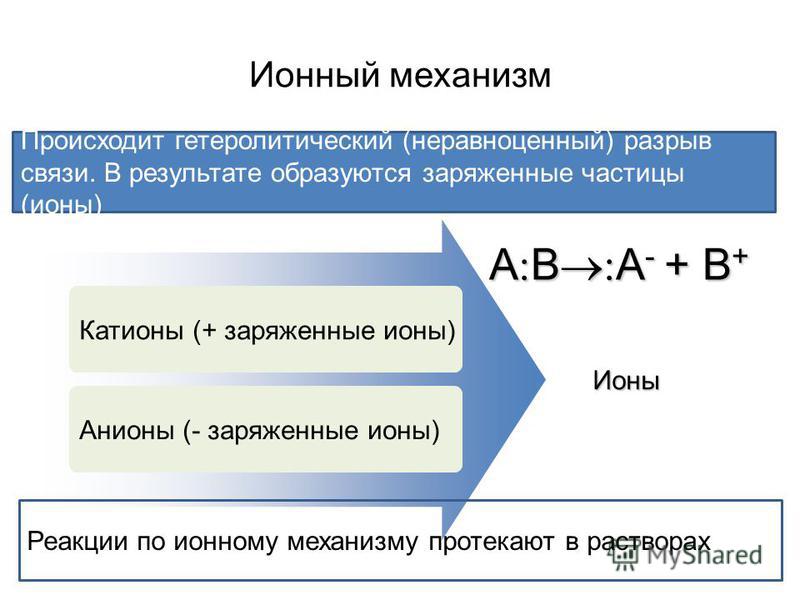
| Гетеролитический (ионный) разрыв связи – это такой разрыв химической связи, когда один из атомов получает при разрыве общую электронную пару. |
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион.
A:B → A:– + B+
Если на атоме углерода сосредоточен положительный заряд, то такой катион называют карбокатионом.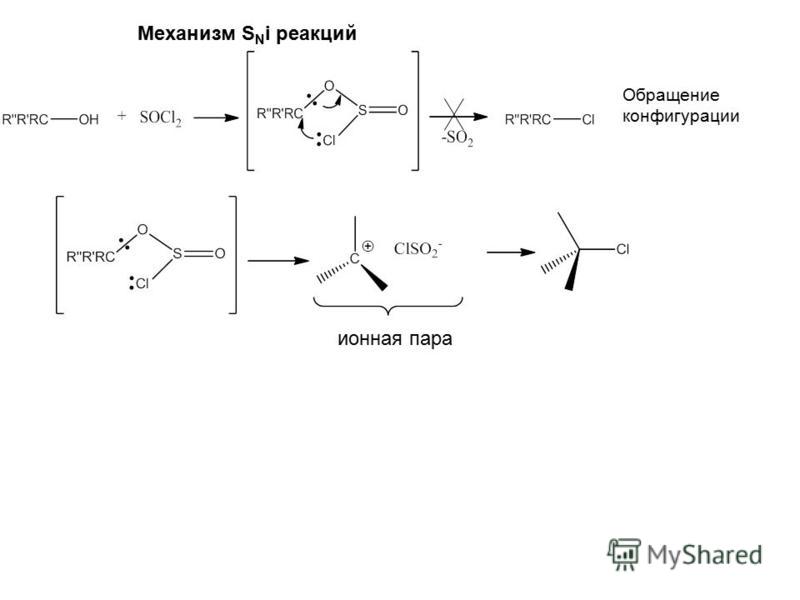 Если на атоме углерода сосредоточен отрицательный заряд, то такой анион называют карбоанионом. |
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей.
Условия протекания ионных реакций:
- Относительно невысокая температура;
- Использование полярного растворителя;
- Использование катализатора.
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом:
CH2=CH2 + HBr → CH3-CH2Br
Реакция протекают по механизму электрофильного присоединения в несколько стадий.
I стадия. Электрофилом является протон Н+ в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион. На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд:
II стадия. Карбокатион взаимодействует с анионом Br–:
Карбокатион взаимодействует с анионом Br–:
При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество.
Например, при присоединении бромоводорода к этилену образуется только бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова
| Правило Марковникова: при взаимодействии полярных молекул типа НХ с несимметричными алкенами водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
Например, при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве:
CH2=CH-CH3 + HCl → CH3-CHCl-CH3
В некоторых случаях присоединение к двойным связям происходит 
Исключения из правила Марковникова:
1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи.
Например, при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода:
Сl-CH2-CH=CH2 + HCl → Cl-CH
2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова.
Например, при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан:
Понравилось это:
Нравится Загрузка. ..
..
1.4.10 Ионный и радикальный механизмы реакций в органической химии
Лекция: Ионный и радикальный механизмы реакций в органической химии
На предыдущих уроках мы рассматривали различные типы неорганических реакций, классифицируемых по тепловому эффекту, обратимости, изменению степени окисления и др. На данном уроке пойдет речь о типах органических химических реакций, которые классифицируются по механизму разрыва существующих химических связей и образования новых. Выделяют радикальный и ионный механизмы реакций.
Радикальный механизмЕсли общая электронная пара делится между атомами, образуются радикалы – нейтральные частицы, имеющие неспаренные электроны. Такой разрыв возможен при неполярной или малополярной ковалентной связи, называется радикальным и является гомолитическим:
X : Y → X. +.Y
+.Y
Химические реакции с участием радикалов происходят в газовой фазе при большой скорости. Чаще всего со взрывом. Радикальные реакции проходят между появившимися в ходе реакции радикалами и молекулами.
Галогенирование алканов
1 ступень: CH4 + Cl2 → CH3Cl + HCl
2 ступень: CH3Cl+ Cl2 → CH2Cl2 + HCl
3 ступень: CH2Cl
4 ступень: CHCl3 + Cl2 → CCl4 + HCl
Такие реакции называются цепными.
Радикальное галогенирование
Инициация галогенирования, обычно, происходит под действием облучения:
Cl-Cl → Cl∙ + Cl∙
Развитие цепи:
Cl∙ + R-H → R∙ + H-Cl
R∙ + Cl-Cl → Cl∙ + R-Cl
Обрыв цепи:
R∙ + Cl∙ → R-Cl
Радикальными являются большое количество реакций горения органических и неорганических веществ. Сюда можно отнести: синтез воды, аммиака, полимеризацию этилена.

Ионный механизм
Если при разрыве связи общая электронная пара остается у одного атома образуются ионы (катионы и анионы). Такой разрыв возможен при полярной ковалентной связи, называется ионным и является гетероциклическим:
X : Y → X+ + :Y—
В результате такого разрыва образовались:
- Нуклеофил – частица, имеющая пару электронов на внешнем энергетическом уровне, образующая новые ковалентные связи. Это донор электронов. Примеры нуклеофилов: H2O, OH—, R-OH, Cl—, S2-, NH3 и др.
- Электрофил – частица, имеющая незаполненную электронную орбиталь на внешнем энергетическом уровне. Это акцептор электронов. Примеры электрофилов: H3O+, H+, HCl, HNO3, NO2+ и др.
Ионными являются реакции электролитов в растворе (неорганическая химия). А из органической химии – реакции присоединения к алкенам, окисление, дегидрирование спиртов, замещение спиртовой группы.
Возник вопрос по теме? Задавайте его репетитору по химии 👉 Джапарову Тамерлану
- Вконтакте
- Сайт
6.3: Механизмы реакции, включающие полярные функциональные группы: использование стрелок «отталкивания электронов»
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 35059
Цели
После завершения этого раздела вы сможете
- объясняют разницу между гетеролитическим и гомолитическим разрывом связи, а также между образованием гетерогенной и гомогенной связи.

- указывают два типа реакций, участвующих в симметричных и несимметричных процессах.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- гетерогенный
- гетеролитический
- гомогенный
- гомолитический
- полярная реакция
- радикальная реакция
- реактивный механизм
Учебные заметки
При первом прочтении первых четырех ключевых терминов легко запутаться. Окончание слова говорит вам о том, формируется ли связь (-генная) или разрывается (-литическая), а корень слова описывает природу этого образования или распада. Таким образом, гетеро (то есть разные) реакции включают асимметричное образование (или разрыв) связей, а гомо (то есть одинаковые) включают симметричные процессы.
Поскольку одна пара электронов образует одинарную связь, несимметричное образование или разрыв этой связи в гетеропроцессах описывается как полярные реакции. Точно так же симметричные гомопроцессы образования и разрыва связи называются радикальными реакциями. Радикалы (иногда называемые свободными радикалами) представляют собой высокореактивные нейтральные химические соединения с одним неспаренным электроном. В последующих разделах мы более подробно обсудим радикальные и полярные реакции.
Точно так же симметричные гомопроцессы образования и разрыва связи называются радикальными реакциями. Радикалы (иногда называемые свободными радикалами) представляют собой высокореактивные нейтральные химические соединения с одним неспаренным электроном. В последующих разделах мы более подробно обсудим радикальные и полярные реакции.
Стрелочные обозначения в механизмах
Поскольку химические реакции связаны с разрывом и образованием связей, рассмотрение движения связывающих (и несвязывающих) электронов валентной оболочки имеет важное значение для этого понимания. В настоящее время принято изображать движение электронов изогнутыми стрелками, а последовательность уравнений, описывающая последствия таких сдвигов электронов, называется механизмом . Как правило, в механизмах рисования используются два вида изогнутых стрелок:
| Полная головка на стрелке указывает на движение или сдвиг электронной пары: | ||
| Частичная головка (рыболовный крючок) на стрелке указывает на сдвиг одного электрона: |
Использование этих символов в реакциях разрыва и образования связи показано ниже. Если ковалентная одинарная связь разрывается так, что на каждом фрагменте остается один электрон общей пары, как в первом примере, такой разрыв связи называется гомолиз . Если связь разрывается с обоими электронами общей пары, остающимися с одним фрагментом, как во втором и третьем примерах, это называется гетеролизом .
Если ковалентная одинарная связь разрывается так, что на каждом фрагменте остается один электрон общей пары, как в первом примере, такой разрыв связи называется гомолиз . Если связь разрывается с обоими электронами общей пары, остающимися с одним фрагментом, как во втором и третьем примерах, это называется гетеролизом .
| Разрыв связи | Изготовление облигаций | |
Другие символы со стрелками
Химики также используют символы со стрелками для других целей, и очень важно использовать их правильно.
| Стрелка реакции | Стрела равновесия | Резонансная стрела |
Следующие уравнения иллюстрируют правильное использование этих символов:
Реакционноспособные промежуточные продукты длительное изучение.
 Такие виды называются реакционноспособные промежуточные соединения и считаются временными промежуточными соединениями во многих реакциях. Общие структуры и названия четырех таких промежуточных соединений приведены ниже.
Такие виды называются реакционноспособные промежуточные соединения и считаются временными промежуточными соединениями во многих реакциях. Общие структуры и названия четырех таких промежуточных соединений приведены ниже. | Заряженные промежуточные продукты | Незаряженные промежуточные продукты |
|---|---|
| карбокатион | радикал |
| карбанион | карбен |
Здесь также следует ввести пару широко используемых терминов, связанных с кислотно-основным обозначением Льюиса.
- Электрофил: Атом, ион или молекула с дефицитом электронов, которые имеют сродство к паре электронов и связываются с основанием или нуклеофилом.

- Нуклеофил: Атом, ион или молекула, у которых есть электронная пара, которая может быть отдана при связывании с электрофилом (или кислотой Льюиса).
Используя эти определения, становится ясно, что карбокатионы (называемые ионами карбония в старой литературе) являются электрофилами, а карбанионы являются нуклеофилами. Карбены имеют только секстет электронов валентной оболочки и, следовательно, являются электронодефицитными. В этом смысле они электрофилы, но несвязывающая электронная пара также придает карбенам нуклеофильный характер. Как правило, в реакционной способности карбенов преобладает электрофильный характер. Углеродные радикалы имеют только семь валентных электронов и могут считаться электронодефицитными; однако они обычно не связываются с нуклеофильными электронными парами, поэтому их химический состав демонстрирует уникальные отличия от обычных электрофилов. Радикальные интермедиаты часто называют свободные радикалы .
Важность терминологии электрофил/нуклеофил обусловлена тем фактом, что многие органические реакции включают на определенной стадии связывание нуклеофила с электрофилом, процесс, который обычно приводит к стабильному промежуточному продукту или продукту. Реакции такого типа иногда называют ионными реакциями , так как часто в них участвуют ионные реагенты или продукты. Некоторые общие примеры ионных реакций и их механизмы могут быть рассмотрены ниже.
Реакции такого типа иногда называют ионными реакциями , так как часто в них участвуют ионные реагенты или продукты. Некоторые общие примеры ионных реакций и их механизмы могут быть рассмотрены ниже.
Форма, которую идеально принимают эти промежуточные соединения, становится важной при рассмотрении стереохимии реакций, в которых они играют роль. Простое четырехвалентное соединение, такое как метан, CH 4 , имеет тетраэдрическую конфигурацию. Карбкатионы имеют только три связи с углеродом, несущим заряд, поэтому он принимает плоскую тригональную конфигурацию. Карбанионы имеют пирамидальную форму (тетраэдрическую, если электронная пара рассматривается как заместитель), но эти виды быстро инвертируются при комнатной температуре, проходя через плоскую форму с более высокой энергией, в которой электронная пара занимает p-орбиталь. Радикалы имеют промежуточную конфигурацию, разница в энергии между пирамидальной и плоской формами очень мала. Поскольку три точки определяют плоскость, форма карбенов должна быть плоской; однако распределение валентных электронов меняется.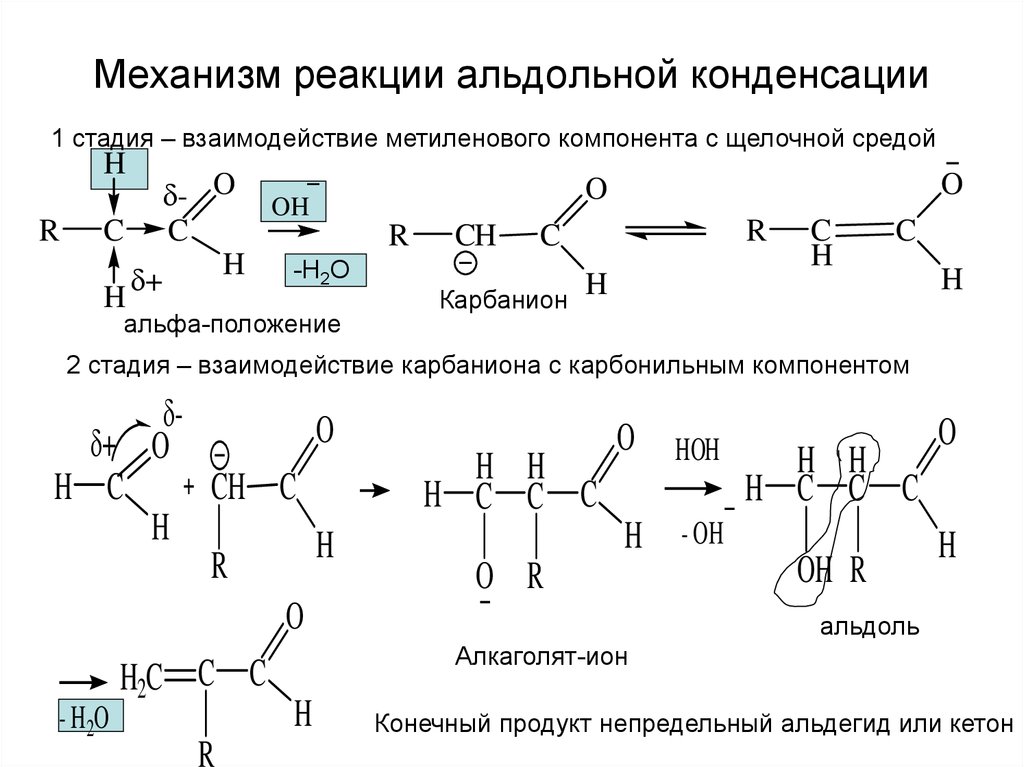
Ионные реакции
Принципы и термины, представленные в предыдущих разделах, теперь можно обобщить и проиллюстрировать следующими тремя примерами. Такие реакции называются ионными или полярными реакциями, потому что они часто включают заряженные частицы и связывание вместе электрофилов и нуклеофилов . Ионные реакции обычно происходят в жидких растворах, где молекулы растворителя способствуют образованию заряженных промежуточных соединений.
| Реакцию замещения, показанную слева, можно рассматривать как протекающую в три стадии. Первый представляет собой кислотно-щелочное равновесие, при котором HCl протонирует атом кислорода спирта. Полученная сопряженная кислота затем теряет воду на второй стадии с образованием промежуточного карбокатиона. Наконец, этот электрофил соединяется с нуклеофилом хлорид-аниона с образованием конечного продукта. | |
Реакцию присоединения, показанную слева, можно рассматривать как протекающую в две стадии.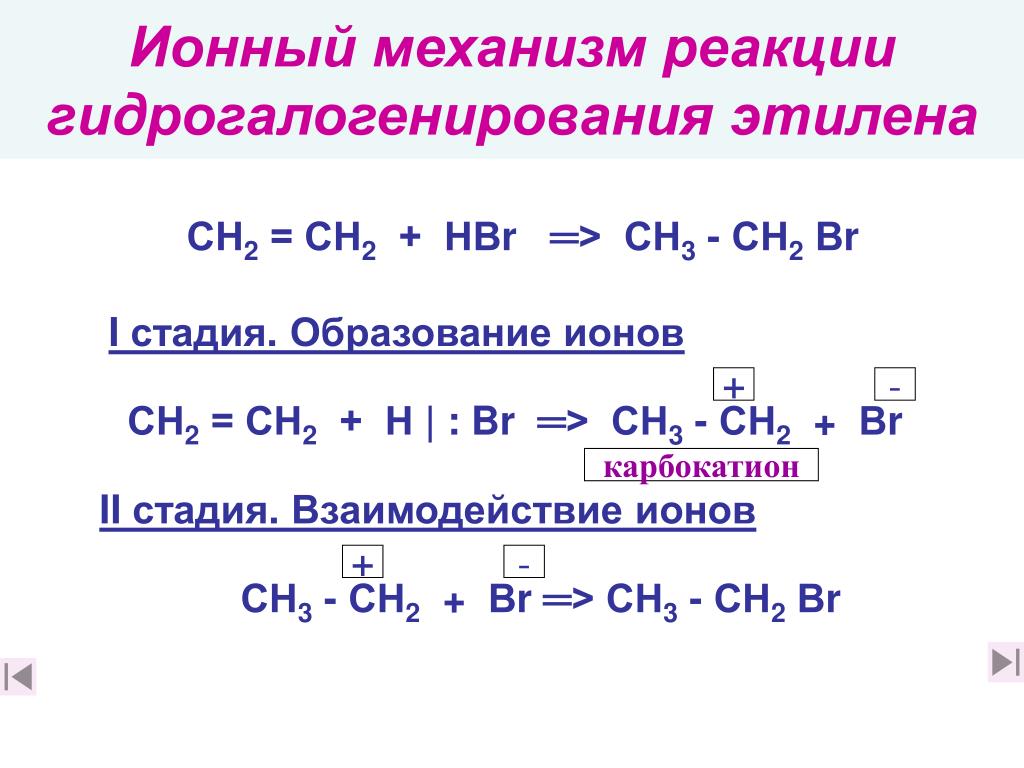 Первый этап снова можно рассматривать как кислотно-щелочное равновесие, при этом пи-электроны двойной углерод-углеродной связи функционируют как основание. Образующаяся сопряженная кислота представляет собой карбокатион, и этот электрофил соединяется с нуклеофильным анионом бромида. Первый этап снова можно рассматривать как кислотно-щелочное равновесие, при этом пи-электроны двойной углерод-углеродной связи функционируют как основание. Образующаяся сопряженная кислота представляет собой карбокатион, и этот электрофил соединяется с нуклеофильным анионом бромида. | |
| Реакция элиминирования, показанная слева, протекает в одну стадию. Операции разрыва и создания связи, которые происходят на этом этапе, описаны изогнутыми стрелками. Начальную стадию также можно рассматривать как кислотно-основное взаимодействие, когда ион гидроксида служит основанием, а атом водорода в составе алкилхлорида — кислотой. | |
| перегруппировка (таутомерия) | Существует много видов молекулярных перестроек. Примеры, показанные слева, относятся к важному классу, называемому таутомеризацией или, более конкретно, кето-енольной таутомеризацией. Таутомеры представляют собой быстро взаимопревращающиеся конституциональные изомеры, обычно отличающиеся другим расположением связи для лабильного атома водорода (здесь окрашены красным) и другим расположением двойной связи.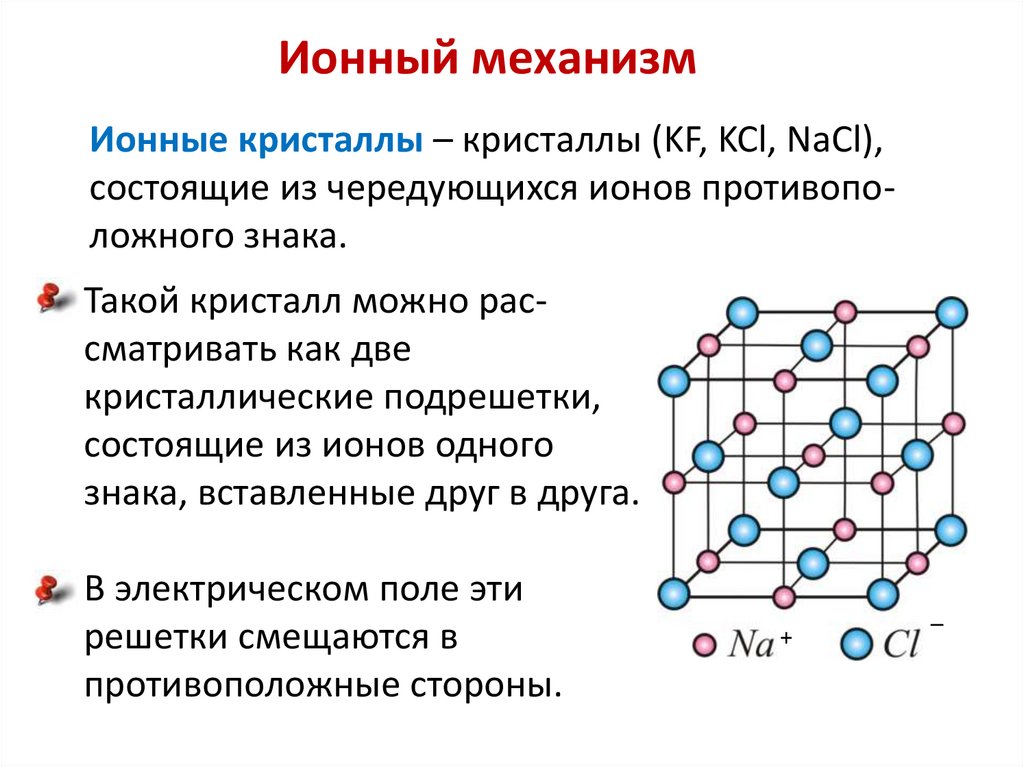 Равновесие между таутомерами не только быстро наступает в нормальных условиях, но часто сильно благоприятствует одному из изомеров (ацетон, например, 99,999% кето-таутомер). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов. Равновесие между таутомерами не только быстро наступает в нормальных условиях, но часто сильно благоприятствует одному из изомеров (ацетон, например, 99,999% кето-таутомер). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов. |
6.3: Механизмы реакции, включающие полярные функциональные группы: использование стрелок «электронного толкания\\’» распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги





 В этом примере образуется пропан-1-ол.
В этом примере образуется пропан-1-ол.

Leave A Comment