Ионный характер связи наиболее выражен в соединении
1) CCI4 2) CaBr2 3) SiO2 4) NH3
Ответ 2
25 . В молекуле BeCI2 угол между связями равен
1) 900 2) 1800 3) 1200 4) 1090
Ответ 2
26. В 400 г раствора гидроксида натрия с массовой долей растворенного вещества 10% содержится___моль NaOH
1)1 2) 10 3) 5 4) 2
Ответ 1
При взаимодействии 1 моль гидроксида натрия и 2 моль угольной кислоты образуется___соль
1) Кислая 2) средняя 3) основная 4) двойная
Ответ 1
28. Масса воды, необходимая для приготовления 400 г раствора с массовой долей нитрата калия 20% _____ гр.
1) 360 2) 320 3) 80 4) 160
Ответ 2
29. Порядковый номер элемента показывает:
1) число элементарных частиц 2) число нуклонов
3) число нейтронов 4) число электронов
Ответ 4
30. В каком ряду указаны элементы, относящиеся к s—семейству?
1) Н, К, Li 2) Н, С, Аl
3) Ве, С, О 4) Мg, Р, Сu
Ответ 1
Как меняется химическая активность щелочных металлов в направлении сверху вниз по подгруппе
1) возрастает 2) уменьшается
3) не изменяется 4) периодически возрастает
Ответ 1
Ионная связь образуется между атомами элементов, у которых
1) большая разница электроотрицательностей
2) большая разница в размерах атомов
3) одинаковая валентность
4) одинаковое количество электронов на внешнем уровне
Ответ 1
35. При взаимодействии избытка раствора NaOH с H3PO4 образуется…
1) Na2HPO3 2) NaH2PO4
3) Na3PO4 4) Na2HPO4
Ответ 3
36. Со щелочами взаимодействуют оксиды…
1) серы (IV) 2) азота (II)
3) железа (II) 4) хрома (II)
Ответ 1
Какие из приведенных оксидов обладают основными свойствами
1) K2O 2) NO
3) SO3 4) ZnO
Ответ 1
Какие из приведенных оксидов проявляют основные свойства
1) P2O5 2) NO2
3) CaO 4) SO2
Ответ 3
Какие из приведенных оксидов взаимодействуют с гидроксидом калия КОН
1) Na2O 2) CaO
3) SO2 4) К2О
Ответ 3
Какие из приведенных ниже оксидов проявляют основные свойства
1) SO3 2) ZnO
3) P2 O5 4) К2O
Ответ 4
Какой макроэлемент принимает участие в формировании костной ткани
1) марганец 2) железо
3) кальций 4) цинк
Ответ 3
Укажите формулу минерала, составляющего костную ткань
1)Mg10(РО4)6 (ОН)2 2)Са10(РО4)6 (ОН)2
3)Са3(РО4)2 4)Mg5(SО4)3 F2
Ответ 2
Укажите название минерала, составляющего костную ткань
1) апатит 2) фторапатит
3) гидроксиапатит 4) церезит
Ответ 3
Укажите суточную потребность в кальции у взрослого человека
1) 0,8 – 1,5 г 2) 3,5 — 5,0 г
3) 0,1 -0,5 г 4) 5,0 -8,0 г
Ответ 1
Какое из приведенных утверждений является правильным. Метаболизм кальция регулируется парат-гормоном, который ______ .
Метаболизм кальция регулируется парат-гормоном, который ______ .
1) способствует усвоению кальция, формированию костной ткани
2) обеспечивает постоянство концентрации кальция, при недостатке стимулирует выведение кальция из костной ткани в кровь
3) обеспечивает постоянство внутриклеточного кальция
4) обеспечивает усвоение кальция за счет образования минерала гидроксиапатита
Ответ 2
46. Какова физиологическая концентрация внутриклеточного (цитоплазматического) Са2+?
1) 10-3 моль/л 2) 10-7 моль/л
3) 10-5 моль/л 4) 10-2 моль/л
Ответ 2
Тест по теме: «Строение вещества»
Тест
по теме: «Строение вещества»
1.
Ионный характер связи наиболее выражен в соединении:
CaBr2
CCl4
SiO2
NH3
2.
В веществах, образованных путем соединения одинаковых атомов, химическая связь:
ионная
ковалентная полярная
водородная
ковалентная неполярная
3.
В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
KCl
CCl4
NH4Сl
CаСl2
4.
Кристаллическая решетка графита:
атомная
ионная
молекулярная
металлическая
5.
Установите соответствие между названием вещества и типом его кристаллической решетки:
НАЗВАНИЕ ВЕЩЕСТВА
ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
1)
бром
графит
3)
цезий
4)
нитрид алюминия
А)
ионная
Б)
атомная
В)
молекулярная
Г)
металлическая
6.
В каком ряду записаны формулы веществ только с ковалентной полярной связью?
Cl2, NH3, HCl
HBr, NO, Br2
H2S, H
HI, H2O, PH3
7.
Между атомами элементов с порядковыми номерами 11 и 17 возникает связь:
металлическая
ионная
ковалентная
донорно-акцепторная
8.
Установите соответствие между названием химического соединения и видом связи атомов в этом соединении:
НАЗВАНИЕ СОЕДИНЕНИЯ
ВИД СВЯЗИ
1)
цинк
2)
азот
3)
аммиак
4)
хлорид кальция
А)
ионная
Б)
металлическая
В)
ковалентная полярная
Г)
ковалентная неполярная
9.
Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решётку:
молекулярную
атомную
ионную
металлическую
10.
Укажите структурные компоненты комплексного соединения:
11.
Молекулярную кристаллическую решетку имеет соединение:
Li2O
HBr
BaO
KCl
12.
Установите соответствие между кристаллической решеткой и названием веществ:
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
1) 2)
НАЗВАНИЕ ВЕЩЕСТВА
А) углекислый газ
Б) оксид магния
В) натрий
Г) иод
13.
Какие из утверждений являются верными?
А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность.
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
верно только А
верно только Б
верны оба утверждения
14.
Заполните пропуски в схеме:
Химическая связь
Ионная
Молекулярное строение
Состав зависит от
условий получения
15.
Заполните таблицу «Типы кристаллических решеток и их характеристики»:
Характеристики
Тип решетки
Атомная
Ионная
Молекулярная
Металлическая
Вид частиц
в узлах решетки
Химическая связь
Примеры
веществ
ЭТАЛОНЫ ОТВЕТОВ
1.
1
2.
4
3.
3
4.
1
5.
1 – В; 2 — Б; 3 – Г; 4 — А
6.
4
7.
2
8.
1 – Б; 2 – Г; 3 – В; 4 — А
9.
3
10.
1 — внешняя сфера; 2 — внутренняя сфера; 3 — координационное число;
4 — лиганды; 5 — ион-комплексообразователь
11.
2
12.
1 — Г; 2 — А; 3 — Б; 4 — В
13.
1
14.
Химическая связь
Ковалентная
Ионная
Молекулярное
строение
Немолекулярное строение
Состав строго
постоянен
Состав зависит от
условий получения
15.
Характеристики
Тип решетки
Атомная
Ионная
Молекулярная
Металлическая
Вид частиц
в узлах решетки
Атомы
Ионы
Молекулы
Атомы и ионы
Химическая связь
Ковалентная
Ионная
Силы межмолекулярного взаимодействия
Металлическая связь
Примеры
веществ
Кремний,
алмаз
Соли,
основания
Йод, лед,
«сухой лед»
Медь, железо, золото
Задания а 4 (201 3 г) Ковалентная химическая связь, ее разновидности и механизмы образования.
 Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связьКовалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1) водородная 2) ковалентная неполярная 3) ковалентная полярная 4) ионная
1) вода и сероводород 2) бромид калия и азот 3) аммиак и водород 4) кислород и метан
1) ковалентная полярная и металлическая 2) ионная и ковалентная полярная 3) ковалентная неполярная и ионная 4) ковалентная полярная и ионная.
В молекуле бромоводорода химическая связь: 1) ковалентная неполярная, 2) ковалентная полярная, 3) водородная, 4) ионная.
Водородные связи образуются между молекулами: 1) H2, 2) CH4, 3) HF, 4) PH3.
По донорно-акцепторному механизму образуется связь в: 1) ионе гидроксония, 2) молекуле аммиака, 3) молекуле воды, 4) гидроксид-ионе.
В перечне веществ: a) Н2, б) H2SO4, в) NaOH, г) KF, д) CO2, е) S8, ковалентная полярная связь осуществляется в: 1) а б д, 2) а б е, 3) в г д, 4) б в д.
Ионная связь в веществах: 1) NH4Cl и KCl, 2) KCl и HCl, 3) HCl и LiOH, 4) LiOH и CS2.
Наиболее прочная связь в молекуле: 1) HCl, 2) HBr, 3) HF, 4) HI.
Наибольшую
длину имеет связь Э – Н в молекуле: 1)
H2Se,
2) H2Te,
3) H2O,
4)H2S.
Число σ-связей в молекуле бензола равно: 1) 3, 2) 6, 3) 9, 4) 12.
В молекуле серной кислоты: 1) 6 σ- и 2 π-связи, 2) 6 σ-связей, 3) 2 σ- и 2 π-связи, 4) 4 σ- и 2 π-связи.
Среди веществ: SO3, NH4NO2, HCOOH, NaNO3, CuI2 число соединений как с ионной, так и с ковалентной связью равно: 1) 1, 2) 2, 3) 3, 4) 4
Водородные связи образуются между молекулами: 1) H2, 2) CH4, 3) H2O, 4) PH3.
В каком веществе нет ковалентных связей: 1) CaCl2, 2) NH4Cl, 3) H2SO4, 4) CuSO4.
Ковалентных связей нет в соединении: 1) NaCl, 2) CH4, 3) NH4Cl, 4) NaNO3.
В каком веществе есть ковалентные связи: 1) KCl, 2) K2SO4, 3) K2S, 4) K2O.
В каком соединении присутствуют как ионные, так и ковалентные связи: 1) NaNO3, 2) HNO3, 3) NH3, 4) NaI.
В каком веществе есть ковалентные полярные связи: 1) графит, 2) белый фосфор, 3) поваренная соль, 4) углекислый газ.
В каком соединении есть ковалентные связи: 1) Na2S, 2) CaO, 3) KI, 4) CH3ONa.
В каком веществе есть ковалентные связи, образованные по донорно-акцепторному механизму: 1) СaCl2, 2) NH4Cl, 3) H2O, 4) CO2
Укажите
молекулу с наибольшей длиной связи:
1) H2, 2) F2,
3) HF, 4) Br2.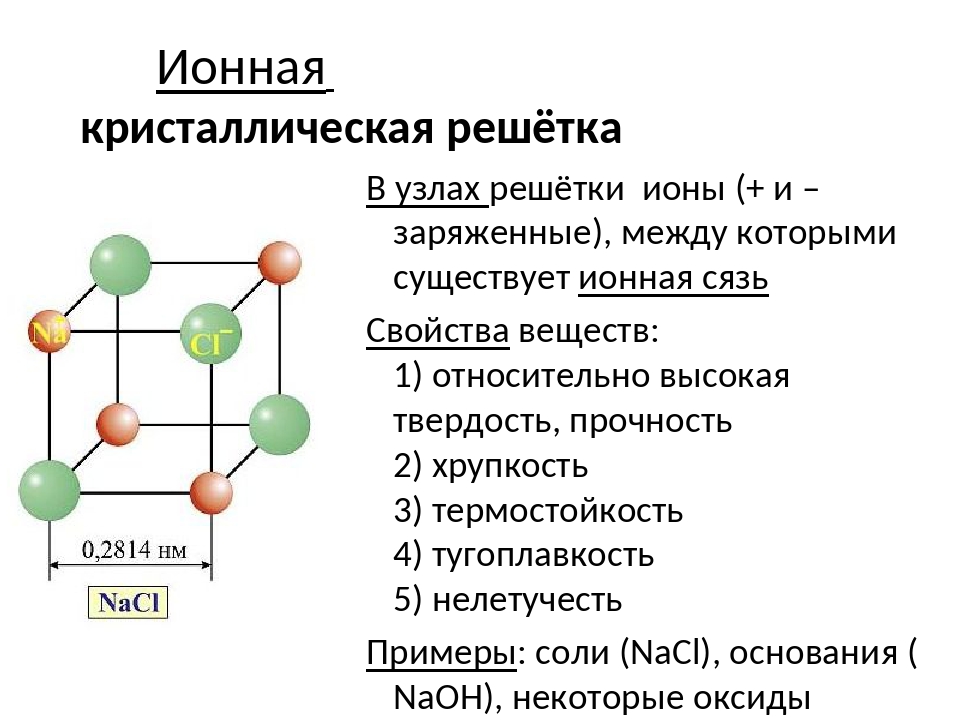
Укажите молекулу, в которой есть тройная связь между атомами: 1) N2, 2) O2, 3) F2, 4) I2.
Укажите молекулу, в которой химическая связь наименее прочная: 1) HF, 2) HCl, 3) HBr, 4) HI.
Какая химическая связь устанавливается между атомами элементов с порядковыми номерами 8 и 15? 1) ионная, 2) металлическая, 3) ковалентная полярная, 4) ковалентная неполярная.
Укажите вещество, в котором реализуется ионная связь: 1) BrF, 2) HBr, 3) Br2, 4) NaBr.
Укажите молекулу, в которой энергия химической связи наибольшая: 1) HF, 2) HCl, 3) HBr, 4) HI.
Укажите вещество, в котором кислород участвует в образовании ионной связи: 1) О2, 2) CO2, 3) H2O, 4) CaO.
Укажите вещество, в котором кислород участвует в образовании ковалентной полярной связи: 1) О2, 2) NO2, 3) Na2O, 4) CaO.
В каком ряду записаны формулы веществ, в которых между молекулами есть водородные связи: 1) HF, H2O, 2) H2, H3PO4, 3) HCl, PH3, 4) CH4, C2H2.
Укажите вещество, в котором фтор образует ковалентные полярные связи: 1) NaF, 2) CaF2, 3) OF2, 4) F2.
В
каком ряду записаны двухатомные молекулы
в порядке убывания энергии связи:
1) H – I,
H – F,
2) H – H, N
≡ N, 3) O
= O, C ≡ O,
4) Cl – Cl,
I – I.
В каком ряду записаны формулы только неполярных молекул? 1) Сl2, CH4, 2) HCl, Br2, 3) H2O, C2H5OH, 4) NH3, HI
В каком ряду записаны формулы веществ только с ионной связью: 1) H2S, HF, 2) NaCl, KF, 3) CaCO3, H2O, 4) SO3, CH4.
В каком ряду записаны формулы веществ, в которых существует водородная связь? 1) NH3, HF, 2) HCl, LiH, 3) HNO3, CH4, 4) C2H6, C2H4O.
Укажите частицу, которая может быть донором электронов при образовании химической связи: 1) Н+, 2) NH4+, 3) NH3, 4) Na+.
Укажите молекулу, в которой энергия химической связи наибольшая: 1) О2, 2) HCl, 3) Cl2, 4) CH4.
Какая из перечисленных молекул требует наибольшей затраты энергии для разложения на атомы? 1) Н2, 2) N2, 3) HCl, 4) HI.
В каком процессе поглощается наибольшее количество энергии (на одну исходную молекулу)? 1) Н2 → Н+Н 2) N2 N+N 3) HI → H+I 4) HCl → H+Cl
В какой молекуле химическая связь самая прочная? 1) СO, 2) HCl, 3) Br2, 4) HI.
Какая
из перечисленных молекул требует
наименьшей затраты энергии для разложения
на атомы? 1) I2,
2) N2,
3) O2,
4) CO.
В какой молекуле энергия химической связи углерод – углерод наименьшая? 1) C2H2, 2) C2H4, 3) C2H6, 4) C6H6.
Сколько электронов участвует в образовании химических связей в молекуле ацетилена (этина)? 1) 6, 2) 8, 3) 10, 4) 14.
Сколько электронов участвует в образовании химических связей в молекуле этилена? 1) 4, 2) 6, 3) 12, 4) 16.
В соединении калия с хлором химическая связь: 1) ковалентная полярная, 2) ковалентная неполярная, 3) ионная, 4) металлическая.
В соединении калия с кислородом химическая связь: 1) металлическая, 2) ковалентная полярная, 3) ковалентная неполярная, 4) ионная.
Тип связи в молекуле азотной кислоты: 1) ковалентная полярная, 2) ионная, 3) металлическая, 4) ковалентная неполярная.
Химическая связь соответственно: ионная, ковалентная полярная, ковалентная неполярная: 1) NaCl, NH3, Br2, 2) H2O, CaO, KCl, 3) Cl2, MgO, HCl, 4) NaOH, H2S, CO.
Ковалентная неполярная связь в веществе: 1) аммиак, 2) сероводород. 3) хлор, 4) железо.
Формула вещества с ионной связью: 1) K2S, 2) NH3, 3) O2, 4) H2O.
Формула
вещества с ковалентной полярной связью:
1) KNO3, 2) HNO3,
3) Cl2, 4) NaCl.
Какое из веществ образовано металлической связью: 1) SO3, 2) N2O, 3) Br2, 4) Fe
Вещество, не образованное ионной связью: 1) хлорид калия, 2) оксид натрия, 3) хлорид магния, 4) оксид серы (VI).
Какое из веществ образовано ионной связью: 1) NH3, 2) K2O, 3) H2O, 4) CH4.
Какое из указанных веществ имеет ковалентную неполярную связь: 1) Br2, 2) NO2, 3) CO, 4) NaCl.
Какое из указанных веществ имеет ковалентную полярную связь: 1) Na2S, 2) N2, 3) H2S, 4) CaO.
Тип связи в веществе, формула которого H2CO3: 1) ковалентная неполярная, 2) ионная, 3) металлическая, 4) ковалентная полярная.
Тип связи в веществе, формула которого СuO: 1) металлическая, 2) ионная, 3) ковалентная полярная, 4) ковалентная неполярная.
Ковалентная полярная связь характерна для каждого из двух веществ: 1) алмаз, хлорид калия, 2) кислород, метан, 3) сероводород, вода, 4) калий, аммиак.
Ионная
связь характерна для каждого из двух
веществ: 1) магний, хлорид натрия, 2)
оксид кальция, бромид калия, 3) вода,
азот, 4) графит, сульфат натрия.
Ковалентная неполярная связь характерна для каждого из двух веществ: 1) оксид углерода (II), хлорид калия, 2) аммиак, углекислый газ, 3) кислород, азот, 4) бромид калия, бром.
Ионная и ковалентная полярная связь соответственно у веществ: 1) NaBr, CH4, 2) NH3, O2, 3) H2O, H2S, 4) KCl, Na2O.
Ковалентная неполярная и ковалентная полярная связи соответственно у веществ: 1) O2, NaCl, 2) N2, CH4, 3) KBr, CO, 4) Br2, Cl2.
Ионная и ковалентная неполярная связи соответственно у веществ: 1) NH3, O2, 2) CaO, H2O, 3) Cl2, H2S, 4) MgCl2, Br2.
В веществе, формула которого FeCl3 тип связи: 1) ионная, 2) ковалентная полярная, 3) ковалентная неполярная, 4) металлическая.
В веществе NH4Cl отсутствует вид связи: 1) ковалентная полярная, 2) ионная, 3) ковалентная неполярная, 4) нет правильного ответа.
В
веществе С2Н4 химическая
связь:
1) ионная
и ковалентная неполярная,
2) ионная и ковалентная полярная,
3) ковалентная полярная
и ковалентная неполярная, 4) металлическая
и ковалентная полярная.
Химическая связь в молекуле PH3: 1) ионная, 2) ковалентная полярная, 3) ковалентная неполярная, 4) металлическая.
Выберите формулу вещества, образованного с помощью ковалентной полярной связи: 1) MgCl2, 2) N2, 3) NF5, 4) BaCl2.
В силикате натрия связи: 1) ковалентные полярные и ионные, 2) все связи ковалентные, 3) все связи ионные, 4) ионные и ковалентные полярные.
В гидроксиде калия связи: 1) ковалентные полярные и металлические, 2) все связи ионные, 3) все связи ковалентные полярные, 4) ионные и ковалентные полярные.
В серной кислоте связи: 1) ионные, 2) ковалентные полярные, 3) ковалентные полярные и неполярные, 4) ковалентные неполярные.
В
кристалле хлорида калия ионная связь,
поэтому хлорид калия:
1) пластичен,
2) обладает резким запахом,
3) тугоплавок, 4) летуч.
В кристалле алмаза между атомами углерода прочная ковалентная связь, поэтому алмаз: 1) тугоплавкий, 2) растворимый в воде, 3) пластичный, 4) летучий.
В каких веществах ионная и металлическая связи соответственно: 1) оксид калия и кислород, 2) аммиак и хлор, 3) магний и вода, 4) бромид натрия и железо.
Ионный характер — Справочник химика 21
Ионный характер связи, выраженный через степень ионности в процентах, указан для нескольких молекул в табл. 12-3. Согласно оценке величины дипольного момента, степень ионности связи в НС1 всего 17%, а в KF 83%. [c.537]Ионный характер (степень ионности) связи, рассчитанный по днпольному моменту молекулы [c.536]
Гетероядерные двухатомные молекулы. Электрические дипольные моменты. Ионный характер связи. [c.509]
Каким образом дипольный момент двухатомной молекулы позволяет оценить ионный характер связи Какова степень ионности связи в молекуле НР [c.546]
В гетероядерной двухатомной молекуле АВ, где В-более электроотрицательный атом, чем А, связывающая молекулярная орбиталь содержит больший вклад атомной орбитали атома В, а разрыхляющая молекулярная орбиталь больше напоминает атомную орбиталь атома А. Если разность электроотрицательностей атомов А и В очень велика, как, например, в КР, валентные электроны локализуются на более электроотрицательном атоме (в данном случае Р) и представление о ковалентной связывающей орбитали теряет свой смысл. В такой ситуации правильнее говорить об ионной структуре К Р . Большинство гетероядерных двухатомных молекул имеют промежуточный характер связи между ионными парами и ковалентно связанными атомами другими словами, они имеют частично ионный характер связи и могут описываться структурами А В . [c.544]
[c.544]
Электроотрицательность. Ионный характер связи. [c.385]
У какого из веществ сильнее выражен ионный характер связи, К1 или ВаО Чему равна степень ионности каждой из этих молекул в процентном выражении (Данные о дипольных моментах указанных молекул следует найти в справочниках.) [c.548]
При разности электроотрицательностей больше 2,0 связь может считаться ионной при разности 0,4-2,0 возникает ковалентная связь с частично ионным характером, и при разности меньше 0,4 связь считается чисто ковалентной. [c.406]
Эти доводы можно представить себе в более ясной форме при более точном рассмотрении природы частично образованной связи С—2 в переходном состоянии. Такие частично образованные связи между углеродом и электрофильным атомом или группой 2 должны были бы иметь более сильно выраженный ионный характер с меняющейся долей участия в ковалентной связи, в зависимости от природы реагента. Сильно электрофильный реагент Ъ будет требовать низкой энергии активации, и С—Ъ связь будет по характеру сильно ионной. Такая связь будет требовать лишь незначительного участия электронов заместителя в кольце. Следовательно, заместители будут проявлять только слабое направляющее влияние на входящие группы. [c.426]
Для какой из перечисленных ниже молекул следует ожидать наибольшего ионного характера связи [c.590]
Потенциал сложного редокси-электрода является функцией не только активностей окисленных н восстановленных частиц, но и активности водородных ионов. Характер зависимости потенциала редокси-электрода от активности водородных ионов определяется при этом природой реагирующих частиц. Так, иапример, для системы МпО -—Мп2+, в которой протекает электродная реакция [c.171]
В действительности же момент диполя газообразного хлорида водорода равен 0,347-10 Кл-м, что составляет примерно 18% от рассчитанного . i в предположении ионного характера связи. Таким образом, эффективные заряды на атомах Н и С1 в молекуле НС равны 0,18 абсолютного заряда электрона. [c.85]
i в предположении ионного характера связи. Таким образом, эффективные заряды на атомах Н и С1 в молекуле НС равны 0,18 абсолютного заряда электрона. [c.85]
Поэтому по окислительной активности водород существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочноземельных, например КН и СаНа. [c.276]
Связь между атомами разных элементов всегда более или менее полярна, что обусловлено различием размеров и электроотрица-т(льностей атомов. Например, в молекуле хлорида водорода НС1 стязующее электронное облако смещено в сторону более электро-огрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в НС1 поляризован положительно, а атом хлора отрицательно на атоме водорода возникает положительный заряд, на атоме хлора — отрицательный. Этот заряд б, называемый эффективным, можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы H I составляет бн = +0,18, а на атоме хлора 6 i = —0>18 абсолютного за-р 1да электрона. Можно сказать, что связь в молекуле НС1 имеет на 18% ионный характер, т. е. полярна. Ниже приведены значения эффективных зарядов на атомах кислорода в оксидах элементов 3-го периода [c.80]
Так, папример, большая скорость замещения фтора объясняется более сильным ионным характером фторидов по сравнению с другими галоидпроизводными [c.479]
Проведенное выше рассмотрение характера связи в HF показывает, что не сушествует чисто ионных, как и чисто ковалентных связей. Не существует и принципиального различия между этими двумя типами связи-они лишь являются предельными случаями непрерывного ряда связей с различной полярностью. В рамках теории молекулярных орбиталей гораздо большее значение, чем оценка ионного характера связи, имеет близость энергетических уровней взаимодействующих орбиталей двух атомов. Эта степень близости уровней связана с электроотрицательностью атомов. [c.537]
Эта степень близости уровней связана с электроотрицательностью атомов. [c.537]
В приведенной классификации учтены природа молекул, определяющая поверхностные эффекты, ионный характер (анионный, катионный, амфотерный) соединений и наличие других структурных элементов. [c.338]
Атомная связь с частично ионным характером [c.54]
Хотя теория кристаллического поля оказалась плодотворной в трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить положения лигандов в спектрохнмическом ряду, а также са.м факт образования некоторых ком плексов, например, так называемых сэндвичевых соединений — дибензолхрома Сг(СбНб)2, ферроцена Fe ( 51 5)2 и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный ион, не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами. [c.598]
Как известно, электропроводность цеолитов связана с движением катионов [689]. Энергия активации процесса, происходящего в цеолите NaA при 230 К, для одного из образцов составила 60 кДж/моль, а энергия активации электропроводности при измерении на постоянном токе в том же образце и в той же температурной области — 56 кДж/моль. Поскольку электропроводность цеолитов имеет ионный характер, близость энергий активации электропроводности и поляризации указывает на ионное происхождение максимумов токов ТСД. [c.259]
Электроотрицательность является мерой способности атома притягивать к себе электроны, обобществляемые при образовании связи с другим атомом. Пользуясь данными, приведенными в табл. 9-1, можно предсказать, что связь в молекуле СзР будет ионной, а в молекуле СН -ковалентной. Характер связи в молекуле НР должен быть промежуточным между предельными случаями СзР и СН . Связывающие электроны в молекуле НР оттягиваются по направлению к атому Р, вследствие того что его электроотрицательность больше. Связь в НР имеет частично ионный характер, что схематически отображается структурой Н Р° (где 5 и 5 — соответствуют дробным зарядам, меньшим 1). Вообще говоря, связи между атомами имеют различную степень ионного характера, или различную степень ионности, зависящую от разности их электроотрицательностей. [c.406]
Характер связи в молекуле НР должен быть промежуточным между предельными случаями СзР и СН . Связывающие электроны в молекуле НР оттягиваются по направлению к атому Р, вследствие того что его электроотрицательность больше. Связь в НР имеет частично ионный характер, что схематически отображается структурой Н Р° (где 5 и 5 — соответствуют дробным зарядам, меньшим 1). Вообще говоря, связи между атомами имеют различную степень ионного характера, или различную степень ионности, зависящую от разности их электроотрицательностей. [c.406]
При рассмотрении комплексов или кристаллов с выраженным ионным характером можно воспользоваться очень простыми электростатическими соображениями. Система сферических ионов образует структуру с минимальной потенциальной энергией, и при увеличении отношения ионных радиусов катионов и анионов (гд /гв) можно предсказать появление следующих координационных многогранников [c.16]
Пользуясь значениями электроотрицательности, предскажите, имеет ли связь в а) СаО, б) HI. в1 SiH, г) Вг и д) I I чисто ковалентный, чисто ионный или частично ионный характер. В случае чисто ионной и частично ионной связей укажите ожидаемое распределение зарядов. [c.407]
Сначала рассмотрим более общий случай исключения влияния межфазного массопереноса. Характер температурной зависимости (энергия активации) не может служить в жидкофазных реакциях надежным критерием оценки по ряду причин. Вследствие возможного клеточного диффузионно-контролируемого механизма или ионного характера реакции истинная энергия активации реакции может быть малой. Далее, как указывалось в предыдущем разделе, наблюдаемая температурная зависимость может быть следствием изменения коэффициентов распределения реагентов между фазами. Вблизи критической области такое влияние может быть особенно сильным и сказывается такнлб на соотношении объемов фаз. Наконец, в жидкостях, в отличие от газов, сам коэффициент диффузии зависит от температуры экспоненциально, причем эффективная энергия активации диффузии в вязких жидкостях составляет заметную величину. Поэтому обычно о переходе в кинетическую область судят ио прекращению зависимости скорости реакции от интенсивности перемешивания или барботажа. Здесь, однако, есть опасность, что при больших скоростях перемешивания может наступить автомодельная область, а ири очень интенсивном барботаже измениться гидродинамический режим. В результате объемный коэффициент массопередачи может стать инвариантным к эффекту перемешивания и ввести, таким образом, в заблуждение исследователя. В трехфазных каталитических реакторах этот прием более надежен ири условии неизменности соотношения фаз в потоке. [c.74]
Поэтому обычно о переходе в кинетическую область судят ио прекращению зависимости скорости реакции от интенсивности перемешивания или барботажа. Здесь, однако, есть опасность, что при больших скоростях перемешивания может наступить автомодельная область, а ири очень интенсивном барботаже измениться гидродинамический режим. В результате объемный коэффициент массопередачи может стать инвариантным к эффекту перемешивания и ввести, таким образом, в заблуждение исследователя. В трехфазных каталитических реакторах этот прием более надежен ири условии неизменности соотношения фаз в потоке. [c.74]
Диссоциация молекул веществ, имеющих атомную связь с частично ионным характером [c.82]
Кроме сернистых соединений вредной составной частью мазутов являются металлы, особенно ванадий. Для борьбы с дезактивирующим отложением металлов на катализаторах нужно искать новые, более стабильные катализаторы. Это, скорее всего, должны быть широкопористые контакты, содержащие промоторы, подавляющие блокировку активных центров высокомолекулярными компонентами, особенно азотистыми основаниями. Для предотвращения коксообразования из-за водородного голодания катализаторы не должны иметь высокой кислотности и ярко выраженного ионного характера. Они должны отличаться очень высокой гидрирующей активностью. [c.303]
Любое изменение растворителя или катализатора, увеличивающее электрофильные свойства замещающего агента, должно сказываться в увеличении ионного характера связи С—Ъ и в увеличении атаки в л -поло-жение толуола. Так, бромирование толуола в присутствии катализаторов с возрастающей злектрофильностью [c.426]
Ионный характер (степень ионности) связи в двухатомной молекуле (в процентах) может быть оценен по отношению экспериментально наблю-даем ого дипольного момента (щ сп) к рассчитанному дипольному моменту (йрассч)> соответствующему идеально ионной структуре [c.545]
В каждом периоде периодической таблицы наблюдается общая тенденция к возрастанию энергии ионизации с увеличением порядкового номера элемента.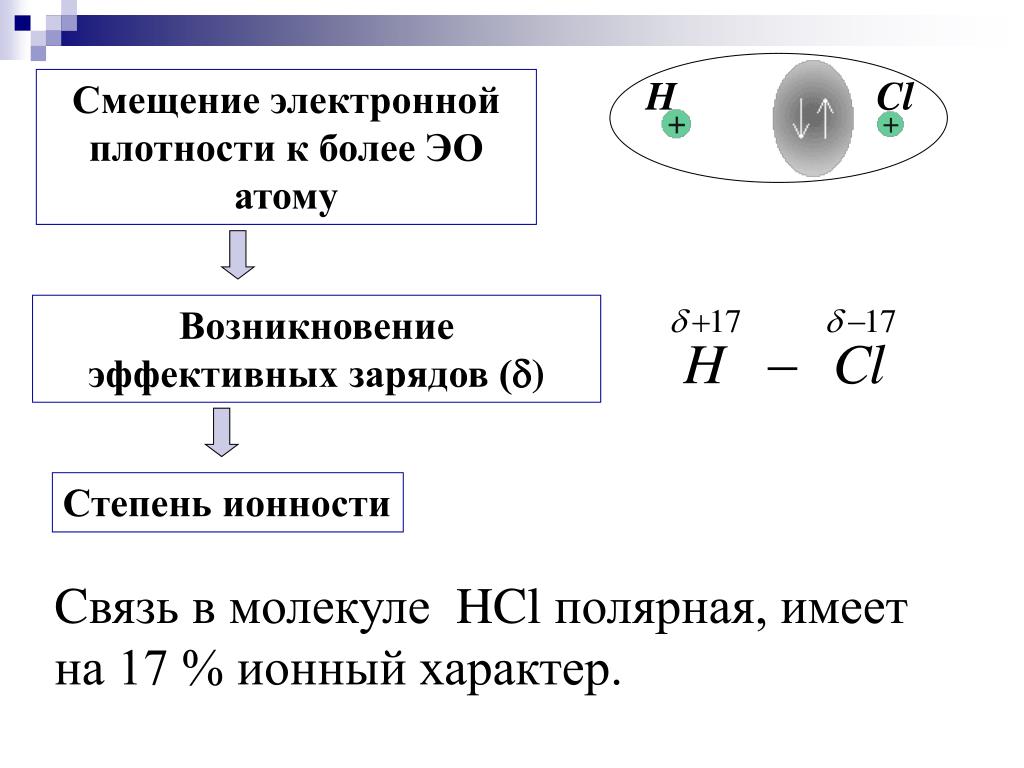 Сродство к электрону оказывается наибольшим у кислорода и галогенов. Атомы с устойчивыми орбитальными конфигурациями.(s , s p , s p ) имеют очень небольшое (часто отрицательное) сродство к электрону. Расстояние между ядрами двух связанных атомов называется длиной связи. Атомный радиус водорода Н равен половине длины связи в молекуле Hj- В каждом периоде периодической таблицы наблюдается в общем закономерное уменьшение атомного радиуса с ростом порядкового номера элемента. Электроотрицательность представляет собой меру притяжения атомом электронов, участвующих в образовании связи с другим атомом. При соединении атомов с си.пьно отличающейся электроотрицательностью происходит перенос электронов и возникает ионная связь атомы с приблизительно одинаковой электроотрицательностью обобществляют электроны, участвующие s сбразовашг. ковалентной связи. Между атомами типа Н и F с умеренной разностью электроотрицательностей образуется связь с частично ионным характером. [c.408]
Сродство к электрону оказывается наибольшим у кислорода и галогенов. Атомы с устойчивыми орбитальными конфигурациями.(s , s p , s p ) имеют очень небольшое (часто отрицательное) сродство к электрону. Расстояние между ядрами двух связанных атомов называется длиной связи. Атомный радиус водорода Н равен половине длины связи в молекуле Hj- В каждом периоде периодической таблицы наблюдается в общем закономерное уменьшение атомного радиуса с ростом порядкового номера элемента. Электроотрицательность представляет собой меру притяжения атомом электронов, участвующих в образовании связи с другим атомом. При соединении атомов с си.пьно отличающейся электроотрицательностью происходит перенос электронов и возникает ионная связь атомы с приблизительно одинаковой электроотрицательностью обобществляют электроны, участвующие s сбразовашг. ковалентной связи. Между атомами типа Н и F с умеренной разностью электроотрицательностей образуется связь с частично ионным характером. [c.408]
При низких температурах эти металлы покрыты защитной пленкой оксида и поэтому оказываются более инертными, чем можно судить по их окислительным потенциалам. У верхнего представителя этой группы оксид УзОд обладает амфотерными свойствами, подобно Т102. Он растворим и в кислотах, и в основаниях, образуя при этом сложные полимеры с плохо различимыми свойствами. В состоянии окисления +4 ванадий также образует соединения, которые проявляют свойства, промежуточные между ионными и ковалентными УС14-молекулярная жидкость с температурой кипения 154 С. В отличие от этого соединения У(П1) имеют ионный характер. [c.441]
Если льюисова структура включает атомы с различной электроотри-цательностью, степени их окисления определяются путем условного отнесения всех связывающих электронных пар к более электроотрицательному партнеру, как если бы связь имела чисто ионный характер. Например, льюисова структура для СО2 имеет вид [c.502]
Если провести математические операции, выражаемые словами скомбинируем две атомные орбитали так, чтобы получить разрыхляющую и связывающие молекулярные орбитали , то обнаружится, что две такие атомные орбитали должны обладать достаточно близкими энергиями. В молекуле каждая из двух молекулярных орбиталей содержит 50%-ный вклад от Ь-орбитали каждого атома водорода. В противоположность этому если в молекуле АВ скомбинировать орбиталь атома А, обладающую очень высокой энергией, и орбиталь атома В с довольно низкой энергией, то математические выкладки покажут, что разрыхляющая молекулярная орбиталь представляет собой почти чистую исходную орбиталь атома А, а связывающая орбиталь — почти чистую исходную орбиталь атома В. Следовательно, пара электронов на такой связывающей орбитали в сущности находится вовсе не на настоящей ковалентной связывающей орбитали. На самом деле речь идет о неподеленной паре электронов на атомной орбитали атома В. Взаимодействие атомных орбиталей двух атомов с больщим различием в энергиях пренебрежимо мало. На примере молекулы НР мы увидим, что это означает, если принять во внимание частично ионный характер связи. [c.532]
В молекуле каждая из двух молекулярных орбиталей содержит 50%-ный вклад от Ь-орбитали каждого атома водорода. В противоположность этому если в молекуле АВ скомбинировать орбиталь атома А, обладающую очень высокой энергией, и орбиталь атома В с довольно низкой энергией, то математические выкладки покажут, что разрыхляющая молекулярная орбиталь представляет собой почти чистую исходную орбиталь атома А, а связывающая орбиталь — почти чистую исходную орбиталь атома В. Следовательно, пара электронов на такой связывающей орбитали в сущности находится вовсе не на настоящей ковалентной связывающей орбитали. На самом деле речь идет о неподеленной паре электронов на атомной орбитали атома В. Взаимодействие атомных орбиталей двух атомов с больщим различием в энергиях пренебрежимо мало. На примере молекулы НР мы увидим, что это означает, если принять во внимание частично ионный характер связи. [c.532]
Возникающая в результате образования молекулярных орбиталей комплекса диаграмма энергетических уровней изображена на рис. 20-14. В ее нижней части находятся уровни шести связывающих орбиталей, заполненные электронными парами. Их можно пр)едставить как шесть электронных пар, поставляемых лигандами-донорами, и больше не обращать на них внимания. Точно так же можно исключить из рассмотрения четыре верхние разрыхляющие орбитали, являющиеся пустыми, за исключением предельных случаев сильного электронного возбуждения, которыми можно пренебречь. Несвязывающий уровень и нижний разрыхляющий уровень соответствуют двум уровням, и вд, к которым приводит расщепление кристаллическим полем (см. рис. 20-13). Мы будем продолжать называть их по-прежнему уровнями 12д и е даже в рамках молекулярно-орбитального подхода. Но важно отметить разницу в объяснении расщепления между этими уровнями. В теории кристаллического поля оно является следствием электростатического отталкивания, а в теории поля лигандов-следствием образования молекулярных орбиталей. Как мы убедились в гл. 12 на примере молекул НР и КР, теория молекулярных орбиталей позволяет охватить все случаи от чисто ионной до чисто ковалентной связи. Поэтому выбор между теорией кристаллического поля и теорией поля лигандов основан лишь на рассмотрении одной из двух предельных моделей связи. В комплексе СоР довольно заметно проявляется ионный характер связи, потому что, как можно видеть из рис. 20-14, орбитали лигандов располагаются по энергии ниже орбиталей металла и ближе к связывающим молекулярным орбиталям. Поэтому связывающие молекулярные орбитали по характеру должны приближаться к орбиталям лигандов, а это должно обусловливать смещение отрицательного заряда в направлении к лигандам. Таким образом, связи в данном случае должны быть частично ионными. [c.235]
Поэтому выбор между теорией кристаллического поля и теорией поля лигандов основан лишь на рассмотрении одной из двух предельных моделей связи. В комплексе СоР довольно заметно проявляется ионный характер связи, потому что, как можно видеть из рис. 20-14, орбитали лигандов располагаются по энергии ниже орбиталей металла и ближе к связывающим молекулярным орбиталям. Поэтому связывающие молекулярные орбитали по характеру должны приближаться к орбиталям лигандов, а это должно обусловливать смещение отрицательного заряда в направлении к лигандам. Таким образом, связи в данном случае должны быть частично ионными. [c.235]
Степень ионности связи в НС1 17%, в s l 75%, в Т1С1 29% s l должен иметь наибольшую степень ионности связи, поскольку атомы щелочных металлов обладают очень низкой злектроотрицательностью (а валентный 5-электрон у атома тяжелого элемента группы IA, каковым является С, находится далеко от ядра, вследствие чего его энергия ионизации очень низка) ионный характер связи в этих молекулах повышается по мере уменьшения электроотрицательности атома, присоединенного к С1 хн = 2,20 Хп = 2,04 Хс = 0,79. [c.523]
На примере гетероядерных двухатомных молекул можно проиллюстрировать необходимость в надлежащей орбитальной симметрии для получения максимального перекрывания и взаимодействия, а также сооткошекяе между энергетическим соответствием атомных орбиталей и ионным характером образующейся связи. В качестве метода измерения ионного характера связи можно обсудить дипольные моменты. [c.576]
Поскольку каталитическую активность связывали с поверхностными гидроксильными группами, природу гидроксильных групп на А12О3 изучали при помощи ИК-спектроскопии [27]. На поверхности окиси алюминия были идентифицированы гидроксильные группы трех типов, и оказалось, что связи групп ОН с поверхностью А1гОз носят преимущественно ионный характер. Гидроксильные группы легко обменивают водород, но скорость обмена значительно ниже, чем при изомеризации бутена-1 на том же катализаторе. [c.152]
Влияние скорости газового потока на скорость химического процесса подтверждает внешнедиффуз,ионный характер протекания процесса, причем скорость реакции пропорциональна линейной скорости потока в степени, близкой к 0,76 [c.86]
8 класс Химическая связь | Методическая разработка по химии (11 класс) на тему:
Самостоятельная работа «Химическая связь»
В тетради чертите табличку и в соответствии с номером вопроса ставите вариант ответа:
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
ответ |
1. Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaBr2 4) Nh4
2. Атомы химических элементов второго периода периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава
1) BaS 2) CO2 3) Al2O3 4) LiF
3. В веществах, образованных путем соединения одинаковых атомов, химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
4. В молекуле F2 химическая связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
5. Химическая связь в молекуле фтороводорода
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
6. В KNO3 химическая связь
1) ковалентная неполярна 2) ковалентная полярная 3) металлическая 4) ионная
7. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) Cl2, Nh4, HCl 2) HBr, NO, Br2 3) h3S, h3O, S8 4) HI, h3O, Ph4
81. Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) донорно-акцепторная
9. Ионы являются структурными частицами
1) кислорода 2) воды 3) CO2 4) хлорида натрия
10. Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
11. Соединением с ковалентной неполярной связью является
1) HCl 2) O2 3) CaCl2 4) h3O
12. В сероуглероде CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
13. Установите соответствие между названием химического соединения и видом связи атомов в этом соединении.
НАЗВАНИЕ СОЕДИНЕНИЯ ВИД СВЯЗИ
1) цинк А) ионная
2) азот Б) металлическая
3) аммиак (Nh4) В) ковалентная полярная
4) хлорид кальция (CaCl2) Г) ковалентная неполярная
14. Установите соответствие между видом связи в веществе и формулой химического соединения.
ВИДЫ СВЯЗИ ФОРМУЛЫ СОЕДИНЕНИЙ
1) ионная А) h3
2) металлическая Б) Ba
3) ковалентная полярная В) HF
4) ковалентная неполярная Г) BaF2
15. Ковалентная неполярная связь реализуется в соединении
1) CrO3 2) P2O5 3) SO2 4) F2
16. В Nh4 и BaCl2 химическая связь соответственно
1) ионная и ковалентная полярная 2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная
17. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) вода и h3S 2) KBr и N2 3) Nh4 и h3 4) O2 и Ch5
18. Наименьшей электроотрицательностью обладает элемент
1) Be 2) B 3) C 4) N
19. Наиболее прочная химическая связь имеет место в молекуле
1) F2 2) Cl2 3) O2 4) N2
20. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
21. За счет общей электронной пары химическая связь образована в соединении
1) KI 2) HBr 3) Li2O 4) NaBr
22. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота 2) сероводорода 3) метана 4) хлора
23. Ковалентная полярная связь характерна для
1) KСl 2) HBr 3) Р4 4) CaCl2
24. Вещества только с ковалентной полярной связью указаны в ряду:
1) CaF2, Na2S, N2 2) P4, FeCl3, Nh4 3) SiF4, HF, h3S 4) NaCl, LiH, SO2
25. В каком соединении полярность связи наименьшая?
1) HBr 2) h3O 3) h3S 4) HCl
26. Вещества с ковалентной полярной связью находятся в ряду:
1) Nh4, SF6, h3S 2) KF, HF, CF4 3) CO2, N2, HF 4) SO2, NO2, Cl2
27. Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
28. Веществом с ковалентной полярной связью является
1) Cl2 2) NaBr 3) h3S 4) MgCl2
29. Ковалентная неполярная связь характерна для каждого из двух веществ:
1) водорода и хлора 2) воды и алмаза 3) меди и азота 4) брома и метана
30. Только ковалентные связи имеет каждое из двух веществ:
- CaO и C3H6 2) NaNO3 и CO 3) N2 и K2S 4) Ch5 и SiO2
- Хлорид бария имеет кристаллическую решётку
1) атомную 2) металлическую 3) ионную 4) молекулярную
- Ковалентная неполярная связь характерна для
1) Cl2 2) SO3 3) CO 4) SiO2
- Из перечисленных элементов наиболее электроотрицательным является
1) азот 2) кислород 3) хлор 4) фтор
- Бром в твердом состоянии имеет кристаллическую решётку
1) молекулярную 2) металлическую 3) ионную 4) атомную
- Ковалентная полярная связь характерна для вещества
1) KI 2) CaO 3) Na2S 4) Ch5
- Кристаллическая решётка кремния
1) атомная 2) молекулярная 3) ионная 4) металлическая
- Водородные связи образуются между молекулами
1) метанола 2) метана 3) ацетилена 4) метилформиата
- Наиболее электроотрицательным элементом из перечисленных является
1) кремний 2) азот 3) фосфор 4) калий
- Немолекулярное строение имеет каждое из двух веществ:
1) S8 и О2 2) Na2CO3 и I2 (тв) 3) СО и Mg 4) Fe и NaCl
- Химическая связь между молекулами воды
1) водородная 2) ионная 3) ковалентная полярная 4) ковалентная неполярная
- Хлорид калия имеет кристаллическую решетку
1) атомную 2) молекулярную 3) ионную 4) металлическую
- К веществам с молекулярным строением относятся
1) графит и оксид углерода (IV) 2) вода и оксид углерода (II)
3) сера и оксид железа (III) 4) серная кислота и оксид кремния (IV)
- Соединению с ковалентной связью соответствует формула
1) Na2O 2) MgCl2 3) CaBr2 4) HF
- Молекулярное строение имеет
1) цинк 2) нитрат бария 3) гидроксид калия 4) сероводород
- Вещество с ковалентной неполярной связью имеет формулу
1) h3O 2) Br2 3) Ch5 4) N2O5
- Кристаллическая решетка хлорида лития
1) металлическая 2) молекулярная 3) ионная 4) атомная
- Веществом с ионной связью является
1) KCl 2) Cl2 3) Nh4 4) SO2
- Атомную кристаллическую решетку имеет
1) железо 2) хлорид натрия 3) сера 4) алмаз
- Ионный характер связи наиболее выражен в соединении
1) BeO 2) СаO 3) MgO 4) B2O3
- Молекулярное строение имеет
1) CO2 2) KBr 3) MgSO4 4) SiO2
- Только ковалентные связи имеет каждое из двух веществ:
1) C3H8 и NaF 2) KCl и Ch4Cl 3) P2O5 и NaHSO3 4) C6H5Nh3 и P4
- Ионную решётку в кристаллическом состоянии имеет
1) фторид кальция 2) оксид углерода(II) 3) оксид фосфора(V) 4) хлороводород
- В молекуле сероводорода химическая связь
1) водородная 2) ковалентная неполярная 3) ковалентная полярная 4) ионная
- Молекулярное строение имеет
1) оксид кремния(IV) 2) нитрат бария 3) хлорид натрия 4) оксид углерода(II)
- Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) C3h5, NO, Na2O 2) CO, Ch4Cl, PBr3 3) P2O3, NaHSO3, Cu 4) C6H5NO2, NaF, CCl4
- Кристаллическая решётка иода
1) металлическая 2) молекулярная 3) атомная 4) ионная
- Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая 2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная 4) ковалентная полярная и ионная
- Веществом молекулярного строения является
1) хлорид натрия 2) графит 3) оксид углерода(IV) 4) оксид калия
- В каком ряду химические элементы расположены в порядке уменьшения их электроотрицательности?
1) Li → Be → B 2) P → S → Cl 3) Sb → As → P 4) Mg → Ca → Sr
- Соединением с ионной связью является
1) NO 2) CaO 3) h3O 4) SeO2
- Молекулярное строение имеет каждое из двух веществ:
1) Nh5Cl и Ch4Nh3 2) C2H5OH и Сh5
3) Na2CO3 и HNO3 4) h3S и Ch4COONa
- Между атомами элементов с порядковыми номерами 3 и 17 образуется химическая связь
1) ионная 2) ковалентная полярная 3) металлическая 4) ковалентная неполярная
- Вещества, имеющие ионную кристаллическую решётку, расположены в ряду:
1) MgCl2, CaI2, HNO3 2) Pb(NO3)2, h3S, Li2SO4
3) Ba(OH)2, Fe, CuCl2 4) NaBrO3, Ch4COONa, Na2S
- В каком ряду химические элементы расположены в порядке уменьшения их электроотрицательности
1) Li → Be → B 2) B → Al → Ga 3) Sb → As → P 4) P → S → Cl
- Полярность связи возрастает в ряду веществ:
1) Cl2, HCl, NaCl 2) SO2, h3S, O2 3) CO2, Ch5, h3 4) LiF, F2, HF
- Вещества, имеющие молекулярное строение, расположены в ряду:
1) C2H5NO2, HCl, Ph4 2) SO2, Ca(OH)2, Ch4COOH
3) NaHCO3, C6H5Cl, HBr 4) C3H6, NO, FeS
- Образование водородной связи нехарактерно для
1) средних солей 2) спиртов 3) воды 4) карбоновых кислот
- Наибольшей электроотрицательностью обладает
1) углерод 2) фосфор 3) кремний 4) азот
- Молекулярное строение имеет каждое из двух веществ:
1) HNO3 и CaO 2) Na2S и NO2 3) h3SO4 и Cu 4) I2 и HClO3
- Ковалентную полярную связь имеет каждое из двух веществ:
1) CS2 и PCl3 2) K и KOH 3) h3SO4 и S8 4) KH и h3O
- Молекулярное строение имеет
1) сульфид калия 2) оксид бария 3) хлороводород 4) оксид кальция
- Химическая связь в сульфиде калия
1) ионная 2) ковалентная 3) металлическая 4) водородная
- Атомную кристаллическую решётку в твёрдом состоянии имеет
1) водород 2) кислород 3) оксид углерода(IV) 4) оксид кремния(IV)
- Ковки, пластичны, электро- и теплопроводны вещества, у которых кристаллическая решётка
1) ионная 2) молекулярная 3) атомная 4) металлическая
- Веществом с ковалентной связью является
1) CaCl2 2) MgS 3) h3S 4) NaBr
- Металлическая кристаллическая решётка характерна для
1) белого фосфора 2) аргона 3) кальция 4) оксида алюминия
- Ковалентную полярную связь имеет соединение хлора с
1) натрием 2) водородом 3) калием 4) кальцием
- Ионную кристаллическую решётку имеет
1) оксид кальция 2) вода 3) алюминий 4) алмаз
- Веществом с ионной связью является
1) K2S 2) h3S 3) CO2 4) CCl4
- Веществом с ионным типом кристаллической решётки является
1) сульфат натрия 2) аммиак 3) бензол 4) уксусная кислота
- Полярность ковалентной связи в ряду веществ HF → HCl → HBr → HI
1) увеличивается 2) уменьшается 3) не изменяется 4) изменяется периодически
- Немолекулярное строение имеет каждое из двух веществ:
1) азот и алмаз 2) хлор и бром 3) калий и медь 4) вода и гидроксид натрия
- Химическая связь в молекуле водорода
1) ионная 2) ковалентная неполярная 3) ковалентная полярная 4) водородная
- Сульфат натрия имеет кристаллическую решётку
1) металлическую 2) ионную 3) молекулярную 4) атомную
- Водородная связь не образуется между молекулами
1) карбоновых кислот 2) спиртов 3) нуклеиновых кислот 4) кетонов
- Среди перечисленных веществ: K2S, h4P, PCl3, NaBr веществом(-ами) с ионной связью является(-ются)
1) только K2S 2) K2S и NaBr 3) K2S, h4P и PCl3 4) K2S, h4P, PCl3 и NaBr
- Соединением с ионной связью является
1) PCl3 2) NO2 3) h3S 4) Cah3
- Водородная связь образуется между молекулами
1) уксусной кислоты 2) водорода 3) метана 4) диметилового эфира
- Наибольшая длина химической связи в молекуле
1) Ph4 2) h3O 3) h3S 4) Nh4
- В молекулах галогеноводородов химическая связь
1) ковалентная неполярная 2) ковалентная полярная 3) ионная 4) водородная
- Ионную связь имеет каждое из двух веществ:
1) h3O и h3S 2) O2 и N2 3) NaF и CaCl2 4) HF и BaF2
- Наиболее полярна химическая связь в молекуле
1) сероводорода 2) хлора 3) хлороводорода 4) фтороводорода
- Соединениями с ковалентной связью являются
1) NO2 и NaCl 2) CaO и Ch4Cl 3) BaS и h3 4) F2 и CCl4
- Веществом с ионной связью является
1) Ch5 2) Cl2O7 3) h3S 4) CsH
- Соединением с ковалентной неполярной связью является
1) h3S 2) h3 3) NO 4) CO
- В молекуле какого вещества имеются π-связи?
1) h3S 2) h3O2 3) Ph4 4) CO2
- Водородные связи образуются между молекулами
1) этилового спирта 2) углекислого газа 3) уксусного альдегида 4) сероводорода
- Веществом с ионной связью является
1) h4P 2) K2S 3) PCl3 4) h3S
- Веществом с ковалентной полярной связью является
1) Br2 2) NaBr 3) HBr 4) CaBr2
- Между атомами элементов с порядковыми номерами 17 и 20 образуется химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) металлическая
- Соединение с ионной связью образуется при взаимодействии
1) P и O2 2) N2 и h3 3) Na и h3 4) S и О2
- Среди веществ, указанных в ряду: Nh4, O2, HCl, SO2 – количество соединений с ковалентной полярной связью равно
1) одному 2) двум 3) трём 4) четырём
- В сульфиде калия химическая связь
1) металлическая 2) водородная 3) ковалентная 4) ионная
- Ионную связь имеет каждое из двух веществ:
1) h3O и h3S 2) h3 и Cl2 3) NaF и CaCl2 4) HF и BaF2
- Наиболее полярна химическая связь в молекуле
1) h3S 2) HCl 3) Ph4 4) Sih5
- В какой молекуле химическая связь наиболее полярна?
1) HF 2) HCl 3) Nh4 4) h3O
- Водородные связи образуются между молекулами
1) водорода 2) пропана 3) формальдегида 4) уксусной кислоты
- Среди веществ, перечисленных в ряду: KCl, h4P, NaBr, PCl3 – количество соединений с ионной связью равно
1) одному 2) двум 3) трём 4) четырём
- Число веществ с ионной связью в ряду: K2S, h4P, NaBr, PCl3 – равно
1) одному 2) двум 3) трём 4) четырём
- Наименее полярна ковалентная связь в молекуле
1) HCl 2) HI 3) HF 4) HBr
- Ковалентную неполярную связь имеет каждое из двух веществ:
1) азот и графит 2) сероводород и метан 3) графит и медь 4) кремний и цинк
- Наиболее полярной является химическая связь в молекуле
1) HBr 2) HCl 3) HI 4) HF
- Соединением с ионной химической связью является
1) Ph4 2) SO3 3) PCl3 4) K2S
- Наименее полярной является ковалентная связь в молекуле
1) h3O 2) Nh4 3) Ch5 4) HF
Тест 3 виды химической связи. Тест на тему «типы химических связей»
Тест «Типы связей и кристаллических решеток»
Вариант №1
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9. Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В1. Установите соответствие между соединением и типом связи в соединении.
В2. Установите соответствие между соединением и типом кристаллической решетки
В3. Установите соответствие между соединением и типом связи в соединении.
Ход урока: (Cлайд 3)
- Объяснение темы “Основные типы химической связи”.
- Закрепление (Тест)
- Работа в графическом редакторе “Paint” – составление графических формул веществ.
- Домашнее задание.
Ход урока
I. Химический диктант. (Cлайд 4)II. Проверка домашнего задания
(Cлайд 5)(Устный опрос)
- Что такое электроотрицательность?
- Зависимость электроотрицательности от расположения элемента в таблице Менделеева?
- Как определить принадлежность элемента к металлам или неметаллам по электроотрицательности?
III. Объяснение темы “Основные типы химической связи”. (
Cлайд 6)- Связь между элементами с одинаковой или близкой электроотрицательностью называется ковалентной. (Cлайд 7)
- Связь между металлами называется металлической.
- Связь между элементами со значительно отличающейся электроотрицательностью называется ионной.
- Связь между электроотрицательными элементами разных молекул при помощи водорода называется водородной.
IV. Закрепление (Тест)
(Cлайд 19)“Закрепление 3” – для тех, кто не совсем уверен в своих знаниях,
“Закрепление 4” – для тех, кто уверен в своих знаниях,
“Закрепление 5” – для тех, кто абсолютно уверен в своих знаниях.
- Отвечаете на вопросы.
- Получаете оценку и ждете пока учитель не разрешит закрыть программу.
V. Работа в графическом редакторе “Paint” – составление графических формул веществ.
(Cлайд 9)1.Открываете программу “Paint”.
2. При помощи “наборов инструментов”
составляете графические формулы веществ: воды,
фторида натрия, хлороводорода, метана.
H 2 O, NaF, HCl, CH 4 .
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2O, H 2F 2, NH 3. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Типы химических свиязей.
Часть А
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
1)1 2)2 3)3 4)4
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
А)железо 1)ионная
Д)азот
Часть С
Типы химических свиязей.
Часть А
1.Химическая связь в молекуле фтороводорода
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
2. ионная связь образуется между атомами
1) натрия и фтора 2)серы и водорода 3) серы и кислорода 4)хлора и водорода
3. Ионная связь образуется между ионами
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
4. Химическая связь между атомами химических элементов с порядковыми номерами 3 и 35
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
5. Химическая связь между атомами, электроотрицательности которых не отличаются друг от друга, называется
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
6. Химическая связь атома химического элемента, имеющего шесть электронов на внешнем электронном слое с водородом
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
7. Ковалентная полярная связь в каждом из двух веществ:
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
8. Две общие электронные пары имеются в молекуле
1)водорода 2)бромоводорода 3)сероводорода 4) аммиака
9. Одну ковалентную связь имеет молекула
1)иодоводорода 2)азота 3)метана 4)кислорода
10. Число общих электронных пар в соединениях состава ЭО 2
1)1 2)2 3)3 4)4
11. Укажите формулу лишнего соединения
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
12. Установите соответствие между названием соединения и типом химической связи в этом соединении.
Название соединения Тип химической связи
А)железо 1)ионная
Б)кислород 2)ковалентная полярная
В)вода 3)ковалентная неполярная
Г)бромид литии 4)металлическая
Д)азот
13. Ковалентная полярная связь имеет место в соединениях:
1)сероводород 2)угарный газ 3)фтор 4)цинк 5)фторид калия 3)фтор
14.Три ковалентные полярные связи имеют молекулы
1)азота 2)фосфина 3) углекислого газа 4)аммиака 5)метана
Часть С
15. Приведите примеры четырех соединений калия, имеющих одновременно и ионную и ковалентную связь.
16. Назовите соединение, имеющее одну ковалентную неполярную связь атомов, электроны которых расположены на трех энергетических слоях.
1. Связь между ионами металла и блуждающими электронами называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
2. Химическая связь, возникающая между атомами неметаллов одного вида называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
3. Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
4. Химическая связь, возникающая между атомами типичного металла и типичного неметалла называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
5. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
6. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N 2 , NH 3, CO 2, Na, NH 3, H 2, KF H 2 O, НCl F 2, HF, C Ca. CO 3
7. Выберите группу веществ, в состав которой входят только вещества с металлической связью: Na, CO 2, K, Al, NH 3, Fe H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
8. Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na. Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
9. Определите вид химической связи и тип кристаллической решетки, если вещество обладает высокой температурой плавления и кипения, твердое, тугоплавкое, хорошо растворимо в воде. Раствор проводит электрический ток. Ковалентная полярная связь и атомная кристаллическая решетка Ионная связь и ионная кристаллическая решетка Ковалентная полярная связь и молекулярная кристаллическая решетка. Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Примеры тестовых заданий к приложению 2
1.Число π связей одинаково в молекулах
1. СН3СООН и СО2 2. СО2 и С2Н2 3. H2SO4 и Н3РО4 4. С12О7 и Р2О5
2. Ионная связь образуется между элементами
1. Н и С 2. Р и О 3. К и С1 4. С и О
3. Ионный характер связи наиболее выражен в соединении I)CCl4 2) SiO2 3)CaBr2 4) NH3
4. Соединением с ковалентной неполярной связью является I)HCl 2) O2 3)CaCl2 4) H2O
5. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
6. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) вода и сероводород 3) аммиак и водород
2) бромид калия и азот 4) кислород и метан
7. Атомы химических элементов второго периода Периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава
I)BaS 2) CO2 3)Al2O3 4) LiF
8. Вещество, в молекуле которого содержится кратная связь называется
1.водород 2.хлороводород 3.кислород 4.сероводород
9.Только полярные ковалентные содержит молекула вещества, формула которой
1. H2SO4 2. Na2SO4 3.F2 4.CaO
10.В молекуле аммиака все связи…
1.ковалентные неполярные 2.ковалентные полярные 3.ионные 4.донорно-акцепторные
11.Веществами, в которых все связи ковалентные, являются
1. K2SO4 , NH3 2. NH4Cl, P2O5 3. NaCl, SO2 4. СО2, H2S
12. Наиболее прочной является связь между элементами в молекуле, формула которой…
1. Н2О 2. H2S 3. H2Se 4. H2Te
13.Формула вещества с молекулярной кристаллической решеткой имеет вид…
1. NH3 2. CaO 3.KF 4. CaH2
14.Вещества с атомной кристаллической решеткой обладают
1. Высокой электропроводностью 2. Высокой температурой плавления
3. Низкой твердостью 4. Низкой температурой плавления
Ответы к тестовым заданиям к приложениям: 1.2; 2.3;.3.3;4.2;5.2;6.3; 7.4; 8.3; 9.1; 10,2; 11.4;13.1; 13.1;14.2
Приложение 3. Понятие о гибридизации
Гибридизация — это смешивание и выравнивание по форме и по энергии орбиталей одного и того же атома, участвующих в образовании -связей.
В результате гибридизации первоначальная форма облаков изменяется, и образуются облака, имеющее форму ассиметричной гантели. Иными словами, электронная плотность в ней сконцентрирована по одну сторону в большей степени, чем по другую. Благодаря такому неравномерному распределению электронной плотности вокруг ядра, гибридное облако способно к более глубокому перекрыванию, чем обычное, и дает энергетически более выгодную связь.
Подвергаться гибридизации могут орбитали как участвующие в образовании связей, так и занятые неподеленной парой электронов. Орбитали, участвующие в образовании π-связей в гибридизации не участвуют. Тип гибридизации определяется видом и количеством участвующих в гибридизации орбиталей. Различают следующие типы гибридизации: sp, sp2, sp3.
Sp-гибридизация
Гибридизуется одна s- и одна р-орбиталь, образуются две гибридные орбитали, которые располагаются на одной прямой под углом 180о. Молекула общего вида АХ2 имеет линейную структуру. Примеры соединений: ВеF2, ВеН2, ВеС12, СО2, CS2.
Рассмотрим на примере молекулы гидрида бериллия. Структурная формула соединения НВеН. На внешнем энергетическом уровне бериллия два электрона. Для образования двух химических связей с атомами водорода бериллий переходит в возбужденное состояние:
В молекуле ВеН2 нет кратных связей, а, следовательно, нет и -связей, пустые орбитали Ру и Рz не участвуют в гибридизации. Исходя из вышесказанного, в гибридизации принимают участие 2s и 2рх орбитали бериллия, именно они образуют -связи с атомами водорода. Такой тип гибридизации называют sp-гибридизацией.
Количество гибридных орбиталей равно количеству орбиталей, участвующих в гибридизации. Две sp-гибридные орбитали располагаются вокруг ядра атома на максимальном удалении друг от друга. Такое удаление достигается в том случае, когда валентный угол = 180о. Валентный угол – угол, образованный направлениями химических связей, исходящими из одного атома. s-орбитали атомов водорода перекрываются с sp-гибридными орбиталями бериллия. Геометрия молекулы – линейная. Связи в молекуле ВеН2 равноценны по энергии и длине.
Еще один пример sp-гибридизации: строение молекулы углекислого газа СО2.
процентный ионный характер и угол связи
Цель обучения
- Признайте разницу между теоретическими и наблюдаемыми свойствами ионных связей.
Ключевые моменты
- Спектр связи (ионной и ковалентной) зависит от того, насколько равномерно электроны распределяются между двумя атомами.
- Ионный характер связи — это количество электронов, которыми совместно пользуются два атома; ограниченное совместное использование электронов соответствует высокому процентному ионному характеру.
- Чтобы определить процентный ионный характер связи, электроотрицательность атомов используется для прогнозирования распределения электронов между атомами.
Условия
- ковалентная связь: два атома связаны друг с другом за счет совместного использования двух или более электронов
- ионная связь: два атома или молекулы связаны друг с другом электростатическим притяжением
Ионные связи в реальности
Когда два элемента образуют ионное соединение, действительно ли электрон теряется одним атомом и передается другому? Чтобы ответить на этот вопрос, рассмотрим данные о твердом ионном LiF.Средний радиус нейтрального атома Li составляет около 2,52 Å. Если этот атом Li реагирует с атомом F с образованием LiF, каково среднее расстояние между ядром Li и электроном, который он «потерял» из-за атома фтора? Ответ 1,56 Å; электрон теперь ближе к ядру лития, чем был в нейтральном литии.
Связывание во фториде лития Где находится электрон во фториде лития? Создает ли это ионную связь, ковалентную связь или что-то среднее?Ответ на вышеупомянутый вопрос — и да, и нет: да, электрон, который сейчас находился на 2s-орбитали Li, теперь находится в пределах досягаемости фторсодержащей 2p-орбитали; но нет, электрон теперь даже ближе к ядру Li, чем раньше, так что он на самом деле не «потерян».”
Связь электронных пар явно ответственна за эту ситуацию; это обеспечивает стабильность ковалентной связи. Что не так очевидно — пока вы не посмотрите на числа, подобные приведенным выше для LiF, — это то, что ионная связь приводит к тому же состоянию; даже в самых высокоионных соединениях оба электрона находятся рядом с обоими ядрами, и возникающие в результате взаимные притяжения связывают ядра вместе.
Возникающий взгляд на ионную связь — это такая, в которой электронные орбитали соседних пар атомов просто смещены, создавая большую плотность электронов вокруг «отрицательного» элемента, чем вокруг «положительного».Думайте о величине этого перекоса как о процентном ионном характере связи; чтобы определить процентный ионный характер, нужно посмотреть на электроотрицательность задействованных атомов и определить, насколько эффективно обмен электронами между частицами.
Однако модель ионной связи полезна для многих целей. Нет ничего плохого в использовании термина «ионная связь» для описания взаимодействий между атомами в очень небольшом классе «ионных твердых тел», таких как LiF и NaCl.
Угол крепления
Валентный угол образуется между тремя атомами, по крайней мере, через две связи.Чем более ковалентна по природе связь, тем более вероятно, что атомы будут располагаться вдоль заранее определенных векторов, заданных орбиталями, которые участвуют в связывании (теория VSEPR). Чем более ионный характер имеет связь, тем более вероятно, что ненаправленные электростатические взаимодействия удерживают атомы вместе. Это означает, что атомы будут располагаться в положениях, которые минимизируют занимаемое ими пространство (например, кристалл соли).
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Химические связи — Принципы биологии
Как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует во внешней области, где электроны присутствуют в атоме. Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может вместить до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем можно будет заполнить любую другую оболочку.Водород имеет один электрон; следовательно, в самой нижней оболочке занято только одно место. Гелий имеет два электрона; следовательно, он может полностью заполнить нижнюю оболочку двумя своими электронами. Если вы посмотрите на таблицу Менделеева, вы увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что в их первой оболочке есть только электроны. Водород и гелий — единственные два элемента, которые имеют самую низкую оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов.Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут сформированы.
Еще раз взглянув на таблицу Менделеева (рис. 1), вы заметите, что там семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере того, как столбцы перемещаются слева направо. Хотя у каждого элемента одинаковое количество оболочек, не все оболочки полностью заполнены электронами.Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. Литий имеет только один электрон во внешней оболочке, бериллий имеет два электрона, бор имеет три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не все элементы имеют достаточно электронов, чтобы заполнить свои внешние оболочки, но атом наиболее стабилен, когда все позиции электронов на внешней оболочке заполнены.Из-за этих вакансий во внешних оболочках мы видим образование химических связей или взаимодействия между двумя или более одинаковыми или разными элементами, которые приводят к образованию молекул. Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и будут связываться с другими элементами для достижения этой цели, разделяя электроны, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов.Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Когда атом не содержит равного количества протонов и электронов, он называется ионом . Поскольку количество электронов не равно количеству протонов, каждый ион имеет чистый заряд. Положительные ионы образуются при потере электронов и называются катионами. Отрицательные ионы образуются путем захвата электронов и называются анионами.
Например, у натрия только один электрон на внешней оболочке.Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий теряет электрон, у него теперь будет 11 протонов и только 10 электронов, а общий заряд останется +1. Теперь он называется ионом натрия.
У атома хлора семь электронов на внешней оболочке. Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, придавая ему чистый отрицательный (–1) заряд.Теперь он называется хлорид-ионом. Это движение электронов от одного элемента к другому называется переносом электронов. Как показано на рисунке 1, атом натрия (Na) имеет только один электрон в своей внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов в своей внешней оболочке. Атом натрия отдаст свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки.Поскольку количество электронов больше не равно количеству протонов, каждый теперь является ионом и имеет заряд +1 (натрий) или –1 (хлорид).
Рис. 1 Элементы имеют тенденцию заполнять свои внешние оболочки электронами. Для этого они могут отдавать или принимать электроны от других элементов.Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и ван-дер-ваальсовы взаимодействия. Ионные и ковалентные связи — это сильные взаимодействия, для разрыва которых требуется больше энергии.Когда элемент отдает электрон из своей внешней оболочки, как в примере с атомом натрия выше, образуется положительный ион (рис. 2). Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительный и отрицательный заряды притягиваются, эти ионы остаются вместе и образуют ионную связь , или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl — объединяются, чтобы произвести NaCl, один электрон от атома натрия остается с другими семью от атома хлора, и ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. обвинять.
Рисунок 2 При образовании ионного соединения металлы теряют электроны, а неметаллы приобретают электроны для достижения октета.Ковалентные облигации
Другой тип прочной химической связи между двумя или более атомами — это ковалентная связь . Эти связи образуются, когда электрон разделяется между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках.В отличие от ионных связей ковалентные связи не диссоциируют в воде.
Интересно, что химики и биологи по-разному измеряют прочность связи. Химики измеряют абсолютную прочность связи (теоретическую прочность), в то время как биологов больше интересует, как связь ведет себя в биологической системе, которая обычно представляет собой водную (водную) основу. В воде ионные связи распадаются гораздо легче, чем ковалентные связи, поэтому биологи сказали бы, что они слабее ковалентных связей.Если вы посмотрите в учебник химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее смотрите.
Атомы водорода и кислорода, которые объединяются в молекулы воды, связаны ковалентными связями. Электрон от атома водорода делит свое время между внешней оболочкой атома водорода и неполной внешней оболочкой атома кислорода. Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимы два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O.Электроны распределяются между атомами, разделяя свое время между ними, чтобы «заполнить» внешнюю оболочку каждого из них. Это совместное использование является более низким энергетическим состоянием для всех задействованных атомов, чем если бы они существовали без заполненных внешних оболочек.
Есть два типа ковалентных связей: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые разделяют электроны в равной степени. Например, атом кислорода может связываться с другим атомом кислорода, чтобы заполнить их внешние оболочки.Эта ассоциация неполярная , потому что электроны будут равномерно распределены между каждым атомом кислорода. Между двумя атомами кислорода образуются две ковалентные связи, потому что кислород требует, чтобы два общих электрона заполняли его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи обнаружен в молекуле метана (CH 4 ).У атома углерода четыре электрона во внешней оболочке, и ему нужно еще четыре, чтобы заполнить его. Он получает эти четыре из четырех атомов водорода, каждый из которых обеспечивает один. Все эти элементы делят электроны в равной степени, создавая четыре неполярные ковалентные связи (рис. 3).
В полярной ковалентной связи , общие для атомов электроны проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ +) или слегка отрицательный (δ–) заряд.Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени около ядра кислорода, придавая ему небольшой отрицательный заряд, чем они проводят около ядер водорода, придавая этим молекулам небольшой положительный заряд.
Рис. 3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом на атомах водорода и слегка отрицательным зарядом на кислороде. Примеры неполярных связей включают метан (в центре) и кислород (справа).Водородные связи
Ионные и ковалентные связи — это прочные связи, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Могут образоваться и более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрушения которых не требуется много энергии. Две часто встречающиеся слабые связи — это водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи создают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положителен (δ +), он будет притягиваться к соседним частичным отрицательным зарядам (δ–). Когда это происходит, происходит слабое взаимодействие между зарядом δ + атома водорода одной молекулы и зарядом δ– другой молекулы.Это взаимодействие называется водородной связью. Этот тип облигации распространен; например, жидкая природа воды обусловлена водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородная связь, вода была бы газом, а не жидкостью при комнатной температуре.
Рис. 4 Водородные связи образуются между слегка положительными (δ +) и слегка отрицательными (δ–) зарядами полярных ковалентных молекул, таких как вода.Водородные связи могут образовываться между разными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, чтобы придать молекуле ДНК характерную двухцепочечную структуру. Водородные связи также ответственны за некоторые трехмерные структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, ван-дер-ваальсовы взаимодействия представляют собой слабое притяжение или взаимодействие между молекулами.Они возникают между полярными ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, которые образуются при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
СсылкиЕсли не указано иное, изображения на этой странице лицензированы OpenStax в соответствии с CC-BY 4.0.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]: IBRqRY3C @ 8 / Строительные блоки молекулы
Химические соединения: Почему некоторые из них отсутствуют | Chem13 News Magazine
В недавней статье, 1 Альберто Монис сделал полезный дискурс о причинах, по которым ковалентные и ионные соединения образуются или не образуются. По моему опыту, это помогает некоторым студентам понимать концепции, если они видят конкретные числа. По этой причине я счел полезным привести примеры, чтобы проиллюстрировать, почему одни соединения существуют, а другие нет.Аргументы будут основаны на энергетических соображениях. Хотя это чистое изменение свободной энергии, которое является окончательным определяющим фактором, связь существования соединения с экзотермичностью процесса образования из элементов (или, вернее, изменение энтальпии) работает в большинстве случаев хорошо.
Существование (Не) ковалентных соединений
Какие соединения образуются, а какие не образуются, представляет собой интересную область сама по себе. Дасент написал целую книгу о несуществующих соединениях, 2 , а Аппельман описал трудности синтеза перброматов и гипофтористой кислоты. 3
Классическим случаем было открытие соединений благородных газов. 4 Соединения благородных газов снова в новостях. Атмосфера Земли должна содержать гораздо больше ксенона, чем есть на самом деле. Недавно был синтезирован диоксид ксенона, и предполагается, что «недостающий» ксенон улавливается в виде XeO 2 единиц в пределах SiO 2 единиц кварца и силикатов глубоко в континентальной коре. 5 Таким образом, представляется целесообразным выбрать пример соединения благородного газа.Здесь я проиллюстрировал, почему существует ковалентно связанный тетрафторид ксенона, в то время как тетрахлорид ксенона почти наверняка никогда не будет синтезирован.
Возможное образование ковалентного соединения из его элементов можно рассматривать с точки зрения связей в разрушаемых элементах и связей в образующемся соединении. Процесс, который в целом является значительно экзотермическим, указывает на значительную вероятность того, что соединение могло существовать.
Для образования тетрафторида ксенона общее химическое уравнение можно записать как
Xe (г) + 2 F 2 (г) → XeF 4 (т)
Процесс можно рассматривать как происходящий в серии теоретических шагов
- Эндотермический разрыв двух моль ковалентных связей фтор-фтор.
- Экзотермическое образование четырех молей ксенон-фторных связей.
- Небольшое экзотермическое осаждение твердого тетрафторида ксенона.
Энергетический цикл с числовыми значениями показан (Рис. 1).
Рис. 1. Теоретическая диаграмма энергии образования тетрафторида ксенона (из ссылки 6)
Таким образом, процесс образования тетрафторида ксенона является значительно экзотермическим, и предполагается, что XeF 4 существует. Фактически, это соединение было впервые синтезировано в 1962 году.
С точки зрения термохимии, тетрафторид ксенона существует потому, что две фтор-фторные связи, которые должны быть разорваны, довольно слабые (F − F = 158 кДж ∙ моль −1 ), в то время как необходимо образовать четыре связи ксенон-фтор, хотя каждый из них еще слабее (Xe − F = 133 кДж ∙ моль −1 ).
Так почему же синтез тетрахлорида ксенона крайне маловероятен? Связь хлор-хлор (Cl-Cl = 240 кДж ∙ моль -1 ) значительно прочнее, чем связь фтор-фтор.В предыдущей статье я показал, что теоретическое значение для связи ксенон-хлор меньше, чем для связи ксенон-фтор (Xe-Cl = 103 кДж ∙ моль -1 ). 7 Таким образом, аналогичный энергетический цикл для газообразного тетрахлорида ксенона даст чистое изменение энергии +68 кДж ∙ моль ( -1 ). Даже если бы образовалось твердое тело, цикл не имел бы значительной степени экзотермичности. Таким образом, можно с достаточной уверенностью сказать, что смешивание газообразного ксенона и газообразного хлора не приведет к образованию тетрахлорида ксенона.
Существование (Не) — ионных соединений
Для ионных соединений должен использоваться путь образования ионов. Мы можем проиллюстрировать эту концепцию на примере образования хлорида натрия.
[mathjax] Na (тв) + Cl2 (г) NaCl (тв)
Процесс в этом случае можно рассматривать как происходящий в следующих теоретических этапах:
- Испарение одного моля атомов натрия.
- Разрушение половины моля молекул хлора.
- Первая энергия ионизации одного моля атомов натрия.
- Сродство к электрону одного моля атомов хлора.
- Осаждение одного моля ионов натрия и одного моля хлорид-ионов с образованием кристаллической решетки.
Энергетический цикл с числовыми значениями показан ниже:
Рис. 2. Теоретическая диаграмма энергии образования хлорида натрия (из ссылки 6)
Из этого рисунка видно, что двумя основными факторами в энергетическом балансе являются энергия ионизации, необходимая для образования катиона, и энергия, выделяемая при образовании кристаллической решетки.Мы можем использовать этот факт, чтобы понять, почему, например, магний и фтор образуют MgF 2 , а не MgF или MgF 3 . Как видно из рис. 3 (следующий столбец), образование MgF теоретически было бы в некоторой степени возможным. Однако энергия, необходимая для удаления другого валентного электрона магния, более чем компенсируется более прочной кристаллической решеткой, образованной упаковкой более заряженных ионов Mg 2+ с ионами F — . Таким образом, образование MgF 2 является энергетически предпочтительным.
Так почему бы не пойти еще дальше и не ионизировать третий электрон из магния? Ибо энергия решетки была бы еще больше.
Конечно, энергия решетки будет примерно вдвое больше, чем у MgF 2 . Однако третий ионизированный электрон должен исходить из внутренней оболочки и требует огромного количества энергии для процесса ионизации. MgF 3 никогда не образуется. Это также показано на рис. 3.
Ионная или ковалентная связь?
Хотя невозможность образования MgF3 энергетически не вызывает сомнений, нужно быть осторожным, когда говорят «никогда».В конце концов, мы думали, что «знаем», что ртуть может образовывать ионы только с зарядом +1 и +2.
Рис. 3 Сравнение энергий образования MgF, MgF 2 и MgF 3 (из ссылки 6)
Теперь мы знаем, что можно синтезировать HgF 4 , в котором ртуть имеет назначенный заряд +4. 8
Hg (л) + 2 F 2 (г) → HgF 4 (т)
Оказывается, для этого «пограничного металла» соединение вовсе не ионное, а ковалентное.Фактически, с энергией связи Hg-F около 180 кДж ∙ моль -1 , оглядываясь назад, можно ожидать образования этой молекулы с точки зрения энергии:
Изменение энергии =
(разрыв 2 моль связей F − F) — (образование 4 моль связей Hg − F)
= (316 кДж) — (720 кДж) = −404 кДж ∙ моль −1
Список литературы
- А. Мониш, «Конструирование значения из правила октетов», Chem 13 News, октябрь 2011 г., стр. 4.
- Вт.E, Dasent, Несуществующие соединения, Эдвард Арнольд, 1965.
- E.H. Аппельман, «Несуществующие соединения: две истории болезни», Отчет о химических исследованиях, 6, 1973, страницы 113-117.
- П. Ласло и Г.Дж. Шробильген: «Один или несколько пионеров? Открытие соединений благородных газов », Angewandte Chemie (International Edition), 1988, 27, стр. 479.
- D.S. Brock, G.J. Шробильген, «Синтез недостающего оксида ксенона, XeO2, и его последствия для отсутствия ксенона на Земле», Журнал Американского химического общества, апрель 2011 г., 133 (16), стр. 6265-9.
- Г. Райнер-Кэнхэм и Т. Овертон, Описательная неорганическая химия, 5-е издание, W.H. Фриман, Нью-Йорк, 2010. .
- Г. Райнер-Кэнхэм, «Благородные газы и их значение для преподавания химии 21 века», Chem 13 News, ноябрь 2006 г.,
стр. 4. - «Википедия, Фторид ртути (IV)»
ЭЛЕКТРОНЕГАТИВНОСТЬ На этой странице объясняется, что такое электроотрицательность, а также как и почему она изменяется в зависимости от Периодической таблицы.Он рассматривает то, как различия электроотрицательности влияют на тип связи, и объясняет, что подразумевается под полярными связями и полярными молекулами. Если вас интересует электроотрицательность в контексте органической химии, вы найдете ссылку внизу этой страницы. Что такое электроотрицательность Определение Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7. Что произойдет, если два атома с одинаковой электроотрицательностью связаны вместе? Рассмотрим связь между двумя атомами, A и B. Каждый атом может образовывать другие связи, кроме показанной, но они не имеют отношения к аргументу. Если атомы одинаково электроотрицательны, оба имеют одинаковую тенденцию притягивать связывающую пару электронов, и поэтому будет найдено в среднем на полпути между двумя атомами. Чтобы получить такую связь, A и B обычно должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 . | ||
Примечание: Важно понимать, что это среднее изображение .Электроны на самом деле находятся на молекулярной орбитали и все время перемещаются по этой орбитали. | ||
Связь такого типа можно рассматривать как «чистую» ковалентную связь, в которой электроны равномерно распределяются между двумя атомами. Что произойдет, если B немного более электроотрицателен, чем A? B будет притягивать электронную пару больше, чем A. Это означает, что конец B связи имеет более чем справедливую долю электронной плотности и поэтому становится немного отрицательным.В то же время конец A (довольно короткий от электронов) становится слегка положительным. На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный». Определение полярных связей Это описывается как полярная связь . Полярная связь — это ковалентная связь, в которой существует разделение зарядов между одним концом и другим, другими словами, в котором один конец является слегка положительным, а другой — слегка отрицательным.Примеры включают большинство ковалентных связей. Связь водород-хлор в HCl или связи водород-кислород в воде являются типичными. Что произойдет, если B будет намного более электроотрицательным, чем A? В этом случае электронная пара перетаскивается прямо на конец связи B. Фактически, A потерял контроль над своим электроном, а B имеет полный контроль над обоими электронами. Ионы образовались. «Спектр» облигаций Смысл всего этого состоит в том, что нет четкого разделения между ковалентными и ионными связями.В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу. Как далеко должно пройти это перетаскивание, прежде чем связь будет считаться ионной? На это нет настоящего ответа. Обычно вы думаете о хлориде натрия как о типично ионном твердом веществе, но даже здесь натрий не полностью потерял контроль над своим электроном. Однако из-за свойств хлорида натрия мы склонны считать его чисто ионным. | ||
Примечание: Не слишком беспокойтесь о точной точке отсечения между полярными ковалентными связями и ионными связями. На A’уровне примеры будут стремиться избегать серых областей — они будут явно ковалентными или явно ионными. Однако ожидается, что вы поймете, что эти серые зоны существуют. | ||
Иодид лития, с другой стороны, можно охарактеризовать как «ионный с некоторым ковалентным характером».В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются. Сводка
Полярные связи и полярные молекулы В простой молекуле, такой как HCl, если связь полярна, то же самое происходит и со всей молекулой. А как насчет более сложных молекул? В CCl 4 каждая связь полярна. | ||
Примечание: Обычные линии обозначают связи в плоскости экрана или бумаги. Пунктирные линии представляют собой связи, уходящие от вас в экран или бумагу.Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги к вам. | ||
Молекула в целом, однако, не полярна — в том смысле, что у нее нет конца (или стороны), который был бы слегка отрицательным, а другой — слегка положительным. Вся внешняя часть молекулы несколько отрицательна, но нет общего разделения заряда сверху вниз или слева направо. Напротив, CHCl 3 имеет полярность . Водород в верхней части молекулы менее электроотрицателен, чем углерод, и поэтому немного положителен. Это означает, что молекула теперь имеет слегка положительный «верх» и слегка отрицательный «низ», и поэтому в целом молекула является полярной. Полярная молекула должна быть каким-то образом «односторонней». Паттерны электроотрицательности в Периодической таблице Самый электроотрицательный элемент — фтор.Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице. | ||
Примечание: Это упрощение игнорирует благородные газы. Исторически это связано с тем, что считалось, что они не образуют связей — и если они не образуют связи, у них не может быть значения электроотрицательности. Даже сейчас, когда мы знаем, что некоторые из них действительно образуют связи, источники данных по-прежнему не указывают для них значения электроотрицательности. | ||
Тенденции электроотрицательности за период По мере прохождения периода электроотрицательность увеличивается. График показывает электроотрицательность от натрия до хлора — аргон не следует учитывать. У него нет электроотрицательности, потому что он не образует связей. Тенденции изменения электроотрицательности в группе По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается.(Если оно увеличивается до фтора, оно должно уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7. Объяснение закономерностей в электроотрицательности Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
| ||
Примечание: Если вас не устраивает концепция экранирования или экранирования , то перед тем, как продолжить, вам стоит прочитать страницу об энергиях ионизации. Факторы, влияющие на энергии ионизации, такие же, как и факторы, влияющие на электроотрицательность. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Почему электроотрицательность увеличивается за период? Рассмотрим натрий в начале периода 3 и хлор в конце (игнорируя благородный газ, аргон).Представьте, что хлорид натрия связан с ковалентной связью. И натрий, и хлор имеют свои связывающие электроны на 3-м уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара так увлекается к хлору, что образуются ионы. Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается.Это сильнее притягивает связывающую пару электронов. Почему электроотрицательность падает при уменьшении группы? Подумайте о фтороводороде и хлористом водороде. Связующая пара защищена от ядра фтора только 1s 2 электронами. В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами. В каждом случае чистое притяжение от центра фтора или хлора +7.Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. Чем ближе к ядру, тем больше притяжение. По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается, потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Диагональные отношения в Периодической таблице Что такое диагональное соотношение? В начале периодов 2 и 3 Периодической таблицы есть несколько случаев, когда элемент в верхней части одной группы имеет некоторое сходство с элементом в следующей группе. На схеме ниже показаны три примера. Обратите внимание, что сходство проявляется в элементах, которые расположены по диагонали друг к другу, а не бок о бок. Например, бор — неметалл с некоторыми свойствами, похожими на кремний. В отличие от остальной группы 2, бериллий имеет некоторые свойства, напоминающие алюминий. А литий обладает некоторыми свойствами, которые отличаются от других элементов в группе 1, и в некоторых отношениях напоминает магний. Говорят, что между этими элементами существует диагональное соотношение . Для этого есть несколько причин, но каждая зависит от того, как атомные свойства, такие как электроотрицательность, изменяются в Периодической таблице. Итак, мы быстро рассмотрим это в отношении электроотрицательности — что, вероятно, проще всего объяснить. Объяснение диагонального отношения относительно электроотрицательности Электроотрицательность увеличивается по Периодической таблице. Так, например, электроотрицательности бериллия и бора составляют: Электроотрицательность падает по мере того, как вы спускаетесь по Периодической таблице.Так, например, электроотрицательности бора и алюминия: Итак, сравнивая Be и Al, вы обнаруживаете, что значения (случайно) точно такие же. Увеличение от группы 2 к группе 3 компенсируется падением по мере того, как вы переходите с группы 3 вниз с бора на алюминий. Нечто подобное происходит с литием (1,0) с магнием (1,2) и с бором (2,0) с кремнием (1,8). В этих случаях электроотрицательности не точно такие же , но очень близки. Сходная электроотрицательность между членами этих диагональных пар означает, что они могут образовывать схожие типы связей, и это повлияет на их химию. Примеры этого вы можете встретить позже в своем курсе.
| ||
Внимание! Насколько мне известно, ни одна из британских программ уровня A (или эквивалентных) больше не требует следующего бита. Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. В противном случае игнорируйте остальную часть этой страницы. Это альтернативный (и, на мой взгляд, более неудобный) способ взглянуть на формирование полярной связи. Чтение его без надобности может сбить вас с толку. | ||
Поляризующая способность положительных ионов Что мы подразумеваем под «поляризационной способностью»? В ходе обсуждения мы рассмотрели образование полярных связей с точки зрения искажений, которые происходят в ковалентной связи, если один атом более электроотрицателен, чем другой.Но вы также можете посмотреть на образование полярных ковалентных связей, представив, что вы начинаете с ионов. Твердый хлорид алюминия ковалентен. Вместо этого представьте, что он был ионным. Он будет содержать ионы Al 3+ и Cl — . Ион алюминия очень мал и имеет три положительных заряда, поэтому «плотность заряда» очень высока. Это окажет значительное влияние на любые ближайшие электроны. Мы говорим, что ионы алюминия поляризуют ионы хлорида. В случае хлорида алюминия электронные пары притягиваются к алюминию до такой степени, что связи становятся ковалентными. Но поскольку хлор более электроотрицателен, чем алюминий, электронные пары не будут вытягиваться на полпути между двумя атомами, и поэтому образующаяся связь будет полярной. Факторы, влияющие на поляризационную способность Положительные ионы могут иметь эффект поляризации (электрически искажения) соседних отрицательных ионов.Поляризующая способность зависит от плотности заряда положительного иона. Поляризационная способность увеличивается по мере уменьшения размера положительного иона и увеличения количества зарядов. Чем больше размер отрицательного иона, тем легче его поляризовать. Например, в иодид-ионе I — внешние электроны находятся на 5-м уровне — относительно далеко от ядра. Положительный ион будет более эффективным в привлечении пары электронов от иодид-иона, чем соответствующие электроны, скажем, во фторид-ионе, где они намного ближе к ядру. Иодид алюминия ковалентен, потому что электронная пара легко уносится от иона иодида. С другой стороны, фторид алюминия является ионным, потому что ион алюминия не может поляризовать небольшой ион фтора в достаточной степени для образования ковалентной связи.
© Джим Кларк 2000 (последнее изменение в марте 2013 г.) | ||
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метанаМетан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения.На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.Британская викторина
Типы химических реакций
Можете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этой викторины!
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, происходящих либо от текущего имени элемента, либо от его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 . Формула соединения, например CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула водыМолекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе связывания атомов углерода, водорода и кислорода. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасХимические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов связывания углерода и других элементов существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / FotoliaВ рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и так далее.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. Когда были раскрыты детали атомной структуры, стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица МенделееваПериодическая таблица элементов.
Encyclopædia Britannica, Inc.Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона, и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, заключается в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающиеся в результате Mg 2+ и O 2− затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная тепло- и электропроводность. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Ковалентное связывание и электроотрицательность
Ковалентное связывание и электроотрицательность
Ковалентные связи образуются, когда атомы разделяют электроны. Это совместное использование позволяет каждому атому достичь своего октета электронов и большей стабильности.Метан, CH 4 , простейшее органическое соединение, содержит ковалентные связи. Углерод имеет четыре валентных электрона, а водород — один валентный электрон. Разделяя эти электроны внешней оболочки, углерод и водород завершают свои валентные оболочки и становятся более стабильными. Дуэт электронов на водороде изоэлектронен гелию и образует законченную оболочку.
Полярность облигаций. В чистой ковалентной связи общие электроны в равной степени доступны каждому из атомов.Такое расположение происходит только тогда, когда два атома одного и того же элемента связываются друг с другом. Таким образом, молекула водорода H 2 содержит хороший пример чистой ковалентной связи.
В большинстве случаев электроны в ковалентных связях не распределяются поровну. Обычно один атом притягивает связывающие электроны сильнее, чем другой. Это неравномерное притяжение приводит к тому, что эти электроны перемещаются ближе к атому с большей силой притяжения. Получающееся в результате асимметричное распределение электронов делает один конец молекулы более богатым электронами, и он приобретает частичный отрицательный заряд, в то время как конец менее богатый электронами приобретает частичный положительный заряд.Эта разница в электронной плотности заставляет молекулу становиться полярной , то есть иметь отрицательный и положительный конец.
Способность атома притягивать электроны химической связью называется электроотрицательностью атома. Электроотрицательность атома связана с его сродством к электрону и энергией ионизации. Сродство к электрону — это энергия, выделяемая атомом газа, когда к нему присоединяется электрон. Энергия ионизации — это минимальное количество энергии, необходимое для удаления наиболее слабосвязанного электрона из газового атома.
Уровень электроотрицательности обычно измеряется по шкале, созданной Линусом Полингом. В этом масштабе наиболее электроотрицательными элементами являются галогены, кислород, азот и сера. Фтор, галоген, является наиболее электроотрицательным со значением 4,0, которое является наивысшим значением на шкале. Менее электроотрицательными элементами являются щелочные и щелочноземельные металлы. Из них цезий и франций являются наименее электроотрицательными при значениях 0,7.
Элементы с большой разницей в электроотрицательности имеют тенденцию к образованию ионных связей.Атомы элементов с подобной электроотрицательностью имеют тенденцию образовывать ковалентные связи. (Чистые ковалентные связи образуются, когда два атома имеют одну и ту же связь электроотрицательности.) Промежуточные различия в электроотрицательности между ковалентно связанными атомами приводят к полярности связи. Как правило, разница электроотрицательностей в 2 и более по шкале Полинга между атомами приводит к образованию ионной связи. Разница менее 2 между атомами приводит к образованию ковалентной связи. Чем ближе разница в электроотрицательности между атомами к нулю, тем чище становится ковалентная связь и тем меньше у нее полярности.
Углерод с электроотрицательностью 2,5 образует ковалентные связи как с низкой, так и с высокой полярностью. Значения электроотрицательности элементов, обычно встречающихся в органических молекулах, приведены в таблице.
Углерод-углеродные связи более гибкие, чем думали
Исследователи из Университета Хоккайдо ставят под сомнение прочный и стабильный образ одинарной связи углерод-углерод.
Углерод, пожалуй, один из самых универсальных элементов в таблице Менделеева.Мы знаем, что его уникальная электронная конфигурация позволяет ему образовывать самое сильное вещество, встречающееся в природе, а также одно из самых слабых, атомарно тонкие слои которого можно легко стереть, перетаскивая его по бумаге. Когда он не связан только с самим собой, он дает начало бесчисленному множеству молекул и соединений, без которых жизнь в том виде, в каком мы ее знаем, не существовала бы. Все это возможно, потому что одинарная связь углерод-углерод (C – C) является одной из самых стабильных и надежных, известных химикам.Это дает C – C одну из самых стабильных известных длин связей, в отличие от других атомов, ковалентные связи которых могут быть намного более гибкими; больше похоже на пружины, чем на натянутые тросы.
Но теперь исследователи обнаружили, что этот взгляд на связь C – C не так прост, как когда-то думали. В статье, опубликованной в Angewandte Chemie , Юсуке Исигаки и его команда из Университета Хоккайдо синтезировали соединение, которое впервые демонстрирует ковалентные связи C – C, которые способны растягиваться и сжиматься до беспрецедентной длины, сохраняя при этом свой ковалентный характер.
Природа химической связи давно является предметом спора теоретиков. Хотя существует широкий консенсус относительно двух основных существующих типов — атомы могут связываться ионно или ковалентно, — другие виды связей (металлические, водородные, межмолекулярные) усложняют эту простую картину двух различных типов связи, а граница между ионной и ковалентной связью может становится менее ясным. Несмотря на это осложнение, мы думали, что находимся на простой территории с одинарной связью C – C; Команда Исигаки могла выбросить эту простоту из воды.
Измеренные ими связи C – C превышали 0,18 нм по сравнению с нормальными 0,154 нм для связи C – C. Это может показаться незначительным изменением, но в контексте органической химии такое изменение может иметь огромное влияние на структуру и, следовательно, свойства химического вещества.
Команда обнаружила эту гибкость связи, разработав и синтезировав органическое соединение, которое самоорганизуется в клеточную структуру (циклизуется) при воздействии света. Затем они сосредоточили внимание на длине связи между двумя конкретными атомами углерода в ядре этой молекулы с помощью рентгеновского анализа и рамановской спектроскопии и обнаружили, что этот процесс циклизации привел к сокращению этой связи.

Leave A Comment