8 класс Химическая связь | Методическая разработка по химии (11 класс) на тему:
Самостоятельная работа «Химическая связь»
В тетради чертите табличку и в соответствии с номером вопроса ставите вариант ответа:
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
ответ |
1. Ионный характер связи наиболее выражен в соединении
Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaBr2 4) Nh4
2. Атомы химических элементов второго периода периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава
1) BaS 2) CO2 3) Al2O3 4) LiF
3. В веществах, образованных путем соединения одинаковых атомов, химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
4. В молекуле F2 химическая связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
5. Химическая связь в молекуле фтороводорода
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
6. В KNO3 химическая связь
1) ковалентная неполярна 2) ковалентная полярная 3) металлическая 4) ионная
7. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) Cl2, Nh4, HCl 2) HBr, NO, Br2 3) h3S, h3O, S8 4) HI, h3O, Ph4
81. Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) донорно-акцепторная
9. Ионы являются структурными частицами
1) кислорода 2) воды 3) CO2 4) хлорида натрия
10. Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
11. Соединением с ковалентной неполярной связью является
1) HCl 2) O2 3) CaCl2 4) h3O
12. В сероуглероде CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
13. Установите соответствие между названием химического соединения и видом связи атомов в этом соединении.
Установите соответствие между названием химического соединения и видом связи атомов в этом соединении.
НАЗВАНИЕ СОЕДИНЕНИЯ ВИД СВЯЗИ
1) цинк А) ионная
2) азот Б) металлическая
3) аммиак (Nh4) В) ковалентная полярная
4) хлорид кальция (CaCl2) Г) ковалентная неполярная
14. Установите соответствие между видом связи в веществе и формулой химического соединения.
ВИДЫ СВЯЗИ ФОРМУЛЫ СОЕДИНЕНИЙ
1) ионная А) h3
2) металлическая Б) Ba
3) ковалентная полярная В) HF
4) ковалентная неполярная Г) BaF2
15. Ковалентная неполярная связь реализуется в соединении
1) CrO3 2) P2O5 3) SO2 4) F2
16. В Nh4 и BaCl2 химическая связь соответственно
В Nh4 и BaCl2 химическая связь соответственно
1) ионная и ковалентная полярная 2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная
17. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) вода и h3S 2) KBr и N2 3) Nh4 и h3 4) O2 и Ch5
18. Наименьшей электроотрицательностью обладает элемент
1) Be 2) B 3) C 4) N
19. Наиболее прочная химическая связь имеет место в молекуле
1) F2 2) Cl2 3) O2 4) N2
20. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
21. За счет общей электронной пары химическая связь образована в соединении
1) KI 2) HBr 3) Li2O 4) NaBr
22. Тремя общими электронными парами образована ковалентная связь в молекуле
Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота 2) сероводорода 3) метана 4) хлора
23. Ковалентная полярная связь характерна для
1) KСl 2) HBr 3) Р4 4) CaCl2
24. Вещества только с ковалентной полярной связью указаны в ряду:
1) CaF2, Na2S, N2 2) P4, FeCl3, Nh4 3) SiF4, HF, h3S 4) NaCl, LiH, SO2
25. В каком соединении полярность связи наименьшая?
1) HBr 2) h3O 3) h3S 4) HCl
26. Вещества с ковалентной полярной связью находятся в ряду:
1) Nh4, SF6, h3S 2) KF, HF, CF4 3) CO2, N2, HF 4) SO2, NO2, Cl2
27. Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
28. Веществом с ковалентной полярной связью является
1) Cl2 2) NaBr 3) h3S 4) MgCl2
29. Ковалентная неполярная связь характерна для каждого из двух веществ:
Ковалентная неполярная связь характерна для каждого из двух веществ:
1) водорода и хлора 2) воды и алмаза 3) меди и азота 4) брома и метана
30. Только ковалентные связи имеет каждое из двух веществ:
- CaO и C3H6 2) NaNO3 и CO 3) N2 и K2S 4) Ch5 и SiO2
- Хлорид бария имеет кристаллическую решётку
1) атомную 2) металлическую 3) ионную 4) молекулярную
- Ковалентная неполярная связь характерна для
1) Cl2 2) SO3 3) CO 4) SiO2
- Из перечисленных элементов наиболее электроотрицательным является
1) азот 2) кислород 3) хлор 4) фтор
- Бром в твердом состоянии имеет кристаллическую решётку
1) молекулярную 2) металлическую 3) ионную 4) атомную
- Ковалентная полярная связь характерна для вещества
1) KI 2) CaO 3) Na2S 4) Ch5
- Кристаллическая решётка кремния
1) атомная 2) молекулярная 3) ионная 4) металлическая
- Водородные связи образуются между молекулами
1) метанола 2) метана 3) ацетилена 4) метилформиата
- Наиболее электроотрицательным элементом из перечисленных является
1) кремний 2) азот 3) фосфор 4) калий
- Немолекулярное строение имеет каждое из двух веществ:
1) S8 и О2 2) Na2CO3 и I2 (тв) 3) СО и Mg 4) Fe и NaCl
- Химическая связь между молекулами воды
1) водородная 2) ионная 3) ковалентная полярная 4) ковалентная неполярная
- Хлорид калия имеет кристаллическую решетку
1) атомную 2) молекулярную 3) ионную 4) металлическую
- К веществам с молекулярным строением относятся
1) графит и оксид углерода (IV) 2) вода и оксид углерода (II)
3) сера и оксид железа (III) 4) серная кислота и оксид кремния (IV)
- Соединению с ковалентной связью соответствует формула
1) Na2O 2) MgCl2 3) CaBr2 4) HF
- Молекулярное строение имеет
1) цинк 2) нитрат бария 3) гидроксид калия 4) сероводород
- Вещество с ковалентной неполярной связью имеет формулу
1) h3O 2) Br2 3) Ch5 4) N2O5
- Кристаллическая решетка хлорида лития
1) металлическая 2) молекулярная 3) ионная 4) атомная
- Веществом с ионной связью является
1) KCl 2) Cl2 3) Nh4 4) SO2
- Атомную кристаллическую решетку имеет
1) железо 2) хлорид натрия 3) сера 4) алмаз
- Ионный характер связи наиболее выражен в соединении
1) BeO 2) СаO 3) MgO 4) B2O3
- Молекулярное строение имеет
1) CO2 2) KBr 3) MgSO4 4) SiO2
- Только ковалентные связи имеет каждое из двух веществ:
1) C3H8 и NaF 2) KCl и Ch4Cl 3) P2O5 и NaHSO3 4) C6H5Nh3 и P4
- Ионную решётку в кристаллическом состоянии имеет
1) фторид кальция 2) оксид углерода(II) 3) оксид фосфора(V) 4) хлороводород
- В молекуле сероводорода химическая связь
1) водородная 2) ковалентная неполярная 3) ковалентная полярная 4) ионная
- Молекулярное строение имеет
1) оксид кремния(IV) 2) нитрат бария 3) хлорид натрия 4) оксид углерода(II)
- Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) C3h5, NO, Na2O 2) CO, Ch4Cl, PBr3 3) P2O3, NaHSO3, Cu 4) C6H5NO2, NaF, CCl4
- Кристаллическая решётка иода
1) металлическая 2) молекулярная 3) атомная 4) ионная
- Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая 2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная 4) ковалентная полярная и ионная
- Веществом молекулярного строения является
1) хлорид натрия 2) графит 3) оксид углерода(IV) 4) оксид калия
- В каком ряду химические элементы расположены в порядке уменьшения их электроотрицательности?
1) Li → Be → B 2) P → S → Cl 3) Sb → As → P 4) Mg → Ca → Sr
- Соединением с ионной связью является
1) NO 2) CaO 3) h3O 4) SeO2
- Молекулярное строение имеет каждое из двух веществ:
1) Nh5Cl и Ch4Nh3 2) C2H5OH и Сh5
3) Na2CO3 и HNO3 4) h3S и Ch4COONa
- Между атомами элементов с порядковыми номерами 3 и 17 образуется химическая связь
1) ионная 2) ковалентная полярная 3) металлическая 4) ковалентная неполярная
- Вещества, имеющие ионную кристаллическую решётку, расположены в ряду:
1) MgCl2, CaI2, HNO3 2) Pb(NO3)2, h3S, Li2SO4
3) Ba(OH)2, Fe, CuCl2 4) NaBrO3, Ch4COONa, Na2S
- В каком ряду химические элементы расположены в порядке уменьшения их электроотрицательности
1) Li → Be → B 2) B → Al → Ga 3) Sb → As → P 4) P → S → Cl
- Полярность связи возрастает в ряду веществ:
1) Cl2, HCl, NaCl 2) SO2, h3S, O2 3) CO2, Ch5, h3 4) LiF, F2, HF
- Вещества, имеющие молекулярное строение, расположены в ряду:
1) C2H5NO2, HCl, Ph4 2) SO2, Ca(OH)2, Ch4COOH
3) NaHCO3, C6H5Cl, HBr 4) C3H6, NO, FeS
- Образование водородной связи нехарактерно для
1) средних солей 2) спиртов 3) воды 4) карбоновых кислот
- Наибольшей электроотрицательностью обладает
1) углерод 2) фосфор 3) кремний 4) азот
- Молекулярное строение имеет каждое из двух веществ:
1) HNO3 и CaO 2) Na2S и NO2 3) h3SO4 и Cu 4) I2 и HClO3
- Ковалентную полярную связь имеет каждое из двух веществ:
1) CS2 и PCl3 2) K и KOH 3) h3SO4 и S8 4) KH и h3O
- Молекулярное строение имеет
1) сульфид калия 2) оксид бария 3) хлороводород 4) оксид кальция
- Химическая связь в сульфиде калия
1) ионная 2) ковалентная 3) металлическая 4) водородная
- Атомную кристаллическую решётку в твёрдом состоянии имеет
1) водород 2) кислород 3) оксид углерода(IV) 4) оксид кремния(IV)
- Ковки, пластичны, электро- и теплопроводны вещества, у которых кристаллическая решётка
1) ионная 2) молекулярная 3) атомная 4) металлическая
- Веществом с ковалентной связью является
1) CaCl2 2) MgS 3) h3S 4) NaBr
- Металлическая кристаллическая решётка характерна для
1) белого фосфора 2) аргона 3) кальция 4) оксида алюминия
- Ковалентную полярную связь имеет соединение хлора с
1) натрием 2) водородом 3) калием 4) кальцием
- Ионную кристаллическую решётку имеет
1) оксид кальция 2) вода 3) алюминий 4) алмаз
- Веществом с ионной связью является
1) K2S 2) h3S 3) CO2 4) CCl4
- Веществом с ионным типом кристаллической решётки является
1) сульфат натрия 2) аммиак 3) бензол 4) уксусная кислота
- Полярность ковалентной связи в ряду веществ HF → HCl → HBr → HI
1) увеличивается 2) уменьшается 3) не изменяется 4) изменяется периодически
- Немолекулярное строение имеет каждое из двух веществ:
1) азот и алмаз 2) хлор и бром 3) калий и медь 4) вода и гидроксид натрия
- Химическая связь в молекуле водорода
1) ионная 2) ковалентная неполярная 3) ковалентная полярная 4) водородная
- Сульфат натрия имеет кристаллическую решётку
1) металлическую 2) ионную 3) молекулярную 4) атомную
- Водородная связь не образуется между молекулами
1) карбоновых кислот 2) спиртов 3) нуклеиновых кислот 4) кетонов
- Среди перечисленных веществ: K2S, h4P, PCl3, NaBr веществом(-ами) с ионной связью является(-ются)
1) только K2S 2) K2S и NaBr 3) K2S, h4P и PCl3 4) K2S, h4P, PCl3 и NaBr
- Соединением с ионной связью является
1) PCl3 2) NO2 3) h3S 4) Cah3
- Водородная связь образуется между молекулами
1) уксусной кислоты 2) водорода 3) метана 4) диметилового эфира
- Наибольшая длина химической связи в молекуле
1) Ph4 2) h3O 3) h3S 4) Nh4
- В молекулах галогеноводородов химическая связь
1) ковалентная неполярная 2) ковалентная полярная 3) ионная 4) водородная
- Ионную связь имеет каждое из двух веществ:
1) h3O и h3S 2) O2 и N2 3) NaF и CaCl2 4) HF и BaF2
- Наиболее полярна химическая связь в молекуле
1) сероводорода 2) хлора 3) хлороводорода 4) фтороводорода
- Соединениями с ковалентной связью являются
1) NO2 и NaCl 2) CaO и Ch4Cl 3) BaS и h3 4) F2 и CCl4
- Веществом с ионной связью является
1) Ch5 2) Cl2O7 3) h3S 4) CsH
- Соединением с ковалентной неполярной связью является
1) h3S 2) h3 3) NO 4) CO
- В молекуле какого вещества имеются π-связи?
1) h3S 2) h3O2 3) Ph4 4) CO2
- Водородные связи образуются между молекулами
1) этилового спирта 2) углекислого газа 3) уксусного альдегида 4) сероводорода
- Веществом с ионной связью является
1) h4P 2) K2S 3) PCl3 4) h3S
- Веществом с ковалентной полярной связью является
1) Br2 2) NaBr 3) HBr 4) CaBr2
- Между атомами элементов с порядковыми номерами 17 и 20 образуется химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) металлическая
- Соединение с ионной связью образуется при взаимодействии
1) P и O2 2) N2 и h3 3) Na и h3 4) S и О2
- Среди веществ, указанных в ряду: Nh4, O2, HCl, SO2 – количество соединений с ковалентной полярной связью равно
1) одному 2) двум 3) трём 4) четырём
- В сульфиде калия химическая связь
1) металлическая 2) водородная 3) ковалентная 4) ионная
- Ионную связь имеет каждое из двух веществ:
1) h3O и h3S 2) h3 и Cl2 3) NaF и CaCl2 4) HF и BaF2
- Наиболее полярна химическая связь в молекуле
1) h3S 2) HCl 3) Ph4 4) Sih5
- В какой молекуле химическая связь наиболее полярна?
1) HF 2) HCl 3) Nh4 4) h3O
- Водородные связи образуются между молекулами
1) водорода 2) пропана 3) формальдегида 4) уксусной кислоты
- Среди веществ, перечисленных в ряду: KCl, h4P, NaBr, PCl3 – количество соединений с ионной связью равно
1) одному 2) двум 3) трём 4) четырём
- Число веществ с ионной связью в ряду: K2S, h4P, NaBr, PCl3 – равно
1) одному 2) двум 3) трём 4) четырём
- Наименее полярна ковалентная связь в молекуле
1) HCl 2) HI 3) HF 4) HBr
- Ковалентную неполярную связь имеет каждое из двух веществ:
1) азот и графит 2) сероводород и метан 3) графит и медь 4) кремний и цинк
- Наиболее полярной является химическая связь в молекуле
1) HBr 2) HCl 3) HI 4) HF
- Соединением с ионной химической связью является
1) Ph4 2) SO3 3) PCl3 4) K2S
- Наименее полярной является ковалентная связь в молекуле
1) h3O 2) Nh4 3) Ch5 4) HF
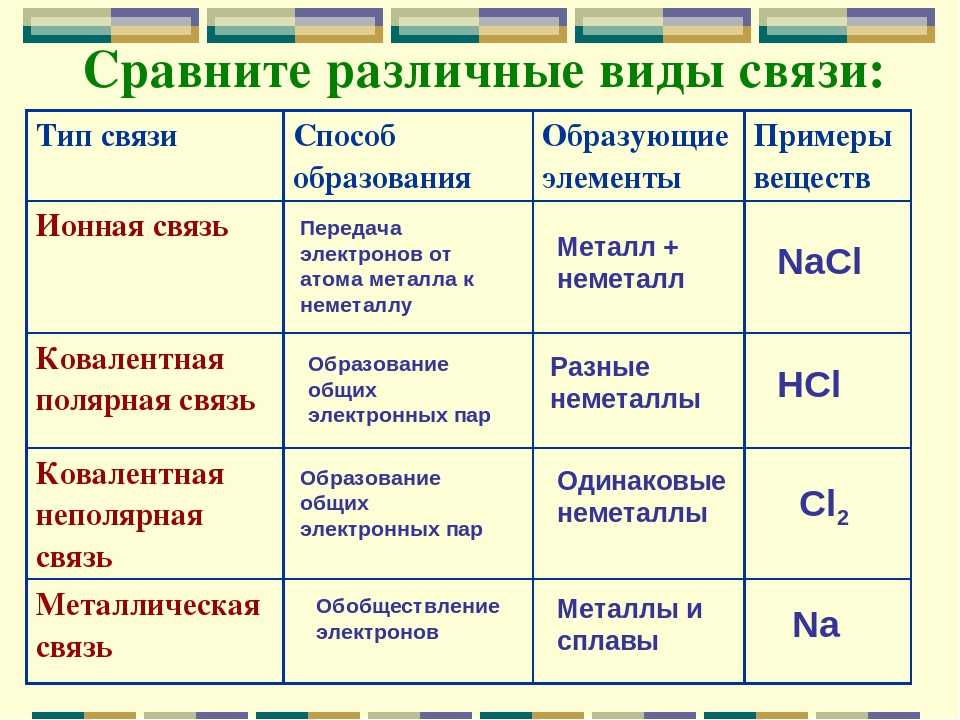
Основные типы химической связи.
 Химическая связь. Типы химических связей Тест 3 виды химической связи
Химическая связь. Типы химических связей Тест 3 виды химической связиХод урока: (Cлайд 3)
- Объяснение темы “Основные типы химической связи”.
- Закрепление (Тест)
- Работа в графическом редакторе “Paint” – составление графических формул веществ.
- Домашнее задание.
Ход урока
II. Проверка домашнего задания
(Cлайд 5)
(Устный опрос)
- Что такое электроотрицательность?
- Зависимость электроотрицательности от расположения элемента в таблице Менделеева?
- Как определить принадлежность элемента к металлам или неметаллам по электроотрицательности?
III.
 Объяснение темы “Основные типы химической
связи”. ( Cлайд 6)
Объяснение темы “Основные типы химической
связи”. ( Cлайд 6)
- Связь между элементами с одинаковой или близкой электроотрицательностью называется ковалентной. (Cлайд 7)
- Связь между металлами называется металлической.
- Связь между элементами со значительно отличающейся электроотрицательностью называется ионной.
- Связь между электроотрицательными элементами разных молекул при помощи водорода называется водородной.
IV. Закрепление (Тест)
(Cлайд 19)“Закрепление 3” – для тех, кто не совсем уверен в своих знаниях,
“Закрепление 4” – для тех, кто уверен в своих знаниях,
“Закрепление 5” – для тех, кто абсолютно уверен в своих знаниях.
- Отвечаете на вопросы.
- Получаете оценку и ждете пока учитель не разрешит закрыть программу.
V.
 Работа в графическом редакторе “Paint” –
составление графических формул веществ. (Cлайд
9)
Работа в графическом редакторе “Paint” –
составление графических формул веществ. (Cлайд
9)
1.Открываете программу “Paint”.
2. При помощи “наборов инструментов”
составляете графические формулы веществ: воды,
фторида натрия, хлороводорода, метана.
H 2 O, NaF, HCl, CH 4 .
Тест «Типы связей и кристаллических решеток»
Вариант №1
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
А1.
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9.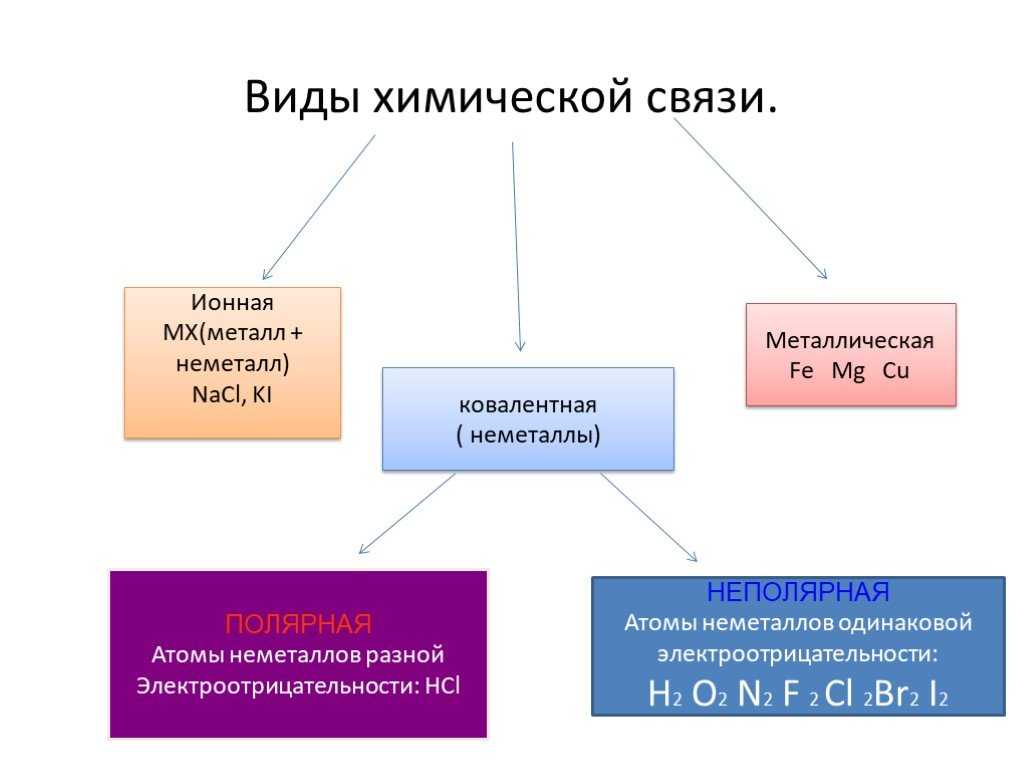 Электронная пара в молекуле HBr
Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В1. Установите соответствие между соединением и типом связи в соединении.
В2. Установите соответствие между соединением и типом кристаллической решетки
В3. Установите соответствие между соединением и типом связи в соединении.
Типы химических свиязей.
Часть А
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
1)1 2)2 3)3 4)4
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
А)железо 1)ионная
Д)азот
Часть С
Типы химических свиязей.
Часть А
1.Химическая связь в молекуле фтороводорода
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
2. ионная связь образуется между атомами
1) натрия и фтора 2)серы и водорода 3) серы и кислорода 4)хлора и водорода
3. Ионная связь образуется между ионами
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
4. Химическая связь между атомами химических элементов с порядковыми номерами 3 и 35
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
5. Химическая связь между атомами, электроотрицательности которых не отличаются друг от друга, называется
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
6. Химическая связь атома химического элемента, имеющего шесть электронов на внешнем электронном слое с водородом
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
7. Ковалентная полярная связь в каждом из двух веществ:
Ковалентная полярная связь в каждом из двух веществ:
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
8. Две общие электронные пары имеются в молекуле
1)водорода 2)бромоводорода 3)сероводорода 4) аммиака
9. Одну ковалентную связь имеет молекула
1)иодоводорода 2)азота 3)метана 4)кислорода
10. Число общих электронных пар в соединениях состава ЭО 2
1)1 2)2 3)3 4)4
11. Укажите формулу лишнего соединения
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
12. Установите соответствие между названием соединения и типом химической связи в этом соединении.
Название соединения Тип химической связи
А)железо 1)ионная
Б)кислород 2)ковалентная полярная
В)вода 3)ковалентная неполярная
Г)бромид литии 4)металлическая
Д)азот
13. Ковалентная полярная связь имеет место в соединениях:
1)сероводород 2)угарный газ 3)фтор 4)цинк 5)фторид калия 3)фтор
14. Три ковалентные полярные связи имеют молекулы
Три ковалентные полярные связи имеют молекулы
1)азота 2)фосфина 3) углекислого газа 4)аммиака 5)метана
Часть С
15. Приведите примеры четырех соединений калия, имеющих одновременно и ионную и ковалентную связь.
16. Назовите соединение, имеющее одну ковалентную неполярную связь атомов, электроны которых расположены на трех энергетических слоях.
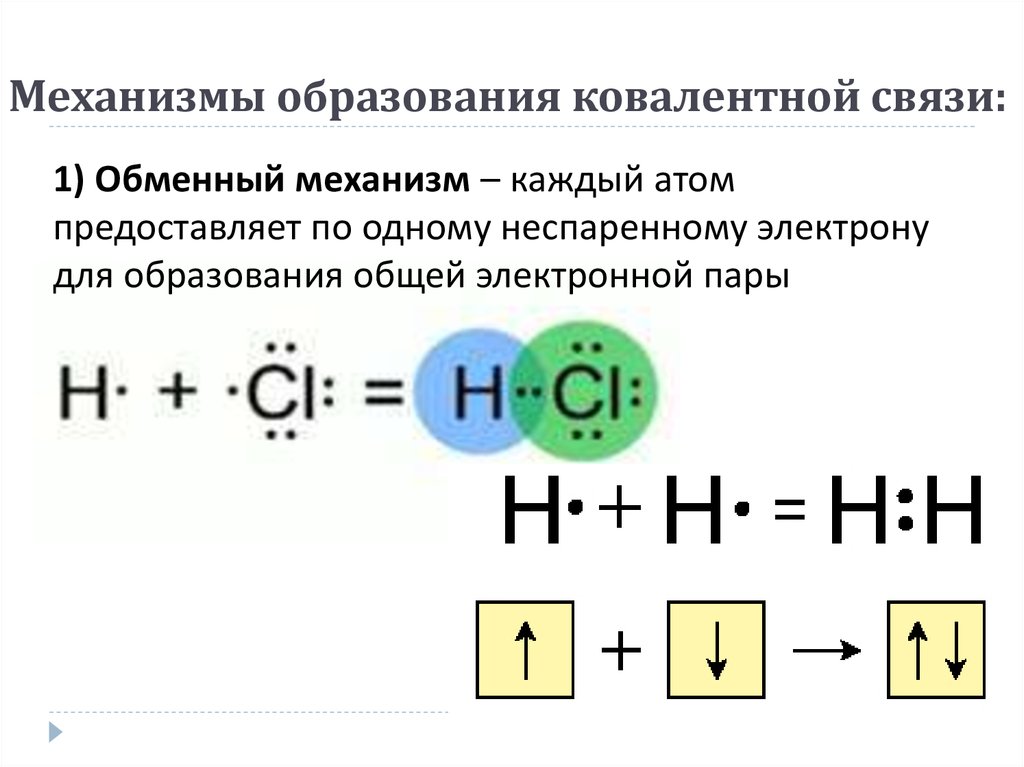
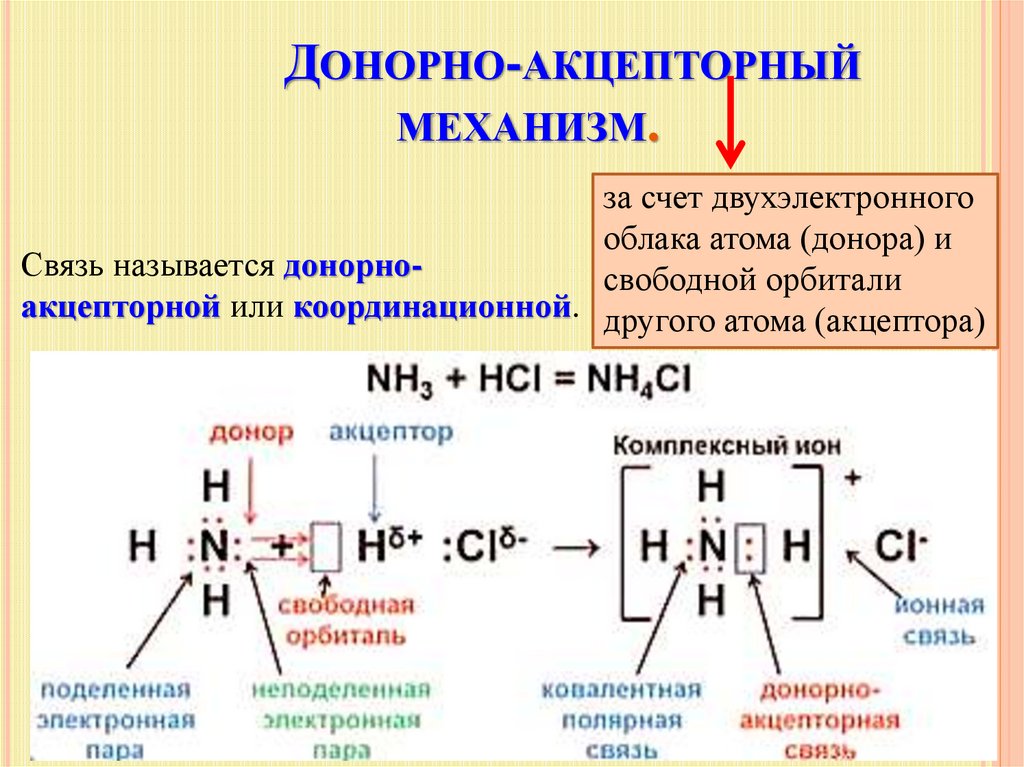
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
(HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2O, H 2F 2, NH 3. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).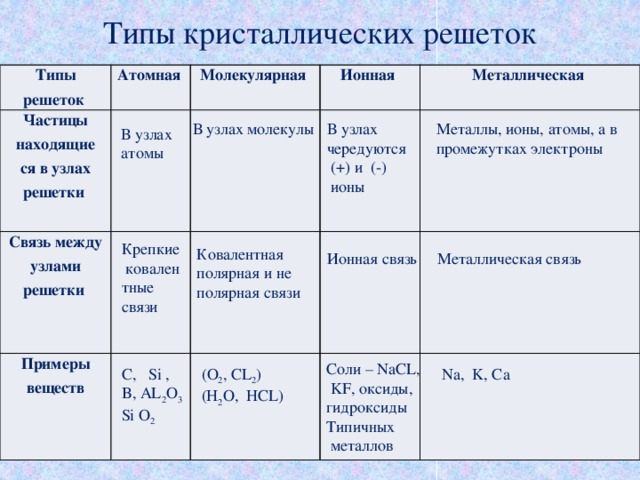 Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
1. Связь между ионами металла и блуждающими электронами называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
2. Химическая связь, возникающая между атомами неметаллов одного вида называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
3. Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
4. Химическая связь, возникающая между атомами типичного металла и типичного неметалла называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
5. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
6. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N 2 , NH 3, CO 2, Na, NH 3, H 2, KF H 2 O, НCl F 2, HF, C Ca. CO 3
7. Выберите группу веществ, в состав которой входят только вещества с металлической связью: Na, CO 2, K, Al, NH 3, Fe H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
8. Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na.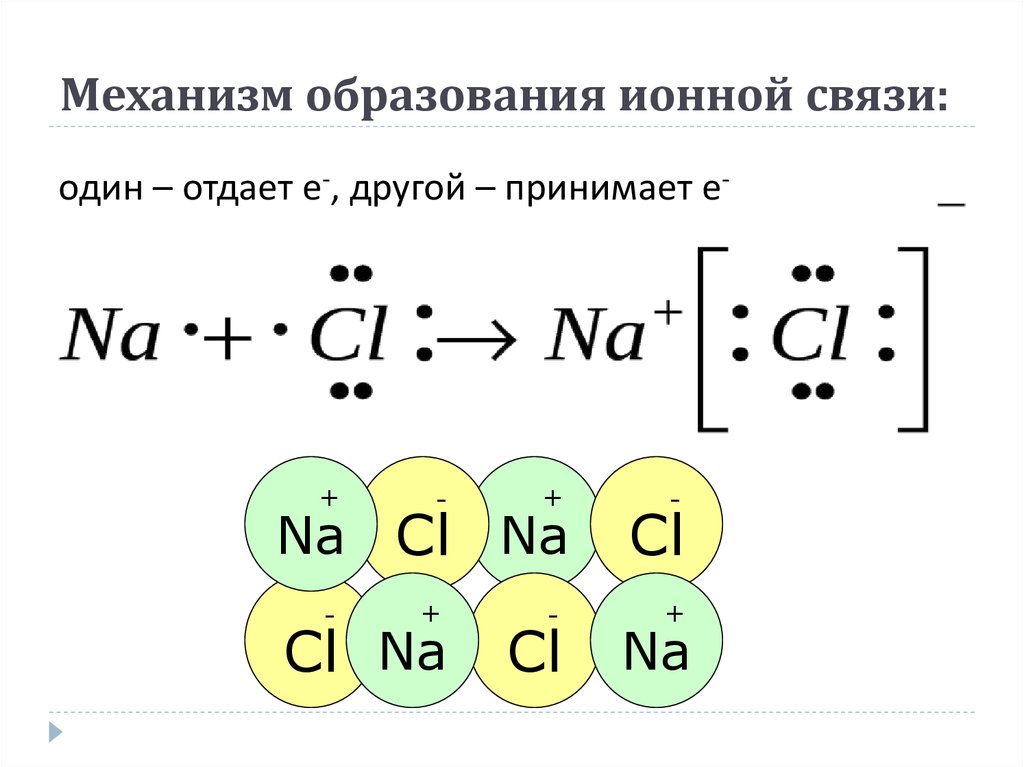 Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
9. Определите вид химической связи и тип кристаллической решетки, если вещество обладает высокой температурой плавления и кипения, твердое, тугоплавкое, хорошо растворимо в воде. Раствор проводит электрический ток. Ковалентная полярная связь и атомная кристаллическая решетка Ионная связь и ионная кристаллическая решетка Ковалентная полярная связь и молекулярная кристаллическая решетка. Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Является ли $HCl$ ионной солью или ковалентной молекулой?
Последняя обновленная дата: 02 -й апрель 2023
•
Общее представление: 182,1K
•
Просмотры сегодня: 5,56K
Ответ
Проверено
182.1K+ Просмотры
HINT:
182,1K+
HINT: 9003 химической связи, ионной связи и ковалентной связи. В ионной связи происходит полный перенос электронов, которые образуются за счет электростатической силы притяжения между двумя противоположно заряженными ионами, тогда как ковалентные связи образуются за счет взаимного обмена электронами между комбинирующими частицами. 9{-}} $ ионов и благодаря наличию иона водорода данная молекула является кислотой.
В ионной связи происходит полный перенос электронов, которые образуются за счет электростатической силы притяжения между двумя противоположно заряженными ионами, тогда как ковалентные связи образуются за счет взаимного обмена электронами между комбинирующими частицами. 9{-}} $ ионов и благодаря наличию иона водорода данная молекула является кислотой.
Кроме того, способность двух соединений образовывать ковалентную связь или ионную связь полностью зависит от электроотрицательности атомов, связанных вместе. Это означает, что разница в электроотрицательности между двумя атомами может определять тип связи молекулы в соответствии со следующими данными.
| Разность электроотрицательностей | Тип связи | ||||||||||||||||||||||||||||||||||||
| больше, чем 1,7 | Ионная связь | ||||||||||||||||||||||||||||||||||||
| между 1,7 и 0,4 | Полярная ковалентная связь | ||||||||||||||||||||||||||||||||||||
| Меньше 0,4 | Неполярная ковалентная связь. рассчитывается следующим образом: Электроотрицательность водорода $ =2,20 $ Электроотрицательность хлора $ =3,16 $ Разность электроотрицательностей молекулы $ =3,16-2,20\Rightarrow 0,96 $ Следовательно, разность электроотрицательностей для молекулы $ HCl $ составляет 0,96 и по данным, приведенным в таблице, если разность электроотрицательностей лежит между 1,7 и 0,4, то молекула является полярной ковалентной молекулой.  Таким образом, можно сделать вывод, что данная молекула, т. е. $HCl$, является полярной ковалентной молекулой. Таким образом, можно сделать вывод, что данная молекула, т. е. $HCl$, является полярной ковалентной молекулой. Примечание: Недавно обновленные страницы В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main Тенденции сомнений 8. 7: Полярность связи и электроотрицательность (\(\chi\)) 7: Полярность связи и электроотрицательность (\(\chi\))
Введение В ковалентной связи электроны находятся на связывающей орбитали между двумя ядрами. Если это гомоядерная связь (между атомами одного и того же элемента, как в H 2 , N 2 , O 2 , Cl 2 ,…), связывающие электроны делятся поровну, и распределение заряда вокруг связи симметрично (левая анимация рисунка \(\PageIndex{1}\)). Если это гетероядерная связь, такая как H-Cl или H-C, электроны могут или не могут быть разделены поровну.
Рисунок \(\PageIndex{1}\) : Атомы слева имеют одинаковую электроотрицательность и поэтому образуют неполярную связь с симметричным распределением электронов. Атомы справа имеют разную электроотрицательность, при этом розовая орбиталь имеет более высокую электроотрицательность, чем синяя, и поэтому полученная связь является асимметричной, с частичным отрицательным зарядом на более электроотрицательном атоме и частичным положительным на менее электроотрицательном атоме. Резюме:
ЭлектроотрицательностьВведение Электроотрицательность не является термодинамическим свойством и не имеет единиц измерения. Термин «электроотрицательность» был введен Берцелиусом в 1811 году, и мы будем использовать шкалу Полинга для электроотрицательностей, разработанную Линусом Полингом, которая варьируется от 0,7 (франций и цезий) до 4,0 (фтор). Хотя мы присваиваем элементам значения электроотрицательности, они являются свойствами не атомов как таковых, а атомов, когда они находятся в связи. То есть, если два атома с разной электроотрицательностью образуют связь, более электроотрицательный элемент будет оттягивать электронную плотность от менее электроотрицательного элемента, который также можно классифицировать как более электроположительный элемент. Периодические тренды электроотрицательностейНа базовом уровне электроотрицательности можно соотнести с энергиями ионизации и сродством к электрону, хотя последние являются термодинамическими свойствами изолированного атома в газовой фазе, а электроотрицательности основаны на произвольной безразмерной шкале. Тем не менее, атомы с низкими энергиями ионизации (которые всегда являются эндотермическими) имеют тенденцию быть электроположительными, потому что они не крепко удерживают свои валентные электроны. Точно так же атомы с экзотермическим сродством к электрону (высвобождают энергию, когда они получают электрон), как правило, имеют высокие энергии электронов, поскольку им нравится получать электроны. Рисунок \(\PageIndex{2}\) : Шкала электроотрицательности Полинга (\(chi\)) элементов.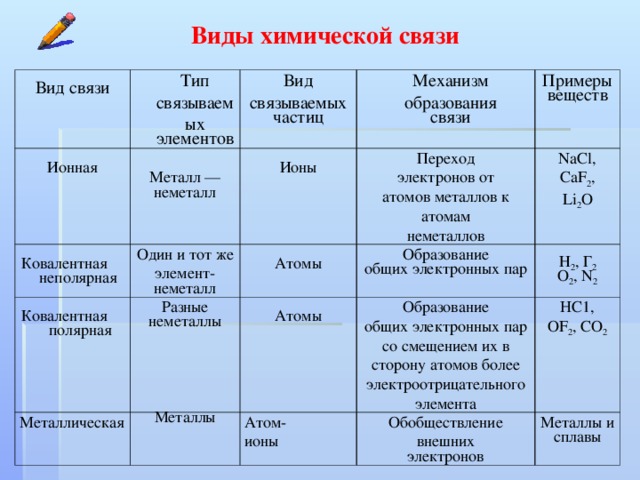 Когда между двумя элементами образуется связь, более электроотрицательный элемент сильнее притягивает электроны, чем более электроположительный элемент. Когда между двумя элементами образуется связь, более электроотрицательный элемент сильнее притягивает электроны, чем более электроположительный элемент. Упражнение \(\PageIndex{1}\) Почему благородные газы в таблице 8.7.1 не имеют значения электроотрицательности?
Рисунок \(\PageIndex{3}\): Диаграмма, показывающая периодические тренды электроотрицательности. Обратите внимание, что подъем по группе и по периоду приводит к увеличению электроотрицательности. Упражнение \(\PageIndex{2}\) Почему переход (слева направо) через точку приводит к увеличению электроотрицательности?
Почему понижение группы приводит к увеличению электроположительности (уменьшению электроотрицательности).
Если бы не таблица электроотрицательностей, можно было бы ожидать, что вы знаете, какая из них больше а). Меркурий или серебро?
Эмпирическое правило: прогнозирование типов связиВ качестве «эмпирического правила» можно использовать различия в электроотрицательности для прогнозирования того, будет ли связь ковалентной, полярно-ковалентной или ионной. Если разница в \(\chi\) между двумя связывающими атомами меньше 1/2, они имеют очень похожую электроотрицательность, и это ковалентная связь. Если оно больше 2, то они существенно различаются и более электроотрицательный атом полностью отбирает валентный электрон от электроположительного, образуя ионное соединение, а если между 0,5 и 2,0 — полярно-ковалентное.
Рисунок \(\PageIndex{4}\): Иллюстрация различных типов связи между атомами с разной электроотрицательностью (см. Диаграмма Ван Аркела-Кетелаара (VAK) Теперь, когда мы рассмотрели периодические тренды электроотрицательности, самое время вернуться к диаграмме Ван Аркела-Кетелаара (VAK), представленной во введении к этой главе, хотя это делается с помощью с оговоркой, что в этой главе основное внимание уделяется ковалентным и полярным ковалентным связям. На диаграмме VAK ось X представляет собой среднюю электроотрицательность двух атомов в связи, которая может иметь высокое значение, только если они оба неметаллы, и низкое значение, если они оба являются металлами, и поэтому металлические связи будут активны. слева и ковалентные связи (между двумя неметаллами) справа. Ось Y — это разница в электроотрицательности, значение, которое может быть высоким только в том случае, если один из них является металлом, а другой — неметаллом, что также приводит к среднему значению, которое находится посередине между металлом и неметаллом, и это приводит к в треугольной структуре, где вершина будет представлять ионные связи между металлами и неметаллами. Следующий YouTube представляет собой анимацию, которая показывает разницу между ковалентными, полярными ковалентными и ионными связями, основанную на разнице в электроотрицательности связывающих атомов. Анимационный ролик на YouTube, посвященный электроотрицательности и типам связи Видео \(\(PageIndex{1}\) 3:32 мин. YouTube, профессор Дэйв рассказывает об основах электроотрицательности (https://youtu.be/PoQjsnQmxok).Второй просмотр на YouTube типов связей и электроотрицательности. Видео \(\PageIndex{2}\): 2’11» загружено на YouTube компанией RicochetScience по электроотрицательности (https://youtu. {-}\) притягивается к положительной пластине внешнего поля. Поскольку молекула тянется в противоположных направлениях, она не мигрирует к пластине, как ион, а выравнивается с полем. 9{-}\), но в газовой фазе эти взаимодействия практически пренебрежимо малы. {-}\) притягивается к положительной пластине внешнего поля. Поскольку молекула тянется в противоположных направлениях, она не мигрирует к пластине, как ион, а выравнивается с полем. 9{-}\), но в газовой фазе эти взаимодействия практически пренебрежимо малы.Дипольный моментЭлектрический диполь возникает, когда два одинаковых заряда находятся на расстоянии друг от друга. Дипольный момент представляет собой вектор \(\vec{\mu}\), который является мерой силы и ориентации электрического диполя и имеет единицы Дебая. Дипольный момент молекулы зависит от частичных зарядов полярной связи и расстояния между ними. Игнорируя векторные аспекты, это можно рассчитать по уравнению: 9-\)) и Дебай — это очень маленькая единица измерения, которая в базовых единицах СИ имеет значение 3,34×10 -30 Амперметр секунд. Обратите внимание, Yocto, (10 -24 ) является наименьшим префиксом SI, и он примерно в 10 6 раз меньше! Отношение дипольных моментов к \(\Delta \chi\) и длинам связей: В таблице 8.
Примечание: В этом классе вы не будете выполнять расчеты с \(\mu\), но вам необходимо концептуальное понимание и понимание разницы между зарядом иона и величиной диполя. Авторы Авторы и ссылки
Эта страница под названием 8.7: Полярность связи и электроотрицательность (\(\chi\)) распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Роберт Белфорд. |

 {-}\)). В этой главе мы познакомим вас с понятием электроотрицательности (\(\chi\), произносится как «ки», как в слове «небо»), чтобы помочь определить, является ли связь полярной или нет. В связи с атомами различной электроотрицательности связывающие атомы с более высокой электроотрицательностью притягивают электронную плотность больше, чем атомы с более низкой электроотрицательностью, и поэтому имеют частично отрицательный заряд..
{-}\)). В этой главе мы познакомим вас с понятием электроотрицательности (\(\chi\), произносится как «ки», как в слове «небо»), чтобы помочь определить, является ли связь полярной или нет. В связи с атомами различной электроотрицательности связывающие атомы с более высокой электроотрицательностью притягивают электронную плотность больше, чем атомы с более низкой электроотрицательностью, и поэтому имеют частично отрицательный заряд.. .
. Также необходимо отметить, что в молекуле, где атом связан более чем с одним другим атомом, фактическое распределение электронов является результатом всех взаимодействий.
Также необходимо отметить, что в молекуле, где атом связан более чем с одним другим атомом, фактическое распределение электронов является результатом всех взаимодействий.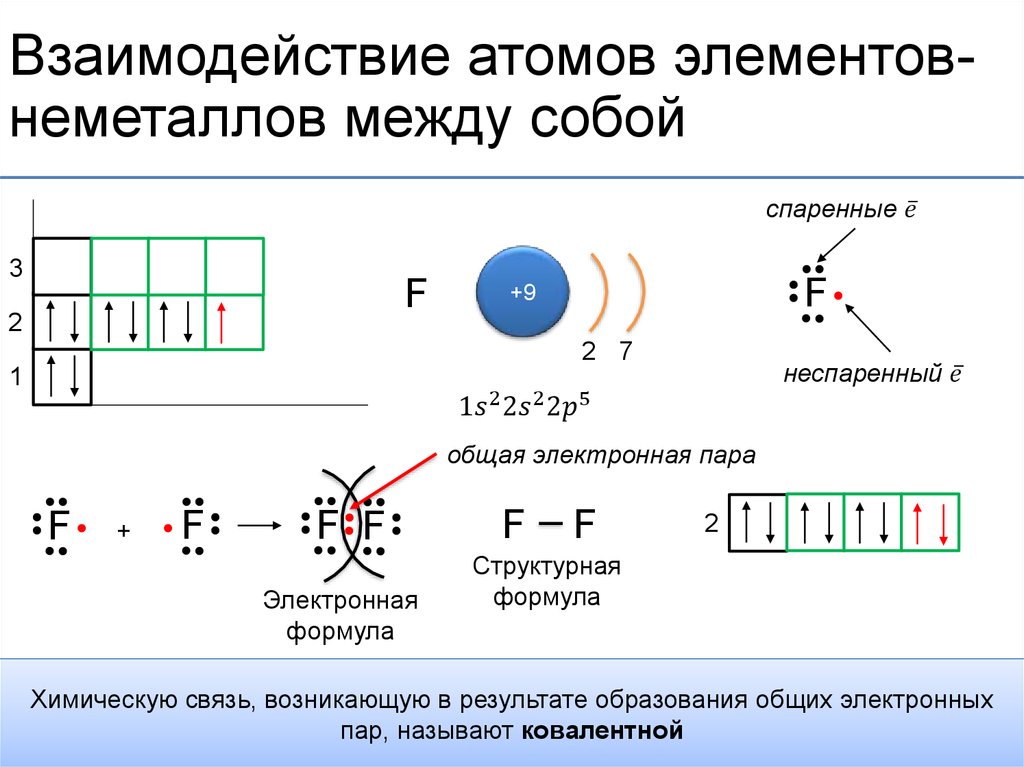 Это означает, что притяжение электрона будет сильнее, и поэтому тенденция имеет смысл.
Это означает, что притяжение электрона будет сильнее, и поэтому тенденция имеет смысл.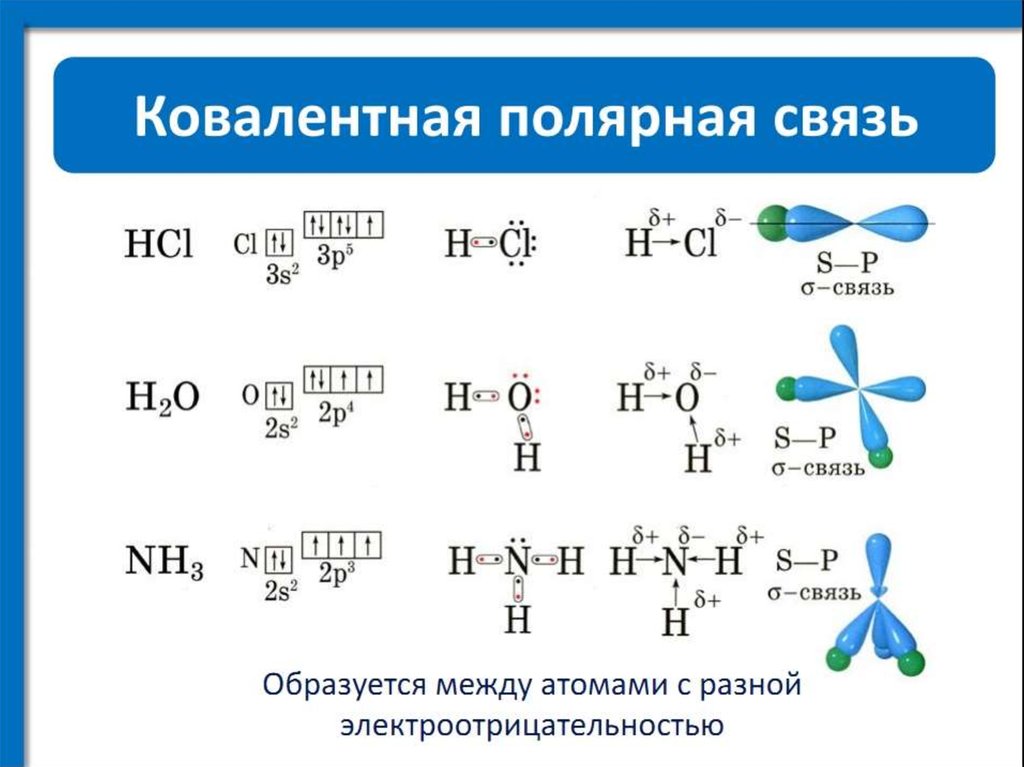 (Тенденции противостоят друг другу.)
(Тенденции противостоят друг другу.) таблица 8.7.1 для значений \(\chi\) и таблица 8.7.2 для значений (\(\Delta \chi\)).
таблица 8.7.1 для значений \(\chi\) и таблица 8.7.2 для значений (\(\Delta \chi\)).
 7.2 мы рассматриваем двухатомные молекулы между H и галогенами. Мы отмечаем, что по мере того, как вы спускаетесь вниз по таблице Менделеева, длина связи увеличивается, что приводит к большому дипольному моменту. Но она снижается, потому что \(\Дельта\чи\) уменьшается в большей степени. Таким образом, разница в электроотрицательности является основным фактором, определяющим силу полярности молекулы.
7.2 мы рассматриваем двухатомные молекулы между H и галогенами. Мы отмечаем, что по мере того, как вы спускаетесь вниз по таблице Менделеева, длина связи увеличивается, что приводит к большому дипольному моменту. Но она снижается, потому что \(\Дельта\чи\) уменьшается в большей степени. Таким образом, разница в электроотрицательности является основным фактором, определяющим силу полярности молекулы. момент полярной молекулы. До сих пор мы держались простых двухатомных. В следующем разделе мы перейдем к соединениям с более чем одной полярной связью и увидим, что ориентация связей влияет на полярность молекулы и что симметричная молекула, такая как двуокись углерода, имеет полярные связи, но сама по себе неполярна.
момент полярной молекулы. До сих пор мы держались простых двухатомных. В следующем разделе мы перейдем к соединениям с более чем одной полярной связью и увидим, что ориентация связей влияет на полярность молекулы и что симметричная молекула, такая как двуокись углерода, имеет полярные связи, но сама по себе неполярна.
Leave A Comment