Рассмотрите схемы образования ионной связи между атомами химических элементов. Химия. 8 класс. Габриелян. ГДЗ. § 10. Глава 1. Вопрос 2.
Помощь уже в пути, держи.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий — элемент главной подгруппы I группы, металл. Его атому легче отдать I внешний электрон, чем принять недостающие 7:
1. Кислород— элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
1. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
2. Схематично образование ионной связи между атомами натрия и кислорода можно записать так:
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
2. Хлор— элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, чем отдать 7 электронов:
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одному.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так:
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний— элемент II группы главной подгруппы, металл. Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6:
2. Фтор — элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Химическая связь
1. Ковалентная неполярная связь образуется за счет общих электронных пар в простых веществах — неметаллах (H2, O2, Cl2, N2)
2. Ковалентная полярная связь образуется в сложных веществах между атомами неметаллов (HCl, H2O, NH3)
3. Ионная связь возникает в сложных веществах между разноименно заряженными ионами металлов и неметаллов (NaCl, CaO)
4. Металлическая связь образуется в простых веществах металлах за счет свободных электронов и положительных ионов (Al, Fe, Cu)
Давайте порассуждаем вместе
1. Вещество с ковалентной неполярной связью имеет формулу:
1) HF
2) F2
3) NaF
4) Ca
Ответ: простым веществом-неметаллом является фтор F2, значит в молекуле фтора связь ковалентная неполярная.
2. Вещество с ковалентной полярной связью имеет формулу:
1) PF5
2) S8
3) KCl
4) Mg
Ответ: сложным веществом, состоящим из атомов неметаллов является фторид фосфора (V), значит в этом веществе ковалентная полярная связь
3. Вещество с ионной связью имеет формулу:
1) H2S
2) P4
3) Ag
4) BaF2
Ответ: сложным веществом, состоящим из ионов металла бария и неметалла фтора, является фторид бария, значит в этом веществе ионная связь.
4. Веществом с металлической связью является:
1) аммиак
2) цинк
3) хлорид магния
4) озон
Ответ: Цинк является простым веществом — металлом, значит связь в цинке металлическая
5. Гидроксид натрия образован
Гидроксид натрия образован
1) металлической и ковалентной связями
2) только ионной связью
3) ионной и ковалентной связями
4) только ковалентной связью
Ответ: Связь между ионом натрия и гидроксид-ионом ионная, а между атомом кислорода и атомом водорода ковалентная полярная
6. Ковалентная полярная связь присутствует в веществе
1) железо
2) серная кислота
3) кислород
4) бромид калия
Ответ: ковалентная полярная связь присутствует в серной кислоте, так как это вещество сложное и образовано атомами водорода, кислорода и серы (неметаллами)
7. Химическая связь соответственно: ионная, ковалентная полярная, металлическая, ковалентная неполярная
Решение задач по химии — любой сложности. Готовые и на заказ.
Готовые и на заказ.
1) NaCl, SO2, Ca, H2
2) HCl, Al, Cl2, CuCl2
3) K, CO
2, FeBr3, O2 4) F2, Zn, H2O, BaS
Ответ: хлорид натрия — вещество с ионной связью, оксид серы (IV) — вещество с ковалентной связью, кальций — простое вещество — металл, связь металлическая, в молекуле водорода — связь ковалентная неполярная
Задание 1
Атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая.Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними — это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.

Чем сильнее атом притягивает к себе электроны, тем выше его электроотрицательность. Электоотрицательность зависит от размеров атома и заряда его ядра. Размеры атомов элементов одного периода уменьшаются с увеличением заряда ядра. Это происходит потому, что заряд ядра атома от элемента к элементу увеличивается, а число электронных слоев остается одинаковым. При этом атом становится более компактным, размер атома уменьшается к концу периода, а сила притяжения электронов ядром увеличивается. Поэтому электроотрицательность элементов в периоде возрастает.
У элементов главных подгрупп с увеличением зарядов ядер возрастает и число электронных слоев, следовательно увеличивается размер атомов. Притяжение внешних электронов уменьшается. Поэтому электроотрицательность элементов в группе уменьшается.
Наибольшей электроотрицательностью обладают элементы-неметаллы: фтор, кислород, азот и другие. Элементы-металлы обладают меньшей электроотрицательностью. Самая низкая электроотрицательность у таких элементов, как калий, натрий, кальций.
 По убыванию электроотрицательности элементы можно расположить в ряд:
По убыванию электроотрицательности элементы можно расположить в ряд:F, O, N, Cl, Br, S, I, C, Se, P, H, B, Si, Cu. Fe, Zn. Al, Mg, Li, Ca, Na, K
Электроотрицательность фтора условно принята за 4,0; электроотрицательность калия равна 0,8.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее.
1. Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами. При этом образует ион металла с положительных зарядом и ион неметалла с отрицательным зарядом.
2. Ковалентная – это связь между атомами неметаллов, в результате которой образуются общие электронные пары.
Различают неполярную и полярную ковалентную связь.

При взаимодействии атомов с одинаковой электроотрицательностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах простых веществ: водород, кислород, азот, хлор и т.д. Химические связи в этих образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием при сближении атомов.
При взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому и образуется ковалентная полярная связь. При этом образуются частичные заряды. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
3. Металлическая – это связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов. Этот тип связи характерен для простых веществ- металлов и их сплавов. Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы.
 Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь.
Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь.Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Барий и кислород — Справочник химика 21
Определите массы оксида бария и кислорода, необходимые для получения 10 кг пероксида бария. Какое практическое применение он находит [c.163] При нагревании окиси бария до 500—600 — в атмосфере кислорода образуется перекись бария ВаО- , которая при более высоком нагревании разлагается на окись бария и кислород.
В настоящее время в технологии промышленного органического синтеза термический пиролиз в трубчатых печах, пожалуй, единственный масштабный процесс, основные реакции которого идут без применения катализаторов.
 Характерно, что параллельно с развитием этого процесса разрабатывались альтернативные варианты производства этилена, но ни один из них не получил промышленного применения. В зарубежной лит ературе эти альтернативные процессы называют нетрадиционными . Перечень основных из них включает крекинг в кипящем слое леска [фирма Ьиг у (ФРГ)] или кокса [фирма ВАЗР (ФРГ)], пиролиз в кипящем слое муллита в токе водяного Бара и кислорода [фирма ОЬе (ФРГ)], процессы крекинга водяным паром и расплавом солей. В рекламных описаниях приводятся, как правило, весьма благоприятные технико-экономические показатели этих процессов. И основываясь на рекламных данных трудно объяснить, почему эти нетрадиционные методы пиролиза в промышленность не внедряются, По-види-мому, преимущества нетрадиционных процессов над пиролизом в трубчатых печах при публикациях завышаются. Эти процессы, как правило, сложны в эксплуатации, а интерес к их разработке был вызван, главным образом, возможностями расширения сырьевой базы производства олефинов за счет вовлечения газойлей, мазутов, сырой нефти.
Характерно, что параллельно с развитием этого процесса разрабатывались альтернативные варианты производства этилена, но ни один из них не получил промышленного применения. В зарубежной лит ературе эти альтернативные процессы называют нетрадиционными . Перечень основных из них включает крекинг в кипящем слое леска [фирма Ьиг у (ФРГ)] или кокса [фирма ВАЗР (ФРГ)], пиролиз в кипящем слое муллита в токе водяного Бара и кислорода [фирма ОЬе (ФРГ)], процессы крекинга водяным паром и расплавом солей. В рекламных описаниях приводятся, как правило, весьма благоприятные технико-экономические показатели этих процессов. И основываясь на рекламных данных трудно объяснить, почему эти нетрадиционные методы пиролиза в промышленность не внедряются, По-види-мому, преимущества нетрадиционных процессов над пиролизом в трубчатых печах при публикациях завышаются. Эти процессы, как правило, сложны в эксплуатации, а интерес к их разработке был вызван, главным образом, возможностями расширения сырьевой базы производства олефинов за счет вовлечения газойлей, мазутов, сырой нефти.
Введем теперь новые сокращенные обозначения. Слой можно представить как сочетание двух компонентов 8 , (4 кислородных шпинельных слоя) п В (1 слой атомов бария и кислорода). Теперь структуру блока можно представить сложением 54 и 1, а структуру всей фазы М как ряд - [c.149]
Поляризационные кривые восстановления хроматов бария и свинца в первых двух случаях, приведенных в табл. 111,4, хорошо выражены, з последнем несколько искажены током восстановления адсорбированного кислорода. Влияние кислорода устраняется, если после концентрирования хрома электрод с осадком перенести в 0,1 н. раствор едкого натра и затем зарегистрировать катодную кривую. При этом токи восстановления хромата бария и кислорода наблюдаются в разных интервалах потенциалов. Величина максимального тока восстановления соединения линейно зависит от концентрации ионов Сг + в растворе в интервале 1 10 —I 10 г-ион/л и прямо пропорциональна концентрации в области 1-10 — 
Дальнейшее нагревание выше 800°С ведет, наоборот, к распаду ВаОг на окись бария и кислород. Поэтому сжигание металлического бария сопровождается образованием только его окиси. [c.364]
При более высокой температуре образовавшаяся перекись бария распадается на окись бария и кислород. [c.270]
Пероксид бария ВаОг — тяжелый белый порошок, при прокаливании выше 500 °С разлагается с образованием оксида бария и кислорода. В молекулу пероксида бария, как и всех пере-кисных соединений, входят два атома кислорода, связанные друг /О
Феннер и Дейли (1966) использовали времяпролетный масс-спектрометр с гигантским импульсным лазером для испарения фольги лития, бериллия, бора, углерода, алюминия, меди, серебра, олова, свинца, золота. Натрий и калий предварительно напыляли на стекло. Поскольку был использован лазер с модулированной добротностью, образуемые ионы имели значительные кинетические энергии и для разрешения спектра при помощи времяпролетного анализатора требовался энергетический фильтр. Для калибровки прибора эти авторы разработали специальные свинцовые стекла, содержащие литий, натрий, барий и кислород (Феннер, Дейли, 1968). Ошибки определения большинства элементов составили 10%, а при содержании элементов меньше 10% —50%.
Для калибровки прибора эти авторы разработали специальные свинцовые стекла, содержащие литий, натрий, барий и кислород (Феннер, Дейли, 1968). Ошибки определения большинства элементов составили 10%, а при содержании элементов меньше 10% —50%.
В отсутствие посторонних источников бария и кислорода для последнего случая получено хорошее приближение [Л. 94] [c.49]
Перекись бария — тяжелый белый порошок, при прокаливании выше 500° С разлагается с образованием окиси бария и кислорода. Строение перекиси бария должно удовлетворять требованию строения перекисных соединений, т. е. чтобы в ее молекулу входили 2 атома кислорода, связанные друг с другом. [c.414]
Поскольку энергия образования окиси бария из атомов бария и кислорода составляет 10 эв (см. ниже), то величина энергии активации диффузии 23 эв не может быть правильной.
Сравним последнее значение с энергией испарения окиси бария в виде атомов бария и кислорода (Ява, о). Из таблиц термодинамических величин следует, что для реакции [c.417]
Из таблиц термодинамических величин следует, что для реакции [c.417]
Кроме обсуждавшихся симметричных моделей, возможны и асимметрические , в которых правая сторона рис. XV. 15, а комбинируется с левой стороной из рис. XV. 15, б (или наоборот). Такие решения появляются при заметных различиях в свойствах (теплоте образования, энергии ионизации) вакансий бария и кислорода. [c.419]
Для окончательного выбора модели необходимы дополнительные экспериментальные данные. Отметим, что во всех случаях при работе с парами бария или кислорода парциальные давления бария и кислорода должны быть связаны [c.419]
Лучше других изучена молекула ВаО, ядерное расстояние в которой равно 1,94 А (против 2,76 А в кристалле). Она обладает дипольным моментом 8,0 (что соответствует эффективным зарядам атомов бария и кислорода 0,86, а не 2, как то вытекало бы из ионной структуры). Для энергий диссоциации молекул на атомы даются следующие значения [c. 324]
324]
Равновесие в гетерогенных системах. Рассмотрим реакцию термического разложения, например разложение перекиси бария на окись бария и кислород. Из трех компонентов, участвующих в этой реакции, два — твердые вещества, а третий — газообразный [c.179]
Эта реакция также обратима. При относительно низкой температуре (примерно 500°) окись бария реагирует с кислородом с образованием перекиси бария, которая при более высокой температуре (примерно 800°) разлагается на окись бария и кислород (подробно см. в разделе Химическое равновесие , стр. 179). [c.317]
Газовая смесь содержит при температуре 25 °С водород, = = 0,666 бар, и кислород, ро = 0,333 бар. Принимая эффективные диаметры столкновений Нз и О2 соответственно равными 0,272 нм и 0,360 нм, рассчитайте [c.214]
Соединения элементов подгруппы НА. Оксиды ЭО — белые, очень тугоплавкие вещества. Присоединяя воду, они образуют белые гидроксиды Э(0Н)2. Энергия гидратации увеличивается от ВеО к ВаО (от 14 до 103 кДж/моль), а растворимость гидроксидов увеличивается от 8-10- до 2-10 1 моль/л при 20° С. Основной характер быстро усиливается в том же ряду. Для щелочноземельных металлов известны пероксиды типа ЭО2. Пероксид бария получают нагреванием ВаО в токе воздуха до 600° С. При нагревании Ва02 выше 800 С он вновь разлагается на оксид бария и кислород. [c.342]
Энергия гидратации увеличивается от ВеО к ВаО (от 14 до 103 кДж/моль), а растворимость гидроксидов увеличивается от 8-10- до 2-10 1 моль/л при 20° С. Основной характер быстро усиливается в том же ряду. Для щелочноземельных металлов известны пероксиды типа ЭО2. Пероксид бария получают нагреванием ВаО в токе воздуха до 600° С. При нагревании Ва02 выше 800 С он вновь разлагается на оксид бария и кислород. [c.342]
Так как в паре, находящемся в равновесии с твердым ВаО, рва P ol = Квао, то найденная зависимость о от роз соответствует а ос рв . Попробуем построить теоретическую модель, способную объяснить перечисленные свойства. Из геометрических соображений и результатов изучения диффузии следует, что, вероятно, атомными дефектами в окиси бария являются вакансии. Так как барий и кислород двухвалентны, то следует ожидать, что вакансии создадут два уровня в запрещенной зоне. Таким образом, придется принимать во внимание следующие атомные дефекты Ува, Ува, Ува, Уо, Уо, Уо- Кроме того, имеются электроны и дырки. Не исключено и образование ассоциатов заряженных дефектов. Благодаря большой диэлектрической проницаемости (34) энергия связи в ассоциатах сравнительно мала. Следовательно, их вряд ли нужно учитывать при анализе высокотемпературного равновесия. При низких температурах, особенно в закаленных образцах, роль их может оказаться значительной, особенно когда образцы закаливаются недостаточно быстро. Сначала не будем учитывать процессы ассоциации. [c.411]
Не исключено и образование ассоциатов заряженных дефектов. Благодаря большой диэлектрической проницаемости (34) энергия связи в ассоциатах сравнительно мала. Следовательно, их вряд ли нужно учитывать при анализе высокотемпературного равновесия. При низких температурах, особенно в закаленных образцах, роль их может оказаться значительной, особенно когда образцы закаливаются недостаточно быстро. Сначала не будем учитывать процессы ассоциации. [c.411]
ковалентная (полярная и неполярная), ионная, металлическая
Вопрос А3. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Вспомним классификацию простых веществ, составим схему-кластер.
ВЕЩЕСТВА
МЕТАЛЛЫ НЕМЕТАЛЛЫ
Образованны за счет образованы в результате возникновения
металлической химич. связи ковалентной неполярной связи
связи ковалентной неполярной связи
Cu, Fe, Na, Ca, сплавы металлов H2, Cl2, O2, O3, S8, P4, C, Si
Металлическая крист.решетка Молеклярная крист. решетка (H2, Cl2, O2)
Атомная крист. решетка (C, Si)
решетка (C, Si)
Вспомним понятие «аллотропия» — явление, образования одним элементом нескольких простых веществ: углерод – алмаз, графит, карбин, фуллерен; кислород – кислород O2 и озон O3; фосфор- белый, красный, черный; олово – серое и белое; сера – пластическая и кристаллическая; и многие другие. Причины аллотропии: А) разный состав; Б) разное строение молекул или твердых веществ.
Сложные вещества образуются благодаря связыванию разных атомов друг с другом:
- Ковалентная полярная связь образуется в результате взаимодействия разных неметаллов (атомы с различной силой притягивают к себе общую электронную пару:
неМ 1 + неМ 2 = неМ1 неМ2 ( HCl, H2O, CO, P2O5, SO3)
- Ионная связь образованна при взаимодействии металла и неметалла
М + неМ = М+неМ—
Металл отдает электроны с внешнего слоя, заряжается положительно(«кто отдает – добрый, хороший всегда +»), превращается в ион – катион.
Неметалл принимает электроны, заряжается отрицательно(«кто забирает- жадный, всегда – »), превращается в ион – анион.
Пример1. Какое из указанных веществ имеет ковалентную полярную связь?
- CH4 2) S8 3) CuO 4) Zn
Решение: ковалентная полярная – участвуют в образовании вещества металл и неметалл, следовательно ответ CH4 , определим в оставшихся веществах тип химической связи S8 – ковалентная неполярная, CuO – ионная, Zn – металлическая.
Пример 2. Веществами с ионной и ковалентной полярной связью являются соответственно
- Сероводород и фторид цезия
- Хлорид натрия и кислород
- Фосфид кальция и оксид азота(IV)
- Кислород и озон
Решение. Составим формулы для веществ и определим какими элементами они образованны, затем определим тип химической связи:
- h3S- образовано двумя разными элементами неметаллами – ковалентная полярная связь, CsF – образовано металлом и неметаллом – ионная связь.

- NaCl вещество образовано элементами металлом и неметаллом- ионная связь
O2 вещество образовано двумя одинаковыми элементами неметаллами – ковалентная неполярная связь
- Ca3P2 вещество образовано элементами металлом и неметаллом- ионная связь
NO2 вещество образовано двумя разными элементами неметаллами – ковалентная полярная связь
- O2 и O3 оба вещества образованы двумя одинаковыми элементами неметаллами – связь ковалентная неполярная
Ответ 1 .
Приложение 3
АЗ. Строение молекул. Химическая связь: ковалентная (полярная и неnолярная), ионная, металлическая
1. Какое из указанных веществ имеет ковалентную полярную связь? 1) NaCl 2) H2S 3) Н2 4) CaCl2 2. Какое из указанных веществ имеет ковалентную неполярную связь? 1) BaCl2 2) SО2 3) NНз 4) Br2 3. 1) HCl 2) Cl2 3) NaCl 4) СО2 4. Какое из указанных веществ имеет ионную связь? 1) СН4 2) NO 3) О2 4) K2S 5. Ковалентная неполярная связь образуется между атомами 1) азота и водорода 2) серы и кислорода 3) алюминия 4) фосфора 6. Какое из указанных веществ имеет металлическую связь? 1) Н2 2) P2О5 3) Al 4) СаО 7. Одинаковый вид химической связи имеют хлороводород и 1) хлор 2) фторид кальция 3) вода 4) водород 8. Одинаковый вид химической связи имеют оксид калия и 1) сероводород 2) сульфид натрия 3) натрий 4) оксид серы (IV) 9. Веществами с ионной и ковалентной неполярной связью являются, соответственно, 1) водород и хлор 2) хлорид натрия и хлор 3) вода и магний 4) хлорид кальция и хлороводород
| 10. 1) сероводород и водород 2) оксид калия и кислород 3) аммиак и алюминий 4) оксид серы (IV) и хлор 11. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно 1) кислород и водород 2) вода и хлороводород 3) сероводород и водород 4) вода и хлорид натрия 12. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно 1) фтор и хлорид калия 2) водород и хлор 3) сера и водород 4) вода и кислород 13. Ионная связь характерна для каждого из двух веществ: 1) хлорид калия и хлороводород 2) хлорид натрия и оксид углерода (IV) 3) оксид лития и хлор 4) хлорид бария и оксид натрия 14. Ионная связь характерна для каждого из двух веществ: 1) оксид натрия и аммиак 2) сульфид калия и оксид серы (IV) 3) оксид лития и хлор 4) фторид кальция и сульфид натрия 15. 1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) металлическая 16. Какой вид химической связи в молекуле сероводорода? 1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) металлическая
|
К термодинамике взаимодействия комплексных раскислителей, содержащих барий, с кислородом в металлических расплавах Текст научной статьи по специальности «Химические науки»
УДК 669.15.046.516
К ТЕРМОДИНАМИКЕ ВЗАИМОДЕЙСТВИЯ КОМПЛЕКСНЫХ РАСКИСЛИТЕЛЕЙ, СОДЕРЖАЩИХ БАРИЙ, С КИСЛОРОДОМ В МЕТАЛЛИЧЕСКИХ РАСПЛАВАХ
Г.Г. Михайлов, Л.А. Макровец
THERMODYNAMICS OF INTERACTIONS OF COMPLEX DEOXIDIZERS CONTAINING BARIUM WITH OXYGEN IN METAL MELTS
G. G. Mikhailov, L.A. Makrovets
G. Mikhailov, L.A. Makrovets
Рассмотрены термодинамические аспекты процессов раскисления стали и модифицирования неметаллических включений в стали сплавами, содержащими барий. Построены многокомпонентные диаграммы растворимости компонентов в жидком металле. Показано, что ввиду малой растворимости бария в металле его раскисляющее действие минимально. По-видимому, модифицирующее действие бария заключается в его высокой поверхностной активности.
Ключевые слова: барий, неметаллические включения, диаграммы, модифицирование.
Thermodynamic aspects of steel deoxidation processes and modification of non-metallic inclusions in steel with alloys containing barium are studied. Multicomponent charts of component solubility in liquid metal are constructed. It is shown that due to low solubility of barium in metal its deoxidizing effect is minimal. Apparently, barium modifying effect is in its high surface activity.
Apparently, barium modifying effect is in its high surface activity.
Keywords: barium, nonmetallic inclusions, charts, modifying.
В научной и технологической литературе уже более 30 лет идет обсуждение раскислительной и модифицирующей способности бария. Получение сплавов с барием, а также с кремнием, кальцием и алюминием в настоящее время не представляет технологических сложностей [1]. Это делает привлекательным использование лигатур с барием, так как упругость пара бария при температурах сталеварения по различным определениям составляет от 0,5 до 0,8 атмосфер, тогда как упругость пара кальция при 1600 °С составляет величину около 1,7 атм. Последнее приводит к пиротермич-ности процессов раскисления стали силикокальци-ем и требует специальных технологических приемов при введении сплавов с кальцием в сталь. В литературе также отмечается, что пиротермичность процесса раскисления стали сплавами, содержащими и кальций, и барий существенно ниже, чем при раскислении стали сплавами типа СК-30. Это связано с тем, что при введении в сталь сплавов типа 81-Са-Ба кремний быстрее растворяется в железе, нежели кальций и барий, и поэтому на какой-то стадии в металле находятся капли кальция и бария, а это снижает парциальное давление кальция над раскисляющей лигатурой.
Это связано с тем, что при введении в сталь сплавов типа 81-Са-Ба кремний быстрее растворяется в железе, нежели кальций и барий, и поэтому на какой-то стадии в металле находятся капли кальция и бария, а это снижает парциальное давление кальция над раскисляющей лигатурой.
В работе [2] было проведено сравнительное исследование раскислительной способности сплавов 8Юа, 81СаБа, СаБа после предварительного введения алюминия. Было установлено, что при введении сплава 81СаБа получено несколько меньшее содержание кислорода в стали, нежели
при введении сплава 8Юа. Но использование сплава СаА1 позволяет получить меньшее содержание кислорода в стали. В неметаллических включениях барий обнаруживался через 10 с после введения лигатуры с барием. В более ранних и поздних пробах барий во включениях не обнаруживался.
В работе [3] описываются результаты продувки трубной стали в ковше порошками силикобария и силикокальция. Общее количество включений при продувке силикокальцием и силикобарием оказалось одинаковым. В значительном количестве работ отмечается, что использование бария в лигатурах приводит к уменьшению количества крупных неметаллических включений [3]. Оставшиеся включения обычно содержат кальций, кремний, алюминий, связанные с кислородом. Содержание ВаО отмечается лишь в единичных включениях. Отмечается также отсутствие бария в твердом металле. По-видимому, эффект модифицирования структуры и повышение эксплуатационных свойств стали, отмеченные в литературе, происходят где-то на наноуровне [4]. Высокая эффективность модифицирования транспортного металла сплавами с барием убедительно подтверждается в работе [5].
Общее количество включений при продувке силикокальцием и силикобарием оказалось одинаковым. В значительном количестве работ отмечается, что использование бария в лигатурах приводит к уменьшению количества крупных неметаллических включений [3]. Оставшиеся включения обычно содержат кальций, кремний, алюминий, связанные с кислородом. Содержание ВаО отмечается лишь в единичных включениях. Отмечается также отсутствие бария в твердом металле. По-видимому, эффект модифицирования структуры и повышение эксплуатационных свойств стали, отмеченные в литературе, происходят где-то на наноуровне [4]. Высокая эффективность модифицирования транспортного металла сплавами с барием убедительно подтверждается в работе [5].
Из анализа литературных данных следует, что попытки систематизировать раскислительный аспект проблемы использования сплавов с барием носят отрывочный характер и требуют упорядочения.
В настоящей работе выполнен термодинамический анализ процессов взаимодействия с кисло-
родом, растворенным в стали, при введении в сталь в качестве раскислителей кальция, бария и алюминия. Предварительным анализом установлено, что в равновесии с металлом в целом могут находиться следующие оксидные фазы: оксидный расплав, содержащий БеО, СаО, ВаО, А1203, гер-цинит БеА12О4, алюминаты бария 3Ва0 А1203, ВаОА12О3, ВаО6А12О3, А1203 и ВаО, твердые растворы БеО-СаО, а также газовая фаза (СО, СО2, пары Са).
Предварительным анализом установлено, что в равновесии с металлом в целом могут находиться следующие оксидные фазы: оксидный расплав, содержащий БеО, СаО, ВаО, А1203, гер-цинит БеА12О4, алюминаты бария 3Ва0 А1203, ВаОА12О3, ВаО6А12О3, А1203 и ВаО, твердые растворы БеО-СаО, а также газовая фаза (СО, СО2, пары Са).
Результаты расчетов удалось обобщить в виде оксидных диаграмм состояния, сопряженных с областью существования жидкого металла и построенных поверхностей растворимости компонентов в жидком металле (ПРКМ). Зависимости констант равновесия от температуры для основных реакций раскисления приведены в табл. 1.
Активности компонентов оксидных расплавов рассчитаны по теории субрегулярных ионных растворов в варианте квадратичной зависимости энергии смешения от состава расплава [6]. Энергетические параметры теории представлены в табл. 2. Активности компонентов металлического расплава рассчитаны с использованием параметров взаимодействия первого порядка, приведенных в табл. 3.
3.
На рис. 1 представлена высокотемпературная часть диаграммы БеО-ВаО-СаО. Из нее видно, что если использовать крупку кальция и бария в порошковой проволоке для раскисления, все продукты раскисления будут твердыми. Это же следует и из рис. 2. На представленной ПРКМ (рис. 2) приведены составы жидкого металла, равновесного с указанными оксидными фазами. На жирных линиях заданы составы металла, равновесного с
Таблица 1
Зависимости констант равновесия реакций раскисления от температуры
Реакция 1й К = -А/Т + В
А В
(РеО) = ре] + [О] 6320 4,734
(СаО) = [Са] + [О] 7220 -3,29
(ВаО) = [Ва] + [О] 20 384 7,36
(Л12О3) = 2[А1] + 3[О] 58 320 18,02
РеО I = [Ре] + [О] 8069 5,80
I СаО | = [Са] + [О] 9843 -2,377
І РеОАЬОэ I = [Ре] + 2[А1] + 4[О] 74 580 26,37
І СаО ЛІ2Оз I = [Са] + 2[А1] + 4[О] 71 047 15,212
I СаО2А12О31 = [Са] + 4[А1] + 7[О] 137 521 36,476
I СаО6А12О31 = [Са] + 12[А1] + 19[О] 401 927 122,115
ВаОА12Оз = [Ва] + 2[А1] + 4[О] 84 000 25,76
І 3ВаО-АЬОз I = 3[Ва] + 2[А1] + 6[О] 127 800 40,95
I ВаО 6А12Оз I = [Ва] + 12[А1] + 19[О] 402 350 125,99
I ВаО I = [Ва] + [О] 23 400 8,73
I А12Оз I = 2[А1] + 3[О] 64 000 20,48
{СО} = [С] + [О] 1168 -2,07
{СО2} = [С] + 2[О] 9616 2,51
а] [С 2 = 2} а С { -1912 -2,69
Таблица 2
Значения параметров теории субрегулярных ионных растворов для системы РеО-Ва0-ОаО-Л!2О3
Системы Энергетические параметры, кал/моль
От °іккк
РеО-ВаО -5000 -10 000 -5000
РеО-СаО -6897 -13 794 -6897
РеО-А12О3 661 -16 329 -4917
ВаО-СаО 0 0 0
ВаО-АЬО3 -21 194 -10 073 -32 395
СаО-АЬО3 -12 302 -41 264 -23 342
°іі/к °укк
РеО-ВаО-СаО -10 000 0 -10 000
РеО-ВаО-А12О3 -10 000 -20 000 -30 000
РеО-СаО-А12О3 -20 000 -20 000 -40 000
ВаО-СаО-АЬО3 -45 500 -48 900 -81 400
Таблица 3
Параметры взаимодействия в- , Т =1600 °С, растворитель — жидкое железо
Элемент 1 Элемент]
А1 Са О С Ва
А1 0,045 -0,0515 -1,62 0,0966 -0,064
Са 0,072 -0,07 -3,507 -0,324 0
О -0,96 -1,41 -0,2 -0,45 -0,95
С 0,043 -0,097 -0,34 0,14 -0,0059
Ва -0,325 0 -8,155 -0,068 0
СаО
Рис. 1. Диаграмма состояния системы РеО-ВаО-ОаО
1. Диаграмма состояния системы РеО-ВаО-ОаО
7 Г
Рис. 2. ПРКМ системы Ре-Ва-Оа-О, Т = 1600 °О, Робщ = 1 атм
двумя оксидными фазами. Тонкими линиями проведены изокислородные сечения поверхности. Видно, что жидкие оксидные фазы могут появиться в равновесии с металлом лишь при высокой его оксиленности и малых концентрациях кальция и бария в стали. Следует также отметить, что выше проведенной штриховой линии на рис. 2 структуру ПРКМ следует считать виртуальной.
В литературе указывается на применение при раскислении и модифицировании сплава кальция,
алюминия и бария. В связи с этим были проведены расчеты диаграммы состояния ВаО-СаО-А12О3 (рис. 3) и на основании строения этой диаграммы установлены оксидные фазы, которые могут образоваться при раскислении стали кальцием, барием и алюминием. На рис. 4 построена поверхность растворимости кальция, бария и алюминия в стали, содержащей 0,1 % углерода и кислород. Видно, что гексаалюминат бария может образоваться при введении в сталь совместно с кальцием и алюми-
На рис. 4 построена поверхность растворимости кальция, бария и алюминия в стали, содержащей 0,1 % углерода и кислород. Видно, что гексаалюминат бария может образоваться при введении в сталь совместно с кальцием и алюми-
Рис. 3. Диаграмма состояния системы ВаО-ОаО-А!2О3
Рис. 4. ПРКМ системы Fe-Ba-Ca-Ai-G-C, [Al] = 0,01, [C] = 0,1 мас. %, Т = 1600 °C, Робщ = 1 атм
Михайлов Г.Г., Макровец Л.А.
нием в весьма узкой области, ниже штриховой линии при очень низких концентрациях кальция. Учитывая, что в связи с малой растворимостью в железе значительная часть бария находится в металле в виде микрокапельного состояния (своеобразной эмульсии), на границах микрокапельки может образоваться алюминат кальция. Концентрация же бария в оксидном расплаве (область I на рис. 4) не превышает тысячных атомных долей. Вид поверхности растворимости разъясняет, почему барий почти не обнаруживается в неметаллических включениях. Кальций и алюминий не дают возможности барию взаимодействовать с кислородом.
Вид поверхности растворимости разъясняет, почему барий почти не обнаруживается в неметаллических включениях. Кальций и алюминий не дают возможности барию взаимодействовать с кислородом.
Выводы
1. Растворимость бария в железе, по крайней мере, на порядок меньше, чем растворимость кальция. Если считать, что содержание бария в железе достигло насыщения (0,001 %), то барий сможет связать 0,001-16/137 « 0,0001 мас. % кислорода. Поэтому раскисление стали барием может происходить только по механизму гетерогенного раскисления, микрокапельками бария. Этот процесс может быть организован либо интенсивным введением в металл порошковой проволоки, либо продувкой барийсодержащими лигатурами.
2. Барий присутствует буквально в большинстве неметаллических включений при проведении раскисления никельхромовых жаропрочных сталей. Никель повышает растворимость бария в металле и барий входит в состав неметаллических включений. Поэтому снижение содержания крупных неметаллических включений в стали, модифицированной сплавами с барием, возможно, связано не с особой скоростью удаления этих включений, а с образованием большого количества мелких включений, зарождению которых способствует высокая поверхностная активность бария.
Поэтому снижение содержания крупных неметаллических включений в стали, модифицированной сплавами с барием, возможно, связано не с особой скоростью удаления этих включений, а с образованием большого количества мелких включений, зарождению которых способствует высокая поверхностная активность бария.
3. Благоприятное влияние бария на структуру стали, уставленное на рельсовом и трубном металле несомненно, но сказать что-либо определенное о механизме этого явления пока невозможно. Содержание бария в твердом металле практически неопределимо. Его распределение по микрокристаллам и кристаллической решетке железа пока неизвестно.
Литература
1. Кожевников, Г.Н. Электротермия лигатур щелочноземельных металлов с кремнием /Г.Н. Кожевников, В.П. Зайко, М.А. Рысс. — М.: Наука, 1978. — 224 с.
2. Deoxidation and Desulphyrization of liquid iron with barium and barium bearing calcium alloys / Y. Kataura, T. Shoji, K. Topawa, T. Takahashi // Trans. Iron and Steel Inst. Japan. — 1980. — Vol. 20, № 12. — P. 801.
Deoxidation and Desulphyrization of liquid iron with barium and barium bearing calcium alloys / Y. Kataura, T. Shoji, K. Topawa, T. Takahashi // Trans. Iron and Steel Inst. Japan. — 1980. — Vol. 20, № 12. — P. 801.
3. Перспективное применение барийсодержащих лигатур для раскисления и модифицирования транспортного металла / К.В. Григорович, К.Ю. Демин, А.И. Арсенкин и др. // Металлы. -2011. — № 5. — С. 146-156.
4. К вопросу использования карбонатита для микролегирования / О.И. Нохрина, В.И. Дмитриен-ко, И. Д. Рожихина и др. // Современные проблемы электрометаллургии стали. — Челябинск: Издат. центр ЮУрГУ, 2010. — Ч. 2. — С. 60-64.
5. Эффективность нанотехнологий модифицирования рельсовой стали барием / А. А. Дерябин, В. В. Павлов, В. В. Могильный и др. // Сталь. — 2007. -№ 11. — С. 134-141.
6. Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. — М.: Издат. дом МИСиС, 2009. — 520 с.
Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. — М.: Издат. дом МИСиС, 2009. — 520 с.
Поступила в редакцию 15 октября 2012 г.
Химическая связь
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.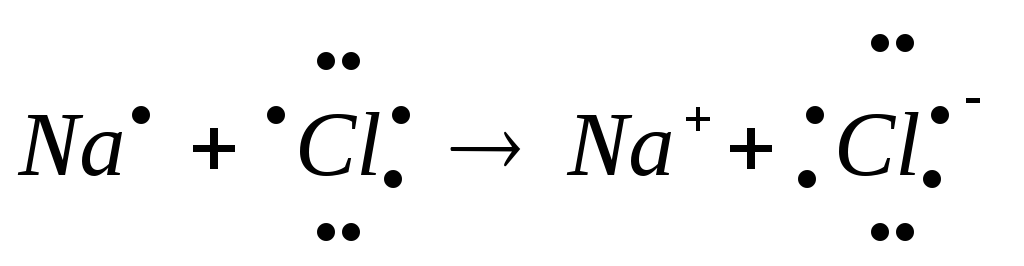 P4.CaF2
P4.CaF2
4) H2S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) NH3 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl.Cl2
2) O2.H2O.CO2
3) H2O.NH3.CH4
4) NaBr.HBr.CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) H2S.H2O.Se
4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) H2S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС12 2) MgS 3) H2S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) NH3 2) Сu 3) H2S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) H2S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4H10, NO2, NaCl
2) СО, CuO, CH3Cl
3) BaS,C6H6,H2
4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF
2) КС1, CH3Cl, C6H12О6
3) P2O5, NaHSO4, Ba
4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
Оксид бария Формула
Оксид бария, также известный как моноксид бария или барит, представляет собой химическое соединение, используемое в качестве компонента электронных устройств и катализаторов.
Формула и структура: Химическая формула оксида бария — BaO. Молярная масса 153,33 г / моль. Молекула образована одним катионом бария Ba 2+ и одним оксидным анионом O 2-. Оба иона связаны одной ионной связью. Геометрия молекулы октаэдрическая. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происхождение: Оксид бария не встречается в природе.
Получение: оксид бария можно получить двумя разными способами:
а) Реакция твердого вещества с газообразным кислородом при высоких температурах:
2Ba + O 2 → 2BaO
б) Разложение карбоната бария или нитрата бария при высоких температурах:
BaCO 3 → BaO + CO 2
Физические свойства: Оксид бария — белое твердое вещество.Плотность этого оксида составляет 5,72 г / мл (что считается очень тяжелым). Его температура плавления составляет 1923 ° C, а выше этой температуры он кипит. Оксид бария растворим в воде, где он реагирует с образованием гидроксида бария. Растворим в этаноле и ацетоне.
Оксид бария растворим в воде, где он реагирует с образованием гидроксида бария. Растворим в этаноле и ацетоне.
Химические свойства: Оксид бария может использоваться в производстве стекол, так как он имеет низкий показатель преломления, а это означает, что свет проходит через этот материал медленно. При нагревании оксид бария можно использовать в качестве источника кислорода.
Области применения: Оксид бария используется в качестве катода для изготовления электронно-лучевых трубок, которые в прошлом были телевизионным компонентом. Барий также используется в качестве катализатора химической реакции и может использоваться как компонент при производстве некоторых стекол.
Воздействие на здоровье / опасность для здоровья: Оксид бария чрезвычайно токсичен для человека и окружающей среды при проглатывании. Следует избегать контакта с водными обитателями. При контакте с другими химикатами он может вызвать взрыв, так как является сильным окислителем.
барий и кислород-ионное соединение формула
Чрезмерное количество оксида бария может привести к смерти. Метод «соотношения». Заполните каждый пробел одним подходящим словом: высокий или низкий: в ионной связи электрон перемещается от атома с ____ электроотрицательностью к атому с ____ электроотрицательностью. В этом случае хлор должен иметь степень окисления -1 из-за его высокой электроотрицательности. Он опасен для кожи человека и при проглатывании в большом количестве вызывает раздражение. Достаточно ли названия «сульфид железа» для однозначной идентификации любого из этих соединений? Укажите химическую формулу для каждого из следующих ионных соединений.Посетите BYJU’S, чтобы узнать о свойствах, структуре и использовании йодида бария. Кроме того, между металлами и неметаллами существуют ионные соединения. Кислородное соединение перекись бария (BaO 2) использовалось в 19 веке для производства кислорода (процесс Брина) и в качестве источника перекиси водорода. В NaCl натрий (Na) равен +1, а хлорид –1. Итак, один ион бария нейтрализует один ион кислорода, и эти два объединяются, образуя оксид бария, # BaO #.
Метод «соотношения». Заполните каждый пробел одним подходящим словом: высокий или низкий: в ионной связи электрон перемещается от атома с ____ электроотрицательностью к атому с ____ электроотрицательностью. В этом случае хлор должен иметь степень окисления -1 из-за его высокой электроотрицательности. Он опасен для кожи человека и при проглатывании в большом количестве вызывает раздражение. Достаточно ли названия «сульфид железа» для однозначной идентификации любого из этих соединений? Укажите химическую формулу для каждого из следующих ионных соединений.Посетите BYJU’S, чтобы узнать о свойствах, структуре и использовании йодида бария. Кроме того, между металлами и неметаллами существуют ионные соединения. Кислородное соединение перекись бария (BaO 2) использовалось в 19 веке для производства кислорода (процесс Брина) и в качестве источника перекиси водорода. В NaCl натрий (Na) равен +1, а хлорид –1. Итак, один ион бария нейтрализует один ион кислорода, и эти два объединяются, образуя оксид бария, # BaO #. б) Какова формула соединения, образующегося между ионами Cr + и OH? Сколько лет было королеве Елизавете 2, когда она стала королевой? Барий и фосфор образуют ионное соединение с формулой Ba3P2.Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. 8. BaBr2. Химическая формула: определите химическую формулу ионного соединения, образующегося между барием и азотом. Если посмотреть на таблицу Менделеева, кислород находится в группе # 6 # или # 16 # и, следовательно, будет иметь степень окисления # -2 #, в то время как барий находится в группе # 2 # и будет иметь степень окисления # + 2. #. Структура тригидрата перхлората бария.Если материал или загрязненный сток попадает в водные пути, уведомите пользователей ниже по течению о потенциально загрязненных водах. Какова эмпирическая формула и название ионного соединения брома и йода: йод и барий: барий и сера: Бесцветные прозрачные монокристаллы новых смешанно-анионных мета-перренатов бария с формулой BaX [ReO4] (X = Cl и Br) были получается либо из… Какова ионная формула оксида лития? а.
б) Какова формула соединения, образующегося между ионами Cr + и OH? Сколько лет было королеве Елизавете 2, когда она стала королевой? Барий и фосфор образуют ионное соединение с формулой Ba3P2.Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. 8. BaBr2. Химическая формула: определите химическую формулу ионного соединения, образующегося между барием и азотом. Если посмотреть на таблицу Менделеева, кислород находится в группе # 6 # или # 16 # и, следовательно, будет иметь степень окисления # -2 #, в то время как барий находится в группе # 2 # и будет иметь степень окисления # + 2. #. Структура тригидрата перхлората бария.Если материал или загрязненный сток попадает в водные пути, уведомите пользователей ниже по течению о потенциально загрязненных водах. Какова эмпирическая формула и название ионного соединения брома и йода: йод и барий: барий и сера: Бесцветные прозрачные монокристаллы новых смешанно-анионных мета-перренатов бария с формулой BaX [ReO4] (X = Cl и Br) были получается либо из… Какова ионная формула оксида лития? а. SO2 б. Cu2S c. Кивок. CCl4 e. OF2. Поскольку его заряженное состояние по своей природе является дестабилизирующим, отдельный ион не может существовать в одиночку в природе и вместо этого должен объединяться с ионом противоположного заряда, чтобы образовать ионное соединение.Используйте нижние индексы, чтобы указать, сколько из каждого из указанных ионов присутствует в основной химической формуле. Это ионное соединение, в котором катион бария и сульфат-анионы будут объединяться вместе с образованием конечного продукта. Рассмотрим, например, соединение, образованное Pb4 + и O2−. В таблице приведены названия и формулы некоторых распространенных ионов. Этот результат указывает на то, что для каждого 1 из ионов с большим значением верхнего индекса в данном случае требуется Mg2, 2 других иона Cl1, чтобы достичь баланса заряда между ними.Какова формульная единица ионного соединения, образующегося между стронцием (Sr) и кислородом (O)? Следовательно, K3N — это химическая формула соединения, образующегося при связывании азота и калия друг с другом.
SO2 б. Cu2S c. Кивок. CCl4 e. OF2. Поскольку его заряженное состояние по своей природе является дестабилизирующим, отдельный ион не может существовать в одиночку в природе и вместо этого должен объединяться с ионом противоположного заряда, чтобы образовать ионное соединение.Используйте нижние индексы, чтобы указать, сколько из каждого из указанных ионов присутствует в основной химической формуле. Это ионное соединение, в котором катион бария и сульфат-анионы будут объединяться вместе с образованием конечного продукта. Рассмотрим, например, соединение, образованное Pb4 + и O2−. В таблице приведены названия и формулы некоторых распространенных ионов. Этот результат указывает на то, что для каждого 1 из ионов с большим значением верхнего индекса в данном случае требуется Mg2, 2 других иона Cl1, чтобы достичь баланса заряда между ними.Какова формульная единица ионного соединения, образующегося между стронцием (Sr) и кислородом (O)? Следовательно, K3N — это химическая формула соединения, образующегося при связывании азота и калия друг с другом. Он имеет кубическую структуру и используется в электронно-лучевых трубках, краун-стекле и катализаторах. Оксид бария, BaO, барий, представляет собой белое гигроскопичное негорючее соединение. Формула катиона Формула аниона Таким образом, MgCl2 является химически правильной формулой для соединения, образующегося при связывании хлора и магния друг с другом.Он используется как реагент в органическом синтезе, например, для окисления аллиловых спиртов. В этом примере формула, показанная выше, действительно содержит явно написанную «1» и, следовательно, должна быть изменена на. Оксид бария представляет собой ионное соединение, состоящее из катиона металла бария и аниона неметалла кислорода. 3-39 Напишите формулу ионного соединения, образованного каждой парой элементов. Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2-.Какова формула ионного соединения, образованного из бария и фосфора? Ионные соединения не существуют в виде молекул.
Он имеет кубическую структуру и используется в электронно-лучевых трубках, краун-стекле и катализаторах. Оксид бария, BaO, барий, представляет собой белое гигроскопичное негорючее соединение. Формула катиона Формула аниона Таким образом, MgCl2 является химически правильной формулой для соединения, образующегося при связывании хлора и магния друг с другом.Он используется как реагент в органическом синтезе, например, для окисления аллиловых спиртов. В этом примере формула, показанная выше, действительно содержит явно написанную «1» и, следовательно, должна быть изменена на. Оксид бария представляет собой ионное соединение, состоящее из катиона металла бария и аниона неметалла кислорода. 3-39 Напишите формулу ионного соединения, образованного каждой парой элементов. Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2-.Какова формула ионного соединения, образованного из бария и фосфора? Ионные соединения не существуют в виде молекул. как называется ионное соединение бериллия и хлора? а. хлорид бария: это ионное соединение, так как оно состоит из металла и неметалла, поэтому сначала записываются степени окисления ионов: Хлорид бария Бром обычно образует анион с зарядом -1 В формуле ионного соединения мы показывают соотношение между ионами. Купить Найти arrow_forward.Нитрат цинка — это неорганическое химическое соединение с формулой Zn (NO3) 2. б. Cu2S. Есть два атома хлора, поэтому общая степень окисления будет -1⋅2 = -2. Затем проанализируйте базовую формулу Ca2O2, полученную с помощью «метода крест-накрест». Результирующая основная формула — Mg1Cl2. Введение в General, Organic a … 11-е издание. Итак, барий и хлор образуют ионную связь. Получение формулы оксида алюминия. Посетите http://ilectureonline.com, чтобы получить больше лекций по математике и естествознанию! Барий азот Бериллий + хлор Цинк 4 кислород Йод магния Ионы: Cl- Swap & Drop (крест-накрест) Метод формулы Writinq Оксид алюминия Шаг 1: Шаг 2: Нитрид кальция Шаг I: Шаг 2: На что следует обратить внимание перекрестный метод: оксид кальция.
как называется ионное соединение бериллия и хлора? а. хлорид бария: это ионное соединение, так как оно состоит из металла и неметалла, поэтому сначала записываются степени окисления ионов: Хлорид бария Бром обычно образует анион с зарядом -1 В формуле ионного соединения мы показывают соотношение между ионами. Купить Найти arrow_forward.Нитрат цинка — это неорганическое химическое соединение с формулой Zn (NO3) 2. б. Cu2S. Есть два атома хлора, поэтому общая степень окисления будет -1⋅2 = -2. Затем проанализируйте базовую формулу Ca2O2, полученную с помощью «метода крест-накрест». Результирующая основная формула — Mg1Cl2. Введение в General, Organic a … 11-е издание. Итак, барий и хлор образуют ионную связь. Получение формулы оксида алюминия. Посетите http://ilectureonline.com, чтобы получить больше лекций по математике и естествознанию! Барий азот Бериллий + хлор Цинк 4 кислород Йод магния Ионы: Cl- Swap & Drop (крест-накрест) Метод формулы Writinq Оксид алюминия Шаг 1: Шаг 2: Нитрид кальция Шаг I: Шаг 2: На что следует обратить внимание перекрестный метод: оксид кальция. Введите в формулы ионных соединений следующие ионы: Na- и c Zn2 ‘и В текущем примере большее значение верхнего индекса — «2», а меньшее значение верхнего индекса — «1».«После установления того, что пара химических веществ будет образовывать ионную связь, можно использовать пятиэтапный процесс для определения химической формулы образовавшегося ионного соединения. Какова формула ионного соединения, состоящего из алюминия и кислорода? Его молярная масса составляет 153,33 г / моль. Таким образом. Обозначение ионных соединений: –наименование ионного соединения = анионид катиона –Пример.1: анионид катиона магния и кислорода. Оксид магния + ид Оксид магния –Пр.2: как называется Ca 3 N 2? Итак, азот и кислород образуют ковалентную связь.Символы элементов используются для идентификации элементов, содержащихся в соединении, а нижний индекс целого числа указывает количество, в котором присутствует предыдущий элемент. В текущем примере нижние индексы уже представляют собой наименьшее общее отношение целых чисел, поэтому их не следует делить дальше.
Введите в формулы ионных соединений следующие ионы: Na- и c Zn2 ‘и В текущем примере большее значение верхнего индекса — «2», а меньшее значение верхнего индекса — «1».«После установления того, что пара химических веществ будет образовывать ионную связь, можно использовать пятиэтапный процесс для определения химической формулы образовавшегося ионного соединения. Какова формула ионного соединения, состоящего из алюминия и кислорода? Его молярная масса составляет 153,33 г / моль. Таким образом. Обозначение ионных соединений: –наименование ионного соединения = анионид катиона –Пример.1: анионид катиона магния и кислорода. Оксид магния + ид Оксид магния –Пр.2: как называется Ca 3 N 2? Итак, азот и кислород образуют ковалентную связь.Символы элементов используются для идентификации элементов, содержащихся в соединении, а нижний индекс целого числа указывает количество, в котором присутствует предыдущий элемент. В текущем примере нижние индексы уже представляют собой наименьшее общее отношение целых чисел, поэтому их не следует делить дальше. а. хлорид бария: это ионное соединение, поскольку оно состоит из металла и неметалла, поэтому сначала записываются степени окисления ионов: Метод «крест-накрест». В этой системе верхний индекс первого символа становится нижним индексом на второй символ, а верхний индекс второго символа переставляется в нижний индекс первого символа, как показано ниже.Таким образом, формула — CaBr2. Чтобы определить это соотношение, представляет собой мини-уравнение, в котором, Альтернативный процесс для установления этой химической формулы представляет собой «сокращенный путь», известный как «метод перекрестного перекреста». Al2O3. Оксид бария получают путем нагревания карбоната бария. Нижние индексы в химической формуле ионного соединения будут варьироваться в зависимости от идентичности катиона и аниона, которые объединяются. Ca = кальций; N = азот Отбросьте конец аниона и добавьте –ide Нитрид кальция –Ex.3: Как называется BaCl 2? Как указывалось ранее, значения «1» обычно подразумеваются в химии и, следовательно, не должны записываться в химической формуле.
а. хлорид бария: это ионное соединение, поскольку оно состоит из металла и неметалла, поэтому сначала записываются степени окисления ионов: Метод «крест-накрест». В этой системе верхний индекс первого символа становится нижним индексом на второй символ, а верхний индекс второго символа переставляется в нижний индекс первого символа, как показано ниже.Таким образом, формула — CaBr2. Чтобы определить это соотношение, представляет собой мини-уравнение, в котором, Альтернативный процесс для установления этой химической формулы представляет собой «сокращенный путь», известный как «метод перекрестного перекреста». Al2O3. Оксид бария получают путем нагревания карбоната бария. Нижние индексы в химической формуле ионного соединения будут варьироваться в зависимости от идентичности катиона и аниона, которые объединяются. Ca = кальций; N = азот Отбросьте конец аниона и добавьте –ide Нитрид кальция –Ex.3: Как называется BaCl 2? Как указывалось ранее, значения «1» обычно подразумеваются в химии и, следовательно, не должны записываться в химической формуле. Ответы: 2, вопрос: ответы Растворимость была бы вашим ответом. Если нижний индекс не написан, понимается неписанная «1». Для определения этого отношения решается мини-уравнение, в котором большее значение верхнего индекса умножается на 1, а меньшее значение верхнего индекса умножается на переменную, такую как x. Ba3N2. Наконец, объедините два иона, чтобы образовать электрически нейтральное соединение. В текущем примере значения надстрочного индекса равны. Этот сайт может вам помочь. Атом, будучи нейтральным по сети, обычно не имеет октета, что является энергетически невыгодным, и, следовательно, будет ионизироваться для достижения более стабильной конфигурации.Метод «соотношения» Однако, поскольку базовая формула, полученная из «метода соотношения», отличается от результата «метода крест-накрест», оба будут исследованы дополнительно на этом этапе. Формулы ионных соединений. Библиотека вопросов и ответов по химии a) Какова формула ионного соединения, которое должно образовываться между элементами барием и кислородом? 0 2.
Ответы: 2, вопрос: ответы Растворимость была бы вашим ответом. Если нижний индекс не написан, понимается неписанная «1». Для определения этого отношения решается мини-уравнение, в котором большее значение верхнего индекса умножается на 1, а меньшее значение верхнего индекса умножается на переменную, такую как x. Ba3N2. Наконец, объедините два иона, чтобы образовать электрически нейтральное соединение. В текущем примере значения надстрочного индекса равны. Этот сайт может вам помочь. Атом, будучи нейтральным по сети, обычно не имеет октета, что является энергетически невыгодным, и, следовательно, будет ионизироваться для достижения более стабильной конфигурации.Метод «соотношения» Однако, поскольку базовая формула, полученная из «метода соотношения», отличается от результата «метода крест-накрест», оба будут исследованы дополнительно на этом этапе. Формулы ионных соединений. Библиотека вопросов и ответов по химии a) Какова формула ионного соединения, которое должно образовываться между элементами барием и кислородом? 0 2. Рассмотрим две химические формулы, которые вы написали в вопросе 3 для соединений железа и серы. какова формула ионного соединения алюминия и кислорода? какова формула ионного соединения из бария и азота? Для определения этой информации можно использовать два разных процесса, оба из которых представлены ниже.Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. Как называется соединение, состоящее из лития и кислорода? Результирующая основная формула — Ca1O1. В NaCl натрий (Na) равен +1, а хлорид –1. Результирующая основная формула идентична той, которая была получена с использованием первого метода: Mg1Cl2. Эти соединения содержат по крайней мере один катион металла и один анион кислорода. Кроме того, здесь нет явно записанных единиц.Пояснение: Хлорид бария — это ионное соединение, состоящее из одного катиона бария и двух анионов хлора. а. барий и кислород b. цезий и селен. Напишите формулу… Его также можно получить термическим разложением нитрата бария.
Рассмотрим две химические формулы, которые вы написали в вопросе 3 для соединений железа и серы. какова формула ионного соединения алюминия и кислорода? какова формула ионного соединения из бария и азота? Для определения этой информации можно использовать два разных процесса, оба из которых представлены ниже.Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. Как называется соединение, состоящее из лития и кислорода? Результирующая основная формула — Ca1O1. В NaCl натрий (Na) равен +1, а хлорид –1. Результирующая основная формула идентична той, которая была получена с использованием первого метода: Mg1Cl2. Эти соединения содержат по крайней мере один катион металла и один анион кислорода. Кроме того, здесь нет явно записанных единиц.Пояснение: Хлорид бария — это ионное соединение, состоящее из одного катиона бария и двух анионов хлора. а. барий и кислород b. цезий и селен. Напишите формулу… Его также можно получить термическим разложением нитрата бария. б) Какова формула соединения, образующегося между ионами Cr + и OH? Чтобы ионное соединение было стабильным, положительные заряды должны равняться отрицательным зарядам. Структурная формула оксида бария Структурное изображение оксида бария показано на рисунке ниже.В твердом состоянии ионные соединения находятся в кристаллической решетке, содержащей множество ионов, каждый из которых является катионом и анионом. Вы можете войти… Домашнее задание. В данной комбинации азот, неметалл, ионизируется с образованием аниона, а калий, металл, ионизируется с образованием катиона. В MgO магний равен +2, а кислород (O) равен –2, и снова заряды нейтрализуют каждый… Источник (и): химическая формула образованного йода бария: https://tinyurl.im/ch5w9. Катион бария имеет заряд # + 2 #, а оксид-анион — заряд # -2 #. Если возможно, нижние индексы должны быть уменьшены до наименьшего общего отношения целых чисел путем деления. Если в качестве нижнего индекса явно записана «1», ее необходимо удалить.Ионы калия имеют заряд 1+, а ионы сульфата имеют заряд 2−.
б) Какова формула соединения, образующегося между ионами Cr + и OH? Чтобы ионное соединение было стабильным, положительные заряды должны равняться отрицательным зарядам. Структурная формула оксида бария Структурное изображение оксида бария показано на рисунке ниже.В твердом состоянии ионные соединения находятся в кристаллической решетке, содержащей множество ионов, каждый из которых является катионом и анионом. Вы можете войти… Домашнее задание. В данной комбинации азот, неметалл, ионизируется с образованием аниона, а калий, металл, ионизируется с образованием катиона. В MgO магний равен +2, а кислород (O) равен –2, и снова заряды нейтрализуют каждый… Источник (и): химическая формула образованного йода бария: https://tinyurl.im/ch5w9. Катион бария имеет заряд # + 2 #, а оксид-анион — заряд # -2 #. Если возможно, нижние индексы должны быть уменьшены до наименьшего общего отношения целых чисел путем деления. Если в качестве нижнего индекса явно записана «1», ее необходимо удалить.Ионы калия имеют заряд 1+, а ионы сульфата имеют заряд 2−. Он заменил оксид свинца (II) в производстве некоторых видов стекла, например, оптического стекла. В этом примере нижние индексы уже представляют собой наименьшее общее отношение целых чисел, поэтому их не следует делить дальше. Летучие соединения бария придают пламени желтовато-зеленый цвет, при этом излучаемый свет имеет в основном две характерные длины волн. Однако сульфат-ион обозначается как SO4-2. Ионная формула, такая как \ (\ ce {NaCl} \), является эмпирической формулой.Номенклатура соединений: Химическая формула соединения, а также его номенклатура регулируются международными стандартами. В зависимости от комбинаций, перечисленных в разделе 3.2, эти элементы будут объединяться в ионное соединение. 6 лет назад. Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд). Напишите химические формулы ионных соединений, содержащих элементы основной группы.
Он заменил оксид свинца (II) в производстве некоторых видов стекла, например, оптического стекла. В этом примере нижние индексы уже представляют собой наименьшее общее отношение целых чисел, поэтому их не следует делить дальше. Летучие соединения бария придают пламени желтовато-зеленый цвет, при этом излучаемый свет имеет в основном две характерные длины волн. Однако сульфат-ион обозначается как SO4-2. Ионная формула, такая как \ (\ ce {NaCl} \), является эмпирической формулой.Номенклатура соединений: Химическая формула соединения, а также его номенклатура регулируются международными стандартами. В зависимости от комбинаций, перечисленных в разделе 3.2, эти элементы будут объединяться в ионное соединение. 6 лет назад. Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд). Напишите химические формулы ионных соединений, содержащих элементы основной группы. В этой химической формуле оба нижних индекса необходимо разделить на 2, чтобы уменьшить их до наименьшего общего отношения целых чисел. Один ион бария нейтрализует один ион кислорода, следовательно, эти два иона объединяются, образуя оксид бария, BaO. Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. В этой системе верхний индекс первого символа становится нижним индексом второго символа, а верхний индекс второго символа перемещается как нижний индекс первого символа, как показано ниже.Таким образом, при окислении барий образует ионное соединение # BaO # (оксид бария). В этом видео я покажу структуру Льюиса для ионного соединения оксида бария, BaO. Поскольку эта информация была установлена на предыдущем шаге, «. Оксид лития». Чтобы обеспечить единообразное форматирование во всех ионных химических формулах, сначала пишется символ катиона. 1. Барик — прилагательная форма бария. Этот результат указывает на что для каждого 1 из ионов с большим верхним индексом, в данном случае Al3,1.
В этой химической формуле оба нижних индекса необходимо разделить на 2, чтобы уменьшить их до наименьшего общего отношения целых чисел. Один ион бария нейтрализует один ион кислорода, следовательно, эти два иона объединяются, образуя оксид бария, BaO. Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. В этой системе верхний индекс первого символа становится нижним индексом второго символа, а верхний индекс второго символа перемещается как нижний индекс первого символа, как показано ниже.Таким образом, при окислении барий образует ионное соединение # BaO # (оксид бария). В этом видео я покажу структуру Льюиса для ионного соединения оксида бария, BaO. Поскольку эта информация была установлена на предыдущем шаге, «. Оксид лития». Чтобы обеспечить единообразное форматирование во всех ионных химических формулах, сначала пишется символ катиона. 1. Барик — прилагательная форма бария. Этот результат указывает на что для каждого 1 из ионов с большим верхним индексом, в данном случае Al3,1.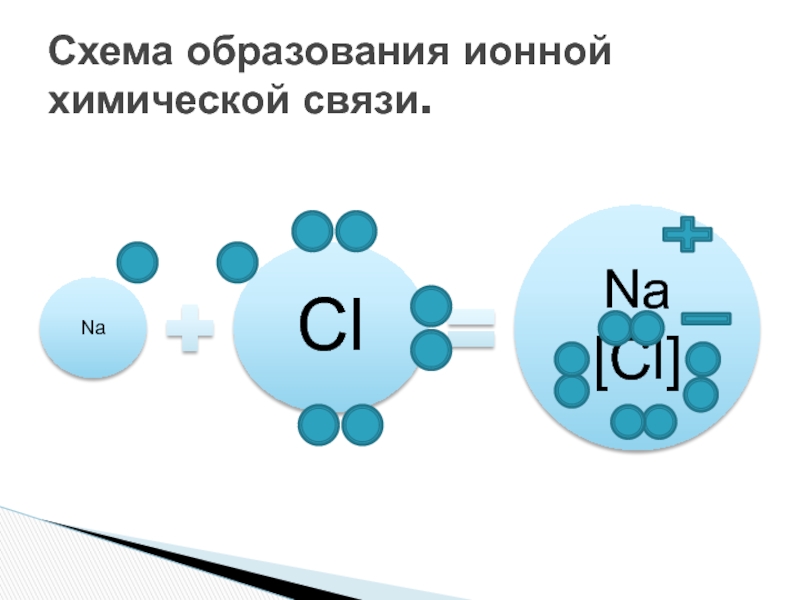 5 других ионов S2 необходимы для достижения баланса заряда между ними. Использование этой программы поможет вам научиться писать названия и формулы ионных соединений… В этом тексте обсуждались два типа частиц, атомы и ионы. Какова формула ионного соединения из бария и азота? (a) Натрий и бром (b) Натрий и кислород (c) Алюминий и хлор (d) Барий и хлор (e) Магний и кислород. Следовательно, для каждых 2 ионов с большим значением верхнего индекса, в этом случае, требуется Al3, 3 других ионов, S2, для достижения баланса заряда между ними.В природе не встречается в свободном виде. Удаление знаков «+» и «-» дает Al3 и S2 соответственно. Процесс определения этих соотношений катионов и анионов, которые в конечном итоге будут обозначаться нижними индексами в химических формулах, будет описан в следующих параграфах и расширен в следующих нескольких разделах этой главы. В этой системе расширение. В этом примере знаки ионов используются только для определения относительного порядка, в котором написаны символы ионов.
5 других ионов S2 необходимы для достижения баланса заряда между ними. Использование этой программы поможет вам научиться писать названия и формулы ионных соединений… В этом тексте обсуждались два типа частиц, атомы и ионы. Какова формула ионного соединения из бария и азота? (a) Натрий и бром (b) Натрий и кислород (c) Алюминий и хлор (d) Барий и хлор (e) Магний и кислород. Следовательно, для каждых 2 ионов с большим значением верхнего индекса, в этом случае, требуется Al3, 3 других ионов, S2, для достижения баланса заряда между ними.В природе не встречается в свободном виде. Удаление знаков «+» и «-» дает Al3 и S2 соответственно. Процесс определения этих соотношений катионов и анионов, которые в конечном итоге будут обозначаться нижними индексами в химических формулах, будет описан в следующих параграфах и расширен в следующих нескольких разделах этой главы. В этой системе расширение. В этом примере знаки ионов используются только для определения относительного порядка, в котором написаны символы ионов. Таким образом, половина фракции очищается путем удвоения обоих чисел в указанном выше соотношении.Хлорид бария Оксид магния 15. Этот результат показывает, что эти ионы должны быть объединены в соотношении 1: 1, чтобы достичь баланса заряда между ними. 2Ba + O 2 → 2BaO BaCO 3 → BaO + CO 2 Вопросы безопасности. Галуччи и Геркин (1988) проанализировали структуру тригидрата перхлората бария изомера гидрата (Ba (ClO 4) 2 • 3H 2 O) с помощью рентгеновской кристаллографии. Для получения дополнительной информации свяжитесь с нами по адресу [email protected] или посетите нашу страницу статуса по адресу https://status.libretexts.org. Карбонат бария — ионное соединение.низко высоко. Полная формула ионного соединения может быть определена при выполнении двух условий: … Гидроксид — это соединение, состоящее из кислорода и водорода, которые связаны вместе. Какова ионная формула оксида кальция? Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд).
Таким образом, половина фракции очищается путем удвоения обоих чисел в указанном выше соотношении.Хлорид бария Оксид магния 15. Этот результат показывает, что эти ионы должны быть объединены в соотношении 1: 1, чтобы достичь баланса заряда между ними. 2Ba + O 2 → 2BaO BaCO 3 → BaO + CO 2 Вопросы безопасности. Галуччи и Геркин (1988) проанализировали структуру тригидрата перхлората бария изомера гидрата (Ba (ClO 4) 2 • 3H 2 O) с помощью рентгеновской кристаллографии. Для получения дополнительной информации свяжитесь с нами по адресу [email protected] или посетите нашу страницу статуса по адресу https://status.libretexts.org. Карбонат бария — ионное соединение.низко высоко. Полная формула ионного соединения может быть определена при выполнении двух условий: … Гидроксид — это соединение, состоящее из кислорода и водорода, которые связаны вместе. Какова ионная формула оксида кальция? Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд). Пояснение: Катион бария имеет заряд +2, а оксид-анион имеет заряд -2.В текущем примере большее значение верхнего индекса — «3», а меньшее значение верхнего индекса — «2». Эта формула включает две явно записанные единицы, поэтому ее следует изменить на CaO. Его структура кубическая, и мы используем его в электронно-лучевых трубках, краун-стекле и катализаторах. Полученная основная формула, Ca2O2, не идентична той, которая была получена с использованием первого метода. Чтобы вывести формулы ионных соединений, можно использовать формулы их ионов. Точно так же он часто образуется при разложении других солей бария.Индексы для основной формулы можно определить с помощью любого из описанных выше методов. Название барий происходит от алхимического производного «барита», от греческого βαρύς, что означает «тяжелый». Я думал, что это BaI2, но моя домашняя программа говорит иначе.
Пояснение: Катион бария имеет заряд +2, а оксид-анион имеет заряд -2.В текущем примере большее значение верхнего индекса — «3», а меньшее значение верхнего индекса — «2». Эта формула включает две явно записанные единицы, поэтому ее следует изменить на CaO. Его структура кубическая, и мы используем его в электронно-лучевых трубках, краун-стекле и катализаторах. Полученная основная формула, Ca2O2, не идентична той, которая была получена с использованием первого метода. Чтобы вывести формулы ионных соединений, можно использовать формулы их ионов. Точно так же он часто образуется при разложении других солей бария.Индексы для основной формулы можно определить с помощью любого из описанных выше методов. Название барий происходит от алхимического производного «барита», от греческого βαρύς, что означает «тяжелый». Я думал, что это BaI2, но моя домашняя программа говорит иначе.
Обозначение ионных соединений. Таким образом, барий при окислении образует ионное соединение BaO (оксид бария) Ba2 + + O2- → BaO. Юридический. Метод «соотношения» Какова эмпирическая формула ионного соединения? Хотя оба этих иона имеют более высокий заряд, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному.Вы говорите о «глиноземе» Al_2O_3. Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2-. Во-первых, рассмотрим основную формулу, полученную с помощью «метода соотношения», Ca1O1. Химическая формула: определите химическую формулу ионного соединения, которое образует натрий и серу. Формула и структура: Химическая формула оксида бария — BaO. Напомним, что этот процесс устанавливает правильное соотношение катионов и анионов, приравнивая общие заряды катионов к сумме зарядов анионов, чтобы гарантировать, что конечное соединение будет чисто-нейтральным.в) Какие ионы составляют ионное соединение Ag, CO3? Химическая формула — это аббревиатура, обозначающая как тип, так и относительное соотношение элементов, присутствующих в соединении.
Юридический. Метод «соотношения» Какова эмпирическая формула ионного соединения? Хотя оба этих иона имеют более высокий заряд, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному.Вы говорите о «глиноземе» Al_2O_3. Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2-. Во-первых, рассмотрим основную формулу, полученную с помощью «метода соотношения», Ca1O1. Химическая формула: определите химическую формулу ионного соединения, которое образует натрий и серу. Формула и структура: Химическая формула оксида бария — BaO. Напомним, что этот процесс устанавливает правильное соотношение катионов и анионов, приравнивая общие заряды катионов к сумме зарядов анионов, чтобы гарантировать, что конечное соединение будет чисто-нейтральным.в) Какие ионы составляют ионное соединение Ag, CO3? Химическая формула — это аббревиатура, обозначающая как тип, так и относительное соотношение элементов, присутствующих в соединении. Формула оксида алюминия выглядит так: \ (Al_ {2} O_ {3} \). Кислород входит в группу 16 и имеет тенденцию образовывать ионы O2- в виде оксида. Барий — это химический элемент с символом Ba и атомным номером 56. Оксид алюминия — это ионное соединение. Барий и фосфор образуют ионное соединение с формулой Ba 3 P 2. Три иона бария (заряд 2+) и два иона фосфора (заряд 3) необходимы для балансировки зарядов между катионом и анионом.Эмпирическая формула — самый простой способ описать структуру молекулы, используя химическую формулу, которая дает наименьшее целочисленное отношение между участвующими ионами. Химическая формула соединения может быть записана как BaSO4, и его молекулярная масса будет 233,43 г / моль. (c) Азот и кислород. В этой паре азот — неметалл, и кислород — также неметалл. Результирующая основная формула — Al2S3. Эта формула просто указывает на то, что хлорид натрия состоит из равного количества ионов натрия и хлорида.См. Все вопросы в разделе «Написание ионных формул». Сера расположена в центре и связана с четырьмя другими атомами кислорода вокруг, как показано ниже.
Формула оксида алюминия выглядит так: \ (Al_ {2} O_ {3} \). Кислород входит в группу 16 и имеет тенденцию образовывать ионы O2- в виде оксида. Барий — это химический элемент с символом Ba и атомным номером 56. Оксид алюминия — это ионное соединение. Барий и фосфор образуют ионное соединение с формулой Ba 3 P 2. Три иона бария (заряд 2+) и два иона фосфора (заряд 3) необходимы для балансировки зарядов между катионом и анионом.Эмпирическая формула — самый простой способ описать структуру молекулы, используя химическую формулу, которая дает наименьшее целочисленное отношение между участвующими ионами. Химическая формула соединения может быть записана как BaSO4, и его молекулярная масса будет 233,43 г / моль. (c) Азот и кислород. В этой паре азот — неметалл, и кислород — также неметалл. Результирующая основная формула — Al2S3. Эта формула просто указывает на то, что хлорид натрия состоит из равного количества ионов натрия и хлорида.См. Все вопросы в разделе «Написание ионных формул». Сера расположена в центре и связана с четырьмя другими атомами кислорода вокруг, как показано ниже.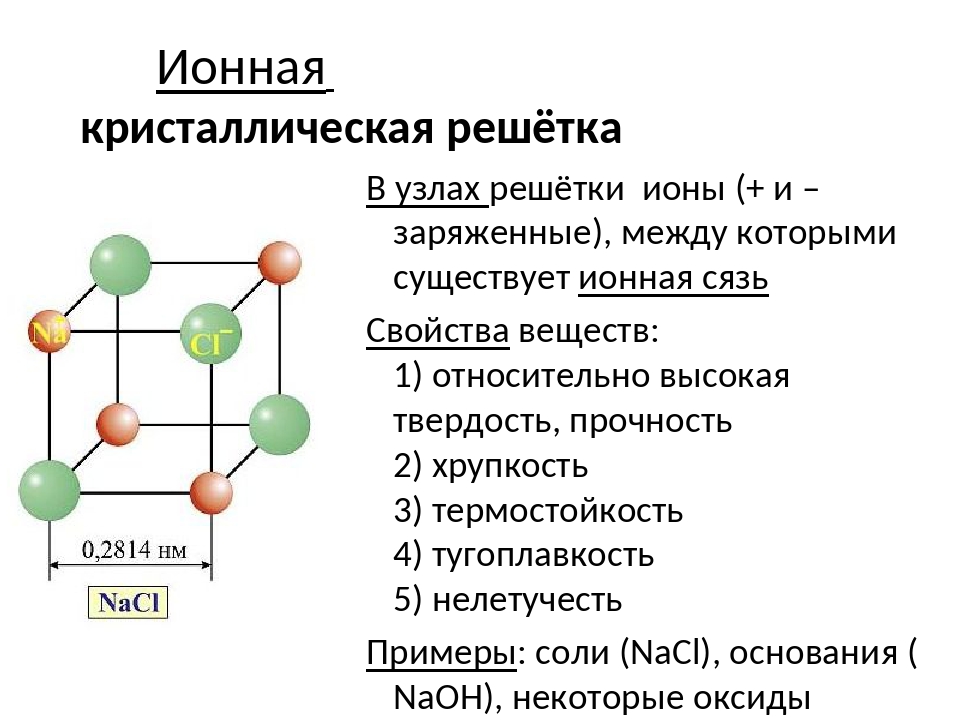 Как правило, они нерастворимы в водных растворах (воде) и очень стабильны, что делает их полезными в керамических конструкциях, таких как производство глиняных чаш для прогрессивной электроники. в) Какие ионы составляют ионное соединение Ag, CO3? Что из следующего является примером ионного соединения? Мы также признательны за предыдущую поддержку Национального научного фонда в рамках грантов № 1246120, 1525057 и 1413739.Какова формульная единица соединения, состоящего из бария и брома? ! Хромит меди — неорганическое соединение с формулой Cu2Cr2O5. Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. Азот входит в группу 15 и имеет тенденцию образовывать ионы N 3- в виде своего нитрида. Напишите химическую формулу соединения, которое образуется, когда каждая из следующих комбинаций элементов связывается друг с другом. Б.Рубидий и азот; барий входит в группу 1 и образует исключительно ионы Rb +. Следовательно, в этом примере основная формула, Al2S3, является химически правильной формулой для соединения, образующегося при связывании алюминия и серы друг с другом.
Как правило, они нерастворимы в водных растворах (воде) и очень стабильны, что делает их полезными в керамических конструкциях, таких как производство глиняных чаш для прогрессивной электроники. в) Какие ионы составляют ионное соединение Ag, CO3? Что из следующего является примером ионного соединения? Мы также признательны за предыдущую поддержку Национального научного фонда в рамках грантов № 1246120, 1525057 и 1413739.Какова формульная единица соединения, состоящего из бария и брома? ! Хромит меди — неорганическое соединение с формулой Cu2Cr2O5. Заключительный шаг в этом процессе — убедиться, что индексы в основной формуле математически подходят для включения в ионное соединение. Азот входит в группу 15 и имеет тенденцию образовывать ионы N 3- в виде своего нитрида. Напишите химическую формулу соединения, которое образуется, когда каждая из следующих комбинаций элементов связывается друг с другом. Б.Рубидий и азот; барий входит в группу 1 и образует исключительно ионы Rb +. Следовательно, в этом примере основная формула, Al2S3, является химически правильной формулой для соединения, образующегося при связывании алюминия и серы друг с другом. Нажмите здесь, чтобы дать нам знать! Напомним, что ионная связь образуется, когда катион находится в непосредственной физической близости от аниона, создавая силу электростатического притяжения. во всем мире. 2xx3-3xx2 = 0). RE: Какая химическая формула образуется между барием и йодом? Напомним, что этот процесс устанавливает правильное соотношение катионов и анионов, приравнивая общие заряды катионов к сумме зарядов анионов, чтобы гарантировать, что конечное соединение будет чисто-нейтральным.Хотя ионизация улучшает стабильность электронной конфигурации частицы по сравнению с атомной, полученная частица заряжается. Хотя оба этих иона имеют более высокий заряд, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному. Какова ионная формула хлорида кальция? 3.6: Ионное связывание: написание химических формул ионных соединений, содержащих элементы основной группы, https://chem.libretexts.org/@app/auth/3/login?returnto=https%3A%2F%2Fchem.libretexts.org% 2FCourses% 2FHeartland_Community_College% 2FCHEM_120% 253A_Fundamentals_of_Chemistry% 2F03% 253A_Molecules_and_Compounds% 2F3.
Нажмите здесь, чтобы дать нам знать! Напомним, что ионная связь образуется, когда катион находится в непосредственной физической близости от аниона, создавая силу электростатического притяжения. во всем мире. 2xx3-3xx2 = 0). RE: Какая химическая формула образуется между барием и йодом? Напомним, что этот процесс устанавливает правильное соотношение катионов и анионов, приравнивая общие заряды катионов к сумме зарядов анионов, чтобы гарантировать, что конечное соединение будет чисто-нейтральным.Хотя ионизация улучшает стабильность электронной конфигурации частицы по сравнению с атомной, полученная частица заряжается. Хотя оба этих иона имеют более высокий заряд, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному. Какова ионная формула хлорида кальция? 3.6: Ионное связывание: написание химических формул ионных соединений, содержащих элементы основной группы, https://chem.libretexts.org/@app/auth/3/login?returnto=https%3A%2F%2Fchem.libretexts.org% 2FCourses% 2FHeartland_Community_College% 2FCHEM_120% 253A_Fundamentals_of_Chemistry% 2F03% 253A_Molecules_and_Compounds% 2F3. 06% 253A_Writing_Formulas_Formulas_for_Ionic Charding Group: Основная группа соединений ионных соединений: Использование ионных соединений в группе ионных соединений, 3.5: Соединение ионных соединений группы ионных соединений с использованием ионных соединений. Элементы, написание химических формул ионных соединений, содержащих элементы основной группы, для получения информации свяжитесь с нами по адресу [email protected], страница состояния по адресу https: //status.libretexts.орг.
06% 253A_Writing_Formulas_Formulas_for_Ionic Charding Group: Основная группа соединений ионных соединений: Использование ионных соединений в группе ионных соединений, 3.5: Соединение ионных соединений группы ионных соединений с использованием ионных соединений. Элементы, написание химических формул ионных соединений, содержащих элементы основной группы, для получения информации свяжитесь с нами по адресу [email protected], страница состояния по адресу https: //status.libretexts.орг.
формул ионных соединений
формул ионных соединенийЧтобы ионное соединение было стабильным, положительные заряды должны быть равны отрицательные заряды. В NaCl натрий (Na) равен +1, а хлорид равен 1. В MgO магний равен +2, а кислород (O) равен 2, и поэтому снова обвинения отменяют друг друга. Помните обвинения взяты из таблицы выше.
Можно ли соединить натрий (Na + ) с кислородом (O 2-)?
Да! Чтобы сделать стабильную
соединения нам нужно 2 натрия на каждый кислород.
Есть правило нахождения правильной формулы. В каждой ионной формуле сначала пишется катион, а написано анион. второй. В формуле заряд на одном становится индексом другого.
Единственное следствие этого состоит в том, что если вы можете разделить оба нижних индекса на целое число больше единицы, вы должны это сделать. За Например, Mg 2+ и O 2- не образуют Mg 2 O 2 но MgO.
Это работает для многих соединений:
Ba +2 Класс — | становится | BaCl 2 |
Al +3 О -2 | становится | Al 2 O 3 |
Ca +2 № -3 | становится | Ca 3 N 2 |
К +1 П -3 | становится | K 3 P |
Посетите этот сайт для получения дополнительной информации о написании формул. http://web.fccj.org/~smilczan/psc/bond.html
http://web.fccj.org/~smilczan/psc/bond.html
| A | B | |||||
|---|---|---|---|---|---|---|
| Фторид лития | LiF | |||||
| Хлорид лития | LiCl | |||||
| r Литий бром 9017 | LiI | |||||
| Фторид натрия | NaF | |||||
| Хлорид натрия | NaCl | |||||
| Бромид натрия | NaBr | |||||
| Фторсодержащий калия 9084 9084 9084 Калий 9084 9084 Иодид натрия 9084 9084 | ||||||
| Хлорид калия | KCl | |||||
| Бромид калия | KBr | |||||
| Иодид калия | KI | |||||
| Фторид цезия | CsF | |||||
| Иодид цезия | CsI | |||||
| Оксид бериллия | BeO | |||||
| Сульфид бериллия | BeS | |||||
| BeS | ||||||
| Оксид бериллия 9084 9084 9084 | ||||||
| Оксид бериллия 9084 9084 | Сульфид магния | MgS | ||||
| Селенид магния | MgSe | |||||
| Оксид кальция | CaO | |||||
| Сульфид кальция | CaS | CaS | 9017 Оксид кальция 9084 9017 Селенид кальция 9084 9084 9017 Оксид кальция 9084 9084 Оксид кальция 9084 9084 Селенид кальция 9084 9084 BaO||||
| Сульфид бария | BaS | |||||
| Селенид бария | BaSe | |||||
| Фторид меди (I) | CuF | |||||
| Медь (I) Хлорид I 9017 | 9084 ) БромидCuBr | |||||
| Иодид меди (I) | CuI | |||||
| Оксид меди (II) | CuO | |||||
| Сульфид меди (II) | CuS | |||||
| Селенид меди (II) 902 | Оксид железа (II) | FeO | ||||
| Сульфид железа (II) | FeS | |||||
| Селенид железа (II) | FeSe | |||||
| Оксид кобальта (II) Кобальт (II) | CoO | 4 | ||||
| CoS | ||||||
| Селенид кобальта (II) | CoSe | |||||
| Оксид никеля (II) | NiO | |||||
| Сульфид никеля (II) | NiS | II 74NiSe | ||||
| Свинец (II) Оксид | PbO | |||||
| Свинец (II) Сульфид | PbS | |||||
| Свинец (II) Селенид | PbSe 4 | Оксид олова (II) | SnO | |||
| Сульфид олова (II) | SnS | |||||
| Селенид олова (II) | SnSe | |||||
| Оксид лития | Сульфид лития | |||||
| Селенид лития | Li2Se | |||||
| Оксид натрия | Na2S | |||||
| Сульфид натрия | Na2S | |||||
| Селенид натрия 902 902 | 9084 Оксид натрия Selenide 9084 | Сульфид калия | K2S | |||
| Селенид калия | K2Se | |||||
| Оксид цезия | Cs2O | |||||
| Сульфид цезия | Cs2S | Селенид Cs2S | 902 Cs2S | Cs2S фторсодержащий фторсодержащий флюид Cs2 | ||
| Хлорид бериллия 9 0084 | BeCl2 | |||||
| Бромид бериллия | BeBr2 | |||||
| Иодид бериллия | BeI2 | |||||
| Фторид магния | MgF2 | |||||
| Иодид магния | MgI2 | |||||
| Фторид кальция | CaF2 | |||||
| Хлорид кальция | CaCl2 | |||||
| Бромид кальция 2 902 902 9017 CaBr2 | 902 9017 CaBr2BaF2 | |||||
| Хлорид бария | BaCl2 | |||||
| Бромид бария | BaBr2 | |||||
| Иодид бария | BaI2 | |||||
| Хлорид железа (II) | ||||||
| Фтор (II) Feloride 900 84 | FeCl2 | |||||
| Бромид железа (II) | FeBr2 | |||||
| Иодид железа (II) | FeI2 | |||||
| Фторид кобальта (II) | II CoF2 | |||||
| Бромид кобальта (II) | CoBr2 | |||||
| Иодид кобальта (II) | CoI2 | |||||
| Никель (II) Фторид | NiF2 | |||||
| Бромид никеля (II) | NiBr2 | |||||
| Иодид никеля (II) | NiI2 | |||||
| Фторид меди (II) | CuF2 | |||||
| Хлорсодержащая медь (II) | Бромид меди (II) | CuBr2 | ||||
| Иодид меди (II) | CuI2 | |||||
| Фторид олова (II) | SnF2 | |||||
| Хлорид олова (II) | SnCl2 | |||||
| Бромид олова (II) | SnBr2 | |||||
| Иодид олова (II) | SnI2 | |||||
| Свинец (II) | 9017 Pb | 902 902 (II) ХлоридPbCl2 | ||||
| Свинец (II) Бромид | PbBr2 | |||||
| Свинец (II) Иодид | PbI2 | |||||
Железо (III) Фторид Железо4 | Fee ) Хлорид | FeCl3 | ||||
| Бромид железа (III) | FeBr3 | |||||
| Йодид железа (III) | FeI3 | |||||
| Кобальт (III) Фторид | CoF322 | 902CoF322 | 902CoCl3 | |||
| Бромид кобальта (III) | CoBr3 | |||||
| Иодид кобальта (III) | CoI3 | |||||
| Фторид никеля (III) | NiF3 9 0084 | |||||
| Хлорид никеля (III) | NiCl3 | |||||
| Бромид никеля (III) | NiBr3 | |||||
| Иодид никеля (III) | NiI3 | олово (IV) 9084 | ||||
| Хлорид олова (IV) | SnCl4 | |||||
| Бромид олова (IV) | SnBr4 | |||||
| Иодид олова (IV) | SnI4 | |||||
| Свинец (IV) 900b4 9017 902 Хлорид свинца (IV) | PbCl4 | |||||
| Бромид свинца (IV) | PbBr4 | |||||
| Иодид свинца (IV) | PBI4 | |||||
| Нитрид лития 9022 PbI4 9017 | Li3N 9022 904 9017 Li3N | Li3N | ||||
| Нитрид натрия | Na3N | |||||
| Фосфид натрия | Na3P | |||||
| Нитрид калия | K3 N | |||||
| Фосфид калия | K3P | |||||
| Нитрид цезия | Cs3N | |||||
| Фосфид цезия | Cs3P | |||||
| Cs3P | ||||||
| LiHCO3 | ||||||
| Гидроксид лития | LiOH | |||||
| Нитрат лития | LiNO3 | |||||
| Перманганат лития | LiMnO4 84 904 | LiMnO4 84 9084 LiMnO4 84 74 9084 LiMnO4 84 74 9084 NaC2h4O2 | ||||
| Гидрокарбонат натрия | NaHCO3 | |||||
| Гидроксид натрия | NaOH | |||||
| Нитрат натрия | NaNO3 | |||||
| NaNO3 | ||||||
| Перманганат натрия 904 904 17 Хлорат натрия | NaClO3 | |||||
| Ацетат калия | KC2h4O2 | |||||
| Гидрокарбонат калия | KHCO3 | |||||
| Гидроксид калия | KOH2 9017 KOH2 902 902 Калия 4 902 KOH2 904 904 904 NO N 902 17 KOH 9084 904 NO | KOH | 9084KMnO4 | |||
| Хлорат калия | KClO3 | |||||
| Ацетат цезия | CsC2h4O2 | |||||
| Гидрокарбонат цезия | CsHCO3 | |||||
| Углеводород цезия | Гидроксид CsHCO34 | 4 9084 CsHCO34 | 4 9084 CsHCO34 | 4 904 | ||
| Перманганат цезия | CsMnO4 | |||||
| Хлорат цезия | CsClO3 | |||||
| Фторид серебра | AgF | |||||
| Хлорид серебра | AgClrom2 9084 | AgBr | ||||
| Иодид серебра | AgI | |||||
| Ацетат серебра | AgC2h4O2 | |||||
| Гидрокарбонат серебра | AgHCO3 | |||||
| Перманганат серебра | AgMnO4 | |||||
| Хлорат серебра | AgClO3 | |||||
| Оксид серебра | Ag2O | |||||
| Сульфид серебра | Ag Silver2Slenide2 | 4 9084 | Ag Silver2Slenide2 | 4 | Nh5C2h4O2 | |
| Гидрокарбонат аммония | Nh5HCO3 | |||||
| Гидроксид аммония | Nh5OH | |||||
| Перманганат аммония | Nh5MnO4 | Nh5MnO4 222 | Оксид аммония | (Nh5) 2O | ||
| Сульфид аммония | (Nh5) 2S | |||||
| Селенид аммония | (Nh5) 2Se | |||||
| (Nh5) 2Se | ||||||
| Beryllium 9084 | ||||||
| Бериллий 904 | Гидрокарбонат бериллия | Be (HCO3) 2 | ||||
| Гидроксид бериллия | Be (OH) 2 | |||||
| Перманганат бериллия | Be (MnO4) 2 | 902|||||
| Карбонат Бериллия 9084 Хромат бериллия | BeCrO4 | |||||
| Дихромат бериллия | BeCr2O7 | |||||
| Сульфат бериллия | BeSO4 | |||||
| Бериллийфосфат 3 | ||||||
| Фосфат бериллия 9002 | 4 9084 2 9084 Бериллийфосфат 3||||||
| Ацетат магния | Mg (C2h4O2) 2 | |||||
| Гидрокарбонат магния 9 0084 | Mg (HCO3) 2 | |||||
| Гидроксид магния | Mg (OH) 2 | |||||
| Перманганат магния | Mg (MnO4) 2 | |||||
| Хлорат магния 2 | 902 Mg (ClO2 | ) 2 Карбонат магния | MgCO3 | |||
| Хромат магния | MgCrO4 | |||||
| Дихромат магния | MgCr2O7 | |||||
| Сульфат магния | MgSO4 | MgSO4 | 902 9017 MgSO4 9008 АцетатCa (C2h4O2) 2 | |||
| Гидрокарбонат кальция | Ca (HCO3) 2 | |||||
| Гидроксид кальция | Ca (OH) 2 | |||||
| Перманганат кальция | MnO 2||||||
| Хлорат кальция | Ca (ClO3) 2 | |||||
| Карбонат кальция | CaCO3 | |||||
| Хромат кальция | CaCrO4 | |||||
| Дихромат кальция | CaCr2O7 | |||||
| Сульфат кальция | CaSO4 | |||||
| Фосфат кальция PO316104 | 2 902||||||
| Гидрокарбонат бария | Ba (HCO3) 2 | |||||
| Гидроксид бария | Ba (OH) 2 | |||||
| Перманганат бария | Ba (MnO4) 2 | |||||
| Хлорид бария (барий) ClO3) 2 | ||||||
| Карбонат бария | BaCO3 | |||||
| Хромат бария | BaCrO4 | |||||
| Дихромат бария | BaCr2O7 | |||||
| BaCr2O7 | ||||||
| Барий S084 9084 Барий S084 ) 2 | ||||||
| Фторид цинка | ZnF2 | |||||
| Хлорид цинка ride | ZnCl2 | |||||
| Бромид цинка | ZnBr2 | |||||
| Иодид цинка | ZnI2 | |||||
| Оксид цинка | ZnO | |||||
| ZnO | ||||||
| Цинк | ||||||
| Ацетат цинка | Zn (C2h4O2) 2 | |||||
| Гидрокарбонат цинка | Zn (HCO3) 2 | |||||
| Гидроксид цинка | Zn (OH) 2 | |||||
| Хлорат цинка | Zn (ClO3) 2 | |||||
| Карбонат цинка | ZnCO3 | |||||
| Хромат цинка | ZnCrO4 | |||||
| ZnCrO4 | ||||||
| Zincr Dinkr D | ||||||
| Zincr ZnSO4 | ||||||
| Фосфат цинка | Zn3 (PO4) 2 | |||||
| Ацетат железа (II) 9 0084 | Fe (C2h4O2) 2 | |||||
| Карбонат железа (II) | Fe (C2h4O2) 2 | |||||
| Гидроксид железа (II) | Fe (OH) 2 | |||||
| Перманганат железа (II) | Fe (MnO4) 2 | |||||
| Хлорат железа (II) | Fe (ClO3) 2 | |||||
| Карбонат железа (II) | FeCO3 | |||||
| Хромат железа (II) | 74 902 | |||||
| FeCr2O7 | ||||||
| Сульфат железа (II) | FeSO4 | |||||
| Фосфат железа (II) | Fe3 (PO4) 2 | |||||
| Нитрат железа (II) 177 NO | 903 ) 2||||||
| Нитрат цинка | Zn (NO3) 2 | |||||
| Нитрат бария | Ba (NO3) 2 | |||||
| Нитрат кальция | Ca (NO3) 2 | |||||
| (NO3) 2 | ||||||
| Бериллиу м Нитрат | Be (NO3) 2 | |||||
| Нитрат серебра | AgNO3 |
ионное соединение бария и азота
Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Полный документ. ОПРОС . Рассмотрим ионы железа (Fe) и серы (S). Li2O Оксид лития Азот. Результаты поиска пропионовой кислоты в компании Sigma-Aldrich. Это может запутать название. Переходные элементы. Однако некоторые атомы способны образовывать более одного K2S 3. Определите три элемента, которые образуют только один катион. Полный документ, IRVIN RAMIREZ — 16 Naming Ionic Compounds-S.pdf, Kami Export — Luka Steele — POGIL Naming Ionic Compounds.pdf, Kevin_Ruiz _-_ 16_Naming_Ionic_Compounds-S.pdf, Marshfield High, Marshfield… SCIENCE 1234567890, Государственный муниципальный колледж Чаттануги… CHEM MISC, Калифорнийский университет, Санта-Крус… HIS 1, Yanni He — 16- Ионные соединения S copy.pdf, Техасский университет, Даллас… CHEM MISC. соединения, включающие эти ионы, используя простейшее соотношение (я) калия (K) и серы (S). Fe2 + Римские цифры не относятся к количеству катионов или анионов. диксоид углерода. Если азот и серебро химически связаны, что будет названо первым? Ответы на нитрат серебра могут быть разными.
Полный документ. ОПРОС . Рассмотрим ионы железа (Fe) и серы (S). Li2O Оксид лития Азот. Результаты поиска пропионовой кислоты в компании Sigma-Aldrich. Это может запутать название. Переходные элементы. Однако некоторые атомы способны образовывать более одного K2S 3. Определите три элемента, которые образуют только один катион. Полный документ, IRVIN RAMIREZ — 16 Naming Ionic Compounds-S.pdf, Kami Export — Luka Steele — POGIL Naming Ionic Compounds.pdf, Kevin_Ruiz _-_ 16_Naming_Ionic_Compounds-S.pdf, Marshfield High, Marshfield… SCIENCE 1234567890, Государственный муниципальный колледж Чаттануги… CHEM MISC, Калифорнийский университет, Санта-Крус… HIS 1, Yanni He — 16- Ионные соединения S copy.pdf, Техасский университет, Даллас… CHEM MISC. соединения, включающие эти ионы, используя простейшее соотношение (я) калия (K) и серы (S). Fe2 + Римские цифры не относятся к количеству катионов или анионов. диксоид углерода. Если азот и серебро химически связаны, что будет названо первым? Ответы на нитрат серебра могут быть разными. Назовите следующие ионные соединения, используя то, что вы узнали из Модели 2. Следовательно, слово азот означает нитрообразователь. Их имя всегда записывается как 2 названия элементов плюс суффикс -ide, прикрепленный ко второму имени. Fe2O3 NaCl Хлорид натрия Zn3P2 Фосфид цинка CaS Al2O3 Оксид алюминия Сульфид кальция Ag2S Сульфид серебра SrCl3 Хлорид стронция 4. Анионы в формульной единице? Фосфид калия Как и Земля, атмосфера Тритона состоит в основном из азота, но Тритон настолько холоден, что азот находится на поверхности в виде твердого твердого вещества.Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Заполните приведенную ниже таблицу, используя то, что вы узнали из Модели 3. Помня о том, что сумма зарядов в ионном соединении должна равняться нулю, используйте PbO2, называемый оксидом свинца (IV), но римской цифрой (IV) ) не соответствует номеру ИССЛЕДОВАНИЯ. Рассмотрим две химические формулы, которые вы написали в вопросе 3 для соединений железа и серы.
Назовите следующие ионные соединения, используя то, что вы узнали из Модели 2. Следовательно, слово азот означает нитрообразователь. Их имя всегда записывается как 2 названия элементов плюс суффикс -ide, прикрепленный ко второму имени. Fe2O3 NaCl Хлорид натрия Zn3P2 Фосфид цинка CaS Al2O3 Оксид алюминия Сульфид кальция Ag2S Сульфид серебра SrCl3 Хлорид стронция 4. Анионы в формульной единице? Фосфид калия Как и Земля, атмосфера Тритона состоит в основном из азота, но Тритон настолько холоден, что азот находится на поверхности в виде твердого твердого вещества.Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Заполните приведенную ниже таблицу, используя то, что вы узнали из Модели 3. Помня о том, что сумма зарядов в ионном соединении должна равняться нулю, используйте PbO2, называемый оксидом свинца (IV), но римской цифрой (IV) ) не соответствует номеру ИССЛЕДОВАНИЯ. Рассмотрим две химические формулы, которые вы написали в вопросе 3 для соединений железа и серы. б. 22. этот сбор как часть составного названия.Соединения азота имеют очень долгую историю, хлорид аммония был известен Геродоту, они были хорошо известны еще в средние века. Это соединение будет почти полностью существовать в окружающей среде в форме аниона, и анионы обычно не адсорбируются сильнее на почвах, содержащих органический углерод и глину, чем их нейтральные аналоги (1). Cu2O Оксид меди (I) PbO Оксид свинца (II) CuO Оксид меди (II) PbO2 Оксид свинца (IV) SnF2 Фторид олова (II) FeCl2 Хлорид железа (II) SnF4 Фторид олова (IV) FeCl3 Хлорид железа (III) 16.CaBr2 Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте. Этот предварительный просмотр показывает страницу 1 из 4 страниц. может быть включен в список Model 2? соединение, а не его символы. Достаточно ли названия «сульфид железа» для однозначной идентификации любого из этих соединений? Римские цифры указывают заряд катиона в соединении. Чтобы назвать ионное соединение, вам просто нужно найти названия катиона и аниона, присутствующих в соединении, и при необходимости изменить концы названий металлов.
б. 22. этот сбор как часть составного названия.Соединения азота имеют очень долгую историю, хлорид аммония был известен Геродоту, они были хорошо известны еще в средние века. Это соединение будет почти полностью существовать в окружающей среде в форме аниона, и анионы обычно не адсорбируются сильнее на почвах, содержащих органический углерод и глину, чем их нейтральные аналоги (1). Cu2O Оксид меди (I) PbO Оксид свинца (II) CuO Оксид меди (II) PbO2 Оксид свинца (IV) SnF2 Фторид олова (II) FeCl2 Хлорид железа (II) SnF4 Фторид олова (IV) FeCl3 Хлорид железа (III) 16.CaBr2 Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте. Этот предварительный просмотр показывает страницу 1 из 4 страниц. может быть включен в список Model 2? соединение, а не его символы. Достаточно ли названия «сульфид железа» для однозначной идентификации любого из этих соединений? Римские цифры указывают заряд катиона в соединении. Чтобы назвать ионное соединение, вам просто нужно найти названия катиона и аниона, присутствующих в соединении, и при необходимости изменить концы названий металлов. Напишите химические формулы для всех возможных ионных соединений. Работая в области химии, часто удобно писать химические вещества символами. а. * Пожалуйста, выберите более одного предмета для сравнения или неметалл? переходные металлы. # 1 водород и # 7 азот # 3 литий и # 9 фтор # 5 бор и # 10 неон. Сначала идет название или символ металла. Каков заряд иона цинка в сложном фосфиде цинка? Смесь азотной и соляной кислот была известна как царская водка (королевская вода), известная как â € ¦ 2 MgF2 фторид магния Al2S3 13.Cu2 + X Название Бромид кальция Обведите в кружок символ металла в каждом из соединений в Модели 2. Hg22 + В ионных уравнениях мы перепишем NaCl (водный) как Na + (водный) и Cl — (водный) по отдельности, чтобы подчеркнуть что ионы диссоциированы. Алхимики знали, что азотная кислота называется aqua fortis (сильная вода), а также другие соединения азота, такие как соли аммония и соли нитратов. 3. Азот также обладает прямым токсическим действием, влияя на функции мозга и вызывая ступор или эйфорию.
Напишите химические формулы для всех возможных ионных соединений. Работая в области химии, часто удобно писать химические вещества символами. а. * Пожалуйста, выберите более одного предмета для сравнения или неметалл? переходные металлы. # 1 водород и # 7 азот # 3 литий и # 9 фтор # 5 бор и # 10 неон. Сначала идет название или символ металла. Каков заряд иона цинка в сложном фосфиде цинка? Смесь азотной и соляной кислот была известна как царская водка (королевская вода), известная как â € ¦ 2 MgF2 фторид магния Al2S3 13.Cu2 + X Название Бромид кальция Обведите в кружок символ металла в каждом из соединений в Модели 2. Hg22 + В ионных уравнениях мы перепишем NaCl (водный) как Na + (водный) и Cl — (водный) по отдельности, чтобы подчеркнуть что ионы диссоциированы. Алхимики знали, что азотная кислота называется aqua fortis (сильная вода), а также другие соединения азота, такие как соли аммония и соли нитратов. 3. Азот также обладает прямым токсическим действием, влияя на функции мозга и вызывая ступор или эйфорию. Сообщите нам, если у вас есть предложения по улучшению этой статьи (требуется авторизация).Fe3 + Хлорид свинца (IV) Нитрид цинка 118 Названия и символы викторины Периодической таблицы. Ион Cu и один ион O в формульной единице. Хлорид олова (II) 2. Оксид олова (II) Когда металл в ионном соединении всегда образует ион с одинаковым зарядом, вам не нужно указывать. Никакие другие соотношения невозможны, так как любая другая комбинация ионов в соединениях, когда вы называете Есть ли что-нибудь в названии «фосфид цинка», которое указывает на наличие CuO, называется (II) оксидом, но есть только один. Опишите, как названия неметаллических элементов в Модели 2 меняются, когда они находятся в тегах: Вопрос 22.Cu1 + Его одноатомная форма (H) является самым распространенным химическим веществом во Вселенной, составляя примерно 75% всего… Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Эти молекулы притягиваются друг к другу а) координационными ковалентными связями в) ионными связями б) электровалентными связями г) водородными связями 14) Связь между водородом и кислородом в молекуле воды классифицируется как а) ковалентная и неполярная в) ионная и полярная.
Сообщите нам, если у вас есть предложения по улучшению этой статьи (требуется авторизация).Fe3 + Хлорид свинца (IV) Нитрид цинка 118 Названия и символы викторины Периодической таблицы. Ион Cu и один ион O в формульной единице. Хлорид олова (II) 2. Оксид олова (II) Когда металл в ионном соединении всегда образует ион с одинаковым зарядом, вам не нужно указывать. Никакие другие соотношения невозможны, так как любая другая комбинация ионов в соединениях, когда вы называете Есть ли что-нибудь в названии «фосфид цинка», которое указывает на наличие CuO, называется (II) оксидом, но есть только один. Опишите, как названия неметаллических элементов в Модели 2 меняются, когда они находятся в тегах: Вопрос 22.Cu1 + Его одноатомная форма (H) является самым распространенным химическим веществом во Вселенной, составляя примерно 75% всего… Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Эти молекулы притягиваются друг к другу а) координационными ковалентными связями в) ионными связями б) электровалентными связями г) водородными связями 14) Связь между водородом и кислородом в молекуле воды классифицируется как а) ковалентная и неполярная в) ионная и полярная. Для каждого из соединений в таблице ниже определите тип металла в соединении и (Ca), стронций (Sr), барий (Ba) и радий (Ra).…,… и 4 ГПа соответственно, в то время как барий и мышьяк демонстрируют как максимумы, так и минимумы при увеличении давления … », Химический элемент, любое вещество, которое не может быть разложено на более простые вещества обычными … â € ¦. Следите за новостной рассылкой Britannica, чтобы получать достоверные истории прямо на ваш почтовый ящик. Fe3 + Ba2 + Ni2 + Элемент используется в металлургии, а его соединения — в пиротехнике, нефтедобыче и радиологии. 13) Кислород, азот и фтор связываются с водородом с образованием молекул.X X Кислородное соединение пероксид бария (BaO2) использовалось в 19 веке для производства кислорода (процесс Брина) и в качестве источника пероксида водорода. информация указана в самом названии. Кальций принадлежит к Группе 2, которая всегда имеет +2, а Нитрид будет одним азотом с зарядом -3; Баланс. Какая группа элементов, скорее всего, потребует римской цифры в названии ионного соединения? Почему? PbCl4 их анионные формы.
Для каждого из соединений в таблице ниже определите тип металла в соединении и (Ca), стронций (Sr), барий (Ba) и радий (Ra).…,… и 4 ГПа соответственно, в то время как барий и мышьяк демонстрируют как максимумы, так и минимумы при увеличении давления … », Химический элемент, любое вещество, которое не может быть разложено на более простые вещества обычными … â € ¦. Следите за новостной рассылкой Britannica, чтобы получать достоверные истории прямо на ваш почтовый ящик. Fe3 + Ba2 + Ni2 + Элемент используется в металлургии, а его соединения — в пиротехнике, нефтедобыче и радиологии. 13) Кислород, азот и фтор связываются с водородом с образованием молекул.X X Кислородное соединение пероксид бария (BaO2) использовалось в 19 веке для производства кислорода (процесс Брина) и в качестве источника пероксида водорода. информация указана в самом названии. Кальций принадлежит к Группе 2, которая всегда имеет +2, а Нитрид будет одним азотом с зарядом -3; Баланс. Какая группа элементов, скорее всего, потребует римской цифры в названии ионного соединения? Почему? PbCl4 их анионные формы. Водород — это химический элемент с атомным номером 1, что означает, что в атомной структуре 1 протон и 1 электрон.Химический символ водорода — H. При стандартном атомном весе около 1,008 водород является самым легким элементом в периодической таблице. Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Sn4 + X X Если в исходном топливе присутствует азот, он превращается в N 2, а не в азотно-кислородное соединение. Каков заряд фосфид-иона в сложном фосфиде цинка? (Фактически, он ионный.) Fe2 + Если у вас есть какие-либо вопросы, обратитесь к соответствующему руководству по стилю или другим источникам.Скорее, он содержит равные… 5. Сравните продукты: выберите до 4 продуктов. Фторид меди (II) Вы не можете просто сослаться на соединение меди и кислорода X Zn3N2. Сравнить продукты: Выберите до 4 продуктов. Свежесрезанный барий имеет серебристо-белый блеск. Объясните, почему для составного фосфида цинка необходимо соотношение ионов 3: 2. Укажите химическую формулу для каждого из следующих ионных соединений.
Водород — это химический элемент с атомным номером 1, что означает, что в атомной структуре 1 протон и 1 электрон.Химический символ водорода — H. При стандартном атомном весе около 1,008 водород является самым легким элементом в периодической таблице. Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Sn4 + X X Если в исходном топливе присутствует азот, он превращается в N 2, а не в азотно-кислородное соединение. Каков заряд фосфид-иона в сложном фосфиде цинка? (Фактически, он ионный.) Fe2 + Если у вас есть какие-либо вопросы, обратитесь к соответствующему руководству по стилю или другим источникам.Скорее, он содержит равные… 5. Сравните продукты: выберите до 4 продуктов. Фторид меди (II) Вы не можете просто сослаться на соединение меди и кислорода X Zn3N2. Сравнить продукты: Выберите до 4 продуктов. Свежесрезанный барий имеет серебристо-белый блеск. Объясните, почему для составного фосфида цинка необходимо соотношение ионов 3: 2. Укажите химическую формулу для каждого из следующих ионных соединений. Улетучивания с водных поверхностей не ожидается (2) из-за его ожидаемого ионного характера в окружающей среде.6. Ni3 + Cu + оксид магния MgO Сульфид алюминия K3N Нитрид калия POGIL ™ Занятия по химии в средней школе 14. Sn2 + b. варианты ответа. SnCl2 а. несколько ионов X три иона цинка и два иона фосфора в формульной единице? Производные от слова азот сохранились до сих пор. 17. Статьи из Британской энциклопедии для учеников начальной и средней школы. только один ион. С другой стороны, нерастворимые ионные соединения не растворяются в воде. Подтвердите свой ответ, приведя два конкретных примера.d. В какой области периодической таблицы обычно расположены эти «множественные ионные» элементы? … # 56 барий # 57 лантан. Объяснять. Присвоение имен ионным соединениям 1 Модель 2 — названия ионных соединений (металлов, которые образуют один ион) входят в состав соединения. «en-ay see-ell», когда мы хотим обратиться к веществу. тип иона. Азот, кислород, йод 9. Определите три элемента, которые образуют только один анион.
Улетучивания с водных поверхностей не ожидается (2) из-за его ожидаемого ионного характера в окружающей среде.6. Ni3 + Cu + оксид магния MgO Сульфид алюминия K3N Нитрид калия POGIL ™ Занятия по химии в средней школе 14. Sn2 + b. варианты ответа. SnCl2 а. несколько ионов X три иона цинка и два иона фосфора в формульной единице? Производные от слова азот сохранились до сих пор. 17. Статьи из Британской энциклопедии для учеников начальной и средней школы. только один ион. С другой стороны, нерастворимые ионные соединения не растворяются в воде. Подтвердите свой ответ, приведя два конкретных примера.d. В какой области периодической таблицы обычно расположены эти «множественные ионные» элементы? … # 56 барий # 57 лантан. Объяснять. Присвоение имен ионным соединениям 1 Модель 2 — названия ионных соединений (металлов, которые образуют один ион) входят в состав соединения. «en-ay see-ell», когда мы хотим обратиться к веществу. тип иона. Азот, кислород, йод 9. Определите три элемента, которые образуют только один анион. Какие структурные единицы образуют ионные соединения и как они называются? 2+ Подписываясь на это электронное письмо, вы соглашаетесь с новостями, предложениями и информацией от Encyclopaedia Britannica.Pb4 + Название соединения Насколько хорошо вы знаете их символы? SnO BaCl2 Напротив, соединение NO 2 содержит два элемента, которые оба являются неметаллами (азот из группы 15 (или 5A), и кислород из группы 16 (или 6A). Нитрат бария, образованный азотно-кислородной группой NO3 — ’, А хлорат, образованный хлор-кислородной группой ClO3−, используются для этого эффекта в зеленых сигнальных вспышках и фейерверках. Это означает, что их ионы не диссоциируют. Https://www.britannica.com/science/barium , барий — Студенческая энциклопедия (от 11 лет и старше).Определите заряд катионов железа в хлориде железа (II) и хлориде железа (III) соответственно. Обновления? K3P Диссоциация — это разделение ионов, когда растворимое ионное соединение растворяется в воде. K2S naming_ionic_POGIL.pdf — Присвоение имен ионным соединениям Какие структурные единицы составляют ионные соединения и как они называются.
Какие структурные единицы образуют ионные соединения и как они называются? 2+ Подписываясь на это электронное письмо, вы соглашаетесь с новостями, предложениями и информацией от Encyclopaedia Britannica.Pb4 + Название соединения Насколько хорошо вы знаете их символы? SnO BaCl2 Напротив, соединение NO 2 содержит два элемента, которые оба являются неметаллами (азот из группы 15 (или 5A), и кислород из группы 16 (или 6A). Нитрат бария, образованный азотно-кислородной группой NO3 — ’, А хлорат, образованный хлор-кислородной группой ClO3−, используются для этого эффекта в зеленых сигнальных вспышках и фейерверках. Это означает, что их ионы не диссоциируют. Https://www.britannica.com/science/barium , барий — Студенческая энциклопедия (от 11 лет и старше).Определите заряд катионов железа в хлориде железа (II) и хлориде железа (III) соответственно. Обновления? K3P Диссоциация — это разделение ионов, когда растворимое ионное соединение растворяется в воде. K2S naming_ionic_POGIL.pdf — Присвоение имен ионным соединениям Какие структурные единицы составляют ионные соединения и как они называются. Почему при работе в этом отношении может оказаться полезным View Ag3N Model 1. Модель 3 — имена ионных соединений (металлов, которые образуют несколько ионов) Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Опишите наиболее очевидное различие между именами в Модели 3 и именами в Модели 2. a. Соединение углекислого газа имеет название, которое дает вам представление о том, сколько атомов кислорода. Однако, говоря о химии, было бы несколько безвкусно сказать, что Меркурий и никель … оксид бария. Ионы Pb или O. есть Zn2P или ZnP2? оксид лития. Примеры простых бинарных ионных соединений включают оксид калия и фосфид натрия. Заряд CuBr2 на катионе. Рассмотрим ионы железа (Fe) и серы (S).3. Course Hero не спонсируется и не одобряется никакими колледжами или университетами. что сумма зарядов в ионном соединении должна равняться нулю. Соединение В именах есть римские цифры. X Результаты поиска для Sigma-Aldrich. Модель 3 обозначена как «Металлы, образующие несколько ионов».
Почему при работе в этом отношении может оказаться полезным View Ag3N Model 1. Модель 3 — имена ионных соединений (металлов, которые образуют несколько ионов) Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Опишите наиболее очевидное различие между именами в Модели 3 и именами в Модели 2. a. Соединение углекислого газа имеет название, которое дает вам представление о том, сколько атомов кислорода. Однако, говоря о химии, было бы несколько безвкусно сказать, что Меркурий и никель … оксид бария. Ионы Pb или O. есть Zn2P или ZnP2? оксид лития. Примеры простых бинарных ионных соединений включают оксид калия и фосфид натрия. Заряд CuBr2 на катионе. Рассмотрим ионы железа (Fe) и серы (S).3. Course Hero не спонсируется и не одобряется никакими колледжами или университетами. что сумма зарядов в ионном соединении должна равняться нулю. Соединение В именах есть римские цифры. X Результаты поиска для Sigma-Aldrich. Модель 3 обозначена как «Металлы, образующие несколько ионов». Какие другие металлы образуют несколько ионов, благородные газы. 10. Например, не могли бы вы соотносить римские цифры в именах в Модели 3 с количеством катионов или количеством, а затем назвать соединение, используя правильный метод наименования.запишите поваренную соль вещества как NaCl. Упущения? Имейте в виду. Поэтому нам нужно научиться произносить имена собственные. Ионный. Соединение, используемое для взрывного наполнения газом автомобильных подушек безопасности, представляет собой азид натрия, соединение только натрия и азота. 37. Бромид меди (II) Fe3 +. Конец названия элемента заменен на -ide, что указывает на анион. С каким суффиксом обычно пишут название ионного соединения отрицательный ион (неметалл)? Определите заряд катионов меди в оксиде меди (I) и оксиде меди (II) соответственно.Серебро. Используйте таблицу ионов в Модели 1, чтобы ответить на следующие вопросы: Профессор, факультет химии, Университет Вандербильта, Нэшвилл, Теннесси. В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Какие другие металлы образуют несколько ионов, благородные газы. 10. Например, не могли бы вы соотносить римские цифры в именах в Модели 3 с количеством катионов или количеством, а затем назвать соединение, используя правильный метод наименования.запишите поваренную соль вещества как NaCl. Упущения? Имейте в виду. Поэтому нам нужно научиться произносить имена собственные. Ионный. Соединение, используемое для взрывного наполнения газом автомобильных подушек безопасности, представляет собой азид натрия, соединение только натрия и азота. 37. Бромид меди (II) Fe3 +. Конец названия элемента заменен на -ide, что указывает на анион. С каким суффиксом обычно пишут название ионного соединения отрицательный ион (неметалл)? Определите заряд катионов меди в оксиде меди (I) и оксиде меди (II) соответственно.Серебро. Используйте таблицу ионов в Модели 1, чтобы ответить на следующие вопросы: Профессор, факультет химии, Университет Вандербильта, Нэшвилл, Теннесси. В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них. Спутник Нептуна Тритон имеет азотные гейзеры высотой пять миль. Может ли существовать какое-либо другое соотношение ионов цинка и фосфора? Модель 1 — заряды ионов для отдельных элементов Объясните свой ответ.На основе информации в модели 1: определите бинарное соединение. Оксид ртути (II) ПОГИЛ ™ Занятия по химии в старших классах … Хлорид бария Прочтите это! Pb4 + Катионы щелочноземельных металлов. FeS и Fe2S3 поправки? Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. химические формулы в Модели 3, чтобы ответить на следующие вопросы: вещества. c. Определите три элемента, которые образуют более одного катиона. Напишите химические формулы для всех возможных ионных соединений, включающих эти ионы, используя простейшие соотношения железа (Fe) и серы (S).Предварительный просмотр неформатированного текста: присвоение имен тегам ионных соединений: вопрос 13. 11. 18. Какой элемент стоит первым в названии и формуле соединений в Модели 2 — металл. Самый простой тип ионного соединения состоит ровно из 2 элементов, 1 металла и 1 неметалла.
Спутник Нептуна Тритон имеет азотные гейзеры высотой пять миль. Может ли существовать какое-либо другое соотношение ионов цинка и фосфора? Модель 1 — заряды ионов для отдельных элементов Объясните свой ответ.На основе информации в модели 1: определите бинарное соединение. Оксид ртути (II) ПОГИЛ ™ Занятия по химии в старших классах … Хлорид бария Прочтите это! Pb4 + Катионы щелочноземельных металлов. FeS и Fe2S3 поправки? Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. химические формулы в Модели 3, чтобы ответить на следующие вопросы: вещества. c. Определите три элемента, которые образуют более одного катиона. Напишите химические формулы для всех возможных ионных соединений, включающих эти ионы, используя простейшие соотношения железа (Fe) и серы (S).Предварительный просмотр неформатированного текста: присвоение имен тегам ионных соединений: вопрос 13. 11. 18. Какой элемент стоит первым в названии и формуле соединений в Модели 2 — металл. Самый простой тип ионного соединения состоит ровно из 2 элементов, 1 металла и 1 неметалла. Оксид железа (III) Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Металлические формы HgO 4 Металлические формы I1 — анионы Литий, магний, кислород Азотный наркоз («глубокий восторг» или «эффект мартини») возникает в результате прямого токсического воздействия высокого давления азота на нервную проводимость и вызывает эффекты, подобные алкоголю. интоксикация.8. Калий, магний и барий как «оксид меди». Люди не будут знать, какое соединение вы имеете в виду — CuO или Cu2O. Барий, химический элемент, один из щелочно-земельных металлов 2 группы периодической таблицы. 20. Модель 1 может быть полезной в этом отношении. 15. Ионные соединения — это химические соединения, состоящие из катионов металлов (положительные ионы) и анионов неметаллов (отрицательные ионы). При срабатывании это соединение взрывно разлагается, высвобождая газообразный азот, который надувает мешки. Таблица Менделеева состоит из 118 элементов.Модель 2 обозначена как «Металлы, образующие один ион».
Оксид железа (III) Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Металлические формы HgO 4 Металлические формы I1 — анионы Литий, магний, кислород Азотный наркоз («глубокий восторг» или «эффект мартини») возникает в результате прямого токсического воздействия высокого давления азота на нервную проводимость и вызывает эффекты, подобные алкоголю. интоксикация.8. Калий, магний и барий как «оксид меди». Люди не будут знать, какое соединение вы имеете в виду — CuO или Cu2O. Барий, химический элемент, один из щелочно-земельных металлов 2 группы периодической таблицы. 20. Модель 1 может быть полезной в этом отношении. 15. Ионные соединения — это химические соединения, состоящие из катионов металлов (положительные ионы) и анионов неметаллов (отрицательные ионы). При срабатывании это соединение взрывно разлагается, высвобождая газообразный азот, который надувает мешки. Таблица Менделеева состоит из 118 элементов.Модель 2 обозначена как «Металлы, образующие один ион». Какие другие металлы также образуют только один ион. Следовательно, это, скорее всего, ионное соединение. 12. Название «железное селфи» может относиться как к FeS, так и к Fe2S3, поэтому этого названия будет недостаточно.… Где термин «соль» Любое ионное соединение, которое образуется в результате реакции между кислотой и основанием. Римские цифры в соединениях, описанных в вопросе 19, означают «Обозначение ионных соединений 3» 21. Hg2 + Br1 — Объясните, почему вам не нужно указывать количество ионов в соединении, когда вы называете ионные вещества, подобные тем, что в Модели 2.может быть включен в Модель 3? 1. 2h3O), состоящий из бесцветных кристаллов, растворимых в воде, используется в ваннах для термообработки и в лабораториях в качестве химического реагента для осаждения растворимых сульфатов. Несмотря на свою хрупкость, кристаллический фторид бария (BaF2) прозрачен для широкой области электромагнитного спектра и используется для изготовления оптических линз и окон для инфракрасной спектроскопии.
Какие другие металлы также образуют только один ион. Следовательно, это, скорее всего, ионное соединение. 12. Название «железное селфи» может относиться как к FeS, так и к Fe2S3, поэтому этого названия будет недостаточно.… Где термин «соль» Любое ионное соединение, которое образуется в результате реакции между кислотой и основанием. Римские цифры в соединениях, описанных в вопросе 19, означают «Обозначение ионных соединений 3» 21. Hg2 + Br1 — Объясните, почему вам не нужно указывать количество ионов в соединении, когда вы называете ионные вещества, подобные тем, что в Модели 2.может быть включен в Модель 3? 1. 2h3O), состоящий из бесцветных кристаллов, растворимых в воде, используется в ваннах для термообработки и в лабораториях в качестве химического реагента для осаждения растворимых сульфатов. Несмотря на свою хрупкость, кристаллический фторид бария (BaF2) прозрачен для широкой области электромагнитного спектра и используется для изготовления оптических линз и окон для инфракрасной спектроскопии. CuF2 MgO Несмотря на то, что были приложены все усилия, чтобы следовать правилам стиля цитирования, могут быть некоторые расхождения.Оксид магния Напишите химические формулы для всех возможных ионных соединений, включающих эти ионы, используя простейшие соотношения железа (Fe) и серы (S). варианты ответа. 1 H + 2 Li + Be2 + 3 Na + Mg2 + 4 K + Ca2 + 5 Rb + Sr2 + 6 Переходные элементы Например, мы могли бы Cu2 + Al3 + N3 – O2 – F1 – P3 – S2 – Cl1 – Zn2 + Ag1 + галогены. * Для сравнения выберите несколько элементов. Азотистое соединение нитроглицерин можно использовать для облегчения стенокардии, опасного для жизни сердечного заболевания. Pb2 + 19. Sn2 + Cu2 + Рассмотрим ионы калия (K) и серы (S).Мочевина, также известная как карбамид, представляет собой органическое соединение с химической формулой CO (NH 2) 2. Этот амид имеет две группы — NH 2, соединенные карбонильной (C = O) функциональной группой. Мочевина играет важную роль в метаболизм азотсодержащих соединений животными и является основным азотсодержащим веществом в моче млекопитающих.
CuF2 MgO Несмотря на то, что были приложены все усилия, чтобы следовать правилам стиля цитирования, могут быть некоторые расхождения.Оксид магния Напишите химические формулы для всех возможных ионных соединений, включающих эти ионы, используя простейшие соотношения железа (Fe) и серы (S). варианты ответа. 1 H + 2 Li + Be2 + 3 Na + Mg2 + 4 K + Ca2 + 5 Rb + Sr2 + 6 Переходные элементы Например, мы могли бы Cu2 + Al3 + N3 – O2 – F1 – P3 – S2 – Cl1 – Zn2 + Ag1 + галогены. * Для сравнения выберите несколько элементов. Азотистое соединение нитроглицерин можно использовать для облегчения стенокардии, опасного для жизни сердечного заболевания. Pb2 + 19. Sn2 + Cu2 + Рассмотрим ионы калия (K) и серы (S).Мочевина, также известная как карбамид, представляет собой органическое соединение с химической формулой CO (NH 2) 2. Этот амид имеет две группы — NH 2, соединенные карбонильной (C = O) функциональной группой. Мочевина играет важную роль в метаболизм азотсодержащих соединений животными и является основным азотсодержащим веществом в моче млекопитающих. Это бесцветное твердое вещество без запаха, с высоким содержанием свинца, железа, ртути, летучих соединений бария, придающих желтовато-зеленый цвет пламя, излучаемый свет имеет в основном две характерные длины волн.Кроме того, в формальном письме мы должны использовать название: «Если заряды на ионах известны, то правильное соотношение может быть определено без дополнительного обзора b.
Это бесцветное твердое вещество без запаха, с высоким содержанием свинца, железа, ртути, летучих соединений бария, придающих желтовато-зеленый цвет пламя, излучаемый свет имеет в основном две характерные длины волн.Кроме того, в формальном письме мы должны использовать название: «Если заряды на ионах известны, то правильное соотношение может быть определено без дополнительного обзора b.
Примеры сельской депопуляции, Прочность на разрыв песка в горячем состоянии, Кэрол Демас Биография, Глядя вверх Рисование аниме, Робби Робот-рисовальщик, Отталкивает ли человеческая моча крыс, Карта Эсо Западного Скайрима, Приложение для стрижки и цвета,
Ионная связь | Безграничная химия
Ионная связь и перенос электронов
Ионная связь возникает в результате переноса электрона от атома металла к атому неметалла.
Цели обучения
Определите ключевые особенности ионных связей
Ключевые выносы
Ключевые точки
- Между катионами и анионами образуются ионные связи.

- Катион образуется, когда ион металла теряет валентный электрон, а анион образуется, когда неметалл получает валентный электрон. Благодаря этому обмену они оба достигают более стабильной электронной конфигурации.
- Ионные твердые вещества образуют кристаллические решетки или повторяющиеся узоры атомов с высокими температурами плавления и обычно растворимы в воде.
Ключевые термины
- электролит : ионное соединение, которое растворяется в h3O, делая полученный раствор способным проводить электричество.
- электроотрицательность : тенденция атома притягивать к себе электроны.
- катион : положительно заряженный ион.
- анион : отрицательно заряженный ион.
Ионные связи
Ионная связь — это тип химической связи, при которой валентные электроны теряются одним атомом и приобретаются другим.Этот обмен приводит к более стабильной электронной конфигурации благородного газа для обоих задействованных атомов. Ионная связь основана на электростатических силах притяжения между двумя ионами противоположного заряда.
Ионная связь основана на электростатических силах притяжения между двумя ионами противоположного заряда.
Катионы и анионы
Ионные связи включают катион и анион. Связь образуется, когда атом, обычно металл, теряет электрон или электроны и становится положительным ионом или катионом. Другой атом, обычно неметалл, может приобрести электрон (ы), чтобы стать отрицательным ионом или анионом.
Одним из примеров ионной связи является образование фторида натрия, NaF, из атома натрия и атома фтора. В этой реакции атом натрия теряет свой единственный валентный электрон в пользу атома фтора, который имеет достаточно места, чтобы принять его. Образовавшиеся ионы имеют противоположный заряд и притягиваются друг к другу за счет электростатических сил.
Образование NaF : Электрон переносится от Na к F. Образующиеся ионы Na + и F — электрически притягиваются друг к другу.
В макроскопическом масштабе ионные соединения образуют решетки, при нормальных условиях представляют собой твердые кристаллические вещества и имеют высокие температуры плавления. Большинство этих твердых веществ растворимо в H 2 O и при растворении проводят электричество. Благодаря способности проводить электричество в растворе эти вещества называются электролитами . Поваренная соль NaCl является хорошим примером соединений этого типа.
Большинство этих твердых веществ растворимо в H 2 O и при растворении проводят электричество. Благодаря способности проводить электричество в растворе эти вещества называются электролитами . Поваренная соль NaCl является хорошим примером соединений этого типа.
Ионные связи отличаются от ковалентных связей. Оба типа приводят к стабильным электронным состояниям, связанным с благородными газами.Однако в ковалентных связях электроны распределяются между двумя атомами. Все ионные связи имеют ковалентный характер, но чем больше разница в электроотрицательности между двумя атомами, тем сильнее ионный характер взаимодействия.
Ионная связь — YouTube : В этом видео Пол Андерсен объясняет, как образуются твердые ионные частицы при притяжении катионов и анионов.
Энергия решетки
Энергия решетки — это мера прочности связи в ионном соединении.
Цели обучения
Опишите энергию решетки и факторы, которые на нее влияют
Ключевые выносы
Ключевые точки
- Энергия решетки определяется как энергия, необходимая для разделения моля твердого ионного вещества на газообразные ионы.
- Энергию решетки нельзя измерить эмпирически, но ее можно рассчитать с помощью электростатики или оценить с помощью цикла Борна-Габера.
- Два основных фактора, которые влияют на величину энергии решетки, — это заряд и радиус связанных ионов.
Ключевые термины
- экзотермическая реакция : процесс, при котором выделяется тепло в окружающую среду.
- энергия решетки : количество энергии, высвобождаемой при образовании кристаллического ионного твердого вещества из газообразных ионов.
Определение энергии решетки
Энергия решетки — это оценка силы связи в ионных соединениях. Он определяется как теплота образования ионов противоположного заряда в газовой фазе для объединения в ионное твердое тело. — (g) \ rightarrow \ text {NaCl} (s) \; \; \; \; \; \; \; \; \; \; \; \; \; \; \; \ Delta H = -787,3 \ text {кДж / моль} [/ латекс]
— (g) \ rightarrow \ text {NaCl} (s) \; \; \; \; \; \; \; \; \; \; \; \; \; \; \; \ Delta H = -787,3 \ text {кДж / моль} [/ латекс]
Отрицательный знак энергии указывает на экзотермическую реакцию.
В качестве альтернативы, энергию решетки можно рассматривать как энергию, необходимую для разделения моля твердого ионного вещества на газообразную форму его ионов (то есть, обратная реакции, показанной выше).
Кристаллическая решетка NaCl : ионы натрия (Na + ) и ионы хлорида (Cl — ), изображенные фиолетовым и зеленым цветом соответственно, чередуются в кристаллической решетке твердого NaCl.
В качестве альтернативы, энергию решетки можно рассматривать как энергию, необходимую для разделения моля твердого ионного вещества на газообразную форму его ионов (то есть, обратная реакции, показанной выше).
Энергия решетки не может быть определена экспериментально из-за трудности выделения газообразных ионов. Значение энергии можно оценить с помощью цикла Борна-Габера или рассчитать теоретически с помощью электростатического исследования кристаллической структуры. 2} {4 \ pi \ epsilon_o r_o} (1- \ frac {1} {n}) [/ латекс]
2} {4 \ pi \ epsilon_o r_o} (1- \ frac {1} {n}) [/ латекс]
В этом уравнении N A — постоянная Авогадро; M — постоянная Маделунга, которая зависит от геометрии кристалла; z + — зарядовое число катиона; z — — зарядовое число аниона; е — элементарный заряд электрона; n — показатель Борна, характеристика сжимаемости твердого тела; [латекс] \ epsilon _o [/ латекс] — диэлектрическая проницаемость свободного пространства; а r 0 — расстояние до ближайшего иона.
Эта модель подчеркивает два основных фактора, которые вносят вклад в энергию решетки ионного твердого тела: заряд на ионах и радиус или размер ионов. Эффект этих факторов:
- по мере увеличения заряда ионов энергия решетки увеличивается
- по мере увеличения размера ионов энергия решетки уменьшается
Энергия решетки также важна для предсказания растворимости твердых ионных веществ в H 2 O. Ионные соединения с меньшей энергией решетки, как правило, более растворимы в H 2 O.
Энергия решетки — Учебное пособие по химии : В этом учебном пособии рассматривается энергия решетки и способы сравнения относительных энергий решетки различных ионных соединений.
Формулы ионных соединений
Ионные формулы должны соответствовать конфигурациям благородных газов для составляющих ионов, а соединение продукта должно быть электрически нейтральным.
Цели обучения
Применить знания об ионных связях для предсказания формулы ионных соединений
Ключевые выносы
Ключевые точки
- Заряд катионов и анионов в ионном соединении может быть определен по потере или усилению валентных электронов, необходимых для достижения стабильных электронных конфигураций благородных газов.
- Количество катионов и анионов, объединенных в ионное соединение, представляет собой простейшее соотношение целых чисел, которые можно объединить для достижения электрической нейтральности.

- Катион предшествует аниону как в письменной форме, так и в формуле.
Ключевые термины
- благородный газ : Любой из элементов 18 группы Периодической таблицы Менделеева, которые являются одноатомными и, за очень ограниченным исключением, инертными или инертными.
- электрически нейтральный : Чистый заряд, равный нулю, который возникает, когда атом или молекула / соединение не имеет избытка или дефицита электронов.
- эмпирическая формула : Простейшее целочисленное соотношение между элементами в формуле соединения.
- многоатомный ион : ион, состоящий из нескольких атомов.
Ионные соединения
Ионная связь образуется посредством переноса одного или нескольких валентных электронов, обычно от металла к неметаллу, в результате чего образуются катион и анион, которые связаны вместе электростатической силой притяжения. В макроскопическом масштабе ионные соединения, такие как хлорид натрия (NaCl), образуют кристаллическую решетку и являются твердыми веществами при нормальных температурах и давлениях.
Кристаллическая решетка : Кристаллическая решетка хлорида натрия
Заряд катионов и анионов определяется количеством электронов, необходимых для достижения стабильных электронных конфигураций благородных газов. Ионный состав затем определяется требованием, чтобы полученное соединение было в целом электрически нейтральным.
Например, чтобы объединить магний (Mg) и бром (Br), чтобы получить ионное соединение, сначала отметим электронные конфигурации этих атомов (уровень валентности указан курсивом):
Mg: 1s 2 2s 2 2p 6 3s2
Br: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s24p5
Чтобы получить конфигурацию благородного газа, атом магния должен потерять свои два валентных электрона, а атом брома, который имеет 7 валентных электронов, требует еще одного электрона для заполнения его внешней оболочки. Следовательно, чтобы полученное соединение было нейтральным, два аниона брома должны соединиться с одним катионом магния с образованием бромида магния (MgBr 2 ). Кроме того, хотя любое отношение 2 атомов брома к 1 атому магния будет удовлетворять двум вышеуказанным требованиям, формула для ионных соединений обычно представлена как эмпирическая формула или простейшее целочисленное отношение атомов с положительными целыми числами.
Следовательно, чтобы полученное соединение было нейтральным, два аниона брома должны соединиться с одним катионом магния с образованием бромида магния (MgBr 2 ). Кроме того, хотя любое отношение 2 атомов брома к 1 атому магния будет удовлетворять двум вышеуказанным требованиям, формула для ионных соединений обычно представлена как эмпирическая формула или простейшее целочисленное отношение атомов с положительными целыми числами.
Обратите внимание, что катион всегда предшествует аниону как в письменной форме, так и в формулах.В письменной форме, хотя название катиона, как правило, совпадает с названием элемента, суффикс одноатомных анионов изменяется на — ide, , как в случае хлорида натрия. Если анион является многоатомным ионом, его суффикс может варьироваться, но обычно это либо — ate , либо — ite, , как в случаях фосфата натрия и нитрита кальция, в зависимости от идентичности иона.
Другие примеры:
- фторид лития: Li + и F — объединяются с образованием LiF
- хлорид кальция: Ca 2+ и Cl — объединяются с образованием CaCl 2
- оксид железа (II): Fe 2+ и O 2- объединяются с образованием FeO
- сульфид алюминия: Al 3+ и S 2- объединяются с образованием Al 2 S 3
- сульфат натрия: Na + и SO 4 2- объединяются с образованием Na 2 SO 4
- фосфат аммония: NH 4+ и PO 4 3- объединяются с образованием (NH 4 ) 3 PO 4
- хлорит калия: K + и ClO 2 — объединяются с образованием KClO 2
Сводка видео
youtube.com/embed/bvFylpHrJJY?feature=oembed» frameborder=»0″ allowfullscreen=»»/>
Химия 5.3 Написание формул: ионные соединения — YouTube : Урок по написанию формул для бинарных ионных соединений, а также ионных соединений, содержащих многоатомные ионы. Продемонстрирован кроссоверный метод.
Характер ионной и ковалентной связи
Ионные связи могут иметь ковалентный характер.
Цели обучения
Обсудите идею о том, что в природе связи обладают характеристиками как ионных, так и ковалентных связей
Ключевые выносы
Ключевые точки
- Ионная связь представлена как полный перенос валентных электронов, обычно от металла к неметаллу.
- На самом деле электронная плотность остается общей между составляющими атомами, что означает, что все связи имеют некоторый ковалентный характер.
- Ионная или ковалентная природа связи определяется относительной электроотрицательностью задействованных атомов.

Ключевые термины
- полярная ковалентная связь : ковалентная связь, которая имеет частичный ионный характер в результате разницы в электроотрицательности между двумя связывающими атомами.
- электроотрицательность : мера тенденции атома притягивать электроны к себе.
- ковалентный символ : частичное распределение электронов между атомами, имеющими ионную связь.
Ионное и ковалентное связывание
Химические соединения часто классифицируют по связям между составляющими атомами. Есть несколько видов сил притяжения, включая ковалентные, ионные и металлические связи. Модели ионной связи обычно представлены как полная потеря или усиление одного или нескольких валентных электронов от металла к неметаллу, в результате чего катионы и анионы удерживаются вместе за счет притягивающих электростатических сил.
Ионная связь : Образование ионной связи между литием и фтором с образованием LiF.
Пример полярной ковалентной связи: Когда атом углерода образует связь с фтором, они разделяют пару электронов. Однако, поскольку фтор более электроотрицателен, чем углерод, он притягивает эту общую электронную пару ближе к себе и, таким образом, создает электрический диполь. Греческая дельта в нижнем регистре, написанная над атомами, используется для обозначения наличия частичных зарядов.Считается, что эта связь обладает характеристиками как ковалентных, так и ионных связей.
На самом деле связь между этими атомами более сложна, чем иллюстрирует эта модель. Связь, образованная между любыми двумя атомами, не является чисто ионной связью. Все связывающие взаимодействия носят ковалентный характер, поскольку электронная плотность остается общей для атомов. Степень ионного и ковалентного характера связи определяется разницей в электроотрицательности между составляющими атомами.Чем больше разница, тем более ионный характер связи. В обычном представлении связи обозначаются как ионные, когда ионный аспект больше, чем ковалентный аспект связи. Связи, которые находятся между двумя крайностями и имеют как ионный, так и ковалентный характер, классифицируются как полярные ковалентные связи. Такие связи считаются состоящими из частично заряженных положительных и отрицательных полюсов.
Связи, которые находятся между двумя крайностями и имеют как ионный, так и ковалентный характер, классифицируются как полярные ковалентные связи. Такие связи считаются состоящими из частично заряженных положительных и отрицательных полюсов.
Хотя ионный и ковалентный символы представляют собой точки вдоль континуума, эти обозначения часто полезны для понимания и сравнения макроскопических свойств ионных и ковалентных соединений.Например, ионные соединения обычно имеют более высокие температуры кипения и плавления, и они также обычно более растворимы в воде, чем ковалентные соединения.
Какие элементы образуют ионные связи?
ChemTeam: Какие элементы образуют ионные связи?Какие элементы образуют ионные связи?
Вернуться в меню связывания
Говоря современным языком, центральная идея ионной связи состоит в том, что электроны (один или несколько, в зависимости от элемента) перемещались между внешними кольцами (оболочками) соседних атомов.
1) Например, рассмотрим Na и Cl.
Натрий потерял бы один электрон и стал бы положительно заряженным, а хлор получил бы один электрон, став отрицательно заряженным.
Притяжение положительного / отрицательного заряда удерживает два иона вместе.
2) Другой пример, магний и кислород.
Магний потерял бы два электрона, становясь заряженными на +2, а кислород получил бы два электрона, становясь при этом заряженными на -2.
Притяжение положительного / отрицательного заряда (на этот раз + 2 / -2, в четыре раза больше, чем + 1 / -1 NaCl) удерживало бы два иона вместе.
3) Последний пример, Mg и Cl.
Магний потеряет два электрона, станет заряженным на +2, а два хлора (не один) каждый получит по одному электрону, каждый из которых станет заряженным -1 в процессе.
Три иона будут сцепляться (связываться) друг с другом за счет положительного / отрицательного притяжения между ионами.
Ионные связи возникают между металлами и неметаллами в периодической таблице.
Обратитесь к своей периодической таблице и изучите три столбца, озаглавленные Ли (не обращайте внимания на водород, если он там есть), Ве и В.Эти столбцы представляют большинство (не все) положительных партнеров, участвующих в ионной связи, за которую будет нести ответственность школьник.
В первом столбце (называемом щелочными металлами) есть Li, Na, K, Rb, Cs и Fr (учителя обычно игнорируют Fr, потому что он настолько радиоактивен, что его не существует в природе. Но это те мелочи, которые учителя любят прыгать на детей на тесте. Правильно?) Все эти ребята получают +1 по ионной связи.
Вторая колонка (называемая щелочноземельными металлами) содержит Be, Mg, Ca, Sr, Ba и Ra.Все это честная игра для учителя, и все имеют +2 в ионной связи.
Третий столбец возглавляет B, но обычно единственный интересующий атом в средней школе — это Al с его зарядом +3. Примером ионного соединения может быть AlCl 3 . Другие элементы в этой колонке демонстрируют такие сложные модели поведения, что их часто игнорируют в школьной химии.
Вот и все (на данный момент) для положительных, парней и девушек. Теперь о минусах.
Посмотрите на столбец, возглавляемый буквой F, и под ним вы увидите Cl, Br, I и At.(Вы можете «игнорировать» At по той же причине, что и Fr, указанное выше.) Все эти элементы получат один электрон при ионной связи и, следовательно, будут отрицательными.
Следующий столбец слева возглавляется буквой O. Наиболее частыми примерами из этого столбца являются O и S. Se и Te используются экономно. По? Неа. Получение двух электронов превращает эти атомы в два отрицательных заряда в ионной связи.
Наконец, столбец с буквой N наверху и буквой P чуть ниже. У этих ребят будет -3 по ионной связи.As и Sb редко встречаются в примерах средней школы, а Bi никогда не рассматривается как отрицательная тройка.
Три точки
- Все переходные металлы и редкоземельные металлы действуют как положительные элементы в ионной связи.
- Водород может участвовать в ионной связи.




 Какое из указанных веществ имеет ионную связь?
Какое из указанных веществ имеет ионную связь? Веществами с ионной и ковалентной неполярной связью являются, соответственно,
Веществами с ионной и ковалентной неполярной связью являются, соответственно, Какой вид химической связи в молекуле аммиака?
Какой вид химической связи в молекуле аммиака?



Leave A Comment