1 вариант | 2 вариант |
А1. Система записи информации о последовательности расположения аминокислот в молекуле белка с помощью аналогичного расположения нуклеотидов в и РНК – это:
3)Генетический код 4) трансляция | А1. Правилом перевода последовательности нуклеотидов в нуклеиновой кислоте в аминокислотную последовательность белка является:
2) транскрипция 3) генетический код 4) универсальность |
А2. Последовательность нуклеотидов участка молекулы ДНК, несущая информацию о первичной структуре одного белка,-это: 1) геном 2) генотип 3) ген 4) фенотип | А2. 3)фермент 4) генотип |
А3. Каждые три нуклеотида молекулы ДНК образуют:
3) аминокислоту 4) липид | А3. Каждые три нуклеотида молекулы ДНК образуют:
3)Кодон 4) аминокислоту |
А4. Каждый триплет кодирует только одну аминокислоту. Этим свойством генетического кода является:
3)Триплетность 4)вырожденность | А4. Одну аминокислоту кодирует последовательность из трех нуклеотидов. Этим свойством генетического кода является: 1) Универсальность 2)специфичность 3)Триплетность 4)вырожденность |
А5. 1) Универсальность 2)специфичность 3)Триплетность 4)вырожденность | А5. Каждая аминокислота зашифрована более чем одним кодоном. Этим свойством генетического кода является:
|
А6. Конечный нуклеотид одного триплета не может служить началом другого триплета. Этим свойством генетического является:
3)триплетность 4) универсальность | А6. Транскрипция – это:
|
А7.
3)репликация 4)трансляция | А7. С помощью молекул иРНК осуществляется передача наследственной информации:
|
А8.В процессе трансляции:
| А8.Процесс перевода последовательности нуклеотидов иРНК в последовательность аминокислот полипептидной цепи- это:
3)репликация 4) трансляция |
А9.
| А9.Процесс синтеза белковой молекулы осуществляется в:
3)рибосоме 4)ядре |
В1. Установите последовательность явлений и процессов, происходящих при биосинтезе белка. А. Образование пептидной связи Б. Синтез молекулы иРНК на ДНК В. Связывание молекулы иРНК с рибосомой Г. Поступление молекулы иРНК из ядра в цитоплазму Д.Процесс разрушения рибосомы Е. Взаимодействие тРНК с аминокислотой метионином, с белково-синтезирующим комплексом (рибосомой и иРНК) (В ответ запишите ряд букв) | В1.
Установите последовательность явлений
и процессов, происходящих в процессе
трансляции. А. Присоединение ко второму триплету иРНК транспортной РНК со второй аминокислотой В. Возникновение между метионином и второй аминокислотой пептидной связи Г. Перемещение рибосомы на один триплет Д. Разрушение рибосомы при достижении триплета терминации Е.Присоединение к первому триплету иРНК антикодона тРНК с аминокислотой метионин (В ответ запишите ряд букв) |
С1. Последовательность нуклеотидов фрагмента цепи ДНК: А-Г-Т-Т-Г-Г-Т-Т-А-Г-А-Г-Г-Т-Т Определите последовательность нуклеотидов в иРНК, аминокислот в полипептидной цепи. Что произойдет в полипептиде, если в результате мутации во фрагменте гена выпадает третий триплет нуклеотидов? Для выполнения задания используйте таблицу генетического кода. | С1.
Известно, что все виды РНК синтезируются
на ДНК. Ц-Ц-А-Г-Т-А-Ц-Г-Т-А-Г-Г-А-Ц-Т Определите кодон иРНК, к которому присоединяется эта тРНК, и аминокислоту, переносимую этой тРНК, если известно, что третий триплет ДНК шифрует её антикодон. Для выполнения задания используйте таблицу генетического кода. |
С2. Известно, что все виды РНК синтезируются на ДНК. Определите последовательность нуклеотидов в молекуле тРНК, если последовательность нуклеотидов фрагмента цепи ДНК: Г-А-Ц-А-Г-Т-Г-Т-А-Г-Ц-А-Т-Ц-Г Определите кодон иРНК, к которому присоединяется эта тРНК, и аминокислоту, переносимую этой тРНК, если известно, что третий триплет ДНК шифрует её антикодон. Для выполнения задания используйте таблицу генетического кода. | С2 Последовательность нуклеотидов фрагмента цепи ДНК: Г-Ц-Т-А-Ц-Г-А-Т-Г-Т-Г-А-Ц-А-Г
Определите последовательность
нуклеотидов в иРНК, аминокислот в
полипептидной цепи. |
325. С помощью матричных реакций в клетке эукариот синтезируются 1 ) нуклеотиды; 2) белки; 3) аминокислоты; 4) жиры; 5) ДНК; 6) РНК. | ||||
326. В основе каких реакций обмена лежит матричный принцип? 1) синтеза молекул АТФ; 2) сборки молекул белка из аминокислот; 3) синтеза глюкозы из углекислого газа и воды; 4) синтеза липидов. | ||||
327. 1) матричным характером реакций в клетке; 2) высокой скоростью химических реакций в клетке; 3) окислительным характером реакций в клетке; 4) восстановительным характером реакций в клетке. | ||||
328. Реакции биосинтеза белка, в которых последовательность триплетов в иРНК обеспечивает последовательность аминокислот в молекуле белка, называют: 1) гидролитическими; 2) матричными; 3) ферментативными; 4) окислительными. | ||||
329. 1) реакции носят матричный характер: белок синтезируется на иРНК; 2) реакции происходят с освобождением энергии; 3) на химические реакции расходуется энергия молекул АТФ; 4) реакции сопровождаются синтезом молекул АТФ; 5) ускорение реакций осуществляется ферментами; 6) синтез белка происходит на внутренней мембране митохондрий. | ||||
330. Биосинтез белка, в отличие от фотосинтеза, характеризуется тем, что: 1
) происходит в хлоропластах; 2) происходит
на рибосомах; 3) используется энергия
солнечного света; 4)
сопровождается синтезом молекул АТФ;
5) активное участие принимают нуклеиновые
кислоты; 6) основными механизмами
являются реакции матричного синтеза. | ||||
331. В чем проявляется взаимосвязь биосинтеза белка и окисления органических веществ? 1 ) в процессе окисления органических веществ освобождается энергия, которая расходуется в ходе биосинтеза белка; 2) в процессе биосинтеза образуются органические вещества, которые используются в ходе окисления; 3) в процессе фотосинтеза используется энергия солнечного света; 4) через плазматическую мембрану в клетку поступает вода. | ||||
332. Белки в клетке синтезируются: 1)
в цитоплазме; 2) в лизосомах; 3) на
рибосомах; 4) в комплексе Гольджи. | ||||
ЗЗЗ.+Биосинтез некоторых белков происходит 1) на гладкой ЭПС; 2) в комплексе Гольджи; 3) в лизосомах; 4) в митохондриях. | ||||
З34.Синтез белка не происходит в: 1) цитоплазме; 2) лизосомах; 3) эндоплазматическом ретикулуме; 4) митохондриях. | ||||
335. Хранителем наследственности в клетке являются молекулы ДНК, так как в них закодирована информация о: 1
) первичной структуре молекул белка:
2) составе молекулы АТФ; 3) строении
триплета; 4) строении аминокислот. | ||||
336. Наследственная информация в клетках грибов заключена в: 1) рРНК; 2) тРНК; 3) белках: 4) генах. | ||||
337. Молекулы ДНК представляют собой материальную основу наследственности, так как в них закодирована информация о структуре молекул: 1) полисахаридов; 2) белков; 3) липидов; 4) аминокислот. | ||||
338. Программа о первичной структуре молекул белка зашифрована в молекулах: 1)
тРНК; 2) ДНК; 3) липидов; 4) полисахаридов. | ||||
339. Участок ДНК, содержащий информацию об одной полипептидной цепи, называют: 1) хромосомой; 2) триплетом; 3) геном; 4) кодом. | ||||
340. Отрезок молекулы ДНК, содержащий информацию о первичной структуре полипептидной цепи, называют: 1) геном; 2) кодоном; 3) генетическим кодом; 4) триплетом. | ||||
341. Генетический код определяет принцип записи информации о: 1) транспорте иРНК в клетке; 2) расположении глюкозы в молекуле крахмала; 3)
последовательности аминокислот
в молекуле белка; 4) числе рибосом на
эндоплазматической сети. | ||||
342. Единицей генетического кода является: 1) нуклеотид; 2) триплет; 3) аминокислота; 4) тРНК. | ||||
343. Три рядом расположенных нуклеотида в молекуле ДНК, кодирующих одну аминокислоты, называют: 1) триплетом; 2) генетическим кодом; 3) геном; 4) генотипом. | ||||
344. Определенной последовательностью трех нуклеотидов зашифрована в клетке каждая молекула: 1)
глюкозы; 2) аминокислоты; 3) крахмала;
4) глицерина. | ||||
345.Триплетность, специфичность, универсальность, неперекрываемость — это свойства: 1) генотипа; 2) генома; 3) генетического кода; 4) генофонда популяции. | ||||
346. Единство генетического кода всех живых существ на Земле проявляется в его: 1) триплетноети; 2) однозначности; 3) специфичности; 4) универсальности. | ||||
347. 1)ДНК→ информационная РНК→ белок; 2) ДНК→ транспортная РНК → белок; 3) рибосомальная РНК → транспортная РНК → белок; 4) рибосомальная РНК→ ДНК→ транспортная РНК→ белок. | ||||
348.Установите соответствие между этапом биосинтеза белка и его признаками. ЭТАПЫ БИОСИНТЕЗА БЕЛКА: 1 ) транскрипция; 2) трансляция. | ||||
— происходит в рибосомах | ||||
— происходит синтез иРНК | ||||
— происходит на участке ДНК | ||||
— тРНК переносят аминокислоты к месту синтеза белка | ||||
— происходит передача информации от иРНК к тРНК | ||||
349. А) на одной из цепей ДНК синтезируется иРНК; Б) участок молекулы ДНК под воздействием ферментов расщепляется на две цепи; В) иРНК перемещается в цитоплазму; Г) на иРНК, служащей матрицей, происходит синтез белка. | ||||
З50.Последовательность реакций матричного синтеза белка: А)
объединение иРНК с рибосомой; Б)
ферментативный разрыв водородных
связей молекулы ДНК; В) синтез иРНК
на участке одной из цепей ДНК и выход
из ядра; Г) объединение тРНК с рибосомой
и узнавание своего кодона; Д)
присоединение аминокислоты к тРНК;
Е) отделение аминокислоты от тРНК и
присоединение к образовавшейся
цепочке аминокислот. | ||||
351. Установите последовательность процессов биосинтеза белка в клетке: А) синтез иРНК на ДНК; Б) присоединение аминокислоты к тРНК и доставка аминокислоты к рибосоме; В) перемещение иРНК из ядра к рибосоме; Г) нанизывание рибосом на иРНК; Д) присоединение двух молекул тРНК с аминокислотами к иРНК; Е) взаимодействие аминокислот, присоединенных к иРНК, образование пептидной связи. | ||||
352. Установите последовательность процессов, происходящих на рибосоме: А)
тРНК отрывается от иРНК и выталкивается
из рибосомы; Б) рибосома нанизывается
на иРНК, в ней размещается два триплета:
В) к двум триплетам присоединяются
два комплементарных триплета тРНК с
аминокислотами; Г) рибосома перемещается
на соседний триплет, к которому тРНК
доставляет новую аминокислоту; Д)
рядом расположенные аминокислоты на
рибосоме взаимодействуют с образованием
пептидной связи. | ||||
353. Первичная структура молекулы белка, заданная последовательностью нуклеотидов иРНК, формируется в процессе: 1) трансляции; 2) транскрипции; 3) редупликации; 4) денатурации. | ||||
354. Роль матрицы в синтезе молекул иРНК выполняет: 1) полипептидная нить; 2) плазматическая мембрана; 3) мембрана эндоплазматической сети; 4) одна из цепей молекулы ДНК. | ||||
355. 1) ДНК; 2) тРНК; 3) АТФ; 4) иРНК. | ||||
356. Информация о последовательности расположения аминокислот в молекуле белка переписывается в ядре с молекулы ДНК на молекулу: 1) АТФ; 2) рРНК; 3) тРНК: 4) иРНК. | ||||
357. Матрицей для трансляции служит: 1) тРНК; 2) ДНК; 3) рРНК; 4) иРНК. | ||||
358. 1) из ядра к митохондрии; 2) из одной клетки в другую; 3) из ядра к рибосоме; 4) из цитоплазмы в ядро. | ||||
359. Синтез какого вещества происходит в ядре? 1) белка; 2) глюкозы; 3) иРНК; 4) тРНК. | ||||
З6О.Какую роль выполняет иРНК в клетке: 1) переписывает наследственную информацию с ДНК; 2) переносит наследственную информацию из ядра на рибосомы; 3) доставляет аминокислоты к рибосоме; 4) служит матрицей для синтеза полипептидной цепи; 5)
участвует в реакциях гликолиза; 6)
ускоряет реакции клеточного обмена. | ||||
361. Молекулы иРНК в отличие от тРНК: 1 ) служат матрицей для синтеза белка; 2) служат матрицей для синтеза тРНК; 3) доставляют аминокислоты к рибосоме; 4) переносят ферменты к рибосоме. | ||||
362. В рибосоме при биосинтезе белка располагаются два триплета иРНК, к которым в соответствии с принципом комплементарности присоединяются кодовые триплеты: 1) ДНК; 2) рРНК; 3) белка; 4) тРНК. | ||||
363. 1) рРНК; 2) тРНК; 3) мРНК; 4) иРНК. | ||||
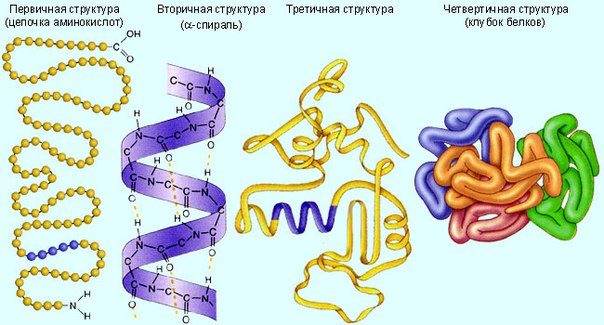
364. Установите, в какой последовательности образуются структуры молекулы белка. А) полипептидная цепь; Б) клубок или глобула; В) полипептидная спираль; Г) структура из нескольких субъединиц. | ||||
З65.Расположите молекулы в порядке увеличения их размера: А) ДНК; Б) АТФ; В) глюкоза; Г) кислород; Д) белок; Е) РНК этого белка. | ||||
366. | ||||
367.Белок состоит из 50 аминокислот. Сколько нуклеотидов в гене, в котором закодирована первичная структура этого белка? | ||||
368. Белок состоит из 180 аминокислотных остатков. Сколько нуклеотидов в гене, в котором закодирована последовательность аминокислот в этом белке? | ||||
369. | ||||
370. В двух цепях молекулы ДНК насчитывается 3000 нуклеотидов. В ДНК зашифровано аминокислот: | ||||
371.Какое число аминокислот в белке, если его кодирующий ген состоит из 600 нуклеотидов | ||||
372. В молекуле ДНК
100 нуклеотидов с тимином, что составляет
10 % от общего количества. | ||||
373. В молекуле ДНК количество нуклеотидов с гуанином составляет 10% от общего числа. Сколько нуклеотидов с аденином в этой молекуле? | ||||
374. Какой процент нуклеотидов с цитозином содержит ДНК, если доля её адениновых нуклеотидов составляет 10% от общего числа? | ||||
375. В иРНК содержание
аденина составляет 22%, ни тот на — 27%,
гуанина — 23% и урацила — 28%. | ||||
376. Антикодону ААГ на тРНК соответствует триплет на ДНК: | ||||
377. Антикодону ААУ на транспортной РНК соответствует триплет на ДНК | ||||
378. Антикодону УГЦ на транспортной РНК соответствует триплет на ДНК: | ||||
379. | ||||
380. Аминокислоте соответствует антикодон ЦЦУ тРНК и триплет в молекуле ДНК: | ||||
381. Какой триплет на ДНК соответствует кодону УГЦ на иРНК | ||||
382. Какой триплет в молекуле информационной РНК соответствует кодовому триплету ААТ в молекуле ДНК |
Тест «Биосинтез белка»
1. Сколько аминокислот кодирует 900 нуклеотидов
Сколько аминокислот кодирует 900 нуклеотидов
1) 100
2) 200
3) 300
4) 400
2. В процессе пластического обмена
1) более сложные углеводы синтезируются из менее сложных
2) жиры превращаются в глицерин и жирные кислоты
3) белки окисляются с образованием углекислого газа, воды, азотсодержащих веществ
4) происходит освобождение энергии и синтез АТФ
3. Единый аппарат биосинтеза белка
1) эндоплазматическая сеть и рибосомы
2) митохондрии и клеточный центр
3) хлоропласты и комплекс Гольджи
4) лизосомы и плазматическая мембрана
4. Принцип комплементарности (дополнительности) лежит в основе взаимодействия
1) аминокислот и образования первичной структуры белка
2) нуклеотидов и образования двуцепочечной молекулы ДНК
3) глюкозы и образования молекулы полисахарида клетчатки
4) глицерина и жирных кислот и образования молекулы жира
5. Принцип комплементарности лежит в основе образования водородных связей между
Принцип комплементарности лежит в основе образования водородных связей между
1) аминокислотами и молекулами белка
2) нуклеотидами в молекуле ДНК
3) глицерином и жирной кислотой в молекуле жира
4) глюкозой в молекуле клетчатки
6. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
7. Пластический обмен в клетках животных не может происходить без энергетического, так как энергетический обмен обеспечивает клетку
1) ферментами
2) молекулами белка
3) молекулами АТФ
4) кислородом
8. Сходство процесса обмена веществ в клетках растений и животных состоит в том, что в них происходит
1) образование гемоглобина
2) биосинтез белка
3) хемосинтез
4) брожение
9. Матрицей для трансляции служит молекула
Матрицей для трансляции служит молекула
1) тРНК
2) ДНК
3) рРНК
4) иРНК
10. Роль матрицы в синтезе молекул и-РНК выполняет
1) полипептидная нить
2) плазматическая мембрана
3) мембрана эндоплазматической сети
4) одна из цепей молекулы ДНК
11. Информация о последовательности расположения аминокислот в молекуле белка переписывается в ядре с молекулы ДНК на молекулу
1) АТФ
2) р-РНК
3) т-РНК
4) и-РНК
12. В рибосоме при биосинтезе белка располагаются два триплета и-РНК, к которым в соответствии с принципом комплементарности присоединяются кодовые триплеты
1) ДНК
2) р-РНК
3) белка
4) т-РНК
13.В основе каких реакций обмена лежит матричный принцип
1) синтеза молекул АТФ
2) сборки молекул белка из аминокислот
3) синтеза глюкозы из углекислого газа и воды
4) образования липидов
14. Все реакции синтеза органических веществ в клетке происходят с
Все реакции синтеза органических веществ в клетке происходят с
1)
Тест по биологии «Биосинтез белка. Подготовка к егэ на тему «биосинтез белка» Синтез молекулы белка завершается в момент
Биосинтез белка.
1. Структура одного белка определяется:
1)группой генов 2)одним геном
3)одной молекулой ДНК 4)совокупностью генов организма
2. Ген кодирует информацию о последовательности мономеров в молекуле:
1)т-РНК 2) АК 3) гликогена 4) ДНК
3. Антикодонами называются триплеты:
1)ДНК 2) т-РНК 3)и-РНК 4) р-РНК
4. Пластический обмен состоит преимущественно из реакций:
1)распада органических веществ 2)распада неорганических веществ
3)синтеза органических веществ 4)синтеза неорганических веществ
5. Синтез белка в прокариотической клетке происходит:
1)на рибосомах в ядре 2)на рибосомах в цитоплазме 3)в клеточной стенке
4)на внешней поверхности цитоплазматической мембраны
6. Процесс трансляции происходит:
Процесс трансляции происходит:
1)в цитоплазме 2)в ядре 3)в митохондриях
4)на мембранах шероховатой эндоплазматической сети
7. На мембранах гранулярной эндоплазматической сети происходит синтез:
1)АТФ; 2)углеводов; 3) липидов; 4)белков.
8. Один триплет кодирует:
1.одну АК 2 один признак организма 3. несколько АК
9. Синтез белка завершается в момент
1.узнавание кодона антикодоном 2.появление на рибосоме «знака препинания»
3.поступление и-РНК на рибосому
10. Процесс, в результате которого происходит считывание информации с молекулы ДНК.
1.трансляция 2.транскрипция 3.трансформация
11. Свойства белков определяется…
1.вторичной структурой белка 2.первичной структурой белка
3.третичной структурой белка
12. Процесс, при котором антикодон узнаёт кодон на и-РНК
13. Этапы биосинтеза белка.
1.транскрипция, трансляция 2. трансформация, трансляция
трансформация, трансляция
3.трансорганизация, транскрипция
14. Антикодон т-РНК состоит из нуклеотидов УЦГ. Какой триплет ДНК ему комплементарен ?
1.УУГ 2. ТТЦ 3. ТЦГ
15. Количество т-РНК, участвующих в трансляции, равно количеству:
1.Кодонов и-РНК, шифрующих аминокислоты 2. Молекул и-РНК
3 Генов, входящих в молекулу ДНК 4. Белков, синтезируемых на рибосомах
16. Установите последовательность расположения нуклеотидов и-РНК при транскрипции с одной из цепей ДНК: А-Г-Т-Ц-Г
1) У 2) Г 3) Ц 4) А 5) Ц
17. При репликации молекулы ДНК образуется:
1) нить, распавшаяся на отдельные фрагменты дочерних молекул
2) молекула, состоящая из двух новых цепей ДНК
3) молекула, половина которой состоит из нити иРНК
4) дочерняя молекула, состоящая из одной старой и одной новой цепи ДНК
18. Матрицей для синтеза молекулы иРНК при транскрипции служит:
1) вся молекула ДНК 2) полностью одна из цепей молекулы ДНК
3) участок одной из цепей ДНК
4) в одних случаях одна из цепей молекулы ДНК, в других– вся молекула ДНК.
19.Процесс самоудвоения молекулы ДНК.
1.репликация 2.репарация
3. реанкорнация
20. При биосинтезе белка в клетке энергия АТФ:
1) расходуется 2) запасается
3) не расходуется и не выделяется
21. В соматических клетках многоклеточного организма:
1) различный набор генов и белков 2) одинаковый набор генов и белков
3) одинаковый набор генов, но разный набор белков
4) одинаковый набор белков, но разный набор генов
22.. Один триплет ДНК несет информацию о:
1)последовательности аминокислот в молекуле белка
2)признаке организма 3)аминокислоте в молекуле синтезируемого белка
4)составе молекулы РНК
23. Какой из процессов не происходит в клетках любого строения и функции:
1)синтез белков 2) обмен веществ 3)митоз 4) мейоз
24. Понятие «транскрипция» относится к процессу:
1)удвоения ДНК 2)синтеза и-РНК на ДНК
3)перехода и-РНК на рибосомы 4)создания белковых молекул на полисоме
25. Участок молекулы ДНК, несущий информацию об одной молекуле белка — это:
Участок молекулы ДНК, несущий информацию об одной молекуле белка — это:
1)ген 2)фенотип 3)геном 4)генотип
26. Транскрипция у эукариот происходит в:
1)цитоплазме 2)эндоплазматической мембране 3)лизосомах 4)ядре
27.Синтез белка происходит в:
1)гранулярном эндоплазматическом ретикулуме
2)гладком эндоплазматическом ретикулуме 3)ядре 4) лизосомах
28. Одна аминокислота кодируется:
1)четырьмя нуклеотидами 2)двумя нуклеотидами
3)одним нуклеотидом 4) тремя нуклеотидами
29. Триплету нуклеотидов АТЦ в молекуле ДНК будет соответствовать кодон молекулы и-РНК:
1) ТАГ 2) УАГ 3) УТЦ 4) ЦАУ
30. Знаки препинания генетического кода:
1.кодируют определённые белки 2. запускают синтез белка
3. прекращают синтез белка
31. Процесс самоудвоения молекулы ДНК.
1.репликация 2.репарация 3.реанкорнация
32. Функция и-РНК в процессе биосинтеза.
1.хранение наследственной информации 2.транспорт АК на рибосомы
3.подача информации на рибосомы
33. Процесс, когда т-РНК приносят аминокислоты на рибосомы.
1.транскрипция 2.трансляция 3.трансформация
34. Рибосомы, синтезирующие одну и ту же белковую молекулу.
1.хромосома 2.полисома 3.мегахромосома
35. Процесс, при котором аминокислоты образуют белковую молекулу.
1.транскрипция 2.трансляция 3.трансформация
36. К реакциям матричного синтеза относят…
1.репликацию ДНК 2.транскрипцию, трансляцию 3.оба ответа правильные
37.Один триплет ДНК несет информацию о:
1.Последовательности аминокислот в молекуле белка
2.Месте определенной АК в белковой цепи
3.Признаке конкретного организма
4.Аминокислоте, включаемой в белковую цепь
38. В гене закодирована информация о:
1) строении белков, жиров и углеводов 2) первичной структуре белка
3) последовательности нуклеотидов в ДНК
4) последовательности аминокислот в 2-х и более молекулах белков
39. Синтез иРНК начинается с:
Синтез иРНК начинается с:
1) разъединения ДНК на две нити 2) взаимодействия фермента РНК — полимеразы и гена
3) удвоения гена 4) распада гена на нуклеотиды
40. Транскрипция происходит:
1) в ядре 2) на рибосомах 3) в цитоплазме 4) на каналах гладкой ЭПС
41. Синтез белка не идет на рибосомах у:
1) возбудителя туберкулеза 2) пчелы 3) мухомора 4) бактериофага
42. При трансляции матрицей для сборки полипептидной цепи белка служат:
1) обе цепочки ДНК 2) одна из цепей молекулы ДНК
3) молекула иРНК 4) в одних случаях одна из цепей ДНК, в других– молекула иРНК
1-В А Р И А Н Т
Часть А
1. Материальным носителем наследственной информации в клетке является:
а) иРНК б) тРНК в) ДНК г) хромосомы
2. ДНК клетки несет информацию о строении:
а) белков, жиров, углеводов в) белков и жиров
б) аминокислот г) белков
3. Какой из нуклеотидов не входит в состав ДНК?
Какой из нуклеотидов не входит в состав ДНК?
а) тимин; б) урацил; в) гуанин; г) цитозин; д) аденин.
4. Сколько новых одинарных нитей синтезируется при удвоении одной молекулы?
а) четыре; б) две; в) одна; г) три
5. Какой из фактов подтверждает, что ДНК является генетическим материалом клетки?
а) количество ДНК во всех клетках организма постоянно
б) ДНК состоит из нуклеотидов
в) ДНК локализована в ядре клетки
г) ДНК представляет собой двойную спираль
6. Если нуклеотидный состав ДНК –АТА-ГЦГ-ТАТ-, то каким должен быть нуклеотидный состав иРНК?
а) –ТАА-ЦГЦ-УУА- в) –УАУ-ЦГЦ-АУА-
б) –ТАА-ГЦГ-УТУ- г) –УАА-ЦГЦ-АТА-
7. Синтез иРНК начинается:
а) с разъединения молекулы ДНК на две нити
б) с удвоения каждой нити
в) с взаимодействия РНК-полимеразы и гена
г) с расщепления гена на нуклеотиды
8. Где синтезируется иРНК?
а) в рибосомах в) в ядрышке
б) в цитоплазме г) в ядре
9. Аминокислота глутамин кодируется кодоном ГАА. Какой триплет ДНК несет информацию об этой аминокислоте?
Аминокислота глутамин кодируется кодоном ГАА. Какой триплет ДНК несет информацию об этой аминокислоте?
а) ГТТ б) ЦАА в) ЦУУ г) ЦТТ
10. Какую информацию содержит один триплет ДНК?
а) информацию о последовательности аминокислот в белке
б) информацию об одном признаке организма
в) информацию об одной аминокислоте, включаемой в белковую цепь
г) информацию о начале о начале синтеза иРНК
11. Каким из указанных триплетов может быть прекращен синтез полипептидной цепи?
а) ГАУ б) ААГ в) УАА г) АГУ
12.Трансляция – это:
а) синтез полипептидной цепи на рибосомах
б) синтез тРНК
в) синтез иРНК по матрице ДНК
г) синтез рРНК
13. Количество тРНК равно:
а) количеству всех кодонов ДНК
б) количеству кодонов иРНК, шифрующих аминокислоты
в) количеству генов
г) количеству белков клетке
14. Синтез белка завершается в момент:
а) появления на рибосоме «знака препинания»
б) истощения запасов ферментов
в) узнавания кодоном антикодона
г) присоединения аминокислоты к тРНК
15. В каких из перечисленных реакций участвуют ферменты?
В каких из перечисленных реакций участвуют ферменты?
а) в синтезе иРНК
б) во взаимодействии тРНК с аминокислотой
в) в сборке белковой молекулы
г) во всех указанных реакциях
16. Известно, что клетки многоклеточного организма имеют одинаковую генетическую информацию, но содержат разные белки. Какая из гипотез, объясняющих этот факт, наиболее верна?
а) разнообразие белков не зависит от особенностей клетки
б) в каждом типе клеток реализуется только часть генетической информации организма
в) присутствие белков в клетке не зависит от генетической информации
17. Кодовой единицей генетического кода является:
а) нуклеотид в) триплет
б) аминокислота г) тРНК
18. В ядре информация о последовательности аминокислот в молекуле белка с молекулы ДНК переписывается на молекулу:
А) глюкозы; б) тРНК; в) иРНК; г) АТФ
19. Транспортная РНК – это
а) аминокислота в) липид
б) глюкоза г) нуклеиновая кислота
20. Если антикодоны тРНК состоят только из триплетов АУА, то из какой аминокислоты будет синтезироваться белок?
Если антикодоны тРНК состоят только из триплетов АУА, то из какой аминокислоты будет синтезироваться белок?
а) из цистеина в) из тирозина
б) из триптофана г) из фенилаланина
21. Сколько нуклеотидов в гене, кодирующем последовательность 60 аминокислот в молекуле белка?
А) 60 б) 120 в) 180 г) 240
Часть В.
В1.
Каковы особенности реакций биосинтеза белка в клетке?
а) реакции носят матричный характер: белок синтезируется на иРНК
б) реакции происходят с освобождением энергии
в) ускорение реакций осуществляется ферментами
е) синтез белка происходит на внутренней мембране митохондрий
В2 . Дайте определения терминам
1.Реакции матричного синтеза — ………
2. Ген — ………………
3. Интрон — ………………….
4. Процессинг — ……………..
5. РНК-полимераза -……………….
6. Код коллинеарен — ……………..
7. Код непекрываем — …………………
8. Код однозначен — ……………. .
.
Часть С . Дайте развернутый ответ .
С1 . Механизм транскрипции.
С2 . Регуляция биосинтеза белка у прокариот на примере лактозного оперона Е.соli
С3 . Решить задачи:
№1 . Белковая молекула состоит из следующих аминокислот: -аргинин- лизин-аланин-пролин-лейцин-валин-. Как изменится структура белка, если в кодирующем гене произойдет замена гуанина(всех) на цитозин.
№2 . Белок состоит из 245 аминокислот. Определить длину гена, кодирующего данный полипептид и вычислить что будет тяжелее и во сколько раз: белок или ген?
Контрольная работа «Биосинтез белков. Регуляция биосинтеза»
2-В А Р И А Н Т
Часть А Выберите один правильный ответ.
1. В основе индивидуальности, специфичности организмов лежит:
а) строение белков организма в) строение клеток
б) функции клеток г) строение аминокислот
2. В одном гене закодирована информация:
а) о структуре нескольких белков
б) о структуре одной из цепей ДНК
в) о первичной структуре одной молекулы белка
г) о структуре аминокислоты
3. Какие связи разрываются в молекуле ДНК при ее удвоении?
Какие связи разрываются в молекуле ДНК при ее удвоении?
а) пептидные
б) ковалентные, между углеводом и фосфатом
в) водородные между двумя нитями молекулы
г) ионные
4. Какая из схем удвоения ДНК правильна?
а) молекула ДНК при удвоении образует совершенно новую дочернюю молекулу
б) дочерняя молекула ДНК состоит из одной старой и одной новой цепи
в) материнская ДНК распадается на мелкие фрагменты
5. В какой из названных клеток человека нет ДНК?
а) зрелый лейкоцит в) лимфоцит
б) зрелый эритроцит г) нейрон
6. Транскрипцией называется:
а) процесс образования иРНК
б) процесс удвоения ДНК
в) процесс образования белковой цепи на рибосомах
г) процесс соединения тРНК с аминокислотами
7. Аминокислота триптофан кодируется кодоном УГГ. Какой триплет ДНК несет информацию об этой аминокислоте?
А) АЦЦ б) ТЦЦ в) УЦЦ г) АТГ
8. Где синтезируется рРНК?
а) в рибосомах в) в ядрышке
б) в цитоплазме г) в ядре
9. Как будет выглядеть участок цепи иРНК, если второй нуклеотид первого триплета в ДНК (-ГЦТ-АГТ-ЦЦА-) будет заменен на нуклеотид Т?
Как будет выглядеть участок цепи иРНК, если второй нуклеотид первого триплета в ДНК (-ГЦТ-АГТ-ЦЦА-) будет заменен на нуклеотид Т?
а) –ЦГА-УЦА-ГГТ- в) –ГУУ-АГУ-ЦЦА-
б) – ЦАА-УЦА-ГГУ- г) –ЦЦУ-УЦУ-ГГУ-
10.Какой из ферментов осуществляет синтез иРНК?
а) РНК-синтетаза
б) РНК-полимераза
в) ДНК-полимераза
11. Код ДНК вырожден потому что:
а) одна аминокислота шифруется одним кодоном
б) несколько аминокислот шифруется одним кодоном
в) между кодонами одного гена есть «знаки препинания»
г) одна аминокислота шифруется несколькими кодонами
12. Антикодоны тРНК комплементарны:
а) кодонам рРНК в) кодонам иРНК
б) кодонам ДНК г) всем указанным кодонам
13.Второй этап синтеза белка заключается:
а) в узнавании и присоединении аминокислоты к тРНК
б) в переписывании информации с ДНК
в) в отрыве аминокислоты от тРНК на рибосоме
г) в объединении аминокислот в белковую цепь
14. На полисоме синтезируется:
На полисоме синтезируется:
а) одна молекула белка
б) несколько молекул различных белков
в) несколько молекул одинаковых белков
г) возможны все варианты
15. Присоединение аминокислоты к тРНК идет:
а) с выделением энергии
б) с поглощением энергии
в) не сопровождается энергетическим эффектом
16. Какая из перечисленных реакций соответствует стадии элонгации трансляции:
а) снятие информации с ДНК
б) узнавание антикодоном тРНК своего кодона на иРНК
в) отщепление аминокислоты от тРНК
г) поступление иРНК на рибосомы
д) присоединение аминокислоты к белковой цепи с помощью фермента
17. Однозначность генетического кода проявляется в том, что каждый триплет кодирует:
а) несколько аминокислот
б) не более двух аминокислот
в) три аминокислоты
г) одну аминокислоту
18. Соответствие триплета тРНК триплету в иРНК лежит в основе:
а) взаимодействия тРНК с аминокислотой
б) передвижения рибосомы по иРНК
в) перемещения тРНК в цитоплазме
г) определения места аминокислоты в молекуле белка
19. «Знаки препинания» между генами – это кодоны (триплеты):
«Знаки препинания» между генами – это кодоны (триплеты):
а) не кодирующие аминокислот
б) на которых кончается транскрипция
в) на которых начинается транскрипция
г) на которых начинается трансляция
20. Какой триплет тРНК комплементарен кодону иРНК?
а) ЦГТ; б) АГЦ; в) ГЦТ; г) ЦГА
21. Молекулы ДНК представляют собой материальную основу наследственности, так как в них закодирована информация о структуре молекул:
а) полисахаридов в) белков
б) липидов г) аминокислот
Часть В.
В1. Выберите три правильных ответа
В чем проявляется взаимосвязь биосинтеза белка и окисления органических веществ?
а) в процессе окисления органических веществ освобождается энергия, которая расходуется в ходе биосинтеза белка
б) в процессе биосинтеза образуются органические вещества, которые используются входе окисления
в) в процессе фотосинтеза используется энергия солнечного света
г) через плазматическую мембрану в клетку поступает вода
д) в процессе биосинтеза образуются ферменты, которые ускоряют реакции окисления
е) реакции биосинтеза белка происходят в рибосомах с выделением энергии
В2 .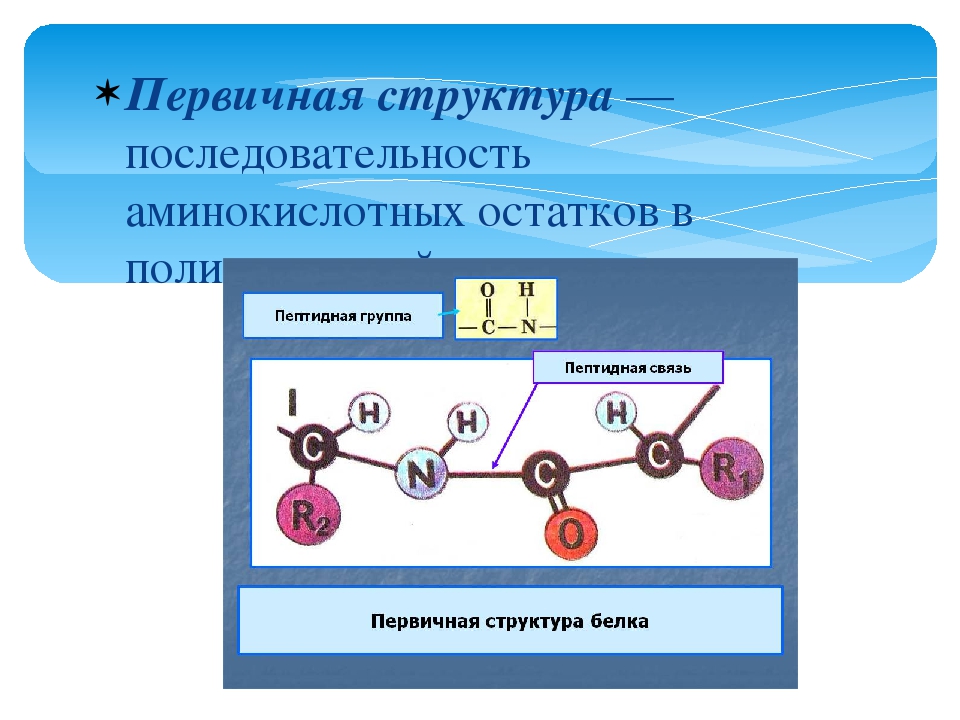 Дайте определения терминам
Дайте определения терминам
1.Репликация — ………
2. Генетический код — …………………
3. Экзон -…………….
4. Сплайсинг — ……………….
5. Хеликаза (Геликаза) -…………………
6. Код вырожден -………….
7. Код универсален — ……………
8. Стоп-кодоны (Терминаторы синтеза) —
Часть С . Дайте развернутый ответ .
С1 . Механизм трансляции.
С2 . Отличия биосинтеза белка у прокариот и эукариот
С3 . Решить задачи:
№1 . Как отразится на структуре синтезиремого белка замещение третьего нуклеотида во втором триплете на цитозин, если исходная ДНК имела следующий вид: ЦГААЦААГГГЦАТЦГ.
№2 . Молекулярная масса ДНК составляет 248400, на долю гуаниловых нуклеотидов приходится 24840. Определить содержание каждого вида нуклеотидов в этой ДНК (в т.ч. в %), длину ДНК, количество аминокислот в синтезируемом белке, массу белка. Вычислить, что тяжелее и во сколько раз: ген или белок?
энергии для реакции
E. Мономер белка
Мономер белка
F Группа нуклеотидов, кодирующих одну аминокислоту
соединения
2. Триплеты ДНК
3. Рибосома
4. РНК- полимераза
5. Аминокислота
нужно соотнести вещества и структуры, участвующие в синтезе белка с их функциями
1.какой тип РНК переносит наследственную информацию от ДНК к месту синтеза белка?2.какой тип РНК переносит аминокислоты к месту синтеза белка?
3.какой тип РНК переносит наследственную информацию из ядра в цитоплазму?
4.у каких организмов процессы транскрипции и трансляции не разделяются во времени и в пространстве?
5.сколько нуклеотидов иРНК включает в себя «функциональный центр»рибосомы?
6.сколько аминокислот должно одновременно находиться в большой субъединице рибосомы?
7.сколько генов могут включать в себя иРНК прокариот?
8.сколько генов могут включать в себя иРНК эукариот?
9.когда рибосома доходит до СТОП-кодона, она присоединяет к последней аминокислоте молекулу
10.если на одной иРНК одновременно находятся много рибосом, такая структура называется
11. для биосинтеза белка, как и для других процессов в клетке, используется энергия
для биосинтеза белка, как и для других процессов в клетке, используется энергия
2. Как называются структуры ядра, хранящие информацию о белках организма?
3. Какая молекула является матрицей (шаблоном) для синтеза и-РНК?
4. Как называется процесс синтеза полипептидной цепи белка на рибосоме?
5. На какой молекуле находится триплет называемый кодон?
6. На какой молекуле находится триплет называемый антикодон?
7. По какому принципу антикодон узнает кодон?
8. Где в клетке происходит образование комплекса т-РНК+аминокислота?
9. Как называется первый этап биосинтеза белка?
10. Дана полипептидная цепь: -ВАЛ — АРГ — АСП- Определить структуру соответствующих цепей ДНК.
лизосомы в митохондрии г клеточный центр 4 все в- ва и клетки можно разделить на 1 белки и углеводы 2 углеводы и жиры 3 жиры и неорганические в-ва 4 неоганические в -ва и органические 5 процесс слзревания специализации клетки называется 6 окисление органических в-в и синтез атф прлисходит в 7 передача информации от одной нервной клетки другой переходит через 8 при нврушении работы имунной системы 1 ослабевает защита от чужеродных тел2 газообмен 3 замедляется двигательная активность 4 нарушается транспорт в -в
В обмене веществ организма ведущая роль принадлежит белкам и нуклеиновым кислотам.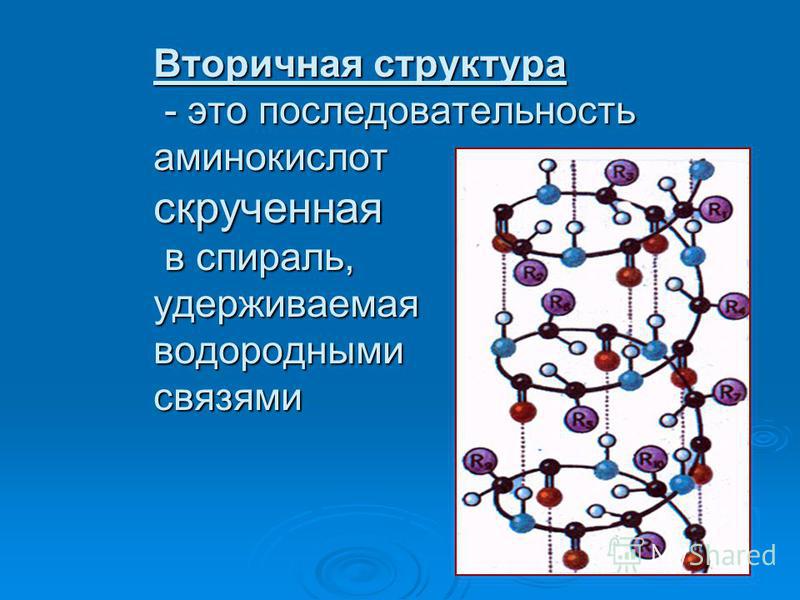
Белковые вещества составляют основу всех жизненно важных структур клетки, обладают необычайно высокой реакционной способностью, наделены каталитическими функциями.
Нуклеиновые кислоты входят в состав важнейшего органа клетки — ядра, а также цитоплазмы, рибосом, митохондрий и т. д. Нуклеиновые кислоты играют важную, первостепенную роль в наследственности, изменчивости организма, в синтезе белка.
План синтеза белка хранится в ядре клетки, а непосредственно синтез происходит вне ядра, поэтому необходима помощь для доставки закодированного плана из ядра к месту синтеза. Такую помощь оказывают молекулы РНК.
Процесс начинается в ядре клетки: раскручивается и открывается часть «лестницы» ДНК. Благодаря этому буквы РНК образуют связи с открытыми буквами ДНК одной из нитей ДНК. Фермент переносит буквы РНК, чтобы соединить их в нить. Так буквы ДНК «переписываются» в буквы РНК. Новообразованная цепочка РНК отделяется, и «лестница» ДНК снова закручивается.
После дальнейших изменений этот вид закодированной РНК готов.
РНК выходит из ядра и направляется к месту синтеза белка, где буквы РНК расшифровываются. Каждый набор из трех букв РНК образует «слово», обозначающее одну конкретную аминокислоту.
Другой вид РНК отыскивает эту аминокислоту, захватывает ее с помощью фермента и доставляет к месту синтеза белка. По мере прочтения и перевода сообщения РНК цепочка аминокислот растет. Эта цепочка закручивается и укладывается в уникальную форму, создавая один вид белка.
Примечателен даже процесс укладки белка: на то, чтобы с помощью компьютера просчитать все возможности укладки белка среднего размера, состоящего из 100 аминокислот, потребовалось бы 10 27 лет. А для образования в организме цепочки из 20 аминокислот требуется не более одной секунды — и этот процесс происходит непрерывно во всех клетках тела.
Гены, генетический код и его свойства .
На Земле живет около 7 млрд людей. Если не считать 25-30 млн пар однояйцовых близнецов, то генетически все люди разные : каждый уникален, обладает неповторимыми наследственными особенностями, свойствами характера, способностями, темпераментом.
Такие различия объясняются различиями в генотипах -наборах генов организма; у каждого он уникален. Генетические признаки конкретного организма воплощаются в белках — следовательно, и строение белка одного человека отличается, хотя и совсем немного, от белка другого человека.
Это не означает , что у людей не встречается совершенно одинаковых белков. Белки, выполняющие одни и те же функции, могут быть одинаковыми или совсем незначительно отличаться одной-двумя аминокислотами друг от друга. Но не существует на Земле людей (за исключением однояйцовых близнецов), у которых все белки были бы одинаковы.
Информация о первичной структуре белка закодирована в виде последовательности нуклеотидов в участке молекулы ДНК – гене – единице наследственной информации организма. Каждая молекула ДНК содержит множество генов. Совокупность всех генов организма составляет его генотип .
Кодирование наследственной информации происходит с помощью генетического кода , который универсален для всех организмов и отличается лишь чередованием нуклеотидов, образующих гены, и кодирующих белки конкретных организмов.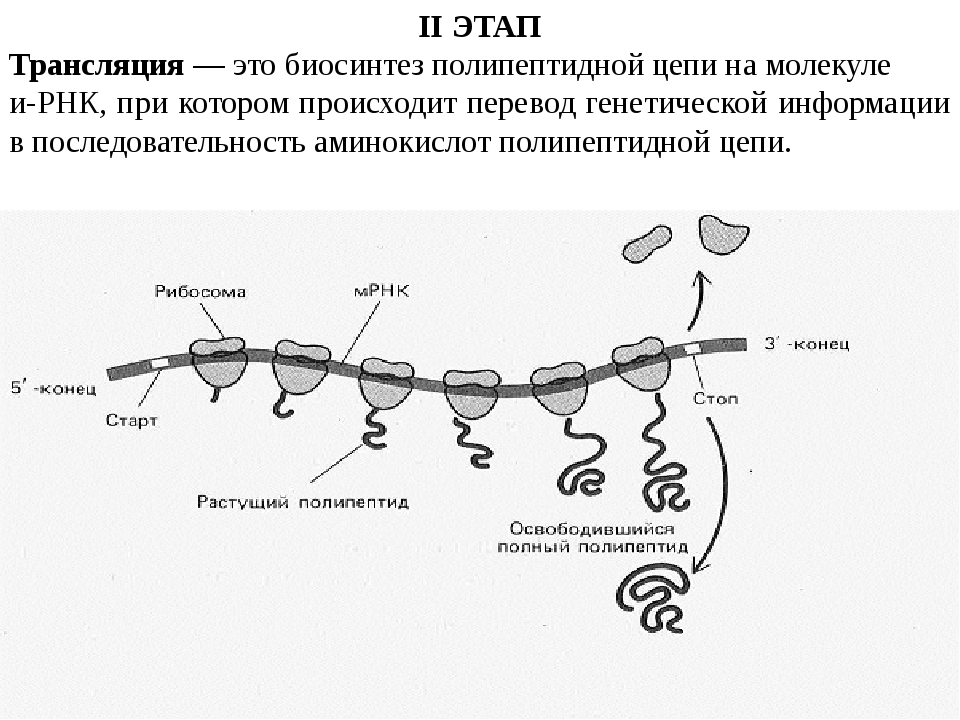
Генетический код состоит из троек (триплетов) нуклеотидов ДНК, комбинирующихся в разной последовательности (ААТ, ГЦА, АЦГ, ТГЦ и т.д.), каждый из которых кодирует определенную аминокислоту (которая будет встроена в полипептидную цепь).
Аминокислот 20 , а возможностей для комбинаций четырех нуклеотидов в группы по три – 64 четырех нуклеотидов вполне достаточно, чтобы кодировать 20 аминокислот
поэтому одна аминокислота может кодироваться несколькими триплетами .
Часть триплетов вовсе не кодирует аминокислоты, а запускает или останавливает биосинтез белка.
Собственно кодом считается последовательность нуклеотидов в молекуле и-РНК , т.к. она снимает информацию с ДНК (процесс транскрипции ) и переводит ее в последовательность аминокислот в молекулах синтезируемых белков (процесс трансляции ).
В состав и-РНК входят нуклеотиды АЦГУ, триплеты которых называются кодонами: триплет на ДНК ЦГТ на и-РНК станет триплетом ГЦА, а триплет ДНК ААГ станет триплетом УУЦ.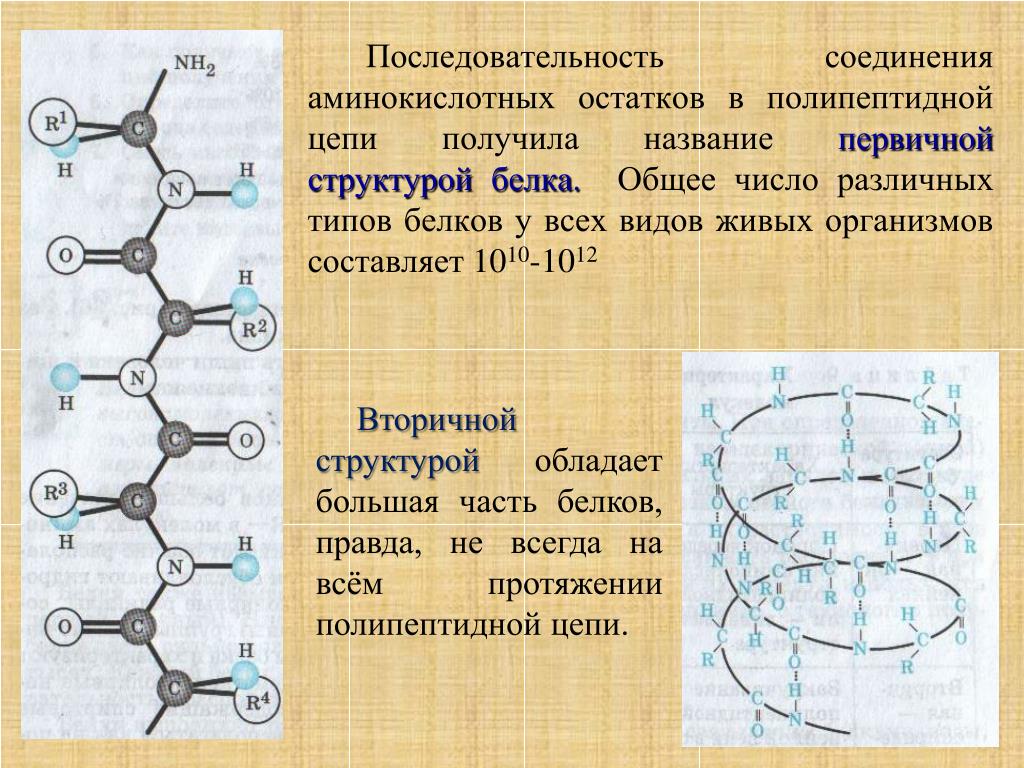
Именно кодонами и-РНК отражается генетический код в записи.
Таким образом, генетический код — единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов. Генетический код основан на использовании алфавита, состоящего всего из четырех букв-нуклеотидов, отличающихся азотистыми основаниями: А, Т, Г, Ц.
Основные свойства генетического кода :
1. Генетический код триплетен. Триплет (кодон) — последовательность трех нуклеотидов, кодирующая одну аминокислоту. Поскольку в состав белков входит 20 аминокислот, то очевидно, что каждая из них не может кодироваться одним нуклеотидом (поскольку в ДНК всего четыре типа нуклеотидов, то в этом случае 16 аминокислот остаются незакодированными). Двух нуклеотидов для кодирования аминокислот также не хватает, поскольку в этом случае могут быть закодированы только 16 аминокислот. Значит, наименьшее число нуклеотидов, кодирующих одну аминокислоту, оказывается равным трем. (В этом случае число возможных триплетов нуклеотидов составляет 4 3 = 64).
(В этом случае число возможных триплетов нуклеотидов составляет 4 3 = 64).
2. Избыточность (вырожденность) кода является следствием его триплетности и означает то, что одна аминокислота может кодироваться несколькими триплетами (поскольку аминокислот 20, а триплетов — 64), за исключением метионина и триптофана, которые кодируются только одним триплетом. Кроме того, некоторые триплеты выполняют специфические функции: в молекуле иРНК триплеты УАА, УАГ, УГА — являются терминирующими кодонами, т. е. стоп-сигналами, прекращающими синтез полипептидной цепи. Триплет, соответствующий метионину (АУГ), стоящий в начале цепи ДНК, не кодирует аминокислоту, а выполняет функцию инициирования (возбуждения) считывания.
3. Одновременно с избыточностью коду присуще свойство однозначности : каждому кодону соответствует только одна определенная аминокислота.
4. Код коллинеарен, т.е. последовательность нуклеотидов в гене точно соответствует последовательности аминокислот в белке.
5. Генетический код неперекрываем и компактен , т. е. не содержит «знаков препинания». Это значит, что процесс считывания не допускает возможности перекрывания колонов (триплетов), и, начавшись на определенном кодоне, считывание идет непрерывно триплет за триплетом вплоть до стоп-сигналов (терминирующих кодонов ).
6. Генетический код универсален , т. е. ядерные гены всех организмов одинаковым образом кодируют информацию о белках вне зависимости от уровня организации и систематического положения этих организмов.
Существуют таблицы генетического кода для расшифровки кодонов и-РНК и построения цепочек белковых молекул.
В живых системах встречается реакции, неизвестные в неживой природе — реакцииматричного синтеза .
Термином «матрица » в технике обозначают форму, употребляемую для отливки монет, медалей, типографского шрифта: затвердевший металл в точности воспроизводит все детали формы, служившей для отливки. Матричный синтез напоминает отливку на матрице: новые молекулы синтезируются в точном соответствии с планом, заложенным в структуре уже существующих молекул.
Матричный синтез напоминает отливку на матрице: новые молекулы синтезируются в точном соответствии с планом, заложенным в структуре уже существующих молекул.
Матричный принцип лежит в основе важнейших синтетических реакций клетки, таких, как синтез нуклеиновых кислот и белков. В этих реакциях обеспечивается точная, строго специфичная последовательность мономерных звеньев в синтезируемых полимерах.
Здесь происходит направленное стягивание мономеров в определенное место клетки — на молекулы, служащие матрицей, где реакция протекает. Если бы такие реакции происходили в результате случайного столкновения молекул, они протекали бы бесконечно медленно. Синтез сложных молекул на основе матричного принципа осуществляется быстро и точно.
Роль матрицы в матричных реакциях играют макромолекулы нуклеиновых кислот ДНК или РНК.
Мономерные молекулы , из которых синтезируется полимер, — нуклеотиды или аминокислоты — в соответствии с принципом комплементарности располагаются и фиксируются на матрице в строго определенном, заданном порядке.
Затем происходит «сшивание» мономерных звеньев в полимерную цепь , и готовый полимер сбрасывается с матрицы.
После этого матрица готова к сборке новой полимерной молекулы. Понятно, что как на данной форме может производиться отливка только какой-то одной монеты, одной буквы, так и на данной матричной молекуле может идти «сборка» только какого-то одного полимера.
Матричный тип реакций — специфическая особенность химизма живых систем. Они являются основой фундаментального свойства всего живого — его способности к воспроизведению себе подобного .
К реакциям матричного синтеза относят:
1. репликацию ДНК — процесс самоудвоения молекулы ДНК, осуществляемый под контролем ферментов. На каждой из цепей ДНК, образовавшихся после разрыва водородных связей, при участии фермента ДНК-полимеразы синтезируется дочерняя цепь ДНК. Материалом для синтеза служат свободные нуклеотиды, имеющиеся в цитоплазме клеток.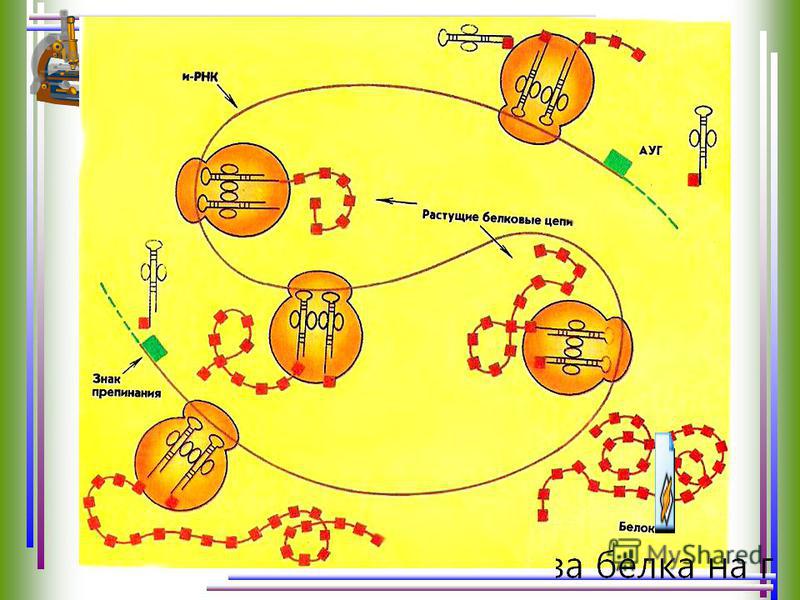
Биологический смысл репликации заключается в точной передаче наследственной информации от материнской молекулы к дочерним, что в норме и происходит при делении соматических клеток.
Молекула ДНК состоит из двух комплементарных цепей. Эти цепи удерживаются слабыми водородными связями, способными разрываться под действием ферментов.
Молекула способна к самоудвоению (репликации), причем на каждой старой половине молекулы синтезируется новая ее половина.
Кроме того, на молекуле ДНК может синтезироваться молекула и-РНК, которая затем переносит полученную от ДНК информацию к месту синтеза белка.
Передача информации и синтез белка идут по матричному принципу, сравнимому с работой печатного станка в типографии. Информация от ДНК многократно копируется. Если при копировании произойдут ошибки, то они повторятся во всех последующих копиях.
Правда, некоторые ошибки при копировании информации молекулой ДНК могут исправляться — процесс устранения ошибок называется репарацией .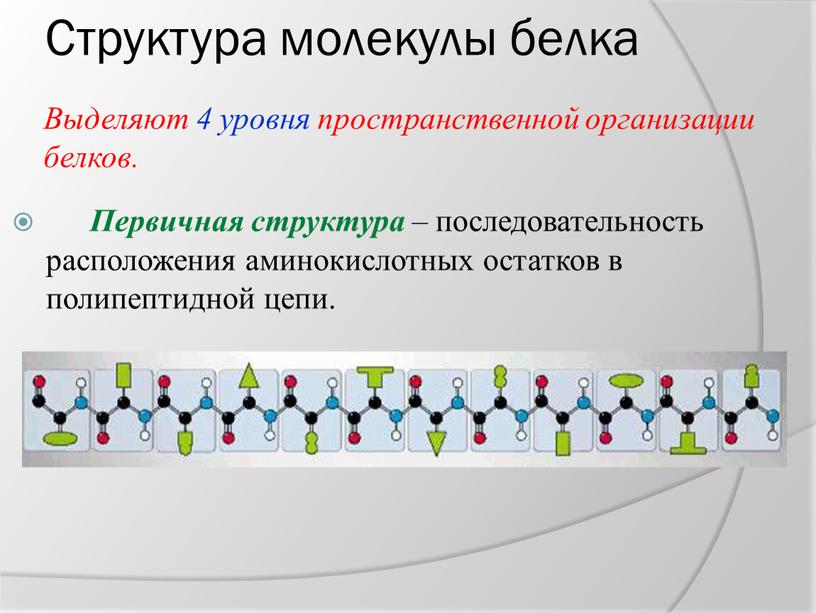 Первой из реакций в процессе передачи информации является репликация молекулы ДНК и синтез новых цепей ДНК.
Первой из реакций в процессе передачи информации является репликация молекулы ДНК и синтез новых цепей ДНК.
2. транскрипцию – синтез и-РНК на ДНК, процесс снятия информации с молекулы ДНК, синтезируемой на ней молекулой и-РНК.
И-РНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности при участии фермента, который активирует начало и конец синтеза молекулы и-РНК.
Готовая молекула и-РНК выходит в цитоплазму на рибосомы, где происходит синтез полипептидных цепей.
3. трансляцию — синтез белка на и-РНК; процесс перевода информации, содержащейся в последовательности нуклеотидов и-РНК, в последовательность аминокислот в полипептиде.
4 . синтез РНК или ДНК на РНК вирусов
Последовательность матричных реакций при биосинтезе белков можно представить в виде схемы:
нетранскрибируемая цепь ДНК | А Т Г | Г Г Ц | Т А Т | |
транскрибируемая цепь ДНК | Т А Ц | Ц Ц Г | А Т А | |
транскрипция ДНК | ||||
кодоны мРНК | А У Г | Г Г Ц | У А У | |
трансляция мРНК | ||||
антикодоны тРНК | У А Ц | Ц Ц Г | А У А | |
аминокислоты белка | метионин | глицин | тирозин |
Таким образом, биосинтез белка – это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определенную последовательность аминокислот в белковых молекулах.
Молекулы белков по существу представляют собой полипептидные цепочки , составленные из отдельных аминокислот. Но аминокислоты недостаточно активны, чтобы соединиться между собой самостоятельно. Поэтому, прежде чем соединиться друг с другом и образовать молекулу белка, аминокислоты должны активироваться . Эта активация происходит под действием особых ферментов.
В результате активирования аминокислота становится более лабильной и под действием того же фермента связывается с т-РНК . Каждой аминокислоте соответствует строго специфическая т-РНК , которая находит «свою» аминокислоту и переносит ее в рибосому.
Следовательно, в рибосому поступают различные активированные аминокислоты, соединенные со своими т-РНК . Рибосома представляет собой как бы конвейер для сборки цепочки белка из поступающих в него различных аминокислот.
Одновременно с т-РНК, на которой «сидит» своя аминокислота, в рибосому поступает «сигнал» от ДНК, которая содержится в ядре. В соответствии с этим сигналом в рибосоме синтезируется тот или иной белок.
В соответствии с этим сигналом в рибосоме синтезируется тот или иной белок.
Направляющее влияние ДНК на синтез белка осуществляется не непосредственно, а с помощью особого посредника – матричной или информационной РНК (м-РНК или и-РНК), которая синтезируется в ядре под влиянием ДНК, поэтому ее состав отражает состав ДНК. Молекула РНК представляет собой как бы слепок с формы ДНК. Синтезированная и-РНК поступает в рибосому и как бы передает этой структуре план — в каком порядке должны соединяться друг с другом поступившие в рибосому активированные аминокислоты, чтобы синтезировался определенный белок. Иначе, генетическая информация, закодированная в ДНК, передается на и-РНК и далее на белок .
Молекула и-РНК поступает в рибосому и прошивает ее. Тот ее отрезок, который находится в данный момент в рибосоме, определенный кодоном (триплет ), взаимодействует совершенно специфично с подходящим к нему по строению триплетом (антикодоном ) в транспортной РНК, которая принесла в рибосому аминокислоту.
Транспортная РНК со своей аминокислотой подходит к определенному кодону и-РНК и соединяется с ним; к следующему, соседнему участку и-РНК присоединяется другая т-РНК с другой аминокислотой и так до тех пор, пока не будет считана вся цепочка и-РНК, пока не нанижутся все аминокислоты в соответствующем порядке, образуя молекулу белка.
А т-РНК, которая доставила аминокислоту к определенному участку полипептидной цепи, освобождается от своей аминокислоты и выходит из рибосомы.
Затем снова в цитоплазме к ней может присоединиться нужная аминокислота, и она снова перенесет ее в рибосому.
В процессе синтеза белка участвует одновременно не одна, а несколько рибосом — полирибосомы.
Основные этапы передачи генетической информации:
синтез на ДНК как на матрице и-РНК (транскрипция)
синтез в рибосомах полипептидной цепи по программе, содержащейся в и-РНК (трансляция).
Этапы универсальны для всех живых существ, но временные и пространственные взаимоотношения этих процессов различаются у про- и эукариотов.
У эукариот транскрипция и трансляция строго разделены в пространстве и времени: синтез различных РНК происходит в ядре, после чего молекулы РНК должны покинуть пределы ядра, пройдя через ядерную мембрану. Затем в цитоплазме РНК транспортируются к месту синтеза белка — рибосомам. Лишь после этого наступает следующий этап — трансляция.
У прокариот транскрипция и трансляция идут одновременно.
Таким образом,
местом синтеза белков и всех ферментов в клетке являются рибосомы — это как бы «фабрики» белка, как бы сборочный цех, куда поступают все материалы, необходимые для сборки полипептидной цепочки белка из аминокислот. Природа синтезируемого белка зависит от строения и-РНК, от порядка расположения в ней нуклеоидов, а строение и-РНК отражает строение ДНК, так что в конечном итоге специфическое строение белка, т. е. порядок расположения в нем различных аминокислот, зависит от порядка расположения нуклеоидов в ДНК, от строения ДНК.
Изложенная теория биосинтеза белка получила название матричной теории.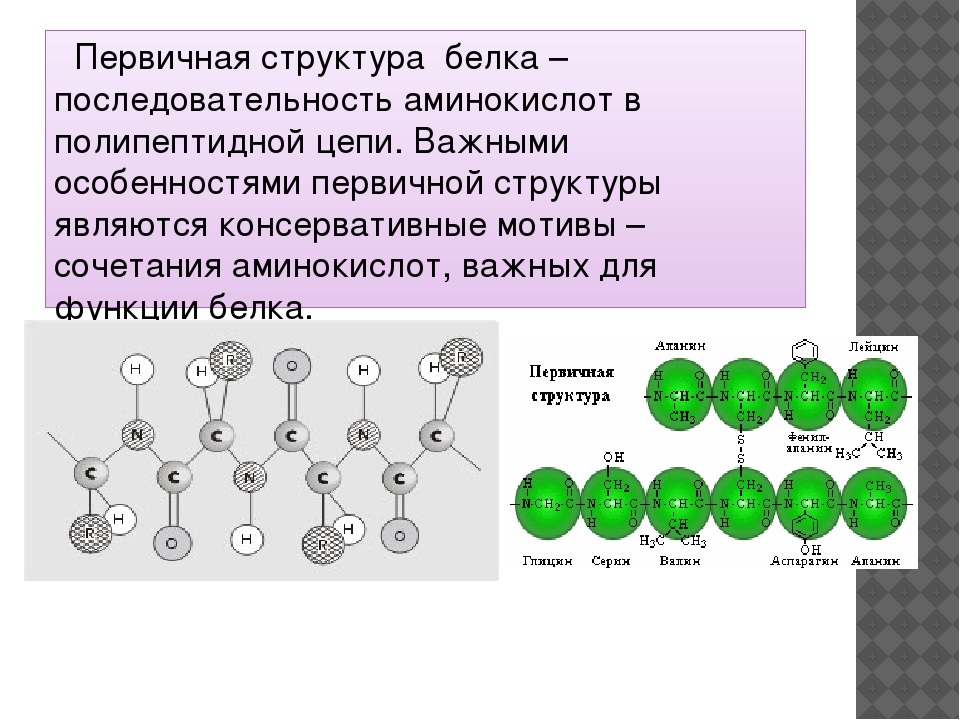 Матричной эта теория называется потому , что нуклеиновые кислоты играют как бы роль матриц, в которых записана вся информация относительно последовательности аминокислотных остатков в молекуле белка.
Матричной эта теория называется потому , что нуклеиновые кислоты играют как бы роль матриц, в которых записана вся информация относительно последовательности аминокислотных остатков в молекуле белка.
Создание матричной теории биосинтеза белка и расшифровка аминокислотного кода является крупнейшим научным достижением XX века, важнейшим шагом на пути к выяснению молекулярного механизма наследственности.
Тематические задания
А1. Какое из утверждений неверно?
1) генетический код универсален
2) генетический код вырожден
3) генетический код индивидуален
4) генетический код триплетен
А2. Один триплет ДНК кодирует:
1) последовательность аминокислот в белке
2) один признак организма
3) одну аминокислоту
4) несколько аминокислот
А3. «Знаки препинания» генетического кода
1) запускают синтез белка
2) прекращают синтез белка
3) кодируют определенные белки
4) кодируют группу аминокислот
А4. Если у лягушки аминокислота ВАЛИН кодируется триплетом ГУУ, то у собаки эта аминокислота может кодироваться триплетами:
1) ГУА и ГУГ
2) УУЦ и УЦА
3) ЦУЦ и ЦУА
4) УАГ и УГА
А5. Синтез белка завершается в момент
1) узнавания кодона антикодоном
2) поступления и-РНК на рибосомы
3) появления на рибосоме «знака препинания»
4) присоединения аминокислоты к т-РНК
А6. Укажите пару клеток в которой у одного человека содержится разная генетическая информация?
1) клетки печени и желудка
2) нейрон и лейкоцит
3) мышечная и костная клетки
4) клетка языка и яйцеклетка
А7. Функция и-РНК в процессе биосинтеза
1) хранение наследственной информации
2) транспорт аминокислот на рибосомы
3) передача информации на рибосомы
4) ускорение процесса биосинтеза
А8. Антикодон т-РНК состоит из нуклеотидов УЦГ. Какой триплет ДНК ему комплементарен?
Тестовые задания «Биосинтез белка»
№ 1:
1. Что является мономерами белков:
А) нуклеотиды; Б) моносахариды;
В) аминокислоты; Г) карбоновые кислоты.
2. Какие особые связи образуются между аминокислотами в первичной структуре белка:
А) пептидные; Б) водородные;
В) дисульфидные; Г) сложноэфирные.
3. Где хранится информация о структуре белка:
А) в АТФ; Б) в ДНК; В) в РНК; Г) в цитоплазме.
4. Какие органические вещества могут ускорять процесс синтеза белка:
А) гормоны; Б) антитела; В) гены; Г) ферменты.
5. Какую основную функцию выполняют белки в клетке:
А) энергетическую; Б) защитную;
В) двигательную; Г) строительную.
№ 2 :
1. Материальным носителем наследственной информации в эукариотической клетке является:
1)иРНК 3) ДНК
2) тРНК 4) хромосома
2. В гене закодирована информация о:
1) строении белков, жиров и углеводов
2) первичной структуре белка
3) последовательности нуклеотидов в ДНК
4) последовательности аминокислот в 2-х и более молекулах белков
3. Репликация ДНК сопровождается разрывом химических связей:
1) пептидных, между аминокислотами
2) ковалентных, между углеводом и фосфатом
3) водородных, между азотистыми основаниями
4) ионных, внутри структуры молекулы
4. Сколько новых одинарных нитей синтезируется при удвоении одной молекулы ДНК:
1) четыре 2) одна 3) две 4) три
5. При репликации молекулы ДНК образуется:
1) нить, распавшаяся на отдельные фрагменты дочерних молекул
2) молекула, состоящая из двух новых цепей ДНК
3) молекула, половина которой состоит из нити иРНК
4) дочерняя молекула, состоящая из одной старой и одной новой цепи ДНК
№ 3:
1. Если нуклеотидный состав ДНК — АТТ-ГЦГ-ТАТ, то нуклеотидный состав иРНК:
1) ТАА-ЦГЦ-УТА 3) УАА-ЦГЦ-АУА
2) ТАА-ГЦГ-УТУ 4) УАА-ЦГЦ-АТА
2. Если аминокислота кодируется кодоном УГГ, то в ДНК ему соответствует триплет:
1)ТЦЦ 2)АГГ 3)УЦЦ 4)АЦЦ
3. Один триплет ДНК несет информацию о:
1) последовательности аминокислот в молекуле белка
2) месте определенной аминокислоты в белковой цепи
3) признаке конкретного организма
4) аминокислоте, включаемой в белковую цепь
4. Код ДНК вырожден потому, что:
1) один код он кодирует одну аминокислоту
2) один кодон кодирует несколько аминокислот
3) между кодонами есть знаки препинания
4) одна аминокислота кодируется несколькими кодонами
5. Эволюционное значение генетического кода заключается в том, что он:
1) триплетен 2) индивидуален 3) универсален 4) вырожден
№ 4:
1. Синтез иРНК начинается с :
1) разъединения ДНК на две нити
2) взаимодействия фермента РНК — полимеразы и гена
3) удвоения гена
4) распада гена на нуклеотиды
2. Транскрипция — это процесс:
1) репликации ДНК 2) синтеза иРНК 3) синтеза белка
4) присоединения тРНК к аминокислоте
3. Матрицей для синтеза молекулы иРНК при транскрипции служит:
1) вся молекула ДНК
2) полностью одна из цепей молекулы ДНК
3) участок одной из цепей ДНК
4) в одних случаях одна из цепей молекулы ДНК, в других– вся молекула ДНК.
4. Транскрипция происходит :
1) в ядре 2) на рибосомах 3) в цитоплазме 4) на каналах гладкой ЭПС
5. Определи последовательность нуклеотидов иРНК, если известна
последовательность нуклеотидов ДНК
ДНК РНК
А – Т?
Т – А?
Г — Ц?
Ц – Г?
Ц – Г?
Г – Ц?
№ 5:
1. Количество тРНК, участвующих в трансляции, равно количеству :
1) кодонов иРНК, шифрующих аминокислоты
2) молекул иРНК
3) генов, входящих в молекулу ДНК
4) белков, синтезируемых на рибосомах
2. Синтез белка завершается в момент:
1) присоединения аминокислоты к тРНК
2) истощения запасов ферментов
3) узнавания кодона антикодоном
4) появления на рибосоме «знака препинания» — стоп-кодона
3. Синтез белка не идет на рибосомах у:
1) возбудителя туберкулеза 2) пчелы 3) мухомора 4) бактериофага
4. При трансляции матрицей для сборки полипептидной цепи белка служат :
1) обе цепочки ДНК
2) одна из цепей молекулы ДНК
3) молекула иРНК
4) в одних случаях одна из цепей ДНК, в других– молекула иРНК
5. При биосинтезе белка в клетке энергия АТФ:
1) расходуется 2) запасается
3) не расходуется и не выделяется 4) на одних этапах синтеза расходуется, на других– выделяется
№ 6:
1. Соотнесите вещества и структуры, участвующие в синтезе белка с их функциями.
ВЕЩЕСТВА И СТРУКТУРЫ
ФУНКЦИИ
1) Участок ДНК
2) иРНК
3) РНК — полимераза
4) Рибосома
5) Полисома
6)АТФ
7) Аминокислота
А) Переносит информацию на рибосомы
Б) Место синтеза белка
В) Фермент, обеспечивающий синтез иРНК
Г) Источник энергии для реакций
Д) Мономер белка
Е) Ген, кодирующий информацию о белке
Ж) Место сборки одинаковых белков
№ 7:
1. В соматических клетках многоклеточного организма:
1) различный набор генов и белков
2) одинаковый набор генов и белков
3) одинаковый набор генов, но разный набор белков
4) одинаковый набор белков, но разный набор генов
2. Работой структурных генов управляет :
1) ген-оператор 2) ген-регулятор 3) белок-репрессор 4) ген-промотор
3. Участок молекулы ДНК , с которым соединяется особый белок- репрессор, регулирующий транскрипцию отдельных генов,—…
4. Участок ДНК , расположенный между геном-регулятором и оператором, с которым соединяется фермент РНК-полимераза, обеспечивающий транскрипцию генов,—…
5. Вещества, играющие важнейшую роль в координации работы тысяч генов в многоклеточном организме:
1) ферменты 2) гормоны 3) ДНК 4) РНК
КОНТРОЛЬНЫЙ ТЕСТ:
1. Выберите три правильно названных свойства генетического кода.
A) Код характерен только для эукариотических клеток и бактерий
Б) Код универсален для эукариотических клеток, бактерий и вирусов
B) Один триплет кодирует последовательность аминокислот в молекуле белка
Г) Код вырожден, так аминокислоты могут кодироваться несколькими кодонами
Д) Код избыточен. Может кодировать более 20 аминокислот
Е) Код характерен только для эукариотических клеток
2. Постройте последовательность реакций биосинтеза белка.
A) Снятие информации с ДНК
Б) Узнавание антикодоном тРНК своего кодона на иРНК
B) Отщепление аминокислоты от тРНК
Г) Поступление иРНК на рибосомы
Д) Присоединение аминокислоты к белковой цепи с помощью фермента
3. Постройте последовательность реакций трансляции.
A) Присоединение аминокислоты к тРНК
Б) Начало синтеза полипептидной цепи на рибосоме
B) Присоединение иРНК к рибосоме
Г) Окончание синтеза белка
Д) Удлинение полипептидной цепи
4. Найдите ошибки в приведенном тексте.
1. Генетическая информация заключена в последовательности нуклеотидов в молекулах нуклеиновых кислот. 2. Она передается от иРНК к ДНК. 3. Генетический код записан на «языке «РНК». 4. Код состоит из четырех нуклеотидов. 5. Почти каждая аминокислота шифруется более чем одним кодоном. 6. Каждый кодон шифрует только одну аминокислоту. 7. У каждого живого организма свой генетический код.
Ответы:
Блок1- 1В 2А 3Б 4Г 5Г
Блок2- 1-3 2-2 3-3 4-3 5-4
Блок3- 1-3 2-4 3-4 4-4 5-3
Блок4 1-2 2-2 3-3 4-1 5-А
У
Г
Ц
Ц
Г
Блок5 1-1 2-4 3-4 4-3 5-1
Блок6 1-Е 2-А 3-В 4-Б 5-Ж 6-Г 7-Д
Блок7 1-3 2-1 3-оператор 4-промотор 5-2
Контрольный тест: 1-БГД 2-АГБВД 3-ВАБДГ 4- 2,4,7
аминокислот и белковых последовательностей
Каждый белок или пептид состоит из линейной последовательности аминокислот. Первичная структура белка обычно начинается на аминоконцевом (N) конце и продолжается до карбоксильного (C) конца. Структура белка может быть напрямую секвенирована или выведена из последовательности ДНК.
Аминокислотная последовательность белка или пептида является полезной информацией для понимания белка или пептида, идентификации его в образце и классификации его посттрансляционных модификаций.Процесс определения аминокислотной последовательности известен как секвенирование белков.
Обозначение
Последовательность белка обычно обозначается строкой букв в соответствии с порядком расположения аминокислот от аминоконца до карбоксильного конца белка. Для представления каждой аминокислоты в последовательности можно использовать одно- или трехбуквенный код.
Существует 20 аминокислот, встречающихся в природе в природе, которые могут быть представлены трех- или однобуквенным кодом следующим образом:
- Аланин (Ала, А)
- Аргинин (Arg, R)
- Аспарагин (Asn, N)
- Аспарагиновая кислота (Asp, D)
- Цистеин (Cys, C)
- Глутаминовая кислота (Glu, E)
- Глютамин (Gln, Q)
- Глицин (Gly, G)
- Гистидин (His, H)
- Изолейцин (Иль, I)
- Лейцин (Leu, L)
- Лизин (Lys, K)
- Метионин (Met, M)
- Фенилаланин (Phe, F)
- Пролайн (Pro, P)
- Серин (Ser, S)
- Треонин (Thr, T)
- Триптофан (Trp, W)
- Тирозин (Tyr, Y)
- Валин (Val, V)
Методы секвенирования белков
Есть два основных метода, используемых для поиска аминокислотных последовательностей белков.В настоящее время масс-спектрометрия является наиболее распространенным методом из-за простоты ее использования. Деградация по Эдману с использованием секвенатора белка является вторым методом, который наиболее полезен, если необходимо охарактеризовать N-конец белка.
Полезно знать, какая аминокислота находится на N-конце белка, как для упорядочивания пептидных фрагментов во всей цепи, так и для уменьшения влияния примесей, которые обычно возникают в первом раунде деградации по Эдману. N-конец можно определить по:
- Использование реагента для метки аминокислоты на конце белка.
- Гидролиз белка
- Использование хроматографии и других методов сравнения для идентификации меченого белка.
Существует меньше методов, которые практически можно использовать для идентификации С-конца белка. Однако один из методов, который можно использовать, включает добавление карбоксипептидаз к раствору белка и регулярный отбор образцов. График зависимости концентрации аминокислот от времени может помочь идентифицировать аминокислоту на С-конце.
Деградация по Эдману позволяет обнаруживать последовательность аминокислот в белке с помощью секвенаторов Эдмана, которые в настоящее время способны секвенировать пептиды длиной примерно до 50 аминокислот. Это включает несколько шагов, чтобы:
- Используйте восстановитель, чтобы разорвать дисульфидные мостики в белке.
- Разделите цепь (и) белкового комплекса и очистите их.
- Определите состав и концевые аминокислоты каждой цепи.
- Разорвать каждую цепь на небольшие фрагменты (менее 50 аминокислот в каждом)
- Разделите фрагменты и очистите их.
- Используйте фрагменты для определения аминокислотной последовательности.
- Предыдущие шаги следует повторить с другим рисунком фрагментов, чтобы можно было восстановить полную последовательность белка с минимальными ошибками.
Аминокислотный состав и анализ
Неупорядоченный состав аминокислоты часто является полезной информацией при попытке определить упорядоченную последовательность белка. Это потому, что он может помочь выявить ошибки и интерпретировать неоднозначные результаты.Кроме того, частота аминокислот также может помочь выбрать протеазу, которая больше подходит для переваривания белка.
Есть два основных шага для определения частоты встречаемости аминокислот в процессе, известном как аминокислотный анализ. Во-первых, гидролиз известного количества белка должен разбить его на мономеры аминокислот. Затем их можно разделить и количественно оценить с помощью различных методов.
Гидролиз обычно проводят путем нагревания образца белка до температуры более 100 ° C в соляной кислоте в течение длительного периода времени (не менее 24 часов), оставляя больше времени для белков с объемными гидрофобными группами.Поскольку в этих условиях существует риск разложения белка, особенно цистеина, глутамина, серина, треонина, триптофана и тирозина, рекомендуется использовать несколько образцов и нагревать их в течение разного времени. После гидролиза аминокислоты можно разделить и идентифицировать с помощью таких методов, как ионообменная хроматография или обращенно-фазовая ВЭЖХ.
Список литературы
- https://www.ncbi.nlm.nih.gov/books/NBK22342/
- https: //www.ncbi.nlm.nih.gov / books / NBK22571 /
- https://www.youtube.com/watch?v=iACY379o1X4
Дополнительная литература
Набор проблем с большими молекуламиПроблема 3: третичная структура белка Третичная структура белка относится к: А. Последовательность аминокислот Учебник
Третичная структура белков
Биологический проект Кафедра биохимии и молекулярной биофизики Университет Аризоны Доработана: октябрь 2004 г. Связаться с разработкой Команда http: // www.biology.arizona.edu | |
19.1: Полипептиды и белки — Биология LibreTexts
Цели обучения
- Определите или опишите следующее:
- аминокислота
- Группа «Р»
- пептидная связь
- пептид
- полипептид
- первичная структура белка
- вторичная структура белка
- структура третичного белка
- Четвертичная структура белка
- ген
- Опишите, как первичная структура белка или полипептида в конечном итоге определяет его окончательную трехмерную форму.
- Опишите, как порядок нуклеотидных оснований в ДНК в конечном итоге определяет окончательную трехмерную форму белка или полипептида.
Аминокислоты — это строительные блоки для белков. Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH. В белках обычно содержится 20 различных аминокислот и часто 300 и более аминокислот на молекулу белка. Каждая аминокислота отличается своей группой «R». Группа «R» аминокислоты представляет собой остаток – молекулы, то есть часть, отличную от аминогруппы, кислотной группы и центрального атома углерода.Каждая аминокислота имеет уникальную группу «R», и уникальные химические свойства аминокислоты зависят от свойств ее группы «R» (рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \) : Аминокислоты. Состав аминокислоты.Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связывается с карбоксильной (кислотной) или COOH-группой другой аминокислоты, как показано на (Рисунок \ ( \ PageIndex {2} \) и рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {2} \) : Пептидные связи. Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Пептид — это две или более аминокислоты, соединенные вместе пептидными связями, а полипептид — это цепь из многих аминокислот. Белок содержит один или несколько полипептидов. Следовательно, белки представляют собой длинные цепочки аминокислот, удерживаемые вместе пептидными связями.
Рисунок \ (\ PageIndex {3} \) : Образование пептидной связи.Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Фактический порядок аминокислот в белке называется его первичной структурой (рисунок \ (\ PageIndex {4} \)) и определяется ДНК. Как будет показано далее в этом разделе, ДНК разделена на функциональные единицы, называемые генами. Ген представляет собой последовательность дезоксирибонуклеотидных оснований вдоль одной цепи ДНК, которая кодирует функциональный продукт — определенную молекулу информационной РНК, транспортной РНК или рибосомной РНК.Продукт обычно представляет собой информационную РНК (мРНК), и мРНК в конечном итоге приводит к синтезу полипептида или белка. Поэтому обычно говорят, что порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Рисунок \ (\ PageIndex {4} \) : Первичная структура белка или полипептида.Первичная структура белка или полипептида — это фактическая последовательность его аминокислот. Первичная структура определяется порядком расположения дезоксирибонуклеотидных оснований в генах.Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой. Это придает белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа (рис. \ (\ PageIndex {5} \)).
Рисунок \ (\ PageIndex {5} \) : Вторичная структура белка или полипептида.(слева) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой. Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. В случае бета-листа водородная связь позволяет полипептиду складываться вперед и назад, как складчатый лист. (справа) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой.Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. В случае бета-листа водородная связь позволяет полипептиду складываться вперед и назад, как складчатый лист.В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру (рисунок \ (\ PageIndex {6} \)). В некоторых белках, таких как молекулы антител и гемоглобин, несколько полипептидов могут связываться вместе, образуя четвертичную структуру (рисунок \ (\ PageIndex {7} \)).
Рисунок \ (\ PageIndex {6} \) : Третичная структура белка или полипептида. В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру.Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи. Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.Как будет показано далее в этом разделе, во время синтеза белка порядок нуклеотидных оснований в гене транскрибируется в комплементарную цепь мРНК, которая затем транслируется тРНК в правильный порядок аминокислот для этого полипептида или белка.Следовательно, порядок дезоксирибонуклеотидных оснований в ДНК определяет порядок аминокислот в белках. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами, порядок аминокислот для каждого белка определяет его окончательную трехмерную форму, которая, в свою очередь, определяет функцию этого белка (например, с каким субстратом будет реагировать фермент, с какими эпитопами Fab антитела будет сочетаться с рецепторами, с которыми свяжется цитокин).
Рисунок \ (\ PageIndex {7} \) : Четвертичная структура белка.Четвертичная структура белка обусловлена соединением нескольких полипептидов, как в случае молекул антител. Схематическая диаграмма базовой единицы иммуноглобулина (антитела) Fab Fc тяжелой цепи (состоит из VH, Ch2, шарнира, областей Ch3 и Ch4: от N-конца) легкой цепи (состоит из областей VL и CL: от N-члена) антигена шарнирные области сайта связывания (*) -SS- означают дисульфидные связи. (CC-SA-BY 3.0; Ы_тамбе).Сводка
- Аминокислоты — это строительные блоки для белков.В белках обычно содержится 20 различных аминокислот и часто 300 и более аминокислот на молекулу белка.
- Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH.
- Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связывается с карбоксильной (кислотной) или COOH-группой другой аминокислоты.
- Пептид — это две или более аминокислоты, соединенные вместе пептидными связями; полипептид — это цепь из множества аминокислот; и белок содержит один или несколько полипептидов.Следовательно, белки представляют собой длинные цепочки аминокислот, удерживаемые вместе пептидными связями.
- Фактический порядок аминокислот в белке называется его первичной структурой и определяется ДНК.
- Порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
- Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой и придают белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа. .
- В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.
- В некоторых белках, таких как молекулы антител, несколько полипептидов могут связываться вместе с образованием четвертичной структуры.
Авторы и авторство
белков | Определение, структура и классификация
Белок , очень сложное вещество, которое присутствует во всех живых организмах.Белки имеют большую питательную ценность и непосредственно участвуют в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, производное от греческого prōteios , что означает «удерживать первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Популярные вопросы
Что такое белок?
Белок — это встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования в животных. Когда животное потребляет избыток белков, они превращаются в жиры (глюкозу или триглицериды) и используются для снабжения энергией или создания энергетических запасов.Если животное не потребляет достаточное количество белка, организм начинает разрушать богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани.Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Белковая молекула очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе, образуя длинные цепи, подобно тому, как бусинки расположены на нити. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность.Хотя пока невозможно объяснить все функции белка на основе его аминокислотной последовательности, установленные корреляции между структурой и функцией можно отнести к свойствам аминокислот, из которых состоят белки.
пептидМолекулярная структура пептида (небольшого белка) состоит из последовательности аминокислот.
© raimund14 / FotoliaРастения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни.Растения могут расти в среде, содержащей неорганические питательные вещества, обеспечивающие азот, калий и другие вещества, необходимые для роста. В процессе фотосинтеза они используют углекислый газ, содержащийся в воздухе, для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, очень большое количество растительного материала требуется животным, таким как жвачные животные (например, коровы), которые едят только растительный материал для удовлетворения своих потребностей в аминокислотах.Нежвачные животные, в том числе люди, получают белки в основном от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
бобовых; amino acidБобовые, такие как фасоль, чечевица и горох, богаты белком и содержат много незаменимых аминокислот.
© Elenathewise / FotoliaСодержание белка в органах животных обычно намного выше, чем в плазме крови.Например, в мышцах содержится около 30 процентов белка, в печени — от 20 до 30 процентов, а в красных кровяных тельцах — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных намного меньше количества белка; Белковые молекулы производятся в клетках путем поэтапного выравнивания аминокислот и попадают в жидкости организма только после завершения синтеза.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишись сейчасВысокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, встречаются в очень малых количествах. Важность белков в основном связана с их функцией. Все идентифицированные ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни, — белки, нуклеиновые кислоты, углеводы и липиды, — превращать их в другие вещества и разлагать их.Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
гемоглобинГемоглобин — это белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ).Каждая цепь присоединена к группе гема, состоящей из порфирина (органическое кольцеобразное соединение), присоединенного к атому железа. Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови.
Британская энциклопедия, Inc.Четыре уровня структуры белка — физиология клетки
Структура и функции белка
Белки являются строительными блоками клеточных структур и двигателей клеточной активности.Они имеют модульную природу, и их взаимодействие с другими молекулами в клетке зависит от наличия определенных функциональных доменов. Точная форма домена, возникающая в результате наличия нековалентных связей между остатками в полипептидной цепи, определяет функцию. Самый известный пример взаимосвязи формы и функции — теория ферментативной функции «ключ и замок». Изменение ферментативного кармана из-за мутации или модификации аминокислотного остатка изменяет аффинность и / или специфичность фермента.Короче говоря, чем лучше подходят две молекулы, тем лучше они функционируют, тем больше связей может быть сделано, тем быстрее может пройти сигнал или тем сильнее соединяются две молекулы (подумайте о молекулах адгезии).
Трехмерная конформация белка зависит от взаимодействий между аминокислотами в полипептидной цепи. Поскольку последовательность аминокислот зависит от генетического кода, форма белка закодирована в ДНК. Белки имеют четыре уровня организации. Первичная структура относится к линейной последовательности аминокислот, связанных пептидными связями.Вторичная структура состоит из локальной упаковки полипептидной цепи в α-спирали и β-листы за счет водородных связей между пептидной связью и центральной углеродной цепью. Третичная (3D) структура — это форма, возникающая в результате сворачивания вторичных структур, определяемых взаимодействиями между боковыми цепями аминокислот. Четвертичная структура описывает расположение полипептидных цепей в многосубъединичном расположении.
В этом видео показаны 4 уровня структуры белка.
Адаптировано из банка данных RCSBProtein под лицензией CC -BY
Все, что необходимо для придания белку уникальной формы и, следовательно, уникальной функции, «записано» во фрагменте ДНК, известном как ген. Каждый раз, когда ген транскрибируется, либо в течение жизни клетки, либо в любой клетке, имеющей одну и ту же ДНК, природную или рекомбинантную, белки появляются одинаково и принимают на себя их заранее запрограммированную функцию.
Первичная структура белков
Белки — это самый важный и универсальный класс макромолекул в клетке.Роли, которые играют эти молекулы, включают в себя что угодно: от транспорта питательных веществ, катализаторов биохимических реакций до структурных компонентов клеток или молекулярных моторов. Белки представляют собой линейные полимеры аминокислот, связанных пептидными связями. Они синтезируются из матричной цепи ДНК и содержат уникальные и специфические аминокислотные последовательности в линейной форме, известной как первичная структура .
Только двадцать аминокислот необходимы и достаточны для производства тысяч белков в клетке.Это не значит, что аминокислот всего двадцать. Это распространенное заблуждение. В мире существует бесчисленное множество аминокислот, но они участвуют в других метаболических реакциях, но не в синтезе белка. То, как индивидуальный белок приобретает свою идентичность, зависит от упорядоченной комбинации аминокислот, которая определяет все его характеристики.
Аминокислоты, которые связаны пептидной связью, называются полипептидной цепью. Полипептидная цепь состоит из последовательности аминокислот, продиктованных геном.Последовательность аминокислотных цепей обеспечивает разнообразие, необходимое для удовлетворения потребностей жизни. Сохранение конкретных белковых последовательностей настолько важно, что в клетке есть механизмы регуляции, гарантирующие производство только совершенных белков. Каждая отдельная последовательность имеет уникальный порядок, который передает очень уникальную функцию. Если бы вы изменили одно-единственное расположение цепочки, у этой цепочки была бы совершенно другая функция. Функция белка может быть нарушена или полностью потеряна, если последовательность нарушена.Но не все мутации или модификации белков приводят к катастрофическим последствиям. Некоторые из них заставляют клетки и организм лучше адаптироваться к давлению окружающей среды, и этот процесс известен как эволюция.
Свойства аминокислот и различия их боковых цепейАминокислоты имеют одинаковую основную структуру, которая важна для правильного образования химической связи между соседними молекулами. Каждая аминокислота имеет центральный углерод, обозначенный как α-углерод. К α-углероду всегда присоединены следующие четыре группы:
- –Nh3 основная аминогруппа
- –COOH кислотная группа (известная как карбоксильная группа)
- –H атом водорода
- –R боковая цепь
-R символизирует вариабельную боковую цепь, которая представляет собой единственную химическую группу , которая различается среди всех двадцати аминокислот. По сути, боковая цепь делает аминокислоту уникальной и может считаться ее отпечатком пальца.
Наиболее важным свойством аминокислот, которое влияет на сворачивание и, следовательно, на функцию всей белковой молекулы, является их известное и предсказуемое взаимодействие с водой. Таким образом, аминокислоты можно разделить на гидрофильные и гидрофобные группы. Гидрофобные, или неполярные, аминокислоты имеют в качестве боковых цепей насыщенные углеводороды. Эти аминокислоты представляют собой аланин, валин, метионин, лейцин и изолейцин и две аминокислоты с ароматическими кольцами , триптофан и фенилаланин .Гидрофобные неполярные аминокислоты играют важную роль в сворачивании белков, потому что они имеют тенденцию сближаться и скапливаться от воды. Эти аминокислоты обычно образуют трансмембранные домены и обнаруживаются глубоко погребенными в гидрофобной внутренней части большинства глобулярных белков.
Гидрофильные аминокислоты легко взаимодействуют с водой. В эту группу входят аминокислоты, которые ионизируются и становятся электрически заряженными (как отрицательно, так и положительно) при диссоциации, и аминокислоты, которые полярны, но не заряжены.Аминокислоты, которые имеют боковые цепи с карбоксильной группой в дополнение к карбоксильной группе при α-углероде, используемом для образования пептидной связи, несут отрицательный заряд. Эти остатки представляют собой глутаминовую кислоту и аспарагиновую кислоту — обратите внимание, что их названия фактически содержат термин «кислота» из-за наличия ДВУХ карбоксильных групп.
Боковые цепи лизина , аргинина и гистидина имеют сильные основные группы и положительно заряжены. Полярные, но незаряженные гидрофильные аминокислоты: аспарагин, глутамин, серин, треонин и тирозин .Гидрофильные и заряженные боковые цепи аминокислот обнажены на поверхности белка и особенно широко распространены в ферментативных карманах или транспортных молекулах. Обнаженные электрические заряды передают природу и активность белка другим молекулам и действуют как магниты, притягивая аналогичные силы для взаимодействия.
Несколько аминокислот вносят вклад в структуру белка из-за уникальных свойств, характерных для их боковых цепей. Структура пролина отличается от других аминокислот тем, что его боковая цепь связана с азотом, а также с центральным углеродом.Эта аминокислота химически нереакционноспособна (гидрофобна), но из-за своего пятичленного кольца она нарушает геометрию сворачивающегося белка, вызывая резкие сдвиги в конформации, физически создавая изгибы и изгибы полипептидной цепи. Глицин вообще не имеет боковой цепи, только второй атом водорода, присоединенный к α-углероду. Не проявляя сильной полярности или электроотрицательности, это обычно наблюдается в местах, где части полипептидной цепи изгибаются и приближаются друг к другу.
Цистеин — это аминокислота, которая, как известно, сильно влияет на структуру белка . Он имеет сульфгидрильную группу, отвечающую за образование дисульфидных связей, которые стабилизируют третичную структуру белков и вносят большой вклад в молекулярные функции, о которых вы узнаете позже в этом тексте.
Вторичная структура и все петли
Как мы узнаем, как на самом деле выглядят белки, когда они свернуты? Есть два метода, позволяющих заглянуть в структуру белка; дифракция рентгеновских лучей и ядерный магнитный резонанс (ЯМР).Метод дифракции рентгеновских лучей создает трехмерную контурную карту электронов в кристалле белка на основе того, как рентгеновские лучи отражаются, когда они проходят через образец. ЯМР измеряет расстояние между белками в насыщенном растворе, и информация об ограниченном пространстве используется для определения складчатых структур каждого белка. Эти два теста вместе помогают нам понять, какова сложенная форма белка.
Форма белка определяется исключительно аминокислотной последовательностью в полипептидной цепи.Верно; это как ДНК, уникальный код создает уникальный дизайн. Сворачивание белков является результатом физических свойств боковых цепей аминокислот и их взаимодействия с окружающей их средой. Белки складываются в наиболее энергоэффективную форму, называемую нативным состоянием , в несколько этапов или уровней в структуре белка.
Фолдинг и архитектура белкаПри воздействии условий в цитозоле или просвете ER полипептидные цепи принимают локализованную организацию, называемую вторичной структурой , которая оптимизирует взаимодействия между боковыми цепями аминокислот друг с другом и водой.Каркас полипептида складывается в спирали и ленты из α-спиралей и β-листов соответственно. Как α-спираль, так и β-лист представляют собой сегменты полипептида, которые имеют правильную геометрию и связаны между собой плавными и не очень плавными поворотами и разделены менее организованными петлями.
Альфа-спираль — это структура, которая упаковывает α-атомы углерода с вращением, обеспечивающим благоприятные углы для образования прочных водородных связей и плотной упаковки боковых цепей. Бета-листы представляют собой плоские структуры, состоящие из нескольких β-нитей, связанных с соседними β-нитями посредством водородных связей.В β-листах полипептидная цепь может идти в одном (параллельном) или противоположном направлении (антипараллельно). Водородные связи более стабильны, когда β-лист имеет антипараллельные, а не параллельные нити. Параллельные листы обычно скрываются внутри белковой структуры. Вторичные структуры соединены неструктурированными участками, образующими несколько петель.
Третичная структура белка
Есть много способов объединения вторичных структур в большую трехмерную решетку. Третичная структура белка представляет собой трехмерную комбинацию α-спиралей и β-листов, которые складываются рядом друг с другом в результате нековалентных взаимодействий между боковыми группами аминокислот и окружающей средой, окружающей отдельный полипептид. На этом этапе белки начинают укреплять свою структуру за счет дополнительных связей, таких как дисульфидные связи между двумя цистеинами . Наиболее важной особенностью третичных структур является наличие консервативных областей со сходными функциями, известных как функциональных доменов .Третичные структуры менее стабильны, и действительно, большинство из них меняют форму в течение жизни белка, часто многократно. Конформационные изменения в этих функциональных доменах являются основой функции белка. Они могут быть постоянными во время фолдинга и созревания белка или обратимыми и служить способом регулирования активности белка в реакции в масштабе реакции. Белковые домены являются областями схожей активности. У них не обязательно должна быть сохраненная последовательность. Например, киназный домен, ответственный за присоединение фосфатной группы, имеет другую форму и последовательность, в зависимости от субстрата, к которому присоединена фосфатная группа.Вторичные структуры, образующие домены, не обязательно должны располагаться последовательно в полипептидной цепи. В случае мультимерных белков они могут даже быть частями нескольких разных полипептидов.
Мотивы представляют собой подгруппу функциональных доменов, которые имеют эволюционно консервативные последовательности , придающие им, конечно, консервативную форму. Один пример, мотивы coiled-coil — очень регулярные надстройки двух α-спиралей, спаренных, чтобы сформировать волокнистую конфигурацию, которая является основой стабильных димеров.Обычно это две идентичные α-спирали, обернутые друг вокруг друга в левой конформации и стабилизированные за счет гидрофобных взаимодействий. Межмолекулярные ионные связи между боковыми цепями в α-спирали, расстояние между которыми составляет 3,6 остатка, дают гидрофобным остаткам пространство для взаимодействия с аналогичным мотивом на противоположном белке.
Четвертичная структура
Четвертичная структура является результатом сборки двух или более полипептидов в один функциональный мультимерный белок .Субъединицы собираются посредством взаимодействий между доменами или областями в белке и удерживаются вместе гидрофобными взаимодействиями (два влажных зеркала) и дисульфидными связями. Если субъединицы одинаковы, структура описывается с префиксом homo , а если они разные — с префиксом гетеро (как в гомодимере мышечного гликогенфосфорилазы или как в гетеротримерных белках G)
Внутриклеточные процессы, такие как передача сигналов, зависят от взаимодействия между молекулами.Чем лучше молекулярное соответствие между двумя молекулами, тем больше связей они могут образовывать или тем сильнее взаимодействие (сродство между ними). Аминокислотная последовательность, продиктованная геном, и, в свою очередь, свойства боковых цепей аминокислот определяют форму и, в свою очередь, взаимодействия.
белков
Аминокислоты
Белки — самые разнообразные биомолекулы на Земле, выполняющие множество функций, необходимых для жизни. Белковые ферменты являются биологическими катализаторами, поддерживающими жизнь, регулируя, где и когда происходят клеточные реакции.Структурные белки обеспечивают внутреннюю и внешнюю поддержку для защиты и поддержания формы клеток. Например, кератины представляют собой важный класс структурных белков, обнаруженных в волосах, коже, ногтях и перьях животных. Белки подвижности обеспечивают основу для движения клеток и всего организма, включая белки мышечных двигателей, которые могут перемещать целые животные! Мембранные белки передают сигналы во время межклеточной коммуникации, транспортируют молекулы в клетки и из них и защищают живые организмы, идентифицируя и помечая захватчиков.
Функции белков настолько разнообразны из-за множества уникальных трехмерных структур, которые образуют белковые полимеры. Несмотря на такое разнообразие, белки также имеют несколько общих структурных характеристик своих мономеров — аминокислот. Структурное сходство аминокислот делает синтез белка единообразным и регулируемым процессом; однако каждая аминокислота также содержит уникальный структурный компонент. Конкретные различия между каждой аминокислотой взаимодействуют, создавая уникальные трехмерные белковые структуры.В совокупности сходства и различия между аминокислотами объясняют, как клетки могут создавать разнообразный пул белков из одного и того же набора строительных блоков.
В каждой аминокислоте существует один центральный атом углерода — альфа-углерод (альфа-углерод). Из четырех групп атомов, ковалентно связанных с α-углеродом, три одинаковы для всех аминокислот. -Углерод всегда напрямую связан с одной аминогруппой и одной карбоксильной группой (карбоновой кислотой). Название «аминокислота» происходит из-за наличия этих двух функциональных групп (аминокислота + кислота).Все аминокислоты имеют третью общую ковалентную связь с атомом водорода, но четвертый атом (или атомная группа), связанный с α-углеродом, уникален в каждой аминокислоте.
Четвертая α-углеродная связь может соединяться с другим одиночным атомом водорода, как в глицине, или с группой атомов. Группы атомов различаются по размеру, полярности или заряду. Например, лизин содержит большую ионную группу атомов. Для простоты, когда конкретная аминокислота не идентифицирована, биологи используют термин «R-группа» для обозначения четвертого атома или группы, связанной с α-углеродом.Термин «R» обозначает остальную часть молекулы и используется при обсуждении общей структуры и реакционной способности аминокислот без усложнения структуры включением деталей R-группы.
Синтез белка включает построение полимера из аминокислот со сложной трехмерной структурой. Синтез дегидратации образует пептидную связь между аминокислотами и высвобождает молекулу воды. Дипептид образуется, когда между двумя отдельными аминокислотами создается пептидная связь, соединяющая углерод карбоксильной группы одной аминокислоты и азот аминогруппы другой аминокислоты.Поскольку дополнительные аминокислоты связываются посредством синтеза дегидратации, короткая цепь (пептид) растет. Полипептиды образуются, когда длина пептидной цепи достигает ста или более аминокислот. Белки образуются в виде аминокислот в одном или нескольких полипептидах, химически взаимодействуя с образованием сложной трехмерной структуры.
Живые организмы синтезируют почти все белки, используя всего двадцать различных аминокислот. Полипептиды образуют уникальную трехмерную структуру в зависимости от типа и положения (последовательности) этих аминокислот.Внутри последовательности R-группы аминокислот образуют химические взаимодействия, которые создают определенную трехмерную структуру. Эти R-группы обычно называют «боковыми цепями», потому что они не участвуют в пептидных связях. R-группы выступают на стороне полипептида, позволяя им химически взаимодействовать друг с другом. Взаимодействия с боковыми цепями образуют специфическую структуру каждого белка, структуру, уникально способную выполнять клеточную функцию этого белка.
Функциональные группы белков
Это задание проверяет вашу способность определять функциональные группы аминокислот в белках.
Построение и расщепление белков
Это задание проверяет вашу способность идентифицировать реагенты и продукты синтеза и гидролиза белка.
Структура и функция белка
В отличие от полисахаридов, полипептидные цепи собраны с широким спектром аминокислот в каждом полимере. Набор из двадцати аминокислот, обычно содержащихся в биологических белках, напрямую отвечает за разнообразие белковых структур в живых клетках.Каждый белок отличается по нескольким аспектам, которые определяют структуру и, следовательно, функцию. Белок может состоять из одной или нескольких полипептидных цепей. Гены клетки определяют длину каждой полипептидной цепи, а также тип и положение каждой аминокислоты в последовательности. Вместе эти факторы определяют структуру белка, которая определяет функцию, которую белок может выполнять.
Как структура белка определяет функцию? Трехмерная форма каждого белка идеально подходит для выполнения одной конкретной функции.Например, аквапорины — это канальные белки, которые образуют небольшие туннели через клеточную мембрану. Внутренняя поверхность аквапориновых туннелей имеет определенный диаметр и полярность. Эта структура идеально подходит для переноса молекул воды, но очень немногого другого, обеспечивая специфичность и функцию. Если структура белка изменяется, меняется и его способность функционировать.
Зная важность структуры белка в определении функции, как тогда определяется структура белка? Чтобы ответить на этот вопрос, мы должны сначала спросить, как только двадцать аминокислот могут создать разнообразие белков, которые мы видим в живых организмах.Это разнообразие легко объяснить тем, как полипептиды образуют последовательность. Представьте себе создание дипептида с использованием двадцати распространенных аминокислот. Существует двадцать вариантов для первого положения и двадцать вариантов для второго положения этого двух аминокислотного пептида. Математические расчеты говорят нам, что мы можем синтезировать четыреста различных дипептидов! Для каждых дополнительных аминокислот в пептиде мы снова умножаем это количество вариантов на двадцать. Представьте себе, сколько различных полипептидов может существовать в природе, имея более ста аминокислот в средней последовательности!
Помимо увеличения вариативности, каждая из двадцати общих аминокислот играет жизненно важную роль в структуре и функции белков во всех живых организмах.В то время как производители, такие как растения, синтезируют все двадцать распространенных аминокислот, потребители, которые получают энергию, поедая биомолекулы, полагаются на потребление с пищей для получения одной или нескольких аминокислот. Люди синтезируют десять из двадцати обычных аминокислот, а остальные десять должны быть получены с пищей. Хотя всех аминокислот необходимы для жизни человека, «незаменимые аминокислоты» — это те аминокислоты, которые человек не может синтезировать самостоятельно. Употребление в пищу продуктов, богатых белком, обеспечивает клетки этими незаменимыми аминокислотами.
Живые организмы, управляемые генами, синтезируют полипептиды с использованием аминокислот. Уникальный порядок аминокислот в полипептиде называется первичной структурой и представляет собой первый уровень трехмерной структуры (конформации) белка. Первичная структура определяет каждый дополнительный уровень химических взаимодействий, управляя формированием окончательной конформации белка.
Если структура определяет функцию, как первичная последовательность аминокислот определяет трехмерную структуру? В процессе, называемом сворачиванием белка, стабильные химические взаимодействия образуются между аминокислотами в белке, изгибая и скручивая полимер в трехмерную форму.Сворачивание белков иногда требует помощи молекулярных белков-шаперонов, которые связывают вновь образующиеся полипептиды и способствуют формированию структуры.
Сворачивание белка включает три уровня химических взаимодействий, называемых вторичной, третичной и четвертичной структурой. Вторичная структура создается за счет образования водородных связей между соседними аминокислотами во время синтеза белка. Водородные связи во вторичной структуре включают полярные амино- и карбоксильные группы аминокислот, но не включают R-группы.По мере того как пептидная цепь продолжает расти, взаимодействия между боковыми цепями аминокислот (R-группами) образуют третичную структуру полипептида. Боковые цепи взаимодействуют друг с другом посредством:
- образование водородных связей в боковой цепи.
- агрегация гидрофобных боковых цепей.
- образование ионных (солевой мостик) и ковалентных (дисульфидный мостик) связей.
Хотя все химические взаимодействия важны для третичной структуры, белки сворачиваются в основном в ответ на то, какие боковые цепи способны образовывать водородные связи с водой.Поскольку молекулы воды составляют большую часть внутреннего раствора клетки, неполярные боковые цепи исключаются из раствора и объединяются по мере образования водородных связей с полярными и ионными боковыми цепями. Эти гидрофобные взаимодействия являются сильнейшим фактором, определяющим третичную структуру.
В некоторых белках сворачивание завершается после образования третичной структуры. В других случаях несколько полипептидных цепей объединяются, образуя четвертый уровень структуры, четвертичную структуру. Четвертичная структура включает два или более полипептидов, складывающихся вместе посредством тех же типов химических взаимодействий, которые сформировали третичную структуру.В четвертичной структуре боковые цепи разных полипептидов образуют водородные связи, гидрофобные взаимодействия и химические связи друг с другом. Гемоглобин, белок, переносящий кислород через кровоток, состоит из четырех полипептидов.
Что делать, если что-то нарушает структуру белка? Экстремальная жара, изменения pH и химические токсины — это лишь несколько причин денатурации белка, потери естественной структуры белка. Некоторые белки способны к рефолдингу, но большинство белков не могут восстановиться после значительной потери структуры белка.Например, приготовление яйца навсегда денатурирует его белки, изменяя внешний вид и текстуру яйца. Живые клетки прилагают значительные усилия для поддержания гомеостаза, контролируя свою внутреннюю среду, потому что неожиданные изменения могут разрушить белки клетки, убивая клетку.
Поскольку функция белка зависит от точного формирования структуры, сворачивание белка является ключевой темой научных исследований. Многие биохимики посвящают всю свою карьеру поиску способов предсказать, как будут складываться белки и как мутации повлияют на структуру и функцию белков.Мутации, которые изменяют первичную последовательность белка, могут привести к массивным изменениям в структуре белка и устранить или изменить функцию, что приведет к болезни или смерти. Иногда мутации приводят к улучшенным или новым функциям, приносящим пользу организму. Редкие полезные мутации распространяются среди популяций посредством естественного отбора, что приводит к эволюционным изменениям.
Денатурация белка
Эта анимация иллюстрирует процесс денатурации.
Белковые термины
Это задание проверяет вашу способность сопоставлять термины, относящиеся к белкам, с их определениями.
Перевод главы 9
Перевод главы 9
Синтез каждые Молекула белка в клетке направляется ДНК этой клетки
Есть два аспекта того, как это достигается:
- Есть проблема информации или кодирования: как последовательность нуклеотидов определяет последовательность аминокислот?
- Есть проблема химии: Каков фактический процесс, посредством которого различные аминокислоты связаны вместе в правильной последовательности с образованием функционального белка?
Представьте игроков и их роли:
- Рибосомы Эти сложные органеллы состоят из нескольких частей рРНК и многих белки.Эти органеллы это фактические фабрики, где происходит синтез белка.
- мРНК это закодированная информация о белке, который вот-вот будет сделали. Эта информация скопирована из матрицы ДНК. Который шаблон называется геном этого белка.
- тРНК Это переходная молекула, которая связывает язык мРНК с язык белков.Эти Молекулы РНК имеют сайт присоединения аминокислот, а также антикодон. которые могут прикрепляться конкретно к кодону длиной три основания, найденному на мРНК.
См. Рис. 9-1 для обзора того, как происходит перевод. Обратите внимание, что есть направление: мРНК считывается 5 3.
Также обратите внимание, что новый белок (зарождающийся белок) производится амино-конец первым.
Пожалуйста, смотрите рисунки 9-2 и 9-3 для более подробной информации. подробнее:
- г. связь матричной цепи ДНК с сообщением
- г. определение кодона
Таблица генетических кодов 9-1
- AUG это стартовый кодон (иногда GUG)
- метионин и триптофан имеют только по одному кодону.Все остальные аминокислоты имеют несколько кодонов, примечание что обычно отличается третья база. Это часто называют вырожденность генетического кода
- Стоп кодоны не кодируют аминокислоты. Это стоп-кодоны, потому что нет соответствующей им тРНК.
- Примечание что в этой таблице изображены кодоны мРНК, написанные 5 3. Мы могли бы точно так же надлежащим образом составьте таблицу антикодонов, написанную 3 5
Что такое тРНК? См. Рис. 9-4 и 9-5.
Молекула тРНК имеет несколько важных характеристик:
- The Молекула тРНК имеет антикодон
- г. Молекула тРНК имеет сайт присоединения аминокислоты на своем 3-конце
- Аминоацил-тРНК-синтетаза (специфична для каждой тРНК / амино сочетание кислот) сопоставляет аминокислоту с антикодоном и прикрепляет аминокислота. (Фермент заряжает или ацилирует тРНК.)
Посмотреть фильм, описывающий, как получается тРНК ацилированный
- Когда тРНК связывается с мРНК, связывание с положением 3 rd кодон шаткий. (Видеть Таблица 9-2. Обратите внимание, что необычное пуриновое основание инозин часто присутствует в третьей позиции антикодон, это основание может сочетаться с U, C и A.)
- Это объясняет, почему код вырожденный.
Рассмотрим общую структуру мРНК
.Давайте еще раз рассмотрим полицистронную РНК:
- См. рисунок 9-6.
- Примечание что каждая из кодирующих белок областей (цистронов) начинается с AUG стартовый кодон.
- Примечание что каждый цистрон также заканчивается стоп-кодоном
- Примечание что между каждым из белков, кодирующих регионы
- Обратите внимание, что в начале сообщения перед первый стартовый кодон.
Что такое перекрывающиеся гены?
В книге упоминается фаг fX174 одноцепочечный ДНК-вирус.
Анализ показали, что геном этого вируса слишком мал, чтобы учесть все белки, которые он мог производить.
Проблема была решена путем обнаружения того, что некоторые из генов fX174s перекрытие:
o одна и та же нуклеотидная последовательность может быть прочитана в нескольких рамках считывания:
o последовательность, приведенная ниже, может читаться по-разному в зависимости от того, какой AUG используется в качестве стартовый кодон:
AUGNNNNAUGNNNNNNNAUGNN
AUG NNN NAU GNN NNN NNA UGN Н.. или
AUG NNN NNN NAU GNN или
AUG NN.
Также см. рис. 9-7.
Синтез полипептидов
Прокариотическая структура рибосомы 70-е рибосомы
30-е годы субъединица 16s рРНК плюс 21 полипептид
50-е годы субъединица 23s рРНК, 5s рРНК и 32 полипептиды
Структура рибосом эукариот 80-е рибосомы
40 с субъединица 18s рРНК плюс 30 белков
60-е годы субъединица 5s рРНК, 5.8s рРНК, 28s рРНК и 50 белков
Посвящение
16s рРНК 30s субъединицы связывается с последовательностью Шайна-Делгарно.
Последовательность Шайна-Делагарно (AGGAGGU) также известна как область инициации трансляции.
Эукариотический аналог — это 5-шапка эукариотическое сообщение.
(См. Рис. 9-11). Формируется комплекс до инициации: 30-я субъединица + мРНК + f-met-тРНК + факторы инициации (белки) + GTP.
Затем связывается 50-я субъединица и начинается удлинение.
Обратите внимание на точки A и P на рисунке
.Относительное удлинение (рис. 9-13)
с f-met-тРНК в P-сайте и следующая ацилированная-тРНК в A-сайте —- a пептидилтрансфераза образует пептидную связь между двумя аминокислотами.
F-met отщепляется от его тРНК и листьев тРНК, оставляя Р-сайт открытым.
вторая тРНК перемещается в P-сайт из A-сайта.
А новая ацилированная тРНК перемещается в пустой A-сайт для образования пары с кодоном в этот сайт.
Это процесс повторяется снова и снова, пока бессмысленный кодон не появится в Сайт.
Прекращение действия
Выпускфакторы расщепляют все — сайт A слишком долго не занят.
В полицистронная мРНК, следующая AUG не так уж далеко и рибосома повторно инициирует синтез следующего белка.
Что такое полисомы?
- Пожалуйста изучите рисунки 9-15 и 9-16
Прочтите об антибиотиках и рибосомах на стр. 188.
.
 Участок ДНК, содержащий информацию о
структуре одного белка, -это: 1) фенотип
2) ген
Участок ДНК, содержащий информацию о
структуре одного белка, -это: 1) фенотип
2) ген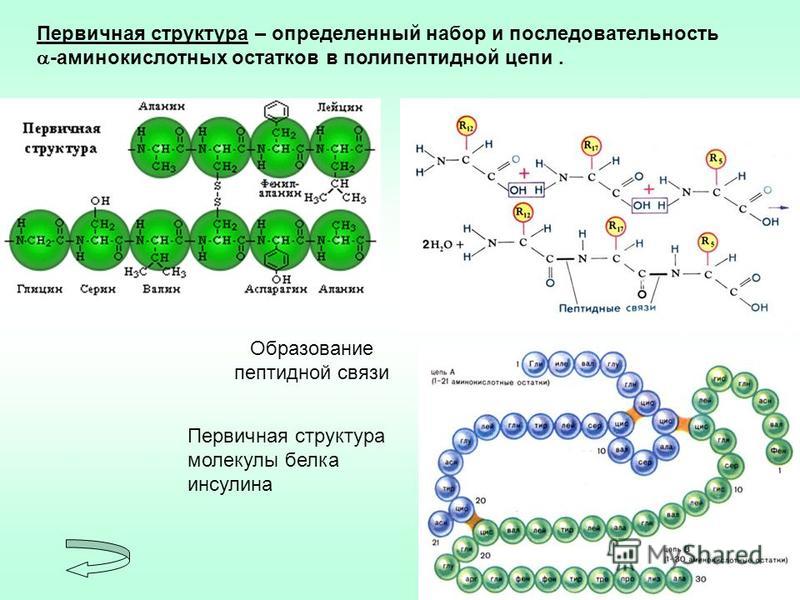 Одни
и те же триплеты кодируют одинаковые
аминокислоты у всех организмов на
Земле. Этим свойством генетического
кода является:
Одни
и те же триплеты кодируют одинаковые
аминокислоты у всех организмов на
Земле. Этим свойством генетического
кода является: Процесс переписывания генетической
информации с ДНК на иРНК – это:
Процесс переписывания генетической
информации с ДНК на иРНК – это: Трансляция
– это:
Трансляция
– это: Определите последовательность
нуклеотидов в молекуле тРНК, если
последовательность нуклеотидов
фрагмента цепи ДНК:
Определите последовательность
нуклеотидов в молекуле тРНК, если
последовательность нуклеотидов
фрагмента цепи ДНК:
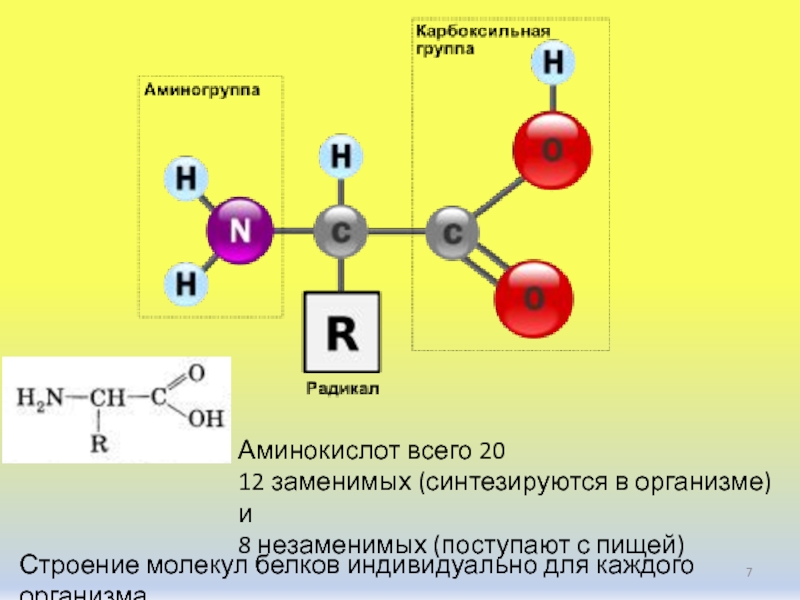 Чем обеспечивается точная
последовательность расположения
аминокислот в молекуле белка в
процессе его биосинтеза?
Чем обеспечивается точная
последовательность расположения
аминокислот в молекуле белка в
процессе его биосинтеза? Каковы особенности реакций биосинтеза
белка в клетке?
Каковы особенности реакций биосинтеза
белка в клетке?

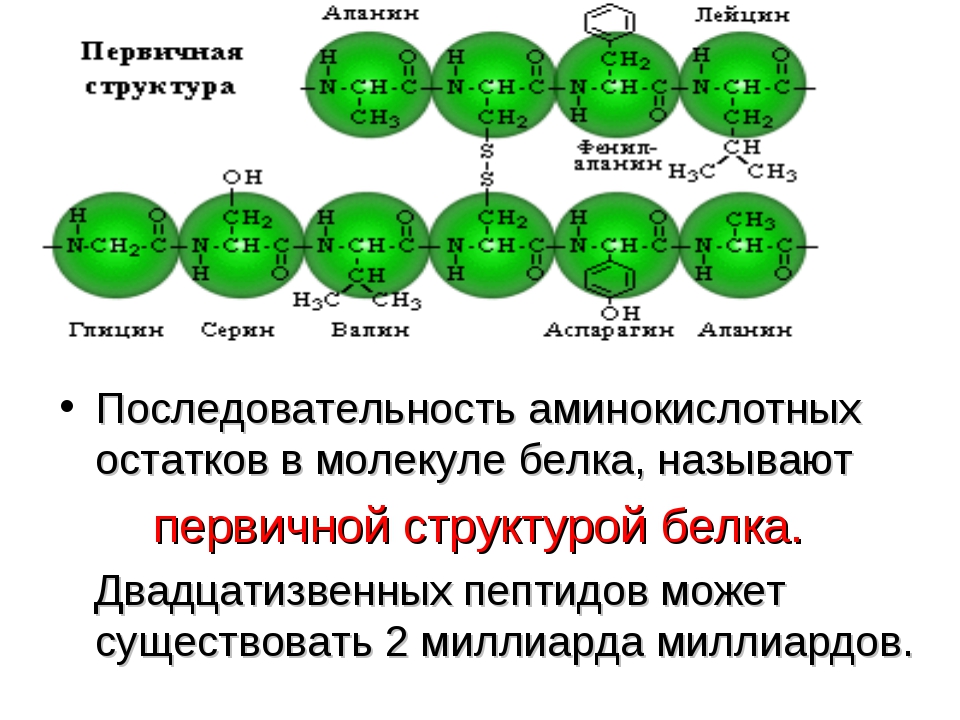

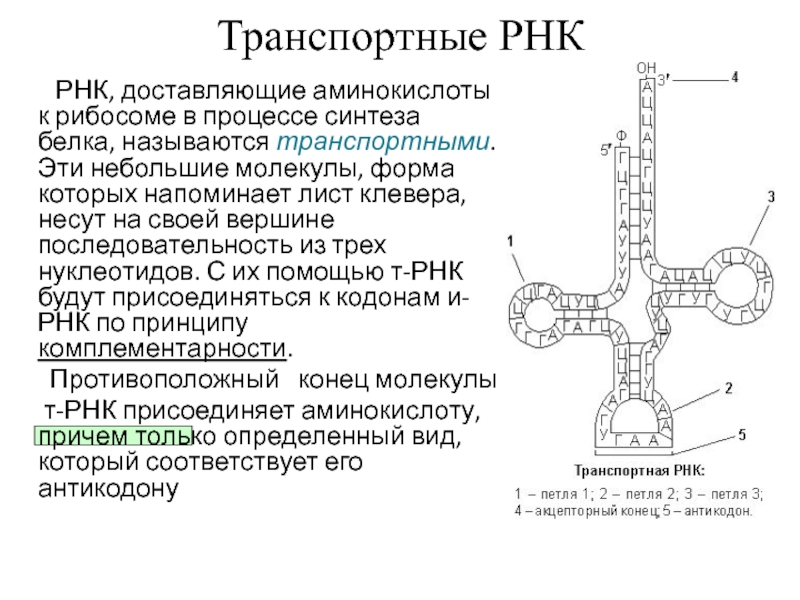

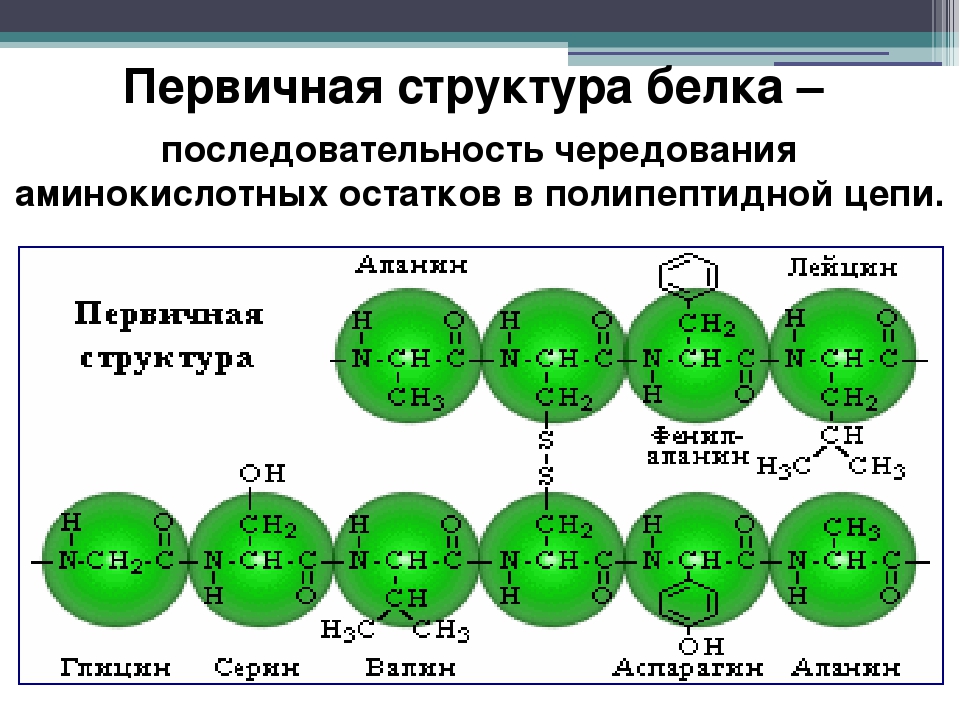 Выберите правильную последовательность
передачи информации в процессе синтеза
белка в клетке:
Выберите правильную последовательность
передачи информации в процессе синтеза
белка в клетке: Установите последовательность
процессов, происходящих в интерфазной
клетке.
Установите последовательность
процессов, происходящих в интерфазной
клетке.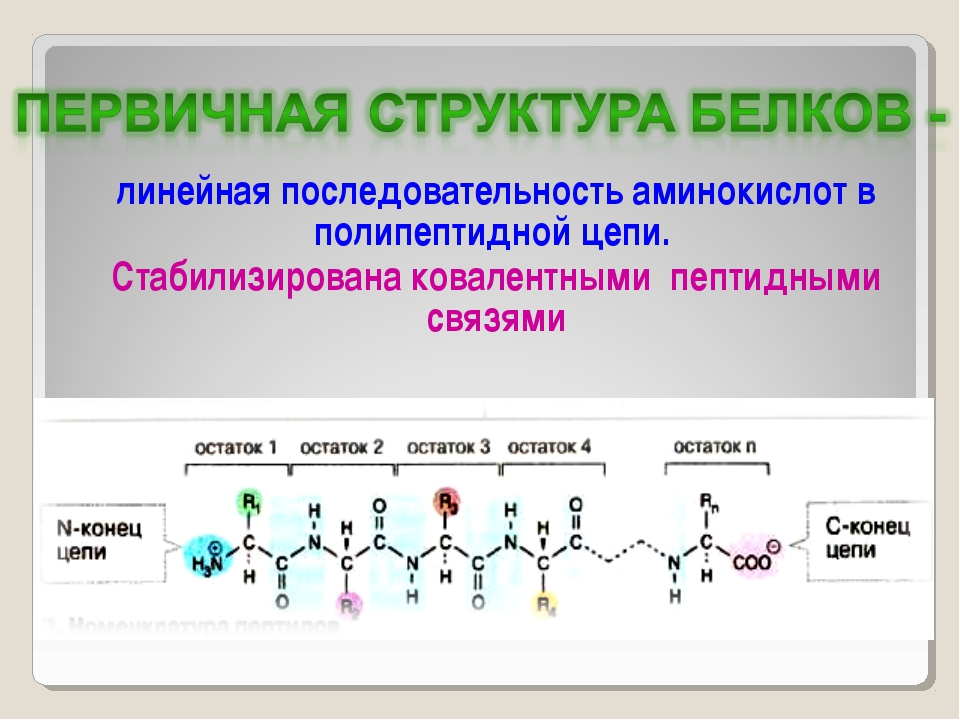

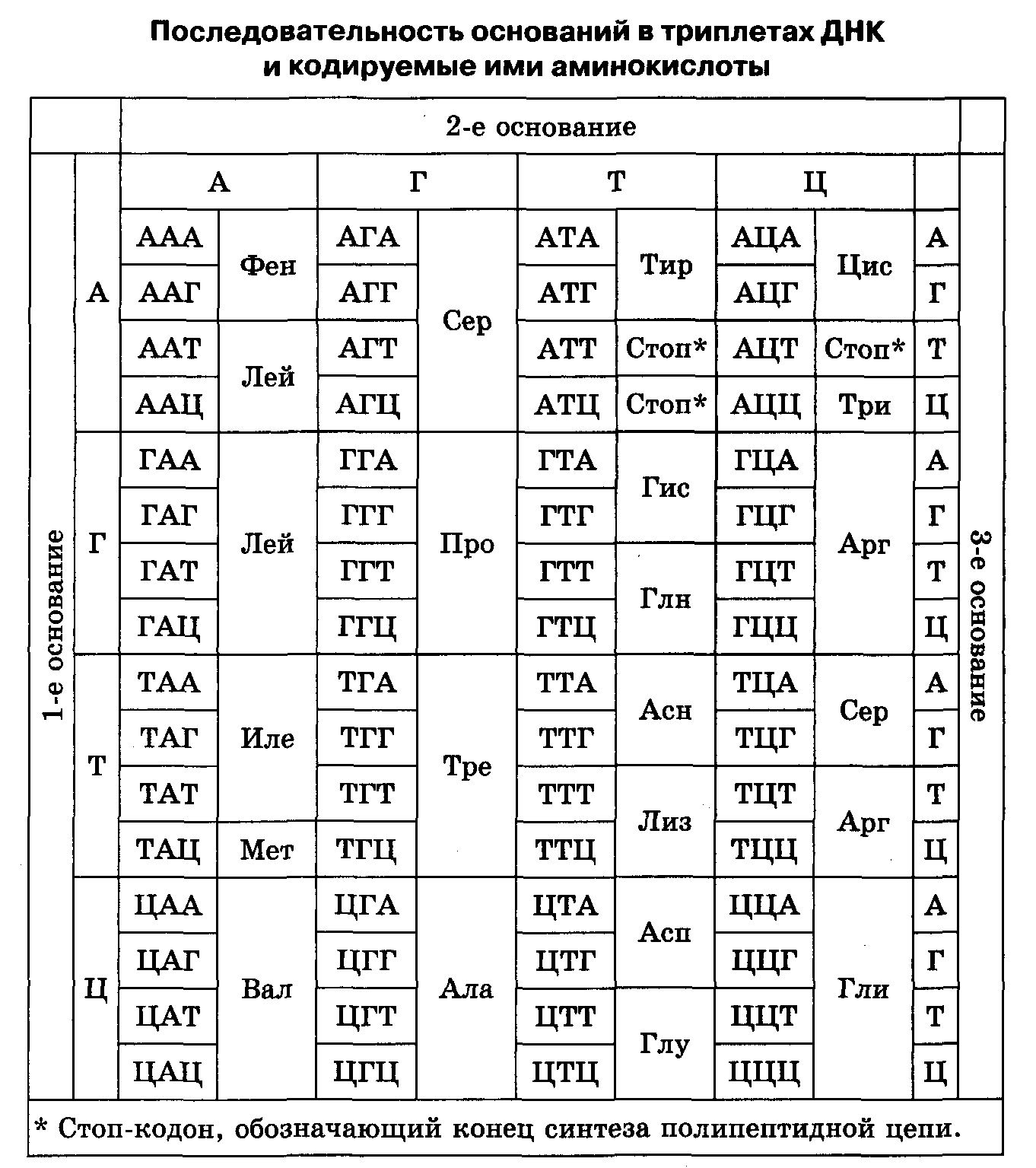 Копией одного или группы генов, несущих
информацию о структуре белков,
выполняющих одну функцию, является
молекула:
Копией одного или группы генов, несущих
информацию о структуре белков,
выполняющих одну функцию, является
молекула: Молекула иРНК осуществляет передачу
наследственной информации:
Молекула иРНК осуществляет передачу
наследственной информации: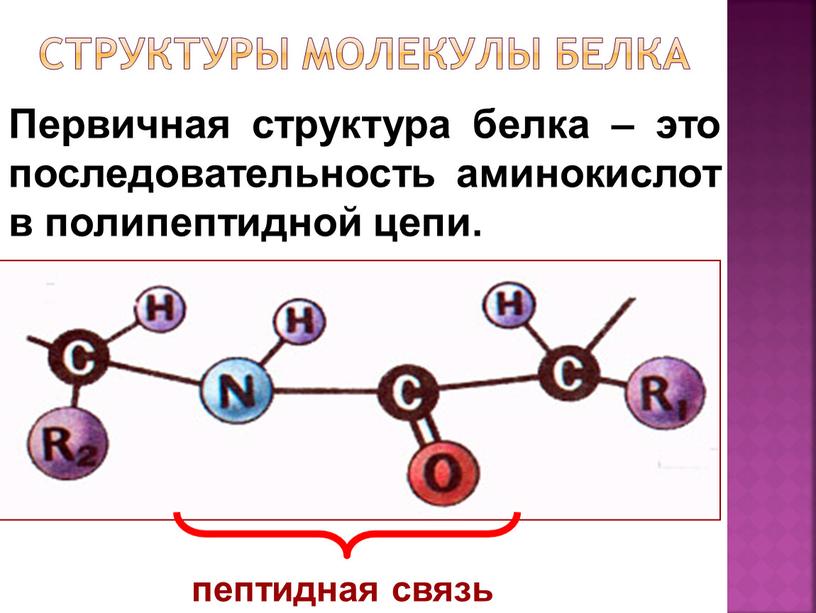
 Перенос аминокислот к рибосомам
осуществляют:
Перенос аминокислот к рибосомам
осуществляют: Белок состоит
из 300 аминокислот. Сколько нуклеотидов
в гене, который служит матрицей для
синтеза этого белка?
Белок состоит
из 300 аминокислот. Сколько нуклеотидов
в гене, который служит матрицей для
синтеза этого белка? С помощью
скольких нуклеотидов в гене закодирована
первичная структура белка, который
состоит из 260 аминокислотных остатков?
С помощью
скольких нуклеотидов в гене закодирована
первичная структура белка, который
состоит из 260 аминокислотных остатков? Сколько
нуклеотидов с гуанином?
Сколько
нуклеотидов с гуанином? Сколько
процентов аденина содержится в участке
ДНК, на котором был осуществлен синтез
указанной иРНК?
Сколько
процентов аденина содержится в участке
ДНК, на котором был осуществлен синтез
указанной иРНК?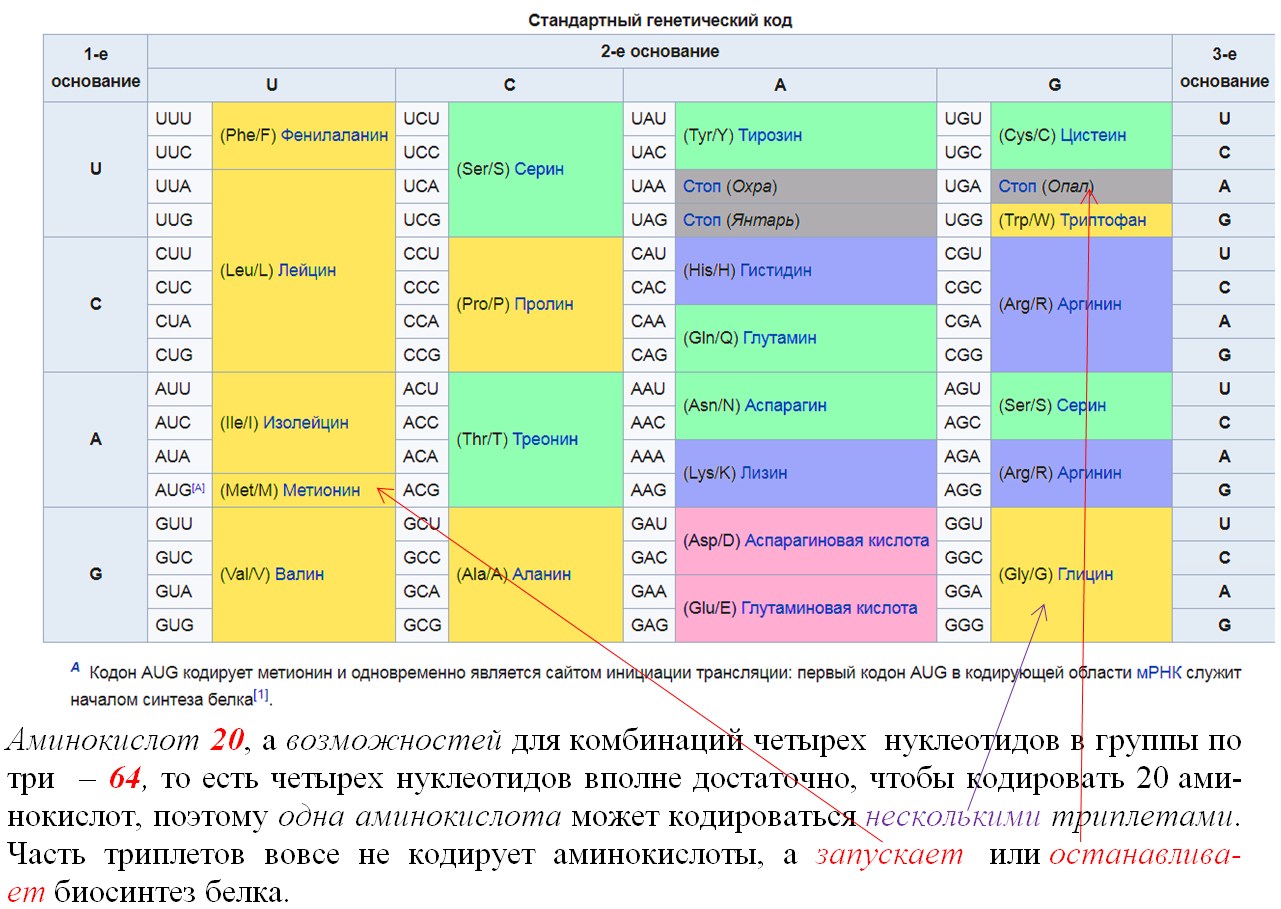 Какой антикодон
транспортной РНК соответствует
триплету ТГА в молекуле ДНК?
Какой антикодон
транспортной РНК соответствует
триплету ТГА в молекуле ДНК?
Leave A Comment