Задачи на концентрацию
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Евсюкова Д.С. 1
1МБОУ «СОШ № 2 ст. Архонская»
Уймина Т.А. 1
1МБОУ «СОШ № 2 ст. Архонская»
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Задачи на концентрацию являются основными задачами в школьном курсе химии, но различные способы решения таких задач можно рассматривать на уроках математики ещё с шестого класса, используя арифметический способ и понятие процента и десятичной дроби. Затем продолжить в седьмом классе изучив понятие пропорции, а так же умение решать задачи алгебраическим способом, то есть уравнением. И, наконец, в восьмом классе рассмотреть возможность решения таких задач с помощью систем уравнений.
И, наконец, в восьмом классе рассмотреть возможность решения таких задач с помощью систем уравнений.
При подготовке ГИА необходимо вспомнить и систематизировать типы и способы решения таких задач.
Арифметический способ
При изучении темы «Проценты» в 6 классе решение задач на концентрацию считаются задачами повышенной сложности и могут быть предложены особо подготовленным учащимся.
Задача 1. Имеется 735 г шестнадцатипроцентного раствора йода в спирте. Нужно получить десятипроцентный раствор йода. Сколько граммов спирта нужно долить для этого к уже имеющемуся раствору?
Решение:
1) Найдем, сколько чистого йода содержится в растворе.
735 · 0,16 = 117,6 (г).
2) В новом растворе йода останется такое же количество, но он будет составлять уже 10 % раствора.
Если 117,6 г – это 10 %, то весь раствор имеет массу 117,6 · 10 = 1176 (г).
3) Найдем, сколько спирта нужно долить для получения нового раствора.
1176 – 735 = 441 (г).
О т в е т: 441 г.
Алгоритм:
Найти массу нового раствора в соответствии с процентным содержанием в нем вещества.
Найти разность масс нового и старого растворов. [3]
Решение с помощью пропорции
Познакомившись с понятием пропорции в 7 классе, подобные задачи можно решать используя это понятие.
Задача 2. К 200 г 30 %-ного раствора соли долили 50 г воды. Какова концентрация полученного раствора?
Составим соответствующую пропорцию, приняв за х массу соли в растворе:
200 г – 100 %
х г – 30 % , тогда х = = 60 г соли.
Масса нового раствора 200 + 50 = 250 г, но масса соли в нём не изменилась, т. е. получим
250 г – 100 %
60 г – х % , тогда х = = 24 % концентрация полученного раствора.
Задача 3. Смешали 12 л 15 %-ного раствора соляной кислоты и 10 л 10 %-ного раствора. Каково процентное содержание кислоты в полученном растворе? Ответ округлить до 0,1 %.
Р е ш е н и е
С помощью пропорций найдём массу кислоты в каждом растворе:
12 л – 100 %
х л – 15 %, х = = 1,8 л кислоты в первом растворе и
10 л – 100 %
х л – 10 %, х = = 1 л кислоты во втором растворе, всего 2,8 литра.
Так как масса кислоты не меняется, а общая масса растворов 12 + 10 = 22 л, то получим
22 л – 100 %
2,8л – х %, х = ≈ 12,7 %.
О т в е т: 12,7 % кислоты.[4]
Алгебраический способ
Задача 4. Сколько граммов воды надо добавить к 50 г раствора, содержащего 8 % соли, чтобы получить 5 %-ный раствор?
Начнём решение этой задачи не с составления уравнения, а с вопросов, которые помогут уяснить условие и осознанно подойти к ее решению, используем так же при этом понятие пропорции.
Вопросы:
1) Сколько граммов соли содержится в имеющемся растворе?
(50 · 0,08 = 4 г.)
2) Если к имеющемуся раствору добавить воды, изменится ли массовая составляющая соли? (Нет.)
3) При добавлении воды изменится ли процентное содержание соли в растворе? (Да.)
4) Если к имеющемуся раствору добавить х г воды, какова станет масса всего раствора? (50 + х).
5) Каково процентное содержание соли в новом растворе? (5 %.)
6) Какую пропорцию, согласно полученным результатам, можно составить?
4 г соли – 5 %
(50 + х) г раствора – 100 %.
Имеем уравнение:
5 (50 + х) = 400, откуда х = 30.
О т в е т: 30 г.
Поскольку при добавлении к раствору какого-либо вещества масса другого вещества не изменяется, а меняется его процентное содержание, то сначала необходимо найти массу неизменяющегося вещества.
Затем за х обозначить массу добавляемого вещества и составить пропорцию, в которой масса неизменного вещества будет составлять новое количество процентов, а масса всего раствора 100 %. [2]
[2]
Решим данные задачи по составленному выше алгоритму.
Задача 5. Сколько граммов воды нужно выпарить из 80 г 6 %-ного раствора соли, чтобы получить раствор, содержащий 10 % соли?
Решение:
Масса соли в имеющемся растворе равна 80 · 0,06 = 4,8 г. В новом растворе соль будет составлять 10 %.
Пусть х г воды нужно выпарить, тогда масса нового раствора будет равна (80 – х) г.
Составим пропорцию:
4,8 г соли – 10 %;
(80 – х) г раствора – 100 %.
Получаем уравнение:
10 (80 – х) = 4,8 · 100, откуда х = 32.
Задача 6. Сколько граммов 75%-ного раствора кислоты надо добавить к 30 г 15%-ного раствора этой же кислоты, чтобы получить 50%-ный раствор?
х г — количество 75%-ного раствора кислоты, которое надо добавить;
(30 + х) г — масса получившегося 50%-ного раствора кислоты;
0,75х г — количество кислоты в х г 75%-ного раствора;
0,15 ∙ 30 г — количество кислоты в 30 г 15%-ного раствора;
0,5(30 + х) г — количество кислоты в 50%-ном растворе. Имеем уравнение:
Имеем уравнение:
в 75%-ном + в 15%-ном = в 50%-ном
растворе растворе растворе
0,75х + 0,15 ∙ 30 = 0,5(30 + х)
0,75х + 0,15 ∙ 30 = 0,5(30 + х), откуда х = 46 г.
Ответ: 46 грамм.[1]
Решение задач с помощью систем уравнений
Задачи такого типа последние годы встречаются на Основном Государственном Экзамене и Едином Государственном Экзамене.
Задача 7. В колбу налили некоторое количество 60% -ного раствора соли и некоторое количество 80%-ного раствора этой же соли. Получили 35 мл раствора, содержащего 72% соли. Сколько миллилитров каждого раствора налили в колбу? Решим задачу, используя следующий план:
Обозначим буквами количество 60%-ного и 80%-ного растворов соли, налитых в колбу.
Запишем уравнение, связывающее эти две величины и общее количество раствора.
Определим количество соли в получившемся растворе.
Запишем уравнение, связывающее количество соли в 60%-ном, 80%-ном и получившемся растворах.
Составим систему и решим ее.
1) Пусть взяли х мл 60 %-ного раствора соли и у мл 80 %-ного раствора.
2) x + у = 35.
3) 0,6x + 0,8у (количество соли в получившемся растворе).
4) 0,6x + 0,8у = 35 ∙ 0,72.
0,6x + 0,8у = 25,2.
5)
Решив эту систему, получим, что х = 14 и у = 21.
Ответ: 14 мл 60 %-ного раствора и 21 мл 80 %-ного раствора.
Рассмотрим арифметический способ, который использовался в старину.
1) Найдем разность между процентным содержанием соли в каждом из имеющихся растворов и полученном растворе:
72 % – 60 % = 12 %;
80 % – 72 % = 8 %.
2) Эти результаты показывают, что 60 %-ного раствора нужно взять 8 частей, а 80 %-ного – 12 частей, то есть растворы должны быть взяты в отношении 2 : 3.
Поскольку в результате получим 35 мл раствора, то 60 %-ного взяли 14 мл, а 80 %-ного – 21 мл. [5]
Задача 8. Сразу после сбора урожая процентное содержание воды в бананах составляет 75%. После их перевозки процентное содержание воды в них становится равным 70%. Сколько килограммов бананов надо приобрести, чтобы после перевозки осталось 2500 кг бананов? [6]
Решение. Определим содержание так называемого «сухого вещества»: после сбора урожая его содержится 25%, после перевозки – 30%. Его масса после перевозки составит 2500 : 100 · 30 = 750 кг, но т. к. она остаётся неизменной и после сбора урожая это 25%, то нужно собрать 3000 кг бананов.
Его масса после перевозки составит 2500 : 100 · 30 = 750 кг, но т. к. она остаётся неизменной и после сбора урожая это 25%, то нужно собрать 3000 кг бананов.
О т в е т: 3000 кг.
Задача 9. Смешав 25-процентныйи и 95-процентный растворы кислоты добавив 20 кг чистой воды, получили 40-процентный раствор кислоты. Если бы вместо 20 кг воды добавили 20 кг 30-процентного раствора той же кислоты, то получили бы 50-процентный раствор кислоты. Сколько килограммов 25-процентного раствора использовали для получения смеси? [7]
Заключение
Задачи, которые мы решили,— это так называемая задача на концентрацию. Концентрацией раствора называют отношение массы содержащегося в нем сухого вещества к массе раствора, выраженное в процентах. С процентами приходится иметь дело и при решении многих других задач, например задач на вычисление прибыли с банковских вкладов, дохода от инвестиций, на расчет объемов выполненных работ. Все такие задачи нетрудно решить, если вы умеете выражать проценты обыкновенной или десятичной дробью и решать главную задачу на проценты — находить процент от заданной величины. Иногда удобно решать их или с помощью пропорции или системой уравнений. И тот и другой способы широко применяются при решении химических задач.
Все такие задачи нетрудно решить, если вы умеете выражать проценты обыкновенной или десятичной дробью и решать главную задачу на проценты — находить процент от заданной величины. Иногда удобно решать их или с помощью пропорции или системой уравнений. И тот и другой способы широко применяются при решении химических задач.
Литература
1. Дорофеев Г. В., Суворова С. Б. и др. Алгебра: учебник для 8 класса общеобразовательных учреждений. — М.: Просвещение, 2010. — 288 с.
2. Дюмина Т. Ю. Алгебра. 8 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. I полугодие.— Волгоград: Учитель, 2008. —205 с.
3. Дюмина Т. Ю. Математика. 6 класс: поурочные планы по учебнику Г. В. Дорофеева, С. Б. Суворовой, И. Ф. Шарыгина и др. Часть 1. — Волгоград: Учитель, 2006. — 235 с.
4. Калинина М. Ф. Алгебра. 7 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. — Волгоград: Учитель, 2008. — 223 с.
В. Дорофеева. — Волгоград: Учитель, 2008. — 223 с.
5. Дюмина Т. Ю. Алгебра. 8 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. II полугодие.— Волгоград: Учитель, 2009. —263 с.
6. Под редакцией Лысенко Ф.Ф. и Калабухова С.Ю. Математика 9 класс. Подготовка к ОГЭ-2016. 40 тренировочных вариантов. – Ростов-на-Дону: Легион, 2015. – 400 с.
7. Под ред. Ященко И.В. ЕГЭ. Математика. Профильный уровень: типовые экзаменационные варианты: 36 вариантов. – М.: Издательство «Национальное образование», 2016. – 256 с.
Просмотров работы: 15791
Задачи на смеси и сплавы — 4ЕГЭ
26 марта 2022
В закладки
Обсудить
Жалоба
TG 4ЕГЭ
Пробные работы ЕГЭ по математике
Подборка задач для самостоятельной работы.
sm-sp.docx
1. Бронза – сплав меди и олова. В древности из бронзы отливали колокола, если в ней содержалось 75% меди. К куску бронзы 500кг и содержащему 72% добавили некоторое количество бронзы, содержащей 80% меди и получили бронзу, необходимую для изготовления колокола. Определите сколько добавили 80% бронзы.
К куску бронзы 500кг и содержащему 72% добавили некоторое количество бронзы, содержащей 80% меди и получили бронзу, необходимую для изготовления колокола. Определите сколько добавили 80% бронзы.
Ответ: 300кг.
2. В лаборатории изготовили 1кг 16% солевого раствора. Через неделю из этого раствора испарилось 200г воды. Какова стала концентрация соли в растворе?
Ответ: 20%.
3. При выплавке стали из чугуна, выжигается углерод. Содержание углерода в чугуне 4%. Сколько тонн углерода нужно выжечь из 245т чугуна, чтобы получилась сталь с содержанием углерода 2%?
Ответ: 5т.
4. Имеется 600г сплава золота и серебра содержащего золото и серебро в отношении 1:5 соответственно. Сколько грамм золота необходимо добавить к этому сплаву чтобы получить новый сплав содержащий 50% серебра.
Ответ: 400г.
5. Слиток сплава меди и цинка массой 36 кг содержит 45% меди. Какую массу меди надо добавить к этому куску, чтобы полученный сплав содержал 60% меди?
Ответ: 13,5кг.
6. После смешивания двух растворов, один из которых содержал 48 г, а другой — 20 г безводного йодистого калия, получилось 200 г нового раствора. Найдите концентрацию каждого из первоначальных растворов, если концентрация первого на 15% больше концентрации второго.
Ответ: 40% и 25%.
7. Имелось два слитка меди. Процент содержания меди в первом слитке на 40% меньше, чем во втором. После того как оба слитка сплавили, получился слиток, содержащий 36% меди. Найдите процентное содержание меди в каждом слитке, если в первом было 6 кг меди, а во втором — 12 кг.
Ответ: 20% и 60%.
8. Сколько чистого спирта нужно добавить к 735 г 16%-ного раствора йода и спирта, чтобы получить 10%-ный раствор?
Ответ: 441г.
9. Смешали 30%-ный раствор соляной кислоты с ее 10%-ным раствором и получили 600 г 15%-ного раствора. Сколько граммов 30 % -ного раствора было взято?
Ответ: 150г.
10. В сосуде находится 10%-ный раствор спирта. Из сосуда отлили 1/3 содержимого, а оставшуюся часть долили водой так, что сосуд оказался заполненным на 5/6 первоначального объема. Какое процентное содержание спирта оказалось в сосуде?
Из сосуда отлили 1/3 содержимого, а оставшуюся часть долили водой так, что сосуд оказался заполненным на 5/6 первоначального объема. Какое процентное содержание спирта оказалось в сосуде?
Ответ: 8%.
11. Имеются два слитка, состоящие из цинка, меди и олова. Известно, что первый слиток массой 150 кг содержит 40% олова, а второй массой 250 кг — 26% меди. Процентное содержание цинка в обоих слитках одинаково. Сплавив первый и второй слитки, получили сплав, в котором оказалось 30% цинка. Сколько килограммов олова содержится в полученном сплаве?
Ответ: 170 кг.
12. Имеются два сплава, состоящие из меди, цинка и олова. Известно, что первый сплав содержит 25% цинка, а второй — 50% меди. Процентное содержание олова в первом сплаве в 2 раза меньше, чем во втором. Сплавив 200 кг первого сплава и 300 кг второго, получили новый сплав, в котором оказалось 28% цинка. Определите, сколько килограммов меди содержится в получившемся новом сплаве.
Ответ: 280 кг.
13. Из сосуда, содержащего чистый спирт, отлили 20% содержимого и добавили такое же количество воды. Затем снова отлили 20% содержимого и добавили такое же количество воды. Какое минимальное количество раз надо повторить этот процесс, чтобы содержание спирта в сосуде стало меньше 30%?
Ответ: 6 раз.
14. Сплав весит 2 кг и состоит из серебра и меди, причем вес серебра составляет 14 % веса меди. Сколько серебра в данном сплаве?
Ответ: 0,25 кг.
15. Имелись два разных сплава меди, причем процент содержания меди в первом сплаве был на 40% меньше, чем во втором. После того как их сплавили вместе, получили сплав, содержащий 36% меди. Определите процентное содержание меди в обоих сплавах, если известно, что в первом ее 6 кг, а во втором — вдвое больше.
Ответ: 20% и 60%.
16. Два раствора, первый из которых содержал 800 г, а второй 600 г безводной серной кислоты, смешали и получили 10 кг нового раствора серной кислоты. Определите массу первого и второго растворов, вошедших в смесь, если известно, что процент содержания безводной серной кислоты в первом растворе на 10% больше, чем во втором.
Определите массу первого и второго растворов, вошедших в смесь, если известно, что процент содержания безводной серной кислоты в первом растворе на 10% больше, чем во втором.
Ответ: 4кг и 6 кг.
17. Морская вода содержит 5% (по весу) соли. Сколько килограммов пресной воды надо прибавить к 40 кг морской воды, чтобы содержание соли в последней составляло 2%?
Ответ: 60 кг.
18. Имеется стальной лом двух сортов с содержанием никеля 5% и 40%. Сколько нужно взять металла каждого из этих сортов, чтобы получить 140 т стали с содержанием 30% никеля?
Ответ: 40т и 100т.
19. Свежие грибы по весу содержат 90% воды, а сухие 12% воды. Сколько получится сухих грибов из 22 кг свежих?
Ответ: 2,5 кг.
20. Имеется сплав серебра с медью. Вычислите вес и пробу этого сплава, если его сплав с 3 кг чистого серебра есть сплав 900-й пробы, а его сплав с 2 кг сплава 900-й пробы есть сплав 840 пробы. (Проба благородного металла, равная например, 760 означает, что масса этого благородного металла в сплаве составляет 0,760 от массы всего сплава. )
)
Ответ: Вес первоначального сплава 3кг его проба 0,8.
21. Имеются три слитка. Первый весит 5 кг, второй 3 кг и каждый из этих слитков содержит 30% меди. Если первый слиток сплавить с третьим, то получится слиток, содержащий 56% меди, а если второй слиток сплавить с третьим, то получится слиток, содержащий 60% меди. Найдите вес третьего слитка и процент содержания меди в нем.
Ответ: 10кг; 69%
22. Один сплав меди с оловом содержит эти металлы в отношении 2:3, другой — в отношении 3 : 7. В каком количестве надо взять эти сплавы, чтобы получить 12 кг нового сплава, в котором медь и олово были бы в отношении 3:5?
Ответ: 9кг и 3кг.
23. 40% раствор серной кислоты разбавили 60% раствором, после чего добавили 5кг воды и получили раствор 20% концентрации. Если бы вместо 5кг воды добавили 5 кг 80% раствора серной кислоты, то получился бы 70% раствор. Сколько было 40% и 60% раствора серной кислоты?
Ответ: 1кг 40% и 2кг 60%.
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействие, дозировка и обзоры
Обзор
Йод — это элемент, который используется щитовидной железой. Люди не могут производить йод, поэтому его необходимо потреблять. Его добавляют в некоторые продукты, а также в соль.
Йод снижает уровень гормона щитовидной железы и может убивать грибки, бактерии и другие микроорганизмы, такие как амебы. Дефицит йода является одной из наиболее распространенных и предотвратимых проблем со здоровьем в мире. Большая часть йода содержится в океане, где он концентрируется морскими обитателями, особенно в водорослях.
Йод принимают внутрь для профилактики и лечения дефицита йода и его последствий, включая зоб и некоторые заболевания щитовидной железы. Определенный вид йода, называемый йодидом калия, также одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для предотвращения повреждения щитовидной железы после радиоактивной аварии. Йод также используется при конъюнктивите, инфекциях десен, заживлении ран и многих других состояниях, но научные данные, подтверждающие многие из этих применений, ограничены.
Йод также используется при конъюнктивите, инфекциях десен, заживлении ран и многих других состояниях, но научные данные, подтверждающие многие из этих применений, ограничены.
Использование и эффективность ?
Вероятно действует на
- Дефицит йода. Прием добавок йода внутрь, включая йодированную соль, эффективен для профилактики и лечения дефицита йода.
- Радиационное облучение. Прием йода внутрь может защитить щитовидную железу после облучения в радиационной аварийной ситуации. Но его не следует использовать для общей защиты от радиации.
Возможно эффективен для
- Розовый глаз. Использование глазных капель, содержащих йод в форме повидон-йода, по-видимому, снижает риск конъюнктивита у новорожденных. Это также помогает лечить конъюнктивит у взрослых.
- Язвы на ногах у людей с диабетом. Нанесение йода на язвы на ногах может помочь в лечении язв на ногах, связанных с диабетом.
- Отек (воспаление) слизистой оболочки матки (эндометрит).
 Промывание влагалища раствором, содержащим йод в форме повидон-йода, перед кесаревым сечением снижает риск отека слизистой оболочки матки.
Промывание влагалища раствором, содержащим йод в форме повидон-йода, перед кесаревым сечением снижает риск отека слизистой оболочки матки. - Тип доброкачественного (неракового) заболевания молочной железы (фиброзно-кистозная мастопатия). Прием молекулярного йода в дозе около 3000-6000 мкг в день уменьшает болезненность молочных желез и боль. Более низкие дозы 1500 мкг в день не помогают.
- Отек (воспаление) и язвы во рту (оральный мукозит). Полоскание рта раствором йода, по-видимому, предотвращает болезненность и отек во рту, вызванные химиотерапией.
- Серьезная инфекция десен (периодонтит). Полоскание рта раствором йода во время нехирургического лечения инфекций десен может помочь уменьшить глубину инфицированных карманов десен.
- Инфекция после операции. Применение йода в виде повидон-йода до или во время операции снижает риск инфекций. Но неясно, как он сравнивается с другими вариантами, такими как хлоргексидин, для предотвращения инфекций.
- Опасное для жизни состояние, вызванное избытком гормонов щитовидной железы (тиреоидный шторм).
 Прием йода внутрь в сочетании с другими методами лечения может помочь в лечении тиреотоксического криза.
Прием йода внутрь в сочетании с другими методами лечения может помочь в лечении тиреотоксического криза. - Уплотнения в щитовидной железе. Прием йода внутрь может улучшить состояние узлов щитовидной железы, называемых узлами щитовидной железы.
- Язвы на ногах, вызванные слабым кровообращением (венозные язвы на ногах). Нанесение кадексомера йода на кожу может помочь заживлению язв на ногах. Но неясно, помогает ли применение повидон-йода.
Возможно неэффективен для
- Инфекции у людей с катетерами. Применение повидон-йода там, где вставлен диализный катетер, по-видимому, не так эффективно, как хлоргексидин, для снижения риска заражения крови. Применение повидон-йода перед установкой мочевого катетера не снижает риск инфекции.
- Рост и развитие недоношенных детей. Кормление недоношенных детей добавками йода не улучшает развитие их мозга и не снижает риск смерти.
Существует интерес к использованию йода для ряда других целей, но нет достаточно надежной информации, чтобы сказать, может ли он быть полезен.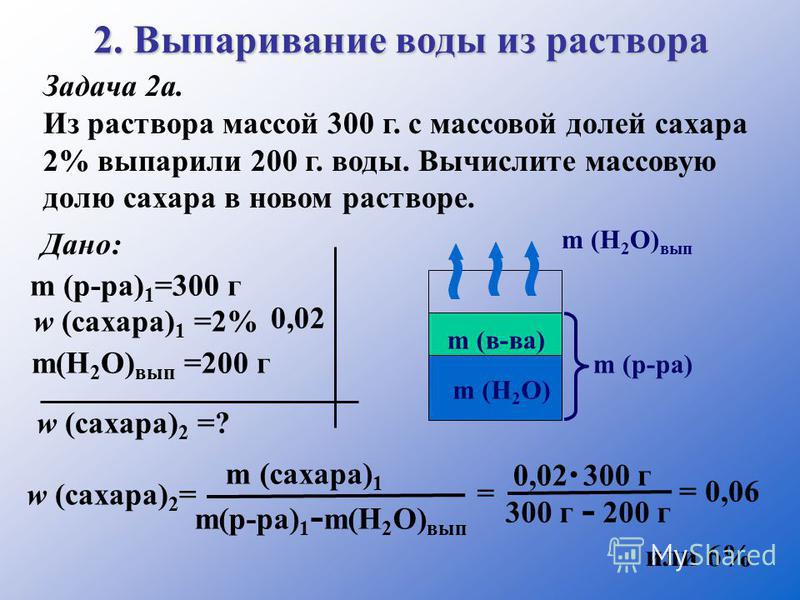
Побочные эффекты
При приеме внутрь : Йод, вероятно, безопасен для большинства людей при приеме в дозах менее 1100 мкг в день. Большие количества или длительное использование йода, возможно, небезопасно. Взрослым следует избегать длительного применения более высоких доз без надлежащего медицинского наблюдения. Более высокое потребление может увеличить риск побочных эффектов, таких как проблемы со щитовидной железой. Йод в больших количествах может вызвать металлический привкус, болезненность зубов и десен, жжение во рту и горле, расстройство желудка и многие другие побочные эффекты.
При нанесении на кожу : Йод, вероятно, безопасен для большинства людей при использовании соответствующих разбавленных продуктов. 2% раствор йода является рецептурным продуктом, одобренным FDA.
Особые меры предосторожности и предупреждения:
Беременность и кормление грудью : Йод, вероятно, безопасен при приеме внутрь в рекомендуемых количествах или при правильном нанесении на кожу с использованием утвержденного продукта (2% раствор). Не принимайте более 1100 мкг йода в день, если вам больше 18 лет; не брать больше 900 мкг йода ежедневно, если вам 14-18 лет. Йод, возможно, небезопасен при приеме внутрь в больших дозах. Более высокое потребление может вызвать проблемы со щитовидной железой у ребенка.
Не принимайте более 1100 мкг йода в день, если вам больше 18 лет; не брать больше 900 мкг йода ежедневно, если вам 14-18 лет. Йод, возможно, небезопасен при приеме внутрь в больших дозах. Более высокое потребление может вызвать проблемы со щитовидной железой у ребенка.
Дети : Йод, вероятно, безопасен при приеме внутрь в соответствующих дозах в зависимости от возраста. Дозы не должны превышать 200 мкг в день для детей от 1 до 3 лет, 300 мкг в день для детей от 4 до 8 лет, 600 мкг в день для детей от 9 до 13 лет и 900 мкг в день для подростков.
Тип сыпи, называемый герпетиформным дерматитом : Прием йода может усилить сыпь.
Заболевания щитовидной железы : Длительное применение или высокие дозы йода могут усугубить некоторые заболевания щитовидной железы, включая гипотиреоз, увеличение щитовидной железы (зоб) или опухоль щитовидной железы. Кроме того, люди с аутоиммунным заболеванием щитовидной железы могут быть особенно чувствительны к вредному воздействию йода.
Особые меры предосторожности и предупреждения
При приеме внутрь : Йод, вероятно, безопасен для большинства людей при приеме в дозах менее 1100 мкг в день. Большие количества или длительное использование йода, возможно, небезопасно. Взрослым следует избегать длительного применения более высоких доз без надлежащего медицинского наблюдения. Более высокое потребление может увеличить риск побочных эффектов, таких как проблемы со щитовидной железой. Йод в больших количествах может вызвать металлический привкус, болезненность зубов и десен, жжение во рту и горле, расстройство желудка и многие другие побочные эффекты.
При нанесении на кожу : Йод, вероятно, безопасен для большинства людей при использовании соответствующих разбавленных продуктов. 2% раствор йода является рецептурным продуктом, одобренным FDA.
Особые меры предосторожности и предупреждения:
Беременность и кормление грудью : Йод, вероятно, безопасен при приеме внутрь в рекомендуемых количествах или при правильном нанесении на кожу с использованием утвержденного продукта (2% раствор). Не принимайте более 1100 мкг йода в день, если вам больше 18 лет; не брать больше 900 мкг йода ежедневно, если вам 14-18 лет. Йод, возможно, небезопасен при приеме внутрь в больших дозах. Более высокое потребление может вызвать проблемы со щитовидной железой у ребенка.
Не принимайте более 1100 мкг йода в день, если вам больше 18 лет; не брать больше 900 мкг йода ежедневно, если вам 14-18 лет. Йод, возможно, небезопасен при приеме внутрь в больших дозах. Более высокое потребление может вызвать проблемы со щитовидной железой у ребенка.
Дети : Йод, вероятно, безопасен при приеме внутрь в соответствующих дозах в зависимости от возраста. Дозы не должны превышать 200 мкг в день для детей от 1 до 3 лет, 300 мкг в день для детей от 4 до 8 лет, 600 мкг в день для детей от 9 до 13 лет и 900 мкг в день для подростков.
Тип сыпи, называемый герпетиформным дерматитом : Прием йода может усилить сыпь.
Заболевания щитовидной железы : Длительное применение или высокие дозы йода могут усугубить некоторые заболевания щитовидной железы, включая гипотиреоз, увеличение щитовидной железы (зоб) или опухоль щитовидной железы. Кроме того, люди с аутоиммунным заболеванием щитовидной железы могут быть особенно чувствительны к вредному воздействию йода.
Взаимодействие ?
Амиодарон содержит йод. Прием добавок йода вместе с амиодароном может повысить уровень йода в крови. Слишком много йода в крови может вызвать побочные эффекты, влияющие на щитовидную железу.
Большое количество йода может снизить функцию щитовидной железы. Литий также может снижать функцию щитовидной железы. Прием йода вместе с литием может слишком сильно снизить функцию щитовидной железы. Не принимайте большое количество йода, если вы принимаете литий.
Йод может усиливать или ослаблять функцию щитовидной железы. Прием йода вместе с лекарствами от гиперактивности щитовидной железы может изменить действие этих лекарств. Не принимайте йодсодержащие добавки, если вы принимаете лекарства от гиперактивности щитовидной железы, за исключением случаев, когда это рекомендовано врачом.

Умеренное взаимодействие
Будьте осторожны с этой комбинацией
Дозировка
Йод является важным питательным веществом, содержащимся в йодированной соли, морских продуктах, таких как морские водоросли, а также яйцах и коровьем молоке. Количество, которое следует потреблять ежедневно, называется рекомендуемой диетической нормой (RDA). Для взрослых RDA составляет 150 мкг в день. Во время беременности RDA составляет 220 мкг в день. При кормлении грудью рекомендуемая суточная доза составляет 290 мкг. У детей RDA зависит от возраста.
Йод также доступен в виде добавок и различных растворов для местного применения, глазных капель, жидкостей для полоскания рта, мазей и скрабов. Поговорите с поставщиком медицинских услуг, чтобы узнать, какой тип продукта и доза лучше всего подходят для конкретного состояния.
Посмотреть ссылки
Вам также могут понравиться
Посмотреть больше
УСЛОВИЯ ИСПОЛЬЗОВАНИЯ И ВАЖНАЯ ИНФОРМАЦИЯ: Эта информация предназначена для дополнения, а не для замены рекомендаций вашего врача или поставщика медицинских услуг, и не предназначена для охвата всех возможных применений. , меры предосторожности, взаимодействие или побочные эффекты. Эта информация может не соответствовать состоянию вашего здоровья. Никогда не откладывайте и не пренебрегайте обращением за профессиональной медицинской консультацией к своему врачу или другому квалифицированному поставщику медицинских услуг из-за чего-то, что вы прочитали на WebMD. Вы всегда должны поговорить со своим врачом или медицинским работником, прежде чем начать, прекратить или изменить любую предписанную часть вашего плана медицинского обслуживания или лечения, а также определить, какой курс терапии подходит именно вам.
, меры предосторожности, взаимодействие или побочные эффекты. Эта информация может не соответствовать состоянию вашего здоровья. Никогда не откладывайте и не пренебрегайте обращением за профессиональной медицинской консультацией к своему врачу или другому квалифицированному поставщику медицинских услуг из-за чего-то, что вы прочитали на WebMD. Вы всегда должны поговорить со своим врачом или медицинским работником, прежде чем начать, прекратить или изменить любую предписанную часть вашего плана медицинского обслуживания или лечения, а также определить, какой курс терапии подходит именно вам.
Этот защищенный авторским правом материал предоставлен Потребительской версией комплексной базы данных Natural Medicines. Информация из этого источника является доказательной, объективной и не имеет коммерческого влияния. Для получения профессиональной медицинской информации о натуральных лекарствах см. Профессиональную версию комплексной базы данных натуральных лекарств.
© Факультет терапевтических исследований, 2020.
Сульфат никеля(II), используемый для никелирования, получают путем обработки…
Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Клеточная биология
Математика
- Алгебра колледжа
- Тригонометрия
- Предварительное исчисление
Физика
- Физика
Бизнес
- Микроэкономика
- Macroeconys
- Financial Accounting
Social Socials 9005
 список.
список.- 3. Химические реакции
- Стехиометрия
Задача
Соответствующее решение
2m
Воспроизведите видео:
Итак, ребята, у нас есть сбалансированная реакция ниже, которая показывает горение пропана. Верно? Таким образом, у нас есть пропан, сгорающий с кислородом, производящим C. 02 и воду. Итак, если нам говорят, что у нас есть 132 грамма С3Н8 пропана, это полностью сгорает. Нам нужно рассчитать массу в граммах кислорода, необходимого для этого процесса. Итак, нам нужен массивный кислород, учитывая массу пропана. Хорошо, так что давайте идти вперед и начать. Итак, мы уже сказали, что это уравновешенная реакция. Так что нам не нужно проверять. Но вы все равно можете пойти и проверить, он сбалансирован, и мы готовы начать. Итак, 132,1 грамма пропана. Это то, с чего мы собираемся начать. Потому что это единственное, что мы знаем, что мы дали нам. И мы продолжим и переведем это в моли, чтобы мы могли провести множественное сравнение между пропаном и кислородом, чтобы найти массу 02. Итак, в одном моле пропана, сколько у нас граммов? Это как раз молярная масса пропана. Давайте продолжим и найдем это сбоку. Итак, у нас есть углерод и водород. У углерода их три. Верно? И каждый из них весит 12. Таким образом, мы получаем 36 граммов. И тогда для водорода у нас есть восемь из них. Они весят 1,01 каждый. То есть 8,08 г. И тогда в сумме это будет 44,08 грамма пермаля. Это молярная масса пропана. Итак, мы собираемся положить это на дно. Итак, 44,08 грамма С три Н восемь В одном моле его. Хорошо, так что отмени. И теперь у нас есть родинки. Теперь мы можем сделать множественное сравнение, верно? Итак, мы видим, что имеется только один моль пропана. Мы поместим это внизу, чтобы оно могло компенсироваться. Таким образом, на каждый моль пропана мы используем пять молей О2. Итак, моли О должны быть наверху, потому что это то, что мы хотим. Верно? Итак, теперь, когда у нас есть моли 02, мы можем очень легко преобразовать его в граммы прямо в массу и граммы. Итак, опять же, нам просто нужна молярная масса 02.
Итак, в одном моле пропана, сколько у нас граммов? Это как раз молярная масса пропана. Давайте продолжим и найдем это сбоку. Итак, у нас есть углерод и водород. У углерода их три. Верно? И каждый из них весит 12. Таким образом, мы получаем 36 граммов. И тогда для водорода у нас есть восемь из них. Они весят 1,01 каждый. То есть 8,08 г. И тогда в сумме это будет 44,08 грамма пермаля. Это молярная масса пропана. Итак, мы собираемся положить это на дно. Итак, 44,08 грамма С три Н восемь В одном моле его. Хорошо, так что отмени. И теперь у нас есть родинки. Теперь мы можем сделать множественное сравнение, верно? Итак, мы видим, что имеется только один моль пропана. Мы поместим это внизу, чтобы оно могло компенсироваться. Таким образом, на каждый моль пропана мы используем пять молей О2. Итак, моли О должны быть наверху, потому что это то, что мы хотим. Верно? Итак, теперь, когда у нас есть моли 02, мы можем очень легко преобразовать его в граммы прямо в массу и граммы. Итак, опять же, нам просто нужна молярная масса 02. Итак, в одном моле 02 и молях О. Чтобы пойти на дно. Так что мы можем отменить это. Сколько там граммов? Что касается кислорода, то это 16 г. Верно? Их двое. 16 умножить на два равно 32. Итак, в одном моле 02 содержится 32 г 02. Таким образом, моли сокращаются, и теперь у нас есть граммы 02. И это будет нашим ответом. Итак, давайте продолжим и разделим и умножим здесь все правильно. И это должно дать вам 4790,5 г co два. Итак, это будет наш ответ для массы и граммов CO. Два нужны для этой реакции горения. Большое спасибо за просмотр.
Итак, в одном моле 02 и молях О. Чтобы пойти на дно. Так что мы можем отменить это. Сколько там граммов? Что касается кислорода, то это 16 г. Верно? Их двое. 16 умножить на два равно 32. Итак, в одном моле 02 содержится 32 г 02. Таким образом, моли сокращаются, и теперь у нас есть граммы 02. И это будет нашим ответом. Итак, давайте продолжим и разделим и умножим здесь все правильно. И это должно дать вам 4790,5 г co два. Итак, это будет наш ответ для массы и граммов CO. Два нужны для этой реакции горения. Большое спасибо за просмотр.
Связанные видео
Связанная практика
The Mole: Номер и Stoichiometry
.Просмотр
Stoichiometry
от Jules Bruno
488Views
Стоихиометрия — Ограничение и избыточный реагент, теоретический и процентный урожай — химия
. , Практические задачи по молярным отношениям
от The Organic Chemistry Tutor
240views
Стехиометрия: Study Hall Chemistry #10: ASU + Crash Course
от Университета штата Аризона
115views
Stoichiometry
от учителя PET
97Views
Стеихиометрия Сделано легко:
9
9
66666.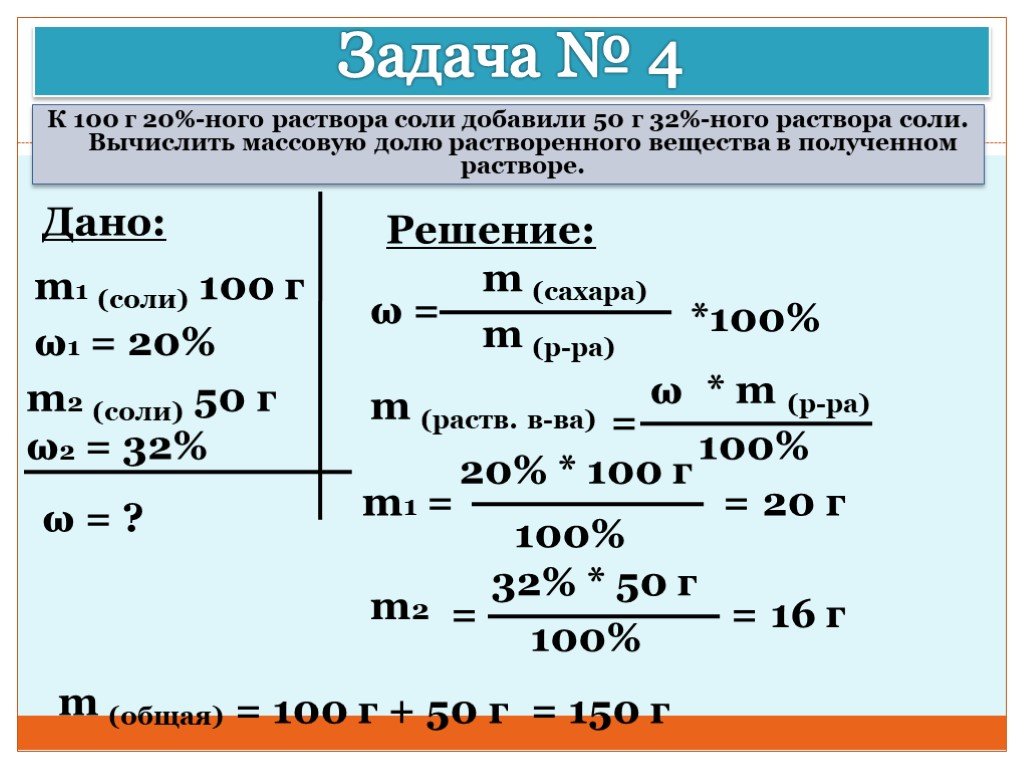

 Промывание влагалища раствором, содержащим йод в форме повидон-йода, перед кесаревым сечением снижает риск отека слизистой оболочки матки.
Промывание влагалища раствором, содержащим йод в форме повидон-йода, перед кесаревым сечением снижает риск отека слизистой оболочки матки. Прием йода внутрь в сочетании с другими методами лечения может помочь в лечении тиреотоксического криза.
Прием йода внутрь в сочетании с другими методами лечения может помочь в лечении тиреотоксического криза.
Leave A Comment