Очень сложный вопрос. Нужна помощь. Вопрос 3 § 4-6 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Очень сложный вопрос. Нужна помощь. Вопрос 3 § 4-6 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди(II) и гидроксида калия; в) сульфата цинка, хлорида магния и ортофосфата натрия; г) хлорида железа(III) и сульфата магния.
ответы
а)
Реакция пойдет до конца, так как BaSО4 выпадает в осадок.
б)
Реакция идет до конца, так как Си(ОН)2 выпадает в осадок.
в)
Реакции идут до конца, так как Zn3(PO4)2 и Mg3(PO4)2 нерастворимы
г)
Fe2(SO4)3 и MgCl2 — растворимые соли, значит, реакция протекать не будет.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Хлорид железа(II), химические свойства, получение
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Части периодической таблицы
Группа 2A (или IIA ) периодической таблицы являются щелочными земные металлы : бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они тяжелее и менее реакционноспособны, чем щелочные металлы группы 1А. Имя приходит от того, что оксиды этих металлов давали основные растворы при растворении в воде и оставались твердыми при температурах доступны древним алхимикам. Как и элементы группы 1А, Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе. элементарная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях с наивысшей энергией.
( нс 2 ). Они меньше, чем щелочные металлы
тот же период и, следовательно, имеют более высокие энергии ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокую температуру плавления, чем щелочные металлы: бериллий плавится при 1287С, магний при 649С, кальций при 839С, стронций при 768°С, барий при 727°С и радий при 700°С. Они есть более твердые металлы, чем элементы группы 1А, но мягкие и легкие по сравнению со многими переходными металлами.
Соли металлов 2А группы менее растворимы в воде, чем соли Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2А прочно связываются с молекулами воды и кристаллизуются в виде гидраты ; среди них английская соль, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z=4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от
греческое слово, обозначающее минерал берилл, beryllo . Он находится в
земной коры с концентрацией 2,6 промилле, что делает ее 47-й по величине
обильный элемент. Первичные руды
бериллия – это берилл [алюмосиликат бериллия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ].
Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Он находится в
земной коры с концентрацией 2,6 промилле, что делает ее 47-й по величине
обильный элемент. Первичные руды
бериллия – это берилл [алюмосиликат бериллия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ].
Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Из-за небольшого размера и высокой плотности заряда бериллий через ковалентную связь вместо ионной связи. Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температурах. температуры.
Бериллий используется для изготовления окон для рентгеновских трубок (это
прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как
медь и никель для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в корпусах ядерного оружия и в атомной промышленности.
электростанции из-за его способности отражать нейтроны. Бериллий
накапливается в костях; Длительное воздействие бериллия приводит к
воспаление в легких и одышка (состояние, называемое бериллиозом).
Бериллий также используется в корпусах ядерного оружия и в атомной промышленности.
электростанции из-за его способности отражать нейтроны. Бериллий
накапливается в костях; Длительное воздействие бериллия приводит к
воспаление в легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z=12).
Магний — относительно мягкий металл серебристо-белого цвета. Название элемента происходит от Магнезия, район в Фессалии в центральной Греции. Он находится в земная кора с концентрацией 2,3%, что делает ее 7-й по величине обильный элемент. Большое количество магния также содержится в полезных ископаемых в мантии Земли. Получают из морской воды, карналита [MgKCl 3 6H 2 O], доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ], и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в
автомобилестроение и авиастроение; магниевые сплавы также используются в других
легкие устройства, такие как лестницы, камеры, велосипедные рамы, жесткий диск
диски и т. д. Магний легче окисляется, чем железо, и
используется в жертвенные аноды для защиты железных труб и других
структуры, которые легко подвергаются коррозии.
д. Магний легче окисляется, чем железо, и
используется в жертвенные аноды для защиты железных труб и других
структуры, которые легко подвергаются коррозии.
Магний горит на воздухе ярко белое пламя, и используется в фейерверках и зажигательных бомбах. (Это было используется в одноразовых лампах-вспышках, но это использование было вытеснено другими виды освещения.) Магниевые костры очень трудно зажечь наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с азот с образованием нитрида магния (Mg 3 N 2 ), и с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде известных соединений. Магний
оксид MgO используется в огнеупорных кирпичах, способных
выдерживать высокие температуры в каминах и печах (магниевый
оксид плавится при 2800 С). Гептагидрат сульфата магния, MgSO 4 7H 2 O,
более известная как английская соль, является
миорелаксант и мягкое слабительное. Гидроксид магния, Mg(OH) 2 ,
также известный как молоко магнезии, является слабительным и антацидом.
(«Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний
гидроксид плохо растворяется в воде, имеет тенденцию образовывать известковую, белую
суспензия, похожая на молоко, но со значительно
физиологические эффекты.)
Гидроксид магния, Mg(OH) 2 ,
также известный как молоко магнезии, является слабительным и антацидом.
(«Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний
гидроксид плохо растворяется в воде, имеет тенденцию образовывать известковую, белую
суспензия, похожая на молоко, но со значительно
физиологические эффекты.)
Зеленые растения содержат молекулу под названием хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота. молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтеза, энергия света превращается в химическую энергии, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами.
(углеводороды, содержащие бромуглеродные связи) с образованием магнийорганических соединений
известны как реактивы Гриньяра (в честь их первооткрывателя Виктора
Гриньяр, получивший Нобелевскую премию по химии в 1912 г. ). Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи и часто используются в синтезе органических соединений. Известно, что реактивы Гриньяра чувствительны к воде, поэтому необходимо соблюдать осторожность.
удостовериться, что аппарат, в котором идет реакция,
проведено очень сухо.
). Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи и часто используются в синтезе органических соединений. Известно, что реактивы Гриньяра чувствительны к воде, поэтому необходимо соблюдать осторожность.
удостовериться, что аппарат, в котором идет реакция,
проведено очень сухо.
Кальций (Ca, Z=20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от Латинское слово, обозначающее известь, calx . Он находится в земная кора с концентрацией 4,1%, что делает ее пятой по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существ. существ, из раковин морских организмов и кораллов кораллов
рифы (в виде кальция
карбонат, CaCO 3 ) к костям и зубам наземных
существ (в виде гидроксиапатита
кристаллы, Са 3 (PO 4 ) 2 ] 3 Ca(OH) 2 ).
существ, из раковин морских организмов и кораллов кораллов
рифы (в виде кальция
карбонат, CaCO 3 ) к костям и зубам наземных
существ (в виде гидроксиапатита
кристаллы, Са 3 (PO 4 ) 2 ] 3 Ca(OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве.
материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
воздух и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния. Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания»).
Хлорид кальция расплывается (он поглощает достаточное количество воды из воздух, который он растворяет в растворе), и используется для удаления влаги с воздуха в сырых подвалах. (Потребуется более сильный человек что я не могу назвать только что открытую коробку с хлоридом кальция, не вел себя должным образом как «несовершеннолетний распутник».)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда, такие как кальций и магний; эти соли вызывают некоторые мыла и моющие средства, выпадающие в осадок в виде «мыльной пены»; эти минералы осаждаются со временем образует «накипь» в воде обогреватели и кастрюли. Кальций можно удалить водой умягчители, которые обменивают ионы кальция на ионы натрия, которые имеют 1+ заряжается и не выпадает в осадок.
Стронций (Sr, Z=38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от
Стронтиан — город в Шотландии, где добывали минерал стронтианит. открыт, из которого впервые был выделен стронций. Он находится в
земная кора с концентрацией 370 частей на миллион, что делает ее 16-й по величине
обильный элемент. Встречается в рудах целестита [стронция
сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
открыт, из которого впервые был выделен стронций. Он находится в
земная кора с концентрацией 370 частей на миллион, что делает ее 16-й по величине
обильный элемент. Встречается в рудах целестита [стронция
сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании окрашиваются в ярко-красный цвет. по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный стронций-90 (бета-излучатель) образуется при ядерных взрывах; с он химически похож на кальций, он включается в кости у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем, и препятствует выработке эритроцитов.
Барий (Ba, Z=56).
Барий — блестящий мягкий металл. Название элемента происходит от
греческое слово barys , означающее «тяжелый», по отношению к
высокая плотность некоторых минералов бария.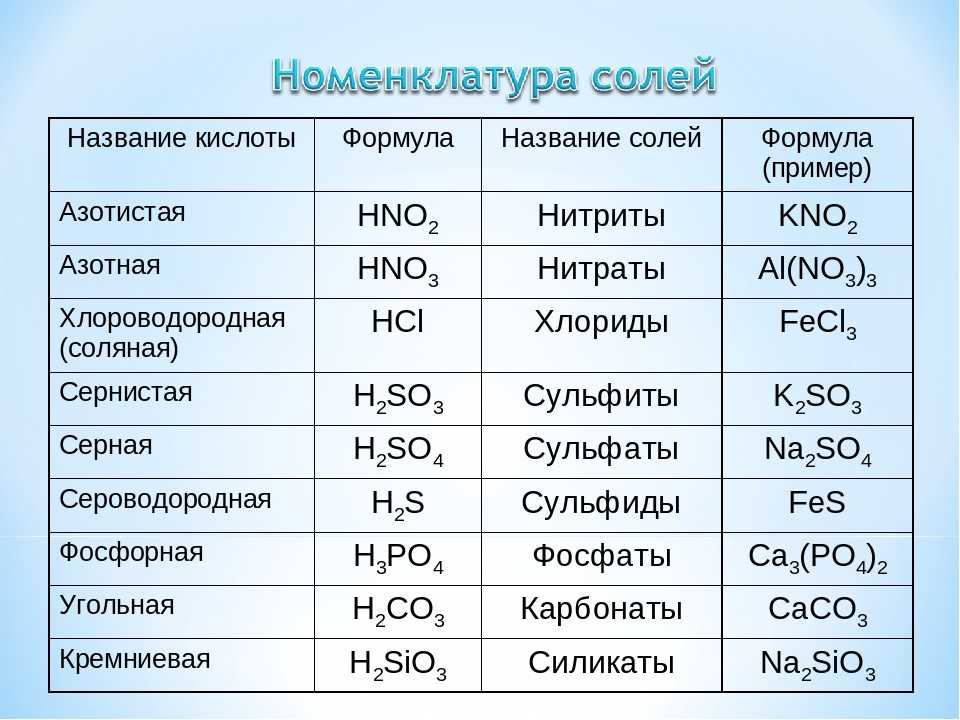 Он находится в
земная кора с концентрацией 500 частей на миллион, что делает ее 14-й по величине
обильный элемент. Встречается в баритовых рудах [сульфат бария,
БаСО 4 ] и витерит [карбонат бария, BaCO 3 ].
Он находится в
земная кора с концентрацией 500 частей на миллион, что делает ее 14-й по величине
обильный элемент. Встречается в баритовых рудах [сульфат бария,
БаСО 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в 1500-х годов в виде «болонских камней» (теперь известных как бариевые сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти камни светились в присутствии света, а также при нагревании. Соли бария при нагревании окрашиваются в зеленый цвет и используются в фейерверки (в форме нитрата бария, Ba(NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так
нерастворимым, что он проходит через тело до любого поглощения
может иметь место барий. Используется в диагностике некоторых
проблемы с кишечником в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может быть использован для рентгенографии пищеварительного тракта.
тракт.
Радий (Ra, Z=88).
Радий — мягкий, блестящий, радиоактивный металл. Название элемента произошло от латинского слова «луч» 9.0013 радиус , из-за его способность светиться в темноте слабым голубым светом. Он находится в земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее 84-й самый распространенный элемент. Он содержится в следовых количествах в урановых руд, но коммерчески используемый радий легче получить из отработавшее ядерное топливо.
Открыт радий
Пьером и Марией Кюри в 1898 году; они извлекли миллиграмм радия
из трех тонн урановой руды. Радий производится в
радиоактивный распад урана-235, урана-238, тория-232 и
плутоний-241. После его открытия и до опасностей
радиация была понята, радий использовался во многих шарлатанских лекарствах и
патентованные лекарства. Радий использовался для изготовления часов, светящихся в темноте.
лица в начале 1900-е годы; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но был остановлен
по корпусу часов по стеклу циферблата. Многие из
рабочие, расписывавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Многие из
рабочие, расписывавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
.Джон Эмсли, Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Разбавляющая вода с БПК
| | Wisconsin DNR
Питательные растворы разбавленной воды по БПК могут быть источником загрязнения. Если вы готовите свой собственный раствор, обязательно храните фосфатный буфер в холодильнике. Выбросьте любой раствор, если он станет мутным или вы заметите какие-либо «кусочки», плавающие в растворе. Использование одноразовых буферных подушек с питательными веществами позволяет избежать многих из этих ловушек.
Питательные растворы:
- Раствор сульфата магния: 22,5 г MgSO 4 •7H 2 0.
 Разбавить до 1 л.
Разбавить до 1 л. - Раствор хлорида кальция: 27,5 г CaCl 2 . Разбавить до 1 л.
- Раствор хлорида железа: 0,25 г FeCl 3 • 6H 2 0. Разбавить до 1 л.
- Фосфатный буфер: 8,5 г KH 2 P0 4 , 21,75 г K 2 HP0 4 , 33,4 г Na • 2 HP0 4 0024 0 и 1,7 г NH 4 Кл. Разбавить до 1 л.
pH должен быть 7,2.
Хранить в холодильнике при температуре 4°C.
Проверяйте перед каждым использованием на загрязнение (выбрасывайте любой реагент с ростом).
- Добавьте по 1 мл буфера PO4; MgSO 4 , CaCl 2 и FeCl 3 на литр или содержимое одной буферной подушки (купите нужный размер!).
- Перед использованием доведите температуру воды для разбавления до 20 ± 1°C.
- Насыщение DO:
- встряхнуть или проветрить отфильтрованным воздухом без органических соединений
- хранить в бутылках с ватными пробками «достаточно долго, чтобы насытиться»
Неправильные представления о воде для разбавления
Существует множество заблуждений относительно подготовки воды для разбавления. Многие учат, что воду для разбавления нельзя смешивать, аэрировать или встряхивать непосредственно перед использованием, потому что вода будет перенасыщенной. Это , а не правда. Разбавляющую воду комнатной температуры (17-23°C) можно тщательно перемешать, встряхнуть или даже аэрировать сжатым воздухом за несколько минут до использования, не опасаясь перенасыщения. Избыток кислорода физически рассеется почти сразу. На самом деле, наоборот… встряхивание воды для разбавления после того, как она уравновешивается до комнатной температуры, требуется для доведения воды до насыщения.
Многие учат, что воду для разбавления нельзя смешивать, аэрировать или встряхивать непосредственно перед использованием, потому что вода будет перенасыщенной. Это , а не правда. Разбавляющую воду комнатной температуры (17-23°C) можно тщательно перемешать, встряхнуть или даже аэрировать сжатым воздухом за несколько минут до использования, не опасаясь перенасыщения. Избыток кислорода физически рассеется почти сразу. На самом деле, наоборот… встряхивание воды для разбавления после того, как она уравновешивается до комнатной температуры, требуется для доведения воды до насыщения.
Вот несколько простых советов по приготовлению воды для разбавления:
Вода для разбавления должна быть приготовлена непосредственно перед использованием. Без фосфатного буфера вы можете приготовить воду для разбавления за несколько дней/недель. Фосфатный буфер является ключевым реагентом, поскольку фосфор является ограничивающим питательным веществом для стимуляции роста, поэтому его необходимо добавлять в день использования воды.
- Используйте только высококачественную дистиллированную или деионизированную воду.
- Перед использованием дайте воде уравновеситься в течение более 24 часов при температуре 20°C в помещении с контролируемой температурой (17-23°C).
- Добавляйте питательные буферные растворы в день использования воды.
- Избегайте загрязнения воды, позволяя воде насыщаться кислородом. Всегда накрывайте флакон ватным тампоном, губкой или чистым бумажным полотенцем.
- Если вы используете сжатый воздух, отфильтруйте воздух.
- Не допускайте контакта с водой каких-либо предметов, кроме стекла или тефлона.
Никогда не допускайте контакта трубок «аквариума» (тайгона) или воздушных камней с водой. Тайгон со временем выщелачивает материал, требующий кислорода, а воздушные камни обеспечивают прекрасную поверхность для роста бактерий. Если они используются, вы можете инокулировать воду для разбавления БПК бактериями.
Если вы хотите состарить воду для разведения, не добавляйте одноразовые питательные буферы до дня использования воды. Обратите внимание, что вам не нужно состаривать воду для лабораторных реагентов, если она приготовлена должным образом.
Чрезмерное истощение воды для разбавления
Чрезмерное истощение растворенного кислорода в бланках БПК является одной из наиболее распространенных проблем, с которыми сталкиваются все лаборатории по анализу сточных вод. Даже в лучших лабораториях иногда возникают проблемы с определением истощения растворенного кислорода в холостой пробе БПК (< 0,2 мг/л). Ниже приведены наиболее распространенные причины чрезмерного истощения заготовок:
- Трубка изготовлена из выщелачивающего материала с потребностью в кислороде
- В лаборатории не используются правильные трубки
- Рост слизи в нагнетательной трубке
- Плохое качество воды/ненадлежащее обслуживание системы
- Плохо очищенные бутыли для определения БПК или емкость для хранения разбавляющей воды.
 ПРИМЕЧАНИЕ: Стекло лучше!
ПРИМЕЧАНИЕ: Стекло лучше! - Загрязнение во время аэрации
- Плохо откалиброван датчик растворенного кислорода
Решение проблем качества разбавляющей воды
Вода в бутылках
Как правило, избегайте использования дистиллированной воды из продуктового магазина. Эта вода хранится в пластиковых бутылках, которые могут выщелачивать материалы, требующие кислорода. Некоторым аналитикам очень повезло с дистиллированной водой из продуктового магазина. Если вам повезло с определенной маркой, не меняйтесь. Однако имейте в виду, что вы не можете контролировать, как хранится вода. Если вода пролежит несколько месяцев на полке в горячем складе, это будет проблемой. Ничто так не выщелачивает органические вещества из пластика, как горячая вода.
У тех, кто успешно использовал воду из продуктового магазина, обычно есть система. Некоторые пойдут прямо на фабрику и купят свежую воду. Затем они датируют воду, хранят ее в прохладном, сухом месте и выбрасывают воду по истечении определенного возраста (например, по истечении срока годности). Практический результат: используйте его, если он работает на вас; но если это не так, рассмотрите другие альтернативы.
Практический результат: используйте его, если он работает на вас; но если это не так, рассмотрите другие альтернативы.
Разбавляющая вода для старения
Если вода подготовлена должным образом, вам не нужно проводить старение разбавляющей воды. Если вам нужно состариться, чтобы улучшить качество, вы должны сосредоточить свои усилия на улучшении процесса подготовки.
Дезодоранты и вода для разбавления
Избегайте использования дезодорантов с автоматическим дозированием в лаборатории. У вас может возникнуть соблазн использовать дезодоранты, потому что в лабораториях по очистке сточных вод может быть небольшой запах. Однако не используйте их! Обычно они используют спирт в качестве носителя, который имеет очень высокий БПК.
Системы очистки воды
Все системы очистки воды для лабораторных реагентов, как и дорогие инструменты, подвержены проблемам, если они не обслуживаются должным образом. Следуйте рекомендациям производителя по очистке и дезинфекции дистилляторов, устройств для полировки воды и систем деионизации.
Простые системы деионизации могут работать хорошо, но могут быстро зарасти бактериями и плесенью и могут выщелачивать органику. Опять же, регулярное плановое техническое обслуживание является ключом к поддержанию оптимальной работы системы.
Простая система деионизатора может и отлично работает во многих лабораториях. Однако вы должны использовать качественные первичные или ядерные смолы. Смолы более низкого качества или часто «регенерируемые» смолы для бытовых смягчителей БУДУТ выщелачивать материал, требующий кислорода, и НЕ будут работать для тестирования БПК. Не позволяйте производителю уговаривать вас покупать смолы более низкого качества, чтобы сэкономить деньги. Это подход, основанный на «мудром копейке и глупом долларе». Не жертвуйте качеством ради нескольких долларов.
Активированный уголь в системах деионизации также подвержен проблемам загрязнения. Они могут быстро заразиться бактериями и плесенью, а также могут отслаивать материал, требующий кислорода.
Хлорированная вода, непосредственно подаваемая в ионообменные системы, может разрушать и выщелачивать материал, требующий кислорода. Решение состоит в том, чтобы пропустить воду через картридж с активированным углем перед смолой.
Опыт SLH с водой для разбавления
Государственная лаборатория гигиены штата Висконсин (WSLH) построила ультрасовременную лабораторию в 1999. Они также установили современную лабораторную систему реагентной воды. Однако производитель продавал им анионообменные и катионообменные смолы более низкого качества, что позволяло им предлагать «низкие цены». WSLH не смог получить бланки БПК, соответствующие критериям истощения (т. е. <0,2 мг/л), используя эту воду. Они потратили месяцы на устранение неполадок в системе водоснабжения. После многих месяцев систематического устранения неполадок в системе WSLH обнаружил проблему и переключился на первичные или ядерные смолы. На графике показаны проблемы, с которыми они столкнулись.
Так что имейте в виду, что даже самые лучшие системы не будут производить воду, достаточно подходящую для тестирования БПК, если не используются ионообменные смолы. Установки для окончательной очистки водой НЕ удалят все органические вещества, выщелоченные из смолы более низкого качества, даже если производители заявляют, что они это сделают. Качественная лабораторная реагентная вода является основой всех лабораторий. Помните, вы получаете то, за что платите. Не экономьте и не обсчитывайте свою лабораторию, покупая «дешевую» систему.
Установки для окончательной очистки водой НЕ удалят все органические вещества, выщелоченные из смолы более низкого качества, даже если производители заявляют, что они это сделают. Качественная лабораторная реагентная вода является основой всех лабораторий. Помните, вы получаете то, за что платите. Не экономьте и не обсчитывайте свою лабораторию, покупая «дешевую» систему.
Вода для разбавления – простейшие растворы
Существует ряд простых решений для получения качественной воды для лабораторных реагентов для приготовления воды для разбавления по БПК.
- Получите воду в другой лаборатории или у другого поставщика.
- Вероятно, самый простой способ — получить воду из другой лаборатории, которая имеет опыт производства воды для разбавления неизменно высокого качества по БПК. Может быть проще возить воду раз в неделю, чем обслуживать лабораторную систему водоснабжения, особенно если у вас небольшая лаборатория.

- Покупайте воду из проверенного источника.
- Вы также можете найти коммерческий источник воды стабильного качества. Если вы найдете конкретный бренд и поставщика, который работает на вас, придерживайтесь его! Не чинить, если не сломано .
- Купите полностью стеклянный лабораторный дистиллятор и дистиллируйте воду самостоятельно.
- Если вам нужно только ограниченное количество воды (например, < 5 галлонов в неделю), подумайте о покупке цельностеклянного дистиллятора. Они менее дороги, чем другие системы очистки воды, и, как правило, производят качественную реагентную воду при условии надлежащего обслуживания.
- Купите настольную установку обратного осмоса (RO) и очиститель для воды, которая будет производить воду типа I по стандарту ASTM.
- Эти системы работают хорошо. Однако они, как правило, дороги (более 1000 долларов) и требуют регулярного обслуживания, чтобы быть эффективными.
Решение: проблема чистоты стеклянной посуды
- Используйте хорошее бесфосфатное моющее средство и отбеливатель лабораторного класса.


 Разбавить до 1 л.
Разбавить до 1 л. ПРИМЕЧАНИЕ: Стекло лучше!
ПРИМЕЧАНИЕ: Стекло лучше! 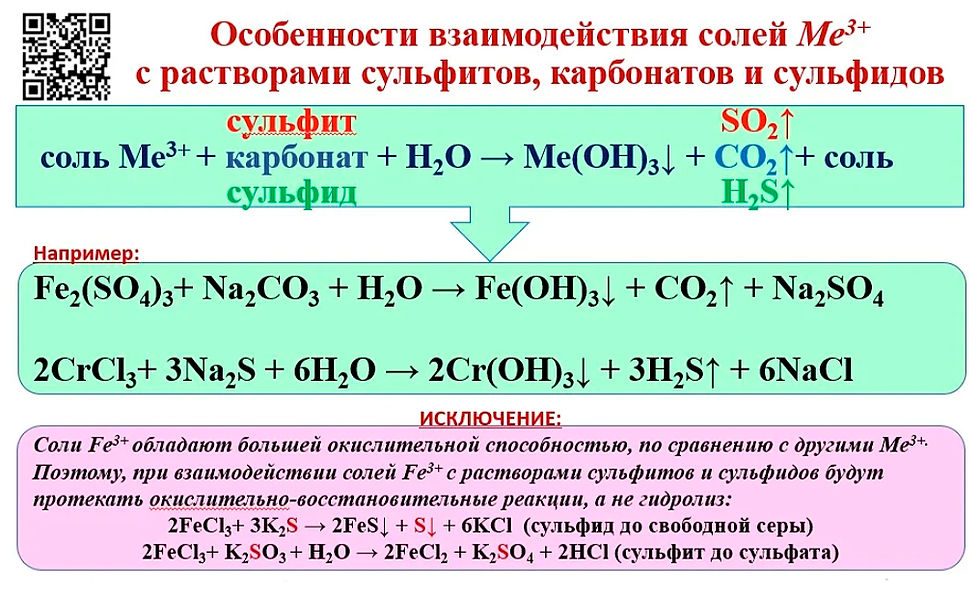

Leave A Comment