Химические связи • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Атомы могут присоединяться друг к другу, либо отдавая и принимая электроны, либо делясь парами электронов с соседними атомами, либо делясь электронами со многими другими атомами, либо благодаря эффекту поляризации.
Электроны в атоме занимают ряд вложенных слоев (см. Атом Бора), при этом воздействию другого атома могут подвергаться, как правило, только электроны, находящиеся во внешнем слое (он называется валентным слоем). Когда электроны в двух атомах выстраиваются так, что возникает сила, удерживающая вместе эти два атома, мы говорим, что образуется химическая связь. Различают несколько видов химической связи.
Ионная связь
Когда внешние электронные слои полностью заполнены, общая энергия атомов понижается. Например, атом натрия, имеющий на внешнем слое один электрон, охотно отдает этот электрон. И наоборот, атом хлора, которому не хватает одного электрона для заполнения внешнего слоя, стремится присоединить электрон для завершения уровня. Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону Кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также Правило октета).
Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону Кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также Правило октета).
С этой реакцией связано одно из чудес химии: бурно реагирующее вещество натрий и сильно ядовитый газ хлор, соединяясь, образуют обычную поваренную соль, широко применяемую в питании.
Ковалентная связь
Некоторые атомы, в основном это касается углерода, образуют связи по-другому. Когда два таких атома достаточно приближаются друг к другу, между ними возникает взаимодействие, которое можно рассматривать как длительный взаимный обмен электронами. Как будто атом бросает один из своих внешних электронов другому атому, затем ловит электрон другого атома и снова бросает его обратно в бесконечной игре в мяч.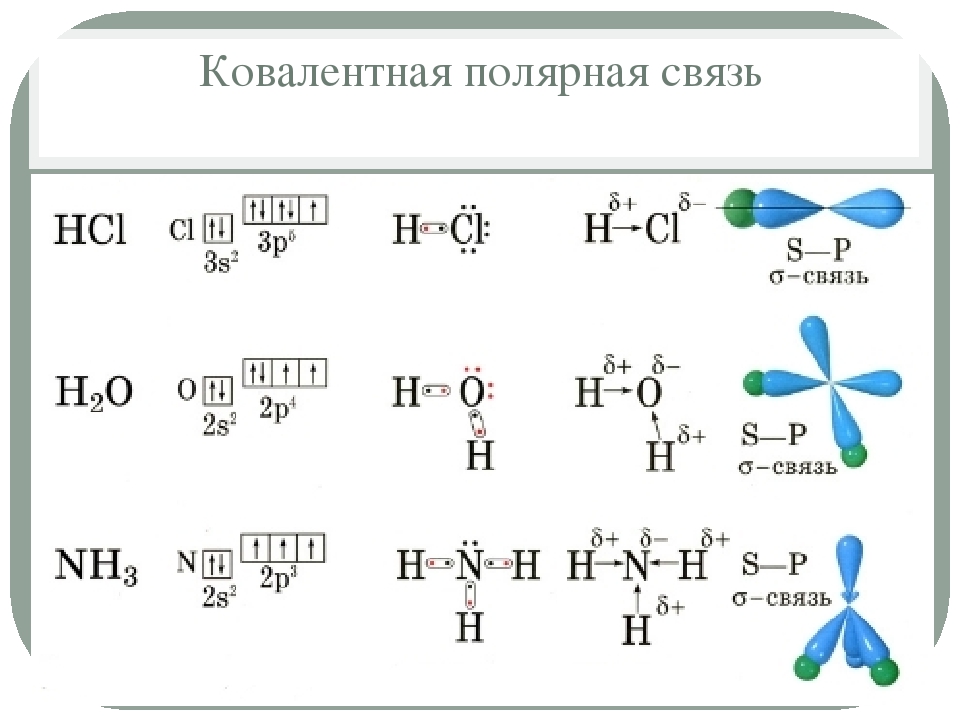 В соответствии с законами квантовой механики, такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
В соответствии с законами квантовой механики, такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
Дело в том, что такой атом как углерод, имеющий четыре электрона во внешнем слое, может дополнить этот валентный слой до восьми электронов, образуя ковалентные связи с четырьмя другими атомами. Поэтому атомы углерода способны образовывать молекулы с длинными цепями, какие мы наблюдаем в биологических системах). Некоторые ученые (и я в том числе) даже утверждают, что вследствие этого свойства атома углерода вся жизнь во Вселенной, как и жизнь на Земле, должна быть углеродной.
Металлическая связь
В металлах образуется химическая связь еще одного вида. Каждый атом в металле отдает один или два подвижных электрона, как бы делясь этими электронами со всеми соседними атомами металла. Эти квазисвободные электроны образуют что-то вроде желе, в котором располагаются тяжелые положительные ионы металла. Все это напоминает трехмерную пространственную решетку из стеклянных шариков в вязкой патоке — если толкнуть один из таких шариков, он слегка сдвинется, но сохранит свое положение относительно других. Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. Электронная теория проводимости).
Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. Электронная теория проводимости).
Водородная связь
Строго говоря, это не химическая связь в том смысле, в каком мы рассматривали предыдущие три типа связи. Это, скорее, притяжение между отдельными молекулами. Многие молекулы, хотя и являются в целом нейтральными (то есть имеют одинаковое количество отрицательных электронов и положительных протонов в своем ядре), оказываются поляризованными. Это значит, что некоторые части таких молекул имеют суммарный отрицательный заряд, в то время как другие части — положительный. Конечно, суммарный заряд молекулы нейтрален, но положительный и отрицательный заряды распределены неравномерно.
Представим, что полярная молекула, как ее называют, приближается своей отрицательной областью к молекуле-мишени. Электростатическая сила со стороны этой отрицательной области больше, чем со стороны положительной, т. к. положительная область расположена дальше. Эта электростатическая сила вызывает в молекуле-мишени передвижение электронов прочь от точки контакта, тем самым создавая в этом месте молекулы-мишени незначительный положительный заряд. В результате между двумя молекулами возникает сила притяжения и, следовательно, образуется связь.
Самая известная полярная молекула — это молекула воды. Отрицательный заряд собирается вокруг атома кислорода, приводя к образованию слабого положительного заряда около атомов водорода. Благодаря такой поляризации вода является хорошим растворителем. Ее молекулы способны создавать связи более прочные, чем те, которые удерживают молекулы-мишени вместе. Связи, создаваемые посредством положительно заряженных атомов водорода, называются водородными связями.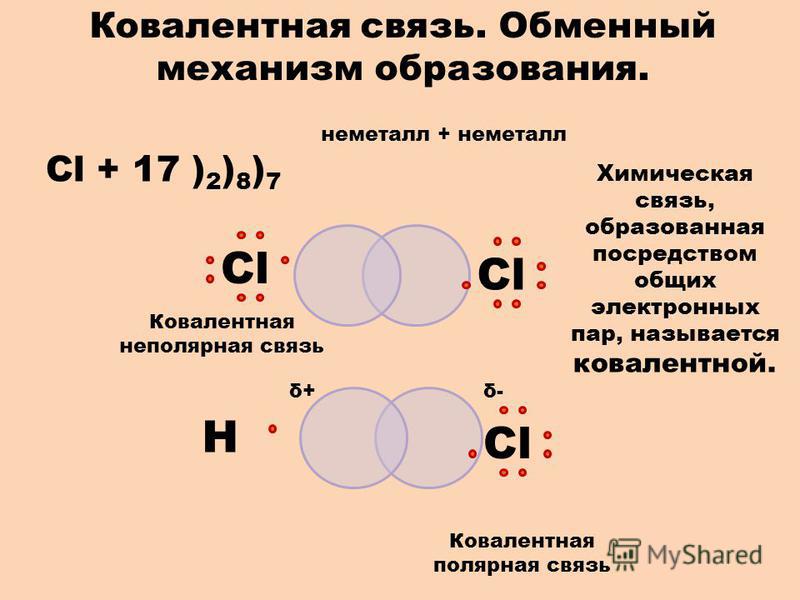 Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная 2. Вещества только с ионной связью приведены в ряду: 1) F2, ССl4, КС1 2) NaBr,Na2O,KI 3) SO2.P4.CaF2 4) H2S,Br2,K2S 3. 1) СН4 и О2 2) SO3 3) С2Н6 и HNO3 4) NH3 и HCI 4. В каком ряду все вещества имеют ковалентную полярную связь? 1) HCl,NaCl.Cl2 2) O2.H2O.CO2 3) H2O.NH3.CH4 4) NaBr.HBr.CO 5. В каком ряду записаны формулы веществ только с ковалентной полярной 1) С12, NO2, НС1 2) HBr,NO,Br2 3) H2S.H2O.Se 4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для 1) С12 7. Веществом с ковалентной полярной связью является 1) С12 2) NaBr 3) H2S 4) MgCl2 8. 1) СаС12 2) MgS 3) H2S 4) NaBr 9. Вещество с ковалентной неполярной связью имеет формулу 1) NH3 2) Сu 3) H 10. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан 11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для 1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь 1)ковалентную полярную 2) ковалентную неполярную 3) ионную 4) металлическую
14. 1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле 1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между молекулами 1) диметилового эфира 2) метанола 4) этилацетата
17. Полярность связи наиболее выражена в молекуле 1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества 1) Н2О 2) СН4 3) NH3 4) СНзОН
20. 1) KI и Н2О 2) СО2 и К2О 3) H2S и Na2S 4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле 1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая? 1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду: 1) C4H10, NO2, NaCl 2) СО, CuO, CH3Cl 3) BaS,C6H6,H2
24. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) СаО,С3Н6, S8 2) Fe. 3) N2, CuCO3, K2S 4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р 4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду: 1) C3Ha,NO2, NaF 2) КС1, CH3Cl, C6H12О6 3) P2O5, NaHSO4, Ba 4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода 2) хлора 3) фосфина 4) хлороводорода
28.
1)СF4 2)CCl4 3)CBr4 4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
|
aКакой тип химической связи присутствует в молекуле хлора Объясните свой ответ bОбъясните формат.
 ..
..Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 4 Углерод и его соединения
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 3 — Глава 3 Металлы и неметаллы >
Вопрос 131 Упражнение
(а) Какой тип химической связи присутствует в молекуле хлора? Поясните свой ответ.
(б) Объясните образование молекулы хлора на основе электронной теории валентности.
Ответ:
(а) В молекуле хлора присутствует ковалентная связь, потому что всякий раз, когда два атома одного и того же элемента объединяются в молекулу, образуется ковалентная связь.
(b) Хлор является электроотрицательным атомом. Атомный номер 17 и конфигурация 2,8,7. Добавление одного электрона на самую внешнюю оболочку даст октет. Он приобретается путем обмена с другим атомом хлора и образует молекулу хлора. Между двумя атомами хлора будет образовываться прочная связь, и эта связь называется ковалентной связью. Поэтому электронная конфигурация станет 2,8,8. Таким образом, он становится устойчивым.
Связанные вопросы
**Назовите один металл и один неметалл, которые существуют в жидком состоянии при комнатной температуре.**
**Назовите металл, который является самым плохим проводником тепла. **
**
**(а) Что имеется в виду, когда говорят, что металлы ковкие и пластичные? Объясните примерами.****(b…
**Назовите два металла, которые бурно реагируют с холодной водой. Напишите любые три наблюдения, которые вы бы сделали…
В данной реакции оксид натрия взаимодействует с водой. Какой продукт образуется в данной реакции?…
_*_*Заполните следующие пропуски подходящими словами:_*_***(a) Магний высвобождает ________________…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение
Главы
Глава 1 Химические реакции и уравнения
Глава 2 Кислоты, основания и соли
Глава 3 Металлы и неметаллы
Глава 4 Углерод и его соединения
Глава 5 Периодическая классификация элементов
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
КОВАЛЕНТНАЯ СВЯЗЬ — ПРОСТЫЕ СВЯЗИ
На этой странице объясняется, что такое ковалентная связь.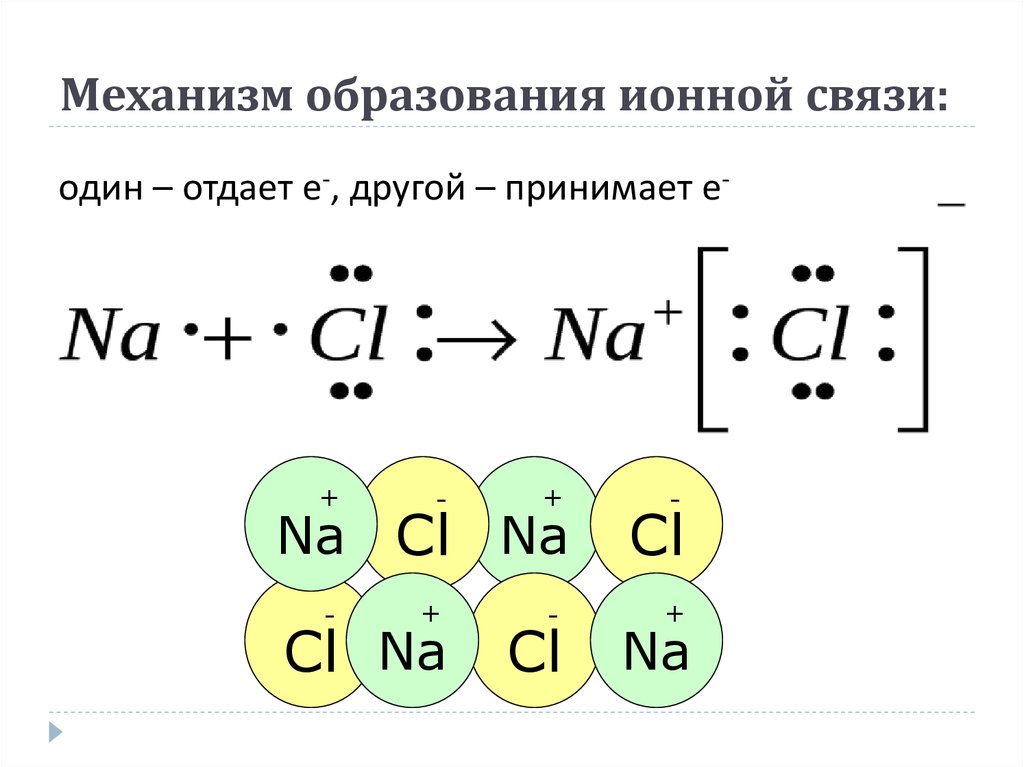 Он начинается с простого изображения одинарной ковалентной связи, а затем слегка видоизменяется для целей уровня A.
Он начинается с простого изображения одинарной ковалентной связи, а затем слегка видоизменяется для целей уровня A.
Он также переходит к более сложному представлению, связанному с гибридизацией. Это не требуется многими британскими учебными планами на этом уровне. Однако, если вы сможете следовать ему, это облегчит понимание связи в органических соединениях. Я буду использовать его в остальной части Chemguide.
В нижней части страницы вы найдете ссылку на страницу о двойных ковалентных связях.
Простой вид ковалентной связи
Важность структур благородных газов
На простом уровне (например, GCSE) большое значение придается электронной структуре благородных газов, таких как неон или аргон, которые имеют восемь электронов на своих внешних энергетических уровнях (или два в случае гелия). Эти структуры благородных газов считаются в некотором роде «желательными» для атома.
Возможно, у вас сложилось сильное впечатление, что когда другие атомы реагируют, они пытаются получить структуру благородного газа.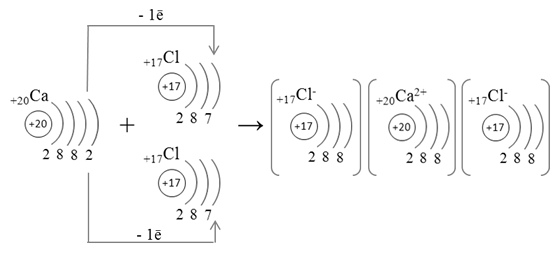
Помимо создания структур благородных газов путем переноса электронов от одного атома к другому, как при ионной связи, атомы также могут достигать этих стабильных структур, разделяя электроны для образования ковалентных связей.
Некоторые очень простые ковалентные молекулы
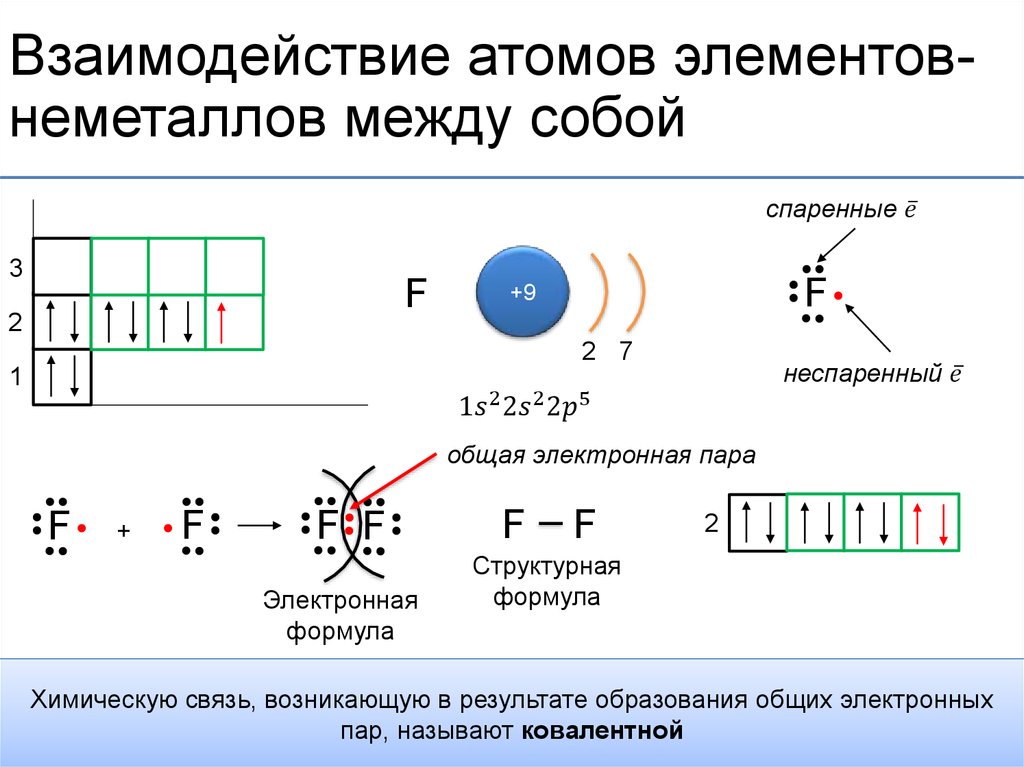
Хлор
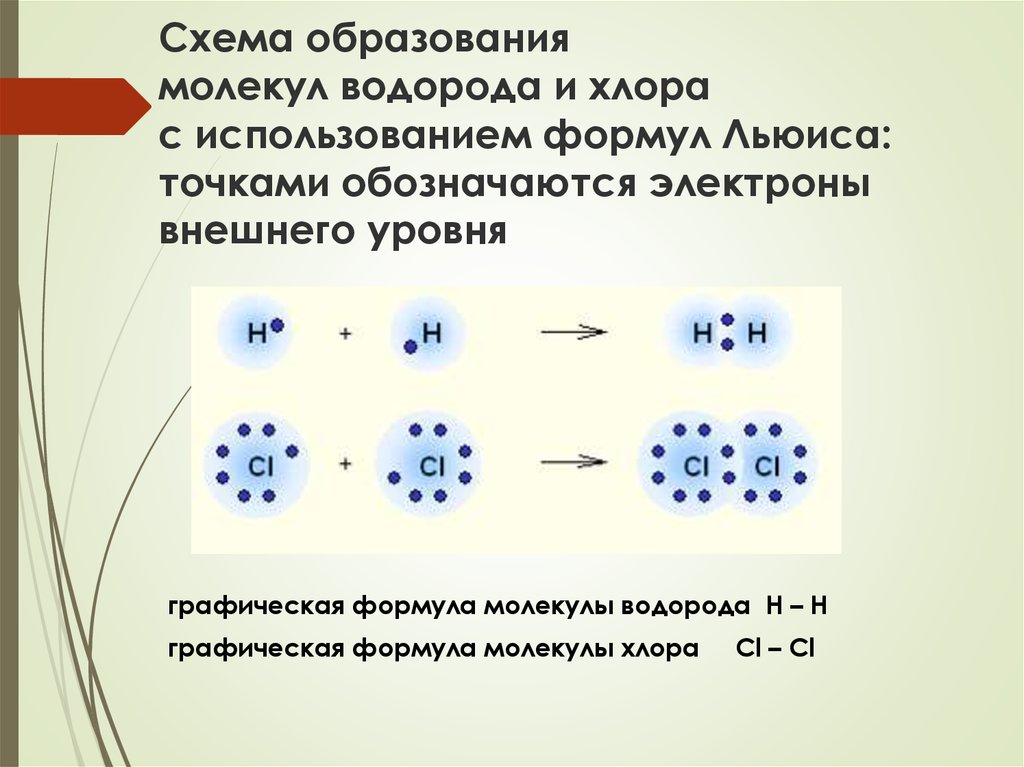
Например, два атома хлора могут получить стабильные структуры, разделив один неспаренный электрон, как показано на диаграмме.
Тот факт, что на одном хлоре электроны отмечены крестиками, а на другом — точками, просто показывает, откуда берутся все электроны. На самом деле между ними нет никакой разницы.
Говорят, что два атома хлора соединены ковалентной связью. Причина, по которой два атома хлора слипаются, заключается в том, что общая пара электронов притягивается к ядрам обоих атомов хлора.
Водород
Атомам водорода нужно всего два электрона на внешнем уровне, чтобы достичь структуры благородного газа гелия. Опять же, ковалентная связь удерживает два атома вместе, потому что пара электронов притягивается к обоим ядрам.
Опять же, ковалентная связь удерживает два атома вместе, потому что пара электронов притягивается к обоим ядрам.
Хлористый водород
Водород имеет структуру гелия, а хлор структуру аргона.
Ковалентная связь на уровне А
Случаи, когда нет никакой разницы с простым видом
Если вы придерживаетесь современных программ A’level, нет необходимости отходить далеко от простого (GCSE) представления. Единственное, что необходимо изменить, — это чрезмерно полагаться на концепцию структур инертных газов. Большинство простых молекул, которые вы рисуете, на самом деле имеют все атомы со структурой благородного газа.
Например:
Даже с более сложной молекулой, такой как PCl 3 , нет проблем. В этом случае для простоты показаны только внешние электроны. Каждый атом в этой структуре имеет внутренние слои электронов 2,8. Опять же, все присутствующее имеет структуру благородного газа.
Случаи, когда простое представление вызывает проблемы
Бор трехфтористый, BF 3
Атом бора имеет только 3 электрона на внешнем уровне, и он не может достичь структуры благородного газа путем простого обмена электронами. Это проблема? Нет. Бор образовал максимально возможное количество связей в данных обстоятельствах, и это совершенно правильная структура.
Энергия высвобождается всякий раз, когда образуется ковалентная связь. Поскольку энергия теряется из системы, она становится более стабильной после образования каждой ковалентной связи. Отсюда следует, что атом будет стремиться образовать как можно больше ковалентных связей. В случае бора в BF 3 три связи являются максимально возможными, потому что бор имеет только 3 общих электрона.
Примечание: Возможно, вы спросите, почему бор вместо этого не образует ионные связи с фтором.
 Бор не образует ионов, потому что полная энергия, необходимая для удаления трех электронов для образования B 9Ион 0205 3+ просто слишком велик, чтобы его можно было восстановить, когда между ионами бора и фтора возникает притяжение.
Бор не образует ионов, потому что полная энергия, необходимая для удаления трех электронов для образования B 9Ион 0205 3+ просто слишком велик, чтобы его можно было восстановить, когда между ионами бора и фтора возникает притяжение. Хлорид фосфора(V), PCl 5
В случае фосфора возможны 5 ковалентных связей — как в PCl 5 .
Фосфор образует два хлорида — PCl 3 и PCl 5 . Когда фосфор сгорает в хлоре, образуются оба продукта — большинство продуктов в зависимости от того, сколько хлора доступно. Мы уже рассмотрели структуру PCl 9.0172 3 .
Диаграмма PCl 5 (как и предыдущая диаграмма PCl 3 ) показывает только внешние электроны.
Обратите внимание, что у фосфора теперь 5 пар электронов на внешнем уровне — это определенно не структура благородного газа. Вы были бы довольны, нарисовав PCl 3 на GCSE, но PCl 5 выглядело бы очень тревожно.
Почему фосфор иногда отрывается от структуры благородного газа и образует пять связей? Чтобы ответить на этот вопрос, нам нужно исследовать территорию, выходящую за рамки большинства текущих программ A’level. Не пугайтесь этого! Это не особенно сложно и чрезвычайно полезно, если вы собираетесь понять связь в некоторых важных органических соединениях.
Более сложный взгляд на ковалентную связь
Склеивание в метане, CH 4
Внимание! Если вас не устраивает описание расположения электронов в обозначениях s и p, а также формы s- и p-орбиталей, вам нужно прочитать об орбиталях, прежде чем продолжить.
Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться к этому пункту.
Что не так с картиной связи в метане, состоящей из точек и крестиков?
Мы начинаем с метана, потому что это самый простой случай, который иллюстрирует тип задействованных процессов. Вы помните, что картина метана с точками и крестиком выглядит так.
Вы помните, что картина метана с точками и крестиком выглядит так.
Существует серьезное несоответствие между этой структурой и современной электронной структурой углерода, 1s 2 2s 2 2p x 1 2p y 1 . Современная структура показывает, что у водородов есть только 2 неспаренных электрона вместо 4, которые требуются в простом представлении.
Вы можете увидеть это более легко, используя обозначение электронов в ящиках. Показаны только двухуровневые электроны. 1s 2 электронов находятся слишком глубоко внутри атома, чтобы участвовать в образовании связи. Единственными электронами, непосредственно доступными для совместного использования, являются 2p-электроны. Почему тогда метан не CH 2 ?
Активация электрона
При образовании связей высвобождается энергия, и система становится более стабильной. Если углерод образует 4 связи, а не 2, высвобождается в два раза больше энергии, и поэтому полученная молекула становится еще более стабильной.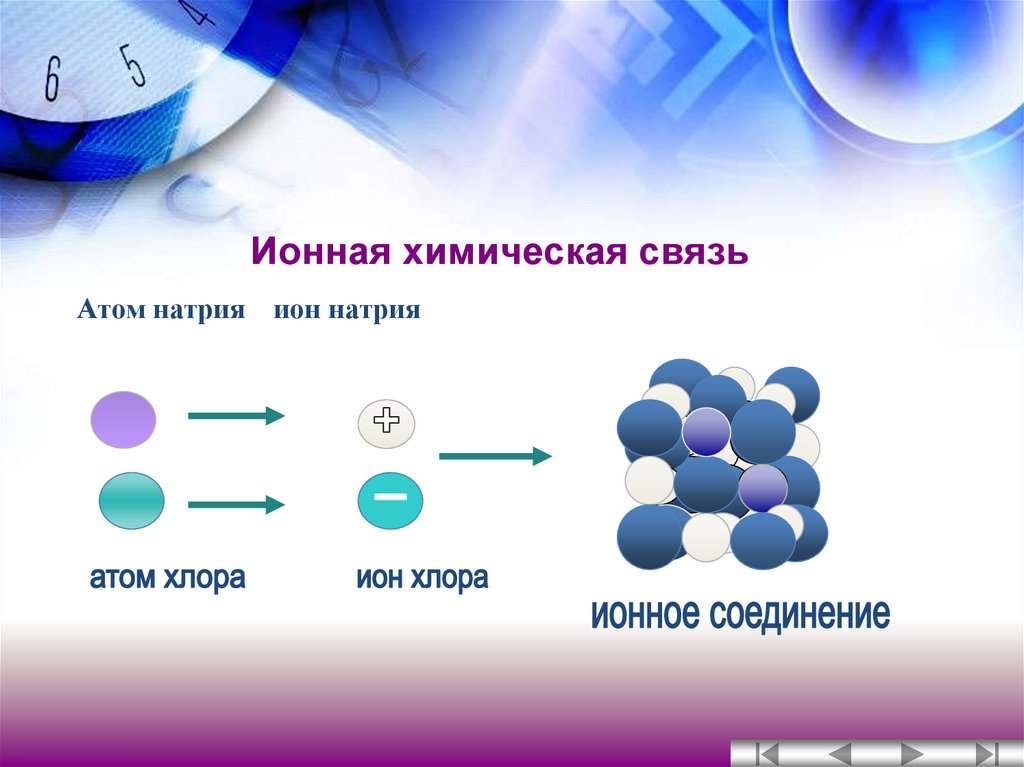
Существует лишь небольшая энергетическая щель между 2s- и 2p-орбиталями, поэтому углерод платит за предоставление небольшого количества энергии для продвижения электрона с 2s на пустую 2p, чтобы получить 4 неспаренных электрона. Дополнительная энергия, высвобождаемая при образовании связей, более чем компенсирует первоначальный вклад.
Теперь говорят, что атом углерода находится в возбужденном состоянии .
Примечание: Иногда люди беспокоятся о том, что продвинутый электрон нарисован стрелкой вверх, тогда как вначале он был стрелкой вниз. Причина этого на самом деле довольно сложная — далеко за пределами того уровня, над которым мы работаем. Просто возьмите за привычку писать так, потому что так диаграммы будут выглядеть аккуратно!
Теперь, когда у нас есть 4 неспаренных электрона, готовых к соединению, возникает другая проблема. В метане все связи углерод-водород идентичны, но наши электроны находятся на двух разных орбиталях. Вы не получите четырех одинаковых связей, если не начнете с четырех одинаковых орбиталей.
В метане все связи углерод-водород идентичны, но наши электроны находятся на двух разных орбиталях. Вы не получите четырех одинаковых связей, если не начнете с четырех одинаковых орбиталей.
Гибридизация
Электроны снова перестраиваются в процессе, называемом гибридизацией. Это реорганизует электроны в четыре идентичных гибридных орбитали, называемых sp 3 гибриды (поскольку они состоят из одной s-орбитали и трех p-орбиталей). Вы должны читать «sp 3 » как «sp three», а не как «sp в кубе».
sp 3 гибридные орбитали немного напоминают половину р-орбитали, и они располагаются в пространстве так, чтобы быть как можно дальше друг от друга. Вы можете представить себе ядро как находящееся в центре тетраэдра (пирамида с треугольным основанием) с орбиталями, указывающими на углы. Для наглядности ядро нарисовано намного крупнее, чем оно есть на самом деле.
Что происходит, когда формируются облигации?
Помните, что электрон водорода находится на 1s-орбитали — сферически симметричной области пространства, окружающей ядро, где существует некоторая фиксированная вероятность (скажем, 95%) найти электрон.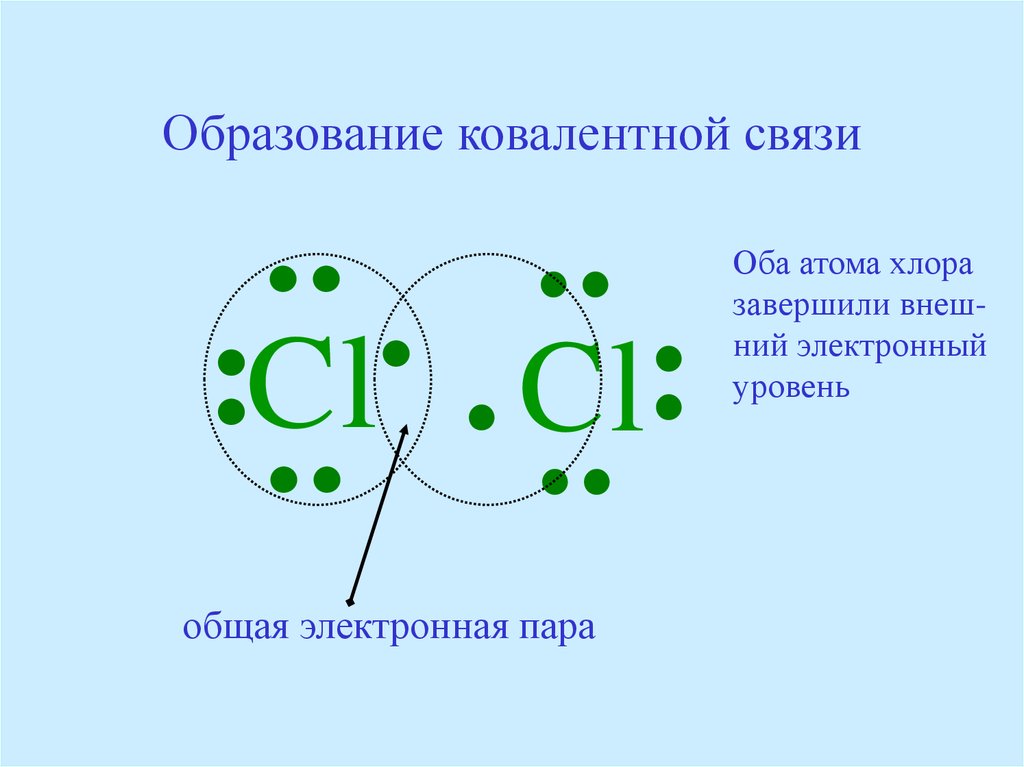 Когда образуется ковалентная связь, атомные орбитали (орбитали в отдельных атомах) сливаются, образуя новую молекулярную орбиталь, которая содержит электронную пару, создающую связь.
Когда образуется ковалентная связь, атомные орбитали (орбитали в отдельных атомах) сливаются, образуя новую молекулярную орбиталь, которая содержит электронную пару, создающую связь.
Образуются четыре молекулярные орбитали, похожие на исходные гибриды sp 3 , но с ядром водорода, встроенным в каждую долю. Каждая орбиталь содержит 2 электрона, которые мы ранее нарисовали в виде точки и креста.
Используемые принципы — промотирование электронов, если необходимо, затем гибридизация с последующим образованием молекулярных орбиталей — могут быть применены к любой ковалентно связанной молекуле.
Примечание: Вы найдете повторение этого фрагмента о метане в органическом разделе этого сайта. В этой статье о метане рассматривается образование одинарных углерод-углеродных связей в этане.
Связывание в хлоридах фосфора, PCl 3 и PCl 5
Что не так с простым представлением PCl 3 ?
На этой диаграмме показаны только внешние (связывающие) электроны.
В этом нет ничего плохого! (Хотя он не учитывает форму молекулы должным образом.) Если бы вы собирались взглянуть на это более современно, аргумент выглядел бы так:
.Phosphorus has the electronic structure 1s 2 2s 2 2p 6 3s 2 3p x 1 3p y 1 3p z 1 . Если мы посмотрим только на внешние электроны как на «электроны в ящиках»:
Есть 3 неспаренных электрона, которые можно использовать для образования связей с 3 атомами хлора. Четыре трехуровневые орбитали гибридизуются, образуя 4 эквивалентных гибрида sp 3 , как и в углероде, за исключением того, что одна из этих гибридных орбиталей содержит неподеленную пару электронов.
Затем каждый из 3 атомов хлора образует ковалентную связь путем слияния атомной орбитали, содержащей его неспаренный электрон, с одним из неспаренных электронов фосфора, образуя 3 молекулярные орбитали.
Вы можете задаться вопросом, стоит ли все это заморачиваться! Возможно нет! Хотя стоит с PCl 5 .
Что не так с простым видом PCl 5 ?
Вы помните, что изображение PCl 5 в точках и крестиках выглядит неуклюжим, потому что фосфор не имеет структуры благородного газа. На этой диаграмме также показаны только внешние электроны.
В этом случае более современный взгляд делает ситуацию лучше, отказываясь от любых притворных беспокойств о структурах благородных газов.
Если фосфор собирается образовать PCl 5 , он должен сначала сгенерировать 5 неспаренных электронов. Он делает это, перемещая один из электронов на 3s-орбитали на следующую доступную орбиталь с более высокой энергией.
Какая орбиталь с более высокой энергией? Он использует одну из трехмерных орбиталей. Вы могли ожидать, что он будет использовать орбиталь 4s, потому что это орбиталь, которая заполняется до 3d, когда атомы строятся с нуля. Не так! За исключением случаев, когда вы строите атомы в первую очередь, 3d всегда считается орбиталью с более низкой энергией.
Не так! За исключением случаев, когда вы строите атомы в первую очередь, 3d всегда считается орбиталью с более низкой энергией.
Остается фосфор с таким расположением электронов:
Электроны 3-го уровня теперь перестраиваются (гибридизуются), образуя 5 гибридных орбиталей с одинаковой энергией. Их можно было бы назвать sp 3 d гибридами, потому что они сделаны из этого материала.
Электроны на каждой из этих орбиталей делили бы пространство с электронами пяти атомов хлора, образуя пять новых молекулярных орбиталей и, следовательно, пять ковалентных связей.
Почему фосфор образует эти дополнительные две связи? Он вкладывает определенное количество энергии для продвижения электрона, которое более чем окупается при образовании новых связей. Проще говоря, фосфору энергетически выгодно образовывать дополнительные связи.
Преимущество такой мысли в том, что она полностью игнорирует вопрос о том, есть ли у вас структура благородного газа, и поэтому вы не беспокоитесь об этом.
Если вы учитель или собираетесь заниматься химией в университете: Статья, опубликованная в 2007 году, предполагает, что это объяснение имеет серьезные недостатки. Если вы, вероятно, будете заниматься химией на университетском уровне, вам, вероятно, придется отказаться от нее позже в пользу более точного объяснения. Однако это объяснение выходит далеко за рамки 16-18-летнего возраста.
Если вас спросят об этом на уровне, эквивалентном UK A, вам придется дать объяснение выше — альтернативы нет. Не беспокойтесь об этом!
Если вам нужна дополнительная информация, вы найдете ее на этой странице.
Несуществующее соединение — NCl 5
Азот находится в той же группе Периодической таблицы, что и фосфор, и можно ожидать, что он образует аналогичный ряд соединений. На самом деле это не так. Например, соединение NCl 3 существует, но такого понятия, как NCl 5 , не существует.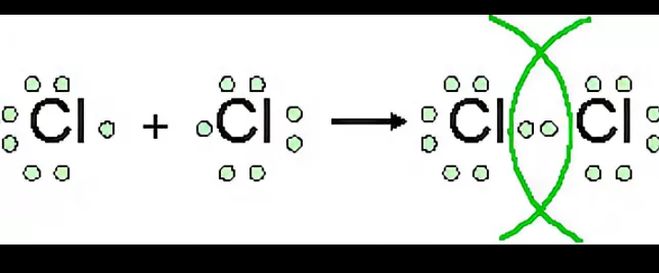
Азот 1s 2 2s 2 2p x 1 2p г 1 2п г 1 . Причина, по которой NCl 5 не существует, заключается в том, что для образования пяти связей азот должен продвигать один из своих 2s-электронов. Проблема в том, что нет никаких 2d-орбиталей, на которые можно было бы перевести электрон, а энергетический зазор до следующего уровня (3s) слишком велик.
Таким образом, в этом случае энергии, высвобождаемой при образовании дополнительных связей , недостаточно, чтобы компенсировать энергию, необходимую для продвижения электрона, и поэтому этого продвижения не происходит.
Атомы образуют столько связей, сколько возможно, если это энергетически выгодно.
Вопросы для проверки вашего понимания Если это первый набор вопросов, который вы задали, пожалуйста, прочтите вводную страницу, прежде чем начать. |

 Соединение с ионной связью образуется при взаимодействии
Соединение с ионной связью образуется при взаимодействии Веществом с ковалентной связью является
Веществом с ковалентной связью является В молекуле какого вещества длина связи между атомами углерода наибольшая?
В молекуле какого вещества длина связи между атомами углерода наибольшая? Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых NaNO3, CO
NaNO3, CO
Leave A Comment