Реакции ионного обмена. Часть 4 От ионной реакции, к молекулярной
На ионы диссоциируют Реагенты (исходные вещества)
Растворимые (P) в воде. (см. таблицу растворимости):
1. Соли
2. Кислоты (сильные: соляная, серная, азотная)
3. Основания
(Включая Ca(OH)2 – M)
Продукты реакции
1. Соли
2. Кислоты (сильные: соляная, серная, азотная)
3. Основания
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
NH4OH↔ H2O + NH3↑
H2S↑ (сероводород сам выделяется
в виде газа)
1. Сокращенное
ионное уравнение реакции
Сокращенное
ионное уравнение реакции
H+ + OH– = H2O
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р.) + HCl (р.) = KCl(р.) + H2O (слабый электролит!)
Чтобы подобрать вещества, взаимодействие которых будет давать такое ионное уравнение, надо, используя таблицу растворимости, найти растворимые вещества, в состав которых входят указанные ионы.
2. Сокращенное ионное уравнение реакции:
CO3
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
Молекулярное уравнение реакции щелочи с кислотой:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
3. Cокращенное
ионное уравнение реакции:
Cокращенное
ионное уравнение реакции:
2OH— + Cu2+ = Cu(OH)2
Полное ионное уравнение реакции:
2Na+ + 2OH— + Cu2+ + SO42- = 2Na+ + SO42- + Cu(OH)2↓
Молекулярное уравнение реакции щелочи с кислотой:
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
Необходимо по таблице растворимости найти те вещества, которые предлагаются в задании, ионы меди и гидроксид ионы можно получить только из растворимых веществ: соли и щелочи
4. Cокращенное ионное уравнение реакции:
CuO + 2H++ = Cu2+ + H2O.
Полное ионное уравнение реакции:
CuO + 2H+ + 2NO3— = Cu2+ + 2NO3— + H2O
Молекулярное уравнение реакции щелочи с кислотой:
CuO (оксид не диссоциирует!) + 2HNO3 (р) = Cu(NO3)2 (р) + H2O
5. Сокращенное
ионное уравнение реакции:
Сокращенное
ионное уравнение реакции:
Ba2+ + SO42- = BaSO4↓
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl
Молекулярное уравнение реакции щелочи с кислотой:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
По таблице растворимости выбрать из предложенного
перечня веществ те, которые растворимы в воде, могут образовывать
соответствующие ионы и при взаимодействии дают только одно не распадающееся на
ионы вещество .
Оксиды на ионы не распадаются, поэтому отпадает BaO и H2SO4
Очень похожая на правильный ответ пара Ba(OH)2и H2SO4 все же не соответствует указанному
сокращенному ионному уравнению, так как кроме сульфата бария образуется вода,
которая тоже не распадается на ионы.
Сокращенное ионное уравнение для первой пары выглядит так:
Ba2+ + 2OH— + 2H+ + SO42- = BaSO4↓+2H2O
Всем этим условиям удовлетворяет пара нитрата бария и сульфата натрия или сульфат алюминия и хлорид бария.
6. Сокращенное ионное уравнение реакции
OH— + H+ = H2O
Полное ионное уравнение реакции:
Na+ + OH— + H+
Молекулярное уравнение реакции щелочи с кислотой:
NaOH + HCl = NaCl + H2O
Соответствует взаимодействию между сильной кислотой и сильным основанием. Такими как HCl и NaOH
5.Cокращенное ионное уравнение реакции:
2H+ + CO32- = H2O + CO2↓
Полное ионное уравнение реакции:
2H+ + 2NO3— + 2K+ + CO32- = 2K+ + 2NO3— + H2O + CO2→H2CO3 неустойчивая
Молекулярное уравнение реакции щелочи с кислотой:
2HNO3 + K2CO3 = 2KNO3 + H2O + CO2↓
Азотная кислота
и карбонат калия это сильные электролиты, поэтому в растворе они находятся в
виде ионов.
Расмотрим процессы, протекающие при сливании растворов нитрата калия и хлорида натрия.
Молекулярное уравнение:
KNO3
+ NaCl
= KCl +
NaNO
растворимая растворимая растворимая растворимая
соль соль соль соль
Полное молекулярно-ионное уравнение:
K+ + NO3– + Na+ + Cl – ⇄ K+ + Cl – + Na+ + NO3–
В данном случае
сокращенное ионно-молекулярное уравнение написать нельзя: согласно теории
электролитической диссоциации, реакция не протекает.
Если такой раствор выпарить, то получим смесь четырех солей: KNO3,
NaCl, KCl, NaNO
Всё понятно? Не понятно? пишите в комментарии.
Ионные уравнения.
 Задача 31 на ЕГЭ по химии. Полные и краткие ионные уравнения
Задача 31 на ЕГЭ по химии. Полные и краткие ионные уравненияПереходим от полного ионного уравнения к краткому
← Начало статьи
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5. Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение. Начнем, естественно, с молекулярного уравнения:
H2SiO3 + 2KOH = K2SiO3 + 2H2O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K2SiO3 пишем в ионной форме. H2O, естественно, записываем в молекулярной форме:
KOH и K2SiO3 пишем в ионной форме. H2O, естественно, записываем в молекулярной форме:
H2SiO3 + 2K+ + 2OH— = 2K+ + SiO32- + 2H2O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H2SiO3 + 2OH— = SiO32- + 2H2O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH—. Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Курс «Сложные задачи ЕГЭ»
Обсуждаются задания 30-35 из вариантов ЕГЭ по химии.
Полный курс рассчитан на 30 занятий.
Дистанционно (Скайп) или с выездом к вам на дом.
Пример 6. Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение. Основные оксиды реагируют с кислотами с образованием соли и воды:
H2SO4 + CuO = CuSO4 + H2O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H+ + SO42- + CuO = Cu2+ + SO42- + H2O
2H+ + CuO = Cu2+ + H2O
Пример 7. C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение. Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl2 + H2↑.
Полное ионное уравнение записывается без труда:
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl— + H2↑.
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H2. Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H2, HCOH и CH4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H+ = Zn2+ + H2↑.
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8. Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение. Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO3 = Cu(NO3)2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu0 + 2Ag+ + 2NO3— = Cu2+ + 2NO3— + 2Ag↓0,
Cu0 + 2Ag+ = Cu2+ + 2Ag↓0.
Дабы уберечь вас от соблазна считать, что Сu2+ и Cu (или Ag+ и Ag) — это «одно и то же», я снабдил нейтральные атомы нулевыми зарядами. Естественно, ионами-наблюдателями являются ионы NO3— (и только они!).
Естественно, ионами-наблюдателями являются ионы NO3— (и только они!).
Пример 9. Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение. Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
Полное ионное уравнение:
Ba2+ + 2OH— + 2H+ + SO42- = BaSO4↓ + 2H2O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H+ и OH— — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6. Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH)2 + HNO3 =
- Fe + HBr =
- Zn + CuSO4 =
- SO2 + KOH =
-
- 01. В кратком ионном уравнении, описывающем взаимодействие KCl и AgNO3, сумма коэффициентов равна:
- а) 2;
- б) 3;
- в) 4;
- г) 5.

- б) 3;
- 02. Краткое ионное уравнение Ca2+ + CO32- = CaCO3 соответствует реакции между:
- а) CaSO4 и H2CO3;
- б) Ca(OH)2 и CO2;
- в) CaBr2 и Na2CO3;
- г) CaO и H2CO3.
- б) Ca(OH)2 и CO2;
- 03. Взаимодействие гидроксида алюминия и соляной кислоты можно описать следующим уравнением:
- а) Al(OH)3 + 3HCl = Al3+ + 3Cl— + 3H2O;
- б) Al(OH)3 + 3H+ + = Al3+ + 3H2O;
- в) Al3+ + 3OH— + 3H+ + 3Cl— = Al3+ + 3Cl— + 3H2O;
- г) OH— + H+ = H2O.
- б) Al(OH)3 + 3H+ + = Al3+ + 3H2O;
- 04.
 В левой части краткого ионного уравнения, соответствующего реакции между водным раствором карбоната натрия и азотной кислотой, сумма коэффициентов равна:
В левой части краткого ионного уравнения, соответствующего реакции между водным раствором карбоната натрия и азотной кислотой, сумма коэффициентов равна:
- а) 6;
- б) 5;
- в) 4;
- г) 3.
- б) 5;
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько… непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10. В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. Вспоминая свойства основных классов неорганических соединений, приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH.
Полное ионное уравнение:
Ba2+ + 2OH— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2OH—.
Краткое ионное уравнение:
Ba2+ + SO42- = BaSO4↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO3 + NaCl = NaNO3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K+ + NO3— + Na+ + Cl— = Na+ + NO3— + K+ + Cl—.
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11. Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости!) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Обратите внимание: вместо формулы H2CO3, которая, по идее, должна была образоваться в ходе реакции, мы пишем H2O и CO2. Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + H2O + CO2↑.
Убираем лишнее, получаем краткое ионное уравнение:
CO32- + 2H+ = H2O + CO2↑.
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Пора двигаться дальше. В третьей части статьи мы:
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Продолжение статьи →
Каковы молекулярное, полное ионное и суммарное ионное уравнения реакции между CuO и HCl?
Ответить
Проверено
186,6 тыс.+ просмотров
Подсказка: Молекулярное уравнение — это просто сбалансированная химическая реакция, которую мы записываем. При этом мы рассматриваем все ионные соединения или кислоты как нейтральные молекулы. Состояние каждого реагента указано в скобках после химической формулы соединения.
Состояние каждого реагента указано в скобках после химической формулы соединения.
Полный ответ:
Полное ионное уравнение дает нам информацию обо всех ионах, которые присутствуют в растворе во время реакции, тогда как молекулярное уравнение говорит нам об ионных соединениях, которые были источниками отдельных ионов, присутствующих в растворе. .
Чистое ионное уравнение показывает только те химические соединения, которые участвуют в этой реакции, тогда как полное ионное уравнение также включает ионы-наблюдатели. Ионы, не изменяющиеся в ходе реакции, называются ионами-спектаторами. Эти виды появляются по обе стороны уравнения. Мы можем отменить их аналогичным образом, чтобы исключить равные члены с обеих сторон математического уравнения.
Нам дана реакция между CuO и HCl. Это реакция нейтрализации с двойным замещением, которая происходит между основанием CuO и кислотой HCl. CuO известен как оксид меди черного цвета и используется для изготовления наночастиц. 9+ }(водн.) \to {H_2}O(l)$.
9+ }(водн.) \to {H_2}O(l)$.
Примечание:
Чистое ионное уравнение обычно записывается с наименьшим целым значением стехиометрических коэффициентов. Возможно, нам придется разделить стехиометрические коэффициенты на обычное делимое число, чтобы получить окончательное чистое ионное уравнение.
Дата последнего обновления: 25 апреля 2023 г.
•
Всего просмотров: 186,6 тыс. 0003
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химический класс JEE_Main
Тенденции сомнений
[Решено] Привет, мне нужна помощь с приведенными ниже вопросами и наблюдениями за деталями.
 ..
..Вопрос задан MajorBoulder4032 на сайте coursehero.com
Привет, мне нужна помощь с приведенными ниже вопросами и наблюдениями за частями 2.1 (и), 2.1 (ii), 2.2, 2.3 и 2.4.
2. Экспериментальная процедура
2.1 Хлорид меди(II) в гидроксид меди(II)
3O в пробирке для взвешивания (используйте лабораторный баланс).
b) Точно взвесьте флакон с крышкой и его содержимое на аналитических весах.
c) Перенесите твердое вещество в химический стакан на 100 мл.
d) Повторно взвесьте закрытый флакон на аналитических весах.
e) Рассчитайте точную массу добавленного CuCl2.2h3O.
f) Добавьте 10 мл деионизированной воды в химический стакан и перемешайте до растворения.
(i) Запишите свои наблюдения, включая ионное уравнение для произошедшего изменения.
Добавьте по каплям около 0,5 мл NaOH (4 М) при перемешивании. Примечание: полная пипетка Пастера содержит примерно 1,5 мл. Любое твердое вещество, которое образуется, представляет собой гидроксид меди (II), Cu(OH)2.
Любое твердое вещество, которое образуется, представляет собой гидроксид меди (II), Cu(OH)2.
(ii) Запишите свои наблюдения, включая результирующее ионное уравнение для произошедшего изменения.
Избыток NaOH должен быть в растворе, чтобы обеспечить завершение реакции. Присутствие избытка OH-
можно проверить, проверив pH индикаторной бумагой. Проверьте свой раствор, погрузив стеклянную палочку в раствор и коснувшись небольшого квадрата индикаторной бумаги на часовом стекле. Если раствор не щелочной, добавьте больше раствора NaOH, пока он не станет щелочным.
2.2 Гидроксид меди(II) в оксид меди(II)
Нагрейте содержимое стакана на плитке в течение примерно 5 минут, периодически помешивая. Это удалит молекулу воды с образованием оксида меди (II) CuO. Запишите свои наблюдения, включая уравнение реакции.
2.3 Оксид меди(II) в сульфат меди(II)
Через 5 минут осторожно снимите химический стакан с плиты с помощью деревянной палочки и дайте ему остыть до комнатной температуры в вытяжном шкафу. Отфильтруйте осадок оксида меди (II) через гофрированную фильтровальную бумагу в коническую колбу на 100 мл, используя стеклянную воронку. Перенесите все твердые вещества на фильтровальную бумагу; промойте химический стакан деионизированной водой в фильтровальную бумагу/воронку. Выбросьте фильтрат.
Отфильтруйте осадок оксида меди (II) через гофрированную фильтровальную бумагу в коническую колбу на 100 мл, используя стеклянную воронку. Перенесите все твердые вещества на фильтровальную бумагу; промойте химический стакан деионизированной водой в фильтровальную бумагу/воронку. Выбросьте фильтрат.
Поместите стакан на 100 мл под воронку с фильтром. Проколите отверстие в фильтровальной бумаге с помощью шпателя и промойте осадок через отверстие примерно 2 мл 6 М серной кислоты, H3SO4 (используя пастеровскую пипетку). Промойте оставшееся твердое вещество на фильтровальной бумаге кислотным фильтратом в химическом стакане. Когда все твердое вещество растворится, промойте фильтровальную бумагу приблизительно 4 мл воды. Запишите свои наблюдения, включая итоговое ионное уравнение реакции.
2.4 Раствор сульфата меди(II) в медь
Используйте небольшой шпатель, чтобы отмерить примерно пин-так порошка цинка, Zn, на часовое стекло. В вытяжном шкафу к окрашенному раствору осторожно добавляют цинковый порошок очень маленькими порциями. Дайте стакану постоять, время от времени помешивая стеклянной палочкой, пока раствор не станет бесцветным. Если раствор не совсем бесцветный, добавьте еще немного цинка. Запишите свои наблюдения, включая уравнение и итоговое ионное уравнение для реакции.
В вытяжном шкафу к окрашенному раствору осторожно добавляют цинковый порошок очень маленькими порциями. Дайте стакану постоять, время от времени помешивая стеклянной палочкой, пока раствор не станет бесцветным. Если раствор не совсем бесцветный, добавьте еще немного цинка. Запишите свои наблюдения, включая уравнение и итоговое ионное уравнение для реакции.
Дважды промойте осадок. Дайте осадку осесть и декантируйте (слейте) большую часть супернатанта (раствор над осадком). Добавьте примерно 10 мл воды, взболтайте содержимое, дайте осадку осесть и слейте надосадочную жидкость. Повторите с еще 10 мл воды. Добавьте к твердому веществу примерно 0,5 мл 5,5 М соляной кислоты (HCl) и перемешайте.
Запишите свои наблюдения. Здесь вы можете наблюдать реакцию, а можете и не наблюдать. Если да, напишите уравнение и результирующее ионное уравнение. Если нет, объясните, почему к твердому веществу добавили HCl. Твердый цинк реагирует с HCl с выделением газообразного водорода h3, а медь — нет.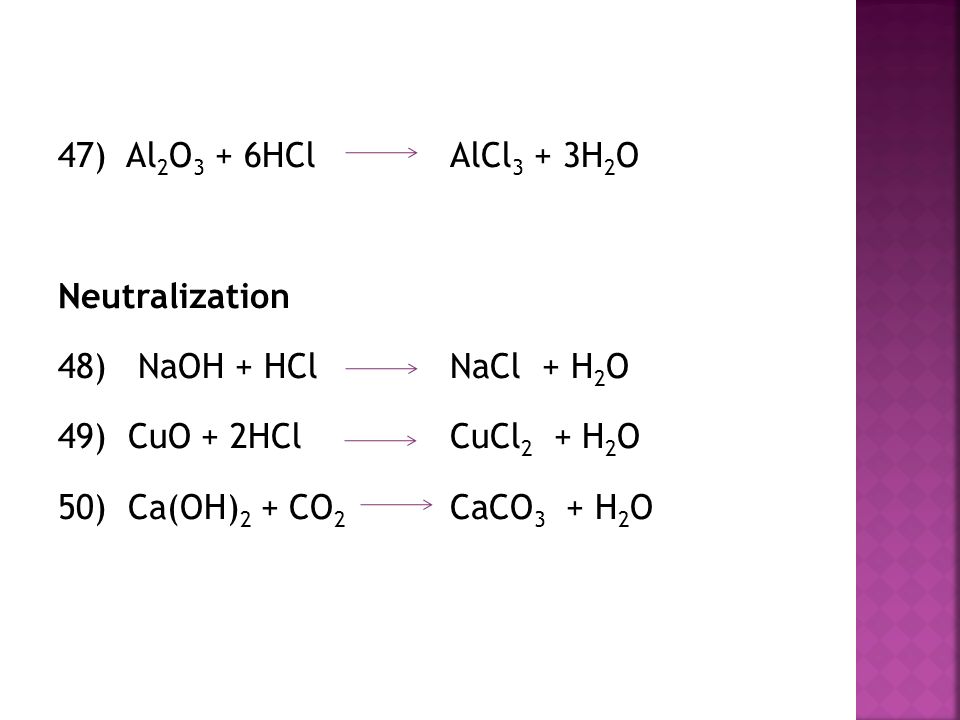
Осадок дважды промывают деионизированной водой путем декантации, оставляя его почти сухим. Поместите стакан с осадком на плитку и нагревайте его, пока он не станет сухим. Снимите стакан с плиты с помощью деревянной палочки и дайте ему остыть до комнатной температуры в вытяжном шкафу.
2.5 Расчет выхода в процентах
Используйте аналитические весы для взвешивания чистой, сухой виалы для взвешивания и крышки. Запишите массу. Количественно перенесите осадок во флакон. Запишите массу.
Используйте полученные результаты для расчета процентного выхода меди.
Запись результатов и наблюдений
При записи наблюдений для экспериментов важно использовать недвусмысленные формулировки и быть как можно более конкретными. Запись точных наблюдений значительно облегчает определение того, какая реакция (если вообще была) имела место. Свойства реагентов и продуктов (например, цвет, состояние, внешний вид и т. д.) информируют нас при написании химических уравнений. Например, «прозрачный» может быть неоднозначным — бесцветный он или прозрачный?
д.) информируют нас при написании химических уравнений. Например, «прозрачный» может быть неоднозначным — бесцветный он или прозрачный?
Наблюдения за реакциями должны охватывать как минимум три ключевых момента:
- С чего начать? (состояние, цвет, пузырьки и т.д.)
- Что ты делаешь? (химическое добавление, нагревание, разбавление и т. д.)
- Что у вас получилось? (состояние, цвет, пузырьки, температура и т. д.)
Пример: Водный раствор хлорида меди вначале был прозрачным и ярко-синим. При добавлении 4 М гидроксида натрия образовывался осадок. Раствор стал непрозрачным (из-за взвешенного осадка), и его цвет изменился на очень светло-голубой.
Текст транскрипции изображения
Метод (примечание: перетащите соответствующие ответы на пустые места) дигидрат хлорида меди (0,10–0,12 г) растворяли в 10 мл воды и перемешивали для растворения твердого вещества. После этого добавляли гидроксид натрия (4 М, порциями ~0,5 мл) до тех пор, пока раствор не становился щелочным, как отмечалось на универсальной индикаторной бумаге. Полученную светло-голубую смесь гидроксида меди нагревали до 70°С на
на плите в течение 5 минут, в результате чего получается смесь :l. Осадок собирали фильтрованием, а полученный фильтрат отбрасывали. Затем черную медь растворяли в серной кислоте (6 М, ~ 2 мл), получая раствор . Затем осторожно добавляли порошок цинка до тех пор, пока цвет не исчезнет и весь цинк не прореагирует. Полученную красно-коричневую медь собирали декантацией, дважды промывали водой и затем оставляли сушиться на горячей плите.
массу меди взвешивали на аналитических весах и рассчитывали % выхода, дигидрат хлорида меди, сульфат меди, воду, серную кислоту.
цинк гидроксид натрия 6 основной
кислый темно-синий черный светло-синий
оксид гидроксида меди 70°C 40°C
фильтрация бесцветного гидроксида
декантация 4 2 весы с верхней загрузкой % выход I аналитические весы I УФ-видимая спектрофотометрия …
Полученную светло-голубую смесь гидроксида меди нагревали до 70°С на
на плите в течение 5 минут, в результате чего получается смесь :l. Осадок собирали фильтрованием, а полученный фильтрат отбрасывали. Затем черную медь растворяли в серной кислоте (6 М, ~ 2 мл), получая раствор . Затем осторожно добавляли порошок цинка до тех пор, пока цвет не исчезнет и весь цинк не прореагирует. Полученную красно-коричневую медь собирали декантацией, дважды промывали водой и затем оставляли сушиться на горячей плите.
массу меди взвешивали на аналитических весах и рассчитывали % выхода, дигидрат хлорида меди, сульфат меди, воду, серную кислоту.
цинк гидроксид натрия 6 основной
кислый темно-синий черный светло-синий
оксид гидроксида меди 70°C 40°C
фильтрация бесцветного гидроксида
декантация 4 2 весы с верхней загрузкой % выход I аналитические весы I УФ-видимая спектрофотометрия …
Текст расшифровки изображения
Вопрос 6 Еще нет
ответил Вычеркнуто из
1.00 17 Отметить вопрос Вопрос 7 Еще нет
ответил Вычеркнуто из
1. 00 17 Отметить вопрос Вопрос 8 Еще нет
ответил Вычеркнуто из
1.00 17 Контрольный вопрос Расчеты На основе предоставленных экспериментальных данных выполните следующие расчеты.
Студент закончил эксперимент с 0,1556 г меди, начав с 0,2656 г CuCl2.2h30. Вычислите количество использованных молей CuCl2.2h30: Ответ: Студент закончил эксперимент с 0,1556 г меди, начав с 0,2656 г CuCl2.2h30. Вычислите моли полученной чистой меди (Cu): Ответ: Студент закончил эксперимент с 0,1556 г меди, начав с 026569.CuCl2.2х30.
Рассчитайте % выхода произведенной меди, т. е. процент извлечения меди по сравнению с ожидаемым количеством. (Подсказка: количество используемых реагентов всегда превышает количество соединений меди (гидроксид натрия, серная кислота и цинк).
соединения меди всегда являются лимитирующим реагентом. Это означает, что nCu=ncUC|2_2h30 при 100%-ном выходе.) (Совет 2: если полученная медь не была должным образом высушена перед взвешиванием, мы можем в конечном итоге вычислить выход >100%!
Почему это?) Ответ: .
00 17 Отметить вопрос Вопрос 8 Еще нет
ответил Вычеркнуто из
1.00 17 Контрольный вопрос Расчеты На основе предоставленных экспериментальных данных выполните следующие расчеты.
Студент закончил эксперимент с 0,1556 г меди, начав с 0,2656 г CuCl2.2h30. Вычислите количество использованных молей CuCl2.2h30: Ответ: Студент закончил эксперимент с 0,1556 г меди, начав с 0,2656 г CuCl2.2h30. Вычислите моли полученной чистой меди (Cu): Ответ: Студент закончил эксперимент с 0,1556 г меди, начав с 026569.CuCl2.2х30.
Рассчитайте % выхода произведенной меди, т. е. процент извлечения меди по сравнению с ожидаемым количеством. (Подсказка: количество используемых реагентов всегда превышает количество соединений меди (гидроксид натрия, серная кислота и цинк).
соединения меди всегда являются лимитирующим реагентом. Это означает, что nCu=ncUC|2_2h30 при 100%-ном выходе.) (Совет 2: если полученная медь не была должным образом высушена перед взвешиванием, мы можем в конечном итоге вычислить выход >100%!
Почему это?) Ответ: . ..
..
Текст транскрипции изображения
Информационные вопросы Следующие химические уравнения могут иметь несколько ошибок. Для каждого уравнения выберите все применимые проблемы. \V Флаговый вопрос Обратите внимание, что баллы будут вычтены за неправильные ответы. Вопрос 9 вода Не et 2+ 2- ответ CUCI —> CU (водн.) + Cl (водн.) Выделено из 050 Выберите один или несколько: \e Отметьте вопрос C] a. Некоторые химические состояния отсутствуют. С] б. Идентификация реагентов/продуктов неверна. С] с. Обвинения по видам неверны. CD. Нет проблем, на которые следует обратить внимание. С] е. Уравнение сбалансировано неправильно. …
Текст расшифровки изображения
Вопрос 10
Нагревать
Еще нет
Cu(OH)2(т) — CuO(т) + h30(9)
ответил
Выделено из
Выберите один или несколько:
0,50
О а. Нет проблем, на которые следует обратить внимание.
Пометить вопрос
О б. Обвинения по видам неверны.
О с. Идентификация реагентов/продуктов неверна.
О д. Некоторые химические состояния отсутствуют. О э. Уравнение сбалансировано неправильно.
Вопрос 1 1
2CuO(т) + 2h3SO4(водн.) — 2CUS05(водн.) + 2h3(9)
Еще нет
ответил
Выберите один или несколько:
Выделено из
0,50
О а. Идентификация реагентов/продуктов неверна.
Пометить вопрос
О б. Нет проблем, на которые следует обратить внимание.
О с. Уравнение не сбалансировано.
О д. Обвинения по видам неверны.
О э. Некоторые химические состояния отсутствуют….
О э. Уравнение сбалансировано неправильно.
Вопрос 1 1
2CuO(т) + 2h3SO4(водн.) — 2CUS05(водн.) + 2h3(9)
Еще нет
ответил
Выберите один или несколько:
Выделено из
0,50
О а. Идентификация реагентов/продуктов неверна.
Пометить вопрос
О б. Нет проблем, на которые следует обратить внимание.
О с. Уравнение не сбалансировано.
О д. Обвинения по видам неверны.
О э. Некоторые химические состояния отсутствуют….
ScienceChemistryInorganic Chemistry
Ответил DoctorBook23300 на сайте coursehero.com
sectetur adipiscing elit. Nam lacinia pulvinar
sectetur adipisci
- sectetur adipiscing elit. Nam lacinia pulvinar tortor n
- sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellent
- sectetur adipiscing elit. Nam lacinia pulvinar tortor nec fac
Разблокировать доступ к этому и более
10 000 пошаговых объяснений
Есть учетная запись? Войти
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, cong
Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, cong
sectetur adipiscing elit. Nam lacinia pulvinar tor
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lac
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictu
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec fac
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis.
Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis.
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. F
sectetur adipiscing elit. Nam lacinia pu
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie conse
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrice
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec fac
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel l
sectetur adipiscing elit.


 В левой части краткого ионного уравнения, соответствующего реакции между водным раствором карбоната натрия и азотной кислотой, сумма коэффициентов равна:
В левой части краткого ионного уравнения, соответствующего реакции между водным раствором карбоната натрия и азотной кислотой, сумма коэффициентов равна:
Leave A Comment