Конспект урока и презентация. Ионные уравнения.
#8 класс #Химия #Учебно-методические материалы #Презентация #Учитель-предметник #Школьное образование
Три пути ведут к знанию: путь размышления – самый благородный, путь подражания – самый легкий, и путь опыта – это самый горький.
Возвращенные шедевры
Джорджоне.Юдифь. И.И. Левитан. У омута. И.К.Айвазовский.Радуга.
Ионные уравнения реакций. Цель: Познакомиться с понятием ионные уравнения и рассмотреть случаи, при которых реакции ионного обмена протекают до конца.
ВОПРОСЫ Какие вещества называются электролитами? . Какие вещества называются неэлектролитами? Что называется ионом? Что называется электролитической диссоциацией? Что называется кислотой в свете ТЭД? Что называется солью в свете ТЭД? Что называется основанием в свете ТЭД?
Ионы
Большинство химических реакций протекает в растворах.
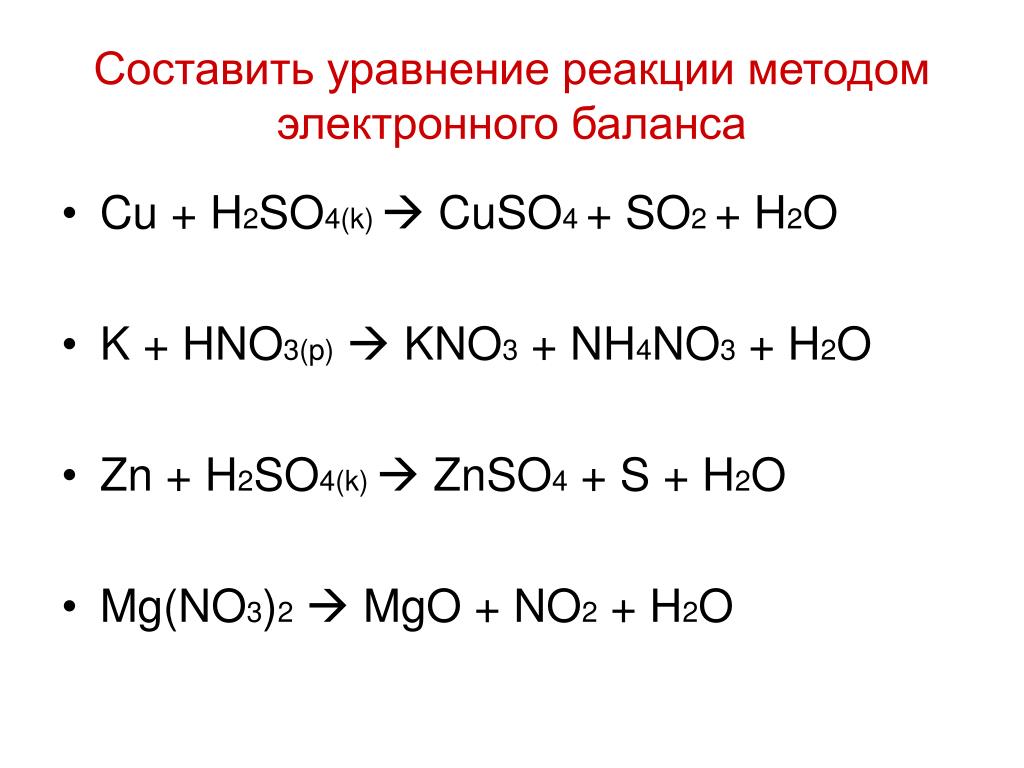
НСl + AgNO3 → AgCl + НNO3
. Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионно-молекулярное сокращенное ионно-молекулярное
. Ионные реакции – это реакции между ионами. Ионные уравнения – это уравнения ионных реакций. Например: 2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2 2K+ + CO32-+ 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
Практическое исследование
Помните, что любое вещество может быть опасным, если обращаться с ним неправильно! Без указания учителя не смешивайте неизвестные вам вещества!
Никогда не пробуйте химические вещества на вкус!
Реакции ионного обмена, идущие с выделением осадка
CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4 Выпадает осадок (↓) CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4 Cu2+ +SO42- +2Na++2OH — = Cu(OH) 2 ↓+2Na++ SO4 2- Ca2++ 2OH -= Ca(OH) 2 ↓ SO42- Na+ Cu2+ OH- SO42- Взаимодействие ионов в растворе Na+ Na+ Na+ ↓ SO42- SO42-
Реакции ионного обмена, идущие с выделением газа
2HCl + Na2CO3 = h3CO3 + 2 NaCl Выделяется газ (↑) 2HCl + Na2CO3 = h3CO3 + 2 NaCl h3O + CO2 ↑ 2H+ +2Cl-+2Na++CO32- = h3O+CO2↑+2Na++2Cl — 2H+ + CO32- = h3O + CO2 ↑ Cl- Cl- H+ CO32- Cl- Cl- Взаимодействие ионов в растворе H+ CO2 h3O Na+ Na+ Na+ Na+
Реакции ионного обмена, идущие с образованием слабого электролита
HCl + NaOH = NaCl + h3O Образуется вода HCl + NaOH = NaCl + h3O H+ +Cl- +Na++ OH- = h3O + Na++ Cl- H++ OH- = h3O Cl- Na+ H+ OH- Cl- Взаимодействие ионов в растворе Na+ h3O
Обратимые реакции
Na2SO4 + KI
Na+
SO42-
K+
I-
1.
В соответствии с правилом Бертолле ионные реакции протекают практически необратимо: I случай II случай III случай В остальных случаях реакции обратимы!
Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH- Na+ S2- H+ Cl- H+ NO3- K+ OH- Сu(OH)2 h3S h3O Выпадает осадок Выделяется газ Образуется слабый электролит Уравнение реакции Уравнение реакции Уравнение реакции
Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного молока, какао, кофе со сгущенным молоком.
Применение ионитов В медицине: 1.Для увеличения сроков хранения крови. 2.Для производства, выделения и очистки антибиотиков. 3.Использование ионитов, селективно извлекающих токсические вещества из крови человека.
Сокращенному ионному уравнению
Сокращенному ионному уравнению
Bа2+ + SО42- BаSО4
соответствуют схемы уравнений химических реакций
1. BаСl2 + K2SO4
2.
Сокращенному ионному уравнению Сокращенному ионному уравнению Н+ + ОН- h3O соответствуют схемы уравнений химических реакций 1. HСl + Fe(OH)2 2. Zn(OH)2 + h3SO4 3. NaOH + h4PO4 4. HNO3 + Ca(OH)2
Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3 + 6H+ = 2Al3+ + 6h3O 1.Al2O3 + 3CO2 = Al2(CO3)3 2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3 3.Al2O3 + 3h3SO4 = Al2(SO4)3 + 6h3O 4.AlCL3 + h3O = AlOHCl2+ + HCl Правильно Ошибка
Установи соответствие между продуктами реакций ионного обмена и схемами реакций газ Ca(OH)2 + НСl => NaOH + НРO3 => CaCO3 + Н2SO4 => НСl + K2S => осадок вода FeCl2 + KOH =>
Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием :
1. SO42-и H+ ; Ag+ и Cl-
2.Cl- и Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
SO42-и H+ ; Ag+ и Cl-
2.Cl- и Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
Домашнее задание § 37, упр. 4, 5. В сточных водах гальванического цеха химического завода обнаружены катионы Fe3+, Fe2+, Ni2+ и анионы Cl-, SO42-. Как с помощью реакций ионного обмена можно очистить эти стоки?
Ионные уравнения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Ионные уравнения
Цели урока:
1)Познакомить учащихся с понятием
ионные
2)рассмотреть случаи, при которых реакции ионного
обмена протекают до конца;
3)продолжить формирование умений составлять
уравнения химических реакций;
4)развивать
познавательный
выполнении теоретических
заданий.

интерес
при
и практических
Ионы
Большинство химических реакций протекает в
растворах. Растворы электролитов содержат
ионы.
Ионы – это положительно или отрицательно
заряженные
частицы,
в
которые
превращаются атомы или группы атомов в
результате
отдачи
или
присоединения
.
Ионные реакции – это реакции между ионами.
Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2
2K+ + CO32- + 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
.
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионное уравнение
сокращенное ионное уравнение
.
Реакции ионного обмена протекают до
конца в тех случаях, когда образуется
ОСАДОК
(МАЛОРАСТВОРИМОЕ
ВЕЩЕСТВО)
ГАЗ
МАЛОДИССОЦИИРУЮЩЕЕ
ВЕЩЕСТВО (ВОДА)
Реакции ионного обмена,
идущие с выделением осадка
Реакции ионного обмена,
идущие с выделением газа
.
Реакции
нейтрализации
–
реакция
взаимодействия сильной кислоты с щелочью.
Это частный случай реакции обмена.
Например: NaOH + HNO3 = NaNO3 + h3O
Na+ + OH- + H+ + NO3- = Na+ + NO3- + h3O
OH- + H+ = h3O
Домашнее задание:
§ 38, упр. 1,2.
14.04.2021.
Решение ионных
уравнений.
Если врезультате реакции выделяется
малодиссоциирующее (мд) вещество –
вода
1. KOH + HCl → KCl + h3O
2. CaO + HNO3 → Ca(NO3)2 + h3O
3. Mg(OH)2 + h3SO4 → MgSO4 + 2h3O
Если врезультате реакции
выделяется нерастворимое в воде
вещество
CuCl2 + KOH→KCl+ Cu(OH)2↓
Al2(SO4)3 + BaCl2 → BaSO4↓ + AlCl3
Если врезультате реакции выделяется
газообразное вещество
K2S + HCl → KCl + h3S↑
Na2CO3 + HNO3 →NaNO3 + h3O + CO2↑
Домашнее задание:
§38, упр.3;
подготовиться к проверочной
работе
Обобщение темы
Тест «Проверь себя»:
1) Ионные реакции – это реакции между:
а) нейтральными атомами б) ионами
в) молекулами
г) протонами
2) Реакции нейтрализации – частный случай реакции:
а) обмена
б) замещения
в) соединения г) разложения
3) Какое из приведенных веществ выпадает в осадок:
а) MgS
б) KОН
в) HNO3
г) Na2SO4
.

4) Какое вещество надо добавить к соляной кислоте,
чтобы в результате реакции выделился газ:
а) KOH б) NaOH
в) Na2CO3 г) AgNO3
5) Какое вещество является малодиссоциирующим:
а) h4PO4 б) KOH
в) Na2SO4 г) h3O
Ответы:
1. б
2. а
3. а
4. в
5. г
Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для
общеобразоват. учрежд. / О.С. Габриелян. – 16
изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.:
ил.
Использованы фотографии:
http://900igr.net/datai/fizika/Tok-v-rastvorakh/0011-001-Skhema-elektroliticheskojdissotsiatsii.gif
ионы хлорид натрия
http://pochit.ru/matematika/71334/index.html
образование малорастворимого вещества
образование газообразного вещества
образование слабого электролита — воды
English Русский Правила
4(водн.)+NaOH(водн.). Предоставьте ионное уравнение и результирующее ионное уравнение. Цитата страницы Начать эссе значок-вопрос Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Заполните и сбалансируйте следующее уравнение для H ^ 3PO ^ 4 (водн. ) + NaOH (водн.). Предоставьте ионное уравнение и суммарное ионное уравнение». eNotes Editorial , 18 ноября 2012 г., https://www.enotes.com/homework-help/complete-balance-following-equation-h-3po-4-aq-373771.
По состоянию на 21 марта 2023 г.
) + NaOH (водн.). Предоставьте ионное уравнение и суммарное ионное уравнение». eNotes Editorial , 18 ноября 2012 г., https://www.enotes.com/homework-help/complete-balance-following-equation-h-3po-4-aq-373771.
По состоянию на 21 марта 2023 г.
Ответы экспертов
h4PO4 + NaOH. Нас просят предоставить ионное уравнение и результирующее ионное уравнение. Ионное уравнение перечисляет все ионы в растворе в сбалансированной форме, а результирующее ионное уравнение исключает все неиспользуемые ионы-спектаторы. Оба реагента полностью ионизируются в воде. Поскольку h4PO4 обеспечивает 3 протона на молекулу кислоты, для полной нейтрализации каждой молекулы кислоты требуется 3 молекулы NaOH. Сбалансированное уравнение написано ниже.
h4PO4 + 3NaOH —> 3h3O + Na3PO4
Ионное уравнение написано ниже.
3H+ + (PO4)3- + 3Na+ + 3OH- —> 3h3O + 3Na+ + (PO4)3-
Ионы фосфата и натрия являются ионами-спектаторами. Итоговое ионное уравнение написано ниже.
3H+ + 3OH- —> 3h3O
См. eNotes без рекламы
Начните с 48-часовой бесплатной пробной версией , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые наши эксперты ответили.
Получите 48 часов бесплатного доступаУже зарегистрированы? Войдите здесь.
Утверждено редакцией eNotes
Наука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 19 сентября 2015 г. в 21:37:47.
Каковы четыре основные функции компьютерной системы?
2 Ответы воспитателя
Наука
Последний ответ опубликован 07 декабря 2018 г. в 12:04:01.
в 12:04:01.
Расположите следующие элементы в порядке от большего к меньшему: клетка, хромосома, ген, ДНК, организм, ядро.
3 Ответы воспитателя
Наука
Последний ответ опубликован 06 июля 2009 г. в 21:23:22.
Каковы функции компьютера?
7 Ответы педагога
Наука
Последний ответ опубликован 21 июня 2018 г. в 17:01:30.
Какие десять примеров решений вы можете найти у себя дома?
2 Ответы воспитателя
4.4: Ионные уравнения — более пристальный взгляд
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 64026
- Анонимный
- LibreTexts
Цели обучения
- Напишите ионные уравнения для химических реакций между ионными соединениями.

- Напишите суммарные ионные уравнения для химических реакций между ионными соединениями.
Для реакций одинарного и двойного замещения многие реакции включали ионные соединения — соединения металлов и неметаллов или соединения, содержащие распознаваемые многоатомные ионы. Теперь мы более подробно рассмотрим реакции, в которых участвуют ионные соединения.
Один важный аспект ионных соединений, который отличается от молекулярных соединений, связан с растворением в жидкости, такой как вода. Когда молекулярные соединения, такие как сахар, растворяются в воде, отдельные молекулы расходятся друг от друга. Когда ионные соединения растворяются, 9{-}(водный раствор)}\номер\]
Когда NaCl растворяется в воде, ионы разделяются и идут своим путем в растворе; ионы теперь записаны с их соответствующими зарядами, а метка фазы (водная) подчеркивает, что они растворены (рис. \(\PageIndex{1}\)). Этот процесс называется диссоциацией; мы говорим, что ионы диссоциируют .
Так ведут себя все растворяющиеся ионные соединения. Такое поведение было впервые предложено шведским химиком Сванте Августом Аррениусом [1859–1927] в рамках его докторской диссертации в 1884 году. Интересно, что его исследовательской группе было трудно поверить, что ионные соединения будут вести себя подобным образом, поэтому они дали Аррениусу едва проходной балл. Позже эта работа была процитирована, когда Аррениусу была присуждена Нобелевская премия по химии. Имейте в виду, что когда ионы разделяются, разделяются все ионов. Таким образом, когда CaCl 9{-}(водный)\номер\]
То есть два иона хлора уходят сами по себе. Они не остаются в виде Cl 2 (это был бы элементарный хлор; это ионы хлорида), и они не слипаются, образуя Cl 2 − или Cl 2 2 − . Они сами по себе становятся диссоциированными ионами. Многоатомные ионы также сохраняют свою общую идентичность при растворении.
Они сами по себе становятся диссоциированными ионами. Многоатомные ионы также сохраняют свою общую идентичность при растворении.
Пример \(\PageIndex{1}\)
Напишите химическое уравнение, представляющее диссоциацию каждого ионного соединения.
- КБр
- Нет 2 SO 4
Раствор
- KBr(т) → K + (водн.) + Br − (водн.)
- Не только два иона натрия идут своим путем, но и ион сульфата остается вместе как ион сульфата. Уравнение растворения: Na 2 SO 4 (т) → 2Na + (водн.) + SO 4 2 − (водн.)
Упражнение \(\PageIndex{1}\)
Напишите химическое уравнение, представляющее диссоциацию (NH 4 ) 2 S.
- Ответ
(NH 4 ) 2 S(s) → 2NH 4 + (водн.
 ) + S 2− (водн.)
) + S 2− (водн.)
Когда химические вещества в растворе вступают в реакцию, правильный способ написания химических формул растворенных ионных соединений — это диссоциированные ионы, а не полная ионная формула. А полное ионное уравнение — это химическое уравнение, в котором растворенные ионные соединения записываются как отдельные ионы. Правила растворимости очень полезны для определения того, какие ионные соединения растворяются, а какие нет. Например, когда NaCl (водн.) реагирует с AgNO 3 (водн.) в реакции двойного замещения с осаждением AgCl(s) и образованием NaNO 3 (водн.), полное ионное уравнение включает NaCl, AgNO 3 , и NaNO 3 записаны отдельными ионами:
9{−}(водный раствор)}\номер\]Это более точно отражает то, что происходит в решении.
Пример \(\PageIndex{1}\)
Напишите полное ионное уравнение для каждой химической реакции.
- KBr(водн.
 ) + AgC 2 H 3 O 2 (водн.) → KC 2 H 3 O 2 04 8Br(водн.)
) + AgC 2 H 3 O 2 (водн.) → KC 2 H 3 O 2 04 8Br(водн.)- MgSO 4 (водн.) + Ba(NO 3 ) 2 (водн.) → Mg(NO 3 ) 2 (водн.) + BaSO 4 (с)
Раствор
Для любого ионного соединения, которое является водным, мы запишем соединение как отдельные ионы.
- Полное ионное уравнение: → K + (водн.) + C 2 H 3 O 2 − (водн.) + AgBr(s)
- Полное ионное уравнение Mg 2 + (aq) + SO 4 2 — (AQ) + BA 2 + (AQ) + 2NO 3 133 (AQ) + 2NO 3 – (AQ) + 2NO 3 . (водн.) + 2NO 3 − (водн.) + BaSO 4 (т)
Упражнение \(\PageIndex{1}\)
Напишите полное ионное уравнение для
\[\ce{CaCl2(водн. ) + Pb(NO3)2(водн.) → Ca(NO3)2(водн.) + PbCl2(s)}\номер \]
) + Pb(NO3)2(водн.) → Ca(NO3)2(водн.) + PbCl2(s)}\номер \]
- Ответ
CA 2 + (AQ) + 2CL — (AQ) + PB 2 + (AQ) + 2NO 3 — (AQ) 3 — (AQ) 3 — (AQ) 3 — (AQ) 3 — (AQ). водный) + 2NO 3 − (водный) + PbCl 2 (т)
Вы можете заметить, что в полном ионном уравнении некоторые ионы не меняют своей химической формы; они остаются точно такими же на стороне реагента и продукта уравнения. Например, в
Na + (водн.) + Cl – (водн.) + Ag + (водн.) + NO 3 – (водн.) → AgCl(т) + Na + (водн.) + NO 3 – (0водн.)
ионы Ag + (водн.) и Cl − (водн.) превращаются в AgCl(s), но ионы Na + (водн. ) и ионы NO 3 − (водн.) остаются в виде Na ионы + (водн.) и NO 3 − (водн.) ионы. Эти два иона являются примерами ионов-спектаторов — ионов, которые ничего не делают в общем ходе химической реакции. Они присутствуют, но не участвуют в общей химии. Обычно ионы-спектаторы сокращаются (то же самое делается с алгебраическими величинами) на противоположных сторонах химического уравнения: 9{-}(водный)\номер\]
) и ионы NO 3 − (водн.) остаются в виде Na ионы + (водн.) и NO 3 − (водн.) ионы. Эти два иона являются примерами ионов-спектаторов — ионов, которые ничего не делают в общем ходе химической реакции. Они присутствуют, но не участвуют в общей химии. Обычно ионы-спектаторы сокращаются (то же самое делается с алгебраическими величинами) на противоположных сторонах химического уравнения: 9{-}(водный)\номер\]
То, что остается после удаления ионов-спектаторов, называется результирующим ионным уравнением , которое представляет фактическое химическое изменение, происходящее между ионными соединениями:
Cl − (водн.) + Ag + (водн.) → AgCl(тв)
Важно повторить, что ионы-спектаторы все еще присутствуют в растворе, но они не претерпевают каких-либо чистых химических изменений, поэтому они не записываются в итоговое ионное уравнение.
Пример \(\PageIndex{1}\)
Напишите суммарное ионное уравнение для каждой химической реакции.
- K + (aq) + BR — (AQ) + AG + (AQ) + C 2 H 3 O 2 h 3 O 2 ° 3333331 3 1. (водн.) + C 2 H 3 O 2 − (водн.) + AgBr(s)
- Mg 2 + (водн.) + SO 4 2 − (водн.) + Ba 2 + (водн.) + 13 901{-}(водн.)}+BaSo_{4}(s)\номер \]
Суммарное ионное уравнение: водн.) → BaSO 4 (s)
Упражнение \(\PageIndex{1}\)
Напишите суммарное ионное уравнение для
CaCl 2 (водн.) + Pb(NO 3 ) 2 (водн.) → Ca(NO 3 ) 2 (водн.) + PbCl 2 (тв)
- Ответ
Pb 2 + (водн.) + 2Cl − (водн.) → PbCl 2 (тв.)
Химия повсюду: растворимые и нерастворимые ионные соединения
Концепция растворимости и нерастворимости в ионных соединениях зависит от степени.
 Некоторые ионные соединения хорошо растворимы, некоторые — лишь умеренно, а некоторые растворимы настолько мало, что считаются нерастворимыми. Для большинства ионных соединений также существует ограничение на количество соединения, которое может быть растворено в образце воды. Например, вы можете растворить максимум 36,0 г NaCl в 100 г воды при комнатной температуре, но вы можете растворить только 0,00019 г.г AgCl в 100 г воды. \(\ce{NaCl}\) считаем растворимым, а \(\ce{AgCl}\) нерастворимым.
Некоторые ионные соединения хорошо растворимы, некоторые — лишь умеренно, а некоторые растворимы настолько мало, что считаются нерастворимыми. Для большинства ионных соединений также существует ограничение на количество соединения, которое может быть растворено в образце воды. Например, вы можете растворить максимум 36,0 г NaCl в 100 г воды при комнатной температуре, но вы можете растворить только 0,00019 г.г AgCl в 100 г воды. \(\ce{NaCl}\) считаем растворимым, а \(\ce{AgCl}\) нерастворимым.Одним из мест, где важна растворимость, являются водонагреватели резервуарного типа, установленные во многих домах в Соединенных Штатах. Бытовая вода часто содержит небольшое количество растворенных ионных соединений, включая карбонат кальция (CaCO 3 ). Однако CaCO 3 обладает относительно необычным свойством: он менее растворим в горячей воде, чем в холодной. Так как водонагреватель работает за счет нагрева воды, CaCO 3 может выпадать в осадок, если его в воде достаточно.
Рисунок \(\PageIndex{2}\) Водонагреватель бака © Thinkstock. В большинстве домов в Соединенных Штатах есть водонагреватель резервуарного типа, подобный этому. Этот осадок, называемый известковым налетом , может также содержать соединения магния, гидрокарбонатные соединения и фосфатные соединения. Проблема заключается в том, что слишком большое количество известкового налета может препятствовать работе водонагревателя, требуя больше энергии для нагрева воды до определенной температуры или даже блокируя водопроводные трубы, ведущие в водонагреватель или выходящие из него, вызывая дисфункцию.
Этот осадок, называемый известковым налетом , может также содержать соединения магния, гидрокарбонатные соединения и фосфатные соединения. Проблема заключается в том, что слишком большое количество известкового налета может препятствовать работе водонагревателя, требуя больше энергии для нагрева воды до определенной температуры или даже блокируя водопроводные трубы, ведущие в водонагреватель или выходящие из него, вызывая дисфункцию.Другим местом, где существует проблема растворимости и нерастворимости, является Гранд-Каньон. Мы обычно думаем о камне как о нерастворимом. Но на самом деле он очень слабо растворим. Это означает, что в течение примерно двух миллиардов лет река Колорадо вырезала горные породы с поверхности, медленно растворяя их, в конечном итоге создавая впечатляющую серию ущелий и каньонов. И все из-за растворимости!
Рисунок \(\PageIndex{3}\): Гранд-Каньон образовался в результате того, что вода текла сквозь горные породы в течение миллиардов лет, очень медленно растворяя их.


 ) + S 2− (водн.)
) + S 2− (водн.) ) + AgC 2 H 3 O 2 (водн.) → KC 2 H 3 O 2 04 8Br(водн.)
) + AgC 2 H 3 O 2 (водн.) → KC 2 H 3 O 2 04 8Br(водн.) Некоторые ионные соединения хорошо растворимы, некоторые — лишь умеренно, а некоторые растворимы настолько мало, что считаются нерастворимыми. Для большинства ионных соединений также существует ограничение на количество соединения, которое может быть растворено в образце воды. Например, вы можете растворить максимум 36,0 г NaCl в 100 г воды при комнатной температуре, но вы можете растворить только 0,00019 г.г AgCl в 100 г воды. \(\ce{NaCl}\) считаем растворимым, а \(\ce{AgCl}\) нерастворимым.
Некоторые ионные соединения хорошо растворимы, некоторые — лишь умеренно, а некоторые растворимы настолько мало, что считаются нерастворимыми. Для большинства ионных соединений также существует ограничение на количество соединения, которое может быть растворено в образце воды. Например, вы можете растворить максимум 36,0 г NaCl в 100 г воды при комнатной температуре, но вы можете растворить только 0,00019 г.г AgCl в 100 г воды. \(\ce{NaCl}\) считаем растворимым, а \(\ce{AgCl}\) нерастворимым. Этот осадок, называемый известковым налетом , может также содержать соединения магния, гидрокарбонатные соединения и фосфатные соединения. Проблема заключается в том, что слишком большое количество известкового налета может препятствовать работе водонагревателя, требуя больше энергии для нагрева воды до определенной температуры или даже блокируя водопроводные трубы, ведущие в водонагреватель или выходящие из него, вызывая дисфункцию.
Этот осадок, называемый известковым налетом , может также содержать соединения магния, гидрокарбонатные соединения и фосфатные соединения. Проблема заключается в том, что слишком большое количество известкового налета может препятствовать работе водонагревателя, требуя больше энергии для нагрева воды до определенной температуры или даже блокируя водопроводные трубы, ведущие в водонагреватель или выходящие из него, вызывая дисфункцию.
Leave A Comment