3-метилбутен-1, химические свойства, структурная формула, Ch3=CH-CH(Ch4)-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задание 11 ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 51.7%
Ответом к заданию 11 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Посмотреть
Задачи для практики
Задача 1
Из предложенного перечня выберите два класса веществ, в молекулах которых присутствует функциональная группа
- спирты
- кетоны
- простые эфиры
- фенолы
- пептиды
Запишите в поле ответа номера выбранных классов веществ.
Решение
Функциональная группа -С(О)- (карбонильная группа) присутствует в кетонах в составе кетогруппы, в альдегидах в составе альдегидной группы -СНО и в кислотах в составе карбоксильной группы -СООН. Среди предложенных классов есть кетоны а также пептиды — производные аминокислот, тоже несущие карбонильную группу — в составе пептидной связи -С(О)-NH-. 2$-гибридизацию.
2$-гибридизацию.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 4
Из предложенного перечня выберите два ряда веществ, которые являются гомологами.
- $CH_3NO_2$ и $CH_3NH_2$
- $CH_3OH$ и $CH_3COOH$
- $CH_3CH_2CH_2OH$ и $CH_3OH$
- $CH_3Cl$ и $CH_3Br$
- $CH_3CHO$ и $C_2H_5CHO$
Запишите в поле ответа номера выбранных рядов веществ.
Решение
Гомологическим рядом называют ряд веществ, которые имеют общую формулу, похожее строение, закономерно изменяющиеся физические свойства, общие способы получения и общие химические свойства и отличаются по составу на одну или несколько групп $CH_2$, которая называется гомологической разностью. Гомологи — вещества, принадлежащие к одному гомологическому ряду.
1) $CH_3NO_2$ — нитрометан, класс нитросоединений; $CH_3NH_2$ — метиламин (аминометан), класс предельных первичных аминов. Вещества принадлежат к разным классам.
Вещества принадлежат к разным классам.
2) $CH_3OH$ — метанол (метиловый спирт), класс предельных одноатомных спиртов; $CH_3COOH$ — уксусная кислота. Вещества принадлежат к разным классам.
3) $CH_3CH_2CH_2OH$ — пропанол-1, $CH_3OH$ — метанол. Оба вещества относятся к классу спиртов, отличаются по составу на две группы $–CH_2$, имеют похожее строение (линейная цепь углеродных атомов, группа –OH находится у крайнего атома углерода) и общую формулу $C_{n}H_{2n+2}O (C_{n}H_{2n+1}OH$), т. е. являются гомологами.
4) $CH_3Cl$ — хлорметан и $CH_3Br$ — бромметан. Вещества отличаются качественным составом.
5) $CH_3CHO$ — этаналь, класс альдегидов предельного ряда; $C_2H_5CHO$ — пропаналь, класс альдегидов предельного ряда. Оба вещества относятся к классу альдегидов, отличаются по составу на группу $–CH_2$, имеют похожее строение (линейная цепь углеродных атомов) и общую формулу $C_{n}H_{2n}O$, т. е. являются гомологами.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 5
Из предложенного перечня выберите два вещества, в молекулах которых имеется две π-связи.
- акриловая кислота
- пропен
- бутан
- бутен
- ацетилен
Запишите в поле ответа номера выбранных веществ.
Решение
Двойная связь состоит из одной σ-связи и одной π-связи.
Тройная связь состоит из одной σ-связи и двух π-связей.
1) Акриловая (пропеновая) кислота $CH_2=CH–C(O)–OH$. В молекуле имеется одна двойная C=C связь и одна двойная C=O связь. Ответ правильный.
2) Пропен $CH_2=CH–CH_3$. В молекуле имеется одна двойная С=С связь. Ответ неверный.
3) Бутан $CH_3–CH_2–CH_2–CH_3$. В молекуле нет двойных С=С связей. Ответ неверный.
4) Бутен, $CH_2=CH–CH_2–CH_3$ или $CH_3–CH=CH–CH_3$. В молекуле любого из бутенов имеется только одна двойная C=C связь. Ответ неверный.
5) Ацетилен, или этин, H–C≡C–H. В молекуле имеется тройная C≡C связь. Ответ правильный.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 6
Из предложенного перечня выберите два вещества, которые относятся к тем же гомологическим рядам, что и вещества, имеющие молекулярную формулу $С_5Н_{10}$.
- метан
- этилен
- бензол
- циклопропан
- ацетилен
Запишите в поле ответа номера выбранных веществ.
Решение
Общую формулу гомологического ряда $C_nH_{2n}$ имеют алкены и циклоалканы. В предложенном списке веществ есть алкен – этилен, и циклоалкан – циклопропан.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 7
Из предложенного перечня выберите два вещества, которые являются изомерами 2-метилбутана.
- $CH_3–CH_2–CH_2–CH_2–CH_3$
- $CH_3–CH_2–CH_2–CH_3$
Запишите в поле ответа номера выбранных веществ.
Решение
Изомеры — вещества, имеющие одинаковый состав, то есть одинаковую молекулярную формулу, но разное строение. 2-метилбутан $СН_3-СН(СН_3)-СН_2-СН_3$ имеет молекулярную формулу $С_5Н_{12}$. Такую же молекулярную формулу имеют все алканы с пятью атомами углерода, в том числе представленный под номером 1 н-пентан и представленный под номером 2 1,2-диметилпропан.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 8
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентена-1.
- циклопентан
- пентадиен-1,3
- 2-метилбутан
- 2-метилбутен-2
- 3-метилбутин-1
Запишите в поле ответа номера выбранных веществ.
Решение
Пентен-1 – алкен, то есть имеет 5 атомов углерода и 10 атомов водорода, его изомерами являются циклопентан, который также теряет два атома водорода из-за кольцевой связи, а также 2-метилбутен-2, который теряет 2 атома водорода в той же двойной связи.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 9
Из предложенного перечня выберите две пары веществ, которые являются гомологами.
- этилен и метан
- пропен и этен
- циклобутан и бутан
- пропан и бутан
- этин и этен
Запишите в поле ответа номера выбранных пар веществ.
Решение
Гомологи — вещества, принадлежащие к одному классу. В первой паре представлен алкен и алкан, во второй — два алкена, в третьей — циклоалкан и алкан, в четвёртой — два алкана, в пятой — алкин и алкен. Таким образом, гомологи представлены в парах номер 2 и 4.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 10
Из предложенного перечня выберите два класса органических веществ, к которым может относиться вещество, формула которого $C_4H_{10}O$.
- спирты
- альдегиды
- простые эфиры
- сложные эфиры
- кетоны
Запишите в поле ответа номера выбранных классов веществ.
Решение
Общей формулой гомологического ряда спиртов является $С_{n}H_{2n+1}ОH$, что как раз соответствует данному веществу (его можно переписать как $C_{4}H_{9}OH$). Общей формулой гомологического ряда простых эфиров является $С_{n}H_{2n+2}О$, что также соответствует данному веществу.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 11
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- этанол
- этан
- этаналь
- ацетон
- этановая кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Водородные связи образуются между молекулами веществ, содержащих атом водорода непосредственно связанным с атомом кислорода. Из органических веществ это спирты, фенолы, карбоновые кислоты, аминокислоты. Среди представленных веществ есть спирт — этанол и карбоновая кислота — этановая.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 12
Из предложенного перечня выберите два вещества, которые имеют систему сопряжённых связей.
- фенол
- бутадиен-1,3
- циклогексен
- 2-метилбутан
- бутин-1
Запишите в поле ответа номера выбранных веществ.
Решение
Систему сопряжённых связей имеют, прежде всего, сопряжённые диены (две двойных связи разделены одинарной). Но помимо них сопряжённые двойные связи формально присутствуют в бензольном кольце, что наглядно отражает формула Кекуле. Среди предложенных веществ есть сопряжённый диен — бутадиен-1,3 $CH_2=CH-CH=CH_2$ и соединение, имеющее в составе бензольное кольцо — фенол $С_6Н_5ОН$.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 13
Из предложенного перечня выберите две пары веществ, каждое из которых содержит функциональную группу –ОН.
- фенол и рибоза
- диэтиловый эфир и глюкоза
- сахароза и формальдегид
- фенол и толуол
- пропанол и крезол
Запишите в поле ответа номера выбранных пар веществ.
Решение
Функциональную группу –ОН содержат спирты, фенолы и углеводы. Из предложенных пар веществ эту группу имеют фенол и рибоза (углевод) — номер 1, пропанол (спирт) и крезол (метилфенол).
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 14
Из предложенного перечня выберите два вещества, которые имеют общую формулу СnH2n.
- бензол
- циклогексан
- гексан
- гексен
- гексин
Запишите в поле ответа номера выбранных веществ.
Решение
Общая формула $С_nH_{2n}$ соответствует классу алкенов, а также их изомеров — циклоалканов. Среди предложенных веществ есть циклоалкан — циклогексан ($С_6Н_{12}$) и алкен — гексен ($С_6Н_{12}$).
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 15
Из предложенного перечня выберите два вещества, которые относятся к кетонам.
- формалин
- ацетон
- этилацетат
- бутанон
- фруктоза
Запишите в поле ответа номера выбранных веществ.
Решение
О принадлежности к классу кетонов в названии вещества свидетельствует суффикс -он-. По этому принципу выбираем бутанон, а ацетон — это тривиальное название диметилкетона (пропанона).
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 16
Из предложенного перечня выберите два вещества, которые являются гомологами глицина.
- $CH_3CH_2CONH_2$
- $CH_3CH(NH_2)COOH$
- $CH_3CH_2COOH$
- $CH_3CH_2CH(NH_2)COOH$
- $CH_3CH_2NH_2$
Запишите в поле ответа номера выбранных веществ.
Решение
Гомологи — вещества, относящиеся к одному классу. Глицин $NH_2-СН_2-СООН$ — аминокислота. К этому же классу относятся вещества, имеющие в составе карбоксильну группу -СООН и аминогруппу $-NH_2$. Подходят соединения под номерами 2 и 4.
Подходят соединения под номерами 2 и 4.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 17
Из предложенного перечня выберите два вещества, которые являются гомологами бензола.
- циклогексан
- толуол
- ацетилен
- винилбензол
- фенилэтан
Запишите в поле ответа номера выбранных веществ.
Решение
Гомологи — вещества, принадлежащие одному классу соединений. Безол — ароматический углеводород, то есть содержит бензольное кольцо и состоит только из углерода и водорода. Его гомологами являются толуол (метилбензол) и фенилэтан. Винилбензол не является гомологом, так как содержит непредельный радикал.
Ответ: 25
Показать решение
Бесплатный интенсив
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк —
это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить
уведомления.
Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить
уведомления.
Включить уведомления
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.
Курс стартует 27 марта. Бесплатный интенсив
Поиск Вернуться к органическим звенам Уровень 1-Алканы Уровень 2-Алкен Уровень 3 Уровень 4 Уровень 4 Уровень 5 Уровень 6-й уровень 7 Цикл 7 Цикл. Цикл.
За прошедшие годы я обнаружил, что просто дать названия органическим соединениям невозможно. Я проведу вас через все изомеры метана через октан. Алканы – это насыщенные (все одинарные связи) углеводороды (только водород и углерод). Правило для наименования: все они заканчиваются на «-ane». Общая формула C n H 2n+2 , n — число атомов углерода, используется для определения числа атомов водорода. Пример n=5, поэтому H=(2(5) +2)=12 C 5 H 12
Гомологические серии- вы приходили на выявление у вас. Теперь у молекулярных формул есть ограничения. Вы никогда не знаете, как устроена молекула. Итак, давайте посмотрим на структурные формулы и назовем каждую. Первые 3 алкана не имеют изомеров (их можно нарисовать только одним способом). Делает хороший вопрос с множественным выбором.
Именование соединений- Игнорируйте все соединения водорода. Мы беспокоимся только об атомах углерода. Изомеры бутана C 4 H 10 Правило № 1. Назовите самую длинную непрерывную цепь атомов углерода и завершите ее цифрой -ан .
Правило № 2.
Изомеры пентана C 5 H 12
Правило № 3- Множественные боковые цепи будут использовать предварительные изделия 2 IS Di-IS, 3-это 4, 4-это 4, 4-это 4, 4-это 4, 4-это 4, 4-это 4, и 4-это 4. на.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| n-hexane |
| methyl pentane |
| methyl pentane |
WAIT….these это разные структуры с одинаковыми именами…
Правило №4 При необходимости используйте наименьший номер , чтобы указать расположение каждой боковой цепи. Возможно, вам придется пронумеровать самую длинную цепочку справа, чтобы найти наименьшее число. (ПРИМЕЧАНИЕ цифры и буквы разделены дефисом)
| 2-methyl pentane |
| 3-methyl pentane |
| 2,2-dimethyl butane
|
Вы заметили, что мы должны были нумеровать справа? Если бы мы назвали слева, это был бы 3,3-диметилбутан.
2+2 против 3+3 всегда используйте наименьшие числа.
| 2,3-dimethyl butane |
Isomers of Heptane C 7 H 16
| n-heptane |
| 2-methylhexane |
| 3-methylhexane |
| 2,2-dimethyl pentane |
| 3,3-dimethyl pentane |
| 2,3-диметилпентан |
| 2,2,3-триметилбутан |
Опять же, каждая боковая цепь получает номер. Так как у нас есть 3, одна углеродная боковая цепь, она называется «триметил». Вам лучше иметь 3 #, когда у вас есть префикс tri.
| этилпентан |
Имеет 1(2-углеродную) боковую цепь. Это НЕ диметил. Диметил представляет собой 2 (1-углеродные) боковые цепи. Это «этиловая» группа.
Обратите внимание, я не использовал номер. Если сдвинуть на один углерод влево…
| 3-метилгексан |
Самая длинная цепь становится гексаном.
Isomers of Octane C 8 H 18
| n-octane |
| 2-methyl heptane |
| 3-methyl heptane |
| 4-methyl heptane |
| 2,2-dimethyl hexane |
| 2,3-dimethyl hexane |
| 2,4-dimethyl hexane |
| 2,5-dimethyl hexane |
| 3,3-dimethyl hexane |
| 3,4-dimethyl hexane |
| ethyl hexane (no number needed) |
| 2,2,3-trimethyl pentane |
| 2,2,4-trimethyl pentane |
| 2,3,3,3-триметилпентатан (номер с правой стороны) |
| 2,3,4-триметил-пентан |
Правила #5-5- две разные боковые цепи, назовите их в алфавитном порядке, используя префикс углерода (meth, eth. .).
.).
| этил-2-метилпентатан (этил не нуждается в #, он может быть только на углероде 3) |
| ETHYL-3-митиля Пентана 97497474747474974747474747474747474747474747474747474747474747473434. | . | |||
| тетраметилбутан (не требуется, 4 атома углерода должны занимать 2,2,3,3) Циклические соединения вернуться к ссылкам ORGANIC Демонстрационные видеоролики о химических веществах |
Номенклатура органических веществ
Номенклатура |
|---|
Увеличивающееся число органических соединений, идентифицируемых с каждым днем, а также тот факт, что многие из этих соединений являются изомерами других соединений, требуют разработки системы систематической номенклатуры. Точно так же, как каждое отдельное соединение имеет уникальную молекулярную структуру, которая может быть обозначена структурной формулой, каждому соединению должно быть присвоено характерное и уникальное имя.
Точно так же, как каждое отдельное соединение имеет уникальную молекулярную структуру, которая может быть обозначена структурной формулой, каждому соединению должно быть присвоено характерное и уникальное имя.
По мере того как органическая химия росла и развивалась, многим соединениям были даны тривиальные названия, которые сейчас широко используются и признаются. Некоторые примеры:
| Имя | Метан | Бутан | Ацетон | Толуол | Ацетилен | Этиловый спирт |
|---|---|---|---|---|---|---|
| Формула | CH 4 | C 4 H 10 | CH 3 COCH 3 | CH 3 C 6 H 5 | C 2 H 2 | C 2 H 5 OH | 5.
Такие общеупотребительные названия часто берут свое начало в истории науки и природных источниках конкретных соединений, но отношение этих названий друг к другу произвольно, и в их присвоении нет никаких рациональных или систематических принципов.
Систематический подход IUPAC к номенклатуре
Рациональная система номенклатуры должна делать как минимум две вещи. Во-первых, он должен указать, как атомы углерода данного соединения связаны друг с другом в характерной решетке цепей и колец. Во-вторых, он должен идентифицировать и локализовать любые функциональные группы, присутствующие в соединении. Поскольку водород является таким распространенным компонентом органических соединений, его количество и расположение можно предположить по четырехвалентности углерода, и в большинстве случаев его не нужно указывать.
Система номенклатуры IUPAC представляет собой набор логических правил, разработанных и используемых химиками-органиками для обхода проблем, вызванных произвольной номенклатурой. Зная эти правила и зная структурную формулу, можно написать уникальное название для каждого отдельного соединения. Точно так же, имея имя IUPAC, можно написать структурную формулу. Как правило, имя ИЮПАК будет иметь три основные характеристики:
Корень или основание, указывающее на основную цепь или кольцо атомов углерода в молекулярной структуре.
Суффикс или другой элемент(ы), обозначающие функциональные группы, которые могут присутствовать в соединении.
Названия групп-заместителей, кроме водорода, которые завершают молекулярную структуру.
В качестве введения в систему номенклатуры IUPAC мы сначала рассмотрим соединения, не имеющие определенных функциональных групп. Такие соединения состоят только из атомов углерода и водорода, связанных между собой сигма-связями (все атомы углерода имеют sp 3 гибридный).
Отличное представление органической номенклатуры представлено на странице номенклатуры. созданный Дэйвом Вудкоком.
Также доступна полная презентация Правил IUPAC.
Алканы |
|---|
Алканы
Углеводороды, не имеющие функциональных групп двойной или тройной связи, классифицируются как алканы или циклоалканы в зависимости от того, расположены ли атомы углерода в молекуле только в виде цепей или также в виде колец. Хотя эти углеводороды не имеют функциональных групп, они составляют каркас, на котором располагаются функциональные группы других классов соединений, и являются идеальной отправной точкой для изучения и обозначения органических соединений. Алканы и циклоалканы также относятся к более широкому классу соединений, называемому 9.0271 алифатические . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
Хотя эти углеводороды не имеют функциональных групп, они составляют каркас, на котором располагаются функциональные группы других классов соединений, и являются идеальной отправной точкой для изучения и обозначения органических соединений. Алканы и циклоалканы также относятся к более широкому классу соединений, называемому 9.0271 алифатические . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
В следующей таблице перечислены названия IUPAC, присвоенные простым алканам с непрерывной цепью от C-1 до C-10. Общий суффикс «ан» идентифицирует эти соединения как алканы. Алканы с более длинной цепью хорошо известны, и их названия можно найти во многих справочниках и учебниках. Названия метан по декан следует запомнить, так как они составляют корень многих названий ИЮПАК. К счастью, для обозначения цепочек из пяти и более атомов углерода используются обычные числовые префиксы.
| Name | Molecular Formula | Structural Formula | Isomers | Name | Molecular Formula | Structural Formula | Isomers | |
|---|---|---|---|---|---|---|---|---|
| meth ane | CH 4 | CH 4 | 1 | hex ane | C 6 H 14 | CH 3 (CH 2 ) 4 CH 3 | 5 | |
| eth ane | C 2 H 6 | CH 3 CH 3 | 1 | hept ane | C 7 H 16 | CH 3 (CH 2 ) 5 CH 3 | 9 | |
| prop ane | C 3 H 8 | CH 3 CH 2 CH 3 | 1 | oct ane | C 8 H 18 | CH 3 (CH 2 ) 6 CH 3 | 18 | |
| but ane | C 4 H 10 | CH 3 CH 2 СН 2 СН 3 | 2 | non ane | C 9 H 20 | CH 3 (CH 2 ) 7 CH 3 | 35 | |
| pent ane | C 5 H 12 | CH 3 (CH 2 ) 3 CH 3 | 3 | dec ane | C 10 H 22 | CH 3 (CH 2 ) 8 CH 3 | 75 |
Некоторые важные тенденции поведения и терминология:
(i) Формулы и структуры этих алканов равномерно возрастают
с шагом CH 2 .
(ii) Единая вариация такого рода в ряду соединений называется гомологичен .
(iii) Все эти формулы подходят для С n H 2n+2 правило. Это также максимально возможное соотношение H/C для стабильного углеводорода.
(iv) Поскольку соотношение H/C в этих соединениях максимально, мы называем их насыщенный (с водородом).
Начиная с бутана (C 4 H 10 ), и становится более многочисленным с более крупными алканами, мы отмечаем существование изомеров алканов. Например, есть пять C 6 H 14 изомеры, показанные ниже в виде сокращенной строки формул ( 9от 0271 А до Е ):
Хотя все эти разные соединения имеют одинаковую молекулярную формулу, только одно из них ( A ) можно назвать гексаном. Как же тогда назвать остальных?
Система IUPAC требует, во-первых, наличия названий для простых неразветвленных цепей, как отмечалось выше, и, во-вторых, наличия названий для простых алкильных групп, которые могут быть присоединены к цепям. Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах именования. Символ R используется для обозначения общей (неопределенной) алкильной группы.
Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах именования. Символ R используется для обозначения общей (неопределенной) алкильной группы.
| Группа | CH 3 – | С 2 Н 5 – | CH 3 CH 2 CH 2 – | (CH 3 ) 2 СН– | CH 3 CH 2 CH 2 CH 2 – | (CH 3 ) 2 CHCH 2 – | CH 3 CH 2 CH(CH 3 )– | (CH 3 ) 3 C– | Р– |
| Имя | Метил | Этил | Пропил | Изопропил | Бутил | Изобутил | сек -Бутил | трет -Бутил | Алкил |
Правила ИЮПАК для номенклатуры алканов 1. |
Для вышеуказанных изомеров гексана названия IUPAC: B 2-метилпентан C 3-метилпентан D 2,2-диметилбутан E 2,3-диметилбутан
Галогеновые заместители легко сочетаются с использованием названий: фтор (F-), хлор (Cl-), бром (Br-) и йод (I-). Например, (CH 3 ) 2 CHCH 2 CH 2 Br будет называться 1-бром-3-метилбутан. Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, С 2 H 5 Cl может называться хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом. Галогенированные алкильные заместители, такие как бромметил, BrCH 2 — и трихлорметил, CCl 3 -, могут быть перечислены и расположены в алфавитном порядке в соответствии с их полными названиями.
Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, С 2 H 5 Cl может называться хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом. Галогенированные алкильные заместители, такие как бромметил, BrCH 2 — и трихлорметил, CCl 3 -, могут быть перечислены и расположены в алфавитном порядке в соответствии с их полными названиями.
Дополнительные примеры того, как эти правила используются при наименовании разветвленных алканов, и некоторые подправила номенклатуры .
Циклоалканы |
|---|
Циклоалканы
Циклоалканы имеют один или несколько
кольца атомов углерода. Простейшие примеры этого класса состоят из
одиночное незамещенное углеродное кольцо, и они образуют гомологический ряд, подобный
к неразветвленным алканам.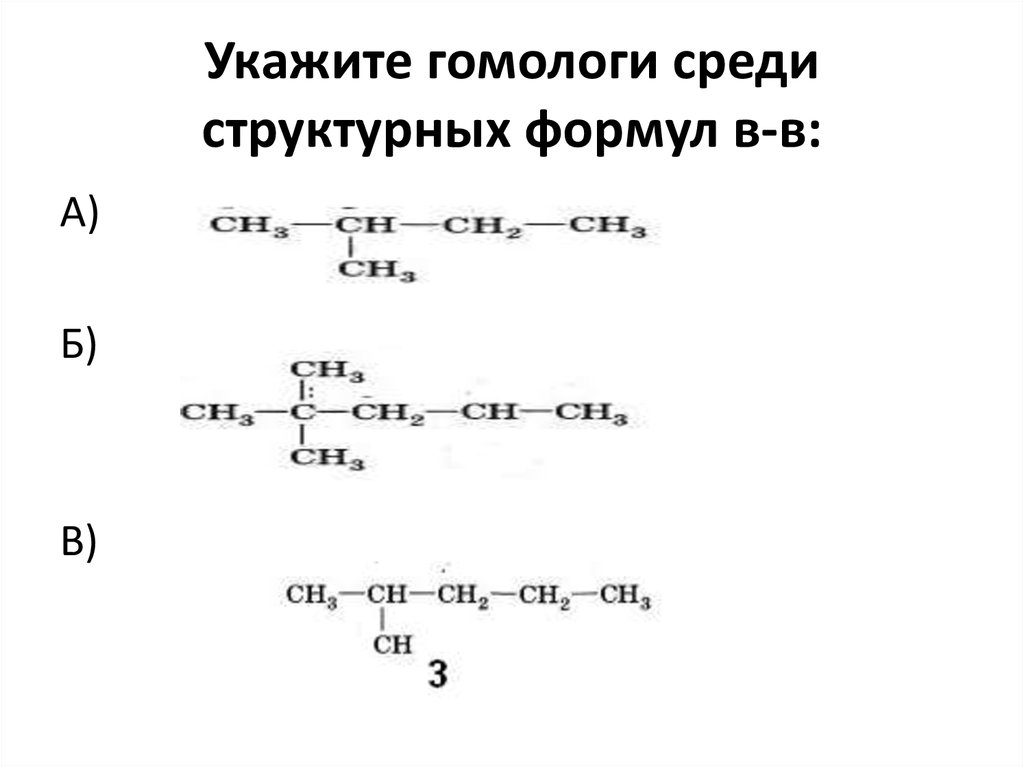 Имена IUPAC первых пяти членов
эта серия представлена в следующей таблице. Последний (желтый) столбец дает
общая формула циклоалкана любого размера. Если простой неразветвленный
алкан превращается в циклоалкан с двумя атомами водорода, по одному с каждого конца
цепи, должны быть потеряны. Отсюда общая формула циклоалкана
состоит из n атомы углерода это C n H 2n . Хотя в циклоалкане на два атома водорода меньше, чем в эквивалентном алкане, каждый углерод связан с четырьмя другими атомами, поэтому такие соединения по-прежнему считаются насыщенными водородом.
Имена IUPAC первых пяти членов
эта серия представлена в следующей таблице. Последний (желтый) столбец дает
общая формула циклоалкана любого размера. Если простой неразветвленный
алкан превращается в циклоалкан с двумя атомами водорода, по одному с каждого конца
цепи, должны быть потеряны. Отсюда общая формула циклоалкана
состоит из n атомы углерода это C n H 2n . Хотя в циклоалкане на два атома водорода меньше, чем в эквивалентном алкане, каждый углерод связан с четырьмя другими атомами, поэтому такие соединения по-прежнему считаются насыщенными водородом.
| Имя | Циклопропан | Циклобутан | Циклопентан | Циклогексан | Циклогептан | Циклоалкан |
|---|---|---|---|---|---|---|
| Молекулярный Формула | С 3 Н 6 | С 4 Н 8 | С 5 Н 10 | С 6 Н 12 | С 7 Н 14 | C n H 2n |
| Структурный Формула | (CH 2 ) n | |||||
| Линия Формула |
Замещенные циклоалканы названы так же, как и разветвленные алканы. Основное различие в правилах и процедурах заключается в системе нумерации. Поскольку все атомы углерода в кольце эквивалентны (кольцо не имеет концов, как цепь),
нумерация начинается с замещенного кольцевого атома.
Основное различие в правилах и процедурах заключается в системе нумерации. Поскольку все атомы углерода в кольце эквивалентны (кольцо не имеет концов, как цепь),
нумерация начинается с замещенного кольцевого атома.
Правила ИЮПАК для номенклатуры циклоалканов 1. Для монозамещенного циклоалкана кольцо дает название корня (таблица выше), а группа-заместитель называется как обычно. Номер места необязателен. |
Примеры того, как эти правила используются при присвоении названий замещенным циклоалканам.
Маленькие кольца, такие как три и
четырехчленные кольца, имеют значительную угловую деформацию в результате деформации
углов связи углерода sp 3 от идеального
109,5º до 60º и 90º соответственно. Эта угловая деформация часто увеличивает химическую активность таких соединений, что приводит к образованию продуктов разрыва кольца. Это также важно
признать, что, за исключением циклопропана, циклоалкильные кольца
не являются плоскими (плоскими). Трехмерные формы, принятые общим
кольца (особенно циклогексановые и более крупные кольца) описаны и обсуждены в разделе «Конформационный анализ».
Это также важно
признать, что, за исключением циклопропана, циклоалкильные кольца
не являются плоскими (плоскими). Трехмерные формы, принятые общим
кольца (особенно циклогексановые и более крупные кольца) описаны и обсуждены в разделе «Конформационный анализ».
Углеводороды, имеющие более одного кольца, широко распространены и называются бициклическими (два кольца), трициклическими (три кольца) и вообще полициклическими соединениями. Молекулярные формулы таких соединений имеют отношения H/C, которые уменьшаются с числом колец. В общем, для углеводорода, состоящего из n атомов углерода, связанный с м кольцами формула: C n H (2n + 2 — 2m) . Структурное соотношение колец в полициклическом соединении может варьироваться. Они могут быть отдельными и независимыми или иметь один или два общих атома. Некоторые примеры этих возможных компоновок показаны в следующей таблице.
Примеры изомерных C
8 H 14 Бициклоалканы| Изолированные кольца | Кольца Spiro | Плавкие кольца | Кольца с мостиками |
|---|---|---|---|
| Нет общих атомов | Один общий атом | Одна обыкновенная облигация | Два обычных атома |
Практические задачи |
|---|
| Выберите проблему Сопоставление формул и имен Распознавание имен формул Получение алканов из названий IUPAC Рисование циклолканов из названий IUPAC |
Алкены и алкины |
|---|
Алкены и алкины
Алкены и алкины представляют собой углеводороды, которые имеют соответственно углерод-углеродную двойную связь и углерод-углеродную тройную связь функциональных групп. Молекулярные формулы этих ненасыщенных углеводородов отражают множественное связывание функциональных групп:
Молекулярные формулы этих ненасыщенных углеводородов отражают множественное связывание функциональных групп:
| Алкан | R–CH 2 –CH 2 –R | C n H 2n+2 | Это максимальное отношение H/C для данного числа атомов углерода. |
|---|---|---|---|
| Алкен | R–CH=CH–R | С Н Н 2 Н | Каждая двойная связь уменьшает число атомов водорода на 2. |
| Алкин | R–C≡C–R | С Н Н 2н-2 | Каждая тройная связь уменьшает число атомов водорода на 4. |
Как отмечалось ранее в разделе «Анализ молекулярных формул», молекулярная формула углеводорода предоставляет информацию о возможных структурных типах, которые он может представлять. Например, рассмотрим соединения, имеющие формулу C 5 H 8 . Формула пентана пятиуглеродного алкана C 5 H 12 , поэтому разница в содержании водорода равна 4. Эта разница предполагает, что такие соединения могут иметь тройную связь, две двойные связи, кольцо плюс двойную связь или два кольца. Некоторые примеры показаны здесь, а есть как минимум четырнадцать других!
Формула пентана пятиуглеродного алкана C 5 H 12 , поэтому разница в содержании водорода равна 4. Эта разница предполагает, что такие соединения могут иметь тройную связь, две двойные связи, кольцо плюс двойную связь или два кольца. Некоторые примеры показаны здесь, а есть как минимум четырнадцать других!
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов 1. Суффикс ene (окончание) указывает на алкен или циклоалкен. |
Правила ИЮПАК для номенклатуры алкинов 1. Суффикс yne (окончание) указывает на алкин или циклоалкин. |
Для примеров того, как эти правила используются для обозначения алкенов, алкинов и циклических аналогов .
Номенклатура соединений с замещенным бензольным кольцом менее систематична, чем номенклатура алканов, алкенов и алкинов. Несколько монозамещенных соединений названы с использованием названия группы в качестве префикса к «бензолу», как показано комбинированными названиями, перечисленными ниже. Однако большинство этих соединений называют уникальными именами в единственном числе. Нет простой альтернативы запоминанию в освоении этих имен.
Двумя обычно встречающимися группами заместителей, которые включают бензольное кольцо, являются фенил , сокращенно Ph-, и бензил , сокращенно Bn-.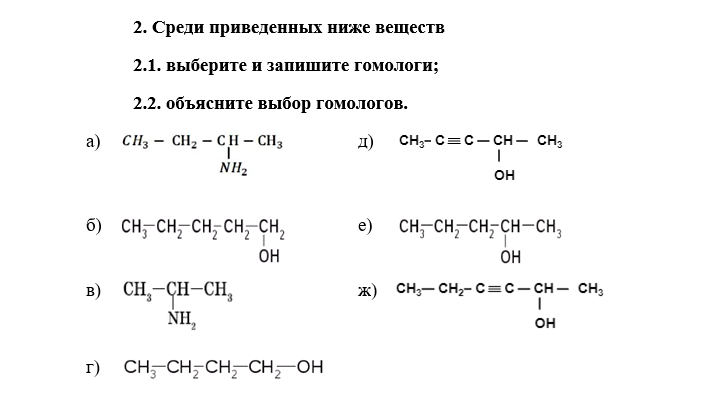 Они показаны здесь с примерами их использования. Будьте осторожны, чтобы не перепутать фенильную группу (произносится как фенил ) с составным фенолом (произносится как фенол ). Общее и полезное общее обозначение, которое дополняет использование R- для алкильной группы, представляет собой Ar- для арильной группы (любое ароматическое кольцо).
Они показаны здесь с примерами их использования. Будьте осторожны, чтобы не перепутать фенильную группу (произносится как фенил ) с составным фенолом (произносится как фенол ). Общее и полезное общее обозначение, которое дополняет использование R- для алкильной группы, представляет собой Ar- для арильной группы (любое ароматическое кольцо).
Когда в бензольном кольце присутствует более одного заместителя, относительное расположение заместителей должно быть обозначено нумерацией атомов углерода в кольце или каким-либо другим обозначением. В случае дизамещенных бензолов префиксы орто, мета и пара обычно используются для обозначения 1,2-, 1,3- или 1,4-соотношений соответственно. В следующих примерах первый ряд соединений показывает это использование красным цветом. Некоторые дизамещенные толуолы имеют имена в единственном числе (например, ксилол, крезол и толуидин), а их изомеры обычно обозначаются цифрой 9.0271 o rtho, m eta или p ara префикс.

 Если вам нужны только правила, нажмите здесь===> ПРАВИЛА.
Если вам нужны только правила, нажмите здесь===> ПРАВИЛА.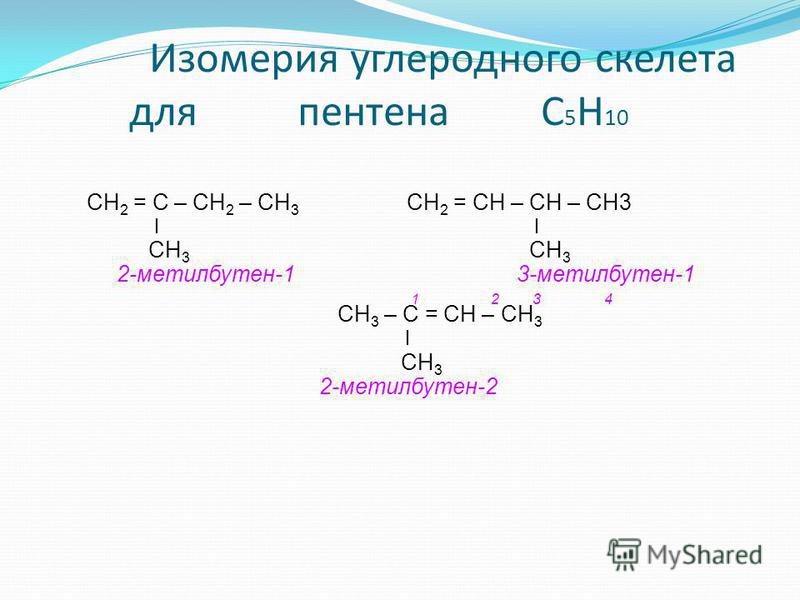 9005 2 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000
9005 2 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000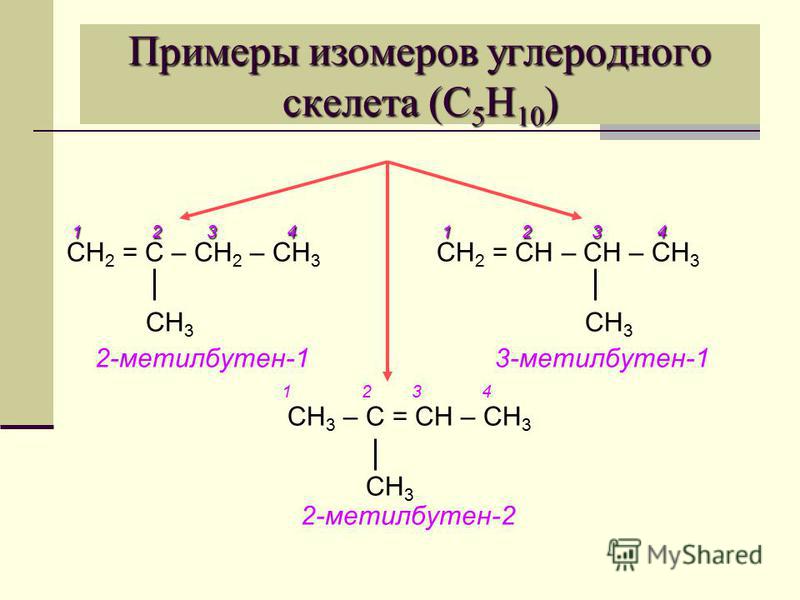 от 0036 4 до C 2 H 6 (и так далее) следующий член отличается на 1 углерод и 2 водорода?
от 0036 4 до C 2 H 6 (и так далее) следующий член отличается на 1 углерод и 2 водорода? Остальным боковым цепям присваивается окончание -yl . Они ставятся перед самой длинной цепочкой при наименовании.
Остальным боковым цепям присваивается окончание -yl . Они ставятся перед самой длинной цепочкой при наименовании.  400234.400234.400244.400234.40024
400234.400234.400244.400234.40024 Найдите и назовите самую длинную непрерывную углеродную цепь.
Найдите и назовите самую длинную непрерывную углеродную цепь. 

 Самая длинная цепь, выбранная для корневого названия, должна включать оба атома углерода тройной связи .
Самая длинная цепь, выбранная для корневого названия, должна включать оба атома углерода тройной связи . 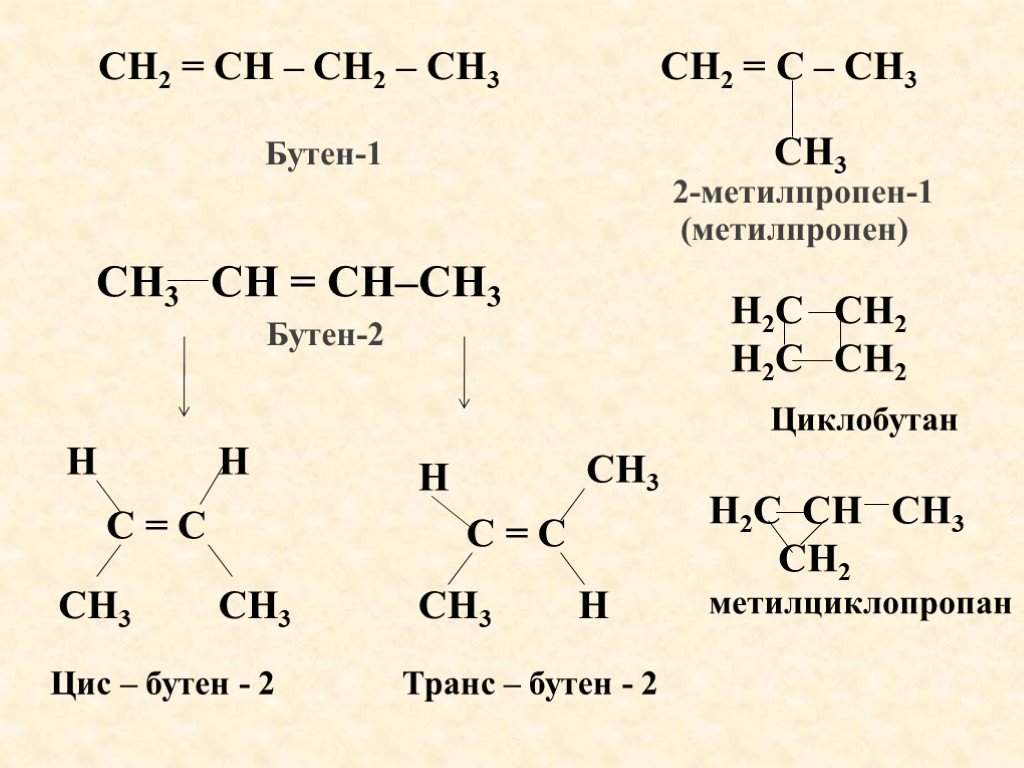 Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
Leave A Comment