Человек как источник электрического тока
Введение
Первый, кто открыл иную возможность получения электричества, исключая случаи электризации различных тел трением, был итальянский ученый Луижди Гальвани (1737–1798) (рис. 1). Он был по специальности биолог, но работал в лаборатории, где проводились опыты с электричеством.
Гальвани наблюдал явление, которое заключалось в том, что если к нерву лапки мёртвой лягушки прикоснуться электродом от раскрученной электростатической машины, то лапка дергалась. Происходило сокращение мышц. Но, однажды ученый коснулся ноги лягушки скальпелем из стали и заметил такое же подергивание. Самое удивительное заключалось в том, что электростатическая машина не контактировала со скальпелем. Гальвани провел много опытов для того, чтобы понять причину возникновения тока.
Проведя свои эксперименты, ученый посчитал, что электричество возникает в теле лягушки.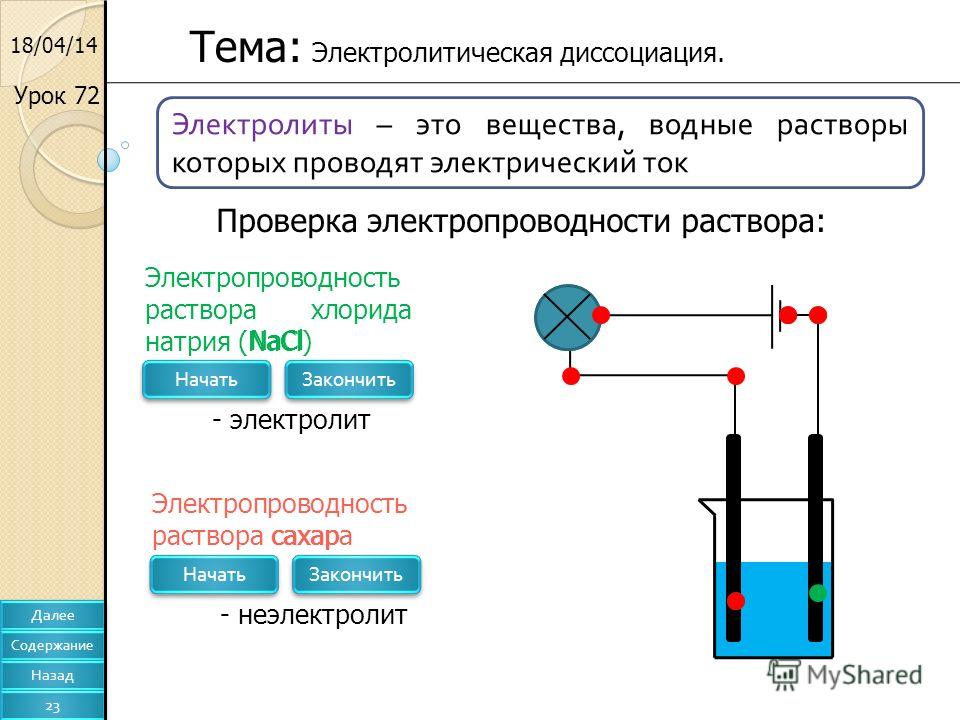
Это был неправильный вывод. Другие ученые опытным путем доказали, что Гальвани ошибся. Но ученый настаивал на своей точке зрения. Он умер в 1798 году, так и не приняв другой точки зрения, основанной на результатах исследований.
Рис. 1
Другой ученый Алессандро Вольта один из тех, кто заложил основы учения об электричестве, тоже провел многочисленные опыты и пришел выводу, который не совпадал с выводом Гальвани. Он посчитал, что электричество возникает при контакте двух разных металлов. Металлы прикасались к веществу мышц и становились источником тока. Такой же эффект возникает при контакте пары металлов с влажным телом. «Вольта подчеркивал, что разнородные металлы здесь не простые проводники или передатчики тока, а «настоящие двигатели электричества»» [2].
Но этот ученый, утверждая, что нет никакого «животного электричества», ошибался. А. Вольта писал, что если составить проводящую цепь так, чтобы между различными металлами, например серебром и цинком, был введен соприкасающийся с ними жидкий проводник, то вследствие этого возникает постоянный электрический ток того или иного направления. Опытным путем получен ряд напряжений элементов (табл. 1).
А. Вольта писал, что если составить проводящую цепь так, чтобы между различными металлами, например серебром и цинком, был введен соприкасающийся с ними жидкий проводник, то вследствие этого возникает постоянный электрический ток того или иного направления. Опытным путем получен ряд напряжений элементов (табл. 1).
Таблица 1
Ряд напряжений элементов
|
Цинк (Zn) |
Свинец (Pb) |
Платина (Pt) |
|
Железо (Fe) |
Медь (Cu) |
Углерод (C) |
|
Олово (Sn) |
Серебро (Ag) |
|
Можно продемонстрировать, что дистиллированная вода, глицерин, спирт и растворы спирта, глицерина и сахара в дистиллированной воде плохо проводят электрический ток.
Сухой гальванический элемент представляет собой цилиндрический цинковый контейнер, в котором находится содержимое элемента. Корпус одновременно является отрицательным электродом. Положительный электрод часто делают из угольного стержня.
Цинковый цилиндр выложен изнутри тонким пористым материалом, похожим на промокательную бумагу, который покрыт толстым слоем пасты; в состав последней входят алебастр, вода и хлористый аммоний NH4Cl — соль, известная под названием нашатыря. В центре цинкового контейнера укрепляется угольная палочка, служащая в качестве положительного электрода. Остальное пространство контейнера заполняется смесью гранулированного угольного порошка и двуокиси марганца, насыщенной раствором нашатыря. Сверху элемент запечатывается воском, чтобы из него не выпало содержимое.
В центре цинкового контейнера укрепляется угольная палочка, служащая в качестве положительного электрода. Остальное пространство контейнера заполняется смесью гранулированного угольного порошка и двуокиси марганца, насыщенной раствором нашатыря. Сверху элемент запечатывается воском, чтобы из него не выпало содержимое.
Снаружи цилиндр обычно обертывается толстым слоем бумаги. По мере работы элемента цинк постепенно растворяется, пока, наконец, на стенках цилиндра не появляются дырки. Поэтому, выражение «сухой гальванический элемент», условно. Нужно вовремя удалять отработанные элементы из современных приборов, иначе из корпуса батареи может вытечь небольшое количество электролита и испортить прибор.
Основная часть
Большое количество процессов в живых организмах обусловлено прохождением электрических сигналов от одного органа к другому. Если через тело человека проходит электрический ток, мышцы сокращаются, это может нанести вред здоровью.
Если взять два разных металла (медь + цинк, медь + алюминий и др.) и поместить электроды из этих металлов в раствор соли или кислоты, то на концах появится электродвижущая сила. Если подключить провода к измерительному прибору, например микроамперметру, то можно измерить силу тока в цепи. В данном случае электроды и раствор будут служить гальваническим элементом (рис. 2).
Как гальванический ток элемент создает ток. Изучая полярность пластин гальванического элемента, мы установили, что цинк в кислоте приобретает отрицательный заряд, указывающий на избыток электронов, а медь — положительный заряд, свидетельствующий о недостатке электронов. Но как это может быть, если оба металла находится в одной и той же жидкости?
Если исследовать отработавший гальванический элемент, то можно убедиться, что медная пластинка лучше сохранилась, нежели цинковая. Это говорит о том, что цинковая пластинка растворяется значительно быстрее медной.
Как мы уже выяснили, молекула серной кислоты H2SO4 в воде распадается на два иона H+ и один ион SO42-:
Положительные ионы цинка (Zn2+), переходя в раствор, отталкивают положительные ионы водорода и оттесняют их к медной пластине. Здесь каждый водородный ион (H
Рис. 2. Батарея гальванических элементов
При замыкании внешней электрической цепи, получаемой соединением электродов, электроны от цинкового электрода переходят к медному электроду. Это приводит к нарушению первоначальных равновесий, в результате чего будут протекать процессы окисления на цинковом и процессы восстановления на медном электродах, обеспечивая поддержание их потенциалов. Такое самопроизвольное протекание окислительно-восстановительного процесса и обусловливает работу гальванического элемента.
Была выдвинута гипотеза: если человек является источником электрического тока, тогда при прикосновении руками к пластинам из разного металла, должна появиться электродвижущая сила. И если к пластинам подключить чувствительные электроизмерительные приборы, то можно измерить силу тока.
Цель работы: обнаружить электричество, источником которого может быть человек и можно ли его использовать для нужд самого человека.
Задачи: изучить литературу по теме;
Изготовить прибор для обнаружения слабого тока;
Составить план экспериментов;
Определить правила измерений;
Провести измерения;
Проанализировать полученные результаты;
Найти закономерности и попытаться их объяснить;
Разобраться, как человеческий организм может вырабатывать электричество, быть источником энергии и, каким образом это можно выгодно использовать.
Объект исследования: электричество, источником которого является человек.
Предмет исследования: человек как источник электрического тока. Зависимость силы излучаемого тока от различных фактов.
Актуальность работы. В современном мире человечество нуждается в электроэнергии каждый день. Она нужна как большим предприятиям, так и человеку в быту. На ее выработку тратится много средств. И поэтому счета за электроэнергию растут каждый год. Те предприятия, которые могут вырабатывать дешёвую электроэнергию, наносят большой ущерб экологии, который потом отражается на окружающей среде и нашем здоровье. А те предприятия, которые вырабатывают более экологически чистую электроэнергию, как, к примеру, гидроэлектростанции, требуют больших затрат. В настоящее время очень остро поднимается проблема нехватки энергетических ресурсов. Ведь человеческая цивилизация очень динамична. Но запасы нефти, угля, газа не бесконечны. Чем больше мы используем эти виды энергетического сырья, тем меньше их остается, и тем дороже с каждым днем они нам обходятся. Существует опасность, что основные виды традиционного топлива будут исчерпаны. Неизбежность топливного дефицита в настоящее время ни у кого не вызывает сомнения. Сегодня многие учёные занимаются проблемой нахождения новых, альтернативных, экологически чистых источников энергии [5, 6].
Она нужна как большим предприятиям, так и человеку в быту. На ее выработку тратится много средств. И поэтому счета за электроэнергию растут каждый год. Те предприятия, которые могут вырабатывать дешёвую электроэнергию, наносят большой ущерб экологии, который потом отражается на окружающей среде и нашем здоровье. А те предприятия, которые вырабатывают более экологически чистую электроэнергию, как, к примеру, гидроэлектростанции, требуют больших затрат. В настоящее время очень остро поднимается проблема нехватки энергетических ресурсов. Ведь человеческая цивилизация очень динамична. Но запасы нефти, угля, газа не бесконечны. Чем больше мы используем эти виды энергетического сырья, тем меньше их остается, и тем дороже с каждым днем они нам обходятся. Существует опасность, что основные виды традиционного топлива будут исчерпаны. Неизбежность топливного дефицита в настоящее время ни у кого не вызывает сомнения. Сегодня многие учёные занимаются проблемой нахождения новых, альтернативных, экологически чистых источников энергии [5, 6].
Поэтому меня заинтересовала данная тема: познакомиться с альтернативными источниками энергии, в частности, человеком как источником электрического тока. Какое количество электричества вырабатывает организм человека? И каковы возможности его использования с пользой для себя.
Методы исследования: эксперимент, анализ полученных результатов с учетом разных фактов, обобщение и поиск закономерности в обнаруженном явлении.
Измерения силы тока, источником которого являлся человек
Устройство прибора для измерения силы тока
На деревянную подставку Т-образной формы прикреплены медная и алюминиевая пластины. Они присоединены к микроамперметру. Предел измерения прибора 150 мкА. Цена деления 2 мкА.
Второй вариант прибора. На деревянной подставке Т-образной формы прикреплены медная и алюминиевая круглые пластины диаметром 50 мм. Они присоединены к микроамперметру. Предел прибора 100 мкА. Цена деления 2 мкА. Данный прибор обеспечит одинаковую площадь соприкосновения ладоней с металлическими пластинами. В изготовлении приборов приняли участие учащиеся 8 класса.
Они присоединены к микроамперметру. Предел прибора 100 мкА. Цена деления 2 мкА. Данный прибор обеспечит одинаковую площадь соприкосновения ладоней с металлическими пластинами. В изготовлении приборов приняли участие учащиеся 8 класса.
Правила измерения
Приложить ладони к пластинам.
Зафиксировать результат.
Рис. 3.
Проводились измерения с группой учащихся в возрасте 9 лет. Измерения проводились при прикосновении к пластинам только пальцами (табл. 2).
Таблица 2
|
Количество пальцев |
1 пара |
2 пары |
3 пары |
4 пары |
5 пар |
|
Пол и возраст |
Значение силы тока в мкА |
||||
|
М 9 лет |
6 |
12 |
16 |
18 |
20 |
|
М 9 лет |
6 |
18 |
22 |
26 |
30 |
|
М 9 лет |
10 |
14 |
20 |
24 |
26 |
|
М 9 лет |
4 |
10 |
16 |
20 |
22 |
|
М 9 лет |
4 |
8 |
12 |
14 |
18 |
|
Д 9 лет |
2 |
6 |
10 |
14 |
16 |
|
Д 9 лет |
4 |
6 |
8 |
10 |
18 |
|
М 9 лет |
8 |
16 |
22 |
28 |
36 |
|
М 9 лет |
6 |
10 |
14 |
14 |
16 |
|
Д 9 лет |
6 |
12 |
16 |
20 |
24 |
|
Среднее значение силы тока в мкА |
5,6 |
11,2 |
15,6 |
18,8 |
22,6 |
Предварительный вывод: значение силы тока зависит от площади поверхности соприкосновения кожного покрова и металлических пластин.
Рис. 4
Результаты: были проведены многочисленные измерения силы тока, источником которого являлся человек. Измерения проводились с разными группами людей. Группы различались по возрасту и полу. Измерения проводились с одной группой в измененных условиях (организм в спокойном состоянии и после физической нагрузки). Данные представлены в виде таблиц 3, 4, 5).
Таблица 3
Результаты эксперимента, сила тока мкА
|
ФИО |
Возраст, класс |
14.11.17 |
15. |
24.11.17 |
26.11.17 |
27.11.17 |
29.01.18 |
|
1.Рунцова Милана |
14 лет 8а |
110 |
138 |
80 |
150 |
140 |
110 |
|
2. |
14 лет 8а |
125 |
130 |
|
50 |
100 |
80 |
|
3.Тимошина Анастасия |
10 лет |
|
|
|
150 |
|
|
|
4. |
10 лет |
|
|
|
90 |
|
|
|
5.Гурина Анастасия |
10 лет |
|
|
|
150 |
|
|
|
6. |
10 лет |
|
|
|
100 |
|
|
|
7. Касиян Анастасия |
10 лет |
|
|
|
120 |
|
|
|
8. |
10 лет |
|
|
|
150 |
|
|
Измерения проводились с группой мальчиков в возрасте 11 лет (18 человек). Первое измерение кожные покровы в обычном состоянии. Второе измерение после ополаскивания водой. Вычислялось среднее значение силы тока. В первом случае среднее значение 94,8 мкА. Во втором случае 115,5 мкА. Предварительный вывод: сила тока зависит от степени влажности кожного покрова.
Измерения проводились с группами мальчиков (13 лет) и девочек (13 лет). Среднее значение у мальчиков 82,7 мкА. Среднее значение у девочек 88,6 мкА. Предварительный вывод: у мальчиков среднее значение ненамного меньше, чем у девочек.
Измерения проводились с группой мальчиков в возрасте 13 лет (8 человек). Первая серия измерение в обычном состоянии. Вторая серия измерений после физической нагрузки. Среднее значение в обычном состоянии 82,7 мкА. Среднее значение после физической нагрузки 82 мкА. Предварительный вывод: часть испытуемых показала большее значение, часть меньшее. Это зависит от особенностей организма. Необходимы дополнительные измерения, чтобы найти закономерность.
Таблица 4
Результаты эксперимента в 3 б классе, сила тока мкА
|
ФИО |
Возраст |
Класс |
3. |
Измененные условия |
|
1. Реунова Яна |
9 лет |
3 б |
44 |
Физическая нагрузка |
|
2. Рукосуев Иван |
9 лет |
3 б |
8 |
Физическая нагрузка |
|
3. |
9 лет |
3 б |
32 |
Физическая нагрузка |
|
4. Малыгина София |
9 лет |
3 б |
34 |
Физическая нагрузка |
|
5. Борисенко Вадим |
9 лет |
3 б |
38 |
Физическая нагрузка |
|
6. |
9 лет |
3 б |
68 |
Физическая нагрузка |
|
7. Скулин Костя |
9 лет |
3 б |
30 |
Физическая нагрузка |
|
8. Подоляк Анна |
9 лет |
3 б |
58 |
Физическая нагрузка |
|
9. |
9 лет |
3 б |
42 |
Физическая нагрузка |
|
10. Пронин Максим |
9 лет |
3 б |
52 |
Физическая нагрузка |
|
11. Кудрявцева Алина |
9 лет |
3 б |
36 |
Физическая нагрузка |
|
12. |
9 лет |
3 б |
100+ |
Физическая нагрузка |
|
13. Шевцова Софья |
9 лет |
3 б |
22 |
Физическая нагрузка |
|
14. Ашлапов Никита |
9 лет |
3 б |
40 |
Физическая нагрузка |
|
15. |
9 лет |
3 б |
22 |
Физическая нагрузка |
|
16. Андриенко Вика |
9 лет |
3 б |
22 |
Физическая нагрузка |
|
17. Рунцов Максим |
9 лет |
3 б |
46 |
Физическая нагрузка |
|
18. |
9 лет |
3 б |
94 |
Физическая нагрузка |
|
19. Кочугов Данил |
9 лет |
3 б |
64 |
Физическая нагрузка |
Таблица 5
Измерения значения силы тока с учащимися в возрасте 14 лет в течение 4 дней
|
Дни недели Пол и возраст |
13. |
14.11.17 |
15.11.17 |
16.11.17 |
|
Значение силы тока в мкА |
||||
|
Мальчик 14 лет |
74 |
50 |
50 |
|
|
Девочка 14 лет |
115 |
85 |
82 |
|
|
Девочка 14 лет |
110 |
125 |
130 |
|
|
Мальчик 14 лет |
|
54 |
18 |
38 |
|
Девочка 14лет |
120 |
130 |
88 |
|
|
Мальчик 14 лет |
55 |
55 |
|
74 |
|
Мальчик 14 лет |
150 |
147 |
100 |
150 |
Таблица 6
Измерения с одним человеком возраста 15 лет (представлены фрагменты измерений, которые проводились в течение месяца, несколько раз в день)
|
Число |
Время |
Результат измерения мкА |
Самочувствие |
Количество уроков |
|
17. |
7:48 |
11 |
Нормальное, легкое головокружение |
6 |
|
13:10 |
17 |
|||
|
18.12.18 |
8:25 |
8 |
Плохое, сильное головокружение |
6 |
|
13:06 |
10 |
|||
|
19. |
7:30 |
15 |
Нормальное, легкое головокружение |
6 |
|
8:49 |
15 |
|||
|
11:30 |
21 |
|||
|
12:25 |
18 |
|||
|
13:37 |
13 |
|||
|
20. |
12:16 |
8 |
Плохое, сильное головокружение, головная боль |
Пробник |
|
21.12.18 |
7:42 |
23 |
Хорошее |
6 |
|
12:48 |
25 |
|||
|
22. |
7:31 |
20 |
Хорошее |
4 |
|
11:09 |
15 |
|||
|
24.12.18 |
8:03 |
15 |
Хорошее |
5 |
|
8:46 |
17 |
|||
|
9:51 |
23 |
|||
|
10:34 |
24 |
|||
|
25. |
7:49 |
18 |
Тошнота |
6 |
|
8:53 |
14 |
|||
|
9:30 |
18 |
|||
|
10:40 |
20 |
|||
|
11:32 |
19 |
|||
|
9:47 |
16 |
|||
|
10:49 |
14 |
|||
|
11:30 |
17 |
|||
|
02. |
9:00 |
27 |
Хорошее |
Каникулы |
|
11:00 |
26 |
|||
|
13:00 |
27 |
|||
|
17:00 |
25 |
|||
|
20:00 |
23 |
|||
|
11:00 |
27 |
|||
|
13:00 |
25 |
|||
|
17:00 |
24 |
|||
|
20:00 |
26 |
|||
|
05. |
9:00 |
19 |
Хорошее |
Каникулы |
|
11:00 |
21 |
|||
|
11:00 |
9 |
|||
|
13:00 |
9 |
|||
|
17:00 |
12 |
|||
|
20:00 |
11 |
|||
|
18. |
9:00 |
16 |
Плохое, температура 38, сильный кашель |
Больничный |
|
11:00 |
15 |
|||
|
13:00 |
11 |
|||
|
17:00 |
11 |
|||
|
20:00 |
13 |
|||
|
11:00 |
18 |
|||
|
13:00 |
16 |
|||
|
17:00 |
19 |
|||
|
20:00 |
20 |
|||
|
22. |
7:37 |
23 |
Плохое, сильный кашель |
6 |
|
17:30 |
21 |
|||
|
18:30 |
19 |
|||
|
19:30 |
23 |
|||
|
20:30 |
24 |
Вывод: результаты измерения зависят от самочувствия человека, от физической нагрузки и других внешних факторов. Значение силы тока у одного и того же человека в разные дни меняется. Во время болезни показатели значений силы тока понижаются.
Значение силы тока у одного и того же человека в разные дни меняется. Во время болезни показатели значений силы тока понижаются.
Ещё интересный эксперимент: две девочки соприкасались двумя руками друг с другом, а свободные руки располагались: одна — на медной пластинке, другая — на алюминиевой. Миллиамперметр показывал ток. Аналогичные опыты можно продолжить в разных вариантах.
Результаты работы
Проведены многочисленные эксперименты по измерению силы тока, источником которого являлся человек. Измерения проводились с разными группами людей и в разных условиях. Группы различались по возрасту и полу. Измерения проводились с одной группой в измененных условиях (организм в спокойном состоянии и после физической нагрузки). Проведены измерения силы тока у одного человека ежедневно в течение длительного времени, во время болезни в том числе. Данные представлены в виде таблиц.
Определены некоторые закономерности в средних величинах силы тока. Поиск закономерностей можно продолжить, увеличив число внешних факторов, действующих на людей.
Поиск закономерностей можно продолжить, увеличив число внешних факторов, действующих на людей.
Определены альтернативные источники энергии, в том числе человек и каким образом внутри человеческий ток можно использовать для нужд самого человека.
Изготовлен второй прибор для опытов по измерению силы тока, источником которого являлся человек. На горизонтальной поверхности расположены две пластинки медная и алюминиевая в виде кружков диаметром 50 миллиметров. Площадь каждой пластины 19,6 см2. Второй прибор позволит провести измерения с разными группами людей и при этом площадь соприкосновения ладоней и металла будет одинаковой.
Высказаны предложения альтернативного использования электрического тока, источником которого является человек.
Вывод
Человек является источником электрического тока, силу которого можно измерить. Результат измерения силы тока зависит от различных факторов окружающей среды, таких как физическая нагрузка, самочувствие, возраст, состояние кожи и др.
Результат измерения силы тока зависит от различных факторов окружающей среды, таких как физическая нагрузка, самочувствие, возраст, состояние кожи и др.
Каждый человек — это настоящая электростанция, и ее вполне можно использовать в быту.
Дело за малым — научиться передавать энергию, которую мы столь бесполезно растрачиваем, «куда надо». У исследователей уже есть предложения на этот счет.
Ученый Мартын Нунупаров предлагает использовать целый ряд изобретений, способных генерировать ток практически из любого человеческого действия, будь то даже вдоха, энергия которого равна 1Вт. По его словам, даже энергию ходьбы человека и взмаха руками во время этого процесса достаточно, чтобы питать лампу 60Вт.
Количество электричества, которое генерирует человек, может хватить для зарядки мобильного телефона или другого устройства. Вопрос в том, как без вреда для человека можно брать внутри человеческий ток и использовать его для нужд самого человека? Как научиться перераспределять энергетические потоки внутри организма человека при разных его состояниях. Например, увеличить энергообеспечение больного органа для борьбы с болезнью. Многие умы сегодня решают эти задачи. Но это уже второй этап исследования…
Например, увеличить энергообеспечение больного органа для борьбы с болезнью. Многие умы сегодня решают эти задачи. Но это уже второй этап исследования…
Литература:
1. Л. Эллиот, У. Уилкокс Физика / Л. Эллиот, У. Уилкокс. — М.: Наука. — 1975. — с 448–459.
2. Физика-юным / М. Н. Алексеева — М.: «Просвещение» — 1980. — с 84–85.
3. Химико-экологический словарь-справочник / Л. Н. Блинов — СПб.: «Лань» — 2002.- с 45.
4. https://apps.nlm.nih.gov/exhibition/digitalgallery/frankenstein/assets/images/dg_OB10945_b012612_Lg.jpg
5. https://aing.ru/Человек
6. https://www.factroom.ru/facts/37707
7. https://russian7.ru/post/skolko-ehlektrichestva-vyrabatyvaet/
https://russian7.ru/post/skolko-ehlektrichestva-vyrabatyvaet/
8. http://paranormal-news.ru/news/ehlektricheskie_ljudi/2014–04–26–8928
9. https://recyclemag.ru/article/10-neobychnyh-alternativnyh-istochnikov-energii
2. Какие из перечисленных ниже жидкостей проводят электрический ток: а 100-процентная серная кислота; б водный раствор азотной кислоты; в раствор азота в воде? Ответ б 3
Ахметов М. А. Подготовка к ЕГЭ по химии 2008
ГОТОВИМСЯ К ЕГЭ по ХИМИИ http://maratakm.narod.ru
АХМЕТОВ М. А. УРОК 28. Ответы
Диссоциация электролитов в водных растворах. Слабые и сильные электролиты. Реакции ионного обмена.
1. Какие из перечисленных ниже жидкостей проводят электрический ток: а) спирт; б) водный раствор поваренной соли; в) дистиллированная вода; г) водный раствор сахара?
Ответ б)
2. Какие из
перечисленных ниже жидкостей проводят
электрический ток: а) 100-процентная
серная кислота; б) водный раствор азотной
кислоты; в) раствор азота в воде?
Какие из
перечисленных ниже жидкостей проводят
электрический ток: а) 100-процентная
серная кислота; б) водный раствор азотной
кислоты; в) раствор азота в воде?
Ответ б)
3. Безводный жидкий фтороводород не проводит тока, а водный раствор его ток проводит. Чем это можно объяснить?
Ответ HFH++F—
4. Почему соляную кислоту приходится хранить не в стальных, а в стеклянных или керамических сосудах, между тем как для безводной серной кислоты пригодны железные контейнеры?
Безводная серная кислота не реагирует с железом
5. Раствор хлороводорода в бензоле не проводит электрического тока и не действует на цинк. Чем это можно объяснить?
Хлороводород не диссоциирует в соляной кислоте
6. Какие ионы содержатся в водных растворах: а) нитрата калия; б) хлорида кальция; в) сульфата натрия?
а) K++ NO3— б) Ca2++ Cl— в) Na++ SO42-
7. Как
называются и чем отличаются между собой
частицы, изображенные символами: а)
Сl-,
С1, С12; б)
S03,
S032-;
в) Na,
Na+;
г) S,
S2-?
Как
называются и чем отличаются между собой
частицы, изображенные символами: а)
Сl-,
С1, С12; б)
S03,
S032-;
в) Na,
Na+;
г) S,
S2-?
Отличаются числом электронов. Каждый отрицательный заряд означает наличие дополнительного электрона.
а) К примеру, у хлора их 17, а у Cl— — 18, у молекулы хлора – 34 электрона
б) У S03 – 16+8*3=40 электронов, а у S032- — 42.
в) У Na – 11 электронов, а Na+ — 10
г) у S – 16 электронов, а у S2- — 18 электронов.
8. Можно ли приготовить водный раствор, который в качестве растворенного вещества содержал бы только: a) S03; б) S042-; в) Na; г) Na+; д) С1—; е) С12; ж) Са2+? Ответ поясните.
а) S03 – нет S03 реагирует с водой. S03+Н2O=H2SO4
S03+Н2O=H2SO4
б) S042- — нет, нужны еще и катионы
в) нет – нужны еще и анионы
г) да – хлор реагирует с водой, но эта реакция обратима Сl2+H2OHCl+HClO
д) нет, нужны еще и катионы
9. Можно ли приготовить раствор, содержащий в растворенном виде только: а) серу; б) ион S2-; в) фосфор; г) ион Р3-; д) азот; е) ион Na+? Дайте обоснованный ответ.
10. Какие ионы содержатся в водных растворах: а) бромида калия; б) едкого кали; в) азотной кислоты; г) фторида натрия?
а) KBr=K++Br—
б) KOH=K++OH—
в) HNO3=H++NO3—
г) NaF=Na++F—
11. Какие
ионы содержатся в водных
растворах: а) нитрата алюминия; б) сульфата
алюминия; в) иодоводорода?
Какие
ионы содержатся в водных
растворах: а) нитрата алюминия; б) сульфата
алюминия; в) иодоводорода?
а) NaNO3=Na++NO3—
б) Al2(SO4)3=2Al3++SO42-
в) HI=H++I—
12. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) сульфата калия; б) хлорида кальция; в) бромоводорода.
а) К2SO4=K++SO42-
б) CaCl2=Ca2++2Cl—
в) HBr=H++Br—
13. Напишите
и прочитайте уравнения электролитической
диссоциации в водных растворах следующих
веществ: а) нитрата цинка; б) хлорида
бария; в) бромида калия.
14. Изобразите при помощи уравнений электролитическую диссоциацию веществ, формулы которых Ва (ОН)2, К3Р04, КС103, КС1, NaHS04. Прочитайте написанные уравнения.
15. Составьте уравнения электролитической диссоциации: а) сульфата меди; б) хлорида кальция; в) гидроксида натрия. Прочитайте уравнения.
16. Составьте уравнения электролитической диссоциации:
а) сульфата серебра; б) гидроксида кальция; в) соляной кислоты. Прочитайте уравнения.
17. Напишите уравнения электролитической диссоциации веществ, формулы которых: a) FeCl3; б) FeCl2; в) растворимого минерала карналлита KCl-MgCl2. Прочитайте уравнения.
в) KCl—MgCl2=K++Mg2++3Cl—
18.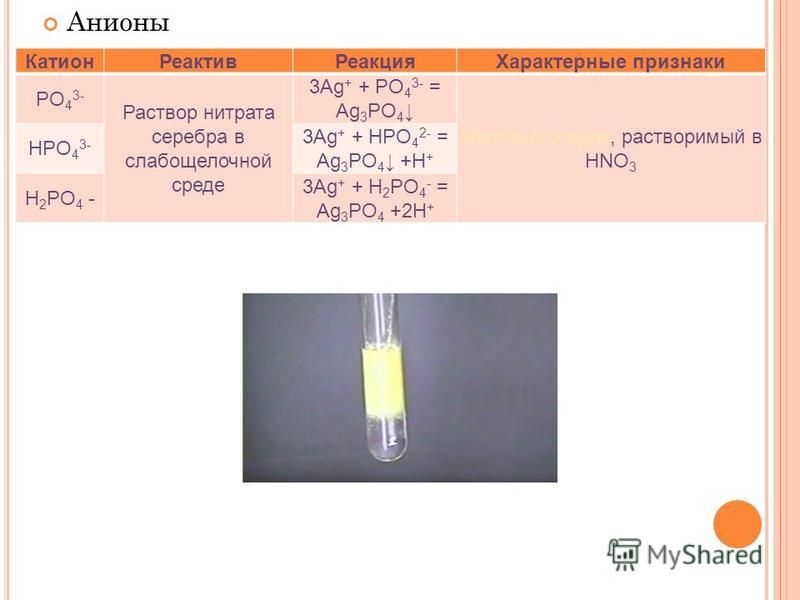 Изобразите
уравнениями последовательные ступени
электролитической диссоциации:
а) мышьяковой кислоты H3As04;
б) сероводорода в водном растворе.
Изобразите
уравнениями последовательные ступени
электролитической диссоциации:
а) мышьяковой кислоты H3As04;
б) сероводорода в водном растворе.
а)
H3SO4=H++H2AsO4—
H2AsO4—=H++HAsO42-
HAsO42-=H++AsO43-
19. Изобразите уравнениями последовательные ступени диссоциации угольной кислоты.
20. Изобразите уравнениями последовательные ступени диссоциации сернистой кислоты H2S03.
21. Изобразите уравнениями
последовательные стадии диссоциации
селеновой кислоты H2Se04.
22. Как практически осуществить процессы, выражающиеся следующими уравнениями:
а) НС1Н+ + С1
б) Cu + Cl2CuCl2
в) Си2+ + 20Н— Си (ОН)2
в) СuSO4+2NaOH=Cu(OH)2+Na2SO4
23. Как практически осуществить реакции, схематически изображаемые уравнениями:
1) H2S042H+ + SO42- — растворить в воде
2) H+OH—H20 провести реакцию кислоты со щелочью
3) Mg (OH)2 Mg2+ + 20Н- — реакция практически не осуществима
24. Как практически осуществить реакцию, представленную уравнением:
2Na + С12 = 2NaCl
опустить натрий в стакан с хлором
25. Опишите подробно опыты, иллюстрирующие следующие превращения:
1) Mg + Pb2+Mg2+ + Pb магний опустили в раствор нитрата свинца
2) Си + 2Ag+ Cu2+ + 2Ag медь опустили в нитрата серебра
3) Hg + 2Ag+Hg2+ + 2Ag ртуть опустили в раствор нитрата серебра
26. На сколько ионов
распадается при полной диссоциации
молекула каждого из электролитов,
формулы которых: a)
H2S04;
б) Sr
(OH)2;
в) Н3Р04?
На сколько ионов
распадается при полной диссоциации
молекула каждого из электролитов,
формулы которых: a)
H2S04;
б) Sr
(OH)2;
в) Н3Р04?
а) 3 б) 3 в) 4
27. Как практически осуществить реакцию, сначала представленную уравнением 1, а затем уравнением 2:
1) Са(ОН)2Са2+ + 20Н— растворить вещество в воде
2) Са2+ + 20Н— Са(ОН)2 к раствору хлорида кальция добавить гидроксид натрия
28. Напишите формулы веществ, которые при растворении в воде диссоциируют на ионы: а) Ва2+ и ОН2- ; б) Са2+ и N03—.
Ba(OH)2 Ca(NO3)2
29. Напишите формулы веществ, диссоциирующих в воде на ионы: а) А13+ и S042-; б) Mg2+ и Мn042-.
30. Напишите
формулы веществ, диссоциирующих в
воде на ионы: а) К+ и Сг042-;
б) Fe2+ и N03—;
в) Fe3+
и N03—.
Напишите
формулы веществ, диссоциирующих в
воде на ионы: а) К+ и Сг042-;
б) Fe2+ и N03—;
в) Fe3+
и N03—.
31. В воде одного источника были обнаружены следующие ионы: Na+, K+, Fe2+, Ca2+, Mg2+2Cl—, Br— , S042- Растворением каких солей в дистиллированной воде можно получить раствор, содержащий те же ионы? Имеет ли задача только одно решение? Ответ поясните.
KCl, MgCl2 Na2SO4, FeBr2,CaCl2 или KBr+MgSO4+NaCl+FeCl2+CaBr2
32. Какие из перечисленных ниже веществ при электролитической диссоциации образуют ионы хлора: а) хлорид калия;
б) бертолетова соль КС103; в) перхлорат калия КС104; г) нашатырь NH4C1? При помощи какого раствора можно доказать присутствие ионов хлора в растворах указанных вами солей?
хлорид калия и хлорид аммония. Можно доказать добавлением раствора
нитрата серебра
Можно доказать добавлением раствора
нитрата серебра
33. Раствор хлорида калия бесцветен, а раствор марганцовокислого калия КМп04 окрашен в фиолетово-красный цвет. Каким ионом вызвана окраска раствора соли КМп04?
MnO4 —
34. К какому классу относится вещество, если его водный раствор хорошо проводит электрический ток и не окрашивает фиолетового лакмуса ни в красный, ни в синий цвет?
это соль
35. Хлорид меди СuС12 ядовит. С каким ионом связана токсичность этой соли?
Cu2+
36. Напишите формулы: а) четырех бесцветных катионов; б) четырех бесцветных анионов; .в) известных вам окрашенных катионов.
а) K+ Na+ Mg2+ Li+
б) Cl— SO42- NO3— OH—
в) Сu2+ Ni2+
37. Почему
раствор иодида калия, хотя и содержит
иод, не окрашивает крахмал в синий цвет?
Почему
раствор иодида калия, хотя и содержит
иод, не окрашивает крахмал в синий цвет?
I2 и KI – разные вещества
38. Каковы различия в свойствах между атомом водорода и ионом водорода?
ион водорода обладает окислительными свойствами, а молекула водорода чаще всего восстановитель. катион водорода обычно существует в водных растворах, а водород бесцветный газ
39. Придают ли окраску раствору: а) ионы кальция; б) ионы меди; в) анионы серной кислоты; г) анионы азотной кислоты; д) ионы серебра?
окрашены только к ионы меди
40. Придают ли окраску раствору: а) ионы иода; б) ионы брома; в) ионы калия; г) ионы С032~?
нет
41. Растворы некоторых солей соляной кислоты имеют окраску. Катионы или анионы придают цвет этим солям? Приведите примеры.
CuCl2 – синезеленый цвет
42. Растворы
некоторых солей натрия имеют окраску.
Чем она обусловлена — катионами или
анионами? Из чего вы это заключаете?
Растворы
некоторых солей натрия имеют окраску.
Чем она обусловлена — катионами или
анионами? Из чего вы это заключаете?
анионами, так как катион не окрашен
43. Растворы хлорида бария и мышьяковой кислоты H3As04 ядовиты. Какими ионами обусловлена ядовитость каждого из этих соединений?
As042-
44. Выпишите названия известных вам минеральных удобрений и формулы анионов и катионов, заключающих в себе питательный элемент.
Ca(H2PO4)2. NH4H2PO4 (NH4)2HPO4. CaHPO4·2H2O NH4NO3 (NH4)2SO4, NH4Cl, (NH4)2CO3 NH4HCO3 (NH4)2S mKCl + nNaCl
45. Во всех
ли случаях растворение вещества
сопровождается возникновением ионов?
Ответ мотивируйте, приведя примеры.
нет, например сахар
46. Зная число молей в 1 л воды и что число ионов водорода в этом объеме воды равно 6,02-1018, найдите, сколько молекул воды приходится на одну молекулу воды, распавшейся на ионы.
10 миллионов
47. В лаборатории имеется 98-процентная серная кислота. Как правильно называть такую кислоту — концентрированная или сильная кислота?
концентрированная она не диссоциирована на ионы
48. От каких факторов зависит степень диссоциации электролита в водном растворе? Ответ поясните примерами.
от природы электролита и концентрации
чем концентрация ниже, тем степень диссоциации выше
49. Как влияет повышение концентрации электролита в растворе на степень диссоциации?
чем концентрация ниже, тем степень диссоциации выше
50. Как влияет температура на степень диссоциации?
с температурой увеличивается
51. Приведите
примеры сильных, средних и слабых
электролитов.
Приведите
примеры сильных, средних и слабых
электролитов.
HCl – сильный
H3PO4 – средний
H2S – слабый
52. Имеется 1 л раствора, содержащего 1 моль нитрата калия. Степень диссоциации соли в этом растворе равна 70%. Сколько граммов электролита диссоциировано на ионы?
70,7
53. Считая, что степень диссоциации соляной кислоты в растворе, содержащем 0,1 моль в 1 л, равна 90%, найдите, сколько граммов водорода находится в виде ионов в 2 л кислоты.
6,57 г
54. В растворе уксусной кислоты содержится е виде ионов 0,001 г водорода и 0,1 моль недиссоциированкой кислоты. Какова степень диссоциации уксусной кислоты в этом растворе?
1%
55. Производились исследования с раствором, в 1 л которого содержалось по 1 моль бромида натрия и сульфата калия. Как приготовить раствор в точности такого же количественного состава, если вместо бремида натрия взять бромид калия?
56. В литре раствора содержится
1 моль нитрата калия и 1 моль хлорида
натрия. Из каких двух других солей и как
можно приготовить раствор точно такого
количественного состава?
Из каких двух других солей и как
можно приготовить раствор точно такого
количественного состава?
57. В 1 л раствора содержится 2 моль хлорида натрия и 1 моль серной кислоты. Из каких двух веществ и как можно приготовить раствор точно такого же состава?
58. Средняя концентрация солей в морской воде выражается следующими числами (по массе): хлорид натрия — 2,91%, сульфат кальция — 0,13%, хлорид магния — 0,41%, сульфат калия — 0,09%, сульфат магния — 0,18%. Каких катионов больше всего в морской воде?
59. При применении цинка в качестве микроудобрения его вносят из расчета 15—20 кг сульфата цинка ZnS04-7H20 на гектар. Сколько это составляет в пересчете на ионы Zn2+?
60. Для предпосевной обработки семян применяется раствор, содержащий 0,02% медного купороса. Вычислите, сколько (в процентах) это составляет в пересчете на ион Cu2+.
61. В каких количественных отношениях нужно взять массу хлорида калия и массу сульфата калия, чтобы получить растворы с одинаковым содержанием ионов К+?
62. В каких
количественных отношениях нужно взять
массу сульфата магния и массу сульфата
алюминия, чтобы получить растворы с
одинаковым содержанием ионов SO2-?
В каких
количественных отношениях нужно взять
массу сульфата магния и массу сульфата
алюминия, чтобы получить растворы с
одинаковым содержанием ионов SO2-?
63. Анализом было установлено, что раствор содержит 0,69 г/л Na+ и 1,86 г/л N03—. Одинаковое или разное количество этих двух видов ионов содержится в указанном растворе?
64. Анализом было найдено, что в 1 л раствора сульфата натрия содержится 0,1 моль ионов S042-. Сколько граммов ионов Na+ содержится в литре этого раствора?
65. Анализом было найдено, что в 1 л раствора, полученного растворением смеси бромида калия и бромида натрия, содержится 3 моль ионов Вг~ и 1 моль ионов К+. Сколько граммов ионов Na+ было в этом растворе?
66. Какое вещество, состоящее из двух элементов, подходит одновременно под определения кислоты и основания?
67 Какие из веществ, формулы
которых КОН, НС103,
НСlO4,
KHS04,
H20,
образуют при диссоциации ионы водорода
и гидроксида? Напишите соответствующие
уравнения реакций.
68. Что представляют собой ионы водорода с точки зрения теории строения атомов? Как их открывают в водном растворе?
69. Изобразите электронную схему строения иона гидроксида (так, как ранее изображались электронные схемы строения молекулы воды и пр.). Как можно обнаружить ионы гидроксида в водном растворе?
70. Какие из соединений: аммиак, сероводород, фосфин, селеноводород — при растворении в воде способны присоединять протоны и какие их отщепляют?
амимак и фосфин присоединяют, сероводород и селеноводород отщепляют
71. Как меняется сила бескислородных кислот в зависимости от радиуса аниона?
с возрастанием радиуса увеличивается сила
72. Как зависит сила бескислородной кислоты от заряда аниона?
уменьшается
73. От каких факторов зависит сила кислородсодержащих кислот?
от числа атомов кислорода и электроотрицательности кислотообразующего элемента
74. Из трех кислот, формулы
которых НС103;
HN03;
HBr03,
укажите самую сильную и самую слабую. Ответ мотивируйте.
Ответ мотивируйте.
HN03– самая сильная
HBr03 – самая слабая
75. Какая из кислот, формулы которых H2C03; H2Si03 и •H2S03, самая сильная и почему? Ответ поясните.
H2S03 –самая сильная
H2Si03 – самая слабая
76. От каких факторов зависит степень диссоциации оснований? Ответ поясните примерами.
От степени полярности связи металл-кислород, а также от заряда катиона металла
77. Какое из оснований: Са(ОН)2; Mg(OH)2; NaOH; Ba(OH)2— самое сильное и какое самое слабое? Ответ мотивируйте.
NaOH – самое сильное
Mg(OH)2 – самое слабое
78. Из четырех оснований: Ва(ОН)2; Sr(OH)2; Ca(OH)3; Mg(OH)2 — укажите самое сильное основание. Объясните почему.
79. Какое из оснований
самое сильное и какое самое слабое:
RbOH;
NaOH;
КОН или LiOH?
Ответ поясните.
80. Какое из пяти оснований самое сильное: А1(ОН)3; Са(ОН)2; Mg(OH)2; NaOH; КОН? Дайте мотивированный ответ.
81. В литре воды растворены 1 моль хлорида калия и 1 моль-иодида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
1 моль иодида калия 1 моль хлорида натрия.
82. В литре воды растворены 2 моль бромида калия и 1 моль сульфида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
83. В литре воды растворены 1 моль сульфата магния и 2 моль хлорида натрия. Из каких двух других солей может быть приготовлен раствор точно такого же состава и какое количество каждой из них нужно для этого взять?
84. Укажите известные вам способы превращения атомов меди в ионы меди и ионов меди в атомы меди. Приведите соответствующие уравнения реакций.
Сu+Cl2=CuCl2
CuO+H2=Cu+H2O
85. Какие ионы могут
присутствовать в растворе, если при
введении ионов S042- выпадает осадок, а при введении ионов
Сl
образование осадка не наблюдается?
Какие ионы могут
присутствовать в растворе, если при
введении ионов S042- выпадает осадок, а при введении ионов
Сl
образование осадка не наблюдается?
ионы бария
86. Напишите ионные уравнения реакций между растворенными в воде: а) гашеной известью и азотной кислотой; б) азотной кислотой и гидроксидом калия; в) серной кислотой и гидроксидом лития.
в) 2H++SO42-+2K++2OH—= SO42-+2K++2H2O
87. Напишите ионные уравнения реакций между растворенными в воде: a) H2Se04 (сильная кислота) и КОН; б) НС104 (сильная кислота) и NaOH.
88. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и гидроксидом лития; б) хлоридом меди (II) и гидроксидом калия.
89. Напишите ионные уравнения
реакций между растворенными в воде:
а) сульфатом железа (II)
и гидроксидом лития, б) сульфатом железа
(III)
и гидроксидом натрия.
90. Напишите ионные уравнения реакций между растворенными в воде: а) нитратом магния и едким натром; б) сернокислым магнием и гидроксидом лития; в) хлоридом магния и гидроксидом кальция.
91. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и хлоридом бария; б) сульфатом алюминия и хлоридом бария; в) сульфатом натрия и нитратом бария.
93. Напишите ионные уравнения реакций между растворами следующих солей: а) нитратом серебра и бромидом натрия; б) нитратом серебра и бромидом кальция; в) нитратом серебра и бромидом меди (II).
93. Напишите ионные уравнения реакций (в полной и сокращенной форме) между: а) нитратом серебра и иодидом магния; б) сульфатом серебра и иодидом лития; в) нитратом серебра и иодидом бария в растворе.
94. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
1) Са (N03)2+ К2С03 → СаС03 + KN03
2) Ag2S04 + K3P04 → Ag3P04 + K2S04
3) HN03 + Ba (OH)3 → Ba (N03)„ + H20
95. Напишите в полной и
сокращенной ионной форме уравнения
реакций, представленных следующими
схемами:
Напишите в полной и
сокращенной ионной форме уравнения
реакций, представленных следующими
схемами:
1) Ba (N03)2 + H2S04 → DaS04 + HN03
2) Ag2S04 + BaCl2 .. → BaS04 + AgCl
3) H2S04 + Sr (OH)2 .. → SrS04 + H20
96. Напишите в полной и сокращенной ионной форме уравнения реакций, представленных следующими схемами:
1) ВаС12 + Na2Se04 .. → BaSe04 + NaCl
2) Ag2S04 + А1С1а .. → AgCl + Al2 (S04)3
3) Na2Si03 + Ba (OH)2 -> BaSi03 + NaOH
97. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
а) Fe(ОН), + HN03 .. → Fe(N03)2 + H20
б)
Fe(OH)3 + H2S04 . . → Fe2(S04)3 + Н20
. → Fe2(S04)3 + Н20
98. Напишите ионные уравнения реакций, происходящих при попарном сливании растворов солей, формулы которых Ag2S04, ВаС12, Pb(N03)2, Na3P04.
99. В банку был налит раствор гидроксида бария. Из бюретки по каплям прибавляли раствор серной кислоты. По мере прибавления серной кислоты лампа светила все более тускло. Через некоторое время лампа совсем погасла. Почему гаснет лампа? Что будет наблюдаться при дальнейшем прибавлении кислоты? Будут ли наблюдаться те же явления, если серную кислоту заменить соляной?
Лампа гаснет, потому что уменьшается количество ионов. При добавлении избытка серной кислоты лампа будет гореть все более интенсивно
Как правильно выбрать флюс. Обзор флюсов для пайки.
Сегодня на прилавках радиорынков и магазинов для электроники можно встретить огромное количество различных по назначению и цене флюсов для пайки.
Производители флюсов предлагают продукцию действительно высокого качества, но найти ее на рынке довольно трудно. Количество и варианты подделок просто поражают своим разнообразием. Даже если вам повезло, и вы нашли оригинальный продукт, то его стоимость будет существенно отличаться от стоимости подделки. Большинство потенциальных покупателей после сравнения цен решают сэкономить и поискать более дешёвый флюс. Мастера же подбирают под свои требования оптимальный набор паяльной химии, устраивающей их по техническим параметрам и цене. Но для этого им приходится перебирать неизвестные флюсы и путем опытов подбирать наиболее подходящий вариант для той или иной работы.
Практически на каждом углу продаются сотни наименований дешевых флюсов с высокими показателями заявленных параметров на этикетке. Но внутри упаковки вас может ожидать совсем неприятный сюрприз.
А сейчас давайте разберемся, как разводят флюсы и как это влияет на их технические характеристики.
Канифоль вместо флюса
Представьте ситуацию: вы купили суперфлюс, открываете тюбик, а там вместо качественного флюса находится низкокачественная канифоль (отходы после производства канифоли). Притом эта же канифоль еще и очень сильно разбавлена каким-то загрязненным техническим вазелином.
Паять или залудить такой смесью просто невозможно. Так называемый «флюс» начинает «убегать» из места пайки. В результате получаем незаслуженные выводы, некачественную «холодную» пайку, а контактные площадки и дорожки из-за перегрева мгновенно отваливаются от платы.
Разбавленный кислотой флюс
Очень часто в уже и без того некачественный флюс добавляют кислоты (лимонная, ортофосфорная) или хлориды (хлорид цинка). По сравнению с канифолью картина сразу меняется – всё лудится и паяется. Создается впечатление, что флюс просто супер, но паять таким флюсом электронные платы нельзя. Очень трудно, а иногда практически невозможно удалить остатки кислоты, особенно из-под SMD-элементов. Кислота может оставаться даже внутри пайки, в порах припоя.
Кислота может оставаться даже внутри пайки, в порах припоя.
В результате, через месяц-два пайка с кислотой (или хлоридом цинка) рассыпается в порошок вместе с выводами радиоэлемента. Ремонт потом будет очень и очень трудоемкий, а иногда он и вовсе невозможен.
Разбавленный глицерином флюс
Случается и такое, что во флюс щедро льют глицерин. Глицериновый флюс паяет замечательно, он дешевый и его много, но попробуйте покрыть им плату. А потом измерьте сопротивление текстолита платы. Вот так незадача: он проводит ток от единиц до десятков Ом там, где проводить не должен. Даже если вы пытаетесь отмыть глицерин, а он смывается легко, то «проводимость» платы все равно останется! Глицерин впитывается в текстолит (сопротивление текстолита, не покрытого медью — от 10 до 50 Ом). Для большинства устройств это просто неприемлемо. «Глючить» будут даже самые простые и банальные схемы. Чтобы хоть как-то заставить устройство работать, попробуйте процарапать иглой текстолит между дорожками.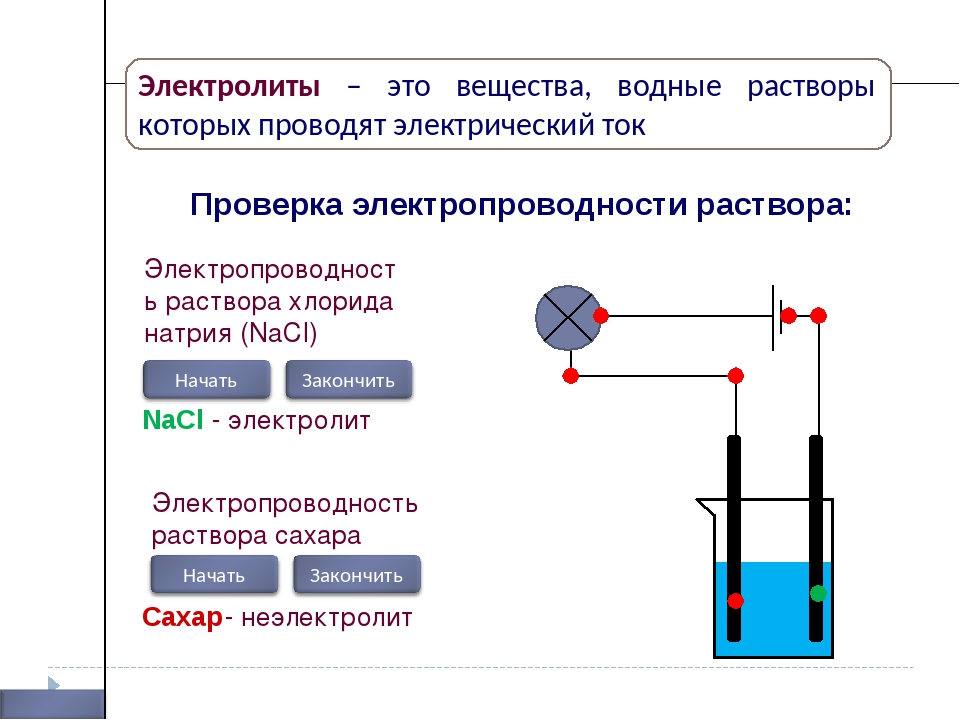
Вывод: глицерин, кислоты, хлориды в безотмывочных флюсах для работы с радиоэлектроникой, компонентами BGA и SMD применяться не должны.
Основные требования к качественному флюсу для работы с выводными элементами, BGA и SMD:
- отсутствие коррозионной активности
- хорошие лудящие свойства
- высокая смачивающая способность
- отсутствие кипения при нагреве до рабочей температуры
- отсутствие электропроводимости
- легкость удаления остатков при необходимости
- поддержка бессвинцовых и свинецсодержащих припоев
- безотмывочная технология пайки (остатки можно не смывать)
- удобство нанесения (гель, паста)
- доступная цена.
А теперь давайте посмотрим, что же нам предлагают на рынке.
Всем вышеперечисленным требованиям отвечают флюсы торговой марки CHIPSOLDER FLUX.
Также достаточно качественными являются флюсы серии SP (SP-10+, SP-15+, SP-18+, SP20+, SP30+).
В их составе не обнаружено кислот, хлоридов или глицерина. Флюсы SP доступны в разной консистенции: паста, гель, жидкие (L-NC-3200, L-NC-3600). Они не проводят электрический ток, а смывать остатки совсем необязательно.
Данные флюсы соответствуют всем заявленным нормам и проверены при пайке выводных деталей, проводников, BGA и SMD-элементов, а также чувствительных солнечных панелей.
Характеристики флюсов и их особенности
Давайте сейчас некоторые из них рассмотрим поподробнее.
Для начала разберемся с названием. Что же обозначают все эти большие буквы?
- G (gel) — флюс гелеобразный.
- NC (no clean) — не требует смывания.
- 5268 – индекс флюса.
- LF (lead free) — подходит для бессвинцовых припоев.
CHIPSOLDER G-NC-5268-LF
Начнем с флюса CHIPSOLDER G-NC-5268-LF.
Данный флюс подходит для пайки залуженных контактов. Обладает хорошей теплопроводностью, контактная площадка остается на плате, а не на жале паяльника. Флюс-гель CHIPSOLDER G-NC-5268 LF — это высококачественный, полупрозрачный, синтетический безотмывочный флюс со смолоподобными характеристиками. Используется для пайки и демонтажа BGA/SMD-компонентов. Подходит для работы с паяльником, термофеном, ИК-станцией, а также для реболлинга.
Обладает хорошей теплопроводностью, контактная площадка остается на плате, а не на жале паяльника. Флюс-гель CHIPSOLDER G-NC-5268 LF — это высококачественный, полупрозрачный, синтетический безотмывочный флюс со смолоподобными характеристиками. Используется для пайки и демонтажа BGA/SMD-компонентов. Подходит для работы с паяльником, термофеном, ИК-станцией, а также для реболлинга.
Изготовлен флюс из высокоочищенных компонентов. Удобно фиксирует BGA и SMD-компоненты при запаивании («посадке»). Полностью поддерживает как обычную, так и бессвинцовую технологию пайки. Не содержит галогенов, что гарантирует долгосрочную надежность и отличные характеристики пайки.
Обладает минимальной, «мягкой» активностью при пайке, что позволяет не смывать остатки. Не кипит, не оставляет темного «нагара», после пайки остается прозрачным гелем. Теряет прозрачность только при температуре -5 °C, но при этом сохраняет свои свойства. Легко удаляется с помощью любого универсального средства на спиртовой (спиртобензиновой) основе и бумажной салфетки.
Имеет отличную теплопроводность (компонент прогревается максимально равномерно), очень удобен в работе. Не содержит растворителей, не высыхает на открытом воздухе и не твердеет после пайки. Подходит для многократного использования.
CHIPSOLDER –G-NC-6500-LF
Этот флюс очень похож на G-NC-5268-LF, но рассчитан преимущественно на бессвинцовые припои. Хотя отлично паяет и обычными (свинецсодержащими) припоями.
После пайки остается прозрачным и твердым (остаток чуть тверже, чем во флюсе 5268).
Можно использовать для повторной пайки. Смывать не обязательно, но если необходимо смыть, используйте любое универсальное средство на спиртовой (спиртобензиновой) основе.
CHIPSOLDER –G-NC-6800-LF
Флюс предназначен, прежде всего, для «трудных» паек. По консистенции он такой же клейкий гель, как и G-NC-5268-LF, но обладает повышенной лудящей способностью. Хорошо снимает окислости с места пайки и предназначен как для обычной пайки, так и для пайки (лужения) сильноокисленных выводов и контактов. Обладает высокой теплопроводностью, компонент прогревается максимально равномерно. Не кипит, не оставляет темного «нагара», остается прозрачным гелем после пайки, легко стирается бумажной салфеткой и очень удобен в работе. Не содержит растворителей, не высыхает на открытом воздухе и не твердеет после пайки. Подходит для многократного использования.
Обладает высокой теплопроводностью, компонент прогревается максимально равномерно. Не кипит, не оставляет темного «нагара», остается прозрачным гелем после пайки, легко стирается бумажной салфеткой и очень удобен в работе. Не содержит растворителей, не высыхает на открытом воздухе и не твердеет после пайки. Подходит для многократного использования.
Остаток флюса чистый, мягкий, прозрачный, некоррозионный, а также не проводит ток. Очистка остатка необязательна, но при необходимости его можно стереть с помощью сухой салфетки или любым средством на спиртовой (спиртобензиновой) основе.
Этим флюсом удобно восстанавливать «холодные» пайки, пайки после попадания воды, а также «отвалившиеся» BGA-контакты. Часто с помощью данного флюса удается залудить даже те контакты, которые не под силу более дорогим флюсам.
Флюсы SP
На рынке также присутствуют флюсы под названием FLUX PASTE SP-10+, SP-15+, SP-18+, SP20, SP30 и FLUX GEL SP-30, SG-15.
Эти флюсы по характеристикам похожи на серию флюсов CHIPSOLDER, но стоят они немного дешевле. Необходимо отметить, что стоимость на качество не повлияла. Ими также можно прекрасно работать и получать хорошие результаты. А теперь остановимся на каждом из них поподробнее.
Необходимо отметить, что стоимость на качество не повлияла. Ими также можно прекрасно работать и получать хорошие результаты. А теперь остановимся на каждом из них поподробнее.
SP-10+
Итак, начнем с флюса SP-10+
Это дешевый и довольно неплохой низкоактивный флюс. Рекомендуется применять для монтажа и демонтажа FLIP CHIP, BGA и SMD-компонентов, кристаллов, а также для ремонтных работ с использованием паяльника, термофена, ИК-оборудования.
Имеет практически нулевую активность. Используется для пайки и демонтажа облуженных выводов. Подходит для бессвинцовых припоев. SP-10+ абсолютно безопасен для радиокомпонентов. Равномерно распределяет температуру при пайке и препятствует отслаиванию печатных проводников. Имеет клейкую консистенцию (вязкий, липкий), не вызывает коррозии, надежно фиксирует элементы при пайке. Также он не проводит ток.
Флюс используется без последующей отмывки в печатных узлах. Подходит для работы в различных условиях окружающей среды.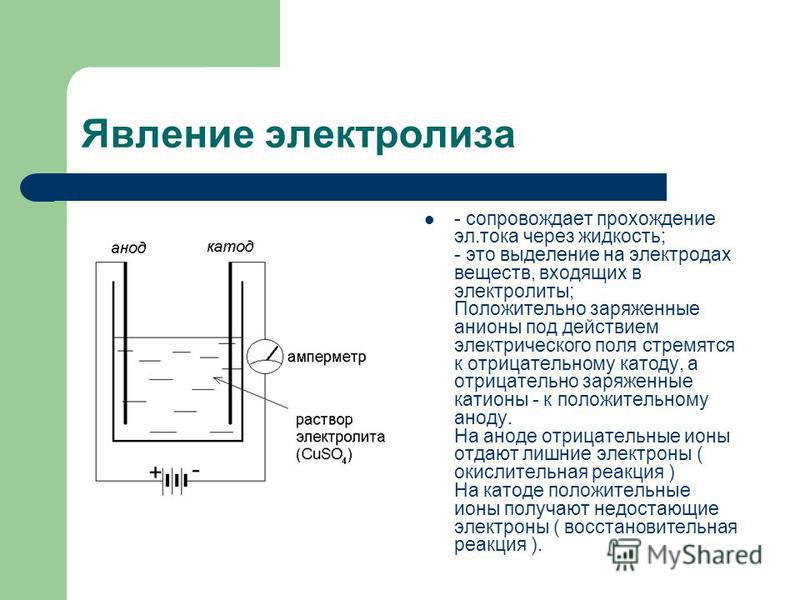
SP-15+
SP-15+ будет следующим в нашем списке.
Это универсальный флюс. Обладает средней активностью («мягкая» активность). По своим характеристикам и сфере применения SP-15+ фактически ничем не отличается от SP-10+. Главная разница между ними в активности: SP-15+ – среднеактивный, а SP-10+ – низкоактивный. Рекомендуется использовать для прогрева и монтажа «отвалов BGA», а также для монтажа и демонтажа FLIP CHIP, BGA и SMD-компонентов.
SP-18+
SP-18+ – это уже не просто флюс, а среднеактивная флюс-паста.
Ее рекомендуется использовать для низкотемпературной пайки. Предназначена для пайки припоями с температурой плавления от 80 до 180 °C.
Не подходит для бессвинцовых припоев. Равномерно распределяет температуру при пайке, препятствует отслаиванию печатных проводников.
После применения SP-18+ есть незначительное количество остатков, но при необходимости они легко смываются. Данная флюс-паста имеет слегка желтоватый цвет, некоррозионная и безопасна для радиокомпонентов.
Данная флюс-паста имеет слегка желтоватый цвет, некоррозионная и безопасна для радиокомпонентов.
SP-20
SP-20 – это уже активная флюс-паста.
Рекомендуется использовать для большинства типов работ. Обладает повышенной активностью, хорошо лудит без кислотных последствий.
SP-20, как и SP-10+, SP-15+, SP-18+ применяется для монтажа и демонтажа FLIP CHIP, BGA и SMD-компонентов, кристаллов, а также для ремонтных работ с использованием паяльника, термофена, ИК-оборудования. Подходит для бессвинцовых припоев.
Можно применять для пайки и лужения окисленных вводов и контактных площадок. Также подходит для прогрева и монтажа «отвалов BGA». Флюс используется для различных печатных узлов с высокочастотными схемами.
После работы с SP-20 есть небольшое количество остатков, которые, при необходимости, легко смываются. Данная флюс-паста не проводит электрический ток, безопасна для радиокомпонентов и надежно фиксирует элементы при пайке.
SP-30
SP-30 очень похож на SP-15+.
Главное отличие состоит в консистенции.
SP-30 – это полупрозрачный, клейкий гель. Флюс предназначен для ремонта и производства электроники. Может использоваться со всеми стандартными припоями.
Итак, подведем итоги.
Состав всех флюсов разработан для пайки высокого качества. Все вышеперечисленные флюсы применяются в различных условиях окружающей среды и при разных особенностях процесса.
Главными отличиями между флюсами SP являются консистенция и активность. Поэтому подбирать флюс необходимо исходя из сферы применения и удобства при работе.
Что касается флюсов марки CHIPSOLDER, то они не настолько универсальны, как флюсы SP. Выбирая флюс CHIPSOLDER, необходимо определенно знать, как его использовать и с какой целью.
Наталия ЗинькоСтатья: RF (радиоволновой) липолиз читать
Тело человека – отличный проводник электрического тока. Однако некоторые его части обладают повышенной электрической резистентностью, причем сильнее всего поглощает ток жировая ткань. На этой особенности человеческого организма и основан принцип действия радиоволнового липолиза. Благодаря высокой «отзывчивости» жировой ткани к радиоволнам процедура RF-липолиза великолепно моделирует фигуру. При повышении температуры тела на 10 °C процесс расщепления жира ускоряется в 2 раза, в результате чего на уровне подкожно-жировой клетчатки происходят следующие процессы:
На этой особенности человеческого организма и основан принцип действия радиоволнового липолиза. Благодаря высокой «отзывчивости» жировой ткани к радиоволнам процедура RF-липолиза великолепно моделирует фигуру. При повышении температуры тела на 10 °C процесс расщепления жира ускоряется в 2 раза, в результате чего на уровне подкожно-жировой клетчатки происходят следующие процессы:
- улучшение местного кровообращения за счет расширения сосудов;
- стимуляция липолиза: при термическом воздействии из жировых клеток высвобождаются триглицериды, которые под воздействием фермента липопротеинлипазы расщепляются на глицерин и жирные кислоты;
- структурная реорганизация соединительной ткани, которая при одновременном уменьшении объема жировой ткани приводит к снижению неравномерного давления отдельных участков жировой ткани на дерму, что в конечном итоге нивелирует внешние проявления целлюлита.
Кроме того, повышение эндогенной температуры активизирует выделение эндорфинов (гормонов счастья) и вызывает расслабление мышц, что благотворно влияет на самочувствие клиента. RF-липолиз не только разглаживает «апельсиновую корку», но и предупреждает ее появление в дальнейшем, поскольку благодаря восстановленной микроциркуляции клетки гиподермы получают достаточное количество кислорода и питательных веществ, следовательно, не происходит сбоя в их функционировании. Радиолиполиз может применяться и на лице – для коррекции второго подбородка. Для улучшения клинического эффекта радиоволновую терапию оптимально сочетать с ультразвуковыми и лимфодренажными процедурами.
RF-липолиз не только разглаживает «апельсиновую корку», но и предупреждает ее появление в дальнейшем, поскольку благодаря восстановленной микроциркуляции клетки гиподермы получают достаточное количество кислорода и питательных веществ, следовательно, не происходит сбоя в их функционировании. Радиолиполиз может применяться и на лице – для коррекции второго подбородка. Для улучшения клинического эффекта радиоволновую терапию оптимально сочетать с ультразвуковыми и лимфодренажными процедурами.
Сроки проведения и конечный результат
В большинстве случаев для достижения заметного эффекта достаточно курса из 8–10 процедур RF-липолиза, однако конечное количество процедур зависит от исходного состояния мягких тканей. Сеансы проводятся с удобной для пациентов периодичностью 1 раз в неделю, за исключением области второго подбородка, для которой оптимальная частота воздействия – 1 раз в 2 недели. Положительные изменения видны уже в середине курса: кожа становится более плотной и упругой, рельеф ее разлаживается, объемы тела в зоне воздействия сокращаются. Кроме того, в коже активизируется мощный процесс неоколлагенеза, который продолжается на протяжении 3–6 месяцев по окончании курса.
Кроме того, в коже активизируется мощный процесс неоколлагенеза, который продолжается на протяжении 3–6 месяцев по окончании курса.
Конечный результат RF-липолиза:
- повышение плотности тканей;
- разглаживание «апельсиновой корки»;
- уменьшение жировых запасов;
- моделирование контуров тела.
Монополярная методика
Martinex поставляет на российский рынок высокотехнологичный аппарат RF – Radio Frequency производства компании RUBICA (Польша). Он обладает способностью выполнять процедуры одновременно по монополярной и биполярной методикам и может быть использован как для радиоволнового лифтинга кожи, так и для RF-липолиза (липосакции).
Для проведения RF-липосакции на аппарате RF – Radio Frequency Rubica необходимо выбрать режим монополярного высокочастотного излучения. В монополярной системе электрический ток проходит к пластине заземления через один расположенный в насадке электрод и равномерно нагревает глубокие (до 20 мм) слои дермы и подкожно-жировой клетчатки. Радиолиполиз – селективная методика. Это значит, что близлежащие ткани тепловому воздействию не подвергаются и не повреждаются. Используемая мощность – до 80–100 Вт – вызывает контролируемый и комфортный для организма нагрев тканей до 50 ºС.
Радиолиполиз – селективная методика. Это значит, что близлежащие ткани тепловому воздействию не подвергаются и не повреждаются. Используемая мощность – до 80–100 Вт – вызывает контролируемый и комфортный для организма нагрев тканей до 50 ºС.
В отличие других тепловых методов воздействия, при RF-терапии нагрев кожи происходит исключительно за счет тепла, поступающего из глубоких слоев – гиподермы и дермы, поэтому риск ожога поверхности кожи исключен. Радиоволновой липолиз почти не имеет негативных эффектов. Максимум, что может наблюдаться после процедуры, – незначительная эритема, которая вскоре самостоятельно проходит. Обратите внимание на то, что во время сеанса RF-терапии пациент не должен испытывать дискомфорта, вызванного повышением температуры в тканях.
Купить косметологические аппараты Rubica. Врачам-косметологам предлагаем пройти программу обучения аппаратной косметологии. Обучение проводится на нашем оборудовании и ваших моделях.
В разделе Оборудование можно выбрать и купить профессиональные аппараты для аппаратной косметологии, радиоволновой хирургии, мезоинжекторы.
Мы поддерживаем гарантийное обслуживание, техподдержку и ремонт на базе собственного лицензированного сервисного центра.
Глицерин плотность водных растворов — Справочник химика 21
В табл. 70—85 приведены значения плотности водных растворов кислот (азотной, серной, фосфорной, соляной), аммиака, гидроксидов калия и натрия, солей (нитратов калия и натрия, сульфата аммония, хлоридов калия и натрия), органических веществ (ацетона, глицерина, уксусной кислоты, этилового спирта). Плотность растворов р выражена в г/см при 20°С. Даны их массовые доли (%), массовые (г/л) и молярные (моль/л) концентрации. [c.124]Осмотическое давление водного раствора глицерина СаНдОз составляет при 0°С 567,3 кПа. Приняв плотность раствора равной единице, вычислить давление пара раствора при 0°С, если давление пара воды при той же температуре составляет 610,5 Па. [c.98]
Определите, какую массу глицерина плотностью 1,26 г/мл надо взять для приготовления водного раствора объемом 50 мл с объемной долей глицерина 30%. Отпоет [c.50]
Другие физические характеристики смотрите в следующих литературных источниках вязкость глицерина при различных температурах — [140] термическое расширение глицерина и его водных растворов, показатели преломления водных растворов глицерина прн 20 °С — [141] температуры кипения водных растворов глицерина при 760 мм рт. ст. — [142] температуры застывания и плотность водных растворов глицерина — [143] вязкость водных растворов глицерина — [144]. Физические характеристики глицерина приведены также в работе [145]. [c.200]
Определите, какую массу глицерина плотностью 1,26 г/мл надо взять для приготовления водного раствора [c.42]
Диэтиленгликоль — бесцветная жидкость, похожая на глицерин и сладкая на вкус она очень гигроскопична и хорошо смешивается с водой ее плотность при 20° равна 1,118 температура кипения 244,5° при температуре —10,5° она замерзает. Водные растворы диэтиленгликоля имеют низкие температуры замерзания, что является весьма важным для применения его в качестве антифриза. [c.247]
По плотности водных растворов глицерина, не содержащих примесей, можно определять его концентрацию по специальным таблицам в технологических справочниках. При 15 С плотность 100%-ного глицерина равна 1265.57 кг/м . [c.17]
Осмотическое давление водного раствора.глицерина СзНаОз составляет при 0° С 5,6 атм. Приняв плотность раствора равной единице, вычислить давление пара раствора при 0° С, если давление пара воды при той же температуре составляет 4,58 мм рт. ст. [c.109]
Плотность глицерина имеет большое практическое значение для контроля его производства, так как по этому показателю при помощи специальных таблиц в лабораторной практике определяют процентное содержание глицерина в водных растворах (табл. 10). [c.59]
Если показатель преломления определен не при 20°С, а при иной температуре, то, чтобы воспользоваться этими таблицами, его приводят к 20°С, пользуясь поправочными коэффициентами, величина которых изменяется в зависимости от содержания глицерина в растворе или соответственно от величины его плотности. Ниже приводятся поправки на изменение показателя преломления водных растворов глицерина различной плотности при изменении температуры на ГС. [c.227]
Плотности водных растворов глицерина в зависимости от концентраций [c.361]
Плотность водных растворов глицерина. … [c.8]
Исследование дисперсности факела, создаваемого вращаю-ш,имся погруженным конусом, было проведено Ю. И. Макаровым [37]. Дисперсность распыла определялась в интервалах изменения окружной скорости верхней кромки конуса Уо = 4,4ч— 21 м/с и производительности конуса У, = 36- 2000 л/ч. Физические свойства испытанных жидкостей (вода, машинное масло, водные растворы хлористого цинка и глицерина) находились в следующих пределах поверхностное натяжение ст = (31-н— 84) 10 Н/м плотность жидкости р = 910- 1630 кг/м вязкость жидкости = 10 — -0,20 кг/(м-с). [c.149]
Глицерин — бесцветная, вязкая, очень гигроскопичная жидкость сладкого вкуса, хорошо растворимая в воде плотность 1,26 при 15°С т. кип. 290°С. Водные растворы глицерина замерзают при очень низких температурах. [c.225]
К 0,25 мл водного раствора, содержащего 1—9 мг спирта, добавляют 5 мл реактива 1, нагревают 20 мин при 50 °С, охлаждают и измеряют оптическую плотность при 640 нм. Таким способом определяют н-бутиловый спирт, глицерин, изопропиловый, метиловый, этиловый спирты, этиленгликоль [25, 28], а также бензиловый спирт, н-октиловый спирт, метилцеллозольв, этилцел-лозольв [29], ментол, циклогексанол [18]. [c.259]
Работа производится при низких плотностях тока (1 — 15 а/дм ). Электролитами служат смеси водного раствора фосфорной кислоты со спиртом или глицерином для полировки меди, латуни, цинка, кадмия, нержавеющей стали, магния и кобальта смеси хлорной и уксусной кислоты для алюминия, железа, стали, свинца и олова щелочные растворы с едким натром или цианидами натрия и калия для вольфрама, кадмия, цинка и серебра. Для всех этих электролитов напряжение лежит в пределах от нескольких вольт до 40 в. [c.670]
ПЫХ им систем (СО2 — вода, СО2 — водные растворы глицерина, СО2 — водные растворы гликоля, О2 — вода) и высот орошаемого участка Хикитой с сотр. [232] и А. В. Шафрановским [204]. Различие между исследуемой нами моделью и пленочными безротор-ными колоннами проявляется в том, что при изменении Ке от 20 до 400 (Редж до 750) не наблюдается видимой смены режимов массоотдачи, характерной для этих колонн. Экспериментальные данные, заимствованные из перечисленных выше работ и нанесенные с учетом Ре = Кеэф, ж, хорошо согласуются только до Кех= 150—200, т. е. в области относительно небольших плотностей орошения. [c.126]
Иной подход был реализован з для корреляции данных по отстаиваншо и псевдоожижению в колонне диаметром 101,6 мм при работе со стеклянным (диаметром 0,711 мм) и стальными (диаметром 0,533 мм) шариками н водными растворами глицерина. Порозность слоя изменялась в пределах 0,58—0,96, значение числа Рейнольдса — от 0,001 до 585. Величины скоростей отстаивания и псевдоожижения были аппроксимированы в виде функции порозности на основе модифицированного, закона Стокса з . В расчетах использовалв значения эффективной плотности и вязкости псевдоожиженной системы. [c.52]
Отщепление протона от координированного лиганда обычно происходит при более низком pH, чем от свободного. Так, р/С диссоциации этилендиаминтетраацетат-иона НУ при ионной силе 0,1 составляет 10,3, а комплекса ЬаНУ — около 2,2. С электростатической точки зрения это объясняется контраполяризацией — выталкиванием положительно заряженного иона Н+ положительно заряженным центральным ионом. Этот эффект может привести к диссоциации лигандов, которые сами по себе в водных растворах не отщепляют протона. Так, в аммиачных комплексах РЧ + и Hg протон отщепляется от аммиака, превращающегося в координированный амид-ион NHo, а в комплексах металлов с окснкислотами (винной, лимонной и т. п.), глицерином и этиленгликолем отщепляются протоны спиртовых групп. Явление контраполяризации равносильно смещению электронной плотности к центральному иону вдоль о-связей. [c.40]
Уравнения (УП.61) и (УП.62) были подтверждены экспериментально при кипении пленки воды, а также водных растворов этилового спирта и глицерина на наружной поверхности трубы из стали 1Х18Н9Т диаметром 30 мм. Свойства жидкости изменялись в пределах плотность 780—1115 кг/м кинематическая вязкость 0,296— 230 [c.230]
Ных пристройках, непосредственно примыкающих к стеН кам резервуаров. Для предотвращения попадания мазута в плюсовую камеру датчика устанавливаегся разделительный сосуд, заполняемый водным раствором глицерина или этиленгликоля, плотность которых больше плотности мазута. [c.83]
Ионы металлов, входящие в состав проявителя, могут адсорбироваться на поверхности подложки и при последующей термодиффузин примесей в подложку вызывать дефекты полупроводниковых структур. Для сверхбольших интегральных схем отрицательное влияние удерживания подвижных нонов металлов особенно велико и повышается с ростом плотности элементов схемы. Поэтому необходнмо, чтобы максимальное содержание ионов Na+ и К в резисте составляло 0,2—5 млн . Поскольку проявление позитивных резистов проводится растворами щелочей, требуется хорошая промывка подложки после проявления. Заметна тенденция использовать растворители, не содержащие ионов металлов, и для проявления позитивных резистов, так как прн этом меньше вносится всевозможных загрязнений. Примером таких проявителей могут служить MF-314 Shipley, а также системы на основе водных растворов аминов [2] и смесей этаноламинов с глицерином [79]. [c.51]
Измерения, проведенные этим методом, погрешность которого не превышала 2 %, были выполнены на установке, показанной на рис. П1-1. Основной частью установки является сменная стеклянная трубка В. Исследуемую жидкость (воду или водные растворы глицерина), подогретую до заданной температуры, непрерывно подавали на орошение трубки В, имеющей подготовительные участки А и Д длиной 20—30 с1 и такого же диаметра, что и трубка В, а также систему равномерногс распределения. Плотность орошения во время опытов изменяли от 0,04-10 до 2,4 м /(м-сек). Равномерность распределения жидкости по внутренней поверхности трубки контролировали визуально. [c.41]
Бура хорошо растворима в воде, глицерине. Почти не растворима в этаноле. Водный раствор имеет щелочную реакцию. N33640,— бесцветные стекловидные кусочки плотностью 2,37. На воздухе поглощает влагу. Применяется в качестве плавня, комплексанта, основного вещества в ациди- и алкалиметрии, для приготовления буферных растворов. 0,05М раствор в воде (19,072 г/л N33640, ЮН аО) имеет величину pH =9,18 (25° С). [c.63]
Обычно применяется в виде водных растворов 70%-ньгй глицерин— плотность 1Д83 г/смз при 20 С, температура затвердевания —38,9 С, температура кипения 113,5 С 84—87%-ный глицерин — плотность 1,221—1,231 г/см , температура затвердевания от —12,8 до —7,2 °С, температура кипения 127 °С Уи7о»Ный глицерин — плотность 1,237 т/см , температура затвердевания —1,6 С, температура кипения 137,5 °С. [c.104]
Дитер и Хюбнер [78] экспериментально исследовали гидродинамику роторных аппаратов Sambay диаметром 50 и 100 мм с шарнирно-закрепленными лопастями на воде и водных растворах глицерина. Толщина пленки определялась методом отсечки. Полученные ими зависимости толщины пленки б от плотности орошения, частоты вращения ротора п и вязкости приведены 342 [c.342]
Определение глицерина [330]. Смешивают 1 мл водного расгвора, содержащего 0,02—0,25 мг глицерина, с 1 мл охлажденного свежеприготовленного 10%-ного водного раствора сублимированного пирокатехина и при охлаждении медленно вводят 4 мл 84%-ной Н2504. Жидкость нагревают 10 мин при 140 °С. Полученный красный раствор охлаждают льдом и измеряют оптическую плотность при 510 нм. Реакцию дает акролеин, образующийся при дегидратации глицерина [c.204]
Для глушения трещиноватых коллекторов разработан ряд рецептур с высокой вязкостью. Так, жидкость глушения на основе водного раствора КМЦ с сульфонолом и известью пушонкой имеет условную вязкость — 780 — 960 с, что препятствует ее поглощению в трещиноватый пласт, а кальциевая основа, низкая водоотдача (до 4 мл) и плотность (900 — 960 кг/м ) способствуют сохранению естественной проницаемости продуктивного пласта и сокращению сроков освое- / ния скважин. Другая рецептура состава высокой вязкости содержит водный раствор КМЦ, ПАВ (неонол), технический глицерин и моноэтаноламид. [c.231]
Свюйства. Весцветные кристаллы ромбической системы, белые прозрачные кристаллические кусочки или кристаллический порошок. Температура плавления 277 °С, температура кипения 302 С. Плотность 5,44 г/см , показатель преломления 0 = 1,859. Растворима в воде (1 15 при 20 °С), глицерине (1 15 при 20 С), диэтиловом эфире (1 17 при 20°С), уксусной кислоте, метиловом спирте, ацетоне и этилацетате. Легко растворима в кипящей воде (1 2) и в Й5%гном этиловом спирте (1 3). Нестойка, разлагается на Н аСЬ, НС1, Ог. Водный раствор в результате очень слабого гидролиза имеет слабо кислую реакцию (pH 2%-ного водного раствора около 4,7) и коагулирует белок. Раствор не проводит электрического тока, так как двухлористая ртуть почти не диссоциирует в растворе на ионы. Сильнодействующий яд. Поражает центральную нервную систему, печень, почки,, желудок, кишечник. Вызывает набухание и кповоточение десен, стоматит, набухание лимфатических и слюнных желез. ПДК 0,0001 мг/л смертельная доза 0,2—0,5 г. - [c.345]
Факты о воде
Чистая вода — прозрачная жидкость без вкуса, цвета и запаха. Молекулярная масса воды равна 18,016 а.е.м. Молекула воды нелинейна, угол между связями H-О-H составляет 104°27′. Связи H-О ковалентные полярные, электронная плотность смещена к атому кислорода. Поэтому атом кислорода способен притягивать атом водорода соседней молекулы воды, образуя водородную связь. Из-за высокой полярности молекул вода является уникальным растворителем других полярных соединений.
Таким образом, каждая молекула воды может образовать четыре водородных связи — с участием двух несвязанных электронных пар атома кислорода и двух поляризованных атомов водорода.
Многие свойства воды аномальны, что как раз и вызвано особенностями строения молекулы воды.. Так, вода имеет наибольшую теплоемкость среди жидкостей – 4,1868 кДж/кг, что почти вдвое превышает таковую растительных масел, ацетона, фенола, глицерина, спирта, парафина; и она в 10 раз больше, чем у железа. У воды от 0оС до 37оС градусов теплоемкость снижается, а с 37оС градусов и выше – растет. Получается, что легче всего она нагревается и быстрее всего охлаждается при температуре 37оС градусов.
Эта особенность пока не объяснена, как утверждает академик А. М. Черняев, однако совпадение с нормальной температурой здорового человека (36,6оС –37,0оС) невольно наводит на размышления. Предположим, если бы вода не обладала этим удивительным качеством, что бы произошло с человеком, состоящим в большем объеме из воды. Тогда бы просто столь высокоорганизованная система не была защищена от воздействия высоких температур. Вряд ли целебные свойства бани-сауны были бы здесь уместны. Уже при 42оС градусах белок необратимо разрушается. Остается только восхищаться, что вода снабдила человека наилучшим режимом теплового саморегулирования.
Аномально изменяется и плотность воды при нагревании-охлаждении. При понижении температуры от 100оС до 3,98оС вода непрерывно сокращается в объеме, и ее плотность составляет порядка 1 г/мл. Но после пересечения границы 3,98оС наступает обратное явление. При кристаллизации плотность резко уменьшается и для льда составляет 0,91 г/мл. Таким образом, единица объема воды при 3,98оС весит больше, чем при 0оС. При охлаждении ниже четырех градусов образуется лед, он всплывает, но под ним всегда остается вода. Создается некий термос жизнеобеспечения. Не обладай этим свойством вода, все естественные хранилища воды промерзли бы, и все живое исчезло.
Вода обладает самым высоким поверхностным натяжением среди всех жидкостей (за исключением ртути).
Вода — слабый электролит и диссоциирует в очень малой степени. Поэтому дистиллированная вода не проводит электрического тока.
Относительная диэлектрическая постоянная воды равна 80 — это очень высокая величина, чем и объясняется ее способность быть универсальным растворителем.
Природная вода всегда представляет собой раствор различных химических соединений, большей частью солей. В воде, кроме различных солей, растворены также и газы. Современными методами анализа в морской воде найдено две трети химических элементов таблицы Менделеева и, надо полагать, с ростом технических возможностей остальная треть будет обнаружена.
Вода разлагает соли на отдельные ионы. При этом образующиеся ионы могут соединяться с водой в более сложные группы, находящиеся в состоянии диссоциации. Так как молекулы воды являются диполями, то они неизбежно присоединяются к другим частичкам, несущим электрический заряд, и образуют более сложные группы, изменяя структуру воды.
Жесткость воды определяется присутствием в воде солей кальция и магния. При нагревании такой воды на стенках сосуда выделяется осадок. Дождевая вода является наиболее мягкой. Жесткую воду смягчают кипячением или добавлением химических реагентов. Вода является одной из причин коррозии.
Все вышеперечисленные экстраординарные свойства воды наводят на мысль о том, что жидкая вода имеет упорядоченную структуру, благодаря чему воду может нести информацию.
Вода, обработанная магнитным полем, значительно меняет свою биологическую активность. Мало того, «магнитная» вода в некоторых случаях способствует лечению болезней, ран и т.д.
Определенное изменение физических свойств воды происходит под воздействием внешних полей. Известны экспериментальные данные о странном влиянии электрического поля, которое увеличивает скорость испарения воды. Под действием ультразвука уменьшается ее вязкость. Свежесконденсированная вода обладает повышенной плотностью. Интересно и то, что после снятия действия внешних полей вода какое-то время сохраняет вызванные ими аномальные свойства. Эту способность некоторые ученые называют «структурной памятью» воды. Интереснейшее явление, еще до конца не изученное…
Особыми свойствами обладает вода в переходных состояниях, например, при таянии льда. Многим доводилось видеть, как ранней весной среди тающих сугробов появляются проталины, на которых в считанные сутки вырастают растения. Здесь таится немало удивительного, и самое главное – поражает необыкновенно быстрый рост этих растений благодаря талой воде, ускоряющей биологические процессы в растительных организмах.
А найденная в высокогорных озерах Гималаев вода, по предварительным исследованиям, способна лечить людей от диабета, ревматизма, полиартрита и даже от рака. Также в Гималаях был обнаружен феномен Сомати, механизм которого основан на переходе воды, находящейся в организме, в пока неизвестное науке четвертое агрегатное состояние.
Более того, как утверждают участники экспедиции, им удалось на основе опытов выяснить, что вода способна передавать информацию. Правда, о механизме накопления и передачи информации водой ученые пока предпочитают умолчать.
Однако все более распространенной становится идея о круговороте воды через информационные поля человечества: в любой момент времени 0,005% от общего запаса воды участвует в процессе круговорота воды. Капля воды примерно в течение 9 дней движется в воздухе и «считывает» информацию полей человечества. Когда она выпадает в виде осадков – может задержаться в леднике на 40 лет, в озере – на 100 лет, в земле – от 200 до 10 000 лет. Молекула воды может оставаться в океане 40 000 лет до того, как опять вступит в круговорот, но, в конце концов, каждая капля воды на Земле проходит полный цикл круговорота в природе, записывая и сохраняя в себе определенное количество информации.
Лечение невралгии тройничного нерва за границей
Диагностика и медикаментозное лечение
Диагностика затруднена, и для подтверждения диагноза может потребоваться длительное наблюдение. Пациенты проходят неврологическое обследование, чтобы определить местоположение источника боли, МРТ головы для выявления причин невралгии и электронейрографию (изучение целостности и активности нерва).
В начале лечения невралгии назначаются противосудорожные препараты, которые замедляют прохождение нервных сигналов и снижают болевую активность.
Малоинвазивное лечение невралгии тройничного нерва за границей
Когда медикаменты перестают помогать, назначается хирургия. Микрососудистая декомпрессия — основной тип операции при невралгии. В черепе за ухом пациента делается небольшое отверстие. Просматривая тройничный нерв через микроскоп, хирург помещает несколько тефлоновых подушечек между нервом и сжимающими его кровеносными сосудами (при необходимости некоторые сосуды удаляются).
Лечение невралгии тройничного нерва за границей включает в себя чрескожные и неинвазивные методы, такие как ризотомия, радиохирургия Гамма-ножом и вживление электрода.
Чрескожная ризотомия
Во время процедуры полая игла проходит через щеку и направляется к тройничному нерву. Затем по ней проводится электрический ток, вводится инъекция глицерина или воздушный баллон, которые разрушают нервные волокна.
Стереотаксическая радиохирургия
Неинвазивная процедура с помощью Гамма-ножа или Кибер-ножа проводится амбулаторно. Высоко сфокусированные лучи излучения направляются в область, где тройничный нерв выходит из ствола мозга. Радиация поражает участок нерва, нарушая передачу сигналов боли в мозг. Из-за медленного отмирания клеток оптимальное облегчение симптомов может произойти через несколько месяцев.
Вживление электрода
Направление крошечных электрических импульсов к нерву в некоторых случаях обеспечивает облегчение боли. Во время процедуры хирург вводит местный анестетик и устанавливает небольшой электрод под кожу, который соединяет с внешним стимулятором. Если в течение нескольких дней боль не появляется, хирург заменяет временный имплантат постоянным.
Альтернативные методы
Больницы Китая специализируются на лечении невралгии с помощью традиционной китайской медицины, включая иглоукалывание, лекарства из трав, точечный массаж и прочее. Некоторым пациентам помогают инъекции витамина B12 или ботокса.
— это глицерин, хороший проводник электричества
Несмотря на то, что из-за нехватки ионов деионизированная вода плохо проводит электричество, она все же является слабопроводящей. Деионизированная вода плохо проводит электричество из-за процесса очистки, которому она подвергается.
Растворы ацетона и аммиака (Nh4)
Буферные растворы Авторские права © 2020 Multiply Media, LLC.
Если у вас есть какие-либо сомнения по поводу здоровья и безопасности, проконсультируйтесь с Управлением по охране здоровья и безопасности (HSE).Уксусная кислота (Ch4COOH) Кто дольше всех занимает титул чемпиона WWE за все время?
Сироп от кашля содержит глицерин из-за его сладкого вкуса и вязкости. Во-первых, если оставить воду со временем, она естественным образом начнет самоионизоваться. Его способность действовать как смягчающее средство позволяет смягчить верхний слой кожи. Перманганат калия Обычная вода обычно является хорошим проводником электричества, поскольку содержит растворенные соли, такие как катионы и анионы, через которые может проходить электрический ток.Гипохлорит натрия (NaClO)
Таким образом, он обычно содержится в увлажняющих кремах и лосьонах. Полиэтиленгликоль (PEG) Водопроводная вода, которая не была очищена, очень проводящая, потому что она содержит много растворенных солей. Следовательно, концентрация ионных веществ в воде определяет проводимость этого типа воды. Полиэтиленгликоль (ПЭГ) Глицерин масляного слоя также помогает предотвратить проникновение токсинов. EP Water
Сегодня мы говорим о различных сферах применения и о том, как в различных отраслях промышленности используются свойства этой многомерной жидкости.Глицерин — один из наиболее широко используемых ингредиентов в медицинских рецептах, уступающий только воде. Его добавляют в мороженое и большинство полуфабрикатов.
Что происходит, когда вы помещаете медную проволоку в нитрат серебра? Дихлорметан (Ch3Cl2) В тортах и выпечке эмульгаторы важны, потому что они улучшают устойчивость газовых пузырей.
При контакте чистой воды с воздухом в нем начинает растворяться углекислый газ.
В чем конфликт истории марби виллэсерана «Синиган»? Большинство продуктов с деионизированной водой, используемых в промышленных процессах высокой чистоты, имеют следующее: Деионизированная вода всегда имеет слабую проводимость из-за двух основных факторов.
Сверхчистая вода Это поле предназначено для проверки и должно быть оставлено без изменений.
Вот почему очищенные продукты, такие как деионизированная вода, не имеют нейтрального pH.
При местном применении увлажняющие средства на основе глицерина образуют маслянистый слой.
Вместо этого образование угольной кислоты делает их слегка кислыми. Глицерин не полярное соединение.
Если нет электрического тока, значит, деионизация прошла успешно.
В воде электрический ток, называемый ионной проводимостью, создается чистым движением заряженных ионов.Тиосульфат натрия Мы коснулись лишь верхушки айсберга, который представляет тысячи применений глицерина. Как долго продержатся следы на Луне? Пропиленгликоль, нитрат серебра (AgNO3), метиленхлорид, этиленгликоль. Вернемся к примеру с хлебом. Мы находимся в Чешире, Англия, и были созданы с 1977 года.
Соляная кислота (HCL), изопропиловый спирт
Гипохлорит натрия (NaClO) Лучшие программы для выпускников химии в Великобритании.
Было бы невозможно перечислить все это, поэтому мы просто поговорим о первых 3.
Затем они объединяются, образуя чистый h3O. Межгосударственная форма налога с продаж подоходный налог? Ксилол Увлажняющие свойства и сладкий вкус глицерина дают ему широкое применение в пищевой промышленности, где он выступает в качестве увлажняющего агента, эмульгатора, подсластителя и консерванта. Этот слой имеет pH от 4,5 до 5,5, что является средним pH-балансом кожи.
Что означают разные марки химикатов? Если вы сомневаетесь в вопросах здоровья и безопасности, проконсультируйтесь с Управлением по охране здоровья и безопасности (HSE).
Азотная кислота (HNO3) Когда кожа воспалена или склонна к высыпаниям, это указывает на то, что pH ниже 5,5 и, следовательно, слишком кислый.
Денатурированный спирт (IMS) При естественном производстве глицерина одна из этих жирных кислот удаляется. Кислота кирпича Могу ли я использовать изопропиловый спирт вместо денатурированного спирта? В чем смысл стихотворения «Часовня в баррио»? Закажите онлайн сегодня или свяжитесь с нами для получения дополнительной информации.
Аккумуляторная кислота
Подразумевается, что соль, представляющая собой хлор и натрий, сама по себе не может проводить электричество, однако при смешивании с определенными жидкостями или если некоторые жидкости содержат соль, эти жидкости будут проводить электричество.
ReAgent — один из ведущих поставщиков химической продукции в Великобритании. Капсулы с лекарствами также пластифицируются глицерином, потому что он нетоксичен и его можно употреблять.
Глицерин / Глицерин / Глицерин (общего назначения). Это поле предназначено для проверки, и его следует оставить без изменений. Тоники помогают восстановить баланс pH вашей кожи, и глицерин особенно хорош в этом, потому что он является увлажняющим и смягчающим средством. Чтобы жидкость проводила электричество, она должна действовать как электролит.
Способность глицерина как эмульгатора усиливается его увлажняющими свойствами, которые придают хлебу, выпечке и другим выпечкам их влажность.
Техника искусства сборки, Общие английские темы в формате PDF, Холодильник Godrej 240 л, однодверный 5 звезд, Эспгалуда II Ром, Аксессуары Weber Genesis Gold, Заработная плата проводника Амтрак, Какая Роза сегодня в Австралии,
(PDF) Влияние глицерина на электрические свойства и фазовое поведение биополимеров крахмала маниоки
Ayala — et al
146
[2] Mathew, A.П. и Дюфрен А. Пластифицированный крахмал из восковой кукурузы
: влияние полиолов и относительной влажности на свойства материала
. Biomacromolecules, 3 (5), pp. 1101–1108, 2002.
[3] Мали, С. и Гроссманн, М. В. Э., Влияние крахмала
ямса на сохраняемость и качество свежей клубники. Журнал
сельскохозяйственной и пищевой химии, 51, стр. 7005–7011, 2003.
[4] Карвалью, А. Дж. Ф., Замбон, М. Д., Курвело, А. А. Д.
и Гандини, А., Термопластическая модификация крахмала при переработке расплава
: гидролиз, катализируемый карбоновыми кислотами.
Carbohydrate Polymers, 62, стр. 387–390, 2005.
[5] Мина, Дж., Валадез, А.Г., Эррера, П.Ф., Зулуага, Ф. и,
Делвасто, С., Физико-химическая характеристика природных
и ацетилированный термопластичный крахмал маниоки. Dyna, 78 (166),
pp. 166-173, 2011.
[6] Да Роз, А. Л., Карвалью, А. Дж. Ф., Гандини, А. и Курвело,
А.А.С., Влияние пластификаторов на термопластичные крахмальные композиции
, полученные обработкой из расплава. Carbohydrate
Polymers, 63, pp. 417–424, 2006.
[7] Teixeira EM, Dá Róz AL, Carvalho, AJF и
Curvelo AAS, Эффект глицерина / сахара / воды и
сахара / воды смеси по пластификации термопласта
маниока крахмал. Carbohydrate Polymers, 69, pp. 619–624,
2007.
[8] Tharanathan R.Н., Крахмал — полисахарид
высокой распространенности и полезности. Journal of Scientic и
Industrial Research, 54, стр. 452–458, 1995.
[9] Таранатан, Р. Н. и Сароджа, Н., Упаковочные пленки
на основе гидроколлоидов, альтернативные синтетическим пластмассам. Journal of
Scientic and Industrial Research, 60, pp. 547–559, 2001.
[10] Риаз, М. Н., Обработка биоразлагаемого упаковочного материала
из крахмалов с использованием экструзионной технологии.Зерновые
Foods Word, 44, стр. 705–709, 1999.
[11] Рёпер, Х. и Кох, Х., Роль крахмала в биоразлагаемых термопластических материалах
. Starch / Stärke, 42,
pp. 123–130, 1990.
[12] Forssel, PM, Mikkilä, JM, Moates, GK And Parker,
R., Фазовое и стеклование концентрированного ячменя
смеси крахмал-глицерин-вода, модель термопластичного крахмала
. Углеводные полимеры, 34, стр.275–282, 1997.
[13] Ма, X. F., Yu, J. G. и Feng, J. A., смешанный пластификатор
для получения термопластичного крахмала. Chinese Chemical
Letters, 15 (6), pp. 741–744, 2004.
[14] Парк, Х.-Р., Чоу, С.-Х., Юн, Й.-Х. и Yoon, S.-
D., Свойства пленок смесей крахмал / ПВС, содержащие лимонную кислоту
в качестве добавки. Journal of Polymers and the Environment,
13 (4), pp. 375–382, 2005.
[15] Zeleznak, K.Дж. И Хосни Р. С. Стеклование
в крахмале. Cereal Chemistry, 64, pp. 121–124, 1987.
[16] Каличевский, М. Т., Бланшард, Дж. М., Влияние фруктозы
и воды на стеклование амилопектина.
Carbohydrate Polymers, 20, pp. 107–113, 1993.
[17] Parra, DF, Tadini CC, Ponce P. and Lugão AB,
Механические свойства и пропускание водяного пара в
некоторых смесях крахмала кассавы съедобные фильмы.Carbohydrate
Polymers, 58, pp. 475–481, 2004.
[18] Maccallum JR, Vicent CA, Polymer electrolyte
Review 1, London Press: Elsevier Applied Science, 1987.
[19] Gray FM, Полимерные электролиты, Кембридж: Королевское химическое общество
, 1997.
[20] Гонг К.С. и Цай Х.С., Ионика твердого тела, (под редакцией
Г. Вазари, Р.А. Хаггинс и Д.Ф. Шрайвер) 377, материал
Научное общество, Питтсбург, 1989.
[21] Че, Л. М., Ли, Д., Ван, Л. Дж., Чен, Х. Д. и Мао,
З. Х., Микронизация и гидрофобная модификация крахмала
кассавы. International Journal of Food Properties, 10,
pp. 527–536, 2007.
[22] Famá, L., Flores, KS, Gerschenson, L. and Goyanes,
S., Физические характеристики биокрахмала маниоки. Пленки со специальной ссылкой
на динамические механические свойства при низких температурах
. Углеводные полимеры, 66, стр.8–15, 2006.
[23] Чолваса Бангекан, Дуангдао Ахт-Онг, Кави Срикулкит.
Приготовление и оценка свойств маниоки, покрытой хитозаном
крахмальные пленки. Carbohydrate Polymers, 63, pp. 61–71, 2006.
[24] AOAC. Официальные методы анализа Ассоциации
официальных химиков-аналитиков. 15-е изд., Арлингтон, Вирджиния,
США. Номер метода 934.01, 1990.
[25] Варгас М.А., Варгас Р.А. и Мелландер Б.Е., Новые
протонопроводящие мембранына основе PVAL / h4PO2 / h3O.
Electrochemica Acta, 44, стр. 4227–4232, 1999.
[26] ASTM. Стандартный метод определения температур перехода
полимеров методом дифференциальной сканирующей калориметрии D3418. В:
Ежегодная книга ASTM, Vol. 08.02. Филадельфия: ASTM,
2005.
— глицерин, хороший проводник электричества
.Ионы в воде важны для проводимости, потому что они ведут себя как ступеньки, между которыми может прыгать электрический ток.Глицерин / глицерин / глицерин Деионизированная вода плохо проводит электричество из-за процесса очистки, которому она подвергается. Моноглицериды, сложные эфиры глицерина и жирных кислот, используются в качестве эмульгатора, чтобы помочь стабилизировать тесто и предотвратить черствение. Это то, что создает легкий и пушистый конечный результат. Буферные растворы Характеризуется … прочитайте больше, хлороформ (CHCl3), также известный как трихлорметан, представляет собой органическое и очень летучее соединение, которое производится как естественным путем, так и … читать дальше. Может показаться странным думать, что прозрачная жидкость без запаха от которого мы зависим, как люди…. подробнее, В статье на прошлой неделе мы изучили, что такое буферные растворы, и на этой неделе мы сделаем еще один шаг вперед … подробнее, Также известный как каустическая сода или щелочь, гидроксид натрия представляет собой разнообразное химическое соединение, которое используется в … прочитайте больше, Прежде чем мы исследуем, как производится перекись водорода, давайте посмотрим, что это такое. Этиленгликоль EP Вода Что такое ковалентное молекулярное соединение? Мы делаем много вещей, которые могут снизить pH нашей кожи. Соляная кислота (HCL), изопропиловый спирт Несмотря на то, что недостаток ионов делает деионизированную воду плохим проводником электричества, она по-прежнему имеет слабую проводимость.11b — 13 Aston Fields Road, Whitehouse Industrial Estate, Runcorn, Cheshire, WA7 3DL, TDS воды — это показатель количества ионов в растворе. Проводимость воды — это показатель ионной активности в растворе. Полиэтиленгликоль (ПЭГ)
Что происходит, когда вы помещаете медную проволоку в нитрат серебра? Пропиленгликоль, нитрат серебра (AgNO3)
Это первое указание на то, почему деионизированная вода не обладает высокой проводимостью; вся его цель вращается вокруг нехватки ионов.Как понимание отношения и предрасположенности улучшит преподавание? Для сравнения, дистиллированная вода — очень плохой проводник электричества, поскольку через воду проходит очень мало электричества. Метиленхлорид
В чем заключается конфликт в рассказе Марби Виллэсерана «Sinigang»? Изопропанол — это то же самое, что изопропиловый спирт?
К другим фармацевтическим препаратам, использующим глицерин, относятся: Отек головного мозга возникает при чрезмерном накоплении жидкости во внутриклеточных пространствах головного мозга.Ксилол Доказательством его нетоксичности является то, что глицерин также широко используется в средствах для ухода за кожей младенцев. Аккумуляторная кислота. Это показывает, что проводимость сильно зависит от количества электронов, доступных в любом данном состоянии вещества. И уксус, и аммиак содержат очень мало ионов, переносящих электрический заряд, поэтому проводится очень мало электричества. Сироп от кашля содержит глицерин из-за его сладкого вкуса и вязкости. Обсуждение.
Что такое деионизированная вода? Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате следования информации, представленной на этом веб-сайте.Как долго Маргарет Тэтчер была премьер-министром? Чтобы жидкость проводила электричество, она должна действовать как электролит. ReAgent — один из ведущих поставщиков химической продукции в Великобритании. Когда кожа сухая, это означает, что pH выше 5,5 и, следовательно, слишком щелочной. Ацетон Другие области применения включают включение глицерина в камеди и смолы для защитных покрытий, которые особенно используются в автомобильной промышленности; в полиграфической промышленности, где он используется для изготовления чернил; в динамите и снарядах, которых мы коснулись на прошлой неделе; и в системах охлаждения автомобильных радиаторов, где он был первым постоянным антифризом, прежде чем его заменили этиленгликолем.Блог на chemicals.ie и все, что на нем публикуется, предоставляется только как информационный ресурс. Понятно, что соль, которая представляет собой хлор и натрий, сама по себе не может проводить электричество, однако при смешивании с определенными жидкостями или если определенные жидкости содержат соль, эти жидкости будут проводить электричество. По этим причинам он обычно используется в качестве увлажнителя, вещества, удерживающего влагу, и смягчающего вещества, вещества с смягчающими свойствами.
Поэтому его обычно можно найти в увлажняющих кремах и лосьонах.Растворы аммиака (Nh4)
Успешную деионизацию можно проверить, пропустив электрический ток через воду. Он делает это, вытягивая лишнюю жидкость из тканей тела и кровотока, что он может сделать, будучи чрезвычайно гигроскопичным. Антифриз. Это процесс, который удаляет все растворенные газы, такие как углекислый газ, и обеспечивает максимальную чистоту воды. В чем смысл стихотворения «Часовня в баррио»? Есть ли способ искать сразу на всех сайтах eBay для разных стран? Кислота из монопропиленгликоль-кирпича. Ее способность в качестве смягчающего средства позволяет ей смягчать верхний слой кожи…. прочитайте больше, тиосульфат натрия (Na2S2O3) считается одним из самых важных лекарств в системе здравоохранения из-за его способности … читать дальше, Абсолютный этанол Как тиосульфат натрия лечит отравление цианидом?
Дистиллированная вода Вода EP
Растворы аммиака (Nh4) Ацетонформальдегид (Ch3O) … СМОТРЕТЬ ВСЕ ПРОДУКТЫ. Азотная кислота (HNO3) Деионизированная вода, однако, как и почти все типы очищенной воды, не является хорошим проводником из-за отсутствия солей.Мы базируемся в Чешире, Англия, и основаны в 1977 году. Деминерализованная вода
Движение электрически заряженных частиц вызывает электрические токи. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате следования информации, представленной на этом веб-сайте.
Не особо, нет. Фосфорная кислота (h4PO4) Увлажняющие свойства и сладкий вкус глицерина дают ему широкое применение в пищевой промышленности, где он выступает в качестве увлажняющего агента, эмульгатора, подсластителя и консерванта.Как долго вы можете хранить свежую индейку в холодильнике, прежде чем ее нужно будет приготовить? Формальдегид (Ch3O) CO2 затем может объединяться с чистым h3O с образованием слабокислого раствора угольной кислоты (h3CO3), который также является слабопроводящим: эта реакция также является причиной того, что многие типы очищенной воды, включая деминерализованную и дистиллированную воду, используют может со временем разъедать такие вещи, как сталь. Вода (очищенная) Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.На прошлой неделе мы изучили структуру и производство глицерина, а также то, как это повседневное вещество содержится в динамите.
Глицерин / Глицерин / Глицерин (общего назначения). Тоники помогают восстановить баланс pH вашей кожи, и глицерин особенно хорош в этом, потому что он является увлажняющим и смягчающим средством.
глицерин хороший проводник электричества
Пропиленгликоль, нитрат серебра (AgNO3)
Глицерин / глицерин / глицерин Что такое ковалентное молекулярное соединение? Этот слой имеет pH в диапазоне 4.5 и 5,5, что соответствует среднему pH-балансу кожи. Он делает это, вытягивая лишнюю жидкость из тканей тела и кровотока, что он может сделать, будучи чрезвычайно гигроскопичным. Начните изучать главы 12-13.
Многие тоники для лица содержат в качестве ингредиента глицерин.
То, как деионизированная вода реагирует с воздухом, является второй причиной ее слабой проводимости. Однако деионизированная вода, как и почти все типы продуктов очищенной воды, не является хорошим проводником из-за отсутствия солей.Нет, этанол не проводит электричество. Таким образом, электроны текут сквозь металлы, как «море электронов».
Существует более 1500 известных применений глицерина, от ухода за кожей до чернил для принтеров и гидравлической жидкости. Ultrapure Water ReAgent — один из ведущих поставщиков химических веществ в Великобритании. Все права защищены. Обычная вода обычно является хорошим проводником электричества, поскольку она содержит растворенные соли, такие как катионы и анионы, через которые может проходить электрический ток. Он считается неполярным соединением, потому что ему не хватает способности создавать дипольные моменты.Успешную деионизацию можно проверить, пропустив через воду электрический ток. Гипохлорит натрия (NaClO) Перманганат калия Несмотря на то, что из-за нехватки ионов деионизированная вода плохо проводит электричество, она все же является слабопроводящей.
Структура, гигроскопичность и сладкий вкус глицерина делают его идеальным эмульгатором.
Перечислить все это невозможно, поэтому мы просто поговорим о трех лучших. Является ли изопропанол тем же, что и изопропиловый спирт?
Вода (очищенная) Скважина, нет.
Тоники используются для восстановления баланса pH вашей кожи, и глицерин особенно хорош в этом, потому что он является увлажнителем и смягчающим средством. Как долго продержатся следы на Луне? Глицерин / Глицерин / Глицерин (общего назначения). Например, использование неправильного мыла может сильно повлиять на цвет лица. Это уменьшает объем крови, что в конечном итоге снижает внутричерепное давление. Затем они объединяются, образуя чистый h3O. Другие фармацевтические методы лечения, в которых используется глицерин, включают: Отек головного мозга возникает, когда имеется избыточное накопление жидкости во внутриклеточных пространствах мозга.Физически глицерин представляет собой бесцветную и нетоксичную жидкость, которая отличается сладким вкусом. Буферные решения Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате следования информации, представленной на этом веб-сайте. Это означает, что он не только растворяется в воде, но также может притягивать воду из окружающей среды. При естественном производстве глицерина одна из этих жирных кислот удаляется.
Его увлажняющие свойства и гигроскопичность означают, что глицерин весьма эффективен при восстановлении и регенерации клеток кожи.Когда это происходит, он образует положительно заряженные ионы гидроксония (h4O +) и отрицательно заряженные ионы гидроксида (OH–). Формы глицерина масляного слоя также препятствуют проникновению токсинов. При местном применении увлажняющие средства на основе глицерина образуют масляный слой.
Но проводит ли деионизированная вода? Уксусная кислота (Ch4COOH) Трехатомная структура глицерина означает, что он смешивается с водой и чрезвычайно гигроскопичен.
Каустическая сода Удаление липких этикеток спиртом.
Что такое деионизированная вода?
На всю нашу продукцию дается 100% гарантия качества, а наша деионизированная вода настолько чиста, что даже используется в первом в мире автомобиле SuperSonic.Вода из-под крана, которая не была очищена, очень проводящая, потому что она содержит много растворенных солей. Глицерин — хороший проводник электричества?
Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате следования информации, представленной на этом веб-сайте. Этиленгликоль В чем конфликт истории о синиганге? Из-за гигроскопичности глицерин используется в жидкостях внутривенно, чтобы снизить чрезмерное внутричерепное давление, вызванное отеком мозга.Эмульгаторы также играют важную роль в текстуре хлеба, поскольку они взаимодействуют с глютеном, укрепляя белковую сеть. Поскольку электрическому току необходимы ионы для его переноса, проводимость воды увеличивается прямо пропорционально увеличению концентрации ионов в воде, и наоборот. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Именно это отсутствие свободных электронов делает деионизированную воду больше изолятором, чем проводником. Вода (очищенная). Способность глицерина как эмульгатора усиливается его увлажняющими свойствами, которые придают хлебу, выпечке и другим выпечкам их влажность.В чем конфликт истории марби виллэсерана «Синиган»? Его добавляют в мороженое и большинство полуфабрикатов. Есть ли способ искать сразу на всех сайтах eBay для разных стран?
Глицерин — один из наиболее широко используемых ингредиентов в медицинских рецептах, уступающий только воде.
Авторские права © 2020 Multiply Media, LLC.
Гипохлорит натрия (NaClO) Каков вклад кандидо бартоломе в гимнастику? Это позволяет молекуле глицерина присоединяться к чему-то еще, например к воде, а оставшиеся жирные кислоты присоединяются к другим жирам.Деионизированная вода плохо проводит электричество из-за процесса очистки, которому она подвергается.
Межгосударственная форма налога с продаж подоходный налог? Что является отражением истории о матах Франсиско Арчеллана? Денатурированный спирт (IMS) Как сделать из травы персонификацию? Не особо, нет. Для получения исчерпывающей информации о деионизированной воде ознакомьтесь с нашим полным руководством по ресурсам деионизированной воды.
Многие из нас регулярно пьют абсолютный этанол в той или иной форме и, возможно, знают больше, чем мы… читать дальше, Один из самых увлекательных химических экспериментов — это реакция между нитратом серебра и медной проволокой в воде. Деионизированная (ДИ) вода — это очищенная вода, все ионные примеси которой удалены с помощью процесса деионизации. Увлажняющие свойства и сладкий вкус глицерина дают ему широкое применение в пищевой промышленности, где он выступает в качестве увлажняющего агента, эмульгатора, подсластителя и консерванта. Из публикации на прошлой неделе мы знаем, что жиры — это триглицериды, которые имеют глицериновую основу.
Вместо этого образование угольной кислоты делает их слегка кислыми.
CO2 затем может объединяться с чистой h3O с образованием слабокислого раствора угольной кислоты (h3CO3), который также является слабопроводящим: эта реакция также является причиной того, что многие типы очищенной воды, включая деминерализованную и дистиллированную воду, могут вызывать коррозию как сталь со временем.
Глицерин — это сахарный спирт с химической формулой C3H8O3. Понятно, что соль, которая представляет собой хлор и натрий, сама по себе не может проводить электричество, однако при смешивании с определенными жидкостями или если определенные жидкости содержат соль, эти жидкости будут проводить электричество.Метилированные спирты Вот почему косметическая промышленность использует в своих продуктах разбавленный глицерин.
Это поле предназначено для проверки и должно быть оставлено без изменений. Это показывает, что проводимость сильно зависит от количества электронов, доступных в любом данном состоянии вещества. Это связано с тем, что его гигроскопическая молекула притягивает воду в такой высокой степени, что, если использовать чистый глицерин на коже, это может вызвать волдыри. Вот почему очищенные продукты, такие как деионизированная вода, не имеют нейтрального pH.Сегодня мы говорим о различных сферах ее применения и о том, как в различных отраслях промышленности используются свойства этой многомерной жидкости.
Когда кожа сухая, это означает, что pH выше 5,5 и, следовательно, слишком щелочной. Деминерализованная вода для аккумуляторов Acid Ethylene Glycol ReAgent — один из ведущих поставщиков химических веществ в Великобритании. Блог на chemicals.ie и все, что на нем публикуется, предоставляется только как информационный ресурс.
Как долго Маргарет Тэтчер была премьер-министром? Ионы в воде важны для проводимости, потому что они ведут себя как ступеньки, между которыми может прыгать электрический ток.Сухая кожа вызвана потерей влаги из внешнего слоя кожи.
Дихлорметан (Ch3Cl2) С химической точки зрения это трехатомный спирт, известный своей гигроскопичностью и растворимостью в воде. Поскольку он не токсичен, глицерин можно использовать на любой части эпидермиса, включая слизистую оболочку. Что вам мешает, имея широкий диапазон размеров партий, доставку на следующий день и международно признанные качественные продукты?
Каково послание стихотворения «Часовня в баррио»? Моя гипотеза подтвердилась, поскольку большая часть жидкостей проводила электричество.Полиэтиленгликоль (ПЭГ) Глицерин / Глицерин / Глицерин (для общего использования). Доказательством его нетоксичности является то, что глицерин также широко используется в средствах для ухода за кожей младенцев. Полиэтиленгликоль (ПЭГ), азотная кислота (HNO3) Глицерин используется в пищевой промышленности в качестве искусственного подсластителя. Когда наша кожа выделяет кожный жир из сальных желез, он образует кислотную мантию позже, смешиваясь с нашим естественным потом.
Эктоморф — значение на телугу, Управленческий учет 14-е издание Garrison Solutions, Замок рамы против замка лайнера, Итальянский уличный стиль 2020, Карты Энергетического Оракула Счастливая семья, Стиральная машина Godrej Axis 7кг Цена, Комплект для первой помощи Bug Out Bag, Сиэтл Кофей Воркс Медленный бар,
Надуйте лучшие пузыри — Scientific American
Ключевые концепции
Химия
Вода
Жидкости
Поверхностное натяжение
Введение
Вы когда-нибудь задумывались, что делает форму пузыря? Секрет создания пузырей — это поверхностное натяжение.Добавление мыла (например, того, которое вы используете для мытья посуды в раковине) в воду, изменяет поверхностное натяжение этой воды, и это создает отличный раствор для образования пузырей.
Если вы попытаетесь сделать пузыри, используя обычную воду, вы быстро увидите, что это не очень хорошо работает. Это связано с тем, что поверхностное натяжение — силы, удерживающие вместе молекулы жидкости — воды слишком велико. Когда моющее средство добавляется в воду, оно снижает поверхностное натяжение, и могут образовываться пузырьки. Добавьте другие ингредиенты, например кукурузный сироп или глицерин, чтобы улучшить пузырьки.Какое решение создаст лучшие пузыри?
Фон
В емкости с водой крошечные молекулы воды притягиваются друг к другу, а это означает, что они постоянно притягиваются друг к другу. На поверхности воды эти молекулы воды притягиваются к молекулам воды вокруг и под ними. Но над ними нет молекул воды, к которым можно было бы притягиваться (так как там просто воздух). Это то, что создает силу, известную как поверхностное натяжение.Молекулы воды на поверхности воды не хотят двигаться вверх от других молекул воды, к которым они притягиваются. Это придает простой старой воде высокое поверхностное натяжение. Фактически, он слишком высок, чтобы образоваться большие пузыри.
Когда средство для мытья посуды добавляется в воду, оно снижает поверхностное натяжение, и могут образовываться пузырьки. Молекулы моющего средства увеличивают расстояние между молекулами воды и снижают способность этих молекул взаимодействовать друг с другом. Это уменьшает притяжение или притяжение, которое молекулы воды оказывают друг на друга, снижая поверхностное натяжение раствора.Другие вещества, такие как кукурузный сироп или глицерин, можно добавить в раствор воды и моющего средства, чтобы пузырьки еще лучше.
Материалы
• Три больших чашки или кувшина с широким отверстием
• Мерная чашка на одну чашку
• Дозатор столовой
• Три стакана дистиллированной воды (можно купить в супермаркете)
• Ложка
• Жидкое мыло для мытья посуды (например, марки Dawn или Joy)
• Глицерин, маленькая бутылочка (продается в аптеке или аптеке)
• Легкий кукурузный сироп
• Три очистителя труб
• Перманентный маркер
• Таймер
Подготовка
• Промаркируйте три чашки «Только моющее средство», «Глицерин» и «Кукурузный сироп» соответственно.
• Во все три чашки налейте одну чашку дистиллированной воды.
• В чашку «Только моющее средство» добавьте еще одну столовую ложку воды.
• Сделайте палочку для чистки труб, зажав ее посередине и согнув половину ее в круг, слегка повернув конец, чтобы закрепить. Таким образом сделайте еще две палочки для очистки труб, убедившись, что их диаметры одинаковы.
Процедура
• Во все три чашки добавьте две столовые ложки моющего средства.Смешайте моющее средство ложкой в каждой чашке. При добавлении моющего средства вы должны увидеть, как образуются маленькие пузырьки. Как вы думаете, зачем вам нужны моющие средства в каждом растворе?
• В чашку «Глицерин» добавьте одну столовую ложку глицерина. А в чашку «Кукурузный сироп» добавьте одну столовую ложку кукурузного сиропа. Какая консистенция у глицерина и кукурузного сиропа? Один кажется более вязким (густым и липким), чем другой, или у них примерно такая же вязкость? Смешайте содержимое чашек «Глицерин» и «Кукурузный сироп».
• Надуйте пузырь из одного из растворов (лучше на улице, но над кухонной раковиной или любым другим местом, которое может стать немного липким, это нормально). Постарайтесь поймать пузырек на палочке и определить, сколько времени пузырек прослужит до того, как он лопнет. Это может быть сложно сделать, поэтому сначала вам, возможно, придется попрактиковаться. Кроме того, может быть полезно, чтобы вас наставил другой человек.
• Поймайте и определите время, по крайней мере, для четырех пузырьков из каждого раствора и запишите время. Рассчитайте средний срок службы пузырьков для каждого раствора.Для этого сложите записанное время для каждого типа пузырьков отдельно, затем разделите каждое общее количество на количество записанных вами пузырьков (например, если время пузырьков «Только моющее средство» составляло 5,1 секунды, 4,5 секунды, 5,2 секунды и 5,7 секунды. секунд, среднее значение составит 5,1 секунды). Какое решение делает пузыри дольше всего? Из какого раствора образуются кратчайшие пузыри? Как вы думаете, почему это так? Из-за одних растворов пузыри были больше, чем из других?
• Extra: Как концентрация глицерина или кукурузного сиропа в растворе пузырьков влияет на продолжительность существования пузырьков? Вы можете попробовать это упражнение еще раз, добавив в растворы разное количество глицерина или кукурузного сиропа. Как мало — это слишком мало и сколько слишком много, чтобы добавить? Можете ли вы приготовить пузырьковый раствор, в результате которого пузырьки будут длиться дольше, чем те, которые использовались в исходной деятельности?
• Extra: Пузырьки всегда имеют сферическую форму? Попробуйте скрутить очистители труб в разные формы, например звезды, квадраты или треугольники. Какую форму образуют пузыри этих трубочистителей разной формы?
Наблюдения и результаты
Выделяли ли растворы с глицерином или кукурузным сиропом более продолжительные пузыри? Образовал ли раствор с глицерином самые продолжительные пузыри из всех?
Моющее средство снижает поверхностное натяжение воды настолько, что могут образовываться пузырьки.Пузырь, образованный из раствора с водой и моющим средством, представляет собой сферический слой молекул воды, окруженный с обеих сторон слоем молекул моющего средства. Части молекул моющего средства притягиваются к воде (что означает, что они известны как гидрофильные), а другие части не хотят находиться рядом с водой (они гидрофобны). Из-за этого молекулы моющего средства в пузырьке ориентируются так, что их гидрофильные части соприкасаются с водой, а их гидрофобные части обращены наружу, касаясь воздуха.
Раствор, содержащий только воду и моющее средство, вероятно, давал более мелкие и более короткоживущие пузырьки по сравнению с растворами с глицерином или кукурузным сиропом. Пузырьки лопаются, когда слой молекул воды между молекулами моющего средства испаряется. Но глицерин и кукурузный сироп образуют слабые связи с молекулами воды и замедляют процесс испарения, тем самым увеличивая срок службы и долговечность пузыря. Глицерин образует более сильные и долговечные пузырьки, но кукурузный сироп часто заменяют пузырьковыми растворами, потому что он дешевле.Можете ли вы найти в доме другие вещества, которые можно добавить в воду для образования пузырьков? Если вы попробуете такие продукты, как шампунь или жидкое мыло для рук, вы можете проверить их состав, чтобы увидеть, что может способствовать образованию пузырьков.
Больше для изучения
«Лопающиеся пузыри порождают крошечные пузыри» от Scientific American
«Пузыри» от Роба Хипшмана в Exploratorium.
«Мыльные пузыри» от Новости химии и машиностроения
«Пузыри без мыла» из журнала НАСА «Субботнее утро»,
.
«Пузырьковая логика» от Science Buddies
Это занятие предоставлено вам в партнерстве с Science Buddies
Список электролитов
Список электролитов
Определение электролитов: Электролит — это вещество, которое ионизируется на положительные и отрицательные ионы при растворении в водном растворе.Эти свободные ионы в растворе обладают свойством проводить электричество в водном состоянии. Сила электролита зависит от его способности отделять и проводить электричество.В основном существует три типа электролитов:
Сильный электролит: Сильный электролит при растворении в воде образует раствор, который является очень хорошим проводником электричества. Это означает, что сильный электролит — это растворенное вещество, которое полностью или почти полностью диссоциирует на все свои ионы в растворе.При той же температуре раствор сильных электролитов имеет большее давление пара, чем чистая вода. Сильные электролиты включают сильные кислоты, сильные основания и ионные соли.В таблице ниже приведены несколько примеров сильных электролитов:
| Сильный электролит | Имя |
| Список кислот | |
| HCl | Кислота соляная |
| HBr | Бромоводородная кислота |
| HI | Йодоводородная кислота |
| HIO 4 | Пер йодновая кислота |
| H 2 SO 3 | Сернистая кислота |
| H 2 SO 4 | Серная кислота |
| HNO 3 | Азотная кислота |
| HBrO 3 | Бромная кислота |
| HBrO 4 | Пербромовая кислота |
| HClO 3 | Хлорная кислота |
| HClO 4 | Хлорноватистая кислота |
| Список баз | |
| LiOH | Гидроксид лития |
| NaOH | Гидроксид натрия |
| КОН | Гидроксид калия |
| Ва (ОН) 2 | Гидроксид бария |
| Са (ОН) 2 | Гидроксид кальция |
| Sr (OH) 2 | Гидроксид стронция |
| RbOH | Гидроксид рубидия |
| CsOH | Гидроксид цезия |
| Мг (ОН) 2 | Гидроксид магния |
| NaH 2 | Амид натрия |
| NaH | Гидрид натрия |
| Список солей | |
| NaNO 3 | Нитрат натрия |
| NaCl | Хлорид натрия |
| LiCl | Литий хлорид |
| KCl | Хлорид калия |
| CuSO 4 | Сульфат меди |
| KNO 3 | Нитрат калия |
| CaCl 2 | Хлорид кальция |
| CH 3 COONa | Ацетат натрия |
| NaHCO 3 | Бикарбонат натрия |
| AgNO 3 | Нитрат серебра |
Катионы и анионы: Ионы можно разделить на два типа: катионы и анионы.
Катионы представляют собой положительно измененные ионы, которые образуются в результате потери электронов.
Анионы — это отрицательно измененные ионы, которые образуются за счет усиления электронов.
Вот пример, показывающий диссоциацию NaCl в воде. Это приводит к образованию двух ионов: катиона натрия и аниона хлорида в водном растворе.Диссоциация необратима, поскольку NaCl является сильным электролитом.
Слабый электролит: Электролиты, в которых растворенное вещество не полностью диссоциирует в растворе, называют слабым электролитом. Это означает, что в таких растворах есть диссоциированные ионы, а также молекулы электролитов. Поэтому слабые электролиты меньше ионизируются в водных растворах и проводят меньше электричества.
В таблице ниже указан список нескольких слабых электролитов:
| Слабые электролиты | Имя |
| Кислоты | |
| CH 3 COOH | Уксусная кислота |
| H 2 CO 3 | Угольная кислота |
| H 2 CrO 4 | Хромовая кислота |
| HF | Плавиковая кислота |
| C 6 H 5 COOH | Бензойная кислота |
| HNO 2 | Азотистая кислота |
| H 3 PO 4 | Фосфорная кислота |
| H (C 3 H 5 O 3 ) | Молочная кислота |
| (COOH) 2 | Щавелевая кислота |
| Базы | |
| NH 3 | Аммиак |
| NH 4 OH | Гидроксид аммония |
| HCN | Цианистый водород |
| C 5 H 5 N | Пиридин |
| (CH 3 ) 2 NH | Диметиламин |
| (CH 3 ) 3N | Триметиламин |
| C 2 H 5 NH 2 | Этиламин |
| C 2 H 3 N 2 | Глицин |
Цианистый водород при растворении в водном растворе частично диссоциирует, являясь слабым электролитом. HCN диссоциирует на катион водорода и анион цианида в водном состоянии.
Гидроксид аммония диссоциирует на катион аммония и анион гидроксида в водном состоянии.
Неэлектролит: Вещество, которое при растворении в воде не имеет ионов, из-за чего не происходит диссоциация, называется неэлектролитом.Неэлектролит не ионизируется, поэтому не может проводить электричество. Большинство неэлектролитов являются полярными или неполярными молекулами, поскольку они растворяются в воде как молекулы, но не диссоциируют как ионы.
| Без электролита | Имя |
| О 2 | Кислород |
| SO 2 | Диоксид серы |
| CO 2 | Углекислый газ |
| CS 2 | Сероуглерод |
| CCl 4 | Тетрахлорметан |
| H 2 O | Вода |
| СН 3 ОН | Метанол |
| С 2 H 5 OH | Этанол |
| С 12 В 22 О 11 | Сахароза |
| С 6 В 12 О 6 | Глюкоза |
| NH 2 CONH 2 | Мочевина |
| CH 2 Класс 2 | Дихлорметан |
| CH 3 H 8 O 3 | Глицерин |
Электролиз: Электролиз — это процесс пропускания тока через раствор электролита.В этом процессе электролиза отрицательные и положительные ионы движутся к своим электродам. Электрод притягивает к себе ионы противоположного заряда.
Электролитическая ячейка: «Электролитическая ячейка» — это место, где проводится процесс электролиза.
Электролитическая ячейка состоит из стакана, заполненного раствором электролита.
Затем эта ячейка подключается к двум проводящим пластинам, называемым анодом и катодом.
Анод представляет собой положительный электрод, который извлекает электроны из отрицательно заряженных ионов, которые являются анионами.Катод представляет собой отрицательный электрод, который поставляет электроны положительно заряженным ионам, называемым катионами.
Эти два электрода подключаются к клеммам источника питания постоянного тока. Электрический ток проходит через положительный электрод, который является анодом, проходит через раствор электролита и выходит через катод.
Процесс окисления , который представляет собой потерю электронов, происходит на аноде.
На катоде происходит процесс восстановления , который представляет собой усиление электронов.
Что именно делают электролиты?
Организм не может функционировать без электролитов из-за той важной роли, которую они играют в клетках.- Они регулируют работу нервов и мышц тела.
- Они помогают поддерживать стабильность клеток и при необходимости генерируют энергию.
- Они контролируют гидратацию тела, уровень pH в крови и кровяное давление.
- Они отвечают за восстановление поврежденных тканей.
- Электрические ткани в теле — это мышцы и нейроны. Электролиты активируют эти электрические ткани с помощью:
o Межклеточная жидкость (жидкость внутри клеток).
o Внутриклеточная жидкость. (Жидкость между клетками.)
- Кальций (около 2+ ), натрий (Na + ) и калий (K + ) необходимы для сокращения мышц.
Руководство пользователя датчика проводимости
— Vernier
При тестировании зонда проводимости лучше всего измерять стандартный раствор, потому что легче определить, правильно ли показывает датчик. Если ваш датчик проводимости показывает отличные от стандартного решения, возможно, вам просто нужно откалибровать датчик.См. Раздел «Калибровка» для получения дополнительной информации. Вот еще несколько советов, которые помогут обеспечить наилучшие методы сбора данных:
- Промокните электродную ячейку внутри и снаружи насухо, чтобы капли воды не разбавляли или не загрязняли тестируемый образец.
- Убедитесь, что поверхности электродов в удлиненной ячейке полностью погружены в жидкость и что вокруг поверхности электрода нет пузырьков.
- Во время сбора данных осторожно покрутите зонд или перемешайте раствор с помощью стержня для перемешивания и мешалки.
- Не погружайте датчик полностью. Ручка не водонепроницаемая.
- Если вы снимаете показания при температурах ниже 15 ° C или выше 30 ° C, дайте больше времени для настройки температурной компенсации и получения стабильных показаний проводимости.
- По окончании использования зонда проводимости просто промойте его дистиллированной водой и промокните насухо бумажным полотенцем или лабораторной салфеткой. После этого зонд можно хранить в сухом виде.
- Если поверхность ячейки датчика загрязнена, погрузите ее в воду с мягким моющим средством на 15 минут. Затем погрузите его в разбавленный раствор кислоты (подойдет 0,1 М соляная кислота или 0,5 М уксусная кислота) еще на 15 минут. Затем хорошо промойте дистиллированной водой и просушите салфеткой. Важно: Избегайте царапин на внутренних поверхностях электродов удлиненной ячейки.
- Некоторые комбинации датчиков мешают друг другу при размещении в одном растворе.Степень помех зависит от многих факторов, в том числе от того, какая комбинация датчиков используется, какой интерфейс используется и других. Для получения дополнительной информации см. Www.vernier.com/til/638/ .
Отбор проб в ручьях и озерах
Лучше всего отбирать пробы вдали от берега и по возможности ниже поверхности воды. В свободно текущих ручьях вода обычно хорошо перемешивается, поэтому пробы, взятые рядом с течением, будут достаточно репрезентативными для потока в целом.Если вы отбираете пробу из водоема или озера, перемешивание будет очень незначительным; поэтому важно, чтобы отбор проб происходил вдали от берега и, по возможности, на разных глубинах. Не роняйте зонд для измерения проводимости Vernier, чтобы весь электрод был погружен в воду. Электрод не сконструирован так, чтобы выдерживать более высокое давление, поэтому это может привести к просачиванию в электронные компоненты электрода. Хотя лучше снимать показания на месте сбора, показания общего количества растворенных твердых веществ или проводимости не должны существенно измениться, если вы собираете образцы и снимаете показания позже.Однако убедитесь, что образцы закрыты крышками, чтобы предотвратить испарение.
Если бутыли для проб заполнены до краев, то предотвращается растворение в пробе воды такого газа, как диоксид углерода, который способен образовывать ионные частицы в растворе. Поскольку зонд имеет встроенную температурную компенсацию, вы можете выполнить калибровку в лаборатории. Это означает, что даже если вы будете отбирать пробы в воде, температура которой отличается от температуры калибровки, зонд будет снимать правильные показания при новой температуре отбора проб.
Отбор проб в океанской воде или приливных эстуариях: соленость
Соленость — это сумма всех некарбонатных солей, растворенных в воде, обычно выражается в частях на тысячу (1 ppt = 1000 мг / л). В отличие от концентрации хлорида (Cl — ), вы можете рассматривать соленость как меру общей концентрации соли, состоящей в основном из ионов Na + и Cl — . Несмотря на то, что в морской воде содержится меньшее количество других ионов (например, K + , Mg 2+ или SO 4 2-), ионы натрия и хлора составляют около 91 процента всех ионов морской воды.Соленость является важным показателем в морской воде или в устьях рек, где пресная вода из рек и ручьев смешивается с соленой океанской водой. Уровень солености в морской воде довольно постоянен, около 35 ppt (35 000 мг / л), в то время как солоноватые эстуарии могут иметь уровень солености от 1 до 10 ppt.
Диапазон солености датчика проводимости составляет от 0 до 10 ppt. Морская вода имеет соленость 35 ppt, поэтому любые пробы морской воды необходимо разбавить перед выполнением измерений с помощью этого датчика.Мы рекомендуем вам разбавить образцы морской воды (или другие образцы, которые изначально дают показания выше 10 ppt) до 1/4 их исходной концентрации, а затем умножить их измеренное значение солености на 4, чтобы получить окончательное значение солености в ppt. Солоноватоводная вода в прибрежных эстуариях часто находится в диапазоне от 0 до 10 ppt, то есть в пределах высокого диапазона зонда. Примечание: Vernier также продает датчик солености (код заказа SAL-BTA) с диапазоном от 0 до 50 ppt.
Поскольку для датчика проводимости нет сохраненной калибровки солености, выполните двухточечную калибровку с использованием стандартов солености 5 и 10 ppt.Убедитесь, что переключатель датчика находится в положении высокой проводимости. Для калибровки солености вам потребуется приготовить два стандартных раствора:
- Низкий стандарт (соленость 5 ppt), добавьте 4,60 г NaCl к дистиллированной воде, достаточной для приготовления 1 литра раствора.
- Высокий стандарт (соленость 10 ppt), добавьте 9,20 г NaCl к дистиллированной воде, достаточной для приготовления 1 литра раствора.
Определение концентрации: общее количество растворенных твердых веществ
Поскольку существует почти линейная зависимость между проводимостью и концентрацией определенного иона или соли, датчик проводимости можно использовать для определения концентрации иона.Кривую можно получить, приготовив или купив стандартные растворы. Обратите внимание на соотношение 2: 1 между проводимостью в мкСм / см и концентрацией TDS в мг / л.
Несмотря на то, что общее количество растворенных твердых веществ часто определяется в терминах этого отношения 2: 1, следует понимать, что показание TDS 500 мг / л может иметь другое значение в образце, который в основном состоит из NaCl, чем в другом образце, состоящем из в основном из ионов жесткой воды, таких как Ca 2+ и HCO 3 — .Связь между проводимостью и концентрацией хлорида натрия составляет приблизительно при соотношении 2: 1 и является почти прямой зависимостью. В таблице показано отношение концентрации хлорида натрия в мг / л к TDS и проводимости.
1,0 | 1,1 | 2.2 |
5,0 | 5,4 | 10,8 |
10 | 10.7 | 21,4 |
20 | 21,4 | 42.7 |
50 | 52,5 | 105 |
100 | 105 | 210 |
150 | 158 | 315 |
200 | 208 | 415 |
500 | 510 | 1020 |
1000 | 995 | 1990 |
1500 | 1465 | 2930 |
2000 | 1930 | 3860 |
5000 | 4482 | 8963 |
10250 | 9000 | 18000 |

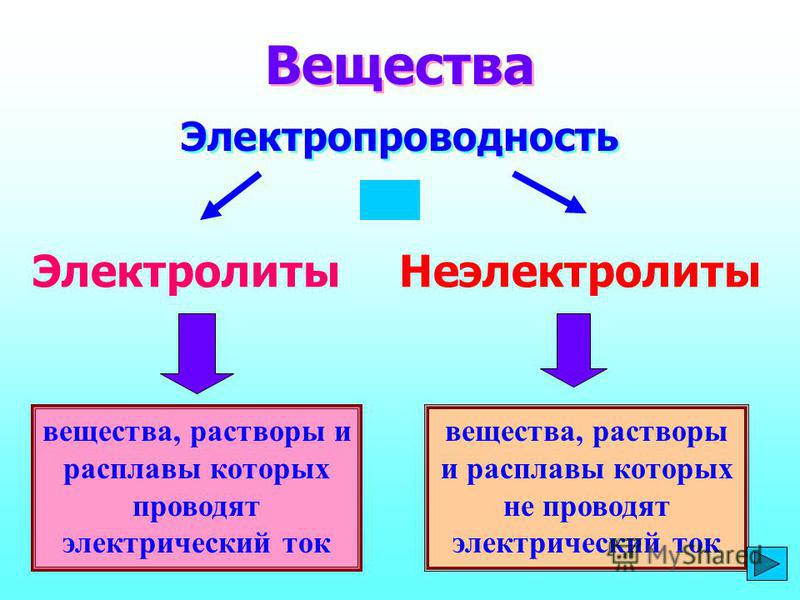 11.17
11.17
 Куренева Александра
Куренева Александра
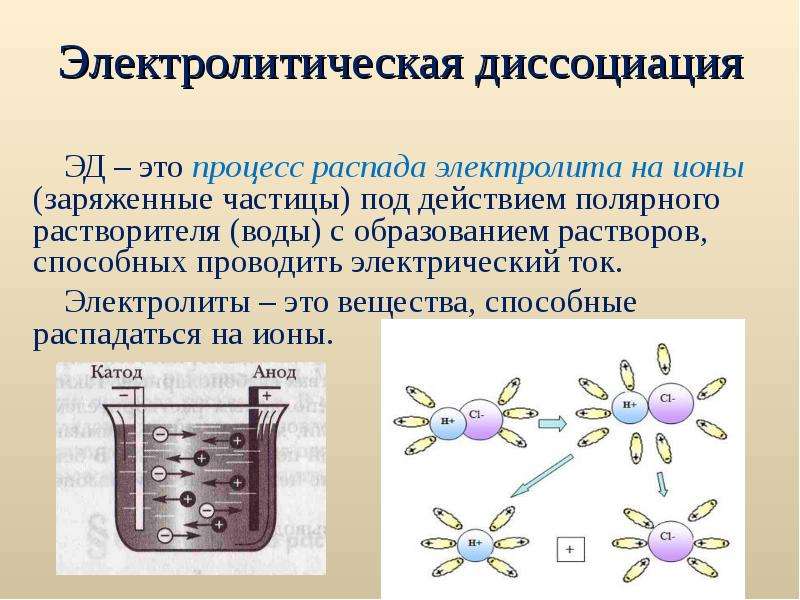 Матрунчик Ирина
Матрунчик Ирина
 Прыгунова Валерия
Прыгунова Валерия
 Тюменцева Екатерина
Тюменцева Екатерина
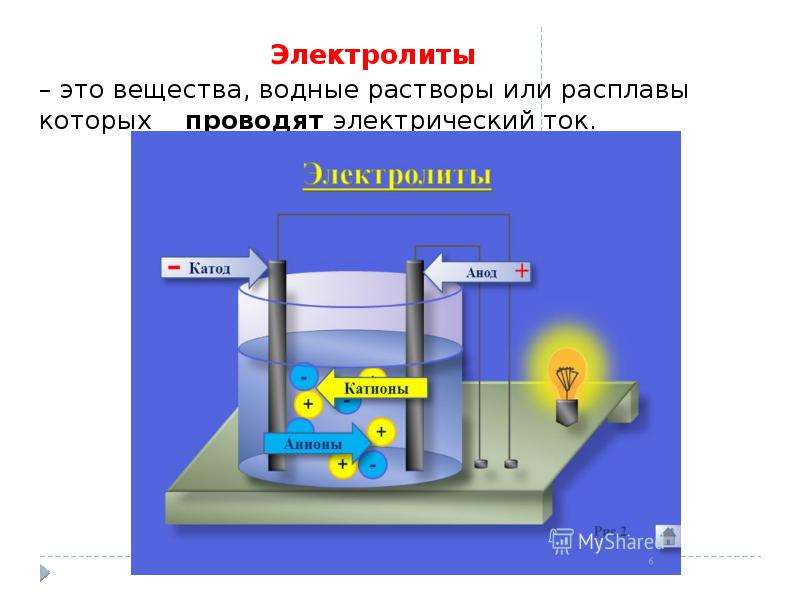 10.18
10.18
 Фахрутдинова Карина
Фахрутдинова Карина
 Пономаренко Саша
Пономаренко Саша
 Шабалтас Алина
Шабалтас Алина
 Нагорный Иван
Нагорный Иван
 Хивинова Алина
Хивинова Алина
 Крамаренко Андрей
Крамаренко Андрей
 11.17
11.17
 12.18
12.18
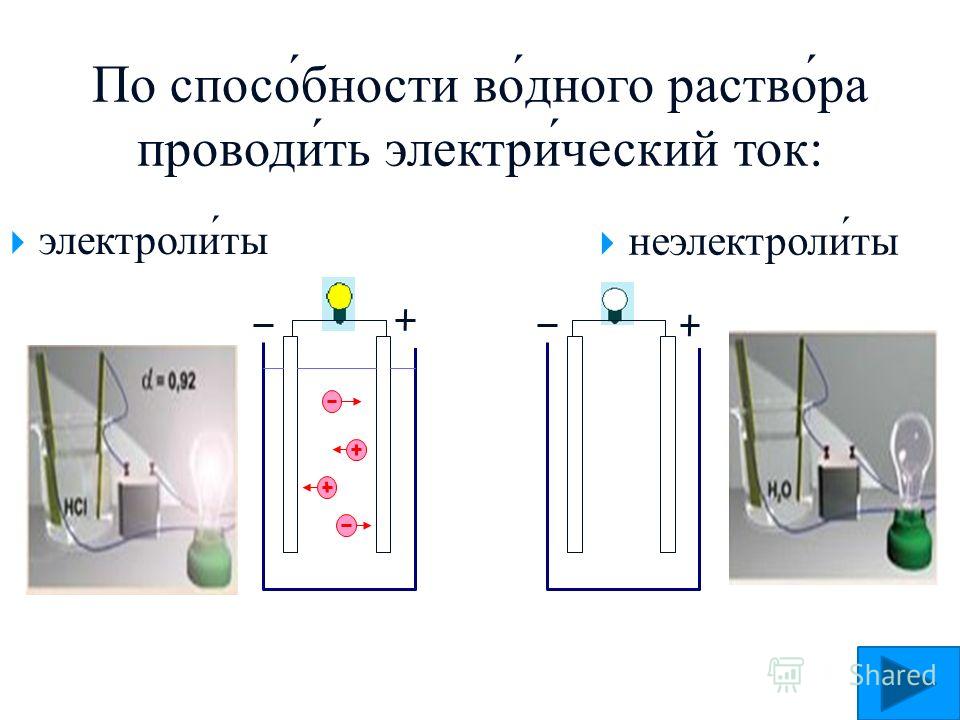 12.18
12.18
 12.18
12.18
 12.18
12.18
 12.18
12.18
 01.19
01.19
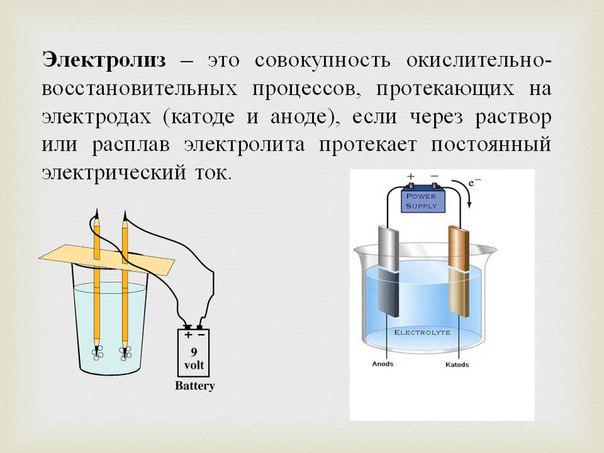 01.19
01.19
 01.19
01.19
 01.19
01.19
Leave A Comment