Гидролиз, подготовка к ЕГЭ по химии
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
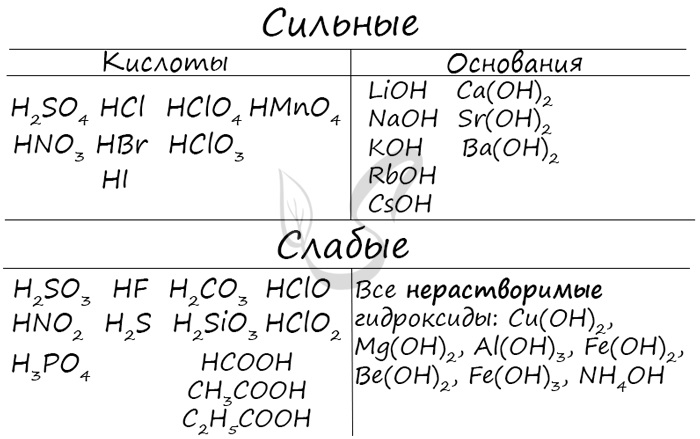
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае — катион. Примеры: AlCl
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
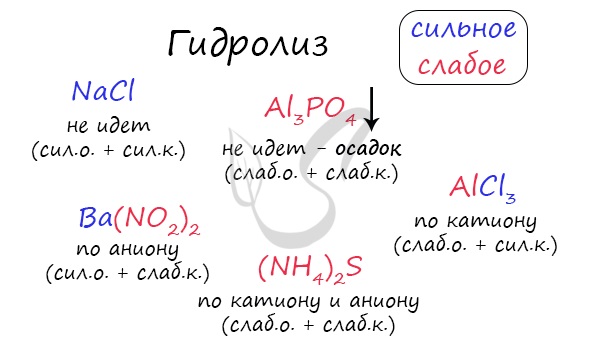
Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO
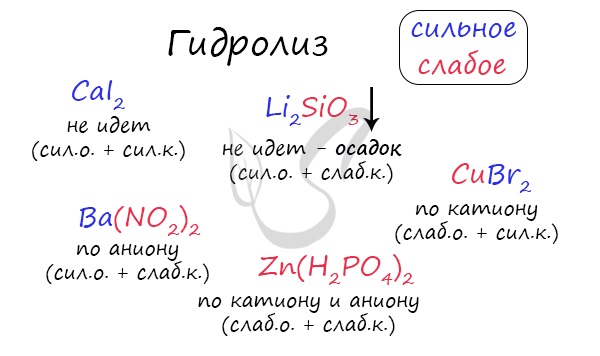
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидрофосфатах гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, NaHSO3, LiHSO4.
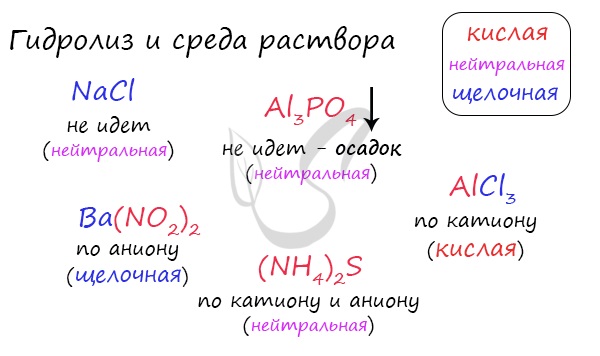
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.

Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды раствора их окраска меняется, что отражает приведенная ниже таблица.
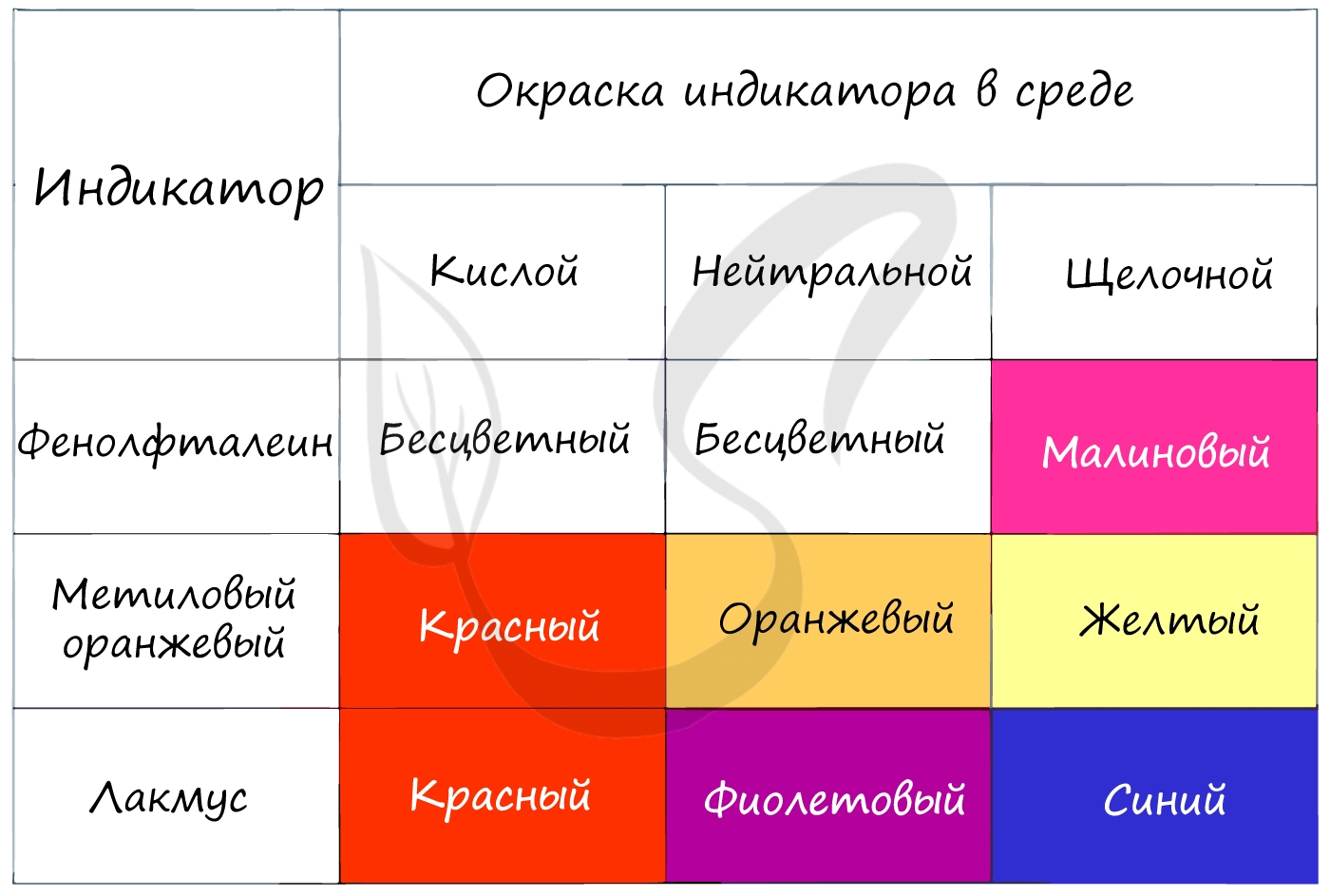
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет настроение ;)
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Гидролиз кислых солей.
NaHSO4 + H2O « H2SO4 + NaOH
K2HAsO4 + H2O « KH2AsO4 +KOH
Совместный гидролиз.
2FeCl3 + 3Na2CO3 + 6H2O « 2Fe(OH)3 +3H2CO3 + 6NaCl
2AlCl3 + K2S + 6H2O « 2Al(OH)3 + 3H2S + 6KCl
Условия подавления гидролиза.
- Повышение концентрации слабого электролита.
- Понижение температуры.
- Если среда кислая, то подкислить, а если щелочная – подщелочить.
Вопрос № 20. Типы окислитльно-восстановительных реакций. Типичные окислители и восстановители.
Обычно различают 3 типа ок-вос р-ций: меж-, внутримолекулярные и диспропорционирования.
К межмолекулярным относятся р-ции, в к-ых ок-ль и вос-ль находятся в разных в-вах и р-ции м-у разными в-вами, в к-ых атомы одного и того же эл-та имеют различные С.О.
K2Cr2O7 + 4H2SO4 + 3Na2SO3 → Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 4H2O
2KMnO4 +6CH3COOH + 5H2S → 2Mn(CH3COO)2 + 2CH3COOK + 5S + 8H2O
К Внутримолекулярнымотносятся р-ции, в к-ых ок-ль и вос-ль находятся в одном и том же в-ве. В этом случае атом с более положительной С.О окисляет атом с меньшей С.О. Такими р-циями являются р-ции термического разложения и р-ции разложения в-в, в к-ых атомы одного и того же хим эл-та имеют разные С.О.
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4NO3 = N2O + 2H2O
Протекание реакций диспропорционирования(самоокисления и самовосстановления) сопровождается одновременным увеличением и уменьшением С.О атома одного и того же эл-та. При этом исходное в-во образует соед-я, одно из к-ых содержит атомы с более высокой, а другое с более низкой С.О.
Br2 + 2NaOH → NaBrO + NaBr + H2O
4Na2SO3 + CuSO4 → 3Na2SO4 + Na2S
Типичные вос-ли:Ме, водород, уголь, СО, Н2S, SO2, сернистая к-та и ее соли, иодо-, бромо-, хлороводородные к-ты, хлорид олова II, сульфат железа II, сульфат марганца II, сульфат хрома III, азотистая к-та, аммиак, NO, фосфористая к-та, альдегиды, спирты, муравьиная и щавелевая к-ты, глюкоза.
Типичные ок-ли: галогены, KMnO4, K2MnO4 манганат калия, оксид марганца IV, дихромат калия K2Cr2O7, K2CrO7, азотная к-та, кислород, озон, пероксид водорода, серная к-та конц, селеновая к-та H2SeO4, оксид меди II, оксид серебра I, оксид свинца IV, ионы благородных Ме, хлорид железа III, гипохлориты, хлораты, перхлораты, царская водка, смесь конц азотной и плавиковой к-т.
Гидролиз солей, среда водных растворов.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na2S = 2Na+ + S2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.

примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H+. Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S2- + H2O ↔ HS− + OH−
HS−+ H2O ↔ H2S + OH−
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn2+, которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn2+ + H2O ↔ Zn(OH) + + H+
Zn(OH) + + H2O ↔ Zn(OH)+ + H+
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na+ соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
Примеры: Ba(NO3)2, KCl, Li2SO4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
Примеры: Zn(NO3)2, Fe2(SO4)3, CuSO4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4+) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H+, и ионы OH− , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 ( − так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO3)3 + 3Na2S + 6H2O= 2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al2S3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Гидролиз | CHEMEGE.RU
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.

Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью оксиления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О=(МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень обратимого гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз. Среда водных растворов: кислая, нейтральная, щелочная.
Гидролиз солей – HIMI4KA

Гидролизом называют взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита. По отношению к гидролизу различают четыре типа солей.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Среда таких растворов щелочная (pH > 7), например:


или в ионной форме
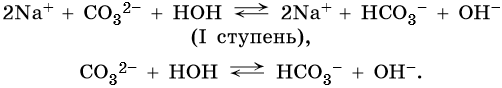
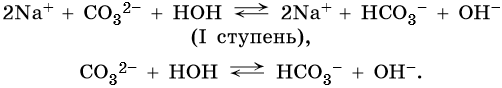
Гидролиз по второй ступени практически не протекает.
Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Среда таких растворов кислая (pH < 7,0), например:


Гидролиз по второй ступени практически не идет.
Уравнение гидролиза по I ступени в ионной форме:
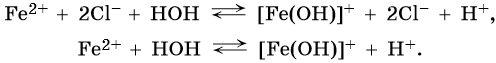
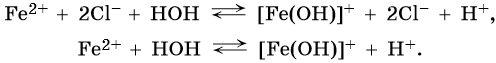
Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и аниону. Такие реакции часто идут полностью и до конца, гидролиз необратим. Реакция и pH среды растворов таких солей зависят от относительной силы кислот и оснований, например:
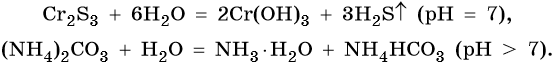
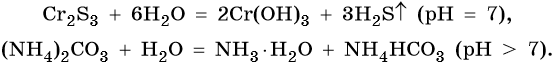
Гидролиз солей подчиняется принципу Ле Шателье и зависит от концентрации и температуры. При разбавлении растворов гидролиз усиливается, а при концентрировании замедляется. С повышением температуры резко возрастает концентрация ионов H+ и OH–, поэтому гидролиз протекает полнее.
Гидролиз кислых солей имеет свои особенности. В этом случае наряду с гидролизом происходит диссоциация аниона кислой соли, поэтому реакция раствора может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Запомним некоторые примеры: Na2CO3 и NaHCO3 — щелочная; Na2SO3 — щелочная, а NaHSO3 — кислая; Na3PO4, Na2HPO4 — щелочная, а NaH2PO4 — кислая.
Перечислим еще ряд солей, определение реакции среды водных растворов которых вызывает затруднения у учащихся. AgNO3, CaCl2 — нейтральная, NaF, (NH4)2CO3 — слабощелочная, NH4F, MgCl2, Mg(NO3)2 — слабокислая. NH4NO2 — гидролиз по катиону и аниону.
Рассмотрим типовой пример задания.
Пример. Установите соответствие между названием соли и ее способностью к гидролизу.


Ацетат калия — соль, образованная анионом слабой уксусной кислоты и катионом сильного основания — гидроксида калия, следовательно, она гидролизуется по аниону. Сульфид калия также образован анионом слабой кислоты (H2S) и катионом сильного основания (KOH). Гидролиз по аниону. Хлорид железа (II) образован анионом сильной кислоты (HCl) и катионом слабого основания Fe(OH)2. Гидролиз по катиону. Сульфид хрома (III) образован катионом слабого основания Cr(OH)3 и анионом слабой кислоты Н2S, поэтому подвергается гидролизу по катиону и аниону.
Ответ: А – 3; Б – 3; В – 2; Г – 4;
2NaHCO3 =(t) Na2CO3 + CO2+ h3O
Nah3PO4=(t) NaPO3 + h3O
2Na2HPO4=(t) Na4P2O7 + h3O
2NaHSO4=(t) Na2S2O7 + h3O
Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулами воды ведет к особой химической реакции ионного обмена, называемой гидролизом солей.
Качественную и количественную стороны гидролиза удобно рассматривать с позиции концепции сильных и слабых электролитов (неассоциированных и ассоциированных). Практически все электролиты, относящиеся к категории слабых в водных растворах, характеризуются тем, что равновесие их диссоциации смещено влево, в сторону недиссоциированных частиц. Иными словами, для них характерна не диссоциация, а наоборот – ассоциация, то есть связывание соответствующими анионами протонов, катионами – ионов ОН— в недиссоциированные частицы. А ионы Н+ и ОН— всегда имеются в воде за счет незначительной диссоциации. Рассмотрим более подробно происходящие процессы на примерах двух солей – СuCl2 и Na2CO3.
Хлорид меди (II) является сильным электролитом, поэтому в водном растворе полностью диссоциирует на ионы:
СuCl2  Cu2+ + 2Cl—
Cu2+ + 2Cl—
Гидроксид меди (II) относится к слабым электролитам, иными словами катион Cu2+ при наличии в растворе ионов ОН— будет активно связывать их в малодиссоциированную частицу CuOH+, нарушая тем самым равновесие диссоциации воды:
Н2О «Н+ + ОН—
Cu2+ + H2O « CuOH+ + H+
В результате, согласно принципу Ле Шателье, усилится диссоциация воды и в растворе увеличится концентрация ионов водорода по сравнению с той, которая была в воде. Раствор становится кислым, его рН<7, подобная ситуация называется гидролизом по катиону.
Разумеется, гидролиз хлорида меди может идти и дальше, по второй ступени:
CuOH+ + H2O « Cu(OH)2 + H+
Однако, принимая во внимание то, что продукты гидролиза по первой ступени подавляют вторую ступень и то, что поляризационное взаимодействие иона Cu2+ с молекулами воды несравненно сильнее, чем иона CuOH+, приходим к следующему важному выводу. При наличии возможности протекания ступенчатого гидролиза, этот процесс реально протекает лишь по первой ступени.
Сходная ситуация возникает и в растворе Na2CO3. В результате полной диссоциации этой соли в растворе образуются ионы СО32-, являющиеся анионами слабой угольной кислоты. Этот ион при наличии в растворе протонов будет активно связывать их в малодиссоциированную частицу НСО3—, нарушая тем самым равновесие диссоциации воды:
Н2О « Н+ + ОН—
СО32- + Н2О « НСО3— + ОН—
В результате усилится диссоциация воды и в растворе увеличится концентрация ионов ОН— по сравнению с той, которая была в воде. Раствор стал щелочным, его рН>7, в этом случае говорят о гидролизе по аниону.
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулями воды ведет к реакции, наз. гидролизом солей.
Гидролиз соли по катиону и по аниону одновременно можно представить в общем виде следующим образом:
Kt+ + A— + H2O  KtOH + HA
KtOH + HA
Гидролиз солей | АЛХИМИК
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН < 7), раствор карбоната калия K2СО3 — щелочную среду (pН > 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН—, которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН— или ионами водорода Н+ из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН—, и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н+ молекулы воды, образуя слабый электролит (кислоту).
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?

Так как ионы Н+ соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН—. Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН— воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4+ связываются с гидроксид-ионами ОН— воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н+. Среда раствора соли NH4I – кислая, рН<7.
Вывод: Соли, образованные сильной кислотой и слабым основанием, при гидролизе показывают кислую реакцию среды, рН < 7.
III. Соли, образованные слабым основанием и слабой кислотой, гидролизуются одновременно и по катиону, и по аниону. Эти соли образованы катионом слабого основания, который связывает ионы ОН— из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н+ из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH: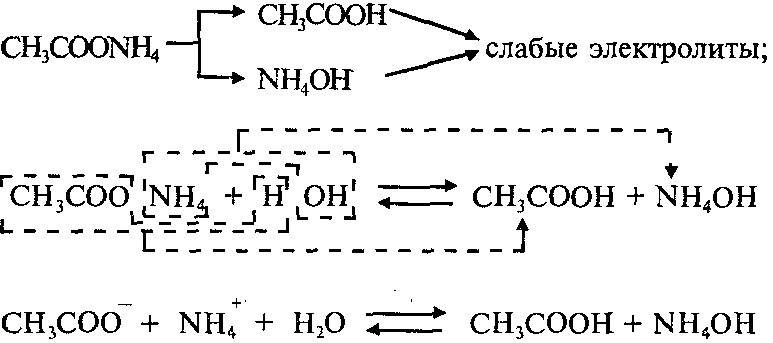
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:


Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
3K2S + 2FeBr3 = Fe2S3 + 6KBr;
Fe2S3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑
Суммируя эти уравнения, получаем:
3K2S + 2FeBr3 + 6Н2O = 2Fe(OH)3↓ + 3H2S↑ + 6KBr
или в ионном виде:
3S2- + 2Fe3+ + 6Н2O = 2Fe(OH)3↓ + 3H2S↑
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н+ или ОН— воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н+ и ОН— в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Первая ступень:

Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН—.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni2+ связывает гидроксид-ионы ОН— воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Первая ступень:

Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН < 7, потому что в растворе увеличивается концентрация ионов Н+.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Похожее
- Классы
- Класс 1 — 3
- Класс 4 — 5
- Класс 6 — 10
- Класс 11 — 12
- КОНКУРСЫ
- BBS
- 000000000000 Книги
- NCERT Книги для 5 класса
- NCERT Книги Класс 6
- NCERT Книги для 7 класса
- NCERT Книги для 8 класса
- NCERT Книги для 9 класса
- NCERT Книги для 10 класса
- NCERT Книги для 11 класса
- NCERT Книги для 12-го класса
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT Exemplar Class 12 9000al Aggar
Agard Agard Agard Agard Agulis Class 12- Классы
- Решения RS Aggarwal класса 10
- Решения RS Aggarwal класса 11
- Решения RS Aggarwal класса 10 90 003 Решения RS Aggarwal Class 9
- Решения RS Aggarwal Class 8
- Решения RS Aggarwal Class 7
- Решения RS Aggarwal Class 6
- Решения RD Sharma
- Решения RD Sharma класса 9
- Решения RD Sharma Class 7 Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- ФИЗИКА
- Механика
- 000000 Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- МАТС
- Теорема Пифагора
- Отношения и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Делительные дроби
- 000 ФОРМУЛЫ
- Математические формулы
- Алгебровые формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- S000
- S0003
- Pегипс Класс 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 11
- Образец образца CBSE pers for Class 12
- CBSE Документ с вопросами о предыдущем году
- CBSE Документы за предыдущий год Class 10
- CBSE Вопросы за предыдущий год Class 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- Решения HC Verma Class 12 Physics
- Решения Lakhmir Singh
- Решения Lakhmir Singh Class 9
- Решения Lakhmir Singh Class 10
- Решения Lakhmir Singh Class 8
- Примечания
- CBSE
- Notes
- CBSE Класс 7 Примечания CBSE
- Класс 8 Примечания CBSE
- Класс 9 Примечания CBSE
- Класс 10 Примечания CBSE
- Класс 11 Примечания CBSE
- Класс 12 Примечания CBSE
- Дополнительные вопросы CBSE 8 класса
- Дополнительные вопросы CBSE 8 по естественным наукам
- CBSE 9 класса Дополнительные вопросы
- CBSE 9 дополнительных вопросов по науке CBSE 9000 Класс 10 Дополнительные вопросы по математике
- Класс 3
- Класс 4
- Класс 5
- Класс 6
- Класс 7
- Класс 8
- Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для физики класса 11
- Решения NCERT для класса 11 Химия Решения для класса 11 Биология
- NCERT Solutions для Класс 12 Физика
- Решения NCERT для 12 класса Химия
- Решения NCERT для 12 класса Биология
- Решения NCERT для 12 класса Математика
- Решения NCERT Класс 12 Бухгалтерский учет
- Решения NCERT Класс 12 Бизнес исследования
- Решения NCERT Класс 12 Экономика
- NCERT Solutions Class 12 Бухгалтерский учет Часть 1
- NCERT Solutions Class 12 Бухгалтерский учет Часть 2
- NCERT Solutions Class 12 Микроэкономика
- NCERT Solutions Class 12 Коммерция
- NCERT Solutions Class 12 Макроэкономика
- Решения NCERT для класса 4 по математике
гидролиза амидов — превращение амидов в карбоновые кислоты
В этом посте мы обсуждаем примеры и механизм кислотного гидролиза амидов, а также некоторые примеры гидролиза амидов, которые представляют собой необычно «легкий». Мы также кратко коснемся гидролиза амидов в основных условиях.
Оглавление
- Гидролиз амидов
- Почему гидролиз амидов такой сложный по сравнению с галогенангидридами и сложными эфирами кислот?
- Гидролиз амидов с использованием водной кислоты: механизм
- Как насчет базового гидролиза амидов
- Вывод: гидролиз амидов
- Примечания: 3 амида, которые необычайно легко сломать
- (Advanced) Ссылки и дальнейшее чтение
1 ,Гидролиз амидов
Амиды являются производными карбоновых кислот, в которых -ОН карбоновой кислоты заменен на -NH 2 , -NHR или -NR 2 амина. Поскольку реакция между карбоновой кислотой и амином с образованием амида также высвобождает воду, это пример «реакции конденсации». [ Мы обсуждаем номенклатуру и синтез амидов здесь ].
Когда две аминокислоты образуют амид, мы называем этот вид пептидом , и если бы вы не жили под камнем, вы бы знали, что белки собираются из аминокислот, связанных пептидными (амидными) связями. ,Амиды — нелегкая функциональная группа, которую можно сломать — и это тоже хорошо, поскольку жизнь на Земле так зависит от них.
Противоположностью реакции конденсации является реакция гидролиза . Гидролиз амидов, как правило, нелегко сделать. Типичные условия для гидролиза амида включают нагревание амида с водной кислотой в течение продолжительных периодов времени.
Циклические амиды называются «лактамами». Подобно тому, как удаление пояса приводит к простой полоске кожи, гидролиз циклического лактама приводит к линейной аминокислоте.(Пример ниже представляет собой «дельта» аминокислоту, поскольку амин является заместителем в четвертом углероде по сравнению с карбонилом — его не следует путать с «аминокислотами» жизни, которые являются «альфа» аминокислотами).
2. Почему гидролиз амидов так сложен по сравнению с галогенангидридами и сложными эфирами кислот? Две причины
Итак, что делает амиды настолько сложными для разрушения по сравнению, скажем, с хлорангидридом или даже сложным эфиром.
Одним из ключевых факторов является способность донора одиночной пары к азоту .Напомним, что одиночные пары на азоте (амины) на меньше на плотно удерживаются, чем одинокие пары на (более электроотрицательном) кислороде и, таким образом, на больше доступны для пожертвования (то есть более базового). Резонансная форма с азот-углеродной двойной связью, таким образом, является более значимой, чем соответствующая резонансная форма для сложных эфиров. [Эта тема может быть знакома: именно поэтому -NH 2 является «более активирующим» заместителем, чем ОН в ароматических кольцах].
Это имеет несколько интересных последствий.Первое состоит в том, что самый простой сайт на амиде — это , а не — одиночная пара на азоте, а вместо этого — кислород .
Протонирование происходит в первую очередь на кислороде!
Вторым интересным следствием является то, что из-за важности этой правой резонансной формы в углерод-азотной связи имеется значительный характер двойной связи. [В предыдущем посте о конъюгации и резонансе мы упоминали, что это проявляется в качестве барьера для вращения в связи C-N около 15-20 ккал / моль]
3.Гидролиз амидов с использованием водной кислоты: механизм
Все это говорит о том, что проведение гидролиза амида не так просто, как расщепление галогенангидрида кислоты. Механизм тоже не такой простой.
Так как же работает реакция?
Как мы уже отмечали, первым шагом является обратимое протонирование амида по кислороду с образованием сопряженной кислоты.
Протонирование карбонильного кислорода делает карбонильный углерод лучшим электрофилом, поскольку связь C-O pi ослабляется и резонансная форма с карбокатионом на углероде становится более значительной.
Следующим этапом является добавление нуклеофила (воды, которая является либо растворителем, либо сорастворителем), образующей новую связь C-O и разрушающей связь C-O pi.
Это приводит к новому виду с положительным зарядом на кислороде. На следующем этапе протон перемещается к атому азота посредством депротонирования кислорода и протонирования азота. [ депротонирование — протонирование, или просто «перенос протона» ]
Полученные в результате положительно заряженные виды азота в настоящее время на значительно лучше покидают группу , поскольку уходящей группой будет HNR 2 (слабое основание ) вместо (-) NR 2 (очень сильное основание).Следовательно, на следующем этапе происходит устранение , образуя новую связь c-o pi и разрушая C-N.
Это приводит к положительно заряженному производному карбоновой кислоты, которое затем депротонируется с получением нейтральной карбоновой кислоты, завершая гидролиз амида.
Этот шестиступенчатый механизм (протонирование, сложение, депротонирование, протонирование, удаление, депротонирование) может показаться смутно знакомым. Это точная последовательность этапов этерификации Фишера и различных других механизмов, идущая под аббревиатурой PADPED.[См. Создание музыки с механизмами]
Все стадии процесса находятся в равновесии, пока не произойдет реакция исключения. После того, как углерод-азотная связь была разорвана, добавление крайне маловероятно, поскольку амин присутствует в качестве сопряженной кислоты и не может действовать как нуклеофил.
Для вашего среднего амида это практически все, что нужно для гидролиза амида. Очевидно, что для первичного амида уходящая группа будет NH 3 , а для вторичного амида — RNH 2 .
4. Как насчет основного гидролиза амидов?
Это кислотный гидролиз. Как насчет основного гидролиза?
Это можно сделать, но обычно это нелегко. Если на этом настаивает грубая сила, это возможно. Гидролиз амидов с основанием требует длительного нагревания.
Вся проблема в том, что для того, чтобы произошла реакция замещения (будь то S N 2 или ацильное замещение), вам нужна достойная уходящая группа. Поскольку это такое сильное основание, депротонированный амин (смущающий и , называемый «амидной», или иногда «металлической амидной основой») в значительной степени является противоположностью достойной уходящей группы.Таким образом, даже с таким сильным основанием, как гидроксид калия и большим количеством тепла, расщепление амида может быть затруднено. [Примечание]
5. Краткое описание: Гидролиз амидов до карбоновых кислот с помощью кислоты или основания
Кислотный гидролиз амидов — это одна из тех химических реакций «мяса и картофеля», которые необходимо знать и понимать. Одним из ключей к полному пониманию механизма является разделение реакции на шесть этапов (PADPED) и сравнение ее с реакциями, которые разделяют этот основной механистический путь (например,грамм. Этерификация Фишера, гидролиз сложных эфиров и многое другое).
Убедитесь, что вы можете извлечь продукт для гидролиза циклического амида (лактама), поскольку реакции циклических молекул (и их обратные, внутримолекулярные реакции) являются обычным кормом для экзаменов.
Эта реакция возникает позже в синтезе аминокислот Штрекера, который начинается с добавления цианид-иона в имин с последующим гидролизом нитрила с образованием карбоновой кислоты.
Спасибо KG за помощь с цифрами в этом посте!
Примечания
Амиды, которые необычайно легко расщепляются (1) — Ацилимидазол
Как мы уже говорили, амиды, как правило, трудно расщепляются.Однако стоит обратить внимание на некоторые исключения, которые помогут проиллюстрировать ключевые моменты здесь.
Одним из особенно легко разрушаемых амидов является ацилимидазол. Все еще есть связь C-N, и есть все еще одинокая пара на азоте.
Так почему же так легко сломаться?
Подумайте о резонансных формах. Что вы заметили в отношении имидазола в резонансной форме слева по сравнению с резонансной формой справа?
В форме резонанса [слева] имидазол является ароматическим.В резонансной форме справа, той, которая имеет частичный характер двойной связи C-N, эта ароматичность теряется.
Это не уникально для N-ацилимидазола. Это также относится к N-ацилпирролу, N-ацилиндолу и другим видам, где одиночная пара «связана» в ароматическом кольце.
Амиды, которые необычайно легко расщепляются (2) — бета-лактамы
Как описано в Зачарованное кольцо , химик из Массачусетского технологического института Джон Шихан и его исследовательская группа чертовски давно синтезировали пенициллин.Проблема заключалась в том, что, как только они сформировали 4-членное амидное кольцо («бета-лактам»), используя обычные условия, эта чертова штука развалилась бы на части. В конечном итоге группа Шихана разработала DCC (а позже и EDC) как очень мягкий метод формирования амидных связей, и проблема была решена.
Бета-лактам необычайно легко разрушить по двум причинам. Во-первых, и наиболее очевидным является тот факт, что резонансная форма, в которой присутствует двойная связь углерод-азот, находится в 4-членном кольце и четырехчленном кольце с двойной связью (т.е.грамм. циклобутен) добавляет еще больше напряжения в систему. Это сводит к минимуму важность вкладчика резонанса с двойной связью C = N. Вторая, более тонкая причина заключается в том, что sp3-гибридизированный углерод на кольцевом соединении (смежном с азотом) придает азоту небольшое уплотнение, так что перекрытие орбиты еще сложнее, чем у линейного амида.
Поскольку орбитальное перекрытие является плохим, углерод-азотная связь не имеет частичного двойного характера, и ее легко разорвать.
амиды, которые необычно легко расщепляются (3) — хинуклидин-амид
Родственным примером является этот «плацдарм» амид хинуклидинон. Хотя это может показаться не таким странным на первый взгляд, когда вы строите модель, вы видите, что одиночная пара азота направлена под странным углом, который предотвращает перекрытие с соседним карбонилом. Кристаллическая структура справа (из этого исследования профессора Брайана Штольца в Калифорнийском технологическом институте) делает отсутствие орбитального перекрытия еще более очевидным.
Помните правило Бредта о нестабильности алкенов-плацдармов? То же самое относится и к амидным азотам на плацдарме.Для того, чтобы «характер частичной двойной связи» присутствовал в этой резонансной форме, должно быть перекрытие орбиты, и, как показала работа Бредта, для разумно малых размеров кольца это перекрытие орбиты чрезвычайно слабо.
Примечание . Некоторые исследования показывают, что разрыв связи C-N не происходит до депротонирования -секундной -ОН-группы.
(Advanced) Ссылки и дополнительные материалы
- α-АМИНОДИЕТИЛАЦЕТИЧЕСКАЯ КИСЛОТА
Steiger, Robert E.
орг. Synth. 1942 , 22 , 13
DOI: 10.15227 / orgsyn.022.0013
Для примера кислотного гидролиза амидов эта процедура в органических синтезах является довольно типичной. Первичный амид кипятят с обратным холодильником в концентрированной HCl в течение 2,5 часов для получения карбоновой кислоты. - Каталитическая эффективность при гидролизе амидов. Двухступенчатый механизм
Ричард Л. Шоуэн, Х. Джаяраман и Ларри Кершнер
Журнал Американского химического общества 1966 88 (14), 3373-3375
DOI: 10.1021 / ja00966a034
Механистическое исследование основного гидролиза амидов поддерживает двухэтапный механизм добавления-удаления. - Синтез и структурный анализ тетрафторбората 2-хинуклидония
Kousuke Tani & Brian M. Stoltz
Природа 441 , с. 731–734 (2006)
DOI: 10.1038 / nature04842 902 Synthen 91343 Syntine 9034 902 чрезвычайно нестабильный «скрученный» амид Штольца и Тани с кристаллической структурой.
Справочник по химической органической реакции
Описание: Обработка иминов водой приводит к их гидролизу до альдегидов (или кетонов) и амина.
Примечания: Реакции способствует использование кислотного катализатора.
Примеры:
Примечания: Обратите внимание, что третий пример является внутримолекулярным.
Механизм: Протонирование иминного азота (шаг 1, стрелки A и B) приводит к образованию иона иминия, который подвергается 1,2-добавлению водой (шаг 2, стрелки C и D). Перенос протона (шаг 3, стрелки E и F) с последующим 1,2-элиминированием аммиака (шаг 4, стрелки G и H) приводит к образованию оксониевого иона, который затем депротонируется с получением нейтрального кетона.
Примечания:
- Кислота полезна, но не является абсолютным требованием для этой реакции.Разумные механизмы можно нарисовать без кислоты.
- «Cl» здесь в h4O + Cl- совершенно не важен, просто для того, чтобы показать баланс заряда для h4O +. Другие противоионы, такие как Br-, HSO3- и т. Д., Будут работать так же хорошо.
- Обратите внимание, что это равновесная реакция и идет в этом направлении из-за большого избытка воды. Это полная противоположность образования имина.
- Конечно, есть и другие разумные способы провести перенос протонов (Шаг 3) и другие виды, помимо Н2О, которые могли бы предположительно выступать в качестве оснований на последнем этапе.
(Advanced) Ссылки и дальнейшее чтение
Имины также известны как «основы Шиффа» в литературе по классической органической химии, отсюда и название в заголовках некоторых из этих работ.
- О механизме образования и гидролиза основания Шиффа
EH Cordes и WP Jencks
Журнал Американского химического общества 1962, 84 (5), 832-837
DOI: 10.1021 / ja00864a031
В этой классической статье авторы приводят доказательства того, что при нейтральном pH потеря h3O является определяющей по скорости, но при кислотном pH атака амина является определяющей по скорости. Максимальная скорость происходит около pH 4. - Механизм гидролиза оснований Шиффа, полученных из алифатических аминов
EH Cordes и WP Jencks
Журнал Американского химического общества 1963, 85 (18), 2843 -2848
DOI : 10.1021 / ja00901a037
В кислой среде реакция протекает через воздействие воды на сопряженную кислоту имина. В нейтральных и базовых условиях определяющим темп шагом является атака воды; в кислых условиях определяющей скорость стадией является разложение промежуточного соединения тетраэдрического присоединения. - Кинетика и механизм гидролиза N-изобутилиденметиламина в водном растворе
Джек Хайн, Джон К. Крейг-младший, Джон Г. Андервуд II и Фрэнсис А.Через
Журнал Американского химического общества 1970, 92 (17), 5194-5199
DOI : 10.1021 / ja00720a032
В этих работах представлены экспериментальные доказательства различных механизмов гидролиза иминов в обеих кислотных и основные средства массовой информации. - Химия Иминов.
Robert W. Layer
Chemical Reviews 1963, 63 (5), 489-510
DOI: 10.1021 / cr60225a003
Раздел IV.A. В этом обзоре («Добавление воды») кратко обсуждается гидролиз иминов, который является хорошим началом для начала. - Гидролиз иминов: кинетика и механизм спонтанного гидролиза N-салицилиден-2-аминотиазолом, вызванного ионами кислот, оснований и металлов 9009 Анади Ч., Бхаскар Дэш и Сомнат Прахарадж
Chem. Soc., Dalton Trans ., , 1981, , 2063-2069,
DOI: 10.1039 / DT9810002063,
, кислота Льюиса (эл.грамм. катализируемый ион металла) гидролиз иминов также возможен, как описано в этой статье. - Кинетическое исследование гидролиза оснований Шиффа, полученных из 2-аминотиофенола
Хассиб Х.Б., Абдель-Кадер Н.С. Исса, Ю.М.
J. Solution Chem 41 , 2036–2046 ( 2012 )
DOI : 10.1007 / s10953-012-9920-6
Очень хорошее тщательное исследование механизма гидролиза конкретного имина, и включает вывод уравнений удельной скорости для кислотно-катализируемого и катализируемого основаниями гидролиза. - Депротонирование основания родопсина Шиффа является обязательным при активации белка G
C. Longstaff, RD Calhoon и RR Rando
PNAS 1 июня 1986 83 ( 12 ) 4209-4213
DOI : 10.1073 / pnas.83.12.4209
Химия иминов имеет огромное значение в биохимии. Видение основано на изомеризации сетчатки, которая связана с белком, называемым родопсином, через иминную связь через боковую цепь амина лизина
Dr. M. Sasvári: Лекции по химии pH солевых растворов (гидролиз) • Дополнительная литература: Отлив, Генерал. Хим: • Кислотно-основные свойства растворов солей: гидролиз • Прогноз погоды: солевой раствор является кислым, основным или нейтральным • рН растворов солей • Равновесия растворимости • Константа продукта растворимости • Растворимость и влияние общего иона • Вычисление осадков Chem Eq 5
Ch4COONa Ацетат-ион Натрий-ион АНИОН КАТИОН Nh5Cl Хлорид-ион Аммоний-ион АНИОН КАТИОН • Соли — сильные электролиты Полная ионизация в воде: Ch4COO- + Na + ацетат натрия Nh5 ++ Cl — Хлорид аммония Реакция с водой: Гидролиз Chem Eq 5
Ацетат ион представляет собой конъюгированное основание — pKb HH + + OA HA OH Основной pH Анионгидролиз Chem Eq 5
Ch4COO- + h 3O Ацетат-ион Основание, конъюгированное с уксусной кислотой ( acid (HA) • Анионгидролиз Ацетат-ион — это конъюгированное основание (реагирует с водой, принимает протон) Ch4COOH + OH- Гидролиз аниона: реакция аниона с водой с образованием слабая кислота и гидроксид-ион.Солевые растворы, содержащие гидролизующий анион и негидролизующий катион (т.е. соль состоит из слабой кислоты и сильного основания), имеют ОСНОВНОЙ рН. Chem Eq 5
H HOOHHH Ион аммония представляет собой конъюгированную кислоту pKa + + + NH NH 4 3 Катионгидролиз Кислотный рН pH Chem Eq 5
Ион аммония сопряженная кислота (B + ) Катионгидролиз Ион аммония представляет собой сопряженное основание (реагирует с водой, берет протон). Nh5 ++ h3O Nh4 + H + Гидролиз катиона: реакция катиона с водой с образованием слабого основания и иона водорода.Солевые растворы, содержащие гидролизующий катион и негидролизующий анион (то есть соль состоит из слабого основания и сильной кислоты), имеют кислотный pH. Chem Eq 5
ацетат Na Уксусная кислота Слабая кислота Конъюгированное основание pKa = 4,7 pKb = 9,3 pKb-lg c pKa-lg c pOH = pH = 2 2 • Расчеты Расчет pH конъюгированного основания абсолютно одинаков в качестве расчета pH слабого основания (см. выше) Chem Eq 5
Аммиак Хлорид аммония Конъюгированная кислота Слабое основание pKa = 9.3 pKb = 4,7 pKb-lg c pKa-lg c pOH = pH = 2 2 • Расчеты Вычисление pH конъюгированной кислоты точно такое же, как и вычисление pH слабой кислоты (см. Выше). Chem Eq 5
Ион аммония: катионный гидролиз pKa = 9,3 Nh5 + + h3O Nh4 + h4O + сопряженная кислота [B +] основание (B) Ацетат-ион: анионный гидролиз pKb = 9,3 Ch4COO — + h3O Ch4COOH + OH-h3O сопряженное основание [A-] кислота (HA) • Катионный и анионный гидролиз Пример: ацетат аммония (Ch4COONh5), если pKa ~ pKb pH является нейтральным, если pKa> pKb pH является ОСНОВНЫМ Оценка pH: КИСЛОТНЫЙ, если pKa
Кислотные соли Кислые соли имеют диссоциируемый H + • Примеры: • NaHSO4 (кислотный pH) • NaHCO3 (основной pH) • Nah3PO4 (кислотный pH) • Na2HPO4 (основной pH) Chem Eq 5
HSO4- Na + + NaHSO4 Кислота серная дипротоновая кислота pKa <2 HSO4- SO42- + H + h3SO4 H + + HSO4- pKa <2 HSO4- SO42- + H + NaHSO4 является сильной кислотой Ium сероводород Ион натрия Гидрогенсульфат-ион Сульфат-ион Полная ионизация NaHSO4 Na + + H + + SO42- Сильная кислота (~ HCl) Chem Уравнение 5
NaHCO3 pKa HCO3- Углекислота является дипротоновой кислотой pKa1 = 6.4 h3CO3 H + + HCO3- pKa2 = 10,3 HCO3- CO32- + H + pKb HCO3- pKb1 = 14-6,4 = 7,6 + h3O NaHCO3 — основной Na + + HCO3- гидрокарбонат натрия Гидрокарбонат (бикарбонат) иона 2-я ионизация: 2 = 10,3 CO32- + H + Если pKa> pKb pH является БАЗОВЫМ Гидролиз: 1 = 7,6 h3CO3 + OH-Chem Уравнение 5
Фосфорная кислота представляет собой трипротонную кислоту pKa1 = 2,1 h4PO4 H + + h3PO4- pKa2 = 7,2 h3 + HPO4- H4 pKa2 = 12,3 HPO42 — PO43 — + H + Nah3PO4 pKa h3PO4- HPO42 — + H + pKb h3PO4- + h3O Nah3PO4 — кислый Na + + h3PO4 — дигидрофосфат натрия Ион гидрофосфата 2-я ионизация: 2 = 7.2 Если pKa
Растворимость солей Chem Eq 5
AgCl (твердое вещество) Ag + (aq) + Cl — (aq) [Ag +] (aq) [Cl-] (aq) K = AgCl (твердое вещество) Насыщенный раствор Продукт растворимости: Ksp = Ag + Cl- осадок Растворимость солей Насыщенные растворы : Солевой раствор находится в равновесии с его твердой формой: Гетерогенное равновесие, так как концентрация твердого AgCl не изменяется: Chem Eq 5
Условия для осадков Фактические концентрации ионов: ионный продукт: Q = Ag + * Cl- Q
Правила растворимости Растворимость: (молярная концентрация насыщенного раствора) Водорастворимые соли: катионы щелочных металлов (IA: Li +, Na +, K +) Все нитраты (NO3-), все ацетаты Большинство хлоридов (Cl-), за исключением AgCl, Hg2Cl2 и PbCl2 Большинство из сульфаты (SO42-), за исключением CaSO4, BaSO4, PbSO4, Hg2SO4, в основном нерастворимые в воде: S2- Все сульфиды, кроме элементов IA и II A и (Nh5) 2S CO32- Все карбонаты, кроме IA и Nh5 + соли PO43- Все фосфаты, кроме IA и Nh5 + соли OH- Все гидроксиды, кроме IA Chem, уравнение 5

Leave A Comment