Nahso4 гидролиз — ХИМИЯ! НУЖНА ПОМОЩЬ! — 22 ответа
В разделе ВУЗы, Колледжи на вопрос ХИМИЯ! НУЖНА ПОМОЩЬ! заданный автором Jar Andreanov лучший ответ это 1.
1)4Na+O2=2Na2O
2)Na2O+h3O=2NaOH
3)NaOH+h3SO4=NaHSO4+h3O
4)NaHSO4 + NaOH(избыток) = Na2SO4 + h3O5)Na2SO4 + Ba(OH)2 = BaSO4(осадок) + 2NaOH6)NaOH + HCl = NaCl + h3O
7)NaCl+h3SO4=Na2SO4+HCl
2. Этот химический элемент Бром! заряд его ядра равен +35, заряд ядра определяется путём определения порядкового номера элемента с плюсов, а вот количество нейтронов уже будет-35.
3. 1) AlCl3+3AgNo3=Al(NO3)3+3AgCl
полное ионное : Al3+ + 3Cl- + 3Ag+ + 3NO3- = Al3+ + 3NO3- + 3AgCl (нерастворим) сокращенное ионное : 3Cl- + 3Ag+ = 3AgCl
2) 2KNO3 + Na2SO4= 2NaNO3+K2SO4
Ионное: 2K + 2NO3 + 2Na +SO4 = 2Na + 2NO3 + 2K+ SO4
всё сокращается
3) CuSO4+K2CO3=CuO+CO2+K2SO4
Ионное: Cu(+2)+SO4(-2)+2K(+)+CO3(-2)=Cu(+2)+O(-2)+C(+4)+2O(-2)+2K(+)+SO4(-2)
4) Ca(NO3)2 + K2CO3 = CaCO3 + 2KNO3
5) Ca(NO3)2 + (Nh5)2CO3 = CaCO3в + 2Nh5NO3
Ионное: сам просто прибавлять разные элементы, а сверху заряд пишешь
Скажи спасибо ))
Привет! Вот подборка тем с ответами на Ваш вопрос: ХИМИЯ! НУЖНА ПОМОЩЬ!
Ответ от Невроз[гуру]
3) Гидролиз солей
а) AlCl3 + h3O = AlOHcL2 + HCl
Al(+3) + HOH = AlOH(+2) + H(+) сокращённое ионно-молекулярное уравнение, среда кислая,
б) 2CuSO4 + 2h3O = (CuOH)2SO4 + h3SO4
Cu(+2) + HOH = CuOH(+) + H(+) , среда кислая,
в) K2CO3 + h3O = KHCO3 + KOH
CO3(-2) + HOH = HCO3(-) + OH(-) . среда щелочная
г) (Nh5)2CO3 + 2h3O <=> 2Nh5OH + h3CO3
. константа диссоциации аммиака больше константы диссоциации угольной кислоты — среда слабощелочная .
CO3(-2) + HOH <=> HCO3(-) + OH(-)
.
Кислые соли на Википедии
Посмотрите статью на википедии про Кислые соли
Ответить на вопрос:
22oa.ru
Тема урока «Гидролиз солей»
Разделы: Химия
Класс – 11
Предмет – химия
Цели:
- Образовательные –
Тип урока: изучение нового материала.
Методы обучения: эвристический, частично-поисковый.
Оборудование и реактивы: таблицы “Окраска индикаторов”, “Степень диссоциации кислот и щелочей”, “Растворимость солей, кислот и оснований в воде”; на столах учащихся: растворы солей NaCl, АlCl3, Nа2СО3, NaHSO4, NaHCO3, Na3PO4, Na2HPO4, NaH2PO4, универсальная индикаторная бумага.
Планируемые результаты обучения: на изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и образование кислых или основных солей в этом процессе; объяснять процессы, протекающие в растворах, применять принцип Ле-Шателье для объяснения процессов гидролиза.
Ход урока
| Этапы урока | Деятельность учителя | Деятельность учащихся | Время |
| 1. Актуализация знаний | Читают и анализируют стихотворение, определяют тему урока и задачи. | 2 мин. | |
| 2. Изучение нового материала | Организует выполнение лабораторной работы №1: Испытайте предложенные растворы солей NaCl, АlCl3, Nа2СО3 универсальной индикаторной бумагой. Определите характер среды. Объясните полученные результаты. Предоставляет инструкцию, напоминает учащимся о правилах ТБ. | Выполняют лабораторный опыт №1. Определяют характер среды. Приходят к выводу о недостаточности имеющихся знаний для объяснения полученных результатов. | 37 мин. |
| Организует беседу для решения
возникших у учеников затруднений в объяснении
полученных результатов: — Что происходит с солями в растворе? (диссоциация) — Какие частицы находятся в растворе? (катионы и анионы) — Возможно ли взаимодействие ионов соли с полярными молекулами воды? В каких случаях оно возможно? (образование малодиссоциирующих частиц) |
Приходят к выводу о взаимодействии ионов солей с молекулами воды, в результате чего в растворе накапливаются ионы водорода или гидроксид-ионы. | ||
| Организует работу учащихся с текстом “Гидролиз солей” (Приложение 2) [2], консультирует учащихся. | Изучают процессы гидролиза солей, записывают уравнения гидролиза. Работают в группах, при необходимости обращаются к учителю за консультацией. | ||
| Организует выполнение лабораторного
опыта №2. |
Выполняют лабораторный опыт №2.
Анализируют состав солей, процессы гидролиза,
записывают уравнение гидролиза: НСО3— + НОН<—> Н2СО3 + ОН— |
||
| Организует беседу по вопросам: - Угольная кислота нестойкая. Почему же не наблюдается выделение углекислого газа? (обратимый процесс) — Какому принципу подчиняется состояние обратимых систем? (принцип Ле-Шателье) — Как усилить гидролиз? (разбавление, повышение температуры) |
Отвечают на вопросы. Применяют принцип Ле-Шателье для гидролитических процессов. |
||
| Организует выполнение лабораторного опыта №3: Испытайте индикаторной бумагой растворы фосфата натрия Na3PO4, гидрофосфата натрия Na2HPO4 и дигидрофосфата натрия NaH2PO4. Запишите полученные результаты. | Выполняют лабораторный опыт №3.Записывают полученные результаты. | ||
| Представляет учащимся таблицу (Приложение 3) для объяснения
полученных результатов. Приводит учащихся к выводу о том, что характер среды в растворах кислых солей зависит от соотношения констант диссоциации и гидролиза. |
Анализируют таблицу и записывают
процессы, происходящие в растворах солей. 1. Na3PO4 —> 3Na+ + РО43- РО43-+ НОН<—> НРО42-+ОН— 2. Na2HPO4 —> 2Na+ + HPO42- HPO42-<—> H+ + РО43- HPO42- + HOH <—> H2 PO4 — + OH— 3. NaH2PO4 —>Na+ + H2PO4- H2PO4— <—> H+ + HPO42- H2PO4— + HOH <—> H3 PO4 + OH- |
||
| Предоставляет учащимся тестовые задания (Приложение 4). | Работают в группах, обсуждают результаты, осуществляют взаимопроверку и самопроверку. | 5 мин. | |
| 4. Домашнее задание | Предлагает и комментирует домашнее задание: выучить теорию и ответить на вопрос: Возможна ли реакция между цинком и хлоридом цинка? | Записывают домашнее задание. | 1 мин. |
Литература.
1. Габриелян О.С. Настольная книга для учителя химии. 11 класс. – М.: Блик плюс, 2000.
2. Можаев Г.М. Гидролиз солей http://www.kontren.narod.ru/lttrs/gydrol.htm
3. Сгибнева Е.П., Скачков А.В. Современные открытые уроки химии (Серия “Школа радости”) – Ростов н/Д: изд-во “Феникс”, 2002.
4. Четверова Л.М. Гидролиз солей http://him.1september.ru/2004/08/21.htm
8.07.2013
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Гидролиз солей – HIMI4KA

Гидролизом называют взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита. По отношению к гидролизу различают четыре типа солей.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Среда таких растворов щелочная (pH > 7), например:
или в ионной форме
Гидролиз по второй ступени практически не протекает.
Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Среда таких растворов кислая (pH < 7,0), например:
Гидролиз по второй ступени практически не идет.
Уравнение гидролиза по I ступени в ионной форме:
Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и аниону. Такие реакции часто идут полностью и до конца, гидролиз необратим. Реакция и pH среды растворов таких солей зависят от относительной силы кислот и оснований, например:
Гидролиз солей подчиняется принципу Ле Шателье и зависит от концентрации и температуры. При разбавлении растворов гидролиз усиливается, а при концентрировании замедляется. С повышением температуры резко возрастает концентрация ионов H+ и OH–, поэтому гидролиз протекает полнее.
Гидролиз кислых солей имеет свои особенности. В этом случае наряду с гидролизом происходит диссоциация аниона кислой соли, поэтому реакция раствора может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Запомним некоторые примеры: Na2CO3 и NaHCO3 — щелочная; Na2SO3 — щелочная, а NaHSO3 — кислая; Na3PO4, Na2HPO4 — щелочная, а NaH2PO4 — кислая.
Перечислим еще ряд солей, определение реакции среды водных растворов которых вызывает затруднения у учащихся. AgNO3, CaCl2 — нейтральная, NaF, (NH4)2CO3 — слабощелочная, NH4F, MgCl2, Mg(NO3)2 — слабокислая. NH4NO2 — гидролиз по катиону и аниону.
Рассмотрим типовой пример задания.
Пример. Установите соответствие между названием соли и ее способностью к гидролизу.
Ацетат калия — соль, образованная анионом слабой уксусной кислоты и катионом сильного основания — гидроксида калия, следовательно, она гидролизуется по аниону. Сульфид калия также образован анионом слабой кислоты (H2S) и катионом сильного основания (KOH). Гидролиз по аниону. Хлорид железа (II) образован анионом сильной кислоты (HCl) и катионом слабого основания Fe(OH)2. Гидролиз по катиону. Сульфид хрома (III) образован катионом слабого основания Cr(OH)3 и анионом слабой кислоты Н2S, поэтому подвергается гидролизу по катиону и аниону.
Ответ: А – 3; Б – 3; В – 2; Г – 4;
himi4ka.ru
7.4. Гидролиз солей
Химическое обменное взаимодействие ионов растворен-ной соли с водой, приводящее к образованию слабодисcоци-ирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КС1. Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
CH3COONa → СН3СОО – + Na+
Вода, как уже указывалось, является слабым электролитом:
Н2О ↔ Н+ + ОН –
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
СН3СОО – + Н+↔ СН3СООН
Таким образом, гидролиз в ионной форме можно представит уравнением
СН3СОО – + Н2О ↔ СН3СООН + ОН –
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
β = сгидр/с
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
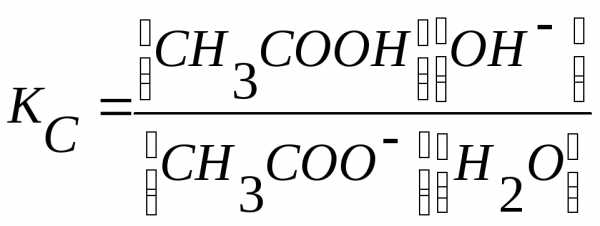
или в общем виде для реакции гидролиза аниона слабой кислоты
А— + Н2О ↔НА + ОН –
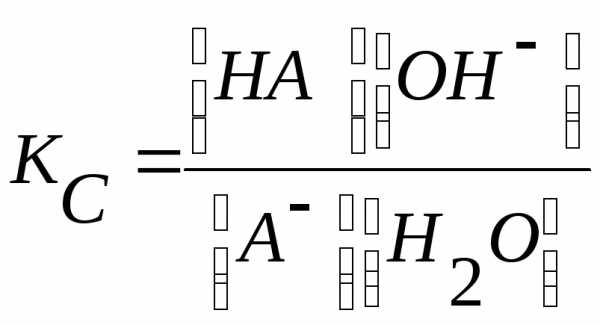
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
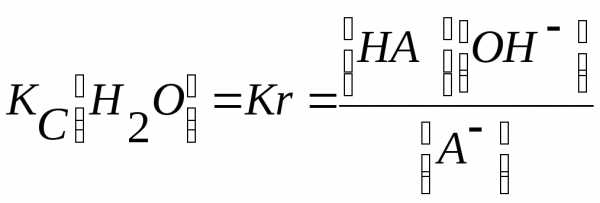
Умножая числитель и знаменатель на равновесную концентрацию ионов водорода, получаем
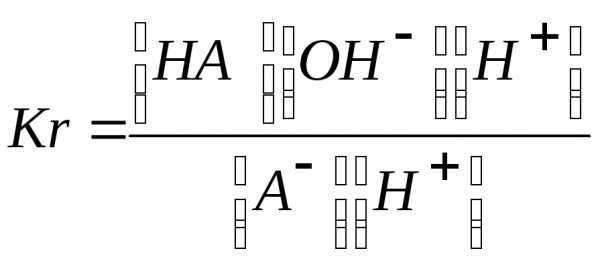
Как указывалось ранее, [OH –][ Н+] ≈ КВ, а отношение — [Н+][А—] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Кr = КВ / КД
Если выразить концентрацию ионов и молекул при установлении равновесия
СН3СОО – + Н2О ↔ СН3СООН + ОН –
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
[СН3СООН] = [ОН –] = βс, а [СН3СОО –] = (1 — β)с
Подставив эти значения в уравнение
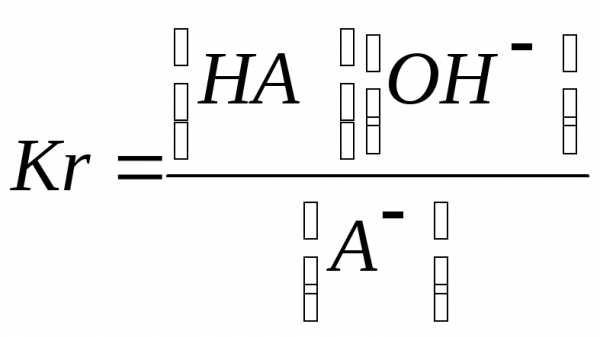
получим:
Кr = КВ/КД = β2с / ( 1 — β).
Если β << 1,то
Кr = β2с
Отсюда следует, что
Как видно, степень гидролиза возрастает с уменьшением концентрации гидролизующегося иона. По уравнению Кr = β2с можно найти равновесную концентрацию гидроксид-иона:
[ОН—]
= βс = 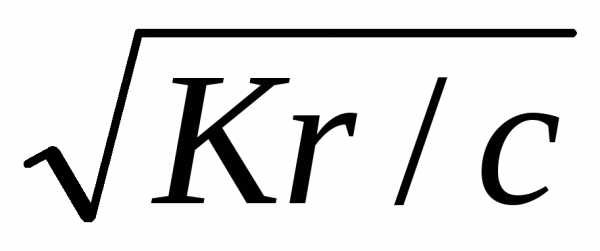
и
рОН = -lg[OH—]
= -lg 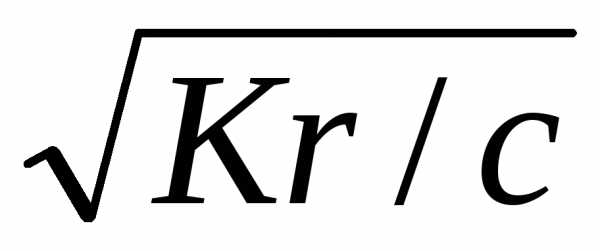 =
— lg
=
— lg 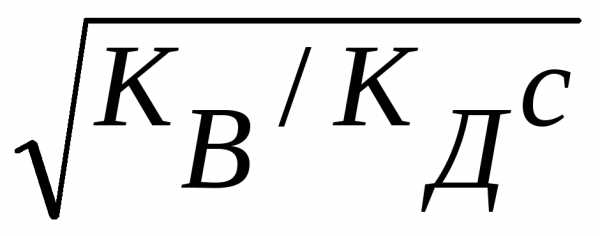
Отсюда легко вычисляется рН раствора соли
рН
= рКВ — рОН = рКВ -lg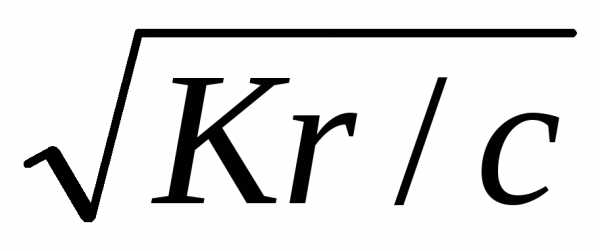
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
СО32- + Н2О↔НСО3– +ОН –
НСО3 – + Н2О ↔ Н2СО3 + ОН–
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО32 – , при 298 К
Кr1 = 2∙10 – 4 ; Кr2 = 2,2-10 – 8
Поэтому, при расчете концентраций ионов [ОН–] или [Н+], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона СО32- по первой ступени
СО32 — + Н2О↔ НСО3– + ОН –
Равна
а константа гидролиза иона РО43 – по первой ступени
РО43 – + Н2О↔НРО42 – + ОН—
равна
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
NH4C1 → NH4+ + С1 –
Гидролизу подвергается ион слабого основания NH4+
NH4+ + Н2О↔NH4OH + H+
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Равновесную концентрацию ионов водорода можно вычислить из уравнения:
[Н+]
= βс = 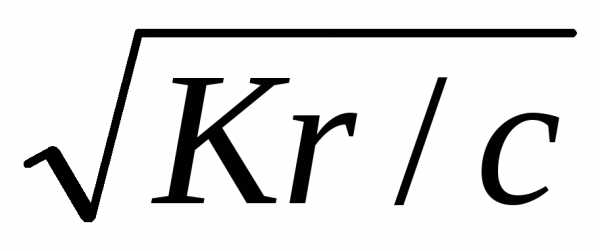
Соответственно водородный показатель среды рассчитывается по уравнению:
РН
= -1g[Н+]
= — 1g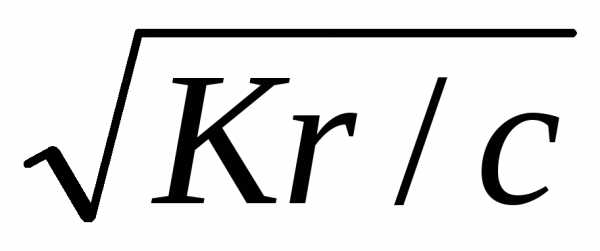 =-1g
=-1g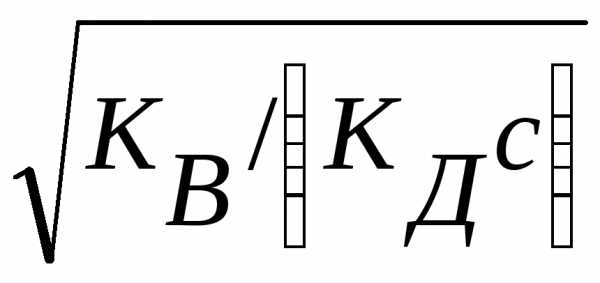
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
NH4F → NH4+ + f—
NH4+ + H2O↔NH4OH + H+
F — + Н2О↔ HF + OH –
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О, так и слабой кислоты КД,К
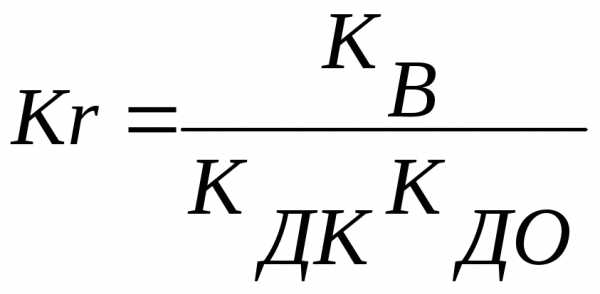
Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли:
[H+] =
рН=
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K+ и анионы CN. Катионы K+ не могут связывать ионы ОН воды, так как КОН — сильный электролит. Анионы же CN связывают ионы H+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO32-, связывая водородные ионы воды, образуют анионы кислой соли НСО3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO32– + H2O↔ HCO3– + OH –
или в молекулярной форме
NA2CO3 + H2O↔ NaHCO3– + NaOH
studfiles.net
Гидролиз | CHEMEGE.RU
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты. Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью оксиления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- +OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 +NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 +OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 +NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей.Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О=(МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень обратимого гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз. Среда водных растворов: кислая, нейтральная, щелочная.
Поделиться ссылкой:
chemege.ru
Ответы@Mail.Ru: Гидролиз сульфита натрия
Сульфит натрия — это соль слабой кислоты и сильного основания Уравнения реакций (обратите внимание на обратимость всех реакций) : 1)Первая ступень: Молекулярное Na2SO3 + h3O <=> NaHSO3+NaOH Ионное: 2Na(+) + SO3(2-) + h3O <=> 2Na(+) + HSO3(-) + OH(-) Краткое ионное: SO3(2-) + h3O <=> HSO3(-) + OH(-) 2) Вторая ступень NaHSO3 + h3O <=> h3SO3+NaOH Ионное: Na(+) + HSO3(-) + h3O <=> Na(+) + h3SO3 + OH(-) Краткое ионное: HSO3(-) + h3O <=> h3SO3 + OH(-) Сернистая кислота неустойчивая, поэтому она частично распадается с выделением оксида серы (IV) h3SO3 <=> SO2 + h3O
а поискать? <a rel=»nofollow» href=»http://otvet.mail.ru/question/23680514/» target=»_blank»>http://otvet.mail.ru/question/23680514/</a> тут не совсем то, но на путь истинный хотя бы натолкнуть должно
Иди сюда: <a rel=»nofollow» href=»http://www.hydorlysis.narod.ru» target=»_blank»>www.hydorlysis.narod.ru</a> В твоем случае это сильное основание+слабая кислота.
touch.otvet.mail.ru
Ответы@Mail.Ru: помогите осуществить гидролиз солей
1) Соль слабого основания (Zn(OH)2) и сильной кислоты (h3SO4). Гидролиз по катиону. Среда кислая. \2ZnSO4 + 2h3O = (ZnOH)2SO4 + h3SO4 Zn2+ + h3O = ZnOH+ + H+ (ZnOH)2SO4 + 2h3O = 2Zn(OH)2 + h3SO4 ZnOH+ + h3O = Zn(OH)2 + H+ 2) Соль слабого основания (Cu(OH)2) и сильной кислоты (HCl). Гидролиз по катиону. Среда кислая. CuCl2 + h3O = Cu(OH)Cl + HCl Cu2+ + h3O = CuOH+ + H+ Cu(OH)Cl + h3O = Cu(OH)2 + HCl CuOH+ + h3O = Cu(OH)2 + H+ 3) Соль сильного основания (NaOH) и слабой кислоты (h3SO3). Гидролиз по аниону. Среда щелочная. Na2SO3 + h3O = NaHSO3 + NaOH SO3 2- + h3O = HSO3 — +OH- NaHSO3 + h3O = h3SO3 + NaOH HSO3 — +h3O = h3SO3 + OH- 4) Соль сильного основания (КOH) и слабой кислоты (h4РO4). Гидролиз по аниону. Среда щелочная. K3PO4 + h3O = K2HPO4 + KOH PO4 3- + h3O = HPO4 2- + OH- K2HPO4 + h3O = Kh3PO4 + KOH HPO4 2- + h3O = h3PO4 — +OH- Kh3PO4 + h3O = h4PO4 + KOH h3PO4 — +h3O = h4PO4 + OH- 5) Соль слабого основания (Zn(OH)2) и сильной кислоты (HCl). Гидролиз по катиону. Среда кислая. ZnCl2 + h3O = ZnOHCl + HCl Zn2+ + h3O = ZnOH+ + H+ ZnOHCl + h3O = Zn(OH)2 + HCl ZnOH+ + h3O = Zn(OH)2 + H+ 6) Соль слабого основания (Fe(OH)2) и сильной кислоты (h3SO4). Гидролиз по катиону. Среда кислая. 2FeSO4 + 2h3O = (FeOH)2SO4 + h3SO4 Fe2+ + h3O = FeOH+ + H+ (FeOH)2SO4 + 2h3O = 2Fe(OH)2 + h3SO4 FeOH+ + h3O = Fe(OH)2 + H+ 7) Соль слабого основания (Ni(OH)2) и сильной кислоты (HNO3). Гидролиз по катиону. Среда кислая. Ni(NO3)2 + h3O = (NiOH)NO3 + HNO3 Ni2+ + h3O = NiOH+ + H+ (NiOH)NO3 + h3O = Ni(OH)2 + HNO3 NiOH+ + h3O = Ni(OH)2 + H+ Во всех случаях гидролиз ступенчатый, идет в 2 стадии, т. е. по 2 ступеням, кроме случая (4) — здесь по 3 ступеням, т. к. фосфорная кислота — 3-основная. Гидролиз по первой ступени идет значительно сильнее, чем по второй и, тем более, по третьей, поэтому часто записывают гидролиз только по первой ступени. Гидролиз — обратимый процесс, поэтому во всех уравнениях вместо знака равенства нужен знак обратимости (просто в «Ответах» я не могу его поставить)
2ZnSO4 + 2h3O = Zn(OH)2 + h3SO4 CuCl2 + 2h3O = Cu(OH)2 + HCl и так далее, оч легко
исчерпывающий ответ Татьяны Ивановой
touch.otvet.mail.ru

Leave A Comment