Гидроксид железа (III) | CHEMEGE.RU
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Понравилось это:
Нравится Загрузка. ..
..
Гидроксид железа (II), характеристика, свойства и получение, химические реакции
Гидроксид железа (II), характеристика, свойства и получение, химические реакции.
Поделиться в:
Гидроксид железа (II) – неорганическое вещество, имеет химическую формулу Fe(OH)2.
Краткая характеристика гидроксида железа (II)
Физические свойства гидроксида железа (II)
Получение гидроксида железа (II)
Химические свойства гидроксида железа (II)
Химические реакции гидроксида железа (II)
Применение и использование гидроксида железа (II)
Краткая характеристика гидроксида железа (II):
Гидроксид железа (II) – неорганическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления, приобретая грязно-бурый цвет (цвет ржавчины).
Химическая формула гидроксида железа (II) Fe(OH)2.
Является одним из промежуточных соединений при ржавлении железа.
Не растворяется в воде и других растворителях. Растворимость в воде 5,2⋅10−5 г/100 мл.
Не горит. При нагревании разлагается на оксид железа (II,III) и водород.
Гидроксид железа (II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула амакинита Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала амакинита жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5-4, плотность 2,925—2,98 г/см³.
Физические свойства гидроксида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | Fe(OH)2 |
| Синонимы и названия иностранном языке | iron(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | белые или светло-зелёные тригональные кристаллы |
| Цвет | белый (иногда с зеленоватым оттенком), на воздухе со временем темнеет, приобретая грязно-бурый цвет. |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3400 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,4 |
| Температура разложения, °C | 150 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 89,86 |
* Примечание:
— нет данных.
Получение гидроксида железа (II):
В лаборатории гидроксид железа (II) получается в результате следующих химических реакций:
- 1. в результате взаимодействия сульфата железа (II) с гидроксидом калия:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4.
При этом гидроксид железа (II) выпадает в осадок.
- 2. в результате взаимодействия хлорида железа (II) и гидроксида калия:
FeCl2 + 2KOH → Fe(OH)2 + 2KCl.
При этом гидроксид железа (II) выпадает в осадок.
Гидроксид железа (II) получают при действии растворов щелочей на соли железа (II) без доступа воздуха.
- 3. в результате ржавления железа:
2Fe + 2Н2O + O2 → Fe(OH)2.
Данная реакция образование гидроксида железа (II) является одной из стадий ржавления железа. Реакция протекает медленно.
Химические свойства гидроксида железа (II). Химические реакции гидроксида железа (II):
Гидроксид железа (II) – слабое основание. Проявляет также и слабые амфотерные свойства, реагирует с концентрированными щелочами.
Химические свойства гидроксида железа (II) аналогичны свойствам гидроксидов других металлов.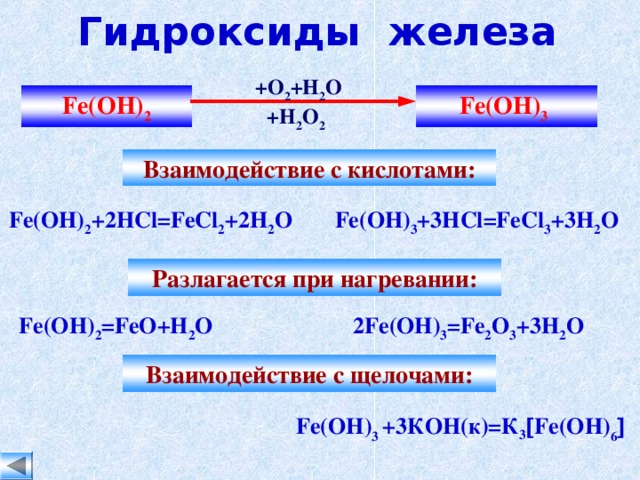 Поэтому для него характерны следующие химические реакции:
Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида железа (II) с ортофосфорной кислотой:
Fe(OH)2 + H3PO4 → Fe3(PO4)2 + 6H2O.
В результате реакции образуются фосфат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида железа (II) с азотной кислотой:
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O.
В результате реакции образуются нитрат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида железа (II) и с другими кислотами.
3. реакция гидроксида железа (II) с фтороводородом:
Fe(OH)2 + 2HF → FeF2 + 2H2O.
В результате реакции образуются фторид железа (II) и вода.
4. реакция гидроксида железа (II) с бромоводородом:
Fe(OH)2 + 2HBr → FeBr2 + 2H2O.
В результате реакции образуются бромид железа (II) и вода.
5. реакция гидроксида железа (II) с йодоводородом:
Fe(OH)2 + 2HI → FeI2 + 2H2O.
В результате реакции образуются йодид железа (II) и вода.
6. реакция гидроксида железа (II) с гидроксидом натрия:
Fe(OH)2 + 2NaOH → Na2[Fe(OH)4] (to).
В результате реакции образуется тетрагидроксоферрат (II) натрия. При этом в ходе реакции качестве исходного вещества используется гидроксид натрия в виде концентрированного раствора (концентрация более 50 %). Реакция протекает при кипении в атмосфере азота.
7. реакция гидроксида железа (II) с хлоридом аммония:
Fe(OH)2 + 2NH4Cl → FeCl2 + 2NH3 + 2H2O.
В результате реакции образуются хлорид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор хлорида аммония.
8. реакция гидроксида железа (II) с бромидом аммония:
Fe(OH)2 + 2NH4Br → FeBr2 + 2NH3 + 2H2O.
В результате реакции образуются бромид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор бромида аммония.
9. реакция гидроксида железа (II) с йодидом аммония:
Fe(OH)2 + 2NH4I → FeI2 + 2NH3 + 2H2O.
В результате реакции образуются йодид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор йодида аммония.
10. реакция гидроксида железа (II) с кислородом:
4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O (to).
В результате реакции образуются метагидроксид железа и вода. При этом в ходе реакции качестве исходного вещества используется гидроксид железа (II) в виде суспензии. Реакция протекает при кипении. Данная реакция также происходит (медленно) в процессе коррозии железа.
11. реакция гидроксида железа (II) с кислородом и водой:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
В результате реакции образуется гидроксида железа (III). Данная реакция также происходит (медленно) в процессе коррозии железа.
12. реакция гидроксида железа (II) с метагидроксидом железа:
2FeO(OH) + Fe(OH)2 → Fe3O4 + 2H2O (t = 600-1000 oС).
В результате реакции образуются оксид железа (II,III) и вода. Данная реакция также происходит (медленно) в процессе коррозии железа.
13. реакция термического разложения гидроксида железа (II):
Fe(OH)2 → FeO + H2O (t = 150-200 oC).
В результате реакции образуются оксид железа (II) и вода. Также образуются примеси: железо Fe, оксид железа (II,III) Fe3O4.
Применение и использование гидроксида железа (II):
Гидроксид железа (II) используется:
– при изготовлении активной массы железо-никелевых аккумуляторов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
гидроксид железа (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида железа (II)
реакции с оксидом натрия
Коэффициент востребованности 10 854
Фотография | Получение гидроксида железа(II), 3 из 6
{{ Элемент.Сообщение об ошибке }} Этот предмет сейчас недоступен. Товар не найден.ВЫБЕРИТЕ ВИДЕОЛИЦЕНЗИЮ
{{ item.PlusItemLicenseSmall }}
TIMESLICES
Создать квант времени
Просмотр временных интервалов (поставляется с 1-секундными дескрипторами)
Просмотр интервалов времени
БИРКИ
{{Ключевое слово}} {{Ключевое слово}}
ПОДЕЛИТЬСЯ ЭТОЙ СТРАНИЦЕЙ
Описание:
Описание:
Узнать больше
Кредит:
{{ item. ImgCredit }} Нет в наличии
ImgCredit }} Нет в наличии
Уникальный идентификатор:
{{ item.ItemID }}
Устаревший идентификатор:
{{ item.ItemDisplaySource }}
Тип:
{{item.MediaType}}
Лицензия:
{{item.LicenseModel}}
ЦЕНЫ РФ
{{item.aText[i]}}
{{ item.aPrice[i] }}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
LabelPB.toLowerCase()»/>
Добавить на доску
Заказать печать
Заказать печать
Скачать в высоком разрешении
Скачать в высоком разрешении
Скачать в высоком разрешении
Скачать в высоком разрешении

Размер без сжатия:
ЛИЦЕНЗИЯ ТОВАР НЕ ДОСТУПЕННазначение: {{item.ImgPurpose}}
{{ item.PlusItemLicenseSmall }}
Запрос товара
ПРОСТАЯ ЦЕНА RM
ПРОСТАЯ ЦЕНА RM
ТОВАР НЕ ДОСТУПЕН Запрос элемента
Назначение: {{ item.ImgPurpose }}
{{Имя}}
{{ FormatCurrency(item.aStandardPricingPrice[i]) }}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
toLowerCase()» aria-label=»‘Remove from ‘ + site.LabelPB.toLowerCase()»/>
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Заказать печать
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }} {{ item.PlusItemLicenseSmall }}
Перейти к оформлению заказа
Скопировать URL
Скачать Комп
Добавить на доску
LabelPB.toLowerCase()» aria-label=»‘Remove from ‘ + site.LabelPB.toLowerCase()»/>
Удалить с доски
Добавить на доску
Добавить в корзину
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам как можно скорее.
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }}
Перейти к оформлению заказаРазмер без сжатия:
ТОВАР НЕ ДОСТУПЕН
Запрос товара Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Скачать в высоком разрешении
ТОВАР НЕ ДОСТУПЕН Запрос товара
Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам, как только
возможный.
Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам, как только
возможный.
Время начала:
{{ SecondsToTime(StartTime) }} Установить
Время окончания:
{{ SecondsToTime(EndTime) }} Установить
Продолжительность: {{ Продолжительность}}
Текущий: {{ Текущий }}
Продолжительность: {{DurationTime}}
Текущее: {{ ТекущееВремя}}
{{ SecondsToTime(Value.StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
Посмотреть
Удалить
Для этого элемента не заданы временные интервалы, поэтому по умолчанию это весь клип.
{{ SecondsToTime(0) }} до {{ SecondsToTime(videocontrols.Duration) }}
Общее время: {{ Math.round(TotalTime * 100) / 100 }}
Цена/сек: {{ FormatCurrency(item.PricePerSec) }}
Цена: {{ ItemPrice }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ сайт.LabelPB }}
{{ сайт. LabelCT }}
LabelCT }}
{{ Lightbox.Name }} ({{ Lightbox.NumPix }})
Вид Управлять Новый
{{ site.LabelCT }}: {{ user.nCartItems }} {{ user.nCartItems == 1 ? «предмет» : «элемент» }}
{{ XXText }}
{{ XXSText }}
{{ XSText }}
{{ SMText }}
{{ MDText }}
{{ LGText }}
XLText 90 002} {{ LGText }} 90 002} { {{ XXLText }}{{ HDText }}
{{ QHDText }}
{{ K4Text }}
{{ K8Text }}
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте.
Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте. Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Закрыть файлы cookie EULA
Химия железа — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3720
- Джим Кларк
- Школа Труро в Корнуолле
Железо, английское название которого происходит от старого англо-саксонского, а его символ — латинское ferrum, было идентифицировано и использовалось в доисторические времена. Это очень распространенный элемент, четвертый по распространенности в земной коре. Кроме того, два из десяти наиболее распространенных соединений в земной коре представляют собой два обычных оксида железа, \(FeO\) и \(Fe_2O_3\).
Это очень распространенный элемент, четвертый по распространенности в земной коре. Кроме того, два из десяти наиболее распространенных соединений в земной коре представляют собой два обычных оксида железа, \(FeO\) и \(Fe_2O_3\).
Введение
В чистом виде железо представляет собой серебристо-белый металл, отличающийся способностью воспринимать и удерживать магнитное поле, а также растворять небольшое количество углерода при расплавлении (что дает сталь). Промышленное рафинирование железа основано на нагреве \(Fe_2O_3\) или \(Fe_3O_4\) (магнетита) со смесью других веществ в высокотемпературной среде доменной печи. Оксиды восстанавливаются до чистого железа. В дополнение к упрочнению железа путем добавления небольшого количества углерода, а также некоторых других металлов к расплавленному железу, чугунные отливки или поковки могут подвергаться термообработке, чтобы использовать преимущества различных физических свойств различных твердых фаз железа.
Чистое железо легко вступает в реакцию с кислородом и влагой в окружающей среде и вызывает разрушительную коррозию. — \rightarrow [Fe(H_2O)_4(OH)_2] + 2H_2O \label{5} \] 9- \rightarrow [Fe(H_2O)_3(OH)_3] + 3H_2O \label{6}\]
— \rightarrow [Fe(H_2O)_4(OH)_2] + 2H_2O \label{5} \] 9- \rightarrow [Fe(H_2O)_3(OH)_3] + 3H_2O \label{6}\]
В пробирке изменение цвета:
- В случае железа(II):
Железо очень легко окисляется в щелочной среде. Кислород в воздухе окисляет осадок гидроксида железа (II) до гидроксида железа (III), особенно в верхней части пробирки. Потемнение осадка происходит от того же эффекта.
- В железном (III) футляре:
Реакции ионов железа с аммиаком 9{2-} \rightarrow FeCO_3(s)\]
Ионы железа (III) и карбонат-ионы
Ион гексаакварона (III) является достаточно кислым, чтобы реагировать со слабоосновным карбонат-ионом. Если к раствору ионов гексаакварона(III) добавить раствор карбоната натрия, то получится точно такой же осадок, как если бы вы добавили раствор гидроксида натрия или раствор аммиака. На этот раз ионы карбоната удаляют ионы водорода из иона гексааква и образуют нейтральный комплекс. В зависимости от соотношения ионов карбоната и ионов гексааква, вы получите либо образовавшиеся ионы гидрокарбоната, либо газообразный диоксид углерода в результате реакции между ионами водорода и ионами карбоната. Более часто цитируемое уравнение показывает образование двуокиси углерода. 9{2-} \rightarrow 2[Fe(H_2O)_3(OH)_3] + 3CO_2 + 3H_2O\]
В зависимости от соотношения ионов карбоната и ионов гексааква, вы получите либо образовавшиеся ионы гидрокарбоната, либо газообразный диоксид углерода в результате реакции между ионами водорода и ионами карбоната. Более часто цитируемое уравнение показывает образование двуокиси углерода. 9{2-} \rightarrow 2[Fe(H_2O)_3(OH)_3] + 3CO_2 + 3H_2O\]
Кроме углекислого газа в этой реакции нет ничего нового:
Тест на железо(III) ионы с ионами тиоцианата
Это обеспечивает чрезвычайно чувствительный тест на ионы железа (III) в растворе. Если вы добавите ионы тиоцианата, SCN – (например, из раствора тиоцианата натрия, калия или аммония) к раствору, содержащему ионы железа (III), вы получите раствор интенсивного кроваво-красного цвета, содержащий ион [Fe (SCN) (H 2 О) 5 ] 2+ .
Определение концентрации ионов железа(II) в растворе методом окислительно-восстановительного титрования
Концентрацию ионов железа(II) в растворе можно определить путем титрования либо раствором манганата калия(VII), либо раствором дихромата калия(VI) . Реакции проводят в присутствии разбавленной серной кислоты. В любом случае вы должны пипетировать известный объем раствора, содержащего ионы железа (II), в колбу и добавить примерно равный объем разбавленной серной кислоты. Что произойдет дальше, зависит от того, используете ли вы раствор манганата калия (VII) или раствор дихромата калия (VI). 9{3+} \label{12}\]
Реакции проводят в присутствии разбавленной серной кислоты. В любом случае вы должны пипетировать известный объем раствора, содержащего ионы железа (II), в колбу и добавить примерно равный объем разбавленной серной кислоты. Что произойдет дальше, зависит от того, используете ли вы раствор манганата калия (VII) или раствор дихромата калия (VI). 9{3+} \label{12}\]
Полное уравнение показывает, что 1 моль ионов манганата(VII) взаимодействует с 5 молями ионов железа(II). Получив эту информацию, расчеты титрования ничем не отличаются от любых других.
Использование раствора дихромата калия(VI)
Раствор дихромата калия(VI) становится зеленым, поскольку он реагирует с ионами железа(II), и невозможно обнаружить изменение цвета, если у вас есть одна капля избыточного оранжевого раствор в сильно окрашенном зеленом растворе. С раствором дихромата калия(VI) необходимо использовать отдельный индикатор, известный как окислительно-восстановительный индикатор. Они меняют цвет в присутствии окислителя.

Leave A Comment