NaOH + Cl2 = ? уравнение реакции
В результате пропускания газообразного хлора через концентрированный раствор гидроксида натрия (NaOH + Cl2 = ?) может происходить образование различных продуктов. Это зависит от температуры раствора щелочи. Так, в случае горячего раствора продуктами взаимодействия являются гипохлорит и хлорид натрия, а также вода; холодного — хлорат и хлорид натрия, а также вода. Молекулярные уравнения реакции имеют вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Гидроксид натрия (едкий натр, каустическая сода) представляет собой твердые белые, очень гигроскопичные кристаллы, плавящиеся при . Он растворяется в воде с выделением большого количества теплоты вследствие образования гидратов. Легко поглощает из воздуха диоксид углерода, постепенно превращаясь в карбонат натрия.
Гидроксид натрия реагирует с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Основным способом получения гидроксида натрия является электролиз водного раствора хлорида натрия:
Химические свойства оснований – HIMI4KA

Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы. Классификация оснований и основные способы их получения описаны ранее в уроке 6.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:


Основания реагируют с кислыми солями с образованием солей и воды:
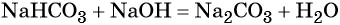
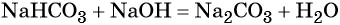
Щёлочи при сплавлении с амфотерными оксидами дают соль и воду:
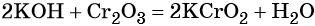
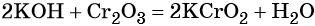
Щёлочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:
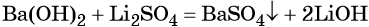
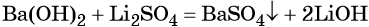
Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:


Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка:
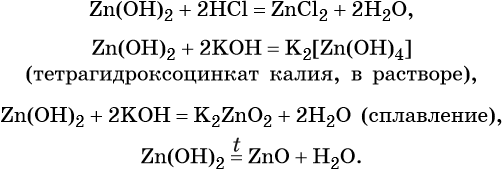
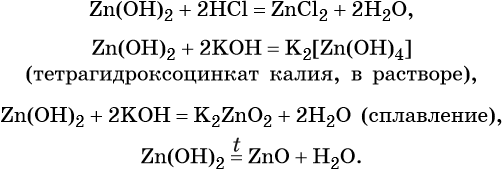
Тренировочные задания
1. Гидроксид лития вступает в реакцию с
1) гидроксидом аммония
2) гидроксидом натрия
3) гидроксидом алюминия
4) гидроксидом бария
2. Гидроксид лития реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) SO2, SO3
3. Верны ли следующие суждения о гидроксиде лития?
А. Это вещество нерастворимо в воде.
Б. Гидроксид лития не вступает в реакцию с хлоридом натрия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Гидроксид натрия вступает в реакцию с
1) сульфатом калия
2) сульфитом калия
3) хлоридом лития
4) хлоридом магния
5. Гидроксид натрия реагирует со всеми веществами набора
1) P2O5, SO3
2) KCl, FeCl3
3) NO, HNO3
4) N2O, Al(OH)3
6. Верны ли следующие суждения о гидроксиде натрия?
А. Гидроксид натрия является более слабым основанием по сравнению с гидроксидом магния.
Б. Гидроксид натрия не вступает в реакцию с хлоридом цинка.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Гидроксид калия вступает в реакцию с
1) сульфатом натрия
2) хлоридом меди
3) хлоридом лития
4) оксидом азота (II)
8. Гидроксид калия реагирует со всеми веществами набора
1) SO2, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) Ca3(PO4)2, NO
9. Верны ли следующие суждения о гидроксиде калия?
А. Гидроксид калия является более сильным основанием по сравнению с гидроксидом магния.
Б. Гидроксид калия вступает в реакцию с хлоридом железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
10. Гидроксид цинка вступает в реакцию с
1) сульфатом калия
2) хлоридом натрия
3) оксидом железа (II)
4) гидроксидом бария
11. Гидроксид цинка реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) HNO3, SO3
12. Верны ли следующие суждения о гидроксиде цинка?
А. Это вещество нерастворимо в воде.
Б. Гидроксид цинка не вступает в реакцию с сульфатом калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Гидроксид алюминия вступает в реакцию с
1) сульфатом натрия
2) хлороводородом
3) фосфатом калия
4) оксидом азота (I)
14. Гидроксид алюминия реагирует со всеми веществами набора
1) K2SO3, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) CaSO4, NO
15. Верны ли следующие суждения о гидроксиде алюминия?
А. Гидроксид алюминия является более сильным основанием по сравнению с гидроксидом натрия.
Б. Гидроксид вступает в реакции с основаниями и основными оксидами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + HI →
Б) NaOH + NaHSO4 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Na2SO4
3) NaI + H2O
4) NaAlO2 + H2O
5) Na2SO4 + H2O
17. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + NaOH (водн. р-р) →
Б) Zn(OH)2 + NaOH ⎯⎯сплавление→
В) Zn(OH)2 ⎯⎯t→
ПРОДУКТЫ РЕАКЦИИ
1) ZnO
2) ZnO + H2O
3) Na2ZnO2
4) Na2[Zn(OH)4]
5) Na2ZnO2 + H2O
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) LiOH + HNO3 →
Б) LiOH + S →
В) LiOH + Al(OH)3 →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) Li2S + Li2SO3 + H2O
4) LiNO3 + H2O
5) Li[Al(OH)4]
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + H2SO4 →
Б) Zn(OH)2 + Na2CO2 ⎯⎯сплавление→
В) Zn(OH)2 + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnSO4 + H2O
2) ZnSO4 + H2↑
3) Na2[Zn(OH)4] + H2↑
4) Na2ZnO2 + H2O 5) Na2ZnO2 + CO2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + ZnCl2 →
Б) NaOH + FeCl2 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Fe(OH)2 + NaCl
3) Na2[Zn(OH)4] + H2O
4) NaAlO2 + H2O
5) Na2[Zn(OH)4] + NaCl
21. Дана схема превращений:
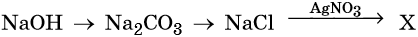
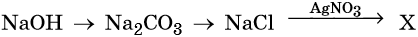
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
22. Дана схема превращений:
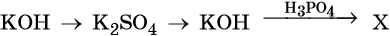
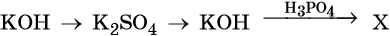
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
23. Дана схема превращений:
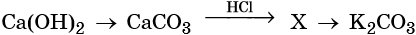
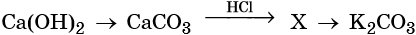
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
24. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Ответы
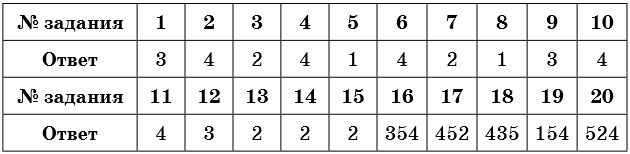



Реакции ионного обмена
Дидактический материал
РЕПЕТИЦИОННЫЙ ЕГЭ ПО ХИМИИ—ДИСТАНЦИОННО, БЕСПЛАТНО
Реакции ионного обмена.
1. Газ выделяется при взаимодействии растворов
1) сульфата калия и азотной кислоты
2) хлороводородной кислоты и гидроксида калия
3) серной кислоты и сульфита калия
4) карбоната натрия и гидроксида бария
2. Нерастворимая соль образуется при взаимодействии
1) КОН (р-р) и Н3РО4(р-р)
2) HNО3 (р-р) и СuО
3) НС1 (р-р) и Mg(NO3)2 (р-р)
4) Са(ОН)2 (р-р) и СО2
3. Одновременно не могут находиться в растворе группы:
1) К+, Н+, NO3—, SO42-
2) Ва2+, Ag+, ОН-, F—
3) Н3O+, Са2+ Сl
4) Mg2+, Н3O+, Вr—, Сl—
4. Какое молекулярное уравнение соответствует сокращенному ионному уравнению H+ + ОН— = H2O?
1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
2) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
3) NaOH + HNO3 = NaNO3 + H2O
4) H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
5. Газ выделяется при взаимодействии растворов
1) сульфата калия и азотной кислоты
2) хлороводородной кислоты и гидроксида бария
3) азотной кислоты и сульфида натрия
4) карбоната натрия и гидроксида бария
6. Одновременно не могут находиться в растворе все ионы ряда
1) Fe3+, К+, Сl—, S042-
2) Fe3+, Na+, NO3—, SO42-
3) Са2+, Li+, NO3—, Сl—
4) Ba2+, Cu2+, OH—, F—
7. Соль и щелочь образуются при взаимодействии растворов
1) А1С1
2) К2СОз и Ва(ОН)2
3) Н3РО4 и КОН
4) MgBr2 и Na3PO4
8. Нерастворимая соль образуется при сливании водных растворов
1) гидроксида калия и хлорида алюминия
2) сульфата меди(II) и сульфида калия
3) серной кислоты и гидроксида лития
4) карбоната натрия и хлороводородной кислоты
9. Осадок выпадет при взаимодействии растворов
1) Н3РO4 и КОН
2) Na2SO3 и H2SO4
3) FeCl3 и Ва(ОН)2
4) Cu(NO3
10. Сокращенное ионное уравнение Fe2+ + 2OH— = Fe(OH)2
соответствует взаимодействию веществ:
1) Fe(NO3)3 и КОН
2) FeSO4 и LiOH
3) Na2S и Fe(NO)3
4) Ва(ОН)2 и FeCl3
11. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался, а затем исчез бесцветный студенистый осадок. Формула неизвестной соли
1) А1С13 2) FeCl3 3) CuSO4 4) KNO3
12. Краткое ионное уравнение
Cu2++ S2-= CuS соответствует реакции между
I) Сu(ОН)2 и H2S
2) CuCl2 и Na2S
3) Cu3(P04)2 и Na2S
4) CuCl2 и H2S
13. Продуктами необратимо протекающей реакции ионного не могут быть
1) сернистый газ, вода и сульфат натрия
2) карбонат кальция и хлорид натрия
3) вода и нитрат бария
4) нитрат натрия и карбонат калия
14. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался бурый осадок. Формула неизвестной соли
1) ВаС12
15. Краткое ионное уравнение
H+ + ОН— = Н2O соответствует реакции между
1) HI и КОН
2) H2S и NaOH
3) H2SiO3 и КОН
4) НС1 и Сu(ОН)2
16. Хлорид натрия может быть получен в реакции ионного обмена в растворе между
1) гидроксидом натрия и хлоридом калия
2) сульфатом натрия и хлоридом бария
3) нитратом натрия и хлоридом серебра
4) хлоридом меди(II) и нитратом натрия
17. Продуктами необратимо протекающей реакции ионного обмена не могут быть
1) вода и фосфат натрия
2) фосфат натрия и сульфат калия
3) сероводород и хлорид железа(II)
4) хлорид серебра и нитрат натрия
18. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался синий осадок. Формула неизвестной соли
1) ВаСl2 2) FeSO4 3) CuSO4 4) AgNO3
19. Краткое ионное уравнение реакции между Сu(ОН)2 и соляной кислотой
1) Н+ + ОН— = Н2O
2) Сu(ОН)2 +2Сl—= CuCl
3) Cu2+ + 2НС1 = CuCl2 + 2Н+
4) Cu(OH)2 + 2Н+ = Сu2+ + 2Н2O
20. Практически необратимо протекает реакция межлу
1) K2SO4 и HC1
2) NaCl и CuSO4
3) Na2SO4 и КОН
4) BaCl2 и CuSO4
21. Сокращенное ионное уравнение
2H+ + CO32-=CO2 +H2O соответствует взаимодействию
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) соляной кислоты с карбонатом калия
4) гидроксида кальция с оксидом углерода (IV)
22. С выпадением осадка протекает реакция между раствором гидроксида натрия и
1) CrCl2 2) Zn(OH)2 3) H2SO4 4) P2O5
23. С выделением газа протекает реакция между азотной кислотой и
1) Ва(ОН)2 2) Na2SO4 3) CaCO3 4) MgO
24. Сокращенному ионному уравнению
СО32– + 2Н+ = СО2 + Н2О
соответствует взаимодействие
1) |
Na2CO3 и H2SiO3 |
|
2) |
Na2CO3 и HCl |
|
3) |
CaCO3 и HCl |
|
4) |
Задание №1
В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. KOH
- 2. HCl
- 3. Cu(NO3)2
- 4. K2SO3
- 5. Na2SiO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеОтвет: 42
При реакции между двумя солями неорганических кислот газ образуется только при смешении горячих растворов нитритов и солей аммония вследствие образования термически неустойчивого нитрита аммония. Например,
NH4Cl + KNO2 =to=> N2 + 2H2O + KCl
Однако в списке нет как нитритов, так и солей аммония.
Значит, одна из трех солей (Cu(NO3)2, K2SO3 и Na2SiO3) реагирует либо с кислотой (HCl), либо с щелочью (NaOH).
Среди солей неорганических кислот только соли аммония выделяют газ при взаимодействии с щелочами:
NH4+ + OH = NH3 + H2O
Солей аммония, как мы уже сказали, в списке нет. Остается только вариант взаимодействия соли с кислотой.
К солям среди указанных веществ относятся Cu(NO3)2, K2SO3 и Na2SiO3. Реакция нитрата меди с соляной кислотой не протекает, т.к. не образуется ни газа, ни осадка, ни малодиссоциирующего вещества (воды или слабой кислоты). Силикат натрия реагирует с соляной кислотой, однако благодаря выделению белого студенистого осадка кремниевой кислоты, а не газа:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
Остается последний вариант — взаимодействие сульфита калия и соляной кислоты. Действительно, в результате реакции ионного обмена между между сульфитом и практически любой кислотой образуется неустойчивая сернистая кислота, которая мгновенно распадается на бесцветный газообразный оксид серы (IV) и воду.
Задание №2
При добавлении вещества X к раствору соли Y выделился бесцветный газ, окрашивающий мокрую лакмусовую бумажку в синий цвет. Выберите из предложенного списка вещества X и Y, которые соответствуют наблюдениям эксперимента.
- 1. Cu(OH)2
- 2. NH4Cl
- 3. Ba(OH)2
- 4. Na2SO3
- 5. H2SO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №3
Сокращенному ионному уравнению
2H+ + CO32- = CO2 + H2O
соответствует взаимодействие между:
1) карбонатом рубидия и серной кислотой
2) гидрокарбонатом калия и соляной кислотой
3) карбонатом магния и серной кислотой
4) карбонатом калия и бромоводородной кислотой
5) карбонатом натрия и уксусной кислотой
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №5
В пробирку с концентрированным раствором вещества X добавили небольшое количество вещества Y, в результате чего не растворимое в воде вещество Y растворилось. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. CuSO4
- 2. Mg
- 3. NaOH
- 4. Al(OH)3
- 5. CaCO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №5
Реакция ионного обмена протекает между:
1) железом и соляной кислотой
2) оксидом железа (III) и алюминием
3) сульфидом натрия и хлоридом меди (II)
4) бромидом натрия и хлором
5) соляной кислотой и нитратом серебра
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №6
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате реакции наблюдали выделение голубого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфат железа (II)
2) гидроксид натрия
3) сульфат меди (II)
4) соляная кислота
5) гидроксид аммония
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №7
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращенное ионное уравнение OH— + H+ = H2O. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфид калия
2) угольная кислота
3) серная кислота
4) гидроксид бария
5) гидроксид натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №8
При комнатной температуре концентрированная серная кислота растворяет металл (вещество X) и взаимодействует с раствором вещества Y с выделением бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) карбонат натрия
2) железо
3) алюминий
4) карбонат магния
5) цинк
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №9
При взаимодействии растворов одних веществ образуется бурый осадок (пара веществ X), а при взаимодействии растворов других веществ образуется белый творожистый осадок (пара веществ Y). Из предложенного перечня выберите две пары веществ, которые могут вступать в описанные реакции.
1) нитрат серебра и хлорид натрия
2) гидроксид натрия и нитрат железа (III)
3) карбонат калия и азотная кислота
4) серная кислота и аммиак
5) хлорид калия и ортофосфорная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №10
Из предложенного перечня выберите две пары веществ, взаимодействие которых в водном растворе приводит к образованию осадка.
1) серная кислота и гидроксид лития
2) гидрокарбонат натрия и гидроксид натрия
3) гидроксид натрия и хлорид бария
4) гидроксид калия и хлорида алюминия
5) сульфат меди и сульфида калия
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
РешениеЗадание №11
Сокращенное ионное взаимодействие H+ + OH— = H2O соответствует взаимодействию раствора щелочи (вещества X) раствором вещества Y. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидроксид лития
2) гидроксид магния
3) иодоводородная кислота
4) фтороводородная кислота
5) сероводородная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №12
Через колбу с раствором электролита (вещества X) пропустили газ Y, который поглотился раствором, при этом никаких признаков реакции не наблюдалось. Из предложенного перечня выберите вещества X и Y, которые соответствуют условию задания.
- 1. CO2
- 2. CaCO3
- 3. NH3
- 4. AlCl3
- 5. BaCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №13
В результате взаимодействия соляной кислоты с раствором вещества X образуется газообразное вещество. При пропускании этого газообразного вещества через раствор вещества Y выпал белый осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) карбонат кальция
2) карбонат калия
3) гидроксид кальция
4) гидроксид калия
5) аммиак
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №14
Гидроксид натрия может реагировать с веществом X с образованием как кислой, так и средней солей, а с веществом Y — с образованием комплексной соли. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфит калия
2) гидроксид магния
3) гидроксид алюминия
4) хлорид лития
5) оксид серы (IV)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №15
Соляная кислота реагирует с раствором вещества X без проявления каких-либо признаков реакции, а с веществом Y — с выделением бесцветного газа с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) карбонат бария
2) гидроксид цинка
3) сульфит бария
4) гидроксид бария
5) сульфат бария
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №16
Вещества X и Y не растворимы в воде. При добавлении разбавленной серной кислоты к веществу X оно растворяется, а при добавлении серной кислоты к веществу Y — растворение сопровождается выделением газа. Из предложенного перечня выберите вещества X и Y, которые вступают в описанные реакции.
- 1. Zn(OH)2
- 2. Ca(OH)2
- 3. Zn
- 4. Ag
- 5. Cu
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №17
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) хлорид меди (II)
2) нитрат серебра
3) хлорид лития
4) иодид серебра
5) хлорид железа (III)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №18
При взаимодействии раствора кислородсодержащей соли X с бескислородной солью Y выпадает осадок белого цвета. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. Fe2(SO4)3
- 2. KOH
- 3. NaCl
- 4. BaCl2
- 5. PbSO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №19
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов натрия, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидроксид натрия
2) фосфат кальция
3) нитрат натрия
4) нитрат кальция
5) карбонат натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №20
Вещество X растворяется как в растворе серной кислоты, так и в растворе гидроксида натрия, а вещество Y реагирует с этими растворами с образованием осадков в обоих случаях. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1. Zn(NO3)2
- 2. Pb(NO3)2
- 3. Al(OH)3
- 4. FeCl3
- 5. FeCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
РешениеЗадание №21
В пробирку с раствором соли аммония Х добавили раствор вещества Y.
В результате реакции наблюдали образование белого осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) нитрат аммония
2) хлорид аммония
3) хлороводород
4) сульфат магния
5) карбонат аммония
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №22
В пробирку с раствором вещества X добавили кислоту Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
H+ + HCO−3 = H2O + CO2↑
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) угольная кислота
2) фтороводородная кислота
3) бромоводородная кислота
4) карбонат калия
5) гидрокарбонат аммония
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №23
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидрокарбонат бария
2) гидроксид натрия
3) нитрат аммония
4) бромид лития
5) сероводород
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №24
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции образовалось слабое растворимое основание и выделился осадок. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) сульфат лития
2) хлорид кальция
3) карбонат аммония
4) гидроксид бария
5) гидроксид калия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №25
В пробирку с раствором соли X добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
H2PO4− + 2OH− = PO43− + 2H2O
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) дигидрофосфат аммония
2) дигидрофосфат кальция
3) дигидрофосфат калия
4) гидроксид бария
5) гидроксид натрия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №26
В пробирку с раствором вещества X добавили раствор щёлочи Y.
В результате произошла реакция, которую описывает сокращённое ионное уравнение
HS– + OH– = S2– + H2O
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) гидросульфид аммония
2) гидросульфид калия
3) сероводородная кислота
4) гидроксид стронция
5) гидроксид калия
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №27
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) нитрат натрия
2) аммиак
3) бромоводород
4) хлорид алюминия
5) оксид серы(IV)
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №1
Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
2 | Mn+7 + ē → Mn+6
7 | S+4 – 2ē → S+6
Сера в степени окисления +4 (или сульфит натрия) является восстановителем.
Марганец в степени окисления +7 (или перманганат калия) – окислителем.
Задание №2
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидрокарбонат натрия, алюминат натрия, бромид калия, углекислый газ, концентрированная серная кислота. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
2KBr(тв.) + 3H2SO4(конц.) → 2KHSO4 + Br2 + SO2↑ + 2H2O
1| 2Br-1 — 2ē → Br2
1| S+6 + 2ē → S+4
Сера в степени окисления +6 (или серная кислота) является окислителем
Бром в степени окисления -1 (или бромид калия) является восстановителем
Второй вариант ответа:
2KBr(тв.) + 2H2SO4(конц.) → K2SO4 + Br2 + SO2↑ + 2H2O
1| 2Br-1 — 2ē → Br2
1| S+6 + 2ē → S+4
Сера в степени окисления +6 (или серная кислота) является окислителем
Бром в степени окисления -1 (или бромид калия) является восстановителем
Задание №3
Для выполнения заданий 30, 31 используйте следующий перечень веществ: азот, хлороводород, оксид фосфора (V), диоксид марганца, ацетат калия. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
1 | Mn+4 + ē → Mn+2
1 | 2Cl-1 – 2ē → Cl02
Хлор в степени окисления -1 (или соляная кислота) является восстановителем.
Марганец в степени окисления +4 (или диоксид марганца) – окислителем.
Задание №4
Для выполнения заданий 30, 31 используйте следующий перечень веществ: серная кислота, гидроксид натрия, оксид серы (VI), бром, силикат натрия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O (при нагревании)
5 | Br02 + 2ē → 2Br-1
1 | Br02 – 10ē → 2Br+5
Бром в степени окисления 0 (или Br2) является и окислителем, и восстановителем.
Второй вариант ответа:
2NaOH + Br2 = NaBrO + NaBr + H2O (на холоде)
1 | Br02 + 2ē → 2Br-1
1 | Br02 – 2ē → 2Br+1
Бром в степени окисления 0 (или Br2) является и окислителем, и восстановителем.
Задание №5
Для выполнения заданий 30, 31 используйте следующий перечень веществ: углекислый газ, сульфат натрия, бром, бромоводород, сульфит калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
Br2 + K2SO3 + H2O = K2SO4 + 2HBr
1 | Br20 + 2ē → 2Br—
1 | S+4 — 2ē → S+6
Бром в степени окисления 0 (или Br2) является окислителем
Сера в степени окисления +4 (сульфит калия) является восстановителем.
Задание №6
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидрокарбонат кальция, углерод, сульфид меди, азотная кислота, тетрагидроксоалюминат натрия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
1 | S2- — 8ē → S+6
8 | N+5 + ē → N+4
Сера в степени окисления -2 (или сульфид меди (ll)) является восстановителем
Азот в степени окисления +5 (или азотная кислота) — окислителем
Второй вариант ответа:
С + 4HNO3 = CO2 + 4NO2 + 2H2O
1 l C0 — 4ē → C+4
4 l N+5 + 1ē → N+4
Углерод в степени окисления 0 является восстановителем
Азот в степени окисления +5 (или азотная кислота) -окислителем.
Задание №7
Для выполнения заданий 30, 31 используйте следующий перечень веществ: пероксид водорода, фосфат лития, гидрокарбонат калия, гидроксид хрома (III), гидроксид калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
3H2O2 + 2Cr(OH)3 + 4KOH = 2K2CrO4 + 8H2O
3 | 2O-1 +2ē → 2O-2
2 | Cr+3 — 3ē → Cr+6
Кислород в степени окисления -1 (или пероксид водорода) является окислителем
Хром в степени окисления +3 (или гидроксид хрома (lll)) – восстановителем.
Задание №8
Для выполнения заданий 30, 31 используйте следующий перечень веществ: карбонат натрия, иодоводородная кислота, оксид серы (IV), гидроксид железа (III), хлорид алюминия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
2 | Fe+3 + 1ē → Fe+2
1 | 2I-1 – 2ē → I2
Железо в степени окисления +3 (или гидроксид железа (lll)) является окислителем
Йод в степени окисления -1 (или йодоводородная кислота) – восстановителем.
Задание №9
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид железа (II), гидроксид натрия, гидроксид алюминия, нитрит натрия, хлорид аммония. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O
1 | 2N+3 + 6ē → N02
1 | 2N-3 – 6ē → N02
Азот в степени окисления +3 (или нитрит натрия) является окислителем
Азот в степени окисления -3 (или хлорид аммония) – восстановителем.
Задание №10
Для выполнения заданий 30, 31 используйте следующий перечень веществ: иодид натрия, ацетат бария, уксусная кислота, серная кислота, угарный газ. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
8NaI(тв.) + 9H2SO4(конц.) → 4I2↓ + H2S↑ + 4H2O + 8NaHSO4
4∙| 2I— — 2ē → I2
1∙| S+6 + 8ē → S-2
Йод в степени окисления -1 (или иодид натрия) является восстановителем
Сера в степени окисления +6 (или серная кислота) – окислителем.
Второй вариант ответа:
8NaI + 5H2SO4(конц.) = 4I2 + H2S + 4H2O + 4Na2SO4
4∙| 2I— — 2ē → I2
1∙| S+6 + 8ē → S-2
Йод в степени окисления -1 (или иодид натрия) является восстановителем
Сера в степени окисления +6 (или серная кислота) – окислителем.
Задание №11
Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид железа (II), хлорид бария, гидроксид натрия, оксид кремния (IV), концентрированная азотная кислота. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
FeO + 4HNO3 = Fe(NO3)3 + NO2 + 2H2O
1∙| Fe2+ — 1ē → Fe3+
1∙| N+5 + 1ē → N+4
Железо в степени окисления +2 (или оксид железа (II)) является восстановителем
Азот в степени окисления +5 (или азотная кислота) — окислителем.
Задание №12
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид натрия, дихромат калия, хлорид бария, диоксид кремния, соляная кислота. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
1∙| 2Cr+6 + 6ē → 2Cr+3
3∙| 2Cl— — 2ē → Cl02
Хром в степени окисления +6 (или дихромат калия) является окислителем
Хлор в степени окисления -1 (или соляная кислота) – восстановителем.
Задание №13
Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат калия, сульфат меди, серная кислота, бромид калия, гидроксид алюминия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
K2Cr2O7 + 6KBr + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3Br2 + 7H2O
1∙| 2Cr+6 + 6ē → 2Cr+3
3∙| 2Br— — 2ē → Br02
Хром в степени окисления +6 (или дихромат калия) является окислителем
Бром в степени окисления -1 (или бромид калия) – восстановителем.
Задание №14
Для выполнения заданий 30, 31 используйте следующий перечень веществ: азотная кислота, гидроксид калия, бром, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель
. РешениеВариант ответа:
Первый вариант ответа:
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8H2O
2∙| Cr+3 — 3ē → Cr+6
3∙| Br2 + 2ē → 2Br—
Бром в степени окисления 0 (или Br2) является окислителем
Хром в степени окисления +3 (или гидроксид хрома (III)) – восстановителем.
Второй вариант ответа:
Br2 + 2KOH = KBrO + KBr + H2O
1∙| Br2 + 2ē → 2Br-1
1∙| Br2 — 2ē → 2Br+1
Бром в степени окисления 0 (или Br2) является и окислителем, и восстановителем.
Третий вариант ответа:
3Br2 + 6KOH = KBrO3 + 5KBr + 3H2O
5∙| Br2 + 2ē → 2Br-1
1∙| Br2 — 10ē → 2Br+5
Бром в степени окисления 0 (или Br2) является и окислителем, и восстановителем.
Задание №15
Для выполнения заданий 30, 31 используйте следующий перечень веществ: карбонат бария, оксид меди (I), концентрированная серная кислота, гидрокарбонат натрия, дихромат натрия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
3Cu2O + Na2Cr2O7 + 10H2SO4 → 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
3∙| 2Cu+1 — 2ē → 2Cu+2
1∙| 2Cr+6 + 6ē → 2Cr+3
Медь в степени окисления +1 (или оксид меди (I)) является восстановителем
Хром в степени окисления +6 (или дихромат натрия) — окислителем.
Второй вариант ответа:
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
1∙| 2Cu+1 -2ē → 2Cu+2
1∙| S+6 + 2ē → S+4
Медь в степени окисления +1 (или оксид меди (I)) является восстановителем
Сера в степени окисления +6 (или серная кислота) — окислителем.
Задание №16
Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат калия, углекислый газ, алюминий, гидрофосфат калия, гидроксид калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
3∙| N+5 + 8ē → N-3
8∙| Al0 — 3ē → Al3+
Азот в степени окисления +5 (или нитрат калия) является окислителем.
Алюминий в степени окисления 0 (или металлический алюминий) — восстановителем.
Второй вариант ответа:
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2↑
3∙| 2H+1 + 2ē → H2
2∙| Al — 3ē → Al+3
Водород в степени окисления +1 (или гидроксид калия) является восстановителем.
Алюминий в степени окисления 0 (или металлический алюминий) — восстановителем.
Третий вариант ответа:
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2↑
3∙| 2H+1 + 2ē → H2
2∙| Al — 3ē → Al+3
Алюминий в степени окисления 0 (или металлический алюминий) — восстановителем.
Водород в степени окисления +1 (гидроксид калия или вода) является восстановителем.
В случае третьего варианта из уравнения реакции однозначно сказать вода или гидроксид калия является окислителем нельзя, т.к. оба вещества содержат водород в степени окисления +1. Однако, исходя из механизма протекания реакции следует, что все-таки окисление происходит водой.
Задание №17
Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид фосфора (III), азотная кислота, оксид железа (III), оксид серы (IV), карбонат кальция. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
SO2 + 2HNO3 = H2SO4 + 2NO2
1∙| S+4 — 2ē → S+6
2∙| N+5 +1ē → N+4
Сера в степени окисления +4 (или диоксид серы) является восстановителем.
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Второй вариант ответа:
P2O3 + 4HNO3 + H2O = 2H3PO4 + 4NO2
1∙| 2P+3 — 4ē → 2P+5
4∙| N+5 +1ē → N+4
Фосфор в степени окисления +3 (или оксид фосфора (III)) является восстановителем.
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Задание №18
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид алюминия, сульфат меди (II), нитрат железа (II), концентрированная азотная кислота, гидроксид калия |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
Fe(NO3)2 + 2HNO3 = Fe(NO3)3 + NO2 + H2O
1∙| Fe+2 — 1ē → Fe+3
1∙| N+5 + 1ē → N+4
Железо в степени окисления +2 (или нитрат железа (II)) является восстановителем.
Азот в степени окисления +5 (или азотная кислота) — окислителем.
Задание №19
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфат бария, сульфид калия, сульфат натрия, ацетат бария, перманганат калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
2∙| Mn+7 + 3ē → Mn+4
3∙| S-2 – 2ē → S0
Сера в степени окисления -2 (или сульфид калия) является восстановителем.
Марганец в степени окисления +7 (или перманганат калия) – окислителем.
Задание №20
Для выполнения заданий 30, 31 используйте следующий перечень веществ: раствор серной кислоты, гидроксид меди (II), дихромат калия, диоксид кремния, сульфат железа (II). Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеВариант ответа:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
1∙ | 2Cr+6 + 6ē → 2Cr+3
6∙ | Fe+2 – 1ē → Fe+3
Железо в степени окисления +2 (или сульфат железа(II)) является восстановителем.
Хром в степени окисления +6 (или дихромат калия) – окислителем.
Различные реакции галогенов
На этот раз мы можем говорить только о реакциях хлора, брома и йода. Везде, где у вас есть решения, фтор будет реагировать с водой.
Хлор и бром являются достаточно сильными окислителями для окисления ионов железа (II) до ионов железа (III). В процессе хлор восстанавливается до хлорид-ионов; от брома до ионов брома.
Для уравнения брома просто поменяйте Cl на Br.
Очень бледно-зеленый раствор, содержащий ионы железа (II), превратится в желтый или оранжевый раствор, содержащий ионы железа (III).
Йод не является достаточно сильным окислителем для окисления ионов железа (II), поэтому никакой реакции не происходит. На самом деле происходит обратная реакция. Ионы железа (III) являются достаточно сильными окислителями для окисления йодид-ионов в йод:
Еще раз, мы просто посмотрим на это для хлора, брома и йода. Мы начнем с подробного рассмотрения случая с хлором, потому что он наиболее вероятен.
Реакция хлора с холодным раствором гидроксида натрия
Реакция между хлором и холодным разбавленным раствором гидроксида натрия:
NaClO (иногда записывается как NaOCl) — хлорат натрия (I).Старое название для этого — гипохлорит натрия — и решение в правой части уравнения — то, что обычно продается как отбеливатель.
Теперь подумайте об этом с точки зрения степени окисления.
Очевидно, что хлор изменил состояние окисления, потому что он превратился в соединения, начиная с исходного элемента. Проверка всех состояний окисления показывает:
Хлор — это только , только , который изменил степень окисления. Это было окислено или восстановлено? Да! Обе! Один атом был восстановлен, потому что его степень окисления упала.Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество окисляется и восстанавливается.
Реакция хлора с горячим раствором гидроксида натрия
Реакция между хлором и горячим концентрированным раствором гидроксида натрия:
На этот раз незнакомым продуктом является хлорат натрия (V) — NaClO 3 .
Как и прежде, проверьте степень окисления всего в уравнении. Еще раз, вы обнаружите, что единственное, что изменилось, это хлор. Он изменяется от 0 в молекулах хлора с левой стороны до -1 (в NaCl) и +5 (в NaClO 3 ).
Это также реакция диспропорционирования.
Построение уравнений для этих реакций
На самом деле, первый прост, и большинство людей просто записывают это.Второй способ сложнее, и одним из способов его создания является использование окислительных состояний.
Вы должны были бы изучить два основных продукта реакции. Запишите их:
Теперь подумайте об изменениях состояния окисления. Чтобы перейти к NaCl, степень окисления хлора упала с 0 до -1.
Чтобы перейти к NaClO 3 , он увеличился с 0 до +5.
Положительные и отрицательные изменения состояния окисления должны быть отменены, поэтому для каждого образованного NaClO 3 должно быть 5 NaCl.Запишите это:
Теперь легко сбалансировать натрий и хлор. Когда вы закончите, вы обнаружите, что у вас осталось достаточно водорода и кислорода, чтобы получить 3Н 2 О. Это кажется разумным!
Реакции с участием брома и йода
Они в основном похожи на хлор, разница в температуре, при которой все происходит. Тенденция к образованию иона с галогеном в степени окисления +5 быстро возрастает, когда вы уходите из группы.
Бром и раствор гидроксида натрия
С бромом образование бромата натрия (V) происходит при значительно более низкой температуре, вплоть до комнатной температуры. Если вы хотите приготовить раствор бромата натрия (I), вам нужно провести реакцию примерно при 0 ° C.
Раствор йода и гидроксида натрия
В этом случае вы получаете йодат натрия (V) независимо от температуры. Коттон и Уилкинсон (Advanced Inorganic Chemistry, 3-е издание, стр. 477) говорят, что ион йодата (I) в растворе неизвестен.
,Гидроксид натрия | 1310-73-2
Гидроксид натрия Химические свойства, применение, Производство
Химические свойства
Гидроксид натрия представляет собой белый, нелетучий щелочной материал без запаха, продаваемый в твердой форме в виде гранул, хлопьев, комков или палочек. Его растворимость в воде составляет 111 мас.%, А давление пара составляет 0 мм рт. Ст. (NIOSH, 1994).Он может реагировать с трихолоэтиленом (TCE) с образованием легковоспламеняющегося дихлорацетилена и с металлами с образованием газообразного водорода (OEHHA, 1993).Его реактивность с металлами следует учитывать в отношении единиц хранения и контейнеров.

Гидроксид натрия обычно доступен в виде водного раствора, известного как каустическая сода, содовый щелок или просто как щелок. Он имеет различные применения, включая нейтрализацию кислоты; производство бумаги, текстиля, пластмасс, коррозийных веществ, красителей, краски, средства для удаления краски и мыла; переработка нефти; гальваники; очистка металла; отмывание; и мытье посуды. Растущее использование было в незаконном изготовлении метамфетамина.
Использует
Гидроксид натрия (NaOH) является одним из наиболее полезных промышленных соединений натрия. Это также известен как щелочь или едкий натр и является одним из самых сильных щелочных оснований (высокое значение pH) на бытовом рынке. Он используется в качестве очистителя для слива и духовки и омыляет жиры в производство мыла. Он должен использоваться с осторожностью, потому что он также способен производить серьезные ожоги кожи.Описание
Гидроксид натрия, также известный как щелочь и каустическая сода, является высоко едким веществом, которое используется в небольших количествах в косметике для определения и поддержания pH продукта.Гидроксид натрия является чрезвычайно важным соединением в нашей жизни, потому что он имеет очень много применений. Это очень распространенная основа, используемая в химической промышленности и используемая для многих вещей, многие из которых происходят в нашей повседневной жизни. Одним из наиболее известных применений гидроксида натрия является его использование в канализационных стоках. Это входит во многие различные бренды очистителей слива, но одним из самых распространенных является Drano. Он также выпускается в виде щелочного мыла, которое можно использовать для мытья практически всего, от посуды до лица.
структура гидроксида натрия
При комнатной температуре гидроксид натрия представляет собой белое кристаллическое твердое вещество без запаха, которое поглощает влагу из воздуха. Это промышленное вещество. Гидроксид натрия является неорганическим соединением, используемым для контроля уровня pH или служащим буферным средством в косметике и средствах личной гигиены. Исторически оно использовалось при составлении мыла, но в настоящее время встречается в различных формулах, включая средства для ванн, чистящие средства, ароматизаторы, пудры для ног, краски и краски для волос, макияж, средства для ногтей, средства личной гигиены, шампуни, средства для бритья. депиляторы, средства по уходу за кожей и средства для загара, а также химические выпрямители для волос и наборы для завивки волос.Согласно Wikipedia, он также является популярным ингредиентом в промышленных растворителях в качестве химической основы для мыла, чистящих средств для духовок, моющих средств и чистящих средств для слива благодаря своей способности растворять жиры, масла, жиры и белковые отложения. Реже гидроксид натрия рассматривается как ингредиент зубных паст.
Гидроксид натрия одобрен FDA и получил оценку GRAS (общепризнанный как безопасный) в качестве прямой пищевой добавки. Тем не менее, он в основном используется при мойке и химическом пилинге продуктов.Он разрешен для использования в косметике и средствах личной гигиены в различных концентрациях: 5% по весу в растворителях для кутикулы ногтей, 2% по весу в выпрямителях для волос общего назначения, 4,5% по весу в выпрямителях для волос для профессионального использования, вплоть до pH 12,7 в депиляторах и до pH 11 в других случаях в качестве регулятора pH.
Ссылки
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Химические свойства
Гидроксид натрия встречается в виде белой или почти белой плавленой массы.это доступны в виде небольших гранул, хлопьев, палочек и других форм или форм. Это является твердым и ломким и показывает кристаллический перелом. натрий гидроокись очень распущена и быстро подвергается воздействию воздуха поглощает углекислый газ и воду.Химические свойства
Гидроксид натрия, NaOH, также называемый каустической содой или гидратом натрия (и ранее известный как щелок), представляет собой белое массивное распадающееся кристаллическое твердое вещество, растворимое в воде, спирте и глицерине.Он плавится при 318 ° C (606 OF) и является наиболее широко используемым и доступным щелочным химическим веществом. Большая часть гидроксида натрия образуется в качестве побочного продукта хлора с помощью электролизеров: клетки диафрагменного, ртутного или мембранного типа. Некоторое количество гидроксида натрия помечается как произведенное в клетках, большинство испаряется и продается в виде 50% и 73% растворов или в виде безводных шариков. Большинство едких конечных применений требуют растворов относительно низких концентраций. Каустическая сода используется в качестве аналитического реагента и химического промежуточного продукта, в чистящих и чистящих ваннах, в регенерации каучука и нефтепереработке, в закалочных ваннах для термической обработки стали, в резке и растворимых маслах, в мылах и моющих средствах, а также в широком разнообразии. других приложений.Химические свойства
NaOH представляет собой белый распущенный материал без запаха, продаваемый в виде гранул, хлопьев, комков или палочек. Водные растворы известны как содовый щелокФизические свойства
Белые ромбические кристаллы, выпускаемые в форме гранул, комочков, палочек, шариков, чипсов, хлопьев или растворов; гигроскопичен; очень едкий; быстро впитывает CO2 и воду из воздуха; плотность 2,13 г / см 3 ; плавится при 323 ° С; испаряется при 1388 ° С; давление пара 1 торр при 739 ° С и 5 торр при 843 ° С; очень растворим в воде (110 г / 100 мл при комнатной температуре), выделяя тепло при растворении; водные растворы сильнощелочные, рН 0.5% раствор около 13 и 0,05% раствор около 12; растворим в метаноле, этаноле и глицерине (23,8 г / 100 мл метанола и 13,9 г / 100 мл этанола при температуре окружающей среды).Использует
Каустическая сода является одним из наиболее широко используемых химических веществ. Используется для нейтрализации кислот; получать соли натрия; осаждать металлы и их гидроксиды; в нефтепереработке; в омылении сложных эфиров; в обработке целлюлозы, пластмассы и резины; и в многочисленных синтетических и аналитических приложениях.Использует
Гидроксид натрия продается коммерчески в виде безводных хлопьев или гранул или в виде 50% или 73% водных растворов. Он имеет бесчисленное количество промышленных применений и является одним из 10 лучших химических веществ с точки зрения производства и использования в глобальном масштабе. Приблизительно 15 миллионов тонн гидроксида натрия используется ежегодно. Его наибольшее использование, потребляющее около половины его производства, служит основой для производства других химических веществ. Он используется для контроля pH и нейтрализации кислот в химических процессах.Бумажная промышленность широко использует гидроксид натрия в процессе варки целлюлозы. Гидроксид натрия используется для разделения волокон путем растворения связующего лигнина. Он используется аналогичным образом при производстве вискозы из целлюлозы. Гидроксид натрия является ключевым химическим веществом в мыльной промышленности. В процессе омыления триглицериды, полученные от животных и растений, нагревают в абазинном растворе с получением глицерина и мыла:Гидроксид натрия используется в текстильной промышленности для отбеливания и обработки текстиля для макетхемного красителя. Более охотно.Нефтяная промышленность использует гидроокись натрия в буровых растворах и как бактерицид. Гипохлорит натрия (NaOCl) широко используется для очистки и в качестве дезинфицирующего средства. Обычный бытовой отбеливатель содержит около 5% раствора гипохлорита натрия. Гипохлорит натрия получают взаимодействием хлора с гидроксидом натрия: Cl2 (г) + 2NaOH (водный) → NaOCl (водный) + NaCl (водный) + h3O (л). Гидроксид натрия используется в пищевой промышленности для очистки и очистки овощей и фруктов. Гидроксид натрия является второстепенным компонентом многих бытовых продуктов, но в некоторых из них он может составлять более половины продукта.Дранокристаллы содержат от 30 до 60% гидроксида натрия, а некоторые очистители могут состоять из 100% гидроксида натрия.
Использует
Гидроксид натрия используется для корректировки рН продукта, чтобы сделать его более приемлемым для кожи. Это обычно упоминается как едкий натр, и часто служит химическим реагентом, делая мыло. Если он слишком концентрированный, это может вызвать сильное раздражение кожи.Использует
Гидроксид натрия представляет собой щелочь, растворимую в воде, имеющую Растворимость 1 г в 1 мл воды.используется для уничтожения горького химические вещества в оливках, которые должны стать черными оливками. это также функционирует нейтрализовать кислоты в различных пищевых продуктах.Использует
Гидроксид натрия является одним из важнейших промышленных химических веществ. По объему он входит в первую десятку химических веществ, производимых в Соединенных Штатах. Он используется в производстве большого количества соединений, включая несколько солей натрия, в обработке целлюлозы для производства вискозы и целлофана, а также в производстве мыла, моющих средств, целлюлозы и бумаги.Гидроксид натрия является распространенным нейтрализующим агентом для кислот при кислотно-основном титровании и нефтепереработке. Другим важным применением является извлечение металлов из их руд, где часто используют щелочной расплав, такой как расплав с едким натром, чтобы открыть руды. Кроме того, гидроксид натрия используется для осаждения металлов в виде гидроксидов. Другие области применения — регенерация каучука, растворение казеина в производстве пластмасс, рафинирование растительных масел, обработка текстиля, в качестве элюента в ионной хроматографии, травлении и гальванизации, а также в качестве лабораторного реагента.Гидроксид натрия также используется в качестве сильного основания во многих реакциях органического синтеза и катализируемых основаниями.Использует
Растворы NaOH используются для нейтрализации кислот и получения солей натрия, например, при переработке нефти для удаления серной и органических кислот; обработать целлюлозу при изготовлении вискозного вискоза и целлофана; в восстановлении резины, чтобы растворить ткань; при изготовлении пластмасс для растворения казеина. Растворы NaOH гидролизуют жиры и образуют мыла; они осаждают алкалоиды (основания) и большинство металлов (в виде гидроксидов) из водных растворов их солей.Фармацевтическая помощь (алкализатор).Определение
Самый важный рекламный ролик каустическая сода.Методы производства
Гидроксид натрия получают электролизом рассола с использованием инертные электроды. Хлор выделяется в виде газа на аноде и водород выделяется в виде газа на катоде. Удаление хлорида и ионы водорода оставляют ионы натрия и гидроксида в растворе. Раствор сушат, чтобы получить твердый гидроксид натрия.Второй метод использует ячейку Келлнера-Солвея. Насыщенный натрий раствор хлорида электролизуется между углеродным анодом и протекающий ртутный катод. В этом случае натрий производится на катод, а не водород из-за готовности натрия, чтобы раствориться в ртути. Натрий-ртутная амальгама затем подвергается воздействию воды и раствора гидроксида натрия производится.
Подготовка
Гидроксид натрия производится вместе с хлором путем электролиза раствора хлорида натрия.Различные типы электролизеров используются в промышленности. Они включают ртутную клетку, клетку диафрагмы и мембранную клетку.
Насыщенный раствор рассола подвергается электролизу. Газообразный хлор выделяется на аноде, а ион натрия — на катоде. Разложение воды приводит к образованию ионов водорода и гидроксида. Гидроксид-ион соединяется с ионом натрия, образуя NaOH. Общие электролитические реакции могут быть представлены как:
2Na + + 2Cl — + 2H 2 O → Cl 2 (г) + H 2 (г) + 2NaOH (водн.)
Ячейка ртути протекает в две стадии, которые происходят раздельно в двух ячейках.Первый известен как рассольный элемент или первичный электролизер, в котором ион натрия осаждается на ртутном катоде, образуя амальгаму, а газообразный хлор выделяется на аноде:
Na + + Cl — → Na-Hg (катод) + ½Cl 2 (г) (анод)
Во второй ячейке, известной как ячейка для разложения, используется графитовый катод, в то время как амальгама натрия служит анодом. Вода реагирует с металлическим натрием амальгамы в декомпозере:
Na-Hg + H 2 O → Na + + OH– + ½H 2 ↑ + Hg
В хлорщелочных мембранных элементах диафрагма используется для отделения хлора, выделяющегося на аноде, от гидроксида натрия и водорода, образующегося на катоде.Без диафрагмы образующийся гидроксид натрия будет соединяться с хлором с образованием гипохлорита натрия и хлората. Во многих клетках для такого разделения используются асбестовые диафрагмы. Многие типы клеток диафрагмы доступны.
Гидроксид натрия производится в виде безводного твердого вещества или в виде 50% водного раствора.
Реакции
Гидроксид натрия является сильно щелочным и может реагировать с кислотами с образованием солей и воды.
Гидроксид натрия реагирует с кислотными оксидами с образованием соли и воды, поэтому гидроксид натрия может использоваться для поглощения кислых газов в лаборатории или в промышленности.
Гидроксид натрия может реагировать с водными растворами многих солей металлов с образованием солей натрия и гидроксидов металлов
Когда гидроксид натрия и соль аммиака нагреваются вместе, он может выделять аммиак
Гидроксид натрия обладает высокой коррозионной активностью, поэтому стеклянные бутылки, в которых хранятся растворы гидроксида натрия, должны быть резиновыми пробками, а стеклянные пробки не должны использоваться для предотвращения открытия химической реакции. Гидроксид натрия является важным промышленным сырьем и может быть получен электролизом солевого раствора в заводских условиях.
Общее описание
Белое тело.Разъедает металлы и ткани. Используется в химическом производстве, нефтепереработке, чистящих составах, очистителях сточных вод.Реакции воздуха и воды
Растворим в воде. Растворение может выделять достаточно тепла, чтобы вызвать парение и разбрызгивание и воспламенить смежные горючие материалы [Haz. Химреагент Данные 1966 г.].Реактивность профиля
КАУСТИЧЕСКАЯ СОДА (гидроксид натрия) является сильным основанием. Быстро и экзотермически реагирует с кислотами, как органическими, так и неорганическими.Легко поглощает влагу из воздуха, образуя едкие полутвердые вещества, которые атакуют алюминий и цинк с выделением легковоспламеняющегося газообразного водорода. Катализирует полимеризацию ацетальдегида и других полимеризуемых соединений; эти реакции могут происходить бурно, например, акролеин полимеризуется с чрезвычайной силой при контакте со щелочными материалами, такими как гидроксид натрия [Chem. Паспорт безопасности SD-85 1961]. Реагирует с большим бешенством с пентаоксидом фосфора при локальном нагревании [Mellor 8 Supp.3: 406 1971]. Контакт (в качестве осушающего агента) с тетрагидрофураном, который часто содержит пероксиды, может быть опасным — при таком использовании химически сходного гидроксида калия произошли взрывы [NSC Newsletter Chem. Soc. 1967]. Смешивание с любым из следующих веществ в закрытом контейнере вызвало повышение температуры и давления: ледяная уксусная кислота, уксусный ангидрид, акролеин, хлоргидрин, хлорсульфоновая кислота, этиленциангидрин, глиоксаль, соляная кислота (36%), фтористоводородная кислота (48.7%), азотная кислота (70%), олеум, пропиолактон, серная кислота (96%) [NFPA 1991]. Случайный контакт между едким моющим раствором (вероятно, содержащим гидроксид натрия) и пентолом вызвал сильный взрыв. [MCA Case History 363 (1964)]. Нагревание смесью метилового спирта и трихлорбензола во время попытки синтеза привело к внезапному повышению давления и взрыву [Руководство по безопасности MCA, Приложение 3, 1972]. Горячий и / или концентрированный NaOH может вызвать экзотермическое разложение гидрохинона при повышенной температуре.(NFPA Pub. 491M, 1975, 385)Опасность
Разъедает ткани в присутствии влаги сильный раздражитель ткани (глаза, кожа, слизистые мембраны и верхние дыхательные пути), яд проглатывания.Опасность для здоровья
Сильное коррозионное воздействие на контактирующие ткани. Вдыхание: пыль может привести к повреждению верхних дыхательных путей и самого легкого, вызывая легкое раздражение носа при пневмоните. Проглатывание: серьезное повреждение слизистых оболочек; Могут возникнуть серьезные рубцы или перфорация.Контакт с глазами: наносит серьезный ущерб.Опасность для здоровья
Гидроксид натрия является очень агрессивным веществом, которое вызывает повреждение тканей человека. Его действие на кожу несколько отличается от кислотных ожогов. Немедленной боли нет, но она проникает в кожу. Он не коагулирует белок, чтобы предотвратить его дальнейшее проникновение, и, таким образом, едкий ожог может стать серьезным и медленным излечением. Разлив концентрированных растворов в глаза может привести к сильному раздражению или травме.Он токсичен при проглатывании и вдыхании его пыли. Хотя было установлено, что пероральная токсичность 5–10% раствора едкого натра была низкой у подопытных животных, высокие дозы при больших концентрациях могут вызывать рвоту, прострацию и коллапс. Пероральная летальная доза для кроликов составляет 500 мг / кг (NIOSH 1986).
Пыль или аэрозоли гидроксида натрия вызывают раздражение глаз, носа и горла. Длительное воздействие высоких концентраций в воздухе может привести к изъязвлению носового прохода.
Пожарная опасность
Негорючее, само вещество не горит, но может разлагаться при нагревании с образованием едких и / или токсичных паров.Некоторые из них являются окислителями и могут воспламенить горючие вещества (дерево, бумага, масло, одежда и т. Д.). При контакте с металлами может выделяться горючий газообразный водород. Контейнеры могут взорваться при нагревании.Воспламеняемость и взрывобезопасность
Гидроксид натрия и гидроксид калия не воспламеняются как твердые или водные решения.Фармацевтические применения
Гидроксид натрия широко используется в фармацевтических составах для отрегулируйте рН растворов.Это может также использоваться, чтобы реагировать со слабым кислоты с образованием солей.Промышленное использование
Каустическая сода (NaOH) считается самым сильным щелочным регулятором рН. Каустическая сода является очень активным веществом и очень агрессивным. Основная часть каустической соды производится электролизом насыщенных рассолов (NaCl). Каустическая сода имеет очень сильное регулирование pH способность (то есть от рН 7 до рН 14) при относительно низкой дозировке по сравнению с другие щелочные вещества. Коммерчески каустическая сода доступна в безводной форме, но в большинстве горных работ каустическая сода поставляется в виде 50% раствора.В горнодобывающей промышленности гидроксид натрия в основном используется для контроля щелочности при обработке неметаллических минералов. При флотации основного металла использование гидроокись натрия встречается редко.
Профиль безопасности
Яд внутрибрюшинным путем. Умеренно токсичен при приеме внутрь. Данные мутации сообщили. Разъедающее раздражение кожи, глаз и слизистых оболочек. При нагревании до разложения он выделяет токсичные пары NanO.Безопасность
Гидроксид натрия широко используется в фармацевтической и пищевой промышленности. промышленности и обычно рассматривается как нетоксичный материал при низких концентрации.При высоких концентрациях он является едким раздражителем для кожа, глаза и слизистые оболочки.LD50 (мышь, IP): 0,04 г / кг
LD50 (кролик, оральный): 0,5 г / кг

Leave A Comment