пропин + h3O = ? уравнение реакции
Реакция взаимодействия пропина с водой (пропин + h3O = ?) носит название гидратации. Это одна из важнейших реакций алкинов (непредельные углеводороды с одной тройной связью), в результате которой получаются карбонильные соединения. Реакция гидратациии алкинов была открыта русским химиком М.Г. Кучеровым (1881) и носит его имя.
Гидратация алкинов протекает в присутствии катализаторов – серной кислоты и сульфата ртути (II) . На первой стадии реакции в результате присоединения молекулы воды образуется непредельный спирт, у которого гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми.
Отличительной чертой алифатических ненасыщенных соединений, содержащий гидроксильную группу при двойной связи, является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны). При гидратации пропина образуется ацетон (диметилкетон):
Качественной реакцией на ацетон является образование иодоформа – желтого вещества с характерным запахом, образующегося при нагревании ацетона с иодом в присутствии щелочей.
Задание №1
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ БРОМИРОВАНИЯ |
А) этан Б) изобутан В) циклопропан Г) циклогексан |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №2
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с избытком бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
А) пропилен Б) циклопропан В) бутен-2 Г) бутен-1 |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №3
Установите соответствие между реагирующими веществами и углеродсодержащими продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| 1) CH4 2) CH2=CH2 3) CH3-CH2-OH 4) HC≡CH 5) CH 6) AgC≡CAg |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №4
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с избытком бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
А) бутен-1 Б) циклобутан В) пропилен Г) пропин | 1) CH3-CHBr-CHBr-CH3 2) Br-CH2-CH2-CH 3) CH3-CBr2-CH3 4) CH3-CHBr-CH2-CH3 5) CH3-CH2-CH2-CH2-Br 6) CH3-CHBr-CH3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №5
Установите соответствие между химической реакцией и органическим веществом, преимущественно образующимся в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ОРГАНИЧЕСКОЕ ВЕЩЕСТВО |
А) гидрирование циклопропана Б) гидратация пропилена В) изомеризация гексана Г) дегидрирование циклогексана | 1) циклогексан 2) CH3-CH(CH3)-CH2-CH2-CH3 3) CH3-CBr2-CH3 4) CH3-CH(OH)-CH3 5) CH3-CH2-CH3 6) бензол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №6
Установите соответствие между названием вещества и преимущественно образующимся продуктом его гидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
А) бутен-1 Б) бутин-1 В) бутен-2 Г) бутин-2 | 1) бутаналь 2) бутанол-1 3) бутанол-2 4) бутанон 5) бутандиол-1,2 6) бутановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №7
Установите соответствие между химической реакцией и органическим веществом, преимущественно образующимся в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ОРГАНИЧЕСКОЕ ВЕЩЕСТВО |
А) гидрирование пропилена Б) гидратация пропина В) изомеризация бутана Г) дегидрирование бутана | 1) CH3-CH(CH3)-CH3 2) CH3-CH(OH)-CH3 3) CH2=CH-CH=CH2 4) CH3-C(O)-CH3 5) CH3-CH2-CH3 6) CH3-CH2-CHO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №8
Установите соответствие между реагирующими веществами и углеродсодержащими продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №9
Установите соответствие между схемой реакции и органическим веществом, преимущественно образующимся при этом взаимодействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №10
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с водородом в соотношении 1:1: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №11
Установите соответствие между названиями веществ и углеродсодержащими продуктами, которые преимущественно образуются при их взаимодействии с подкисленным раствором перманганата калия при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) бутен-2 Б) циклогексен В) этилен Г) стирол |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №12
Установите соответствие между схемой реакции и органическим веществом, преимущественно образующимся при этом взаимодействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №13
Установите соответствие между схемой реакции и продуктом, который преимущественно образуется при взаимодействии этого вещества с хлором: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №14
Установите соответствие между названием вещества и схемой реакции его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №15
Установите соответствие между схемой реакции и органическим веществом, преимущественно образующимся при этом взаимодействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №16
Установите соответствие между схемой превращения углеводорода и методом воздействия, с помощью которого данное превращение можно осуществить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №17
Ниже представлены возможные процессы, протекающие при взаимодействии метана с хлором: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №18
Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| 1) 1,3,5-триметилбензол 2) пропилбензол 3) изопропилбензол 4) стирол 5) гексабромциклогексан 6) бромбензол |
Задание №19
Установите соответствие между схемой реакции и реагентом, необходимым для протекания данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | РЕАГЕНТ X |
А) CH3–СН(CH3)–CH3 + X → CH3–СBr(CH3)–CH3 Б) CH3–СH2Cl + X → CH3–CH2–CH2–CH3 В) HC≡CН + X → AgC≡CAg Г) H2C=CH–CH3 + X → CH3–CHBr–CH3 | 1) HBr 2) NaOH 3) Br2 4) Na 5) Ag 6) Ag2O (p-p NH3) |
Задание №20
Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
А) C2H2 Б) CH3–СH2–СH3 + Br2 → В) HC≡CН + HC≡CН → Г) С7H16 | 1) бензол 2) 1-бромпропан 3) 2-бромпропан 4) дивинил 5) винилацетилен 6) толуол |
Задание №21
Установите соответствие между схемой реакции и продуктом, который преимущественно образуется в ходе этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
А) толуол + бром Б) бензол + бромметан В) толуол + бром Г) бензол + хлор |
|
Задание №22
Установите соответствие между названием исходного вещества и продуктом, который образуется при взаимодействии этого вещества с избытком водорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ИСХОДНОГО ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
А) пропен Б) циклопропан В) пропин Г) метилпропен | 1) изобутан 2) диметилпропан 3) метилбутан 4) бутан 5) изопрен 6) пропан |
Задание №23
Установите соответствие между схемой реакции и реагентом Х, который участвует в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | РЕАГЕНТ X |
| 1) H2 2) HBr 3) Br2 4) H2O 5) KOH (водн.) 6) KOH (спирт.) |
Задание №24
Установите соответствие между названием исходного вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ИСХОДНОГО ВЕЩЕСТВА | ПРОДУКТ БРОМИРОВАНИЯ |
А) пропан Б) циклопропан В) циклогексан Г) изобутан |
|
Алкины | CHEMEGE.RU
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Все алкины имеют общие или похожие физические и химические свойства. Схожие по строению алкины, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкины образуют гомологический ряд.
Первый представитель гомологического ряда алкенов – этин (ацетилен) C2H2, или СH≡СH.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкина | Формула алкина |
| Этин (ацетилен) | C2H2 |
| Пропин | C3H4 |
| Бутин | C4H6 |
| Пентин | C5H8 |
| Гексин | C6H10 |
| Гептин | C7H12 |
Общая формула гомологического ряда алкинов CnH2n-2.
Первые три члена гомологического ряда алкинов – газы, начиная с C5Н8 по С16Н30 – жидкости, начиная с С17Н32 — твердые вещества.
Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях.
Рассмотрим особенности строения алкинов на примере ацетилена.
В молекуле ацетилена присутствуют химические связи C–H и С≡С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С≡С – тройная, ковалентная неполярная, одна из связей σ, еще две: π-связи. Атомы углерода при тройной связи образуют по две σ-связи и две π-связи. Следовательно, гибридизация атомов углерода при тройной связи в молекулах алкинов – sp:

При образовании σ-связи между атомами углерода происходит перекрывание sp-гибридных орбиталей атомов углерода:

При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:

Две sp-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому две гибридные орбитали атомов углерода при тройной связи в алкинах направлены в пространстве под углом 180о друг к другу:

Изображение с сайта orgchem.ru
Это соответствует линейному строению молекулы.
| Например, молекуле ацетилена C2H2 соответствует линейное строение. |

Изображение с сайта orgchem.ru
Молекулам алкинов с большим числом атомов углерода соответствует пространственное строение.
| Например, в молекуле пропина присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение. |
Для алкинов характерна структурная и пространственная изомерия.
Структурная изомерия
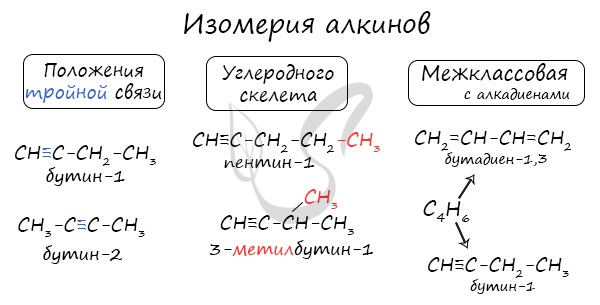
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры с различным углеродным скелетом и с формулой С4Н6 — бутин-1 и бутадиен-1,3 |
| Пентин-1 | 3-Метилбутин-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми изомерами с алкадиенами. Общая формула алкинов и алкадиенов — CnH2n-2.
| Например. Межклассовые изомеры с общей формулой С4Н6 — бутин-1 и бутадиен |
| Бутин-1 | Бутадиен |
 |  |
Изомеры с различным положением тройной связи отличаются положением тройной связи в углеродном скелете.
| Например. Изомеры положения тройной связи, которые соответствуют формуле С5Н8 — пентин-1 и пентин-2 |
| Пентин-1 | Пентин-2 |
 |  |
Пространственная изомерия
Для алкенов также характерна оптическая изомерия.
Алкины, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкина должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия для алкинов не характерна, так как по тройной связи вращение возможно.
В названиях алкинов для обозначения тройной связи используется суффикс -ИН.
| Например, алкин на рисунке называется бутин-2 |

Для простейших алкинов применяются также исторически сложившиеся (тривиальные) названия:
| Название алкина | Формула алкина |
| Ацетилен | CH≡CH |
| Пропин | CH≡C−CH3 |
| Бутин-1 | CH≡C−СH2−CH3 |
Радикалы, содержащие тройную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH≡C− | этинил |
| CH≡C−CH2− | пропаргил |
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |

При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |

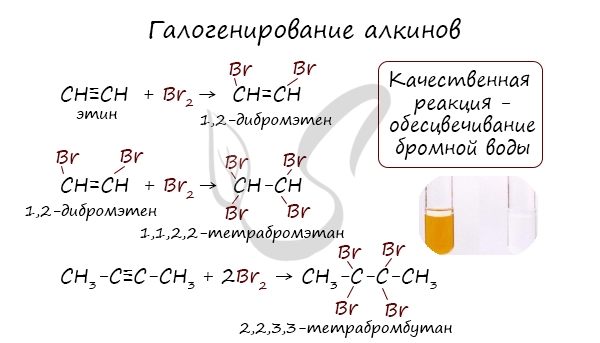
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |


Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
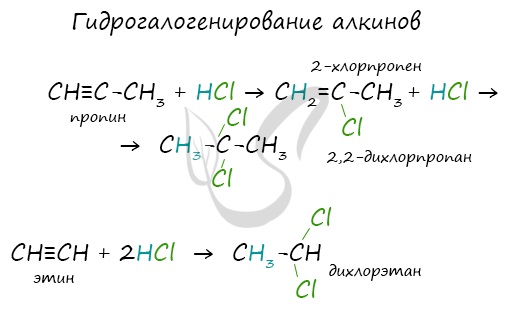
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |


При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |


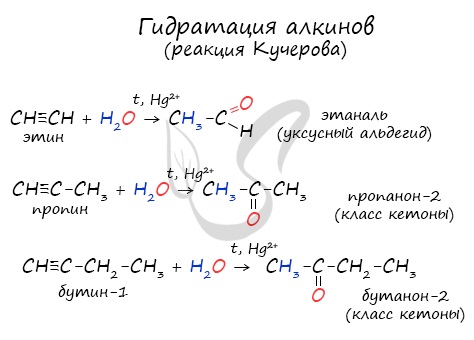
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |

Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
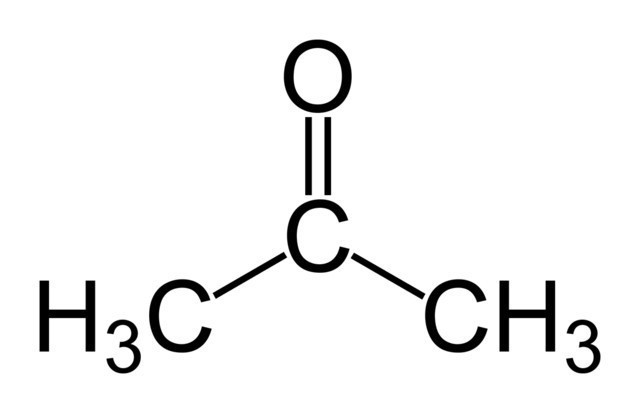
| Например, при гидратации пропина образуется пропанон (ацентон). |

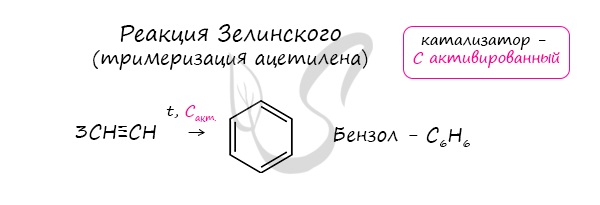
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:

Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):

Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например, уравнение сгорания пропина: |
C3H4 + 4O2 → 3CO2 + 2H2O
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:

При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:

При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия |

Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:

В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:

Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |

| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |

Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):

| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).

1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |

2. Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.

Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500оС.
Если процесс проводить дольше, то метан разлагается на углерод и водород:

3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
В кислой среде образуется ацетилен и соответствующая соль:
CaC2 + 2HCl = CaCl2 + C2H2
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
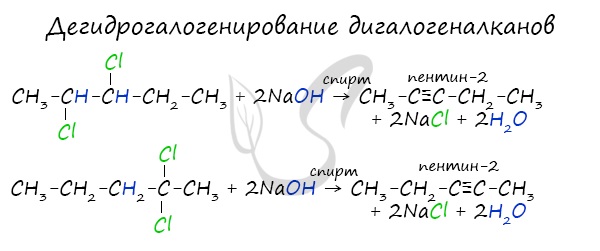
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
| Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия |

1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
5. Алкилирование соединений алкинов с металлами
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
| Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2 |

Гидратация алкинов по Кучерову
Алкины при наличии катализаторов присоединяют воду и образуют карбонильные соединения. Промышленное значение приобрела реакция гидратации ацетилена, открытая в 1881 г. М. Г. Кучеровым, который установил, что присоединение воды к ацетилену происходит в среде 10%-го раствора $H_2SO_4$ при наличии 5% сульфата ртути. Продуктом реакции является уксусный альдегид:
Рисунок 1.
Механизм гидратации ацетилена
Гидратацию ацетилена называют реакцией Кучерова. Механизм этой реакции еще не полностью выяснен. Считают, что сначала к тройной углерод-углеродной связи присоединяется катализатор и образует с ним продукт присоединения (І). Продукт (І) далее гидролизуется в енол — неустойчивый виниловый спирт (II), который сразу же изомеризуется (таутомеризуеться) в термодинамически устойчивое соединение (в карбонильную форму) — уксусный альдегид (III):
Рисунок 2.
Установлено, что кроме солей ртути гидратацию алкинов катализируют соли трехвалентного золота, одновалентной меди, одновалентного серебра и трехвалентного рутения. Механизм реакций Кучерова достаточно сложен, до конца не изучен и содержит еще много неясных моментов. В частности, неясна роль ионов металлов (йонов ртути в классической реакции) и путь образования винил-катионов в качестве промежуточных частиц.
Готовые работы на аналогичную тему
Енолы
Органические соединения, в молекулах которых $OH$-группа соединена с атомом углерода с двойной связью, как например, в виниловом спирте (II), называют енолами («ен-» означает наличие в молекуле двойной $C = C$-связи, «-ол» — означает $OH$-группы спирта).
А. П. Эльтеков в 1877 сформулировал правило, согласно которому ненасыщенные спирты с группой -$OH$ у атома углерода с двойной связью являются неустойчивыми и самовольно изомеризуются в устойчивые карбонильные соединения. Это правило выполняется преимущественно для простых енольных систем.
Исследования химиков показали, что всегда при извлечении соединения с енольной структурой получают изомерные ей соединения с карбонильной структурой. Между енольной и карбонильной структурами существует равновесие:
Рисунок 3.
Такая перегруппировка енольной структуры в карбонильную происходит особенно легко и поэтому равновесие этого процесса сильно смещено в сторону карбонильной структуры. Причина такой изомеризации заключается в том, что вследствие высокой полярности связи $O-H$ атом водорода этой группы енола может легко отщеплятся от атома кислорода в виде иона. При обратном присоединении этот ион водорода может присоединятся как к атому кислорода, так и к атому углерода с двойной связью. Если $H^+$ присоединится к кислороду, то очень легко сможет снова отщепиться. Если этот ион присоединится к углероду, то уже останется соединенным с ним, поскольку полярность связи $C-H$ достаточно мала. В результате происходит перегруппировка, при которой сильная кислота превращается в значительно более слабую:
Рисунок 4.
Структурные изомеры, между которыми существует равновесие, называют таутомерами, а явление существования такой изомерии называют таутомерия.
Гидратация гомологов ацетилена
Гидратация гомологов ацетилена приводит к образованию кетонов. Присоединение воды к алкинам-1 происходит по правилу Марковникова. Например, при гидратации пропина образуется диметилкетон (ацетон):
Рисунок 5.
Из терминальных алкинов $R-CHC-H$ при гидратации получают почти всегда метилкетоны $R-CO-CH_3$, а из двцзамещенныих $R»-CH_2-R’$ ($R»$ и $R’$ — различные по строению алкильные группы) — кетоны, образование которых подчиняется такой такой тенденции: для первичного $R$ ($CH_3$- или $CH_3-CH_2-$) и вторичного или третичного $R$ ($-CH(CH_3)_2$ или $-C(CH_3)_3$) карбонильная группа $C =O$ образуется в основном в $\alpha$-положении к вторичному или третичному атому углерода алкиле $R$. Так, при гидратации метилизопропилацетилена в реакционной смеси будет преобладать етилизопропилкетон по сравнению изобутилметилкетоном:
Рисунок 6.
Катализируемые кислотами и ионами ртути (II) реакции присоединения воды по месту тройной связи алкинов протекает строго по правилу Марковникова. Следовательно, гидратация как терминальноых, так и нетерминальных алкинов всегда приводит к кетонам, например для циклических и линейных алкинов:
Рисунок 7.
Гидратация пропилена: уравнение реакции
Органические вещества занимают важное место в нашей жизни. Они являются основной составляющей полимеров, которые окружают нас повсюду: это и полиэтиленовые пакеты, и резина, а также множество других материалов. Полипропилен занимает в этом ряду не последнюю ступень. Он также входит в состав различных материалов и применяется в ряде отраслей, таких как строительство, имеет бытовое применение в качестве материала для пластиковых стаканчиков и прочих мелких (но не по масштабам производства) нужд. Прежде чем поговорить о таком процессе, как гидратация пропилена (благодаря которому, кстати, мы можем получить изопропиловый спирт), обратимся к истории открытия этого необходимого для промышленности вещества.
История
Как таковой даты открытия пропилен не имеет. Однако его полимер — полипропилен -был фактически открыт в 1936 году известным немецким химиком Отто Байером. Конечно, теоретически было известно, как можно получить столь важный материал, но практически сделать это не удавалось. Удалось это только в середине двадцатого века, когда немецкий и итальянский химики Циглер и Натт открыли катализатор полимеризации непредельных углеводородов (имеющих одну и более кратных связей), который впоследствии так и назвали: катализатор Циглера-Натта. До этого момента решительно невозможно было сделать так, чтобы реакция полимеризации таких веществ пошла. Были известны реакции поликонденсации, когда без воздействия катализатора вещества соединялись в полимерную цепь, образуя при этом побочные вещества. Но с непредельными углеводородами это сделать не удавалось.
Ещё одним важным процессом, связанным с этим веществом, была его гидратация. Пропилена в годы начала его применения было достаточно много. И всё это благодаря изобретённым разными нефте- и газоперерабатывающими компаниями способам излечения пропена (так иногда тоже называют описываемое вещество). При крекинге нефти он был побочным продуктом, а когда оказалось, что его производное, изопропиловый спирт, является основой для синтеза множества полезных для человечества веществ, многие фирмы, такие как BASF, запатентовали свой способ его производства и начали массовую торговлю этим соединением. Гидратация пропилена была опробована и применена раньше полимеризации, именно поэтому ацетон, пероксид водорода, изопропиламин начали производить раньше полипропилена.
Очень интересен процесс выделения пропена из нефти. Именно к нему мы сейчас и обратимся.
Выделение пропилена
На самом деле в теоретическом понимании основным способом является лишь один процесс: пиролиз нефти и попутных газов. Но вот технологических реализаций — просто море. Дело в том, что каждая компания стремится получить уникальный способ и защитить его патентом, а другие такие же компании также ищут свои способы, чтобы всё-таки производить и продавать пропен как сырьё или же превращать его в различные продукты.
Пиролиз («пиро» — огонь, «лиз» — разрушение) — химический процесс распада сложной и большой молекулы на более мелкие под действием высокой температуры и катализатора. Нефть, как известно, представляет собой смесь углеводородов и состоит из лёгких, средних и тяжёлых фракций. Из первых, самых низкомолекулярных, и получают пропен и этан при пиролизе. Проводят этот процесс в специальных печах. У самых передовых фирм-производителей этот процесс технологически различается: одни используют песок в качестве теплоносителя, другие — кварц, третьи — кокс; можно также разделить печи по их строению: бывают трубчатые и обычные, как их называют, реакторы.
Но процесс пиролиза позволяет получить недостаточно чистый пропен, так как, кроме него, там образуется огромное множество углеводородов, которые потом приходится разделять достаточно энергозатратными способами. Поэтому для получения более чистого вещества для последующей гидратации применяют также дегидрирование алканов: в нашем случае — пропана. Так же, как и полимеризация, вышеописанный процесс просто так не происходит. Отщепление водорода от молкулы предельного углеводорода происходит под действием катализаторов: оксида трёхвалентного хрома и оксида алюминия.
Ну а прежде чем перейти к рассказу о том, как происходит процесс гидратации, обратимся к строению нашего непредельного углеводорода.
Особенности строения пропилена
Пропен сам по себе — лишь второй член ряда алкенов (углеводороды с одной двойной связью). По лёгкости он уступает лишь этилену (из которого, как можно догадаться, делают полиэтилен — самый массовый полимер в мире). В обычном состоянии пропен — газ, как и его «родственник» из семейства алканов, пропан.
Но существенное отличие пропана от пропена — в том, что последний имеет в своём составе двойную связь, которая коренным образом меняет его химические свойства. Она позволяет присоединять к молекуле непредельного углеводорода другие вещества, в результате чего получаются соединения с совершенно другими свойствами, зачастую очень важными для промышленности и быта.
Пришло время поговорить о теории реакции, которой, собственно, и посвящена эта статья. В следующем разделе вы узнаете, что при гидратации пропилена образуется один из самых промышленно важных продуктов, а также то, как происходит эта реакция и какие в ней есть нюансы.

Теория гидратации
Для начала обратимся к более общему процессу — сольватации, — который включает в себя также и описанную выше реакцию. Это химическое превращение, которое заключается в присоединении молекул растворителя к молекулам растворённого вещества. При этом они могут образовывать новые молекулы, или же так называемые сольваты, — частицы, состоящие из молекул растворённого вещества и растворителя, связанных электростатическим взаимодействием. Нас интересует только первый вид веществ, ведь при гидратации пропилена преимущественно образуется именно такой продукт.
При сольватации вышеописанным способом молекулы растворителя присоединяются к растворённому веществу, получается новое соединение. В органической химии при гидратации преимущественно образуются спирты, кетоны и альдегиды, однако есть и несколько других случаев, например образование гликолей, но их мы касаться не будем. На самом деле этот процесс очень прост, но в то же время достаточно сложен.
Механизм гидратации
Двойная связь, как известно, состоит из двух видов соединения атомов: пи- и сигма-связей. Пи-связь при реакции гидратации разрывается всегда первой, так как она менее прочная (обладает меньшей энергией связи). При её разрыве образуются две вакантные орбитали у двух соседних атомов углерода, которые могут образовать новые связи. Молекула воды, существующая в растворе в виде двух частиц: гидроксид-иона и протона, способна присоединяться по разорвавшейся двойной связи. При этом гидроксид-ион присоединяется к центральному атому углерода, а протон — ко второму, крайнему. Таким образом, при гидратации пропилена преимущественно образуется пропанол 1, или изопропиловый спирт. Это очень важное вещество, так как при его окислении можно получить ацетон, массово используемый в нашем мире. Мы сказали, что он образуется преимущественно, однако это не совсем так. Надо сказать так: единственный продукт образуется при гидратации пропилена, и это — изопропиловый спирт.
Это, конечно, всё тонкости. На самом деле всё можно описать гораздо проще. И сейчас мы узнаем, как же в школьном курсе записывают такой процесс, как гидратация пропилена.
Реакция: как она происходит
В химии всё принято обозначать просто: с помощью уравнений реакций. Вот и химическое превращение обсуждаемого вещества можно описать таким способом. Гидратация пропилена, уравнение реакции которой очень простое, проходит в две стадии. Сначала разрывается пи-связь, входящая в состав двойной. Затем молекула воды в виде двух частиц, гидроксид-аниона и катиона водорода, подходит к молекуле пропилена, имеющей на данный момент два вакантных места для образования связей. Гидроксид-ион образует связь с менее гидрогенизированным атомом углерода (то есть с таким, к которому присоединено меньшее количество атомов водорода), а протон, соответственно, — с оставшимся крайним. Таким образом, получается один-единственный продукт: предельный одноатомный спирт изопропанол.
Как записать реакцию?
Сейчас мы узнаем, как химическим языком записать реакцию, отражающую такой процесс, как гидратация пропилена. Формула, которая нам пригодится: CH2 = CH — CH3. Это формула исходного вещества — пропена. Как можно видеть, у него есть двойная связь, обозначенная знаком «=», и именно в это место будет присоедняться вода, когда будет происходить гидратация пропилена. Уравнение реакции можно записать так: CH2 = CH — CH3 + H2O = CH3 — CH(OH) — CH3. Гидроксильная группа в скобочках означает, что эта часть находится не в плоскости формулы, а ниже или выше. Тут мы не можем показать углы между тремя группами, отходящими от среднего атома углерода, но скажем, что они примерно равны между собой и составляют по 120 градусов.
Где это применяется?
Мы уже говорили, что получаемое в ходе реакции вещество активно используется для синтеза других жизненно важных нам веществ. Оно очень похоже по строению на ацетон, от которого отличается только тем, что вместо гидроксогруппы там стоит кетогруппа (то есть атом кислорода, соединённый двойной связью с атомом азота). Как известно, сам ацетон находит применение в растворителях и лаках, но, кроме этого, он применяется в качестве реагента для дальнейшего синтеза более сложных веществ, таких как полиуретаны, эпоксидные смолы, уксусный ангидрид и так далее.
Реакция получения ацетона
Думаем, нелишним будет описать превращение изопропилового спирта в ацетон, тем более что реакция эта не так сложна. Для начала пропанол испаряют и при 400-600 градусах по Цельсию оксиляют кислородом на специальном катализаторе. Очень чистый продукт получается при проведении реакции на серебряной сетке.

Уравнение реакции
Не будем вдаваться в подробности механизма реакции окисления пропанола в ацетон, так как он очень сложен. Ограничимся обычным уравнением химического превращения: CH3 — CH(OH) — CH3 + O2 = CH3 — C(O) — CH3 + H2O. Как видно, на схеме всё достаточно просто, но стоит углубиться в процесс, и мы столкнёмся с рядом трудностей.
Заключение
Вот мы и разобрали процесс гидратации пропилена и изучили уравнение реакции и механизм её протекания. Рассмотренные технологические принципы лежат в основе реальных процессов, происходящих в производстве. Как оказалось, они не очень сложны, однако имеют реальную пользу для нашей повседневной жизни.
Алкины, подготовка к ЕГЭ по химии
Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкинов
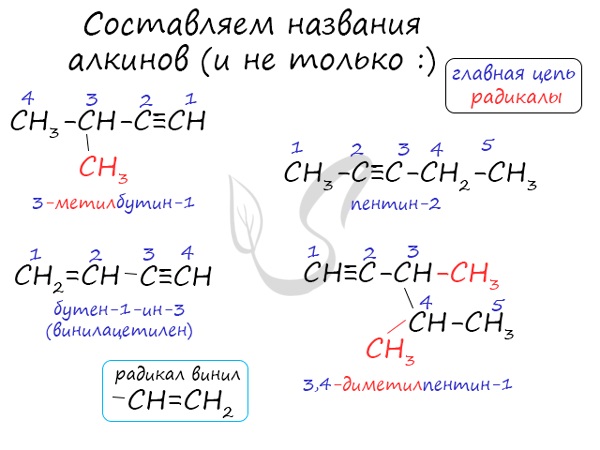
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
- Синтез Бертло
- Разложение карбида кальция
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
2CH4 → (t) CH≡CH + 3H2
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
CaC2 + 2H2O → CH≡CH + Ca(OH)2
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкины
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Реакция Кучерова
- Окисление
- Реакция Н.Д. Зелинского (тримеризация ацетилена)
- Димеризация ацетилена
- Образование солей алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH2=CH-CH3 + H2 → (t, Ni) CH3-CH2-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg2+.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
2CH≡CH + 5O2 → 4CO2 + 2H2O
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.

Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
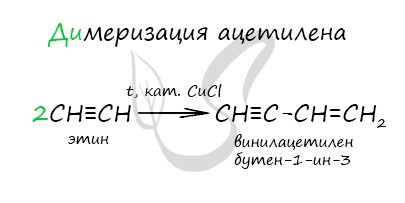
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Способы получения альдегидов и кетонов
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:

Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:

| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. |
Структурная формула кетонов:

1. Окисление спиртов
| При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны. |
1.1. Окисление спиртов оксидом меди (II)
| Например, при окислении этанола оксидом меди образуется уксусный альдегид |

| Например, при окислении изопропанола оксидом меди образуется ацетон |

1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
| Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь |

В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:

1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
| Например, при дегидрировании этанола образуется этаналь |

3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
| Например, при гидратации ацетилена образуется уксусный альдегид |
| Например: при гидратации пропина образуется ацетон |

4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
| Например: при гидролизе 1,1-дихлорэтана образуется этаналь |

5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
| Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция: |

6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.

Общее название: дипивефрин гидрохлорид
Лекарственная форма: офтальмологический раствор
Медицински рассмотрен Drugs.com. Последнее обновление: 22 мая 2020 г.
Пропин Описание
Propine® содержит дипивефрина гидрохлорид в стерильном изотоническом растворе. Дипивефрин HCI представляет собой белый кристаллический порошок, легко растворимый в воде с осмоляльностью примерно 250 — 330 мОсмоль / кг.
Эмпирическая формула:
C19h39O5N • HCI
Химическое название: (±) -3,4-дигидрокси-α– [(метиламино) метил] бензиловый спирт 3,4-дипивалат гидрохлорид.
СТРУКТУРНАЯ ФОРМУЛА:
Содержит: Активный: дипивефрин HCl 0,1%
Консервант: бензалкония хлорид
Неактивные вещества: эдетат динатрия; дистиллированная вода; хлорид натрия; и соляная кислота для корректировки рН. РН в течение срока годности составляет от 2,5 до 3,5.
пропина — клиническая фармакология
Пропин® (офтальмологический раствор дипивефрина HCI, USP) входит в класс препаратов, известных как пролекарства.Пролекарства обычно не активны сами по себе и требуют биотрансформации к исходному соединению, прежде чем проявляется терапевтическая активность. Эти модификации предпринимаются для усиления абсорбции, уменьшения побочных эффектов и повышения стабильности и комфорта, что делает исходное соединение более полезным лекарственным средством. Повышенная абсорбция делает пролекарство более эффективной системой доставки для исходного лекарственного средства, поскольку для получения желаемого терапевтического ответа потребуется меньшее количество лекарственного средства.
Офтальмологический растворPropine® — это пролекарство адреналина, образующееся в результате переэтерификации адреналина и пивалевой кислоты.Добавление пивалоильных групп к молекуле адреналина усиливает ее липофильный характер и, как следствие, его проникновение в переднюю камеру.
Propine® превращается в адреналин в человеческом глазу путем ферментативного гидролиза. Освобожденный адреналин, адренергический агонист, по-видимому, оказывает свое действие, уменьшая выработку воды и усиливая способность оттока. Система доставки пролекарства Propine® является более эффективным способом доставки терапевтического эффекта адреналина, с меньшим количеством побочных эффектов, чем при обычной терапии адреналином.
Начало действия с одной каплей Propine® происходит примерно через 30 минут после обработки, с максимальным эффектом, наблюдаемым примерно через час.
Использование пролекарства означает, что для терапевтического эффекта требуется меньше лекарственного средства, поскольку поглощение усиливается при пролекарстве. Офтальмологический раствор Propine® в концентрации 0,1% дипивефрина был оценен как менее раздражающий, чем 1% раствор гидрохлорида или битартрата адреналина. Кроме того, только 8 из 455 пациентов (1,8%), получавших пропин®, сообщили о дискомфорте из-за фотофобии, бликов или светочувствительности.
ПОКАЗАНИЯ
Пропин® (офтальмологический раствор дипивефрин HCI, USP) показан в качестве начальной терапии для контроля внутриглазного давления при хронической открытоугольной глаукоме. Пациенты, неадекватно реагирующие на другие антиглаукомные препараты, могут реагировать на добавление Пропина®.
В контролируемых и открытых исследованиях глаукомы офтальмологический раствор Propine® продемонстрировал статистически значимый эффект снижения внутриглазного давления. Пациенты, использующие пропин® два раза в день в исследованиях со средней продолжительностью 76-146 дней, испытывали снижение среднего давления в пределах 20-24%.
Терапевтический ответ на офтальмологический раствор Propine® два раза в день составляет несколько менее 2% адреналина дважды в день. Контролируемые исследования показали статистически значимые различия в снижении внутриглазного давления между Propine® и 2% адреналином. В контролируемых исследованиях у пациентов с непереносимостью адреналина в анамнезе только у 3% пациентов, получавших офтальмологический раствор Propine®, наблюдалась непереносимость, в то время как у 55% пациентов, получавших адреналин, снова развивалась непереносимость.
Терапевтический ответ на препарат Пропин® два раза в день сопоставим с 2% пилокарпином 4 раза в день. В контролируемых клинических исследованиях, сравнивающих офтальмологический раствор Пропина® и 2% пилокарпина, не было статистически значимых различий в поддержании уровней ВГД для двух препаратов. Propine® не вызывает миоз или аккомодационный спазм, который, как известно, вызывает холинергические агенты. Ночная слепота, часто связанная с миотическими агентами, отсутствует при терапии Пропине®.Пациенты с катарактой избегают видеть вокруг лентикулярной помутнения, вызванной сужением зрачка.
Противопоказания
Propine® не следует использовать у пациентов с узкими углами, поскольку любое расширение зрачка может предрасполагать пациента к приступу закрытоугольной глаукомы. Этот продукт противопоказан пациентам с повышенной чувствительностью к любому из его компонентов.
Меры предосторожности
пациентов с афакией.
Отек макулы был обнаружен у 30% пациентов с афакией, получавших адреналин.Прекращение адреналина обычно приводит к обращению макулопатии.
Беременность:
Беременность категории B. Исследования репродукции были проведены на крысах и кроликах при ежедневных пероральных дозах до 10 мг / кг массы тела (5 мг / кг в исследованиях тератогенности) и не выявили признаков нарушения фертильности или вреда для плода из-за дипивефрин HCI. Однако не существует адекватных и контролируемых исследований у беременных женщин. Поскольку исследования репродукции на животных не всегда предсказывают реакцию человека, этот препарат следует использовать во время беременности, только если это явно необходимо.
кормящих матерей.
Не известно ли этот препарат из организма в материнском молоке. Поскольку многие лекарства выводятся с грудным молоком, следует соблюдать осторожность при назначении глазного раствора Пропина® кормящей женщине.
Детская использования.
Безопасность и эффективность в педиатрических больных не были созданы.
Гериатрическое Использование.
Никаких общих клинических различий в безопасности или эффективности не наблюдалось между пожилых и других взрослых пациентов.
Исследования на животных.
Исследования на кроликах показали дозозависимую частоту удержания кист мейбомиевых желез после местного применения как дипивефрина гидрохлорида, так и адреналина.
побочных реакций
Сердечно-сосудистые эффекты. Сообщалось о тахикардии, аритмии и гипертонии при глазном введении адреналина.
Местные эффекты. Наиболее частыми побочными эффектами, отмеченными при приеме только пропина®, были инъекции в 6.У 5% больных и жжение и покалывание у 6%. Сообщалось о фолликулярном конъюнктивите, боли в глазах, мидриазе, ухудшении зрения, зуде в глазах, головной боли и аллергической реакции на офтальмологический раствор Propine®. Эпинефриновая терапия может привести к отложению адренохрома в конъюнктиве и роговице.
дозировка пропина и администрации
Первичная терапия глаукомы. Обычная доза Пропина® составляет одну каплю в глаз (ах) каждые 12 часов.
Замена на Пропин® офтальмологический раствор.Когда пациенты переводятся на Пропин® от других средств против глаукомы, кроме адреналина, в первый день продолжайте прием предыдущего лекарства и добавляйте по одной капле офтальмологического раствора Пропин® в каждый глаз каждые 12 часов. На следующий день прекратите использование ранее использованного средства против глаукомы и продолжайте прием препарата Пропин®.
При переводе пациентов с обычной терапии адреналином в офтальмологический раствор Propine® просто прекратите прием адреналина и назначьте режим Propine®.
Добавление пропина® офтальмологического раствора. Когда пациентам, принимающим другие препараты против глаукомы, требуется дополнительная терапия, добавляйте одну каплю Пропина® каждые 12 часов.
Сопутствующая терапия. Для трудно контролируемых пациентов было показано, что добавление офтальмологического раствора Propine® к другим агентам, таким как пилокарпин, карбахол, эхотиофат йодид или ацетазоламид, оказалось эффективным.
Примечание: не для инъекций.
Как поставляется Пропин
Propine® (офтальмологический раствор дипивефрина HCl, USP) 0.1%, поставляется стерильно в непрозрачных белых флаконах офтальмологических офтальмологических диспенсеров низкой плотности и наконечниках с фиолетовыми колпачками из полистирола следующим образом:
| 10 мл в 10 мл флаконе | — НДЦ 0023-9208-10 | |
| 15 мл в бутылке 15 мл | — НДЦ 0023-9208-15 |
Примечание. Хранить в плотном, светостойком контейнере при температуре от 15 до 25 ° C.
ТолькоRx
Пересмотрено в декабре 2005 г.
© 2006 Allergan, Inc.
Irvine, CA 92612, США
® знаки принадлежат Allergan, Inc.
7592X
71738US11T
| Пропин раствор дипивефрина гидрохлорида | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| Labeler — Allergan, Inc. |
Allergan, Inc.
Медицинский отказ от ответственности
Подробнее о пропине (дипивефрин офтальмологический)
Потребительские ресурсы
Профессиональные ресурсы
Руководства по лечению
,Учебник по химии гидратации алкенов
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Пример гидратации алкена: гидратация этена (этилена) в этанол
Этен (этилен) представляет собой алкен с конденсированной структурной формулой H 2 C = CH 2 .
Активным центром молекулы этена является двойная связь (C = C).
В присутствии разбавленной сильной кислоты вода будет добавляться через двойную связь в этене (этилене) с образованием этанола (этилового спирта).
Атом водорода молекулы воды будет добавлен к одному из атомов углерода этена, а ОН из молекулы воды будет добавлен к другому атому углерода в этене.
Этот синтез этанола из этена показан в химических уравнениях ниже:
| и ен (этилен) | + | вода | H + → | и и или (этиловый спирт) | ||||||||||||||||||||||||||||||
| C 2 H 4 | + | H 2 O | H + → | C 2 H 5 OH | ||||||||||||||||||||||||||||||
| CH 2 = CH 2 | + | H 2 O | H + → | CH 3 — CH 2 OH | ||||||||||||||||||||||||||||||
| + | H -O-H | H + → |
| ||||||||||||||||||||||||||||||
Пример гидратации алкенов: гидратация пропена (пропилена) в пропанол
Пропен (пропилен) представляет собой алкен с конденсированной структурной формулой CH 3 -H 2 C = CH 2 .
Активным центром молекулы пропена является двойная связь (C = C).
В присутствии разбавленной сильной кислоты вода будет добавляться через двойную связь в пропене (пропилене) с образованием смеси спиртов: пропан-1-ол (1-пропанол) и пропан-2-ол (2-пропанол) ,
Пропан-1-ол и пропан-2-ол являются структурными изомерами, они имеют одинаковую молекулярную формулу (C 3 H 8 O), но разные структурные формулы (CH 3 -CH 2 -CHOH и CH (3-CHOH-CH (3)).
Пропан-1-ол и пропан-2-ол являются позиционными изомерами, они получены из одного и того же исходного алкана (пропана), но функциональная группа ОН (гидроксил) расположена в другом положении в углеродной цепи (первая Атом C для пропан-1-ола и второй атом C для пропан-2-ола).
Эти два изомера пропанола не производятся в равных количествах.
Мы используем правило Марковникова, чтобы решить, какой продукт является «основным», а какой — «второстепенным».
Правило Марковникова гласит, что атом водорода молекулы воды будет добавлять в углерод наибольшее количество атомов водорода.
Пропен: CH 3 — C (2) H = C (1) H 2
C (1) имеет 2 атома водорода, связанных с ним.
C (2) имеет только 1 атом водорода, связанный с ним.
Правило Марковникова предсказывает, что атом водорода из воды будет в основном присоединяться к C (1) , а OH воды будет присоединяться к C (2) с образованием основного продукта пропан-2-ола.
Другой изомер, пропан-1-ол, менее предпочтителен, поэтому он будет присутствовать в меньшем количестве и известен как второстепенный продукт.
Этот синтез пропан-1-ола и пропан-2-ола из пропена показан в химических уравнениях ниже:
| проп ен (пропилен) | + | вода | H + → | реквизита и -2- или (основной продукт) | + | опор 9009 -1- или (незначительный продукт) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CH 2 = CH-CH 3 | + | H 2 O | H + → | CH 3 — CH ( OH ) -CH 3 (основной продукт) | + | CH 3 — CH 2 -CH 2 OH (второстепенный продукт) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| + | H -O-H | H + → |
| + |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Патология
ПРОДОЛЖАЙТЕ УЧИТЬСЯ НАЧИНАЙ СЕЙЧАС ПРОДОЛЖАЙТЕ УЧИТЬСЯ НАЧИНАЙ СЕЙЧАС КАТЕГОРИИ
КАТЕГОРИИ 
- Медицинская онлайн-библиотека Lecturio
- Pre-Med Curriculum
- Биология
- Химия
- Физика
- Статистика
- Доклиническая учебная программа
- Анатомия
- Поведенческая наука
- Биохимия
- Биомедицинские науки
- Эмбриология
- Эпидемиология и биостатистика
- Гистология
- Иммунология
- Микробиология
- Патология
- Фармакология
- Физиология
- Клинический учебный план
- Анестезиология
- Кардиология
- Дерматология
- Экстренная медицина
- Эндокринология
- Семейная медицина
- Гастроэнтерология
- Гинекология
- Гематология
- Гепатология
- Инфекционные заболевания
- Медицинская генетика
- Неврология
- Офтальмология
- Отоларингология (ЛОР)
- Онкология
- Ортопедия
- Психиатрия
- Педиатрия
- Радиология
- Ревматология
- Болезни репродуктивной системы
- Респираторная медицина
- Хирургия
- нефрология / урология
- Сосудистая медицина
- Учиться и учить медицине
- Медицинская онлайн-библиотека Lecturio
- Pre-Med Curriculum
- Биология
- Химия
- Физика
- Статистика
- Доклиническая учебная программа
- Анатомия
- Поведенческая наука
- Биохимия
- Биомедицинские науки
- Эмбриология
- Эпидемиология и биостатистика
- Гистология
- Иммунология
- Микробиология
- Патология
- Фармакология
- Физиология
- Клинический учебный план
- Анестезиология
Чрезвычайно обезвоженный — определяемый Всемирной организацией здравоохранения как потеря более 10 процентов веса вашего тела в жидкости — может привести к травме или фатальным осложнениям, и это требует посещения ER , Приступы, сердечная аритмия или гиповолемический шок могут возникнуть из-за слишком низкого объема крови.
И все же это редко случается. В большинстве случаев вы можете легко пополнить запасы жидкости и предотвратить обезвоживание.По словам Алпа Аркуна, доктора медицинских наук, руководителя службы неотложной медицинской помощи в медицинских центрах Kaiser Permanente Fontana и Ontario в Южной Калифорнии, вы можете потерять от 3 до 4 процентов массы тела за счет обезвоживания. Тем не менее, как только вы потеряли от 5 до 6 процентов, вы начнете чувствовать симптомы легкого обезвоживания, отмечает MedlinePlus. Жажда, усталость, головокружение или запор — явные признаки того, что пришло время достать воду или спортивный напиток с низким содержанием сахара и высоким содержанием электролитов.
ОТНОСИТЕЛЬНО: Жажда? 9 Освежающие альтернативы газированной воде
Но признаки обезвоживания не всегда так очевидны. Вот шесть удивительных признаков и симптомов обезвоживания.
1. Зловонное дыхание — возможный предупреждающий признак обезвоживания.
Слюна обладает антибактериальными свойствами, но обезвоживание может помешать вашему организму выделять достаточное количество слюны.
«Если вы не производите достаточно слюны, у вас может возникнуть бактериальный разрастание во рту, и одним из побочных эффектов этого является неприятный запах изо рта», — говорит Джон Хиггинс, доктор медицины, профессор медицины в Техасском университете в Хьюстон и начальник кардиологии Линдона Б.Госпиталь Джонсона в Хьюстоне.
Это та же самая причина, по которой вы можете проснуться с «утренним дыханием»: выработка слюны замедляется во время сна, отмечает клиника Майо, приводящая к неприятному вкусу во рту по мере роста бактерий. Поэтому в следующий раз, когда ваш рот кажется сухим и ваше дыхание пахнет менее свежим, возможно, пришло время для регидратации.
RELATED: Что такое «сырая» вода и стоит ли ее пить?
2. Сухая или покрасневшая кожа может быть симптомом обезвоживания
«Многие люди считают, что люди, обезвоженные, действительно потные, но на самом деле, когда вы проходите различные стадии обезвоживания, вы очень сухая кожа », докторХиггинс говорит, добавляя, что кожа также может выглядеть покрасневшей.
Другим ключевым симптомом обезвоживания, связанным с кожей, является кожа, которая остается «треснутой» после защемления и требует некоторого времени, чтобы вернуться к своему нормальному плоскому виду (подробнее об этом ниже).
СВЯЗАННЫЕ: 10 Неожиданные причины сухости кожи
3. Мышечные спазмы являются симптомом обезвоживания, вероятным из-за теплового недуга
Когда ваше тело теряет достаточно жидкости, оно не может адекватно охладиться, что приводит к тепловая болезнь, отмечает OrthoInfo.Один из симптомов, на которые следует обратить внимание — это мышечные спазмы, которые могут возникнуть во время тренировок, особенно в жаркую погоду.
«Чем жарче вы становитесь, тем больше вероятность того, что у вас будут мышечные спазмы, и это из-за воздействия тепла на мышцы. По мере того, как мышцы работают все сильнее и сильнее, они могут захватить само тепло. Изменения в электролитах, таких как натрий и калий, также могут привести к мышечным спазмам », — говорит Хиггинс.
Имейте в виду, что когда речь идет о регидратации после тренировки, все напитки не могут быть созданы равными.Исследование, опубликованное в марте 2019 года в BMJ Open Sport and Exercise Medicine , показало, что, когда участники регидратировались с напитком, содержащим электролиты после тренировки, у них была меньше вероятность развития мышечных спазмов. С другой стороны, у участников, которые пили простую воду, чаще возникали судороги. Исследование было небольшим, поэтому его результаты могут не относиться к вам, но в следующий раз, когда вы почувствуете мышечный спазм, возникающий после тренировки, выбор спортивного напитка с электролитом может помочь.
Даже в прохладную погоду обезвоживание возможно, если вы не пьете достаточно жидкости во время тренировки. Хиггинс говорит, что симптомы могут быть слабее или развиваться медленнее, но обезвоживание сопряжено с такими же рисками, независимо от температуры на улице.
4. Лихорадка и озноб являются симптомами теплового недуга, вызывающего обезвоживание организма
Другие симптомы теплового заболевания включают жар и озноб. Вы можете сильно потеть, пока ваша кожа холодная на ощупь.
Лихорадка может усугубить обезвоживание.Чем выше температура, тем более обезвоженной вы можете стать. Если температура вашего тела не снизится, ваша кожа потеряет прохладную липкость, а затем станет горячей, покрасневшей и сухой на ощупь. На этом этапе важно, чтобы вы сразу же охладились и обратились к медицинскому работнику, который рекомендует Центр по контролю и профилактике заболеваний (CDC). Применение льда и прохладной, влажной ткани и перемещение в прохладное место — это краткосрочные стратегии, пока вы не обратитесь к врачу.
По данным клиники Майо, дети и младенцы теряют больше жидкости в организме из-за лихорадки, и у них чаще возникает сильная диарея и рвота из-за болезни.Любая лихорадка у младенца или малыша вызывает беспокойство. Попросите вашего педиатра дать рекомендации о том, когда обращаться за помощью.
CDC призывает взрослых с лихорадкой обращаться за медицинской помощью, если их температура достигает 103 градусов по Фаренгейту Просто имейте в виду, что вы жаждете
«Когда вы обезвожены, органам, таким как печень, которая использует воду, может быть трудно высвобождать гликоген [запасенную глюкозу] и другие компоненты ваших запасов энергии, поэтому вы можете реально получить тягу к еде », — говорит Хиггинс.
Хотя вы можете жаждать чего угодно, от шоколада до соленой закуски, тяга к сладкому встречается чаще, поскольку ваше тело может испытывать трудности с расщеплением гликогена с целью высвобождения глюкозы в кровь для использования в качестве топлива, говорит он.
6. Головные боли могут быть признаком того, что вам нужно пить больше воды
Как указывает MedlinePlus, даже легкое обезвоживание может вызвать обезвоживающую головную боль и вызвать мигрень. Хотя различные факторы помимо обезвоживания могут вызывать головные боли, выпить полный стакан воды и продолжать пить больше жидкости в течение дня — это простой способ облегчить вашу боль, если на самом деле дегидратация является виновником.
RELATED: Что такое щелочная вода и дает ли она больше преимуществ, чем обычная H 2 O?
Как определить, что у вас обезвоживание или что-то еще
Если вы хотите пить, вы уже обезвожены. Но отсутствие жажды не обязательно означает, что вы хорошо увлажнены. Вот два других способа проверить, обезвожен ли ваш организм:
Попробуйте этот тест кожи. Используйте два пальца, чтобы ущипнуть кожу на тыльной стороне ладони, а затем отпустите кожу.Кожа должна вернуться в нормальное положение менее чем за пару секунд. Хиггинс говорит, что если кожа нормализуется медленнее, возможно, вы обезвожены.
Проверьте свою мочу. Если вы хорошо увлажнены, ваша моча будет в основном прозрачной с оттенком желтого (цвета светлого лимонада до того, как он попадет в миску). Темный желтый или оранжевый — это «предупреждающие» цвета, за которыми нужно следить, согласно UC San Diego Health. Если вы видите эти цвета, начните пить жидкости.
ОТНОСИТЕЛЬНО: 8 продуктов с высоким содержанием воды, которые могут помочь предотвратить обезвоживание так много переменных, включая ваш возраст, пол, беременность или кормление грудью, а также наличие каких-либо заболеваний.
Тем не менее, руководящие принципы 2004 года от Национальных академий наук, инженерии и медицины — самые последние из доступных — рекомендуют получать 2,7 литра в день для женщин и 3,7 литра в день для мужчин. Вы можете достичь этого количества, потребляя продукты и жидкости.
Вот несколько советов, как получить все необходимые жидкости и избежать обезвоживания:
Всегда держите бутылку с водой под рукой
«Если она рядом, вы, вероятно, привыкнете ее пить. даже не осознавая этого », — говорит Джоанна Сакимура, врач-амбулаторный врач-онколог-диетолог в медицинском центре Overlook в Саммите, штат Нью-Джерси.
СВЯЗАННЫЕ: Лучшие бутылки с водой, чтобы держать вас гидратированными
Попробовать приправить простую воду
«Если вы не любите простую воду, добавьте в нее немного фруктового сока или кусочки свежие или замороженные фрукты », — говорит Сакимура. «Или попробуйте натуральные ароматизированные сельтеры без калорий — их шипучий и фруктовый вкус делает их более привлекательными, чем обычная плоская вода».
ОТНОШЕНО: Судебный процесс по делу LaCroix: полезна или вредна газированная вода для вас?
Обратитесь к травяному чаю или кофе без сахара
Sakimura рекомендует пить несладкие чаи, которые доступны в большом количестве различных вкусов.«Потягивайте фруктовые чаи со льдом в течение дня (с большим количеством льда, если жарко) или с кружкой горячего мятного или ромашкового чая по ночам — все они имеют значение для вашей ежедневной цели жидкости». И если предпочтительным напитком является кофе, а не чай, это тоже работает: хотя напитки с кофеином могут оказывать мочегонное воздействие, увеличивая вашу потребность в мочеиспускании, одно перекрестное исследование с участием 50 мужчин показало, что не было значительных различий в общей гидратации, когда мужчины выпивали четыре чашки кофе ежедневно по сравнению с четырьмя чашками воды.Результаты исследования, которые были опубликованы в журнале PLoS One в январе 2014 года, показывают, что кофе гидратируется так же, как и вода, если употреблять его умеренно обычные любители кофе.
RELATED: Является ли фильтрованный кофе полезнее, чем нефильтрованный кофе?
Замените ваши упакованные закуски на свежие продукты
«Замените сухие закуски, такие как чипсы, крендели и крекеры — с очень низким содержанием воды — с освежающими закусками, такими как свежие или замороженные фрукты, йогурт, полезные смузи, сельдерей с арахисовым маслом и нарезанные овощи с хумусом », — рекомендует Сакимура.
Куча на продукт
В том же духе, знайте, что эти овощи и фрукты увлажняют, как напитки. «Стремитесь сделать половину своей тарелки во время еды. Все эти овощи и фрукты будут снабжать водой, а также сердечной дозой витаминов, минералов и клетчатки », — говорит Сакимура. «Фактически, некоторые фрукты и овощи на 90% состоят из воды, включая канталупу, клубнику, арбуз (конечно), огурец, сельдерей, салат и листовую зелень, цуккини, помидоры и болгарский перец.«
потребляйте больше жидкости во время еды»
«Пить воду во время еды поможет вам есть медленнее, ускорить прием пищи и, конечно же, избежать обезвоживания», — говорит Сакимура. Кроме того, питьевая вода перед едой может помочь с потерей веса, как это было сделано для участников исследования, опубликованного в журнале Ожирение в августе 2015 года. Во время небольшого рандомизированного контролируемого исследования с участием 84 субъектов, участников, которые выпили 500 миллилитров (мл) воды За 30 минут до еды потеряли в среднем 1.3 килограмма (кг) при 12-недельном наблюдении.
СВЯЗАННЫЕ: 5 хитростей для получения достаточного количества фруктов и овощей
Заключительное примечание о важности предотвращения обезвоживания, если вы пожилые
Пожилые люди могут подвергаться повышенному риску обезвоживания по ряду причин по данным Национальной академии наук, инженерии и медицины.
Некоторые пожилые люди становятся хронически обезвоженными, если они принимают определенные лекарства, такие как диуретики, испытывают слабое чувство жажды, не могут легко взять себе стакан воды или забывают пить из-за деменции.Хроническое обезвоживание у пожилого человека может привести к спутанности сознания, низкому кровяному давлению, головокружению и запорам.
Если у вас есть пожилой родственник с ограниченными физическими возможностями или когнитивными проблемами, обязательно наблюдайте за ним или у него на наличие признаков обезвоживания или попросите об этом своих опекунов.
Что касается вашего собственного благополучия, помните, что здоровые тела состоят как минимум на 60 процентов из воды, отмечает Геологическое общество США. Сохраняйте этот здоровый баланс и пейте!
Дополнительная отчетность по Шерил Хаггинс Саломон и Лора МакАрдл .
.
Leave A Comment