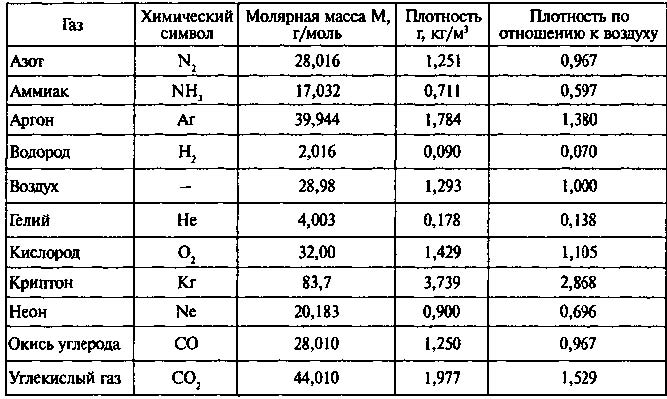
Самостоятельные работы по физике
Самостоятельная работа № 1
«Величины, характеризующие мир молекулы»
1. Определить
a. молярную массу сахара C12H22O11
b. молярную массу поваренной соли NaCl
2. Определить массу молекулы
a. Сахара C12H22O11
b. Поваренной соли NaCl
3. Сколько молекул содержится в
a. 5 кг сахара
b. 5 кг поваренной соли
4. Определить массу
a. куска поваренной соли, в котором содержится 1,03*1025молекул
b. куска сахара, в котором содержится 3,5*1024 молекул
5. Определить количество вещества
a. в 684 г сахара
b. в 580 г поваренной соли
6. Какой объем занимают 100 моль ртути (плотность ртути 13,6*103 кг/м3)
7. Определите
диаметр молекулы масла по масляному пятну площадью 5,68·10  Масса капли воды 0,022·10-6 кг, а плотность масла 900 кг/м3.
Масса капли воды 0,022·10-6 кг, а плотность масла 900 кг/м3.
Вариант «В»
1. Где больше атомов: в стакане воды или в стакане ртути?
2. Зная число Авогадро, определите объем и диаметр атома золота.
3. В комнате объемом 60 м3 испарили капельку духов, содержащую 10-4 г ароматического вещества. Сколько молекул ароматического вещества попадает в легкие человека при каждом вдохе? Объем вдыхаемого воздуха 1 дм3. Молярная масса ароматического вещества 1 кг/моль.
4.
Озеро со средней глубиной 5 м и площадью 4
км
5.
Средняя кинетическая энергия хаотического
движения молекул при данной температуре у всех веществ одинакова. Определите
отношения средних скоростей хаотического движения молекул водорода и кислорода
при одной и той же температуре.
Самостоятельная работа № 2
«Основное уравнение молекулярно-кинетической теории газа»
1. Найти среднюю скорость молекул газа, имеющего плотность 2 кг/м3 при давлении 2,43*105Па
2. Кислород находится при нормальных условиях. Вычислить среднюю квадратичную скорость молекул газа. (Плотность кислорода 1,43 кг/м3).
3. Какое давление на стенки сосуда производят молекулы газа, если масса газа 3·10-3 кг, объем 0,5·10-3м3, средняя квадратичная скорость молекул 500 м/с?
4. В 1 м3 газа при давлении 1,5·105 Па содержится 2·1025 молекул. Определите среднюю кинетическую энергию хаотического движения этих молекул.
5. Какой объем занимает газ при давлении 2105 Па, если масса его 1 кг, а средняя квадратичная скорость молекул 600 м/с?
6. Какова средняя квадратичная скорость движения молекул газа, который занимает объем 5 м при давлении 2·105 Па и имеет массу 6 кг?
7. Чему равна средняя кинетическая энергия
хаотического движения молекул аргона, если 2 кг его, находясь в сосуде объемом
2 м3, оказывают давление 3·105 Па (молярная масса аргона 0,04
кг/моль).
Чему равна средняя кинетическая энергия
хаотического движения молекул аргона, если 2 кг его, находясь в сосуде объемом
2 м3, оказывают давление 3·105 Па (молярная масса аргона 0,04
кг/моль).
8.
Определите кинетическую энергию
хаотического поступательного движения всех молекул любого газа в баллоне
емкостью 10 л и давлением 0,4·10
9. Найти концентрацию молекул кислорода, если давление его 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/с.
Вариант «В»
1. Молекула азота при нормальных условиях движется со скоростью 454 м/с. Определите импульс молекулы.
2. Одинаковые сосуды наполнили: один — водородом, другой — кислородом. Сравните давления этих газов, если одинаковы их: а) массы; б) количество молекул.
3. Часть стенки сосуда покрыли клеем, поглощающим все падающие молекулы газа. Изменится ли давление газа на этом участке стенки?
4.
5. Во сколько раз изменится давление одноатомного газа в результате уменьшения его объёма в 3 раза и увеличения средней кинетической энергии его молекул в 2 раза?
Самостоятельная работа № 3.
Температура в молекулярно-кинетической теории газов.
Вариант «А»
1. В сосуде находится газ при температуре 27°С. Определите среднюю кинетическую энергию хаотического движения молекул газа.
2. Определите температуру газа, если средняя кинетическая энергия хаотического движения его равна 5,6∙10-21 Дж.
3. Найти температуру газа при давлении 100 кПа и концентрации молекул 1025 м-3
4.
Определите среднюю кинетическую энергию
молекул одноатомного газа и концентрацию молекул при температуре 290 К и
давлении 0,8 МПа.
5. При какой температуре находится газ, если средняя кинетическая энергия хаотического движения его молекул на 20% больше, чем при 0°С?
6.
При понижении температуры газа с 300 К до
200 К средняя кинетическая энергия хаотического движения молекул уменьшилась на
10
7. Сравните, как изменилась средняя кинетическая энергия хаотического движения молекул газа, если его температура уменьшилась на 50°С. Первоначальная температура газа 70°С.
Вариант “В”
1. Определить количество молекул в 4 м3 азота и его плотность, если давление 1,33 нПа, а температура 290 К.
2. Определить среднюю квадратичную скорость молекул кислорода при 20°С. При какой температуре эта скорость равна 500 м/с?
3. После того, как в комнате протопили печь, температура поднялась с 15 °С до 27 °С. На сколько процентов изменилось число молекул в этой комнате?
4. Гелий
находится при температуре 580 К. При какой температуре должен находиться
водород, чтобы средняя квадратичная скорость молекул этих газов была одна и та
же?
При какой температуре должен находиться
водород, чтобы средняя квадратичная скорость молекул этих газов была одна и та
же?
5. Средняя квадратичная скорость теплового движения молекул увеличилась в два раза. Как при этом изменилась температура и кинетическая энергия теплового движения молекул одноатомного газа?
6. Вычислить число молекул воздуха, находящихся в помещении размером 6х4х2,5 м3 при температуре 27 °С и давлении 99,8 кПа.
Уравнение состояния идеального газа
Вариант «А»
1. Сосуд емкостью 2·10-3 м3 наполнен азотом под давлением 2·105 Па при температуре 27°С. Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль.
2.
Какова температура 1,6·10-2 кг
кислорода, находящегося под давлением 106 Па и занимающего объем
1,6·10 -3 м3? Молярная масса кислорода 0,032 кг/моль.
3.
Определите давление воздуха в сосуде
объемом 2·10-3 м3, если его масса 1,2·10
4. Определите плотность водорода при температуре 17 °С и давлении 204 кПа.
5. Объем водорода при температуре 50 °С и давлении 0,98∙105 Па равен 2,5·10-3 м3. Каков объем той же массы водорода при 0°С и давлении 105 Па?
6. При давлении 105 Па и температуре 15°С воздух имеет объем 2 10 —9м3. При каком давлении данная масса воздуха займет объем 4·10-3 м3, если температура его станет 20°С?
7.
Воздух, содержащийся в резиновом шаре, при
температуре 20°С и давлении 99,75 кПа имеет объем 2,5 л. При погружении шара в
воду, температура которой 5°С, давление воздуха увеличилось до 2·10
8. Какова разница в массе воздуха, заполняющего помещение объемом 50 м3, зимой и летом, если летом температура помещения достигает 40°С, а зимой падает до 0°С?
9. В баллоне при 27°С и давлении 4,05 МПа
находится ацетилен. Каким станет давление в баллоне после расхода половины
массы газа, если температура при этом понизится до 12°С?
В баллоне при 27°С и давлении 4,05 МПа
находится ацетилен. Каким станет давление в баллоне после расхода половины
массы газа, если температура при этом понизится до 12°С?
10. Сколько молекул воздуха выходит из комнаты объемом 120 м3 при повышении температуры от 15 до 25°С? Атмосферное давление 105
Вариант «В»
1. Цилиндрический сосуд делится на две части подвижным поршнем. Каково будет равновесное положение поршня, когда в одну часть сосуда помещено некоторое количество кислорода, в другую — такое же по массе количество водорода, если длина сосуда 85 см?
2. Масса 716 мг органического соединения, имеющего формулу (С3Н6О)n при давлении 105 Па и температуре 200°С занимает в газообразном состоянии объем 243 см3. Найти п.
3. Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура — на 10%. Какую часть газа выпустили?
4. В легкой герметичной оболочке воздушного
шара находится водород. Определить подъемную силу шара. Считать, что оболочка
сделана из неупругого материала и может свободно растягиваться. Масса водорода т. Молярная масса 29 кг/кмоль.
В легкой герметичной оболочке воздушного
шара находится водород. Определить подъемную силу шара. Считать, что оболочка
сделана из неупругого материала и может свободно растягиваться. Масса водорода т. Молярная масса 29 кг/кмоль.
5. В цилиндре под поршнем площадью 100 см2 находится 28 г азота при температуре 273 К. Цилиндр нагревается до температуры 373 К. На какую высоту поднимается поршень массой 100 кг? Атмосферное давление 105 Па.
6. В закрытом цилиндре по одну сторону легкоподвижного поршня имеется некоторая масса газа при температуре -70°С, по другую — такая же масса этого газа при температуре 25°С. Поршень находится в равновесии. Общий объем газа 4·10-4 м3. Определите объем газа в каждой из частей цилиндра.
7. Закрытый с обоих концов цилиндр наполнен газом и разделен легкоподвижным поршнем на две равные части длиной по 0,34 м каждая. Температура газа 27°С. На сколько градусов надо нагреть газ в одной половине цилиндра, чтобы поршень сместился на 0,1 м?
8. В цилиндре под невесомым поршнем находится
газ при атмосферном давлении ро и температуре Т0 .
Поршень удерживается упругой пружиной. Во сколько раз нужно увеличить
температуру газа, чтобы его объем увеличился в 1,5 раза? Если газ полностью
откачать из-под поршня, поршень будет находиться в равновесии у дна цилиндра.
В цилиндре под невесомым поршнем находится
газ при атмосферном давлении ро и температуре Т0 .
Поршень удерживается упругой пружиной. Во сколько раз нужно увеличить
температуру газа, чтобы его объем увеличился в 1,5 раза? Если газ полностью
откачать из-под поршня, поршень будет находиться в равновесии у дна цилиндра.
9. Давление воздуха, находящегося в камере с постоянным объемом V, равно половине атмосферного давления. Сколько ходов нужно совершить поршню насоса, чтобы накачать в камеру воздух до давления р, если емкость насоса v0, а атмосферное давление p0? Нагреванием воздуха пренебречь.
10. Герметично закрытый сосуд полностью заполнен водой при температуре 27°С. Каким стало бы давление внутри сосуда, если бы силы взаимодействия между молекулами воды внезапно исчезли?
Самостоятельная работа №5
ИЗОПРОЦЕССЫ В ГАЗАХ
ВАРИАНТ «А»
1. Какой объем займет газ при 77 °С, если при
27 °С его объем был 6 л?
Какой объем займет газ при 77 °С, если при
27 °С его объем был 6 л?
2. При температуре 27 °С давление газа в закрытом сосуде было 75 кПа. Каким будет давление при температуре -13 °С?
3. Сосуд, содержащий газ под давлением 1,4·105 Па, соединили с пустым сосудом объемом 6 л. После этого в обоих сосудах установилось давление 1·105 Па. Найти объем первого сосуда. Процесс изотермический.
4. При изохорном охлаждении идеального газа, взятого при температуре 480 К, его давление уменьшилась в 1,5 раза. Какой стала конечная температура газа?
5. Во сколько раз увеличится объем воздушного шара, если его внести с улицы в теплое помещение. Температура на улице -3 °С, в помещении 27 °С.
6. При изобарном нагревании идеального газа от температуры 280 К плотность его уменьшилась вдвое. На сколько увеличилась температура газа?
7.
Определить начальную и конечную
температуры идеального газа, если при изобарном охлаждении на 290 К его объем
уменьшился вдвое.
8. При сжатии газа его объем уменьшился с 8 до 5 л, а давление повысилось на 60 кПа. Найти первоначальное давление. Процесс изотермический.
9. При какой температуре находился газ, если в результате изобарного нагревания на 1К его объем увеличился на 0,0035 первоначального?
10. Сосуд вместимостью 20 л, заполненный воздухом при давлении 0,4 МПа, соединяют с сосудом, из которого воздух удален. При этом давление в обоих сосудах становится одинаковым и равным 1·105 Па. Определить вместимость второго сосуда. Процесс изотермический.
ВАРИАНТ «В»
1. В баллоне содержится газ при температуре 17°С и давлении 1 МПа. На сколько изменится давление, когда температура понизится до -23°С?
2. На какой глубине радиус пузырька воздуха вдвое меньше, чем у поверхности воды, если атмосферное давление у поверхности воды р0?
3.
В сосуд нагнетается при помощи ручного
насоса воздух. Объем сосуда равен 3 л, объем цилиндра насоса 0,5 л. Каково
будет давление газа в сосуде после двадцати рабочих ходов поршня, если сосуд
вначале был пустым?
Каково
будет давление газа в сосуде после двадцати рабочих ходов поршня, если сосуд
вначале был пустым?
4. Электрическая лампочка емкостью 0,5 л наполнена азотом при давлении 76 кПа. Какое количество воды войдет в лампу, если у нее отломить кончик под водой на глубине 1,4 м? Атмосферное давление нормальное.
5. Открытую с двух сторон стеклянную трубку длиной 1 м наполовину погружают в ртуть. Затем трубку закрывают сверху и вынимают. Какой длины х столбик ртути останется в трубке? Атмосферное давление 750 мм. рт. ст.
6. Имеется два сосуда с газом: один вместимостью 3 л, другой вместимостью 4 л. В первом сосуде газ находится под давлением 202 кПа, а во втором 101 кПа. Под каким давлением будет находится газ, если эти сосуды соединить между собой? Считать, что температура в сосудах одинакова и постоянна.
7.
Барометрическая трубка погружена в
глубокий сосуд с ртутью так, что уровни ртути в трубке и в сосуде совпадают.
При этом воздух в трубке занимает столб длиной 1 см. Трубку поднимают на 11 см.
На сколько сантиметров поднимется ртуть в трубке? Атмосферное давление равно Н см. рт. ст.
Трубку поднимают на 11 см.
На сколько сантиметров поднимется ртуть в трубке? Атмосферное давление равно Н см. рт. ст.
8. Закрытый цилиндрический сосуд высотой h разделен на две части невесомым поршнем. При закрепленном поршне обе половинки заполнены газом, причем в одной из них давление в n раз больше, чем в другой. На сколько переместится поршень, если его освободить? Температуру считать постоянной.
Самостоятельная работа № 7
РАБОТА В ТЕРМОДИНАМИКЕ
ВАРИАНТ «А»
1. В процессе изобарного расширения газа была совершена работа, равная 400 Дж. При каком давлении совершался процесс, если объем газа изменился с 0,3 м3 до 600 л?
2. При изобарном расширении газа была совершена работа 600 Дж. На сколько изменился объем газа, если давление газа было 4·105 Па?
3. На рисунке
показана изобара газа в координатах р,V. Определите работу, совершенную
газом в процессе расширения.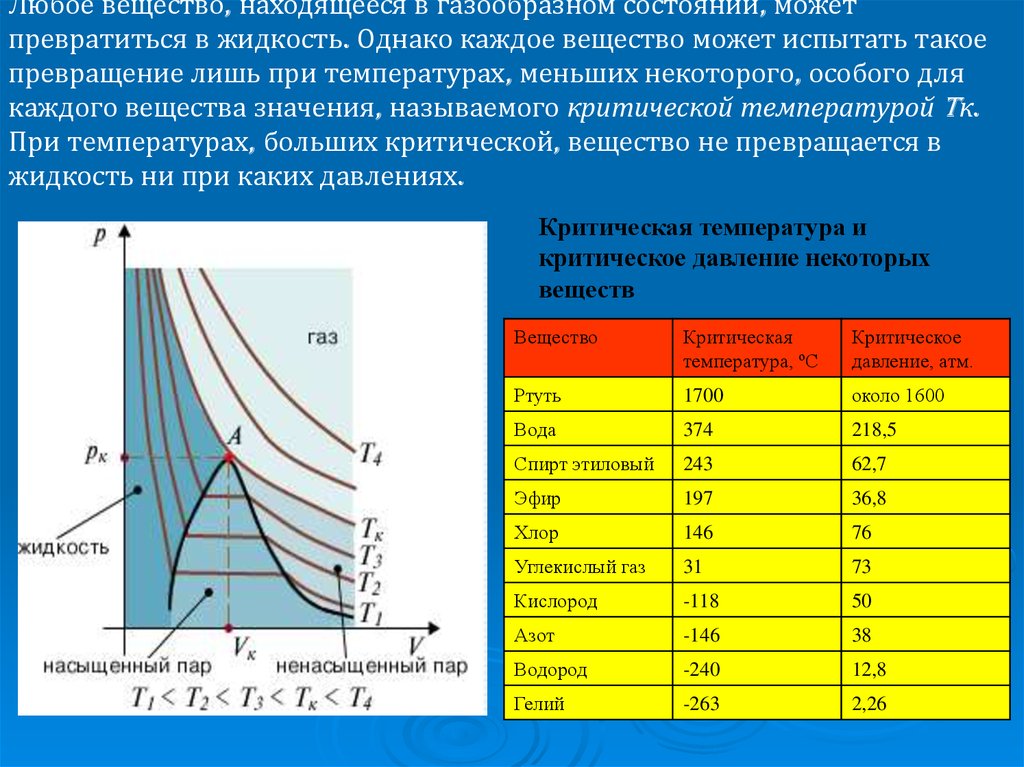
4. Некоторый газ занимал объем 20 л. Каким стал объем газа, если при изобарном расширении была совершена работа 496 Дж. Давление газа 80 кПа.
5. Газ, занимающий некоторый объем под давлением 1,2·105 Па, изобарно расширяясь, совершил работу 1,8 кДж. Определить начальный объем газа, если после расширения его объем стал 45 л.
6. Какую работу А совершает газ, количество вещества которого ν, при изобарном повышении температуры на ∆T?
Самостоятельная работа № 7
РАБОТА В ТЕРМОДИНАМИКЕ
ВАРИАНТ «В»
1. Азот массой 280 г был нагрет при постоянном давлении на 100°С. Определить работу расширения.
2. Определить работу расширения 20 л газа при изобарическом нагревании от 300 К до 393 К. Давление газа 80 кПа.
3. Один килограмм углекислого газа CO2 изобарно нагрет от 268 до 400 К. Определить работу, совершенную газом при увеличении его объема.
4. При
изобарном нагревании на 159 К газом, масса которого 3,47 кг, была совершена работа
144 кДж. Определить молярную массу газа и назвать его.
При
изобарном нагревании на 159 К газом, масса которого 3,47 кг, была совершена работа
144 кДж. Определить молярную массу газа и назвать его.
5. В цилиндре под поршнем находится кислород. Определить массу кислорода, если известно, что работа, совершаемая при нагревании газа от 273 до 473 К, равна 16 кДж. Трение не учитывать.
6. В двух цилиндрах под подвижным поршнем находятся водород и кислород. Сравнить работы, которые совершают эти газы при изобарном нагревании, если их массы, а также начальные и конечные температуры равны.
Самостоятельная работа № 8 по теме «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»
ВАРИАНТ «А»
1. В цилиндре под поршнем находится 1,25 кг воздуха. Для его нагревания на 4°С при постоянном давлении было затрачено 5 кДж теплоты. Определите изменение внутренней энергии воздуха (μ= 0,029 кг/моль).
2. 0,02 кг
углекислого газа нагревают при постоянном объеме.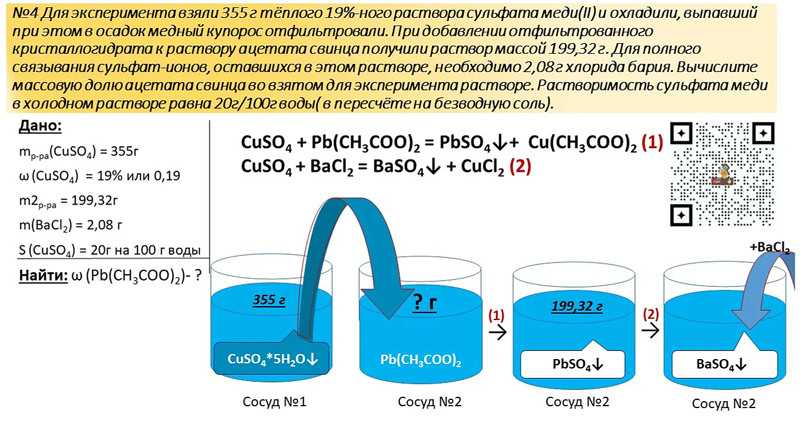 Определите изменение
внутренней энергии газа при нагревании от 20 до 108°С (Сv =
655Дж/кг-К).
Определите изменение
внутренней энергии газа при нагревании от 20 до 108°С (Сv =
655Дж/кг-К).
3. При изобарном расширении 0,04 кг кислорода его температура изменяется на 6°С. Величина работы, совершенная во время этого процесса, равна 250 Дж. Какое количество теплоты было передано газу и чему равно изменение его внутренней энергии (сp= 916 Дж/кг·К)?
4. 0,2 кг азота нагревают при постоянном давлении от 20 до 80°С. Какое количество теплоты поглощается при этом? Какую работу производит газ? (Ср=1 кДж/кг·К).
5. В цилиндре под поршнем находится 1,5 кг кислорода. Поршень неподвижен. Какое количество теплоты необходимо сообщить газу, чтобы его температура повысилась на 8°С? Чему равно изменение внутренней энергии? (Сv = 675 Дж/кг·К).
6. Для изобарного нагревания газа, количество вещества которого 800 моль, на 500 К ему сообщили количество теплоты 9,4 МДж. Определить работу газа и приращение его внутренней энергии.
Самостоятельная работа № 8 по теме «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»
ВАРИАНТ «В»
1. На рисунке
изображен график некоторого процесса, совершенного с определенной массой
идеального газа. Сопровождается ли этот процесс поглощением или выделением
некоторого количества теплоты?
На рисунке
изображен график некоторого процесса, совершенного с определенной массой
идеального газа. Сопровождается ли этот процесс поглощением или выделением
некоторого количества теплоты?
2. Газ расширяется от объема V1 до объема V2: один раз — изотермически, второй — изобарически и третий — адиабатически. При каком процессе газ совершает большую работу и когда газу передается большее количество теплоты?
3. Для нагревания 10 г неизвестного газа на 1К при постоянном давлении требуется 9,12 Дж, при постоянном объеме 6,49 Дж. Что это за газ?
4. При изобарном расширении 80 г кислорода с температурой 300 К его объем увеличился в 1,5 раза. Определить количество теплоты, израсходованной на нагревание кислорода, работу совершенную для его расширения, и изменение внутренней энергии газа.
5. Кислород
массой 0,3 кг при температуре Т=320К охладили изохорно, вследствие чего его
давление уменьшилось в 3 раза. Затем газ изобарно расширили так, что
температура его стала равна первоначальной. Какую работу совершил газ? Как изменилась
его внутренняя энергия?
Какую работу совершил газ? Как изменилась
его внутренняя энергия?
6. Некоторая масса газа переходит из состояния В в состояние С двумя различными способами: ВаС и ВЬС, причем в процессе каждого перехода газ совершает работу и ему путем теплообмена сообщается энергия. Одинаковы ли при каждом переходе: а) величина работы, совершаемой газом; б) изменение его внутренней энергии; в) сообщаемое газу количество теплоты? (см. рис.)
Самостоятельная работа № 9 по теме «КПД ТЕПЛОВЫХ ДВИГАТЕЛЕЙ2
ВАРИАНТ «А»
1. Температура нагревателя тепловой машины 150°С, а холодильника 25″С; машина получила от нагревателя 4·104 Дж энергии. Как велика работа, произведенная машиной?
2. КПД идеального теплового двигателя 40%. Газ получил от нагревателя 5 кДж теплоты. Какое количество теплоты отдано холодильнику?
3. В идеальной
тепловой машине, КПД которой 30%, газ получил от нагревателя 10 кДж теплоты. Какова температура нагревателя, если температура холодильника 20°С? Сколько
джоулей теплоты машина отдала холодильнику?
Какова температура нагревателя, если температура холодильника 20°С? Сколько
джоулей теплоты машина отдала холодильнику?
4. Температура пара, поступающего в турбину, 227°С, а температура холодильника 30°С. Определите КПД турбины и количество теплоты, получаемой от нагревателя каждую секунду, если за это же время бесполезно теряется 12 кДж энергии.
5. Определите КПД тепловой машины и величину работы, совершенной за счет каждого килоджоуля энергии, получаемой от нагревателя, если температура нагревателя 140°С, а холодильника 17°С.
6. КПД идеальной паровой турбины 60%, температура нагревателя 480°С. Какова температура холодильника и какая часть теплоты, получаемой от нагревателя, уходит в холодильник?
ВАРИАНТ «В»
1. Газ совершает цикл Карно. Абсолютная температура нагревателя в три раза выше абсолютной температуры холодильника. Определить долю теплоты, отдаваемой холодильнику.
2. Идеальная
тепловая машина, для которой окружающий воздух при нормальных условиях является
холодильником, поднимает груз массой 400 кг.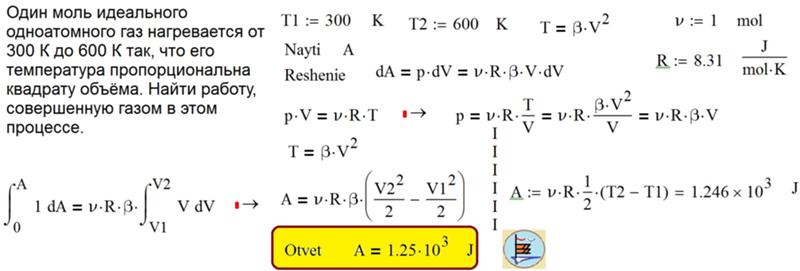 Рабочее тело машины получает от
нагревателя с температурой 200°С количество теплоты 8·104 Дж. На
какую максимальную высоту поднимает груз тепловая машина? Трением пренебречь.
Рабочее тело машины получает от
нагревателя с температурой 200°С количество теплоты 8·104 Дж. На
какую максимальную высоту поднимает груз тепловая машина? Трением пренебречь.
3. Холодильник, потребляющий мощность Р, за время t превратил воду в лед. Какое количество теплоты Q передал холодильник воздуху в комнате, если масса воды т, а ее начальная температура tº. Теплоемкостью самого холодильника можно пренебречь.
4. Автомобиль движется со скоростью 72 км/ч. Мощность двигателя 600 кВт, его КПД равен 30%. Определить расход бензина на 1 км пути.
5. Температура газов, образующихся при сгорании топлива в цилиндрах двигателя автомобиля, 800°С; температура выхлопных газов 80°С. Расход топлива на 100 км при скорости 90 км/ч равен 10-2 м3; теплота сгорания топлива 3,2·1010 Дж/м3. Какую мощность мог бы развить двигатель, если бы он представлял собой идеальную тепловую машину, работающую с максимально возможным коэффициентом полезного действия?
6. Двигатель
мотороллера развивает мощность 3,31 кВт при скорости 58 км/ч. Сколько километров
пройдет мотороллер, расходуя 3,2 л бензина, если КПД двигателя 20% ?
Двигатель
мотороллера развивает мощность 3,31 кВт при скорости 58 км/ч. Сколько километров
пройдет мотороллер, расходуя 3,2 л бензина, если КПД двигателя 20% ?
Вопросы-ответы — ПироШар
Что такое газ гелий и где он используется?
Гелий — инертный газ. Не горюч. Не взрывоопасен. Не токсичен. Без вкуса, цвета и запаха. Не оказывает влияния на окружающую среду, экологически безопасен. Опасности для живых организмов не представляет. Нельзя вдыхать гелий без примеси кислорода — это может привести к кислородному голоданию и потере сознания. Запрещены сильные удары по гелиевому баллону и нагревание свыше 60 градусов по Цельсию. Сам по себе гелий безвреден, но высокое давление в баллоне все же представляет собой некоторую опасность. Следует предохранять вентиль баллона от сильных ударов; транспортировать баллон лучше с защитным колпаком. Гелий используется не только для надувания воздушных шаров. Самый инертный из летучих и самый летучий из инертных, этот газ используется в машиностроении и оборонной промышленности, являясь рабочей средой некоторых приборов и технологического оборудования. Гелий используется в воздухоплавании. Он обеспечивает подъемную силу вместо огнеопасного водорода, ставшего причиной громких катастроф, из-за которых строительство дирижаблей в 30-е годы было остановлено. Гелий используется в метеорологии для наполнения воздушных шаров и зондов, а также в медицине.
Гелий используется в воздухоплавании. Он обеспечивает подъемную силу вместо огнеопасного водорода, ставшего причиной громких катастроф, из-за которых строительство дирижаблей в 30-е годы было остановлено. Гелий используется в метеорологии для наполнения воздушных шаров и зондов, а также в медицине.
Можно ли хранить баллон с гелием в помещениях где работают люди?
Газообразный гелий соответствует марке «А» или «Б» по ТУ-51-940-80. Согласно ТУ-51-940-80: Хранение газообразного гелия осуществляется согласно инструкции Минхимпрома BCH 6-75, действие которой распространяется на все продукты разделения воздуха и которая допускает хранение баллонов с гелием газообразным в помещении, где работают люди. Газообразный гелий применяется в аэронавтике для заполнения стратостатов, воздушных шаров и т.д., может также применяться в качестве наполнителя рекламных и других воздушных шаров в местах большого скопления людей в магазинах на стадионах и концертных площадках.
Расскажите более подробно о разновидностях баллонов с гелием и количестве шаров которые можно надуть с одного баллона?
Информация о гелиевых баллонах
| Емкость баллона, литры | Объем газа приполной заправке баллона (150 А), м куб.  | Вес* баллона, кг | Длина* баллона, м | Диаметр баллона, м | Можно надуть шаров (приблизительно) | |||
| 9” (23 см) | 12” (30 см) | 14” (38 см) | 16” (60 см) | |||||
| 5 | 0, 75 | 10 | 0,55 | 0,14 | 100 | 50 | 27 | 8 |
| 8 | 1,2 | 14 | 0,8 | 0,14 | 170 | 85 | 43 | 13 |
| 10 | 1, 5 | 17 | 0,9 | 0,14 | 220 | 110 | 54 | 17 |
| 20 | 3 | 30 | 1,4 | 0,24 | 450 | 225 | 110 | 33 |
| 40 | 6 | 70 | 1,6 | 0,24 | 900 | 450 | 215 | 67 |
*Вес и длина баллона могут в небольшой степени варьироваться.
У нас начатый баллон с гелием, как рассчитать хватит ли нам газа для выполнения предстоящего заказа?
Гелий содержится в специальных баллонах под давлением. Под давлением – для того чтобы газа в баллон вошло больше. Давление измеряется в атмосферах: 1 Атмосфера = 1 кг/см. кв. Номинальное давление (давление, с которым заправляют баллоны на заводе) -150 атмосфер, в таком баллоне газ сжат в 150 раз, а значит его там в 150 раз больше. В 40 литровом баллоне при полной заправке (150 А) содержится: 40 * 150 = 6000 литров гелия. По сути дела, сами гелиевые баллоны отличаются от других (например, кислородных, азотных, углекислотных) газовых баллонов только цветом – они красятся в коричневый цвет, специальный в них только вентиль, ведь гелий очень текуч, а значит, баллон должен закрываться очень плотно.
Под давлением – для того чтобы газа в баллон вошло больше. Давление измеряется в атмосферах: 1 Атмосфера = 1 кг/см. кв. Номинальное давление (давление, с которым заправляют баллоны на заводе) -150 атмосфер, в таком баллоне газ сжат в 150 раз, а значит его там в 150 раз больше. В 40 литровом баллоне при полной заправке (150 А) содержится: 40 * 150 = 6000 литров гелия. По сути дела, сами гелиевые баллоны отличаются от других (например, кислородных, азотных, углекислотных) газовых баллонов только цветом – они красятся в коричневый цвет, специальный в них только вентиль, ведь гелий очень текуч, а значит, баллон должен закрываться очень плотно.
При надувании шаров мы расходуем гелий, и давление в баллоне понижается, пока не дойдет до нуля. Для того чтобы определить, сколько в баллоне осталось гелия, нужно замерить давление манометром и перемножить количество атмосфер на емкость баллона:
Пример: Баллон 5 литров. Давление 60 атмосфер. 5 * 60 = 300 литров гелия (0,3 м. куб.)
Информация о количестве гелия в баллоне нам нужна, чтобы знать хватит ли нам газа для выполнения работы. Однако для этого нам еще нужно знать расход газа на один шар:
Однако для этого нам еще нужно знать расход газа на один шар:
Расход газа на 1 шар
| Тип шара | Объем газа в надутом шаре | |
| м куб. | литров | |
| 9” (23 см) круглый латексный | 0,007 | 7 |
| 12” (30 см) круглый латексный | 0,014 | 14 |
| 14” (38 см) круглый латексный | 0,028 | 28 |
| 16” (60 см) круглый латексный | 0,9 | 90 |
| 10” (25 см) сердце латексное | 0,007 | 7 |
Продолжая пример, и используя данные таблицы, мы можем сказать, что, имея 300 литров гелия, мы можем надуть:
300 / 7 = 42 шара 9”
или 300 / 14 = 21 шар 12”
или 300 / 28 = 10 шаров 14”
или 300 / 90 = 3 шара 16”
или 300 / 7 = 42 шара 10” сердечко
Из таблицы мы видим, что 12” шар вмещает в себя 14 литров гелия. Так много, не ошибка ли это? Конечно же, объем шара значительно меньше 14-ти литров, но гелий в шаре находится также в сжатом состоянии (стенки шара давят на газ). Гелий в шаре сжат примерно в 1,5 раза, т.е. давление составляет 1,5 атмосферы. Таким образом, объем 12” шара составляет около 9 литров, а гелия в нем около 14 литров.
Так много, не ошибка ли это? Конечно же, объем шара значительно меньше 14-ти литров, но гелий в шаре находится также в сжатом состоянии (стенки шара давят на газ). Гелий в шаре сжат примерно в 1,5 раза, т.е. давление составляет 1,5 атмосферы. Таким образом, объем 12” шара составляет около 9 литров, а гелия в нем около 14 литров.
Влияет ли на расход гелия температура окружающей среды?
Следует знать, что при минусовой температуре газ в баллоне сжимается – уменьшается в объеме, следовательно, понижается давление. Например, при температуре -20С° в полном 40-литровом баллоне давление газа будет не 150 атмосфер, а около 120 (газ сжался на 20%). Поэтому учитывайте это надувая шары в прохладном помещении и перемещая их в тёплое. Исходя из вышесказанного, рекомендуем надувать шар немного меньше положенного размера и тогда в тёплом месте, расширившийся газ гелий не разорвёт шар, а придаст ему нужную согласно размера форму.
Сколько времени летают гелиевые шары?
Полет шара с гелием самого распространённого размера 12 дюйма(30см. ) составляет от 12 до 20 часов, в зависимости от условий хранения.
) составляет от 12 до 20 часов, в зависимости от условий хранения.
А как можно увеличить время полёта гелиевого шара?
Что бы растянуть удовольствие лицезреть полёт гелиевого шара на несколько часов, в домашних условиях, достаточно обрезать ему хвостик используя для этого обычные ножницы.
Второй способ- это специальное средство Hi Float. HI-FLOAT – это безопасный для детей и взрослых раствор жидкого пластика, который, высыхая внутри воздушного шарика, образует удерживающую гелий плёнку и не даёт молекулам гелия выходить через стенку шара. За счёт этого срок полёта шарика увеличивается до двух недель, а иногда и дольше!
Для обеспечения максимальной продолжительности полета шарики должны находиться в теплом или кондиционируемом помещении при температуре от 22° до 26° C.
Так же при повышенной влажности на улице сроки полета шара резко сокращаются, т.к. хим раствор обработки не переносит влажность!
Если надутые и обработанные шарики хранятся на улице,в слишком тёплом или слишком холодном помещении — то срок полёта может несколько сократиться.
Опасен ли Hi Float для людей и окружающих предметов?
HI-FLOAT – это безопасный для детей и взрослых раствор жидкого пластика.
Хотя раствор не является токсичным, непросохший HI-FLOAT похож на клейкий состав на конвертах и при попадании на мебель или станы может оставить следы.
HI-FLOAT — водорастворим, поэтому при попадании на одежду или мебель он легко удаляется влажной тряпкой.
Предупреждение: ULTRA HI-FLOAT – это нетоксичный, смываемый водой пластиковый материал. Хотя он нетоксичен, при попадании в глаза промойте глаза водой в течение нескольких минут.
Остаточное давление
При обмене пустого баллона на полный на предприятиях, реализующих гелий, необходимым условием является наличие остаточного давления в баллоне. Проще говоря – ваш баллон не должен быть совсем пустым, хотя бы 1,5 – 2 атмосферы в нем должно остаться, баллон должен шипеть. Иначе придется доплачивать за «промывку» баллона от возможно попавшего воздуха. Для того, чтобы не платить дополнительные деньги, всегда, когда вы видите, что шар с этого баллона уже не надувается, немедленно закройте и больше не открывайте вентиль. Для предотвращения случайного открывания пустого баллона, его лучше сразу пометить, например, можно натянуть на вентиль не надутый шарик.
Для того, чтобы не платить дополнительные деньги, всегда, когда вы видите, что шар с этого баллона уже не надувается, немедленно закройте и больше не открывайте вентиль. Для предотвращения случайного открывания пустого баллона, его лучше сразу пометить, например, можно натянуть на вентиль не надутый шарик.
Заправка баллонов должна выполняться только на соответствующих предприятиях, при помощи специального оборудования, квалифицированным персоналом. Во избежание трагедии, не осуществляйте самостоятельно заправку баллонов! Именно при таких действиях может проявить себя опасность высокого давления.
ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ ОТ 2000 ГРАД ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ. (Технический отчет)
ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ ОТ 2000 ГРАДУСОВ ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ. (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Коутс, Нью-Хэмпшир; Галли, А Ф
- Дата публикации:
- Исследовательская организация:
- Горное управление, Вашингтон, округ Колумбия
- Идентификатор ОСТИ:
- 4476917
- Номер(а) отчета:
- БМ-РИ-6856
- Номер АНБ:
- НСА-21-004656
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Другая информация: UNCL.
 Ориг. Дата получения: 31-DEC-67
Ориг. Дата получения: 31-DEC-67
- Страна публикации:
- Страна неизвестна/код недоступен
- Язык:
- Английский
- Тема:
- N24300* -Инженерия-теплопередача и поток жидкости; ПОТОК ЖИДКОСТИ; ПОТОК ГАЗА; ТЕПЛОПЕРЕДАЧА; ГЕЛИЙ; РЕАКТОРЫ; ТУРБУЛЕНТНОСТЬ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Коутс, Н. Х., и Галли, А. Ф. ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛОПЕРЕДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ ОТ 2000 ГРАДУСОВ ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ. . Страна неизвестна/Код недоступен: N. p., 1966.
Веб. дои: 10.2172/4476917.
Копировать в буфер обмена
Коутс, Н. Х., и Галли, А. Ф. ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ 2000 ГРАД ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ. . Страна неизвестна/код недоступен. https://doi.org/10.2172/4476917
Х., и Галли, А. Ф. ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ 2000 ГРАД ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ. . Страна неизвестна/код недоступен. https://doi.org/10.2172/4476917
Копировать в буфер обмена
Коутс, Н. Х., и Галли, А. Ф. 1966.
«ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРАХ ОТ 2000 ГРАДУСОВ ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ». Страна неизвестна/код недоступен. https://doi.org/10.2172/4476917. https://www.osti.gov/servlets/purl/4476917.
Копировать в буфер обмена
@статья{osti_4476917,
title = {ПЛЕНОЧНЫЕ КОЭФФИЦИЕНТЫ ТЕПЛООТДАЧИ ДЛЯ ГЕЛИЯ ПРИ ТЕМПЕРАТУРЕ ОТ 2000 ГРАДУСОВ ДО 2500 ГРАДУСОВ F В ТУРБУЛЕНТНОМ ПОТОКЕ.},
автор = {Коутс, Н. Х. и Галли, А. Ф.},
abstractNote = {},
дои = {10,2172/4476917},
URL = {https://www. osti.gov/biblio/4476917},
журнал = {},
osti.gov/biblio/4476917},
журнал = {},
номер =,
объем = ,
place = {Страна неизвестна/Код недоступен},
год = {1966},
месяц = {1}
}
Копировать в буфер обмена
Посмотреть технический отчет (1,14 МБ)
https://doi.org/10.2172/4476917
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
3 | Передовые технологии Air Liquide
Обеспечение самым редким газом, где бы вы ни находились
Связаться с нами
Гелий-3, важная молекула
Один из самых редких газов, гелий-3 стабилен, инертен, нетоксичен и негорюч. Гелий-3 имеет широкий спектр применения. Это важная молекула для обнаружения нейтронов, рефрижераторов разбавления, исследований в области физики сверхнизких температур и анейтронного синтеза.
Гелий-3 имеет широкий спектр применения. Это важная молекула для обнаружения нейтронов, рефрижераторов разбавления, исследований в области физики сверхнизких температур и анейтронного синтеза.
3 Он – легкий и нерадиоактивный изотоп гелия, получаемый при превращении трития. Кратко:
- Уровень изотопной чистоты 99,8%
- Уровень химической чистоты 99,99%
Ключевой компонент холодильников для растворов
Холодильники для растворов используются учеными для проведения различных экспериментов, таких как исследования темной материи. 3He используется в качестве охлаждающей способности в холодильнике разбавления для достижения температур, близких к абсолютному нулю, что снижает шум или помехи в вычислениях.
3 He и квантовые вычисления
Обладая уникальными свойствами, такими как температура кипения 3,19 К (-270° по Цельсию), гелий-3 позволяет достигать температуры, близкой к абсолютному нулю, что необходимо в квантовых компьютерах , что позволяет им обрабатывать экспоненциально больше данных по сравнению с классическими компьютерами. Квантовые вычисления обещают ускоренное развитие во многих областях, включая поиск новых лекарств, открытие новых материалов и даже киберзащиту.
Квантовые вычисления обещают ускоренное развитие во многих областях, включая поиск новых лекарств, открытие новых материалов и даже киберзащиту.
Квантовые вычисления
Обнаружение нейтронов
Обнаружение нейтронов обычно использует гелий-3 в качестве реактивного агента. Обнаружение нейтронов используется в исследованиях в области физики элементарных частиц и материаловедения. Самое известное использование обнаружения нейтронов — это контрольно-пропускные пункты для обнаружения радиоактивных материалов и обеспечения безопасности границ.
Анейтронный синтез
Анейтронный синтез все еще находится на экспериментальной стадии, но должен стать источником питания следующего поколения, обещающим поставлять энергию, которая должна быть менее дорогостоящей, без долгосрочных ядерных отходов. В этом процессе, управляемом схемами анейтронных реакций, 3He используется в качестве топлива.
Наш
3 ОнТехнические характеристики
| Компонент | Описание | Спецификация |
| 3 Он | Атомная доля (%) | ≥ 99,800 |
| 4 Он | Атомная доля (%) | ≤ 0,200 |
| 3 Не + 4 Не | Объемная доля общего гелия (гелий-3 и гелий-4) | ≥ 99,995 |
| Н 2 | Объемная доля (%) | ≤ 0,0006 |
| С Н В м | Объемная доля (%) | ≤ 0,0006 |
| Н 2 | Объемная доля (%) | ≤ 0,0006 |
| О 2 + Ar | Объемная доля (%) | ≤ 0,0006 |
| СО | Объемная доля (%) | ≤ 0,0006 |
| 3 H, (тритий) | Объемная активность (Бк/л) | ≤ 4,8 |
| 3 Н | Атомная доля (%) | ≤ 1x 10 -11 |
Наше предложение
3Гибкое и комплексное решение:
- Индивидуальное логистическое решение для быстрой доставки,
- Полная логистика осуществляется Air Liquide,
- Общее время выполнения 2-4 недели,
- Размеры упаковки по запросу и объем, заполняемый на цилиндр
- Несколько размеров упаковки от 0,4л до 5л.

| Размер цилиндра | В04 | В1 | В5 |
| Объем воды | 0,4 л | 1 л | 5л |
| Максимальное содержание газа | 40 л | 100 л | 500 л |
| Материал цилиндра | Алюминий | Алюминий | Алюминий |
| Материал клапана | Латунь | Латунь | Латунь |
| Тип клапана | КГА580 | КГА580 | КГА580 |
| Высота | 242 мм | 335мм | 530 мм |
| Диаметр | 60 мм | 81 мм | 140 мм |
| Диаметр отверстия | 30 мм | 36 мм | 52 мм |
| Сертификация | ТПЕД+ДОТ | ТПЕД+ДОТ | ТПЕД+ДОТ |
Расскажите нам, что вам нужно.

 Ориг. Дата получения: 31-DEC-67
Ориг. Дата получения: 31-DEC-67
Leave A Comment