Сульфидные руды — techade.ru
Сульфидные руды – руды, в которых полезные ископаемые находятся в химических соединениях с серой. Сульфидные руды, имеют очень большое значение в горно-перерабатывающей промышленности, а так же в металлургии.
Выбор методики обогащения руды очень сильно зависит от содержания серы в породе. Сера – является примесным элементом с точки зрения получения чистых металлов и сплавов. Избавление от сернистых соединений довольно долгое и трудоемкое занятие.
К основным сульфидным минералам относятся: пирит, марказит, халькопирит, пирротин, сфалерит и вюртцит, менее распространены: троилит, галенит, асенопирит, борнит, халькозин, кубанит, дигенит и др.
Пирит – дисульфид железа FeS2, является самым распространенным сульфидом в земной коре, процентное содержание железа и серы составляет соответственно 46.6% и 53.4%. Основные примеси – Ni, Co, Cu, Au, As, Se, Tl. Обладает золотисто желтым цветом (поэтому иногда называется «золото дурака»). Пиритовые руды – основные источники сырья для получения серной кислоты и медного купороса. Однако, переработка пирита в полезные компоненты (извлечение цветных металлов) является экономически не выгодной, поэтому его отправляют в отвалы. В России месторождения пирита расположены на Урале (Дегтярское, Калатинское, Берёзовское). Большие залежи пирита сосредоточены на Алтае.
Пиритовые руды – основные источники сырья для получения серной кислоты и медного купороса. Однако, переработка пирита в полезные компоненты (извлечение цветных металлов) является экономически не выгодной, поэтому его отправляют в отвалы. В России месторождения пирита расположены на Урале (Дегтярское, Калатинское, Берёзовское). Большие залежи пирита сосредоточены на Алтае.
Марказит обладает сильным плеохроизмом, варьирующим от светлокоричневого до темно-зеленого, и встречается в виде радиальных лейст, образующих гобулярные структуры; в ядрах таких структур встречаются кристаллы пирита. Марказит, как и пирит, является сульфидов железа FeS2, но отличается от него внутренним кристаллическим строением, большей хрупкостью и меньшей твердостью. Марказит не устойчив в поверхностных условиях, что влечет его разложение (особенно при высокой влажности). Имея небольшую плотность, марказит может разрабатываться в качестве материала для производства серной кислоты. Марказит – распространенный минерал, но не так сильно как пирит. Обычно встречается в осадочных породах (что характерно для месторождений России). Наибольшие запасы марказита сосредоточены в Блявинском месторождении на Южном Урале, которое было открыто в 1933 году.
Марказит – распространенный минерал, но не так сильно как пирит. Обычно встречается в осадочных породах (что характерно для месторождений России). Наибольшие запасы марказита сосредоточены в Блявинском месторождении на Южном Урале, которое было открыто в 1933 году.
Пирротин – широко распространен в гипогенных месторождениях медно-никелевых руд, имеет огненно-красный или темно-оранжевый цвет, относится к классу сульфидов с составом Fe1-xS. Характерный состав (%): S – 36, Fe – 60-63.5, содержание железа может значительно варьировать. Так же сосредоточен на Урале на Кольском полуострове. Встречается в Германии, Баварии, Финляндии, встречается так же в метиоритах. Основные примеси – Ni, Co. Используется так же для получения серной кислоты.
Халькопирит – основной минерал для получения меди. Химическое соединение имеет вид CuFeS2, цвет – золотисто желтый, хрупкий. Минерал неустойчив и в процессе выветривания разрушается. Халькопирит широко распространенный минерал, в России сосредоточен в таких месторождениях как: Удокан (Забайкалье), Сибай (Урал), Турьинские месторождения (Северный Урал), Норильская группа месторождений.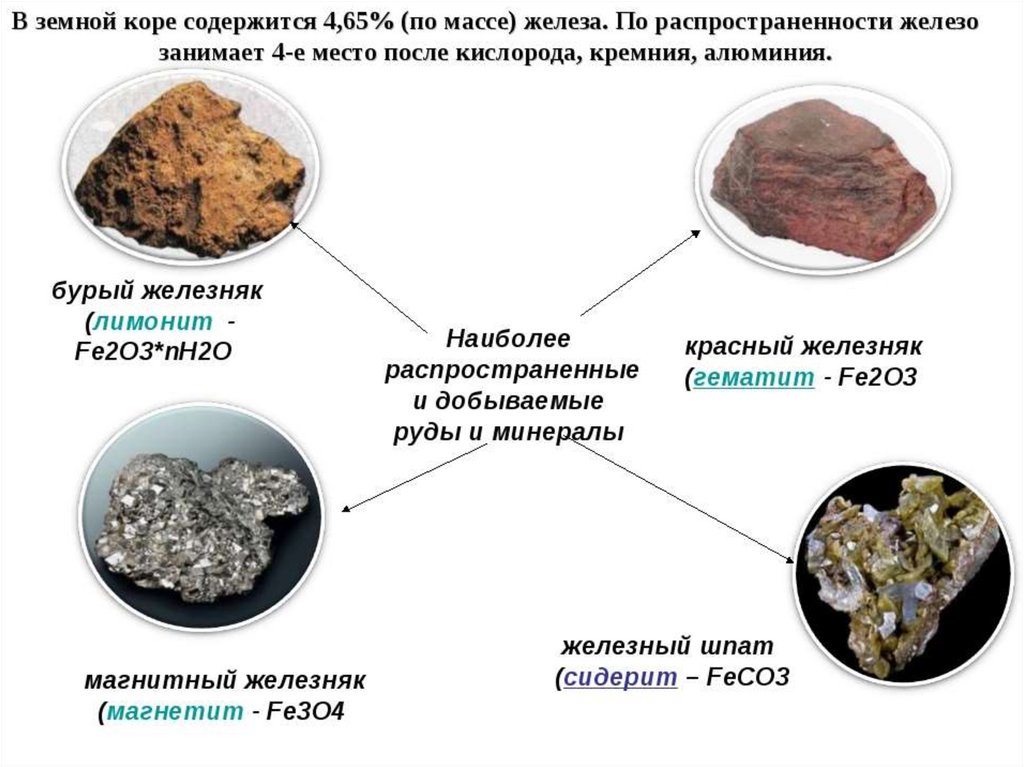 Большие залежи сосредоточены в Чили. Встречается в Казахстане, США, Армении и т. д.
Большие залежи сосредоточены в Чили. Встречается в Казахстане, США, Армении и т. д.
Рис. 1. Пирит
Рис. 2. Марказит
Рис. 3. Пирротин
Рис. 4. Халькопирит
Сульфидные руды, очень важный источник в получении цветных металлов (никеля, кобальта, меди, цинка, свинца, молибдена, ртути и др). В зависимости от соотношения сульфидов и других минералов в породе сульфидные пруды классифицируются на: сплошные, массивные, с преобладанием сульфидов, и прожилковые, или вкрапленные, с преобладанием несульфидных минералов. Так же руды бывают как монометаллические, содержащие один ценный компонент, так и полиметаллические, содержащие несколько ценных элементов.
Пирит, халькопирит, ковеллин, сфалерит – относятся к основным минералам сплошных и вкрапленных сульфидных руд. В таких рудах, пустая порода обычно представлена кварцем и слюдами.
В таких рудах, пустая порода обычно представлена кварцем и слюдами.
Для обогащения сульфидных руд применяются реагентные режимы и схемы флотационного обогащения. Эти режимы главным образом зависят от вещественного состава руды, соотношения минеральных форм рудных компонентов, степени активации рудного минерала, а так же степени окисления сульфидов интересующих элементов. Для большинства сульфидных руд характерна крайне неравномерная вкрапленность минералов, что в свою очередь, определяет необходимость использования сложных многостадийных схем обогащения. На первых стадиях обогащения, необходимо раскрыть сростки интересующих компонентов с пустой породой главного минерала. Это обычно достигается измельчением до 50-65%. Однако в зависимости от добываемого элемента, требуемое раскрытие может не произойти при таком измельчении, что может требовать доизмельчения до 85-95% .
На сегодняшний день, все большее распространение при обогащении сульфидных руд получают схемы с раздельной флотацией песковой и шламовой фракций с перефлотацией песковой фракции хвостов флотации. Схема такой флотации представлена на рисунке 5.
Схема такой флотации представлена на рисунке 5.
Изучение процесса термообработки сидеритовой руды в шахтной печи | Юрьев
1. Технологические и теплотехнические основы подготовки сидеритовых руд к металлургическим переделам / Б.П. Юрьев, С.Г. Меламуд, Н.А. Спирин, В.В. Шацилло. ― Екатеринбург: АМК “День РА”, 2016. ― 428 с.
2. Юрьев Б.П., Меламуд С.Г., Спирин Н.А. Исследование кинетики диссоциации бакальских сидеритовых руд // Изв. вузов. Черная металлургия. 2012. № 10. С. 12–14.
3. Ахлюстина Н.В. Влияние химико-минералогического состава сидерита и сидероплезита на температуру начала разложения // Изв. вузов. Горный журнал. 1979. № 8. С. 135–138.
4. Поведение сидерита в процессе обжига / М.М. Гольдман, Л.П. Ни, А.И. Ардашева, Т.Б. Турсунбаев // Изв. вузов. Цветная металлургия. 1977. № 3. С. 41–44.
5. Юрьев Б.П., Костоусова Т.И. Исследование свойств сидеритовой руды и продуктов ее обжига в процессе термообработки // Изв. вузов. Черная металлургия.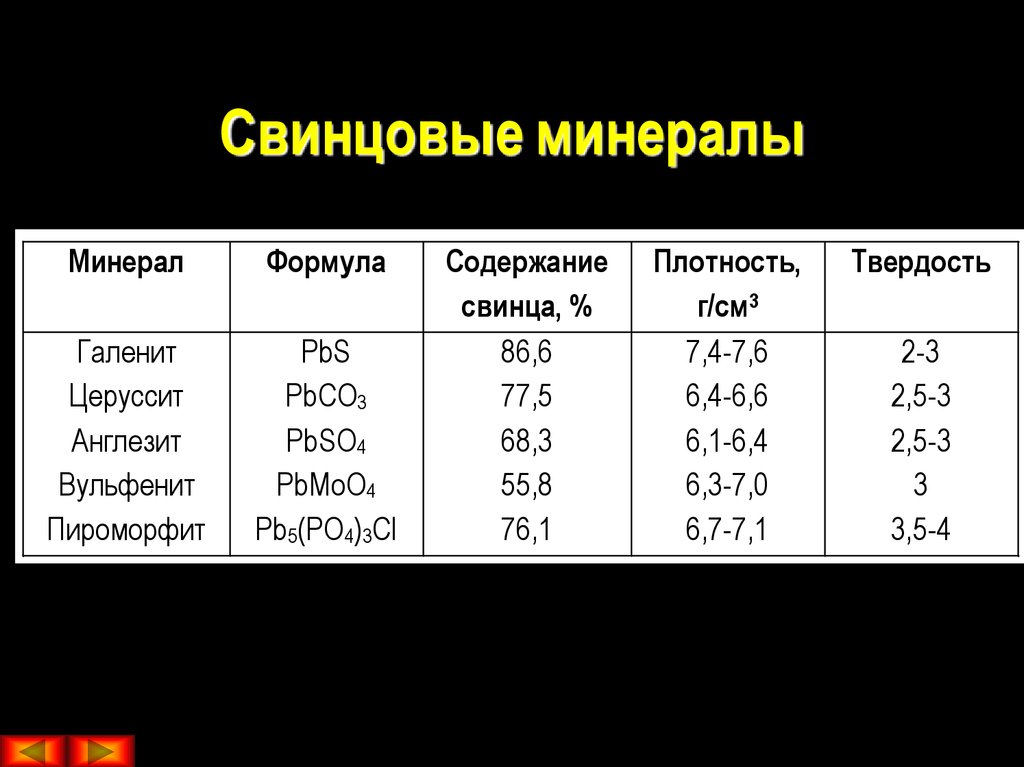 1999. № 3. С. 17–23.
1999. № 3. С. 17–23.
6. Запарнюк М.Н., Нешпоренко Е.Г. Определение термодинамических условий энергоэффективной переработки сидеритовых руд // Наука и производство Урала. 2015. № 11. С. 2–3.
7. Пирометаллургическая переработка комплексных руд / Л.И. Леонтьев, Н.А. Ватолин, С.В. Шаврин, Н.С. Шумаков. — М.: Металлургия, 1997. ― 432 с.
8. Костина З.И., Крылова С.А., Понурко И.В. К вопросу о способах переработки сидеритовых руд // Международный журнал прикладных и фундаментальных исследований. 2015. № 11 (часть 4). С. 580–585.
9. Большаков В.И. Технология высокоэффективной энергосберегающей доменной плавки. ― Киев: Наукова думка, 2007. ― 412 с.
10. Muhl O. Erfahrungsbericht uber die Schwertrube-Lyklonanlage an Steiurischen Erzberg // Berg-und Huttenmannische Monashefte. 1981. Bd. 126. № 8. S. 344–348.
11. Kardi A. Moznosti Ldokonalenia technologie up ravy Sideritovej rudy vzavode LB Rudnany // Rudy. 1983. R. 31. № 3. S. 75–79.
12. Юрьев Б.П., Гольцев В. А. Влияние состава сидеритовой руды, конструктивных и режимных факторов на показатели работы шахтных печей // Сталь. 2013. № 4. С. 6–10.
А. Влияние состава сидеритовой руды, конструктивных и режимных факторов на показатели работы шахтных печей // Сталь. 2013. № 4. С. 6–10.
13. Юрьев Б.П., Меламуд С.Г. Технология обжига сидеритовой руды с использованием твердого топлива // Сталь. 2012. № 7. С. 2–4.
14. Юрьев Б.П. Методика расчета времени нагрева сидеритовой руды при фазовых превращениях // Изв. вузов. Черная металлургия. 2011. № 3. С. 61–64.
15. Юрьев Б.П., Шацилло В.В., Меламуд С.Г. Методика определения расхода твердого топлива на обжиг сидеритовых руд в различных газовых средах // Изв. вузов. Черная металлургия. 2008. № 2. С. 8–11.
16. Жунев А.Г., Юрьев Б.П. Особенности десульфурации при обжиге бакальских сидеритовых руд // Сталь. 2009. № 12. С. 12–16.
17. Юрьев Б.П., Меламуд С.Г., Шацилло В.В. Влияние конструктивных и режимных параметров работы шахтных печей на свойства сидеритовой руды и продуктов ее обжига // Черная металлургия. Бюллетень научно-технической и экономической информации. 2006. № 9. С. 16–33.
№ 9. С. 16–33.
18. Эффективность и перспективы применения сидеритовых руд к доменной плавке / В.А. Красноборов, С.Л. Ярошевский, А.А. Денисов и др. ― Донецк: Новый мир, 1996. ― 74 с.
19. Экспериментальное изучение кинетики процесса восстановительного обжига сидеритовой руды / М.Э. Бланк, Б.А. Боковиков, Т.Д. Трапезникова, Б.П. Юрьев // Теплотехнические исследования процессов и агрегатов в черной металлургии. ― М.: Металлургия, 1986. С. 9–12.
20. Юрьев Б.П., Шацилло В.В., Меламуд С.Г. Методика учета тепловых эффектов реакций, протекающих в обжигаемом слое сидеритовой руды, при определении оптимального расхода топлива в шахтной печи // Изв. вузов. Черная металлургия. 2008. № 8. С. 3–5.
21. Юрьев Б.П., Меламуд С.Г., Шацилло В.В. Изучение кинетики процессов восстановительного и окислительного обжига сидеритовой руды // Черная металлургия. Бюллетень научно-технической и экономической информации. 2007. № 5. С. 29–33.
22. Янг Д. Кинетика разложения твердых веществ. ― М.: Мир, 1969. ― 263 с.
― М.: Мир, 1969. ― 263 с.
23. Ерофеев Б.В. Обобщенное уравнение химической кинетики и его применение к реакциям с участием твердых веществ // Доклады АН СССР. 1946. Т. 52. № 6. С. 515–518.
24. Вентцель Е.С. Теория вероятностей. ― М., 1969. ― 576 с.
Химия — Металлургия
- Примечания по химии для предварительных испытаний UPSC IAS (Часть II)
- Химия — Главная
- Химия — Введение
- Химия — Отрасли
- Химия — Радиоактивность
- Химия — Атомная энергия
- Химия — Металлы
- Химия — Металлургия
- Химия — Натрий
- Химия — Кальций
- Химия — Алюминий
- Химия — Магний
- Химия — Маганец
- Химия — Железо
- Химия — Медь
- Химия — Серебро
- Химия — Золото
- Химия — Платина
- Химия — Цинк
- Химия — Ртуть
- Химия — Плутоний
- Химия — Уран
- Химия — Свинец
- Химия — Торий
- Химия — Водород
- Химия — Гелий
- Химия — Кислород
- Химия — Углерод
- Химия — Азот
- Химия — Химическое право
- Химия — открытие элементов
- элемента с их валентностью
- Химия — Нобелевская премия
- Полезные ресурсы по химии
- Химия Часть 2 — Онлайн-викторина
- Химия, часть 2 — онлайн-тест
- Химия.
 Часть 2. Краткое руководство
Часть 2. Краткое руководство - Химия — полезные ресурсы
- Химия — Обсуждение
- Выбранное чтение
- Примечания к экзаменам UPSC IAS
- Передовой опыт разработчиков
- Вопросы и ответы
- Эффективное составление резюме
- Вопросы для собеседования с персоналом
- Компьютерный глоссарий
- Кто есть кто
Предыдущая страница
Следующая страница
Раздел науки и техники, изучающий свойства металлов, их получение и очистку, известен как металлургия .
Встречающееся в природе твердое неорганическое вещество известно как минерал .
Встречающийся в природе твердый материал, из которого можно извлечь ценный минерал или металл, известен как руда .
В следующей таблице показаны основные элементы и их руды –
| Элемент | Руды | Химический состав |
|---|---|---|
| Алюминий | Бокситы | Алюминий | Корунд | Алюминий 2 О 3 |
| Криолит | Na 3 AlF 6 | |
| Диспора | Алюминий 2 О 3 . H 2 О H 2 О | |
| Медь | Медный пирит | CuFeS 2 |
| Малахит | 2CuCO 3 Cu(OH) 2 | |
| Железо | Гематит | Fe 2 О 3 |
| Магнетит | Fe 3 О 4 | |
| Сидерит | FeCO 3 | |
| Натрий | Карбонат натрия | Na 2 CO 3 |
| Хлорид натрия | NaCl | |
| Нитрат натрия | NaNO 3 | |
| Сульфат натрия | Нет 2 SO 4 | |
| Калий | Хлорид калия | KCl |
| Карбонат калия | К 2 СО 3 | |
| Нитрат калия | КНО 3 | |
| Магний | Магнезит | МгСО 3 |
| Доломит | CaMg(CO 3 ) 2 | |
| Английская соль | MgSO 4 | |
| Кальций | Карбонат кальция | СаСО 3 |
| Олово | Касситерит | СНО 2 |
| Свинец | Галена | ПбС |
| Церуссит | PbCO 3 | |
| Англесайт | PbSO 4 | |
| Серебро | аргентит | Серебряный 2 С |
| Тетраэдрит | Сб 4 С 3 | |
| Цинк | Карбонат цинка (известный как каламин) | ZnCO 3 |
| Сульфид цинка | ЗНС | |
| Меркурий | Киноварь | HgS |
| Марганец | Пиролюзит | MnO 2 |
| Фосфор | Фосфорит | Ca 3 (ПО 4 ) 2 |
| Фторапатит | Ca 5 (ПО 4 ) 3 F | |
| Хлорапатит | 3Ca 3 (PO 4 ) 2 . | |
| Золото | Калаверит | AuTE 2 |
| Сильванит | (Ag,Au)Te 2 | |
| Надьагите | (Pb 5 Au(Te, Sb)4S 5-8 ) | |
| Петците | Ag 3 AuTe 2 | |
| Сурьма | Стибнит | Сб 2 С 3 |
| Стибиконит | (Сб 3+ Сб 2 5+ О 6 (ОН)) | |
| Кобальт | Кобальтит | КОАСС |
| Никель | Пентландит | ((Ni, Fe)S) |
| Хром | Хромит | (ФеХр 2 О 4 ) |
Предыдущая страница Печать страницы Следующая страница
Обработка железа | Определение, история, шаги, использование и факты
доменная печь и воздухонагреватель
Смотреть все СМИ
- Ключевые люди:
- Абрам Стивенс Хьюитт Джон Фриц
- Связанные темы:
- кованое железо чугун вагранка цветочный процесс процесс украшения
Просмотреть весь связанный контент →
 В эту статью также включено обсуждение добычи железа и его подготовки к выплавке.
В эту статью также включено обсуждение добычи железа и его подготовки к выплавке.
Железо (Fe) представляет собой относительно плотный металл серебристо-белого цвета с характерными магнитными свойствами. Он составляет 5% массы земной коры и является четвертым по распространенности элементом после кислорода, кремния и алюминия. Он плавится при температуре 1538°C (2800°F).
Изучение производства и структурных форм железа от феррита и аустенита до легированной стали
Железо аллотропно, то есть существует в разных формах. Его кристаллическая структура может быть объемно-центрированной кубической (ОЦК) или гранецентрированной кубической (ГЦК) в зависимости от температуры. В обеих кристаллографических модификациях основная конфигурация представляет собой куб с атомами железа, расположенными по углам. В центре каждого куба в ОЦК-модификации и в центре каждой грани в ГЦК-модификации есть лишний атом. При комнатной температуре чистое железо имеет ОЦК-структуру, называемую альфа-ферритом; это продолжается до тех пор, пока температура не поднимется до 912 ° C (1674 ° F), когда он превращается в структуру ГЦК, известную как аустенит.
Чистый металл податлив и легко поддается обработке молотком, но, за исключением специализированных электрических применений, он редко используется без добавления других элементов для улучшения его свойств. В основном он появляется в сплавах железа с углеродом, таких как стали, которые содержат от 0,003 до примерно 2 процентов углерода (большинство лежит в диапазоне от 0,01 до 1,2 процента), и чугуны с содержанием углерода от 2 до 4 процентов. При содержании углерода, характерном для сталей, карбид железа (Fe  При более высоком содержании углерода, характерном для чугуна, углерод может выделяться либо в виде цементита, либо в виде графита, в зависимости от условий производства. Опять же, получается широкий спектр свойств. Эта универсальность сплавов железа с углеродом приводит к их широкому использованию в технике и объясняет, почему железо является самым важным из всех промышленных металлов.
При более высоком содержании углерода, характерном для чугуна, углерод может выделяться либо в виде цементита, либо в виде графита, в зависимости от условий производства. Опять же, получается широкий спектр свойств. Эта универсальность сплавов железа с углеродом приводит к их широкому использованию в технике и объясняет, почему железо является самым важным из всех промышленных металлов.
Имеются свидетельства того, что метеориты использовались в качестве источника железа до 3000 г. до н.э., но извлечение металла из руд датируется примерно 2000 г. до н.э. Производство, по-видимому, началось в медедобывающих регионах Анатолии и Персии, где использование соединений железа в качестве флюсов для облегчения плавки могло случайно вызвать накопление металлического железа на дне медеплавильных печей. Когда производство железа было налажено должным образом, стали использовать два типа печей. Чашевые печи были построены путем рытья небольшого отверстия в земле и обеспечения подачи воздуха из мехов через трубу или фурму. С другой стороны, каменные шахтные печи полагались на естественную тягу, хотя иногда в них также использовались фурмы. В обоих случаях плавка включала создание слоя раскаленного древесного угля, в который добавлялась железная руда, смешанная с большим количеством древесного угля. Затем произошло химическое восстановление руды, но, поскольку примитивные печи не могли достигать температуры выше 1150 ° C (2100 ° F), обычным продуктом был твердый кусок металла, известный как блюм. Он мог весить до 5 кг (11 фунтов) и состоял из почти чистого железа с небольшим количеством захваченного шлака и кусков древесного угля. Затем изготовление железных артефактов требовало операции формовки, которая включала нагревание цветков в огне и удары молотком по раскаленному докрасна металлу для изготовления желаемых предметов. Железо, изготовленное таким образом, известно как кованое железо. Иногда кажется, что было использовано слишком много древесного угля, и сплавы железа с углеродом, которые имеют более низкую температуру плавления и могут быть отлиты в простые формы, были сделаны непреднамеренно.
С другой стороны, каменные шахтные печи полагались на естественную тягу, хотя иногда в них также использовались фурмы. В обоих случаях плавка включала создание слоя раскаленного древесного угля, в который добавлялась железная руда, смешанная с большим количеством древесного угля. Затем произошло химическое восстановление руды, но, поскольку примитивные печи не могли достигать температуры выше 1150 ° C (2100 ° F), обычным продуктом был твердый кусок металла, известный как блюм. Он мог весить до 5 кг (11 фунтов) и состоял из почти чистого железа с небольшим количеством захваченного шлака и кусков древесного угля. Затем изготовление железных артефактов требовало операции формовки, которая включала нагревание цветков в огне и удары молотком по раскаленному докрасна металлу для изготовления желаемых предметов. Железо, изготовленное таким образом, известно как кованое железо. Иногда кажется, что было использовано слишком много древесного угля, и сплавы железа с углеродом, которые имеют более низкую температуру плавления и могут быть отлиты в простые формы, были сделаны непреднамеренно. Применение этого чугуна было ограничено из-за его хрупкости, и в раннем железном веке, похоже, его использовали только китайцы. В других местах предпочтительным материалом было кованое железо.
Применение этого чугуна было ограничено из-за его хрупкости, и в раннем железном веке, похоже, его использовали только китайцы. В других местах предпочтительным материалом было кованое железо.
Хотя римляне строили печи с ямой, в которую можно было сливать шлак, до средневековья мало что изменилось в методах производства железа. К 15 веку многие цветочные печи использовали печи с низким валом с приводом от воды для привода мехов, а цвет, который мог весить более 100 кг, извлекался через верхнюю часть вала. Окончательным вариантом такого рода горнила была каталонская кузница, просуществовавшая в Испании до 19 века. Другая конструкция, высокая горная печь, имела более высокий вал и превратилась в печь высотой 3 метра (10 футов).0600 Stückofen , который давал такие большие блюмы, что их приходилось удалять через переднее отверстие в печи.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Доменная печь появилась в Европе в 15 веке, когда стало понятно, что чугун можно использовать для изготовления цельных ружей с хорошими свойствами удержания давления, но было ли ее появление связано с китайским влиянием или было независимым развитие неизвестно. Во-первых, различия между доменной печью и Stückofen были незначительными. Оба имели квадратное поперечное сечение, и основными изменениями, необходимыми для работы доменной печи, были увеличение соотношения древесного угля и руды в шихте и летка для удаления жидкого железа. Продукт доменной печи стал известен как чугун из-за метода литья, при котором жидкость направлялась в основной канал, соединенный под прямым углом с несколькими более короткими каналами. Вся конструкция напоминала свиноматку, кормящую свой помет, поэтому куски твердого железа из более коротких каналов были известны как свиньи.
Во-первых, различия между доменной печью и Stückofen были незначительными. Оба имели квадратное поперечное сечение, и основными изменениями, необходимыми для работы доменной печи, были увеличение соотношения древесного угля и руды в шихте и летка для удаления жидкого железа. Продукт доменной печи стал известен как чугун из-за метода литья, при котором жидкость направлялась в основной канал, соединенный под прямым углом с несколькими более короткими каналами. Вся конструкция напоминала свиноматку, кормящую свой помет, поэтому куски твердого железа из более коротких каналов были известны как свиньи.
Несмотря на военную потребность в чугуне, для большинства гражданских применений требовался ковкий чугун, который до этого производился непосредственно в блочном заводе. Однако появление доменных печей открыло альтернативный путь производства; это включало преобразование чугуна в кованое железо с помощью процесса, известного как рафинирование. Куски чугуна были помещены на убранный очаг, на котором сжигался древесный уголь с обильной подачей воздуха, так что углерод в железе удалялся путем окисления, оставляя полутвердое ковкое железо. Начиная с 15 века, этот двухстадийный процесс постепенно вытеснил прямое производство железа, которое, тем не менее, сохранилось до 19 века.век.
Начиная с 15 века, этот двухстадийный процесс постепенно вытеснил прямое производство железа, которое, тем не менее, сохранилось до 19 века.век.
К середине 16 века в юго-восточной Англии доменные печи работали более или менее непрерывно. Увеличение производства железа привело к нехватке древесины для производства древесного угля и к его последующей замене углем в виде кокса — открытие, которое обычно приписывают Абрахаму Дарби в 1709 году. Поскольку более высокая прочность кокса позволяла ему поддерживать большую загрузку, стали возможными печи гораздо большего размера, и была достигнута производительность от 5 до 10 тонн чугуна в неделю.
Затем, появление паровой машины для привода продувочных цилиндров означало, что доменная печь могла быть снабжена большим количеством воздуха. Это создало потенциальную проблему, заключающуюся в том, что производство чугуна будет намного превышать возможности процесса очистки. Ряд изобретателей пытались ускорить преобразование чугуна в ковкий, но наиболее успешным был англичанин Генри Корт, который запатентовал свою пудлинговую печь в 1784 году. Корт использовал угольную отражательную печь для плавления шихты чугуна. к которому добавляли оксид железа для получения шлака. Встряхивание образовавшейся «лужи» металла приводило к удалению углерода путем окисления (вместе с кремнием, фосфором и марганцем). В результате температура плавления металла повысилась настолько, что он стал полутвердым, хотя шлак оставался достаточно жидким. Затем из металла формовали шарики и освобождали от как можно большего количества шлака, прежде чем вынуть из печи и отжать молотком. В течение короткого времени пудлинговые печи могли производить достаточное количество железа для удовлетворения потребностей машинного оборудования, но в результате изобретения шотландцем Джеймсом Бомонтом Нильсеном в 1828 году доменной печи для предварительного нагрева дутья производительность доменных печей снова увеличилась. воздух и осознание того, что круглая печь работает лучше, чем квадратная.
Корт использовал угольную отражательную печь для плавления шихты чугуна. к которому добавляли оксид железа для получения шлака. Встряхивание образовавшейся «лужи» металла приводило к удалению углерода путем окисления (вместе с кремнием, фосфором и марганцем). В результате температура плавления металла повысилась настолько, что он стал полутвердым, хотя шлак оставался достаточно жидким. Затем из металла формовали шарики и освобождали от как можно большего количества шлака, прежде чем вынуть из печи и отжать молотком. В течение короткого времени пудлинговые печи могли производить достаточное количество железа для удовлетворения потребностей машинного оборудования, но в результате изобретения шотландцем Джеймсом Бомонтом Нильсеном в 1828 году доменной печи для предварительного нагрева дутья производительность доменных печей снова увеличилась. воздух и осознание того, что круглая печь работает лучше, чем квадратная.
Окончательный спад в использовании кованого железа был вызван серией изобретений, которые позволили печам работать при температурах, достаточно высоких для плавления железа. Тогда стало возможным производить сталь, которая является превосходным материалом. Сначала в 1856 году Генри Бессемер запатентовал свой конвертерный процесс для продувки воздухом расплавленного чугуна, а в 1861 году Уильям Сименс получил патент на свою регенеративную мартеновскую печь. В 1879 году Сидни Гилкрист Томас и Перси Гилкрист адаптировали конвертер Бессемера для использования с фосфорным чугуном; в результате основной бессемеровский процесс, или процесс Томаса, получил широкое распространение на европейском континенте, где были в изобилии железные руды с высоким содержанием фосфора. Около 100 лет мартеновский и бессемеровский процессы производили большую часть стали, прежде чем они были заменены кислородными и электродуговыми печами.
Тогда стало возможным производить сталь, которая является превосходным материалом. Сначала в 1856 году Генри Бессемер запатентовал свой конвертерный процесс для продувки воздухом расплавленного чугуна, а в 1861 году Уильям Сименс получил патент на свою регенеративную мартеновскую печь. В 1879 году Сидни Гилкрист Томас и Перси Гилкрист адаптировали конвертер Бессемера для использования с фосфорным чугуном; в результате основной бессемеровский процесс, или процесс Томаса, получил широкое распространение на европейском континенте, где были в изобилии железные руды с высоким содержанием фосфора. Около 100 лет мартеновский и бессемеровский процессы производили большую часть стали, прежде чем они были заменены кислородными и электродуговыми печами.
За исключением вдувания части топлива через фурмы, в доменной печи с начала 19 века используется тот же принцип работы. Однако размер печи заметно увеличился, и одна большая современная печь может снабжать сталеплавильный завод до 10 000 тонн жидкого чугуна в день.
На протяжении 20-го века было предложено много новых процессов производства чугуна, но только в 1950-х годах появились потенциальные заменители доменной печи. Прямое восстановление, при котором железные руды восстанавливаются при температурах ниже точки плавления металла, берет свое начало в таких экспериментах, как процесс Виберга-Зодерфорса, введенный в Швеции в 1919 г.52 и процесс HyL, введенный в Мексике в 1957 году. Немногие из этих методов сохранились, а те, что сохранились, были значительно модифицированы. Другой альтернативный метод производства чугуна, восстановление плавлением, имел своих предшественников в электрических печах, которые использовались для производства жидкого чугуна в Швеции и Норвегии в 1920-х годах. Этот метод расширился и стал включать методы, основанные на кислородных конвертерах для производства стали с использованием угля в качестве источника дополнительной энергии, и в 1980-х годах он стал центром обширных исследований и разработок в Европе, Японии и США.

 Часть 2. Краткое руководство
Часть 2. Краткое руководство
Leave A Comment