Тестовая работа по теме Периодическая система химических элементов Д. И. Менделеева
Тестовая работа по теме «Периодическая система химических элементов Д. И. Менделеева»
Вариант 1
Определите количество периодов в периодической системе
а) 7 | б) 8 | в) 9 | г) 10 |
Определите порядковый номер химического элемента, который находится в IV периоде, IV группе, главной подгруппе
а) 22 | б) 32 | в) 48 | г) 73 |
Определите относительную атомную массу химического элемента, который находится в V периоде, III группе, побочной подгруппе
а) 89 | б) 115 | в) 88 | г) 114 |
В каком из предложенных рядов химических элементов записаны только металлы
а)C, Si, Mg | б) Sc, Se, Sr | в) K, Mo, Ca | г) Mn, Fe, P |
Укажите положение химического элемента селен в периодической системе
а)IV период, IV группа, побочная подгруппа
б)IV период, VI группа, главная подгруппа
в) IV период, IV группа, главная подгруппа
г) IV период, VI группа, побочная подгруппа
Какова формула высшего оксида молибдена
а) Мо2О3 | б) МоО2 | в) Мо2О5 | г) МоО3 |
К щелочным металлам относятся все химические элементы в ряду
а)K, Ca, Sc | б) K, Ca, Mg | в) K, Rb, Cs | г) Rb, Cs, Ba |
К галогенам относятся все химические элементы в ряду
а)O, S, Se | б) Cl, I, Br | в) Mn, Tc, Re | г) S, Cl, Ar |
Определите название и положение химического элемента в периодической системе химических элементов Д. И. Менделеева по его порядковому номеру: 40, 28
И. Менделеева по его порядковому номеру: 40, 28
Тестовая работа по теме «Периодическая система химических элементов Д. И. Менделеева»
Вариант 2
Определите количество групп в периодической системе
а)7 | б) 8 | в) 9 | г) 10 |
Определите порядковый номер химического элемента, который находится в VI периоде, II группе, главной подгруппе
а)8 | б) 16 | в) 56 | г) 80 |
Определите относительную атомную массу химического элемента, который находится в IV периоде, VII группе, побочной подгруппе
а)54 | б) 55 | в) 79 | г) 80 |
В каком из предложенных рядов химических элементов записаны только неметаллы
а)F, Cl, Mn | б) As, Se, Br | в) Sn, Sb, Te | г) C, Si, Ge |
Укажите положение химического элемента ртуть в периодической системе
а) VI период, II группа, побочная подгруппа
б) II период, VI группа, главная подгруппа
в) II период, VI группа, побочная подгруппа
г) VI период, II группа, главная подгруппа
Какова формула летучего водородного соединения селена
а)SeH4 | б) SeH3 | в) SeH2 | г) SeH |
К щелочноземельным металлам относятся все химические элементы в ряду
а)B, Al, Sc | б) F, Cl, Br | в) Ba, Sr, Mg | г) Mg, Be, Ca |
К благородным (инертным) газам относятся все химические элементы в ряду
а)Se, Br, Kr | б) F, I, Cl | в) Fe, Co, Ni | г) He, Ne, Ar |
Определите название и положение химического элемента в периодической системе химических элементов Д.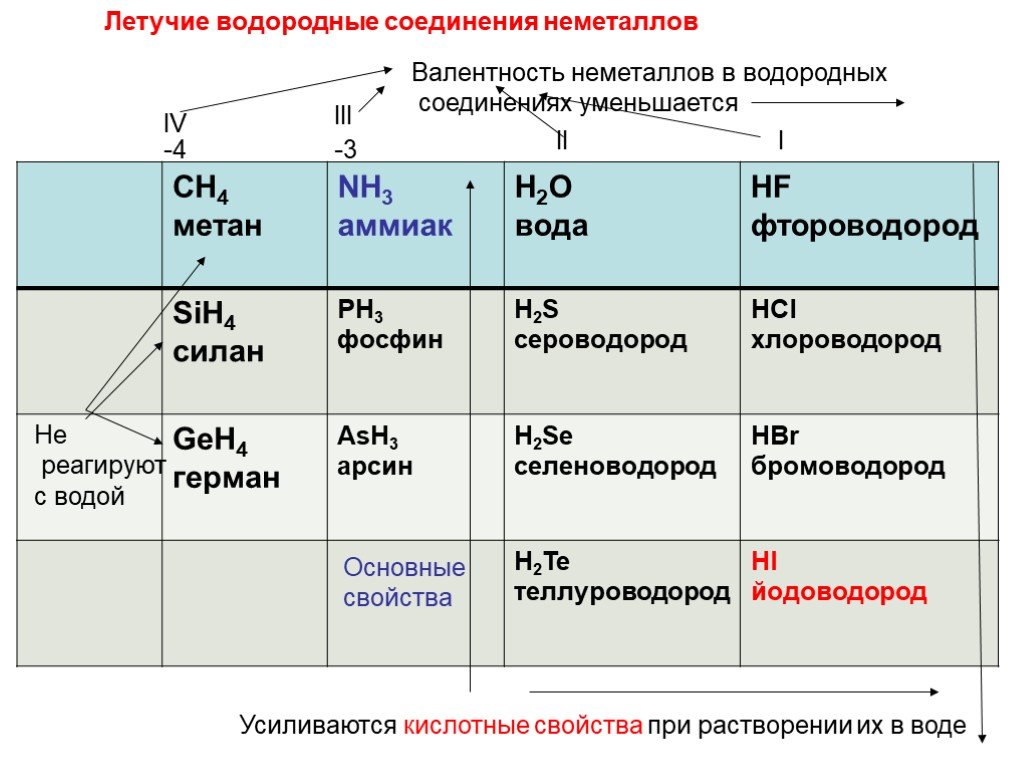 И. Менделеева по его порядковому номеру: 45, 53
И. Менделеева по его порядковому номеру: 45, 53
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/129473-testovaja-rabota-po-teme-periodicheskaja-sist
Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе
План урока
- План характеристики химического элемента
- Характеристика металла и его соединений
- Характеристика неметалла и его соединений
Цели урока
- рассмотреть план характеристики химического элемента на основании его положения в ПС
- научиться описывать свойства химического элемента и его соединений на основе плана характеристики
- расширить и углубить знания о химических элементах, периодической системе и строении атомов
Элементы и атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
Можно предположить, что химические элементы в периодической системе — это герои, и им, как и любым героям, можно давать определённые характеристики. За основу характеристики химических элементов мы будем брать Периодическую систему химических элементов (ПСХЭ) Д. И. Менделеева.
План характеристики элементов по ПСХЭ
- Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
- Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
- Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
- Распределение электронов по энергетическим уровням, электронная формула атома.
- Характер элемента (металл, неметалл).
- Характеристика химической связи, физические свойства.
- Сравнение со свойствами соседних элементов (по группе, по периоду).
- Формула высшего оксида, название, его характер.

- Формула гидроксида (основания или кислоты), название, его характер.
- Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Характеристика металла и его соединений
Охарактеризуем металл калий К
1. Порядковый номер калия, т. е. клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
2. Значит, заряд его ядра равен Z = +19 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов (19 e—), и 19 протонов (19 p+), а число нейтронов определяется по формуле n = Ar — Z, т. е. 39 – 19 = 20, значит, в атоме 20 нейтронов
(12 n0).
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s-семейства.
4. Так как калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом,
Так как калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом,
значит, — 1 электрон.
Электронная формула атома калия: 1s22s22p63s23p64s1.
5. Т. к. у калия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Рис. 1. Металл калий
6. Раз калий — металл, то для него характерна металлическая химическая связь и металлическая кристаллическая решётка. Поэтому, как и для любого металла, для него характерны такие физические свойства, как металлический блеск, пластичность, тепло- и электропроводность.
7. Сравнение свойств элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у
Сравнение свойств элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у
рубидия, т. к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра, их становится легче отдавать. Сравнение свойств элемента калия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у кальция, т. к. в периодах слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее отдавать, чем присоединить.
8. Калий — металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия K2O, значит, это основный оксид, он проявляет все свойства, характерные для этих оксидов: реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
К2О + 2HCl → 2KCl + h3O
K2O + SO3 → K2SO4
K2O + h3O → 2KOH
9.
КОH + HNO3 → KNO3 + h3O
2KOH + CO2 → K2CO3 + h3O
2KOH + CaCl2 → 2KCl + Ca(OH)2
10. Если калий — металл, то он не образует летучих водородных соединений.
Характеристика неметалла и его соединений
Охарактеризуем неметалл сера S
1. Сера находится в клетке номер 16, т. е. её порядковый номер 16, относительная атомная масса Ar — 32.
Химический символ — S.
2. Значит, заряд ядра её атома будет Z = +16, а число протонов, как и число электронов равно 16: (р0 = 16, e— = 16). Число нейтронов будет равно 16, т. к. если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
3. Сера расположена в ПС в VI группе, главной (A) подгруппе, 3 малом периоде, относится к элементам p-семейства.
4. Сера находится в третьем периоде, значит, у неё три энергетических уровня: на первом 2 электрона, на втором — 8, а на третьем — 6.
Электронная формула атома серы: 1s22s22p63s23p4.
5. Сера — это неметалл, значит, она может быть как окислителем, так и восстановителем. Как окислитель она может присоединить 2 электрона до завершения внешнего уровня, получая при этом степень окисления -2
(S0 + 2e- → S-2), а как восстановитель она может отдать 4 или 6 электронов и получить степень окисления +4 или +6 (S0 — 4e- → S+4, S0 — 6e- → S+6).
6.
Рис.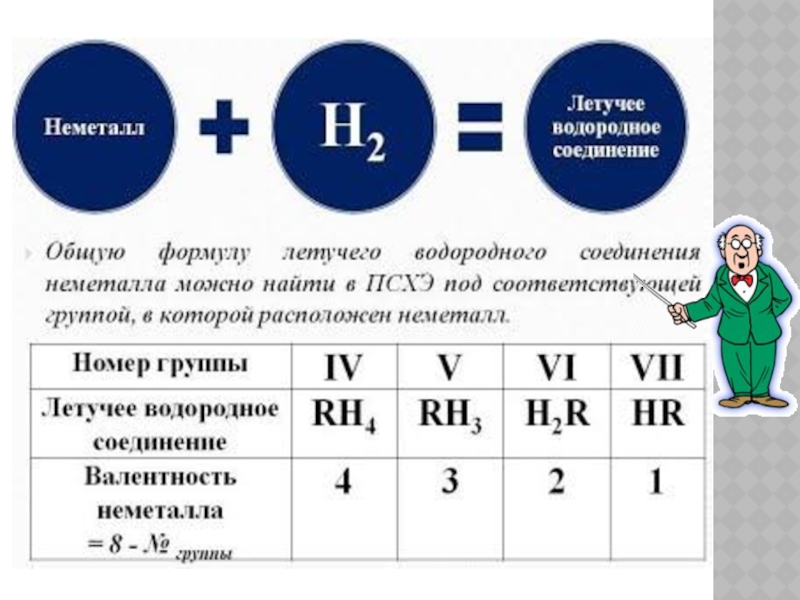 2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
Наиболее устойчивая модификация серы — ромбическая сера S8, это хрупкое вещество жёлтого цвета. Моноклинная сера, в которой атомы соединены в циклы в виде «короны», представляет собой твёрдое вещество, состоящее из тёмно-жёлтых игл, устойчивое при температуре более 96 °C, а при обычной температуре превращающееся в ромбическую серу. Пластическая сера — длинные полимерные цепи пластической коричневой массы, нерастворимой в воде.
7. Сравнение свойств элемента серы со свойствами её соседей по группе: неметаллические свойства серы выражены сильнее, чем у селена, но слабее, чем у кислорода, так как радиус у кислорода меньше, чем у серы. По сравнению с соседями по периоду свойства серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
8. Сера имеет высшую валентность 6 и низшую валентность 2 (определяется по формуле: 8-N, где N — номер группы). Высший оксид серы (VI) — SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
Высший оксид серы (VI) — SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
SO3 + BaO → BaSO4
SО3 + 2NaOH → Na2SO4 + h3O
SO3 + h3O → h3SO4
9. Высший гидроксид серы — это серная кислота h3SO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями. Это подтверждается уравнениями реакции:
h3SО4 + Mg → MgSO4 + h3
h3SO4 + Ca(OH)2 → CaSO4 + 2h3O
h3SO4 + CaO → CaSO4 + h3O
h3SO4 + Na2SiO3 → h3SiO3 + Na2SO4
10. Сера — неметалл, поэтому имеет летучее водородное соединение h3S — сероводород.
Пример 1
Охарактеризуем химический элемент кальций по следующим характеристикам:
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кальций | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | II, главная | |
Металл, неметалл, амфотерный элемент | металл | |
Номер периода (большой, малый) | 4 большой | |
Относительная атомная масса (Аr) | Аr = 40 | |
Формула высшего оксида | ||
Формула высшего гидроксида | ||
Формула летучего водородного соединения | ||
Строение атома: | ||
а) заряд ядра | ||
б) количество электронов и протонов | ||
в) количество нейтронов (n = Ar — Z) | n=40-20=20 | |
г) количество энергетических уровней | ||
д) количество электронов на последнем уровне | ||
е) распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p64s2 | |
ж) s-, p-, d-, f-элемент | s-элемент | |
Упражнение
Охарактеризуйте химический элемент кремний по тем же характеристикам, что и в примере.
Контрольные вопросы
- Перечислите пункты плана характеристики химического элемента.
- Каким элементам характерно наличие летучих водородных соединений?
Ответы
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кремний | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | IV, главная | |
Металл, неметалл, амфотерный элемент | неметалл | |
Номер периода (большой, малый) | 3 малый | |
Относительная атомная масса (Аr) | Аr = 28 | |
Формула высшего оксида | ||
Формула высшего гидроксида | h3SiO3 | |
Формула летучего водородного соединения | ||
Строение атома: | ||
а) заряд ядра | ||
б) количество электронов и протонов | ||
в) количество нейтронов (n = Ar — Z) | n=28-14=14 | |
г) количество энергетических уровней | ||
д) количество электронов на последнем уровне | ||
е) распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p2 | |
ж) s-, p-, d-, f-элемент | p-элемент | |
Селен | химический элемент | Британика
селен
Посмотреть все СМИ
- Ключевые люди:
- Йонс Якоб Берцелиус
- Похожие темы:
- химический элемент элемент кислородной группы соединение селена
См. все связанные материалы →
все связанные материалы →
селен (Se) , химический элемент кислородной группы (группа 16 [VIa] периодической таблицы), близкий по химическим и физическим свойствам элементам серы и теллуру. Селен встречается редко, в его составе примерно 90 частей на миллиард земной коры. Иногда он встречается в несвязанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (медью, ртутью, свинцом или серебром) в некоторых минералах. Основным коммерческим источником селена является побочный продукт рафинирования меди; его основные области применения — производство электронного оборудования, пигментов и стекла. Селен – это металлоид (элемент, промежуточный по свойствам между металлами и неметаллами). Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительно увеличивать электропроводность при воздействии света. Соединения селена токсичны для животных; растения, выращенные на селенсодержащих почвах, могут концентрировать элемент и стать ядовитыми.
| атомный номер | 34 |
|---|---|
| атомный вес | 78,96 | 900 34
| массы стабильных изотопов | 74, 76, 77, 78, 80, 82 |
| плавление точечный | |
| аморфный | 50 °C (122 °F) |
| серый | 217 °C (423 °F) | температура кипения | 685 °C (1265 °F) |
| плотность | |
| аморфный | 4,28 г/см 3 |
| серый | 4,79 г/см 3 |
| степени окисления | −2, +4, +6 |
| электронная конфигурация | 1 s 2 2 s 2 2 p 6 3 с 2 3 р 6 3 д 10 4 s 2 4 p 4 |
История
В 1817 году шведский химик Йонс Якоб Берцелиус обнаружил красное вещество, полученное из сульфидных руд из шахт Фалун, Швеция.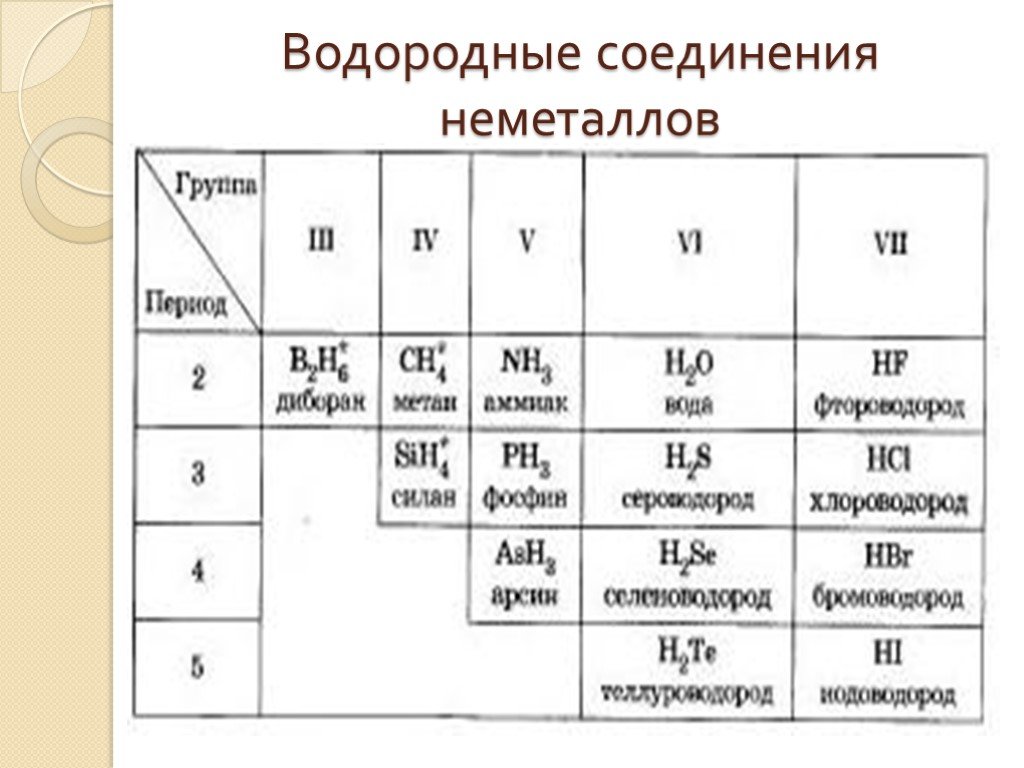 Когда в следующем году этот красный материал был исследован, он оказался элементом и был назван в честь Луны или богини Луны Селены. Руда с необычно высоким содержанием селена была обнаружена Берцелиусом всего за несколько дней до того, как он сделал свой доклад о селене перед научными обществами мира. Его чувство юмора видно из имени, которое он дал руде, eucairite , что означает «как раз вовремя».
Когда в следующем году этот красный материал был исследован, он оказался элементом и был назван в честь Луны или богини Луны Селены. Руда с необычно высоким содержанием селена была обнаружена Берцелиусом всего за несколько дней до того, как он сделал свой доклад о селене перед научными обществами мира. Его чувство юмора видно из имени, которое он дал руде, eucairite , что означает «как раз вовремя».
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Возникновение и использование
Доля селена в земной коре составляет примерно от 10 −5 до 10 −6 процентов. Он был получен в основном из анодных шламов (отложений и остаточных материалов с анода) при электролитическом рафинировании меди и никеля. Другими источниками являются колошниковая пыль при производстве меди и свинца и газы, образующиеся при обжиге пирита. Селен сопровождает медь при рафинировании этого металла: около 40 процентов селена, присутствующего в исходной руде, может концентрироваться в меди, осажденной в электролитических процессах. Из тонны выплавленной меди можно получить около 1,5 килограмма селена.
Из тонны выплавленной меди можно получить около 1,5 килограмма селена.
Селен, введенный в небольших количествах в стекло, служит обесцвечивателем; в больших количествах он придает стеклу ярко-красный цвет, полезный в сигнальных огнях. Этот элемент также используется в производстве красных эмалей для керамики и стальных изделий, а также для вулканизации резины для повышения устойчивости к истиранию.
Наибольшие усилия по усовершенствованию селенапредпринимаются в Германии, Японии, Бельгии и России.
Аллотропия селена не так обширна, как аллотропия серы, и аллотропы изучены не так тщательно. Только две кристаллические разновидности селена состоят из циклического Se 8 молекулы: обозначены α и β, обе существуют в виде красных моноклинных кристаллов. Серый аллотроп, обладающий металлическими свойствами, образуется при хранении любой из других форм при температуре 200–220 °C и является наиболее стабильным в обычных условиях.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Аморфная (некристаллическая) красная порошкообразная форма селена образуется при обработке раствора селенистой кислоты или одной из ее солей диоксидом серы. Если растворы очень разбавлены, очень мелкие частицы этого сорта дают прозрачную красную коллоидную суспензию. Прозрачное красное стекло получается в результате аналогичного процесса, происходящего при обработке расплавленного стекла, содержащего селениты, углеродом. Стекловидная, почти черная разновидность селена образуется при быстром охлаждении других модификаций от температуры выше 200 °С. Превращение этой стекловидной формы в красные кристаллические аллотропы происходит при нагревании выше 90 °C или при контакте с органическими растворителями, такими как хлороформ, этанол или бензол.
Подготовка
Чистый селен получают из шламов и шламов, образующихся при производстве серной кислоты. Неочищенный красный селен растворяют в серной кислоте в присутствии окислителя, такого как нитрат калия или некоторые соединения марганца.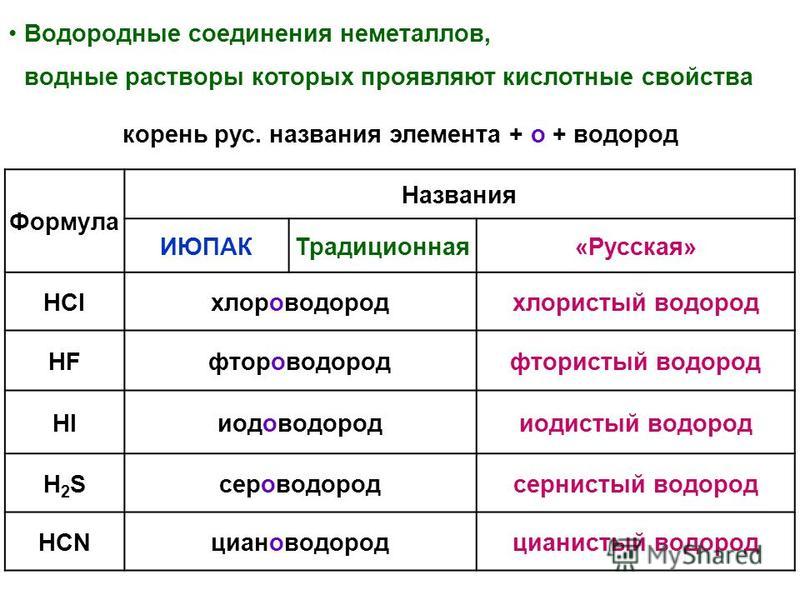 И селенистая кислота, H 2 SeO 3 , и селеновая кислота, H 2 SeO 4 , образуются и могут быть выщелочены из остаточного нерастворимого материала. В других методах используется окисление воздухом (обжиг) и нагревание с карбонатом натрия с получением растворимого селенита натрия Na 9.0161 2 SeO 3 ·5H 2 O и селенат натрия, Na 2 SeO 4 . Можно также использовать хлор: его действие на селениды металлов приводит к образованию летучих соединений, включая дихлорид селена, SeCl 2 ; тетрахлорид селена, SeCl 4 ; диселен дихлорид, Se 2 Cl 2 ; и оксихлорид селена, SeOCl 2 . В одном процессе эти соединения селена превращаются водой в селенистую кислоту. Наконец, селен извлекают путем обработки селенистой кислоты диоксидом серы.
И селенистая кислота, H 2 SeO 3 , и селеновая кислота, H 2 SeO 4 , образуются и могут быть выщелочены из остаточного нерастворимого материала. В других методах используется окисление воздухом (обжиг) и нагревание с карбонатом натрия с получением растворимого селенита натрия Na 9.0161 2 SeO 3 ·5H 2 O и селенат натрия, Na 2 SeO 4 . Можно также использовать хлор: его действие на селениды металлов приводит к образованию летучих соединений, включая дихлорид селена, SeCl 2 ; тетрахлорид селена, SeCl 4 ; диселен дихлорид, Se 2 Cl 2 ; и оксихлорид селена, SeOCl 2 . В одном процессе эти соединения селена превращаются водой в селенистую кислоту. Наконец, селен извлекают путем обработки селенистой кислоты диоксидом серы.
Селен является обычным компонентом руд, ценимых за содержание в них серебра или меди; он концентрируется в шламах, образующихся при электролитической очистке металлов. Были разработаны методы выделения селена из этих шламов, которые также содержат некоторое количество серебра и меди. При плавлении шлама образуется селенид серебра Ag 2 Se и селенид меди(I) Cu 2 Se. Обработка этих селенидов хлорноватистой кислотой HOCl дает растворимые селениты и селенаты, которые можно восстановить диоксидом серы. Окончательную очистку селена осуществляют повторной перегонкой.
Были разработаны методы выделения селена из этих шламов, которые также содержат некоторое количество серебра и меди. При плавлении шлама образуется селенид серебра Ag 2 Se и селенид меди(I) Cu 2 Se. Обработка этих селенидов хлорноватистой кислотой HOCl дает растворимые селениты и селенаты, которые можно восстановить диоксидом серы. Окончательную очистку селена осуществляют повторной перегонкой.
Физико-электрические свойства
Наиболее выдающимся физическим свойством кристаллического селена является его фотопроводимость: при освещении электропроводность увеличивается более чем в 1000 раз. Это явление возникает в результате продвижения или возбуждения относительно свободно удерживаемых светом электронов в более высокие энергетические состояния (называемые уровнями проводимости), что обеспечивает миграцию электронов и, таким образом, электрическую проводимость. Напротив, электроны типичных металлов уже находятся на уровнях или зонах проводимости, способных течь под действием электродвижущей силы.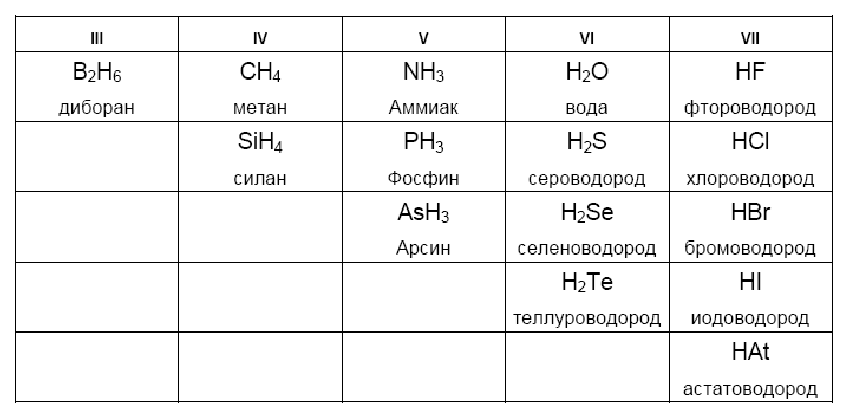
Удельное электрическое сопротивление селена изменяется в огромных пределах в зависимости от таких переменных, как природа аллотропа, примеси, метод очистки, температура и давление. Большинство металлов нерастворимы в селене, а неметаллические примеси увеличивают удельное сопротивление.
Освещение кристаллического селена в течение 0,001 секунды увеличивает его проводимость в 10-15 раз. Красный свет более эффективен, чем свет с более короткой длиной волны.
Преимущество этих фотоэлектрических и фоточувствительных свойств селена используется при создании различных устройств, которые могут преобразовывать изменения интенсивности света в электрический ток и, следовательно, в визуальные, магнитные или механические эффекты. Сигнальные устройства, механические открывающие и закрывающие устройства, системы безопасности, телевидение, звуковые фильмы и ксерография зависят от полупроводниковых свойств и светочувствительности селена. Выпрямление переменного электрического тока (преобразование в постоянный ток) в течение многих лет осуществлялось с помощью устройств, управляемых селеном.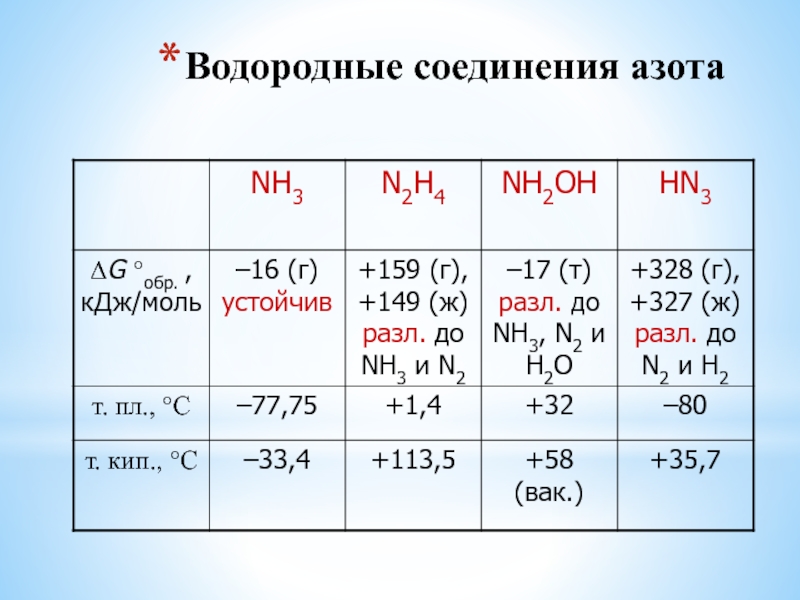 Многие приложения фотоэлементов, использующие селен, были заменены другими устройствами, использующими материалы, более чувствительные, более доступные и более простые в изготовлении, чем селен.
Многие приложения фотоэлементов, использующие селен, были заменены другими устройствами, использующими материалы, более чувствительные, более доступные и более простые в изготовлении, чем селен.
Соединения
В своих соединениях селен существует в степенях окисления -2, +4 и +6. Он проявляет отчетливую склонность к образованию кислот в высших степенях окисления. Хотя сам элемент не ядовит, многие его соединения чрезвычайно токсичны.
Селен соединяется непосредственно с водородом, в результате чего образуется селенид водорода, H 2 Se, бесцветный зловонный газ, который является кумулятивным ядом. Он также образует селениды с большинством металлов (например, селенид алюминия, селенид кадмия и селенид натрия).
В сочетании с кислородом встречается в виде диоксида селена, SeO 2 , белого твердого полимерного вещества в виде цепочек, которое является важным реагентом в органической химии. Реакция этого оксида с водой приводит к образованию селенистой кислоты H 2 SeO 3 .
Селен образует множество соединений, в которых атом селена связан как с атомом кислорода, так и с атомом галогена. Ярким примером является оксихлорид селена, SeO 2 Cl 2 (с селеном в степени окисления +6), чрезвычайно мощный растворитель. Наиболее важной кислотой селена является селеновая кислота, H 2 SeO 4 , такой же сильный, как серная кислота, и легче восстанавливается.
Robert C. BrastedРАДИОХИМИЯ СЕЛЕНА (Технический отчет)
РАДИОХИМИЯ СЕЛЕНА (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Представлены обзор ядерных и химических свойств селена, обсуждение проблем растворения проб и методов подсчета, а также сборник радиохимических методик для этого элемента, найденных в литературе. (94 ссылки) (M.C.G.)
(94 ссылки) (M.C.G.)
- Авторов:
- Леддикотт, GW
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Ок-Ридж. (ORNL), Ок-Ридж, Теннесси (США)
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 4025138
- Номер(а) отчета:
- NAS-NS-3030
- Номер АНБ:
- НСА-15-016965
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: «Серия ядерных исследований» Национального исследовательского совета.
 Комитет по ядерной науке. Ориг. Дата получения: 31-DEC-61
Комитет по ядерной науке. Ориг. Дата получения: 31-DEC-61
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- ХИМИЯ; РАДИОХИМИЯ; СЕЛЕН
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Леддикотт, Г. В. РАДИОХИМИЯ СЕЛЕНА . США: Н. П., 1961.
Веб. дои: 10.2172/4025138.
Копировать в буфер обмена
Леддикотт, Г. В. РАДИОХИМИЯ СЕЛЕНА . Соединенные Штаты. https://doi.org/10.2172/4025138
Копировать в буфер обмена
Леддикотт, Г. В. 1961.
"РАДИОХИМИЯ СЕЛЕНА". Соединенные Штаты. https://doi.org/10.2172/4025138. https://www.osti.gov/servlets/purl/4025138.
В. 1961.
"РАДИОХИМИЯ СЕЛЕНА". Соединенные Штаты. https://doi.org/10.2172/4025138. https://www.osti.gov/servlets/purl/4025138.
Копировать в буфер обмена
@статья{osti_4025138,
title = {РАДИОХИМИЯ СЕЛЕНА},
автор = {Leddicotte, GW},
abstractNote = {Представлены обзор ядерных и химических свойств селена, обсуждение проблем растворения образцов и методов подсчета, а также набор радиохимических процедур для элемента, найденных в литературе. (94 ссылки) (MCG)},
дои = {10,2172/4025138},
URL = {https://www.osti.gov/biblio/4025138},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1961},
месяц = {1}
}
Копировать в буфер обмена
Посмотреть технический отчет (2,03 МБ)
https://doi.



 Комитет по ядерной науке. Ориг. Дата получения: 31-DEC-61
Комитет по ядерной науке. Ориг. Дата получения: 31-DEC-61
Leave A Comment