Азотная кислота. Задача №33 ЕГЭ 2022 по Химии. Полный разбор с объяснениями. ✎ pangenes.ru
Задания по подготовке к ЕГЭ по химии 6 января 2022 г., 2:56
Задача №33 ЕГЭ по Химии 2022
Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 грамм. Из полученного раствора отобрали порцию массой 92,4 грамма. Вычислите массу 8%-ного раствора едкого натра, необходимого для полного осаждения меди из отобранной порции раствора и ее нейтрализации.
Решение:
Для начала, в задачах №33 всегда присутствуют химические реакции, которые мы обязаны расписать.
В условии сказано, что прошел электролиз водного раствора нитрата меди(II) Cu(NO3)2.
Причем, этот процесс остановили, когда общая масса раствора уменьшилась на 8 грамм. После этого взяли пробу массой 92,4 грамма(этот состав еще нужно найти) и в итоге необходимо вычислить массу 8%-ного раствора гидроксида натрия, который был использован в реакции.
Первая реакция – это электролиз водного раствора нитрата меди(II):
2Cu(NO3)2 + 2H2O → 2Cu↓ + O2↑ + 4HNO3.
В электролизе раствора данной соли будет выделяться чистая медь(на катоде), кислород(на аноде) и азотная кислота само собой.
Вспомним, что по условию задачи – электролиз прекратили после того, как масса раствора уменьшилась на 8 грамм. Так вот эти 8 грамм – это общая масса осажденной меди и выделившегося кислорода.
Вторая реакция представляется собой взаимодействие раствора едкого натра(который представляет собой гидроксид натрия) и отобранной порцией оставшегося раствора, которой является нитрат меди(II).
Cu(NO3)2 + 2NaOH → 2NaNO3 + Cu(OH)2↓
Есть еще третья реакция – она не так заметна в условии, но при электролизе у нас выделилась азотная кислота, а та порция массой 92,4 грамма представляет собой не только нитрат меди, но и HNO3. Поскольку азотная кислота вступает в реакцию нейтрализации с гидроксидом натрия, и это частая реакция в ЕГЭ, то нужно ее записать:
Поскольку азотная кислота вступает в реакцию нейтрализации с гидроксидом натрия, и это частая реакция в ЕГЭ, то нужно ее записать:
HNO3 + NaOH → NaNO3 +H2O.
Теперь, когда мы написали все возможные реакции, переходим к расчетам.
Во первых, смотрим, что у нас дано: есть 470 грамм 5%-ного раствора нитрата меди(II), через которые можем вычислить количество вещества(моль) этой соли и проводить через нее все вычисления, вплоть до ответа.
1) Для начала, нужно найти массу чистой соли:
m(Cu(NO3)2) = 470 x 0,05 = 23,5 грамм.
2) Находим количество вещества соли:
n(Cu(NO3)2) = 23,5 / 188 = 0,125 моль.
Я не стала расписывать молярную массу нитрата меди, так как это действие и так понятно.

Мы нашли моль нитрата меди. Далее у нас масса общего раствора уменьшилась на 8 грамм, и нужно найти количество вещества осажденной меди и выделившегося кислорода.
Смотрим на реакцию электролиза, и видим, что количество молекул нитрата меди и меди равно(2:2):
2Cu(NO3)2 + 2H2O → 2Cu↓ + O2↑ + 4HNO3.
3) Представим, что прореагировавшего нитрата меди х грамм, тогда
n(Cu) = n(Cu(NO3)2) = x моль.
Молярная масса меди = 64 г / моль, тогда m(Cu) = 64x грамм.
4) Смотрим на количество молекул кислорода – его в реакции в два раза меньше, чем нитрата меди, значит:
n(O2) = 0,5n(Cu(NO3)2) = 0,5x моль.
5) Далее идет расчет кислорода:
M(O2) = 32 г / моль; m(O2) = 0,5x * 32 = 16x грамм.
6) Составляем линейное уравнение:
64x + 16x = 8
Как расшифровать эту запись:
64х – это масса осажденной меди;
16х – это масса выделившегося кислорода;
8 – это и есть та масса уменьшенного на 8 грамм раствора после электролиза.
В результате несложного вычисления линейного уравнения, получаем:
х = 0,1.
7) Теперь можем рассчитать сколько нитрата меди(II) осталось:
n(Cu(NO3)2) = 0,125 – 0,1 = 0,025 моль.
8) Через моль нитрата меди можем найти азотную кислоту, которая так нужна нам в дальнейшем(ты видишь, что азотной кислоты в реакции электролиза 4 молекулы, а нитрата – 2, значит, и при вычислении молей азотной кислоты будет в два раза больше):
n(HNO3) = 2n(Cu(NO3)2) = 2 * 0,1 = 0,2 моль.
9) Идем дальше; нам необходимо узнать, какова масса раствора нитрата меди после электролиза с учетом выпавшей в осадок меди и выделившегося кислорода:
m(р-ра после электролиза) = 470 – 8 = 462 грамма.
Тогда как понять, сколько же там моль нитрата меди и азотной кислоты?
И, решение этого вопроса достаточно легкое: так как концентрация нитрата меди(II) в обоих растворах одинаковая, то и количество вещества соответственно, тоже.
10) А вычислить моль нитрата меди в таком случае возможно при помощи пропорции:
462 ———- 0,025 моль
92,4 ——— n(2Cu(NO3)2),
n(2Cu(NO3)2) = 0,005 моль.
11) Далее по списку нужно найти моль азотной кислоты через моль нитрата меди:
462 ——— 0,2 моль
92,4 ——- n(HNO3),
n(HNO3) = 0,04 моль.
12) Теперь производим расчеты по второй реакции, чтобы сопоставить моль нитрата меди(II) гидроксида натрия:
Cu(NO3)2 + 2NaOH → 2NaNO3 + Cu(OH)2↓
n(NaOH) = 2n(Cu(NO3)2) = 2 * 0,005 = 0,01 моль.
13) Находим моль NaOH из третьей реакции через известный моль азотной кислоты:
n(NaOH) = n(HNO3) = 0,04 моль.
14) Следующее действие – это нахождение общего количества вещества гидроксида натрия:
n(NaOH) = 0,01 + 0,04 = 0,05 моль
15) Ну, осталось найти массу NaOH:
M(NaOH) = 40 г / моль; m(NaOH) = 0,05 * 40 = 2 грамма.
16) И не забываем про условие задачи: найти массу 8%-ного раствора едкого натра, значит
m(раствора) = 2 / 0,08 = 25 грамм.
Почему мы совершили такое действие? Дело в том, что по задаче нужно вычислить массу раствора едкого натра(2 грамма), поэтому мы 2 разделили на 0,08 и получили общий раствор гидроксида натрия, равное 25 граммам.
Данное действие можно решить с помощью пропорции:
2 гр —— 8%
х гр —— 100%; х = 25 гр.
На этом задача решена!
Задачи на электролиз | CHEMEGE.RU
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т. к. протекающие на катоде и аноде процессы приводят к электролизу воды.
к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.), выделившегося на аноде и массовую долю йодида калия в растворе.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
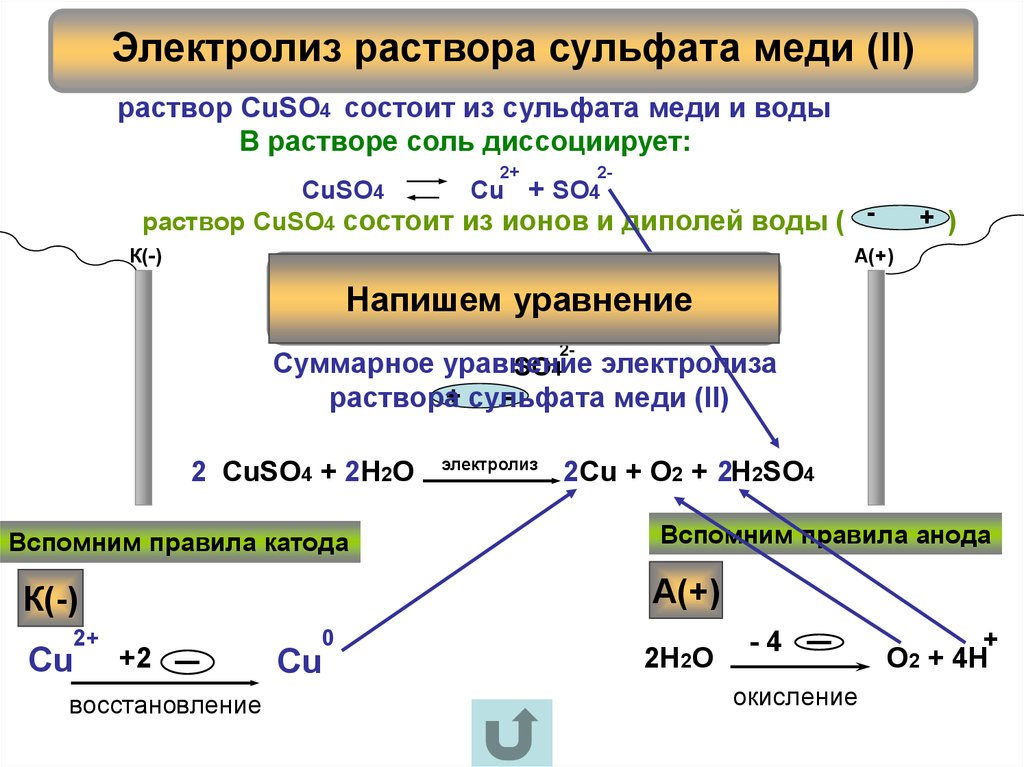
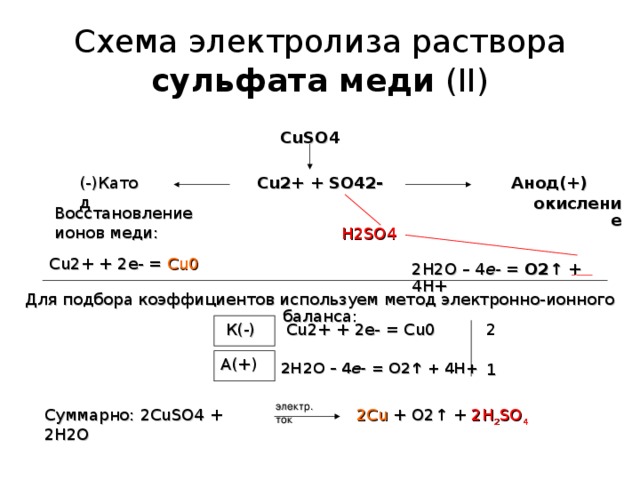
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2= 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия.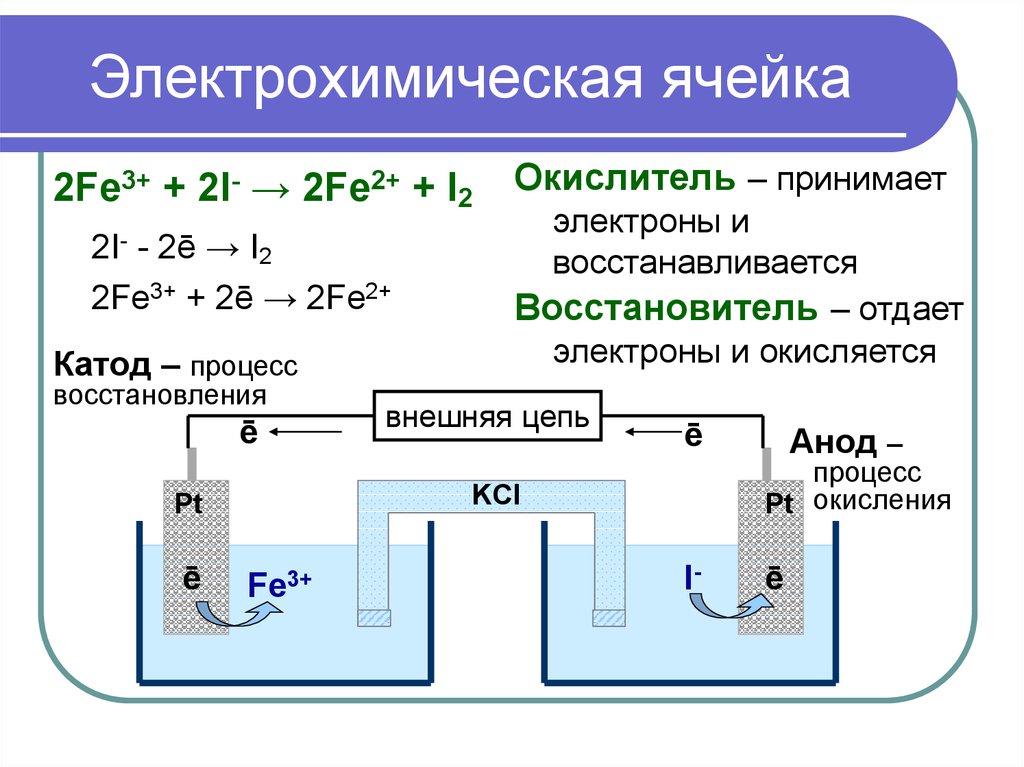 Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Решение и ответ
Свернуть
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг. ) = 2n(O2 [2]) = 0,4 моль
) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
Решение и ответ
Свернуть
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра.
Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н. у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
39. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
40. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
41. Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
42. Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
43. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
44. Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
45. Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
46. Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
47. Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
48. Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
49. Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
50. Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
51. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
52. Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
53. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
53. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
54. Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
55. Для проведения электролиза (на инертных электродах) взяли 170 г 15%-ного раствора хлорида лития. После того как на аноде выделилось 2,24 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 410 г 16%-ного раствора фосфата натрия. Определите массовую долю фосфата натрия в полученном растворе.
56. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
57. Для проведения электролиза (на инертных электродах) взяли 240 г 40%-ного раствора сульфата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
58. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 152 г 20%-ного раствора сульфата железа(II). Определите массовую долю хлорида калия в полученном растворе.
59. Для проведения электролиза (на инертных электродах) взяли 80 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 0,896 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 28 г порошка железа. Определите массовую долю сульфата железа(II) в полученном растворе.
60. Для проведения электролиза (на инертных электродах) взяли 340 г 40%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 46,4 г, процесс остановили. К образовавшемуся раствору добавили 207,5 г 40%-ного раствора иодида калия. Определите массовую долю иодида калия в полученном растворе.
61. Для проведения электролиза (на инертных электродах) взяли 180 г 37,5%-ного раствора хлорида меди(II). После того как на аноде выделилось 6,72 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 55,8 г. Вычислите массу 10%-ного раствора сульфида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.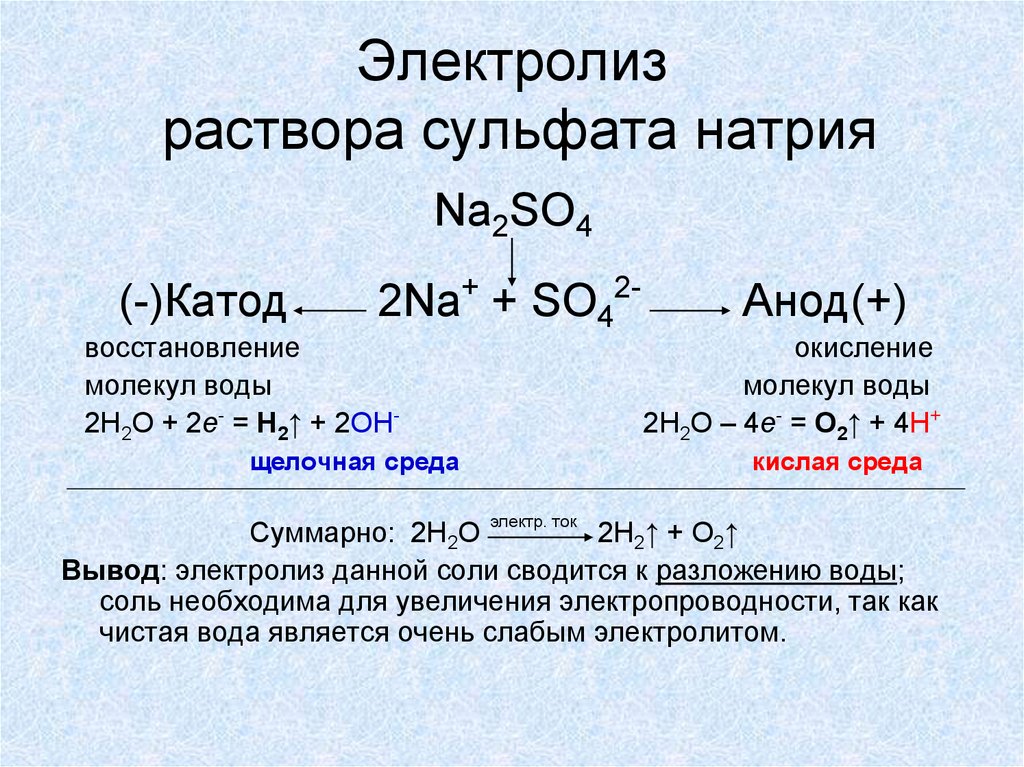
62. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 40,5 г, процесс остановили. К образовавшемуся раствору добавили 70 г 40%-ного раствора гидроксида калия. Определите массовую долю щёлочи в полученном растворе.
63. Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 5,6 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе.
Понравилось это:
Нравится Загрузка…
Идентификация продуктов электролиза | Эксперимент
Проведите этот классный эксперимент, чтобы провести электролиз различных растворов и исследовать образующиеся продукты
В этом практическом занятии учащиеся получают возможность попрактиковаться в проведении электролиза с рядом растворов, определяя продукты, образующиеся на электродах. Они должны быть в состоянии связать свой практический опыт с теорией и научиться составлять простые ионные уравнения.
Они должны быть в состоянии связать свой практический опыт с теорией и научиться составлять простые ионные уравнения.
Классный эксперимент лучше всего проводить учащимся, работающим в парах или втроем. Каждому члену команды предстоит выполнить множество заданий.
Это должно проводиться в хорошо вентилируемой лаборатории, так как в некоторых случаях могут образовываться значительные количества токсичного хлора, брома и йода, а также легковоспламеняющийся водород.
Оборудование
Аппарат
- Защита глаз
- Аппарат для электролиза (см. примечание 1 и схему ниже)
- Графитовые электроды диаметром около 5 мм, 2 шт. (см. примечание 2)
- Большая резиновая пробка для электролизера с отверстиями для графитовых электродов
- Маленькие пробирки для электродов, 2 шт.
- Маленькая лампочка в патроне, 6 В 5 Вт (опционально)
- Поводки и зажимы типа «крокодил»
- Деревянные шины
- Маленькие кусочки наждачной бумаги
- Полоски универсальной индикаторной бумаги
- Одноразовые пластиковые перчатки
- Зажим и подставка
Химические вещества
Доступ к следующим растворам, все с концентрацией примерно 0,5 М (см. примечание 3):
примечание 3):
- Бромид калия водный
- Водный йодид натрия
- Водный нитрат кальция
- Водный хлорид цинка (РАЗДРАЖАЕТ при такой концентрации)
- Водный нитрат меди
Примечания по оборудованию
- Представленный ниже электролизный аппарат можно приобрести в готовом виде. В качестве альтернативы его можно сделать из толстой стеклянной трубки диаметром 8–10 см, профессионально нарезанной на отрезки длиной около 12 см. Вместо нее можно использовать подходящую стеклянную бутылку с широким горлышком и отрезанным дном (как показано на схеме). Графитовые стержни должны быть хорошо заделаны в отверстия резиновой пробки на расстоянии 2–3 см друг от друга, иначе электролит может вытечь на внешнюю проводку, что приведет к ее коррозии. После изготовления этого устройства должно хватить на несколько сеансов, но графитовые стержни имеют тенденцию довольно быстро разрушаться, особенно если учащиеся используют напряжение, превышающее рекомендованное.
 Стержни со временем становятся тонкими и довольно легко ломаются, но их достаточно дешево заменить.
Стержни со временем становятся тонкими и довольно легко ломаются, но их достаточно дешево заменить.
Источник: Королевское химическое общество
Оборудование, необходимое для электролизера
- После электролиза нитрата меди(II) (желательно в последнюю очередь) на катоде образуется осадок меди. Это должно быть удалено, прежде чем клетки можно будет использовать снова. Для этого можно погрузить гальванизированную часть электрода в небольшое количество 50% концентрированной азотной кислоты (КОРРОЗИОННОЕ ВЕЩЕСТВО) в небольшом стакане. Необходимо надевать перчатки и защитные очки, а очистку в вытяжном шкафу должен выполнять квалифицированный специалист.
- В зависимости от объема аппарата для электролиза каждой группе студентов требуется достаточное количество раствора, чтобы покрыть электроды плюс около 2 см, чтобы можно было перевернуть полные пробирки с жидкостью над электродами.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда используйте защитные очки.
- Эксперимент должен проводиться в хорошо проветриваемой лаборатории, так как при этом могут выделяться значительные количества токсичного хлора, брома и йода, а также легковоспламеняющийся водород.
- Водный бромид калия, KBr(aq) – см. карточку опасности CLEAPSS HC047b.
- Водный йодид натрия, NaI(aq) – см. карточку опасности CLEAPSS HC047b.
- Нитрат кальция водный, Ca(NO 3 ) 2 (водн.) – см. карточку опасности CLEAPSS HC019B.
- Водный хлорид цинка, ZnCl 2 (водн.), (РАЗДРАЖАЮЩЕЕ средство в используемой концентрации) – см. карту опасности CLEAPSS HC108a.
- Водный нитрат меди, Cu(NO 3 ) 2 (водн.) – см. карточку опасности CLEAPSS HC027B.
- 50 % концентрированная азотная кислота, HNO 3 (водн.), (КОРРОЗИОННОЕ) – см. карту опасности CLEAPSS HC067 и книгу рецептов CLEAPSS RB061. Это используется для очистки электродов от меди и производится путем медленного добавления концентрированной азотной кислоты к равному объему воды.

- Хлор, Cl 2 (г), (ТОКСИЧНЫЙ) – см. карту опасности CLEAPSS HC022a.
- Бром, Br 2 (l), (ТОКСИЧНЫЙ) – см. карту опасности CLEAPSS HC015a.
- Йод, I 2 (s), (ТОКСИЧНЫЙ) – см. карту опасности CLEAPSS HC054.
Процедура
- Настройте таблицу для результатов следующим образом:
| Potassium bromide | Sodium iodide | Calcium nitrate | Zinc chloride | Copper nitrate | ||
|---|---|---|---|---|---|---|
| Lamp lights? | ||||||
| Наблюдения | Катод (–) | |||||
| Анод (+) | ||||||
| Тест, использованный для продукта | Катод (–) | |||||
| Анод (+) | ||||||
| Идентичность формируемых продуктов | Катод (–) | |||||
| Анод (+) | ||||||
- Зажмите электролизную ячейку и залейте достаточное количество первого электролита, чтобы вершины электродов были покрыты жидкостью примерно на 1–2 см.
 Наполните две пробирки одним и тем же электролитом. Надев перчатки, закройте по очереди пальцем конец каждой пробирки и переверните ее над электродом так, чтобы не попал воздух (см. схему). Во время электролиза может потребоваться слегка приподнять пробирки, чтобы убедиться, что электроды не полностью закрыты, препятствуя прохождению тока.
Наполните две пробирки одним и тем же электролитом. Надев перчатки, закройте по очереди пальцем конец каждой пробирки и переверните ее над электродом так, чтобы не попал воздух (см. схему). Во время электролиза может потребоваться слегка приподнять пробирки, чтобы убедиться, что электроды не полностью закрыты, препятствуя прохождению тока. - Подсоедините цепь и отметьте полярность каждого электрода на пробке. Цепь должна быть проверена перед включением.
- Включите цепь, затем:
- Проверьте, горит ли лампа.
- Ищите вещества, образующиеся на каждом электроде, т. е. газообразные, твердые или растворенные.
- Записывайте результаты после каждого наблюдения, а не после завершения всех экспериментов.
- Проводите электролиз только в течение времени, достаточного для проведения необходимых наблюдений. Продление электролиза без необходимости приводит к образованию токсичных газов, таких как хлор и бром, в неприемлемо опасных количествах.
 Немедленно отключите ток, если это станет очевидным.
Немедленно отключите ток, если это станет очевидным. - После каждого электролиза выключайте ток и вынимайте пробирки из ячейки, чтобы проверить наличие газов, медленно поднимая их по очереди, чтобы дать стечь оставшемуся раствору, прежде чем закрыть конец пальцем. Проведите испытания газов в соответствии с инструкциями.
- (дополнительно) После извлечения пробирок из ячейки быстро слейте жидкость в раковину с большим количеством воды. Протрите каждый электрод кусочком универсальной индикаторной бумаги и отметьте любые изменения цвета.
- Промойте ячейку большим количеством воды и высушите снаружи бумажным полотенцем перед тем, как установить ее на место и снова подключить к источнику питания. Важно подключить провода в соответствии с полярностью, отмеченной на пробке.
- Повторите эксперимент с каждым из остальных четырех растворов, стараясь соблюдать порядок, указанный в таблице. Хлорид цинка и нитрат меди следует проверять последними электролитами.
 Это связано с тем, что они осаждают твердые частицы на катоде. Если сначала подвергается электролизу хлорид цинка, твердый осадок на катоде можно легко удалить кусочком наждачной бумаги или погрузив конец электрода в стакан с разбавленной соляной кислотой.
Это связано с тем, что они осаждают твердые частицы на катоде. Если сначала подвергается электролизу хлорид цинка, твердый осадок на катоде можно легко удалить кусочком наждачной бумаги или погрузив конец электрода в стакан с разбавленной соляной кислотой.
Учебные заметки
Электролиз водных растворов, а не расплавленных солей, легче и безопаснее для самостоятельного выполнения учащимися. электроды.
Дополнительная поддержка
Используйте анимации, включенные в наше практическое видео Электролиз водных растворов, чтобы помочь учащимся понять, какие ионы присутствуют в водном растворе и что происходит на каждом электроде.
Убедитесь, что учащиеся не пытаются непосредственно почувствовать запах паров галогенов. Важно, чтобы вы знали о студентах, страдающих астмой или у которых может быть аллергическая реакция на эти токсичные газы. В связи с этим не позволяйте электролизу растворов галогенидов продолжаться дольше, чем это абсолютно необходимо.
При тестировании на водород или кислород горловину пробирки можно закрыть пальцем в перчатке, а пробирку перенести в центральную зону, где установлено единственное открытое пламя, вдали от экспериментов. Запас разливов также может храниться в этой зоне для испытаний.
При испытании водородом учащиеся могут спросить, почему хлопки или скрипы практически отсутствуют. Объясните, что тестируется чистый водород, а не смесь водорода и воздуха, если пробирка была заполнена газом до того, как ее вынули.
При кислородном испытании следует соблюдать осторожность, чтобы влага на горлышке пробирки не погасила «свечение», что может привести к провалу испытания.
После проведения электролиза хлорида цинка или нитрата меди на катоде образуется осадок металла. Это должно быть очищено, прежде чем ячейку можно будет использовать снова. Эти металлические отложения можно удалить с помощью наждачной бумаги. В качестве альтернативы для удаления меди можно использовать небольшое количество 50% концентрированной азотной кислоты (КОРРОЗИОННОЕ ВЕЩЕСТВО) в небольшом стакане, при условии, что надеты перчатки и операция выполняется в вытяжном шкафу квалифицированным специалистом. Точно так же разбавленная соляная кислота удалит цинк.
Точно так же разбавленная соляная кислота удалит цинк.
| Potassium bromide | Sodium iodide | Calcium nitrate | Zinc chloride | Copper nitrate | ||
|---|---|---|---|---|---|---|
| Lamp lights? | Да | Да | Да | Да | Да | |
| Наблюдения | Катод (–) | Бесцветный газ | Бесцветный газ | Бесцветный газ | Беловато-серый твердый осадок | Красновато-коричневый твердый осадок |
| Анод (+) | Оранжево-коричневый раствор; может немного оранжевого газа | Темно-коричневый раствор | Бесцветный газ | Крошечные пузырьки, образующиеся на электроде: очень бледно-зеленый газ, но большая часть растворяется | Бесцветный газ | |
| Тест, используемый для продукта | Катод (–) | Газ воспламеняется от горящей лучины; может быть «скрип» | Газ воспламеняется от горящей лучины; может быть «скрип» | Газ воспламеняется от горящей лучины; может писк | Внешний вид порошка | Внешний вид порошка |
| Анод (+) | Универсальная индикаторная бумага краснеет и обесцвечивается | Превращает раствор крахмала в синий/черный | Зажигает светящуюся шину | Универсальная индикаторная бумага краснеет и обесцвечивается | Зажигает светящуюся шину | |
| Идентичность формируемых продуктов | Катод (–) | Водород | Водород | Водород | Цинк | Медь |
| Анод (+) | Бром | Йод | Кислород | Хлор | Кислород | |
Cathode reactions:
KBr NaI Ca(NO 3 ) 2 : 2H 2 O(l) + 2e – → H 2 (g ) + 2OH — (AQ)
ZnCl 2 CU (№ 3 ) 2 : M 2+ (AQ) + 2E — → M (S)
ANDOD
KBr NaI ZnCl 2 : 2X – (aq) → X 2 (g/aq) + 2e –
Ca(NO 3 ) 2 Cu(NO 3 ) 2 : 2H 2 O(l) → O 2 (g) + 4H + (водн. ) + 4e –
) + 4e –
спросит, почему водород является выделяющимся газом, а не металлом. Затем студентов можно попросить представить, что произойдет, если один из этих металлов образуется, учитывая, что это происходит в присутствии воды. В результате реакции образуется водород в качестве одного из продуктов и гидроксид металла в качестве другого. Учащихся с более высокими способностями можно было бы познакомить с концепцией электродных потенциалов и подробно рассказать о вероятной реакции, протекающей на катоде, показанном ранее.
В частности, при работе с хлором и бромом учащиеся обнаружат, что индикаторная бумага обесцвечивается, а также проявляет признаки кислотности. Йод обычно окрашивает бумагу в коричневый цвет.
Некоторые учащиеся могут спросить об относительных объемах газов, образующихся на электродах. Хотя это практическое задание не предназначено для исследования этого, им можно сказать следующее. Объемное соотношение газообразных водорода и хлора, образующихся при электролизе NaCl, фактически составляет 1:1. На практике ничего подобного не наблюдается, так как хлор мало растворим в водных растворах и газ не начинает собираться до тех пор, пока раствор электролита не станет им насыщенным.
На практике ничего подобного не наблюдается, так как хлор мало растворим в водных растворах и газ не начинает собираться до тех пор, пока раствор электролита не станет им насыщенным.
Менее продвинутых учащихся можно попросить сосредоточиться на простых наблюдениях, например, образуется ли газ? Какие изменения рН происходят на электродах? Основной принцип, который следует подчеркнуть, заключается в том, что проводимость электричества водными растворами обусловлена движением ионов (а не электронов) и что они движутся к электродам с противоположным зарядом.
Менее продвинутые учащиеся должны просто отметить, что:
- Раствор вокруг катода имеет тенденцию становиться щелочным.
- Раствор вокруг анода становится кислым.
- Металлы с низкой реакционной способностью осаждаются на отрицательном электроде.
- На отрицательном электроде выделяется газ, если металл занимает высокое место в ряду реактивности. Если уместно, им можно сказать, что этот газ — водород.

- Неметаллы образуются на положительном электроде: ионы хлорида образуют газообразный бромид хлора, а ионы йодида образуют соответственно бром и йод, которые растворяются с образованием окрашенных растворов.
- При электролизе нитрата меди на положительном электроде образуется бесцветный газ. При необходимости студентам можно сказать, что это кислород.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016 г.
Chemguide: Core Chemistry 14–16 Электролиз водных растворов ионных соединений с использованием неинертных электродов На этой странице подробно рассматривается электролиз раствора сульфата меди (II) с использованием медных электродов и раствора нитрата серебра с использованием серебряного анода. Если вы еще не сделали этого недавно, вам следует сначала прочитать страницу об электролизе растворов с использованием инертных электродов, в частности, об электролизе растворов сульфата меди (II) и нитрата серебра. Электролиз раствора сульфата меди(II) с использованием медных электродов. Начните с просмотра этого фрагмента видео, демонстрирующего быструю лабораторную демонстрацию. На катоде Прибываютионов меди(II) и ионов водорода. Медь стоит ниже водорода в ряду реакционной способности и поэтому выбрасывается, а не водороду. На катоде образуется слой коричневой меди.
На аноде Сульфат-ионы и гидроксид-ионы (из воды) поступают, но ни не выводятся. Вместо этого атомы меди в электроде высвобождают электроны и переходят в раствор в виде ионов Cu 2+ (водн.).
Чистый эффект Раствор сульфата меди(II) не изменился. На каждый ион меди(II), разряженный на катоде, в раствор выделяется новый ион на аноде. Все, что происходит, это перенос меди с анода на катод. Фрагмент видео, который вы только что посмотрели, показывает, как это происходит. | |
Примечание: Чтобы показать это убедительно, требуется гораздо больше внимания, чем в этом коротком видео. Ток должен быть достаточно низким, чтобы медные пластины плотно прилегали к катоду. Это требует, чтобы катод был очень чистым, а также имел низкий ток. Промывание, сушка и взвешивание катода также требует большой осторожности, чтобы ни одно покрытие не сместилось. Если вы сделаете все это, вы обнаружите, что вес, потерянный анодом, точно такой же, как вес, полученный катодом. | |
Использование для очистки меди Следующий фрагмент видео объясняет, как это делается. Единственное, что видео упускает, это объяснение того, что происходит с ионами металлов выше меди в ряду реактивности (например, цинка), когда они попадают в раствор. На самом деле с ними ничего особенного не происходит! Они будут притягиваться к катоду, но не разряжаются, когда добираются до него. Вместо этого разряжаются ионы меди (II), поскольку они находятся ниже в ряду реактивности. Однако, если концентрация ионов цинка становится слишком высокой, возможно, что некоторые из них также могут разряжаться, делая катод из чистой меди снова нечистым. Вот почему раствор время от времени меняется. Использование аналогичной реакции при серебрении При серебрении вы используете анод из чистого серебра и любой металлический предмет, который вы пытаетесь покрыть, в качестве катода. Неважно, что вы используете медный катод, а не серебряный. Все, что происходит на катоде, это то, что он покрывается серебром. Электролит – раствор азотнокислого серебра. На катоде Прибывают ионы серебра и ионы водорода. Серебро находится ниже водорода в ряду реакционной способности и поэтому выбрасывается, а не водороду.
На аноде Нитрат-ионы и гидроксид-ионы (из воды) поступают, но ни не выделяются. Вместо этого атомы серебра в электроде высвобождают электроны и переходят в раствор в виде ионов Ag + (водн.).
Чистый эффект Раствор нитрата серебра не изменился. На каждый ион серебра, разряжающийся на катоде, в раствор на аноде выделяется новый. Все, что происходит, это перенос серебра с анода на катод. Следующий бит, если видео показывает, что это происходит. | |





 Стержни со временем становятся тонкими и довольно легко ломаются, но их достаточно дешево заменить.
Стержни со временем становятся тонкими и довольно легко ломаются, но их достаточно дешево заменить.

 Наполните две пробирки одним и тем же электролитом. Надев перчатки, закройте по очереди пальцем конец каждой пробирки и переверните ее над электродом так, чтобы не попал воздух (см. схему). Во время электролиза может потребоваться слегка приподнять пробирки, чтобы убедиться, что электроды не полностью закрыты, препятствуя прохождению тока.
Наполните две пробирки одним и тем же электролитом. Надев перчатки, закройте по очереди пальцем конец каждой пробирки и переверните ее над электродом так, чтобы не попал воздух (см. схему). Во время электролиза может потребоваться слегка приподнять пробирки, чтобы убедиться, что электроды не полностью закрыты, препятствуя прохождению тока. Немедленно отключите ток, если это станет очевидным.
Немедленно отключите ток, если это станет очевидным. Это связано с тем, что они осаждают твердые частицы на катоде. Если сначала подвергается электролизу хлорид цинка, твердый осадок на катоде можно легко удалить кусочком наждачной бумаги или погрузив конец электрода в стакан с разбавленной соляной кислотой.
Это связано с тем, что они осаждают твердые частицы на катоде. Если сначала подвергается электролизу хлорид цинка, твердый осадок на катоде можно легко удалить кусочком наждачной бумаги или погрузив конец электрода в стакан с разбавленной соляной кислотой.


 На катоде образуется слой серебра.
На катоде образуется слой серебра.
Leave A Comment