ОГЭ 2018. Химия. Вариант 13
основным оксидом, кислотным оксидом и солью
амфотерным оксидом, кислотным оксидом и основанием
основным оксидом, амфотерным оксидом и солью
амфотерным оксидом, основным оксидом и солью
Задание 1
Задание 1. 1
1
Определите, атомы каких из указанных в ряду элементов
1) Na; 2) K; 3) Si; 4) Mg; 5) C
в основном состоянии имеют на внешнем энергетическом уровне четыре электрона.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Na 1s22s22p63s1;
2) K 1s22s22p63s23p64s1;
3) Si 1s22s22p63s23p2;
4) Mg 1s22s22p63s2;
В соответствии с приведенными формулами определяем внешний энергетический уровень и количество электронов на нем для каждого элемента:
1) Na – третий уровень – 1 электрон;
2) K – четвертый уровень – 1 электрон;
3) Si – третий уровень – 4 электрона;
4) Mg – третий уровень – 2 электрона;
5) C – второй уровень – 4 электрона.
Таким образом, на внешнем энергетическом уровне 4 электрона имеют атомы кремния и углерода.
Ответ: 35
Задание 1.2
Определите, атомы каких из указанных в ряду элементов
1) Ca; 2) O; 3) Al; 4) Mg; 5) S
в основном состоянии имеют на внешнем энергетическом уровне два электрона.
Запишите в поле ответа номера выбранных элементов.
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Ca 1s22s22p63s23p64s2;
2) O 1s22s22p4;
3) Al 1s22s22p63s23p1;
4) Mg 1s
5) S 1s22s22p63s23p4.
В соответствии с приведенными формулами определяем внешний энергетический уровень и количество электронов на нем для каждого элемента:
1) Ca – четвертый уровень – 2 электрона;
2) O – второй уровень – 6 электронов;
3) Al – третий уровень – 3 электрона;
4) Mg – третий уровень – 2 электрона;
5) S – третий уровень – 6 электронов.
Таким образом, на внешнем энергетическом уровне 2 электрона имеют атомы кальция и магния.
Ответ: 14
Задание 1.3
Определите, атомы каких из указанных в ряду элементов
1) Li; 2) As; 3) B; 4) N; 5) Rb
в основном состоянии имеют на внешнем энергетическом уровне три неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Li 1s22s1;
2) As 1s22s22p63s23p64s23d104p3;
3) B 1s2
4) N 1s22s22p3;
5) Rb 1s22s22p63s23p64s23d104p65s1.

В соответствии с приведенными формулами определяем внешний энергетический уровень и количество неспаренных электронов на нем для каждого элемента:
1) Li – второй уровень – 1 электрон;
2) As – четвёртый уровень – 3 электрона;
3) B – второй уровень – 1 электрон;
4) N – второй уровень – 3 электрона;
Таким образом, на внешнем энергетическом уровне 3 неспаренных электрона имеют атомы мышьяка и азота.
Ответ: 24
Задание 1.4
Определите, атомы каких из указанных в ряду элементов
1) Cl; 2) F; 3) Se; 4) Ca; 5) Br
в основном состоянии имеют на внешнем энергетическом уровне два неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
2) F 1s22s22p5;
3) Se 1s22s22p63s23p64s23d104p4;
4) C 1s22s22p2;
5) Br 1s22s22p63s23p64s23d104p5.
В соответствии с приведенными формулами определяем внешний энергетический уровень и количество неспаренных электронов на нем для каждого элемента:
1) Cl – третий уровень – 1 электрон;
3) Se – четвёртый уровень – 2 электрона;
4) C – второй уровень – 2 электрона;
5) Br – четвёртый уровень – 1 электрон.
Таким образом, на внешнем энергетическом уровне 2 неспаренных электрона имеют атомы селена и углерода.
Ответ: 34
Задание 1.5
Определите, атомы каких из указанных в ряду элементов
1) Se; 2) O; 3) H; 4) S; 5) Al
в основном состоянии имеют на внешнем энергетическом уровне один неспаренный электрон.
Запишите в поле ответа номера выбранных элементов.
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
2) O 1s22s22p4;
3) H 1s1;
4) S 1s22s22p63s23p4;
5) Al 1s22s22p63s23p1.

В соответствии с приведенными формулами определяем внешний энергетический уровень и количество неспаренных электронов на нем для каждого элемента:
2) O – второй уровень – 2 электрона;
3) H – первый уровень – 1 электрон;
4) S – третий уровень – 2 электрона;
5) Al – третий уровень – 1 электрон.
Таким образом, на внешнем энергетическом уровне 1 неспаренный электрон имеют атомы водорода и алюминия.
Ответ: 35
Задание 1.6
Определите, атомы каких из указанных в ряду элементов
1) Cu; 2) Mg; 3) Cl; 4) Al; 5) Li
в основном состоянии имеют на внешнем энергетическом уровне один электрон.
Запишите в поле ответа номера выбранных элементов.
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Cu 1s22s22p63s23p64s13d10;
2) Mg 1s22s22p63s2;
3) Cl 1s22s22p63s23p5;
4) Al 1s22s22p63s23p1;
5) Li 1s22s1.
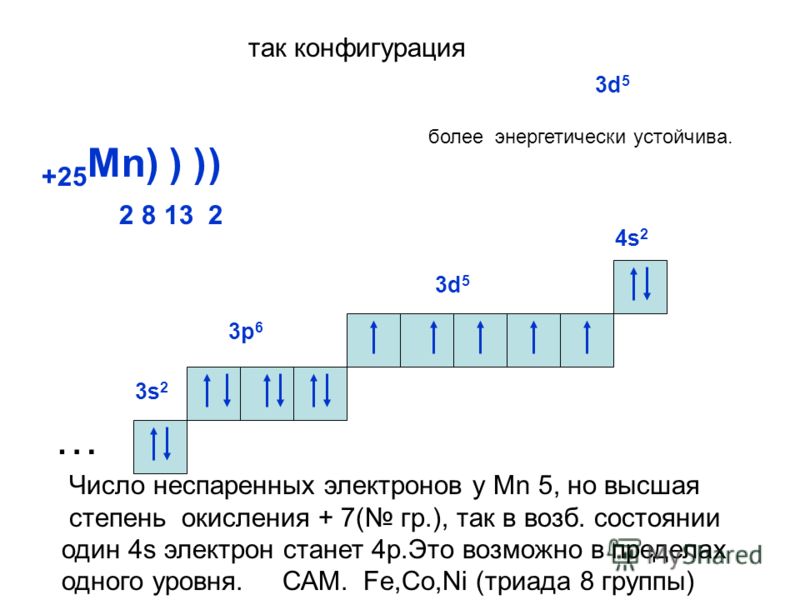
Напомним, что в атомах меди происходит «проскок» (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующейся при этом электронной конфигурации 3d10.
В соответствии с приведенными формулами определяем внешний энергетический уровень и количество электронов на нем для каждого элемента:
1) Cu – четвёртый уровень – 1 электрон;
2) Mg – третий уровень – 2 электрона;
3) Cl – третий уровень – 7 электронов;
4) Al – третий уровень – 3 электрона;
5) Li – второй уровень – 1 электрон.
Таким образом, на внешнем энергетическом уровне 1 электрон имеют атомы меди и лития.
Ответ: 15
Задание 1.7
Определите, атомы каких из указанных в ряду элементов
1) Na; 2) N; 3) F; 4) Cu; 5) Be
в основном состоянии содержат во внешнем слое одинаковое число электронов.
Запишите в поле ответа номера выбранных элементов.
Источник — Открытый банк заданий ЕГЭ
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Na 1s22s22p63s1;
2) N 1s22s22p3;
3) F 1s22s22p6;
4) Cu 1s22s22p63s23p64s13d10;
5) Be 1s22s2.
Напомним, что в атомах меди происходит «проскок» (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующейся при этом электронной конфигурации 3d10.
В соответствии с приведенными формулами определяем, что одинаковое число электронов на внешнем слое имеют атомы натрия и меди.
Ответ: 14
Задание 1. 8
8
Определите, атомы каких из указанных в ряду элементов
1) O; 2) Se; 3) Si; 4) C; 5) N
в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
Запишите в поле ответа номера выбранных элементов.
Источник — Открытый банк заданий ЕГЭ
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) O 1s22s22p4;
2) Se 1s22s22p63s23p64s23d104p4;
3) Si 1s22s22p63s23p2;
4) C 1s22s22p2;
5) N 1s22s22p3.
В соответствии с приведенными формулами определяем, что электронную конфигурацию внешнего энергетического уровня ns2np4
имеют атомы кислорода и селена.
Ответ: 12
Задание 1.9
Определите, атомы каких из указанных в ряду элементов
1) Al; 2) N; 3) P; 4) B; 5) S
в основном состоянии содержат три неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
Источник — Открытый банк заданий ЕГЭ
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
1) Al 1s22s22p63s23p1;
2) N 1s22s22p3;
3) P 1s22s22p63s23p3;
4) B 1s22s22p1;
5) S 1s22s22p63s23p4.
В соответствии с приведенными формулами определяем внешний энергетический уровень и количество неспаренных электронов на нем для каждого элемента:
1) Al – третий уровень – 1 электрон;
2) N – второй уровень – 3 электрона;
3) P – третий уровень – 3 электрона;
4) B – второй уровень – 1 электрон;
5) S – третий уровень – 2 электрона.
Таким образом, на внешнем энергетическом уровне 3 неспаренных электрона имеют атомы азота и фосфора.
Ответ: 23
Задание 1.10
Определите, атомы каких из указанных в ряду элементов
1) P; 2) Na; 3) Cl; 4) Mn; 5) S
имеют семь валентных электронов.
Запишите в поле ответа номера выбранных элементов.
Источник — Открытый банк заданий ЕГЭ
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов:
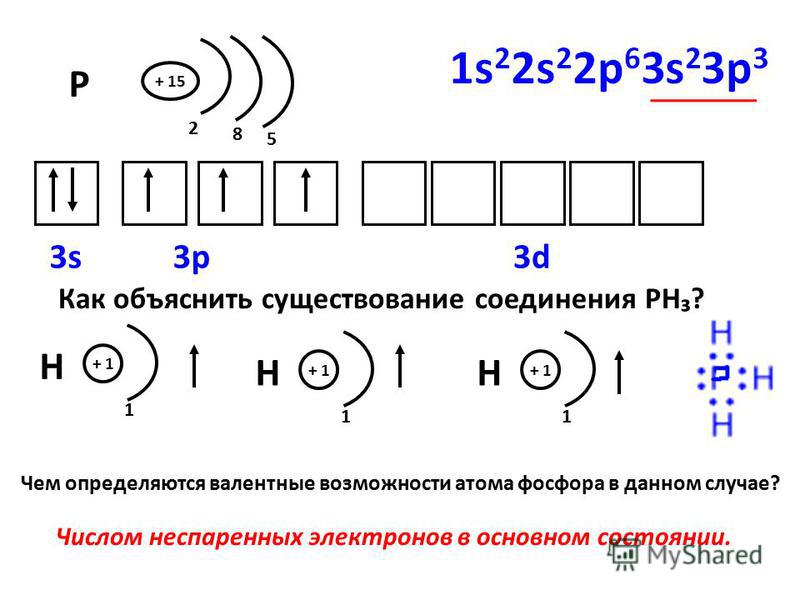
1) P 1s22s22p63s23p3;
2) Na 1s22s22p63s1;
3) Cl 1s22s22p63s23p5;
4) Mn 1s22s22p63s23p64s23d5;
5) S 1s22s22p63s23p4.
В соответствии с приведенными формулами определяем количество валентных электронов (электронов на внешней оболочке атома):
1) P – 5 электронов;
2) Na – 1 электрон;
3) Cl – 7 электронов;
4) Mn – 7 электронов;
5) S – 6 электронов.
Таким образом, семь валентных электронов имеют атомы хлора и марганца.
Ответ: 34
Задание 1.11
Определите, атомы каких из указанных в ряду элементов
1) O; 2) C; 3) Al; 4) Si; 5) P
в возбужденном состоянии содержат четыре неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
Источник — Открытый банк заданий ЕГЭ
Решение
На основе положения элементов в Периодической системе химических элементов Д.И. Менделеева приводим электронные формулы атомов представленных элементов в основном состоянии:
1) O 1s22s22p4;
2) C 1s22s22p2;
3) Al 1s22s22p63s23p1;
4) Si 1s22s22p63s23p2;
5) P 1s22s22p63s23p3.
Далее представим электронные формулы атомов рассматриваемых элементов в возбужденном состоянии:
1) O — атом кислорода не имеет возбужденного состояния, так как в данном случае отсутствует свободная орбиталь с более высокой энергией для «перескока»
электрона;
2) C 1s22s12p3;
3) Al 1s22s22p63s13p2;
4) Si 1s22s22p63s13p3;
5) P 1s22s22p63s13p33d1.
В соответствии с приведенными формулами определяем количество неспаренных электронов в возбужденном состоянии атома:
1) O — атом не может переходить в возбужденное состояние;
2) C — 4 электрона;
3) Al — 3 электрона;
4) Si — 4 электрона;
5) P — 5 электронов.
Таким образом, четыре неспаренных электрона в возбужденном состоянии имеют атомы углерода и кремния.
Ответ: 24
Электронная конфигурация атома. Часть 1
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Дан ряд элементов: 1) Na; 2) K; 3) Si; 4) Mg; 5) C. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) C; 2) H; 3) O; 4) Mg; 5) N. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Sn; 2) Fe; 3) C; 4) Pb; 5) Cr. Определите, у атомов каких из указанных в ряду элементов в основном состоянии валентные электроны находятся как на s-, так и на d-подуровнях. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) O; 2) H; 3) Be; 4) Cu; 5) N. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) H; 2) S; 3) F; 4) Na; 5) Mg. Определите, атомам каких из указанных в ряду элементов в основном состоянии до завершения внешнего электронного слоя недостаёт одного электрона. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Mg; 2) Al; 3) Na; 4) S; 5) Si.
 Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) B; 2) Al; 3) F; 4) Fe; 5) N. Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня n
s1 np2. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) H; 2) He; 3) Al; 4) Si; 5) P. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов на внешнем энергетическом уровне. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Li; 2) Be; 3) C; 4) Si; 5) P. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.

Дан ряд элементов: 1) Cu; 2) Ti; 3) Al; 4) Zn; 5) Si. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число d-электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Si; 2) S; 3) P; 4) Br; 5) F. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число p-электронов на внешнем уровне. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Cl; 2) F; 3) N; 4) Li; 5) S. Определите, атомы каких из указанных в ряду элементов содержат шесть s‐электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Be; 2) N; 3) Na; 4) C; 5) Cu. Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.

Дан ряд элементов: 1) Na; 2) Cl; 3) Si; 4) Mn; 5) Cr. Определите, атомы каких из указанных в ряду элементов имеют одинаковое число валентных электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) К; 2) Zn; 3) Si; 4) Ca; 5) C. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Na; 2) Be; 3) Ca; 4) Mg; 5) Cl. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Al; 2) Ca; 3) P; 4) Ne; 5) Cl. Определите, атомы каких из указанных в ряду элементов в основном состоянии НЕ имеют на внешнем энергетическом уровне неспаренных электронов. Запишите в поле ответа номера выбранных элементов.

Дан ряд элементов: 1) Mg; 2) S; 3) O; 4) Cl; 5) Cu. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне по четыре спаренных электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Mg; 2) Al; 3) Si; 4) Ti; 5) Ga. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют число валентных электронов равное числу энергетических уровней. Запишите в поле ответа номера выбранных элементов.
Дан ряд атомов: 1) С; 2) N; 3) O; 4) F; 5) Ne. Определите два атома, имеющие одинаковые числа нейтронов. Запишите в поле ответа номера выбранных атомов.
Дан ряд элементов: 1) H; 2) S; 3) I; 4) Na; 5) Mg. Определите, атомам каких из указанных в ряду элементов в основном состоянии до завершения внешнего электронного слоя недостаёт одного электрона. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Be; 2) H; 3) O; 4) Cu; 5) N.
 Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Mg; 2) H; 3) O; 4) C; 5) N. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) C; 2) Fe; 3) Sn; 4) Pb; 5) Cr. Определите, у атомов каких из указанных в ряду элементов в основном состоянии валентные электроны находятся как на s-, так и на d-подуровнях. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Al; 2) Si; 3) Mg; 4) C; 5) N. Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns
1np3. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) B; 2) Al; 3) F; 4) Fe; 5) N. Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns
1np2. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Al; 2) Li; 3) Mg; 4) C; 5) N. Определите, катионы каких из указанных в ряду элементов имеют электронную формулу, совпадающую с электронной формулой атома неона. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Rb; 2) P; 3) Mg; 4) Cr; 5) Al. Определите элементы, атомы которых в основном состоянии имеют одинаковую конфигурацию внешнего энергетического уровня. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) Sn; 2) F; 3) Al; 4) Cr; 5) N.
 Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных р-электронов на внешнем слое. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных р-электронов на внешнем слое. Запишите в поле ответа номера выбранных элементов.
Дан ряд элементов: 1) S; 2) F; 3) Al; 4) Si; 5) Li. Определите, у наиболее распространенных изотопов каких из указанных в ряду двух элементов в составе атомного ядра число протонов равно числу нейтронов. Запишите в поле ответа номера выбранных элементов.
Все ответы:
- 35
- 13
- 25
- 24
- 13
- 23
- 12
- 13
- 34
- 14
- 45
- 15
- 35
- 24
- 24
- 15
- 24
- 34
- 24
- 45
- 13
- 24
- 34
- 25
- 24
- 12
- 13
- 14
- 23
- 14
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2020 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5Faypn_4kuX8Vwy8ly-yDJV3″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Тест по теме «Строение атома»
1.Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом
2. Электронная конфигурация катиона, образующегося при диссоциации хлорида кальция
1) 1s22s22p63s23p64s1
2) 1s22s22p63s23p6
3) 1s22s22p63s23p64s2
4) 1s22s22p63s23p64s24p6
3. В четвёртом электронном слое содержит пять электронов атом
1) V
2) Аs
3) Sn
4) Zr
4. Число нейтронов в изотопе цинка с относительной атомной массой 70 равно:
1) 40
2) 30
3) 35
4) 65
5. Чему равен заряд ядра атома натрия?
Чему равен заряд ядра атома натрия?
1) 0
2) +1
3)+11
4) +23
6.У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
1) 4 и +16
2) 6 и +32
3) 6 и +16
4) 4 и + 32
7. Атом какого элемента в основном состоянии содержит 2 электрона на первом уровне, 8 — на втором, 14 — на третьем и 2 — на четвертом:
1)Сr;
2) Мn;
3)Со;
4)Fe;
8. Относительная атомная масса изотопа, содержащего на третьем энергетическом уровне 11 электронов, на четвертом — 2 электрона, а в ядре — 27 нейтронов, равна:
1) 40
2) 14
3) 38
4) 50
9. Распределение электронов по энергетическим уровням атома марганца
Распределение электронов по энергетическим уровням атома марганца
1) 2; 8; 8; 7
2) 2; 8; 13; 2
3) 2; 8; 10
4) 2; 8; 8; 10; 5
10.Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы фосфора и
1) Si
2)N
3) S
4) Be
13.Электронную конфигурацию внешнего энергетического уровня 4s24p5 имеет атом:
1)As
2) Mn
3) Cl
4) Br
14. Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом
1) титана
2) кремния
3) магния
4) фосфора
15. Конфигурация валентных электронов некоторого элемента – 3d64s2. Каково положение этого элемента в Периодической системе?
Каково положение этого элемента в Периодической системе?
1)3 период, VI группа, главная подгруппа
2) 3 период, VI группа, побочная подгруппа
3) 4 период, VIII группа, главная подгруппа
4) 4 период, VIII группа, побочная подгруппа
16. На внешнем уровне атома- элемента 2-го периода находятся 4 электрона. Этот элемент —
1) бериллий
2) углерод
3)бор
4)азот
17. Укажите символ металла, который содержит на внешнем энергетическом p-подуровне три электрона:
1) Тантал
2) Висмут
3) Таллий
4) фосфор
18.Какое количество энергетических подуровней полностью заполнено в атоме алюминия в основном состоянии:
1) 2
2) 3
3) 4
4) 5
19. Число неспаренных электронов атома углерода в возбуждённом состоянии:
Число неспаренных электронов атома углерода в возбуждённом состоянии:
1) 1
2) 2
3) 3
4) 4
20. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1
2) 1s22s22p63sl
3) 1s22s2
4) 1s22s22p63s23pl
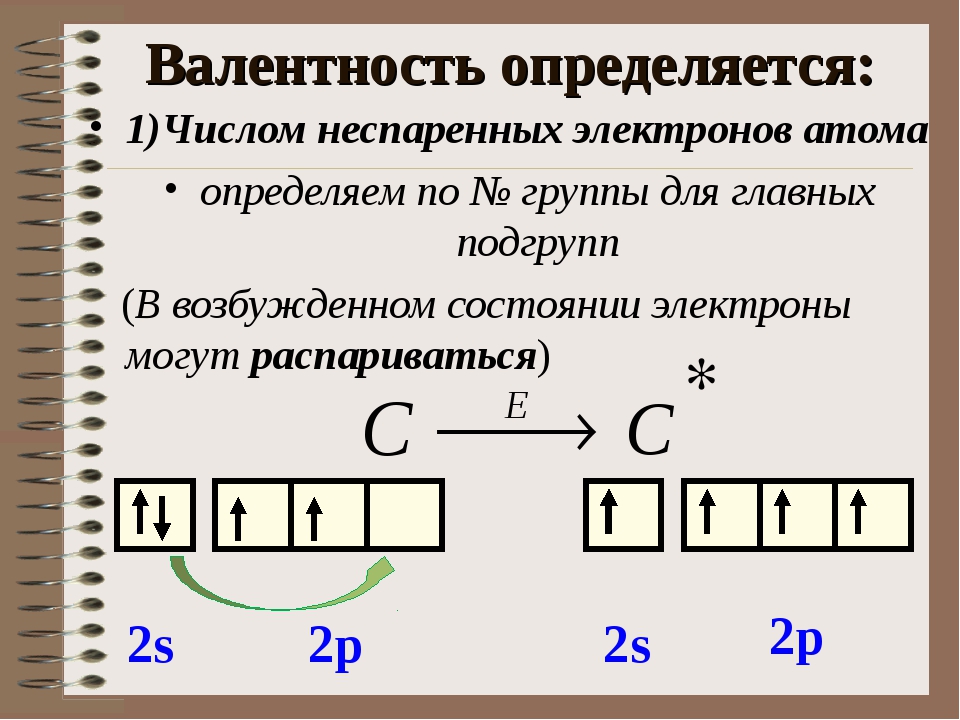
Углерод конфигурация, атома с неспаренным электроном
Предположение, что на первой стадии действительно происходит гомолитический разрыв связи углерод—галоген, а не синхронная передача атомом магния двух валентных электронов атомам углерода и галогена, подтверждается тем, что оптически активные алкилгалогениды, в которых атом галогена связан с асимметрическим атомом углерода, в процессе реакции полностью рацемизуются. В настоящее время полагают, что неспаренный электрон, оказавшийся в одном из углов тетраэдра, в отличие от пары электронов неспособен закрепить конфигурацию образовавшегося радикала. [c.257]
[c.257] Перейдем теперь к атому углерода. Его электронная конфигурация имеет вид с двумя неспаренными электронами. Промоти-рование одного 25-электрона на 2р-орбиталь и построение яр -гибрида дает четыре эквивалентные орбитали, направленные к вершинам правильного тетраэдра угол между ними составляет 109°28 (рис. И1.12). Именно такую конфигурацию имеют молекулы СХ4 (X = Н, Р, С1, Вг, I, СНз). [c.182]
Обратимся теперь к элементам группы IVA-углероду и кремнию,— атомы которых обладают валентной электронной конфигурацией s p , включающей два неспаренных электрона. Можно было бы ожидать, что они образуют всего по две двухэлектронные связи на атом, как в двухатомных молекулах [c.603]
Рассмотрим содержание этого понятия на примере соединений углерода, в подавляющем больщинстве которых атом С образует четыре ковалентные связи, хотя в валентной конфигурации основного состояния он имеет только две неспаренные орбитали (два неспаренных электрона, как чаще говорят). [c.172]
[c.172]
Объяснение строения и свойств молекул, основанное на представлении о перекрывании 5- и р-орбиталей, оказалось во многих случаях непригодным, в частности для соединений углерода. Как видно из схемы электронного строения атома углерода (рис. 29), в нем имеются два неспаренных электрона. Следовало бы ожидать, что такой атом углерода должен быть двухвалентным. Для проявления валентности, равной четырем, необходимо возбудить атом углерода. При этом один из 25-электронов может занять уровень 2р , благодаря чему образуется конфигурация (15) (25) (2р ) (2р.) 2р , в которой имеется 4 неспаренных электрона, из них три электрона обладают орбиталями р, а четвертый — орбиталью 5. При полном спаривании должно быть три однотипных связи, а четвертая связь должна быть другого типа. Од- [c.84]
При радикальной полимеризации конфигурация мономерного звена в растущей цепи фиксируется не в момент его присоединения к активному центру, а только после присоединения к макро-радикалу последующей молекулы мономера. Это связано с тем, что концевой углеродный атом, несущий неспаренный электрон, не имеет определенной конфигурации вследствие относительно свободного вращения вокруг концевой углерод-углеродной связи. Схематически процесс роста можно представить следующим образом [c.25]
Это связано с тем, что концевой углеродный атом, несущий неспаренный электрон, не имеет определенной конфигурации вследствие относительно свободного вращения вокруг концевой углерод-углеродной связи. Схематически процесс роста можно представить следующим образом [c.25]
До сих пор рассматривалось такое положение, когда изолированный атом в возбужденном состоянии имеет два, три или четыре неспаренных электрона. К сожалению, нельзя проверить наши предсказания радиального или углового распределения электронов для изолированных атомов, но можно изучить молекулы, образованные этими атомами. Предполагают, что в ковалентных молекулах, в которых неспаренные электроны одного атома становятся спаренными с электронами окружащих атомов, электроны с параллельными спинами находятся как можно дальше друг от друга в соответствии с принципом Паули и принципом неразличимости. В качестве примера рассмотрим атом неона, у которого есть четыре пары электронов во внешней оболочке.
 Леннард-Джонс на основе принципа Паули предсказал, что наиболее вероятной конфигурацией каждой четверки электронов с параллельными спинами является тетраэдр. Далее, если пренебречь кулоновским отталкиванием, то не будет корреляции между двумя конфигурациями электронов с противоположными спинами, и их можно будет равновероятно найти в любой ориентации друг относительно друга. Однако следует напомнить, что у электронов с противоположно направленными спинами существует определенная тенденция к стягиванию, которому препятствует кулоновское отталкивание корреляция зарядов). Метода проверки такого взгляда на атом неона нет. Однако интересно отметить, что Ме, Аг, Кг и Хе имеют в твердом состоянии структуру с плотной кубической упаковкой, подобной тетраэдрическому метану, а не плотную гексагональную упаковку, найденную для гелия, хотя ранее для всех инертных газов последняя структура ожидалась в предположении, что их атомы должны быть сферическими . Теперь рассмотрим метан, в котором углерод может быть гипотетически представлен как с электронной конфигурацией неона.
Леннард-Джонс на основе принципа Паули предсказал, что наиболее вероятной конфигурацией каждой четверки электронов с параллельными спинами является тетраэдр. Далее, если пренебречь кулоновским отталкиванием, то не будет корреляции между двумя конфигурациями электронов с противоположными спинами, и их можно будет равновероятно найти в любой ориентации друг относительно друга. Однако следует напомнить, что у электронов с противоположно направленными спинами существует определенная тенденция к стягиванию, которому препятствует кулоновское отталкивание корреляция зарядов). Метода проверки такого взгляда на атом неона нет. Однако интересно отметить, что Ме, Аг, Кг и Хе имеют в твердом состоянии структуру с плотной кубической упаковкой, подобной тетраэдрическому метану, а не плотную гексагональную упаковку, найденную для гелия, хотя ранее для всех инертных газов последняя структура ожидалась в предположении, что их атомы должны быть сферическими . Теперь рассмотрим метан, в котором углерод может быть гипотетически представлен как с электронной конфигурацией неона. Когда четыре протона присоединяются к С , образуя СН4, притяжение протонов к электронам приводит к совмещению двух независимых четверок электронов, расположенных в вершинах тетраэдров. Так как молекула метана действительно тетраэдрическая, то это предсказание оправдывается, хотя механизм образования молекулы метана проверить нельзя. Суммируя все сказанное, можно считать, что наиболее вероятное расположение п электронов с одинаковыми спинами будет также и наиболее вероятным расположением п пар электронов. [c.205]
Когда четыре протона присоединяются к С , образуя СН4, притяжение протонов к электронам приводит к совмещению двух независимых четверок электронов, расположенных в вершинах тетраэдров. Так как молекула метана действительно тетраэдрическая, то это предсказание оправдывается, хотя механизм образования молекулы метана проверить нельзя. Суммируя все сказанное, можно считать, что наиболее вероятное расположение п электронов с одинаковыми спинами будет также и наиболее вероятным расположением п пар электронов. [c.205]У атома углерода два неспаренных электрона, и можно было бы ожидать, что атом углерода образует две химические связи. Но при этом он не приобрел бы конфигурации атома неона чтобы это произошло, другие атомы должны поделиться с углеродом четырьмя электронами. Достичь этого можно, если один из х-электронов будет промотирован на р-уровень. [c.114]
Атом лития на 25-подуровне имеет один неспаренный электрон и, следовательно, соединение должно иметь состав LiH. У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (С, N, О, F) происходит последовательное заполнение 2р-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения ВН, СН , Nh4, Н7О, HF. Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными бериллий образует соединение с водородом состава ВеНг, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав СН4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т.е. происходит распаривание 5-электронов и переход их на р-подуровень.
У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (С, N, О, F) происходит последовательное заполнение 2р-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения ВН, СН , Nh4, Н7О, HF. Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными бериллий образует соединение с водородом состава ВеНг, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав СН4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т.е. происходит распаривание 5-электронов и переход их на р-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии 5- и р-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э-Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий 5- и р-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см.
Но тут возникает другое несоответствие с опытными данными. Поскольку энергии 5- и р-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э-Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий 5- и р-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см. рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации [c.48]
рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации [c.48]
Вопрос о том, имеет ли атом углерода с неспаренным электроном пространственную или плоскостную конфигурацию, т. е. занимает ли свободный электрон один из углов тетраэдра или же все валент- [c.839]
В табл. 2 представлены нормальные электронные конфигурации атомов первых десяти элементов периодической системы (каждый дублет состоит из электронов с противоположно направленными спинами). Из табл. 2 видно, что применение правила Хунда к углероду с его двумя неспаренными электронами на 2р-орбитах может привести к выводу о двухвалентности углерода. Однако при образовании связей ато- мы стремятся использовать все возможные орбиты путем гибридиза- [c.42]
При свободно-радикальной полимеризации винилового мономера концевой атом углерода, несущий неспаренный электрон, имеет практически плоскую форму (хр -гибридизация) и приобретает определенную пространственную конфигурацию (Р или 5) только после присоединения следующей молекулы мономера [90—92]. В общем случае фиксация той или иной пространственной конфигурации может определяться как относительным расположением заместителей К и К в момент присоединения, так и направлением атаки молекулы мономера. Как показали расчеты с использованием потенциалов взаимодействия валентно-несвязанных атомов (см., например, [92]), для реальных полимеров винилового ряда, например полиметилметакрилата, доступным для атаки мономера, обычно оказывается только одно из двух возможных направлений, например сверху от плоскости, образованной тремя заместителями концевого углеродного атома (см. рис. 14). К такому же результату приводит анализ на пространственных молекулярных моделях [85]. Следовательно, характер конфигурации у атома углерода, фиксируемой в акте роста цепи, практически пол- [c.99]
В общем случае фиксация той или иной пространственной конфигурации может определяться как относительным расположением заместителей К и К в момент присоединения, так и направлением атаки молекулы мономера. Как показали расчеты с использованием потенциалов взаимодействия валентно-несвязанных атомов (см., например, [92]), для реальных полимеров винилового ряда, например полиметилметакрилата, доступным для атаки мономера, обычно оказывается только одно из двух возможных направлений, например сверху от плоскости, образованной тремя заместителями концевого углеродного атома (см. рис. 14). К такому же результату приводит анализ на пространственных молекулярных моделях [85]. Следовательно, характер конфигурации у атома углерода, фиксируемой в акте роста цепи, практически пол- [c.99]
СНз)зМ—О), или б) вследствие отдачи электрона, как в ионах аммония. Такая потеря электрона дает конфигурацию валентного состояния азота (в виде Ы+) с четырьмя неспаренными электронами на А р -гибридных орбиталях, аналогичных орбиталям нейтрального атома углерода, в то время как (что уже отмечено выше) присоединение электрона (например, в МНг) оставляет для образования связи только два электрона. В этом случае атом азота (в виде Ы ) [c.156]
В этом случае атом азота (в виде Ы ) [c.156]
В основном состоянии атом азота с конфигурацией 18 2з 2р имеет три неспаренных электрона и в соответствии с этим трехвалентен в простых соединениях. Следующая орбиталь Зс расположена по энергии слишком высоко, чтобы было возможно промотирование на нее одного из 25-электронов, поэтому валентность нейтрального атома азота никогда не превышает трех. Как уже говорилось, пирамидальное расположение связей можно объяснить, исходя из тетраэдрического распределения электронных пар, считая одну из них неподеленной и три связывающими. В то же время положительно заряженный атом азота изоэлектронен нейтральному атому углерода и может иметь четыре неспаренных электрона, т. е. четыре ковалентные связи. Отрицательно заряженный атом азота изоэлектронен нейтральному атому кислорода, и мы получаем две связи и две неподеленные пары электронов. Когда некоторые из электронов участвуют в образовании я-связей, могут возникать плоские тригональные и линейные структуры. Сведения о строении соединений азота собраны в табл. 10.9. [c.162]
Сведения о строении соединений азота собраны в табл. 10.9. [c.162]
Электронная конфигурация углерода 15 2з 2р , т. е. атом углерода имеет два неспаренных р-электрона, которые могут принимать участие в образовании двух ковалентных связей. Однако известно, что углерод, как правило, образует четыре ковалентные связи. Это объясняется тем, что один из двух 25-электронов переходит на 2р-орбиту, в результате чего появляются четыре неспаренных электрона, которые могут образовать четыре ковалентные связи с другими атомами. Для такого перехода необходимо затратить значительную энергию (161,5 ккал). Однако выигрыш энергии [c.152]
Эти понятия очень хорошо можно проиллюстрировать на примере химической связи в соединениях углерода, но в равной мере подошел бы любой другой атом, за исключением водорода и щелочного металла. Наинизшая по энергии конфигурация атома углерода 5 25 2р . В ней неспаренными могут быть лишь два спина 2р-электронов. Исходя из этой конфигурации и метода валентных схем, следует ожидать, что углерод двухвалентен и [c. 298]
298]
Характеристика элемента. Атом углерода имеет 6 электронов ls 2s 2p . Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх-, а другой либо 2ру, либо 2рг-орбиталь. Электронная конфигурация з 25 2рх 2ру 2р2°. Различие энергии 5- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 25-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1з 2з 2рх 2ру 2р2 Именно такое состояние атома углерода характерно для решетки алмаза. Тетраэдрическое пространственное расположение, одинаковая длина я энергия связей объясняются возникновением четырех равнозначных функций д в результате взаимного наложения 5- и р -функций. Это явление, как известно, называют 5рз-гибридизацией, а возникающие функции — рЗ-гибридными (рис. 62, а). Если принять прочность связи, возникающей в результате объединения з-элект-ронных пар, за единицу, то прочность р-связи оказывается равной уз, а 5р -гибридной связи 2. Таким образом, образование четырех 5рЗ-связей обеспечивает атому углерода более устойчивое состояние, чем три р — р- и одна 5 — -связи. Помимо р -гибридиза-ции у атома углерода наблюдается также зр — и р-гибридизация (рис. 62,6, в). В первом случае возникает взаимное наложение [c.212]
62, а). Если принять прочность связи, возникающей в результате объединения з-элект-ронных пар, за единицу, то прочность р-связи оказывается равной уз, а 5р -гибридной связи 2. Таким образом, образование четырех 5рЗ-связей обеспечивает атому углерода более устойчивое состояние, чем три р — р- и одна 5 — -связи. Помимо р -гибридиза-ции у атома углерода наблюдается также зр — и р-гибридизация (рис. 62,6, в). В первом случае возникает взаимное наложение [c.212]
Из спектроскопических наблюдений и представлений атомной теории для основного состояния атома углерода выводится электронная конфигурация 15 2р , т. е. атом имеет два неспаренных р-электрона [c.35]
Число ковалентных связей, которые может образовать данный атом (ковалентность атома), определяется числом неспарепных электронов. Например, атом углерода в состоянии 2з2р имеет четыре неспаренных электрона и может образовать четыре ковалентные связи. Атом азота имеет электронную конфигурацию внешнего слоя 25 2р и имеет три неспарениых 2р-электрона и, следовательно, является трехковалентным элементом. Положительный ион азота в состоянии 2з2р имеет четыре неспаренных электрона и может образовать четыре ковалентные связи (например, в ионе КН ). [c.11]
Положительный ион азота в состоянии 2з2р имеет четыре неспаренных электрона и может образовать четыре ковалентные связи (например, в ионе КН ). [c.11]
Атом с номером 6, углерод. Заполнение 2р-подуровня проис-ходиг, как было рассмотрено выше. Шестой электрон занимает одну из двух вакантных р-орбиталей. Электронная конфигурация ls 2s 2p Суммарный спин +1. На внешнем уровне 2 неспаренных электрона. [c.42]
Теперь становится понятным, почему атомы таких элементов, как бериллий, цинк, кадмий и ртуть, которые могут принимать конфигурацию п8 пр с параллельными электронными спинами, образуют двухковалентные соединения со связями, направленными под углом 180 . Аналогично, атом бора в конфигурации 15 2з 2р р1 с тремя электронами, имеющими параллельные спины, должен с наибольшей вероятностью образовывать лежащие в плсскссти связи, направленные под углом 120° друг относительно друга (ср. с гибридными хр -орбиталями). Циммерман и ван Рис-сельберг показали, что для атома углерода в конфигурации 1з 25 2р1р ,р2 четыре неспаренных электрона с параллельными спинами, согласно принципу Паули, наиболее вероятно распределе ны по направлению к вершинам правильного тетраэдра (ср.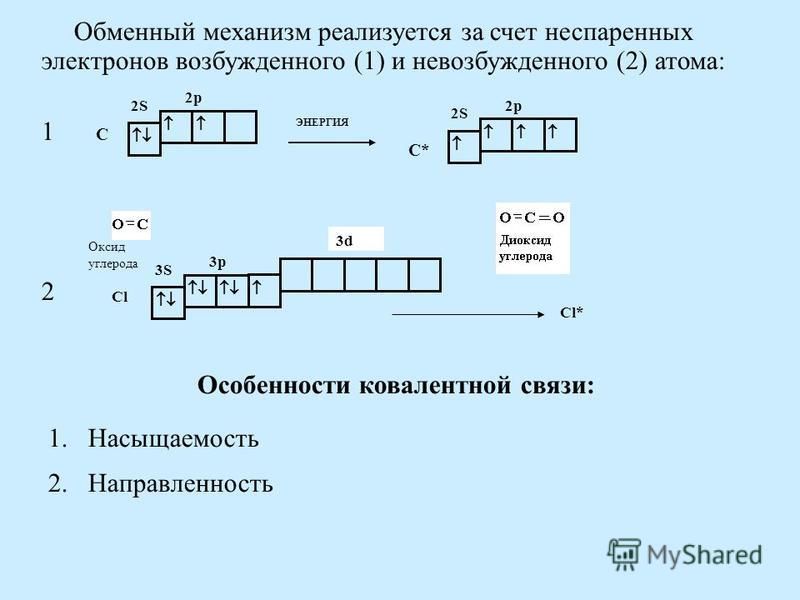 с ибридными 5р -орбиталями). [c.204]
с ибридными 5р -орбиталями). [c.204]
Чтобы объяснить валентность-углерода, равную 4, нужно допустить, что он может иметь электронную конфигурацию, соответствующую наличию четырех неспаренных электронов на внешней оболочке. Для этого нужно возбудить атом углерода, т. е. сообщить ему добавоч- [c.66]
С другой стороны, радикалы, в оторых атом углерода с неспаренным электроном находится в основании мостика жесткой циклической системы, вынуждены иметь пирамидальную конфигурацию, как, например, в случае радикала апокамфила X [c.285]
Атом углерода. Об уникальной неповторимости электронной оболочки атома углерода уже было сказано. В химические реакции он вступает, находясь в возбужденном энергетическом состоянии с конфигурацией валентной оболочки 2 р , имеющей четыре неэквивалентных (я и р) неспаренных электрона и не имеющей доступных для связи вакантных орбиталей или электронных пар. Таким образом, атом углерода в этом состоянии не способен к донорио-акцептор-1ШМ взаимодействиям. Он может образовывать только ковалентные а- и л-связи. [c.45]
Он может образовывать только ковалентные а- и л-связи. [c.45]
Эта реакция называется реакцией миграции лигандов, поскольку группа СНз переходит к атому углерода соседнего лиганда СО, а иногда также реакцией внедрения, так как ее можно формально рассматривать как внедрение СО по связи НзС—Мп. Здесь связь образуется между Мп(П) и СНз, но можно записать, что образование связи происходит между Мп(0) ((1 -конфигурация) и радикалом -СНз (метил). Этот комплекс диамагнитен и поэтому не имеет неспаренных электронов. Реакция, обратная внедрению, и состоящая в том, что атомы, или группы, находящиеся в р-положении лиганда, отщепляются и непосредственно координируются с центральным атомом, называется реакцией р-элиминирования. Реакции этого типа характерны главным образом для невернеровских комплексов и тесно связаны с каталитическими свойствами (гл. 5, разд. 3). У вернеровских комплексов таких примеров почти не наблюдается. [c.255]
Обсуждение в предыдущей главе направленной валентности было неполным, так как мы опустили почти весь круг вопросов, связанных с химией углерода. Это было сделано по той причине, что изучение углеродных соединений приводит нас к крайне важному и довольно неожиданному новому понятию. Можно проследить за его возникновением при попытке объяснить характерный факт четырехвалентности углерода, например в СН4. Согласно рис. 2.7, в низшем энергетическом состоянии атома углерода з) (28) 2рх) 2ру) имеются два неспаренных электрона. Спектроскопически это состояние является триплетным — Р. Такой атом, вообще говоря, должен быть двухвалентным с валентным углом примерно таким же, как и в молекуле воды . Единственный способ получить валентность, равную четырем, состоит в том, чтобы возбудить атом, поместив один из 25-электронов в незанятое состояние 2рг, и образовать тем самым конфигурацию 1з) 28) (2рх) 2ру) 2рг). Поскольку теперь имеются четыре неспаренных электрона (раздел 5.9), такое состояние будет квинтетным — Энергия этого возбуждения может быть определена из спектроскопических данных расчет [5] и экспериментальные исследования [346] дают приблизительно одно и то же значение, а именно около 96 ккал1моль .
Это было сделано по той причине, что изучение углеродных соединений приводит нас к крайне важному и довольно неожиданному новому понятию. Можно проследить за его возникновением при попытке объяснить характерный факт четырехвалентности углерода, например в СН4. Согласно рис. 2.7, в низшем энергетическом состоянии атома углерода з) (28) 2рх) 2ру) имеются два неспаренных электрона. Спектроскопически это состояние является триплетным — Р. Такой атом, вообще говоря, должен быть двухвалентным с валентным углом примерно таким же, как и в молекуле воды . Единственный способ получить валентность, равную четырем, состоит в том, чтобы возбудить атом, поместив один из 25-электронов в незанятое состояние 2рг, и образовать тем самым конфигурацию 1з) 28) (2рх) 2ру) 2рг). Поскольку теперь имеются четыре неспаренных электрона (раздел 5.9), такое состояние будет квинтетным — Энергия этого возбуждения может быть определена из спектроскопических данных расчет [5] и экспериментальные исследования [346] дают приблизительно одно и то же значение, а именно около 96 ккал1моль . После того как возбуждение произошло, получилось четыре неспаренных электрона, которые могут спариваться с электронами четырех присоединенных групп, как это было описано в гл. 7. Однако именно здесь имеется трудность три таких электрона обладают орбиталями типа р, а четвертый — орбиталью типа В предположении полного спаривания электронов, при котором энергия выражается формулой (7.25), должны, очевидно, иметься три однотипные связи и четвертая связь другого типа. [c.211]
После того как возбуждение произошло, получилось четыре неспаренных электрона, которые могут спариваться с электронами четырех присоединенных групп, как это было описано в гл. 7. Однако именно здесь имеется трудность три таких электрона обладают орбиталями типа р, а четвертый — орбиталью типа В предположении полного спаривания электронов, при котором энергия выражается формулой (7.25), должны, очевидно, иметься три однотипные связи и четвертая связь другого типа. [c.211]
Последний тип гибридизации с использованием только 5- и р-орбиталей можно показать, рассмотрев, как атом углерода соединяется с четырьмя атомами водорода при образовании молекулы метана. Снова необходимо сначала возбудить атом углерода из основного состояния 8 28 2р , в котором число неспаренных электронов недостаточно для образования четырех связей, в валентное состояние 18 28 2рх2ру2рг. Затем четыре орбитали комбинируются и образуют набор из четырех эквивалентных орбиталей, которые называют зр -гибридными. Это показано на рис. 3.22. Эти орбитали направлены к вершинам тетраэдра и, таким образом, СН4 имеет тетраэдрическую конфигурацию. [c.93]
Это показано на рис. 3.22. Эти орбитали направлены к вершинам тетраэдра и, таким образом, СН4 имеет тетраэдрическую конфигурацию. [c.93]
Таким же образом можно считать, что атом углерода имеет валентную конфигурацию 15 2з2рх2ру2р2 , получающуюся из конфигурации основного состояния при переходе одного из двух электронов, находящихся первоначально на 25-орбитали атома, на первоначально вакантную 2рг-орбиталь. В этой возбужденной конфигурации имеется четыре неспаренных электрона с одинаковыми спинами и их взаимодействие минимально, если они находятся на максимально возможном расстоянии друг от друга, т, е. в углах правильного тетраэдра с ядром в центре. Система лучше всего описывается четырьмя гибридными зр -орбиталями, аналогичными гибридным орбиталям в атоме неона [разд. 1,13, уравнение (1.48)]. Поэтому такую молекулу, как метан СН4, можно описать при помощи четырех локализованных связывающих молекулярных а-орбиталей, образованных комбинацией (перекрыванием) этих гибридных орбиталей с 15-орбиталями атомов водорода.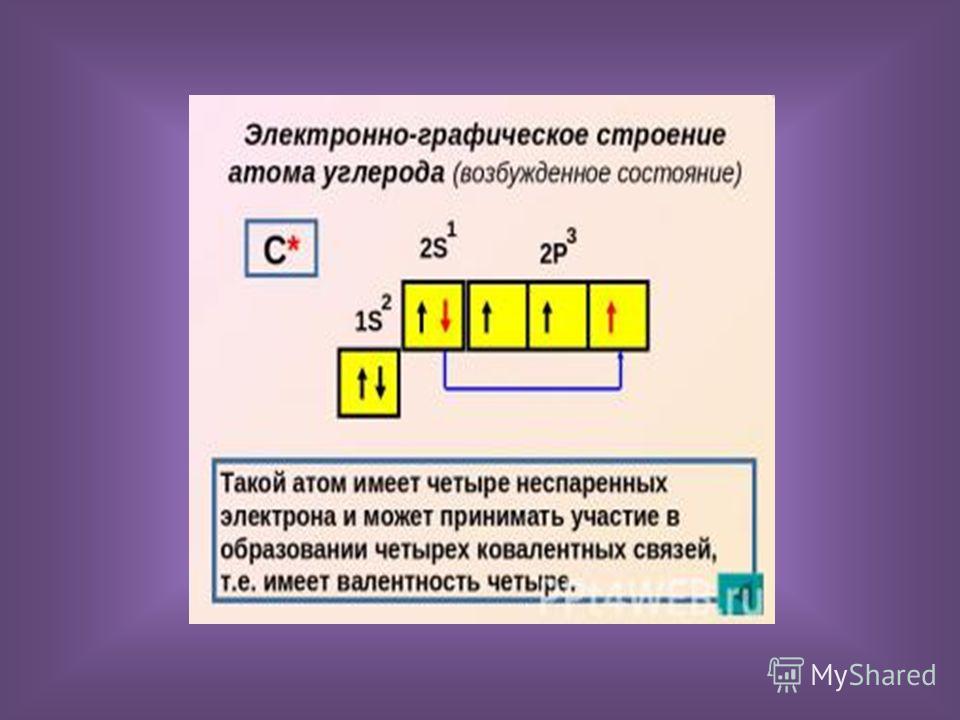 В результате молекула метана имеет тетраэдрическое строение. [c.46]
В результате молекула метана имеет тетраэдрическое строение. [c.46]
Конфигурация внешней электронной оболочки атома У. 28 р . Энергии ионизации (в ав) С°- С + — — С + ->-С С + соответственно равны 11,256 24,376 47,871 и 64,19. Несмотря на то, что атом У. в основном состоянии имеет 2 неспаренных электрона, для У. характерно образование 4 ковалентных связей. Этот факт объясняется предположением о возбуждении атома У. при взаимодействии до состояния 2 р с 4 неспаренными электронами, что является энергетически выгодным вследствие образования двух дополнительных связей (см. Валентность). Соединения, в к-рых число связей У. равно 3 (см. Радикалы свободные) или 2 (см. Карбены), как правило, неустойчивы в обычных условиях и обладают повышенной химич. активностью, что связано с наличием неспаренных электронов у атома У. Относительная стабильность углерода окиси СО и изонитрилов, в к-рых У. формально 2-валентен, объясняется 3-ковалентной [c.153]
Н. ,. Если один атом образует несколько валентных связей, то оси орбит его неспаренных электронов должны быть направлены вдоль связей, под определенными углами друг к другу, в соответствии с реально наблюдаемым в данном соединении валентными углами. Если среди исходных s-, p-, d- и т. д. орбит свободного атома таких орбит нет, то они образуются прн возникновении X. с. в результате т. н. г и б р н-д и 3 а ц и и атомных орбит. Последняя основана на том, что при образовании соединения сферич. симметрия свободного атома нарушается, вследствие чего классификация одноэлектронных состояний по квантовому числу I более не сохраняется. Типичным примером может служить молекула метана СН4. В свободном состоянии атом углерода содержит четыре валентных электрона в конфигурации (2s) 2p) , орбиты к-рых при образовании СН превращаются в гибридные 5рЗ-орбиты, направленные тетраэдрически иод углами 108° 28 друг к другу. Орбиты этих 4 электронов и образуют связи С—Н. [c.315]
,. Если один атом образует несколько валентных связей, то оси орбит его неспаренных электронов должны быть направлены вдоль связей, под определенными углами друг к другу, в соответствии с реально наблюдаемым в данном соединении валентными углами. Если среди исходных s-, p-, d- и т. д. орбит свободного атома таких орбит нет, то они образуются прн возникновении X. с. в результате т. н. г и б р н-д и 3 а ц и и атомных орбит. Последняя основана на том, что при образовании соединения сферич. симметрия свободного атома нарушается, вследствие чего классификация одноэлектронных состояний по квантовому числу I более не сохраняется. Типичным примером может служить молекула метана СН4. В свободном состоянии атом углерода содержит четыре валентных электрона в конфигурации (2s) 2p) , орбиты к-рых при образовании СН превращаются в гибридные 5рЗ-орбиты, направленные тетраэдрически иод углами 108° 28 друг к другу. Орбиты этих 4 электронов и образуют связи С—Н. [c.315]
Для образования одинарной ковалентной связи необходимо, чтобы атом имел орбиту, занятую одним неспаренным электроном для установления четырех связей атом углерода в решетке алмаза должен иметь четыре неспаренных электрона. Однако конфигурация электронного облака изолированного атома углерода в его нормальном состоянии имеет лишь два неспарепных электрона 8 25 2р , при этой конфигурации могут установиться только две ковалентные связи. В большинстве соединений углерод образует четыре ковалентные связи за счет того, что вступая во взаимодействие с другими атомами, атом углерода возбуждается и один электрон переходит с 25 орбиты на менее устойчивую 2р. В этом состоянии его конфигурация записывается 1з 252р . Следовательно, в общем случае направленные ковалентные связи могут обладать различной конфигурацией, которая характеризуется прямым или комбинированным спариванием 5, р и / электронов. Кратность связи определяет координационное число и пространственное распределение связей по углалг (табл. 1.10). [c.47]
Однако конфигурация электронного облака изолированного атома углерода в его нормальном состоянии имеет лишь два неспарепных электрона 8 25 2р , при этой конфигурации могут установиться только две ковалентные связи. В большинстве соединений углерод образует четыре ковалентные связи за счет того, что вступая во взаимодействие с другими атомами, атом углерода возбуждается и один электрон переходит с 25 орбиты на менее устойчивую 2р. В этом состоянии его конфигурация записывается 1з 252р . Следовательно, в общем случае направленные ковалентные связи могут обладать различной конфигурацией, которая характеризуется прямым или комбинированным спариванием 5, р и / электронов. Кратность связи определяет координационное число и пространственное распределение связей по углалг (табл. 1.10). [c.47]
Так, согласно квантовохимическим расчетам, атом бора в конфигурации з 25 2р 2р1 с тремя электронами с одинаковыми спинами должен с наибольшей вероятностью образовывать лежащие в одной плоскости связи, направленные под углом 120° друг к другу. Для атома углерода в конфигурации 5 2з 2р12р12р1 четыре неспаренных электрона должны распределяться по вершинам правильного тетраэдра. [c.12]
Для атома углерода в конфигурации 5 2з 2р12р12р1 четыре неспаренных электрона должны распределяться по вершинам правильного тетраэдра. [c.12]
В основном состоянии атом углерода имеет конфигурацию 15 -25 -2р-и его мультиплетпым термом является терм (см. стр. 260). Поскольку это состояние триплетное, в нем имеется всего два неспаренных электрона, так что можно было бы думать, что углерод должен быть двухвалентным. Как же объяснить тогда существование таких молекул, какСН иСС1 , в которых неспаренными должны быть четыре электрона углерода [c.312]
Олово, элемент с порядковым номером 50, является членом IVa группы периодической системы элементов. Атом любого из этих элементов имеет на валентном уровне четыре электрона. Основное состояние атома олова — Р-состояние, которому отвечает конфигурация 5s 5p , характерная для соединений двухвалентного олова. Однако в огромном большинстве случаев олово четырехвалентно, т. е. характеризуется 5-состоянием с четырьмя неспаренными электронами. Это состояние в ряде случаев приводит к 55р -гибриди-зации. Олово довольно легко образует прочные ковалентные связи с углеродом, сохраняя при этом способность к связи с различными неорганическими аддендами. За очень немногими исключениями, все органические соединения олова, содержащие хотя бы одну связь Sn. — С, образованы четырехвалентным оловом (sp -гибридизация). Полностью ионные соединения четырехвалентного олова должны были бы иметь конфигурацию 4 «, а аналогичные соединения двухвалентного олова — 4ковалентные соединения четырех-и двухвалентного олова имеют промежуточное число бх-электронов в зависимости от степени гибридизации и частично ионного характера рассматриваемых связей. Благодаря такому различию в числе бх-электронов можно классифицировать валентные состояния олова в различных его соединениях на основании изомерного сдвига (б) лтессбауэровских линий. В такой классификации учитывается только число бх-электронов независимо от величины AR/R. В вводной главе настоящей книги приведен более подробный анализ величин 6 и AR/R.
Это состояние в ряде случаев приводит к 55р -гибриди-зации. Олово довольно легко образует прочные ковалентные связи с углеродом, сохраняя при этом способность к связи с различными неорганическими аддендами. За очень немногими исключениями, все органические соединения олова, содержащие хотя бы одну связь Sn. — С, образованы четырехвалентным оловом (sp -гибридизация). Полностью ионные соединения четырехвалентного олова должны были бы иметь конфигурацию 4 «, а аналогичные соединения двухвалентного олова — 4ковалентные соединения четырех-и двухвалентного олова имеют промежуточное число бх-электронов в зависимости от степени гибридизации и частично ионного характера рассматриваемых связей. Благодаря такому различию в числе бх-электронов можно классифицировать валентные состояния олова в различных его соединениях на основании изомерного сдвига (б) лтессбауэровских линий. В такой классификации учитывается только число бх-электронов независимо от величины AR/R. В вводной главе настоящей книги приведен более подробный анализ величин 6 и AR/R. [c.265]
[c.265]
Так, атом углерода должен был бы являться двухвалентным, так как он имеет лишь два неспаренных электрона и поэтому может образовывать две ковалентные связи. На самом деле в большинстве соединений углерод образует четыре ковалентные связи. В этом случае атом углерода имеет следующую электронную конфигурацию 1 2з2р , при этом один электрон переходит с 25-орбиты на менее устойчивую 2р-орбиту. Благодаря этому атом углерода может образовывать четыре ковалентные связи вместо двух. Энергия промотирования электрона представляет собою энергию, необходимую для того, чтобы атом мог образовать две дополнительные связи. Иногда электронную конфигурацию четырехвалентного атома углерода записывают 18 2з2р2р2р для того, чтобы показать, что четыре валентных электрона занимают различные орбиты. [c.15]
Атом углерода в основном состоянии имеет конфигурацию 2з 2р с двумя неспаренными р-электронами, з-парой и вакантной р-орбиталью. В таком состоянии атом углерода может образовать две обычные ковалентные связи, причем 2з-пара и вакантная р-орбиталь остаются неиспользованными. Энергетически такая ситуация исключительно невыгодна. Установлено, что энергия, выделяющаяся при образовании атомом углерода даже одной связи, достаточна для перевода атома с затратой 400 кДж/моль в новое валентное состояние с гибридизованными орбитйлями ар, ар или ар . В любом случае при гибридизации ис- [c.302]
Энергетически такая ситуация исключительно невыгодна. Установлено, что энергия, выделяющаяся при образовании атомом углерода даже одной связи, достаточна для перевода атома с затратой 400 кДж/моль в новое валентное состояние с гибридизованными орбитйлями ар, ар или ар . В любом случае при гибридизации ис- [c.302]
Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом
Банк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
ПодробнееБанк заданий по химии 10 класс
Банк заданий по химии 10 класс 1.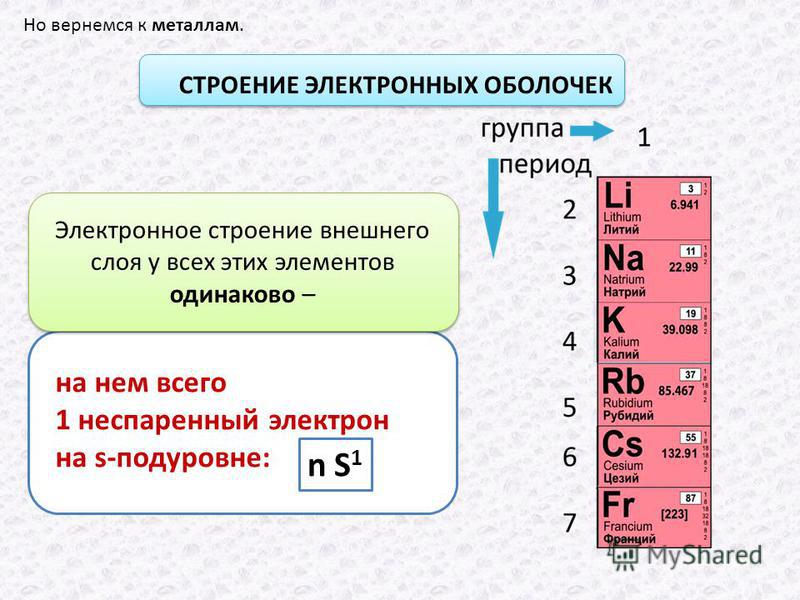 С каждым из указанных веществ: хлороводород, водород, бромная вода будет реагировать пропан метан этан этилен 5) ацетилен 2. При выполнении задания из предложенного перечня
С каждым из указанных веществ: хлороводород, водород, бромная вода будет реагировать пропан метан этан этилен 5) ацетилен 2. При выполнении задания из предложенного перечня
Вариант 1. Желаем успеха
Федеральное агентство по рыболовству Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Астраханский государственный технический университет» Разработка
ПодробнееЗадания В7 по химии 1. Фенол реагирует с
Задания В7 по химии 1. Фенол реагирует с 1) хлором 2) бутаном 3) серой 4) гидроксидом натрия 5) азотной кислотой 6) оксидом кремния (IV) Фенолы- кислородсодержащие органические соединения, в молекуле которых
ПодробнееДемонстрационный вариант
Демонстрационный вариант Ссылка на вариант: https://bingoschool. ru/ege/chemistry/variants/demo/ Часть 1 1. 1) Na 2) K 3) Si 4) Mg 5) C Определите, атомы каких из указанных в ряду элементов в основном состоянии
ru/ege/chemistry/variants/demo/ Часть 1 1. 1) Na 2) K 3) Si 4) Mg 5) C Определите, атомы каких из указанных в ряду элементов в основном состоянии
2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы базового образования по учебному
Подробнее1) 2,24 л 2) 6,72 л 3) 8,96 л 4) 11,2 л. 1) F- 2) Ca2+ 3) P+5 4) Br- 1) Sr, Ca, Mg 2) Mg, Al, Si 3) Mg, Al, Ca 4) F, Cl, Br
Вариант демо14 стр. 1 из 9 Тест по химии Демонстрационный вариант 2014 г. ИНСТРУКЦИЯ Тест состоит из частей А и В. На его выполнение отводится 120 минут. Задания рекомендуем выполнять по порядку. Если
ПодробнееБанк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы среднего образования по учебному
ПодробнееБилеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
Подробнее1) 2 2) 0 3) +4 4) +6
Химия Демонстрационный вариант 2015 г. (стр. 1 из 5) Тест по химии 6 Демонстрационный вариант 2015 г. ИНСТРУКЦИЯ Тест состоит из 30 заданий. На его выполнение отводится 120 минут. Задания рекомендуем выполнять
1 из 5) Тест по химии 6 Демонстрационный вариант 2015 г. ИНСТРУКЦИЯ Тест состоит из 30 заданий. На его выполнение отводится 120 минут. Задания рекомендуем выполнять
Зачет по теме «Химическая связь» 11класс
Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
ПодробнееХимические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
ПодробнееІX класс, XІ (ХII) классы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «РЕСПУБЛИКАНСКИЙ ЦЕНТР РАЗВИТИЯ ОБРАЗОВАНИЯ»
Подробнее1.
 ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ1. ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ Раздел 2. Многообразие химических реакций В результате изучения раздела учащиеся должны важнейшие химические понятия: классификация химических реакций различными способами,
Подробнееучебный год
АВТОНОМНАЯ НЕКОММЕРЧЕСКАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ОРГАНИЗАЦИЯ «ШКОЛА СОСНЫ» УТВЕРЖДАЮ Директор И.П. Гурьянкина Приказ _8 от «29» августа 2017 г. Рабочая программа по предмету «ХИМИЯ» 9 класс основное общее
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа составлена в соответствии с Федеральным компонентом государственного образовательного стандарта первого поколения на основе авторской программы О.С.Габриеляна от
ПодробнееРЕЗУЛЬТАТЫ ОСВОЕНИЯ КУРСА «ХИМИЯ 9 КЛАСС»
РЕЗУЛЬТАТЫ ОСВОЕНИЯ КУРСА «ХИМИЯ 9 КЛАСС» В результате изучения химии ученик должен знать химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций; важнейшие
ПодробнееСтроение атома
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Строение электронных оболочек атомов элементов первых четырех периодов: s- и p- и d- элементы. Электронная конфигурация атома. Основное и возбужденное состояние атома.
Электронная конфигурация атома. Основное и возбужденное состояние атома.
Для решение задания А1 нужно знать как находить
количество протонов, электронов в атоме и ионе, знать как распределяются электроны по электронным уровням и подуровням, уметь записывать электронную конфигурацию атома и иона, находить количество неспаренных электронов в атоме и ионе, знать как связана электронная конфигурация и валентность химического элемента
1. Количество электронов в атоме равно
1) | числу протонов |
2) | числу нейтронов |
3) | числу энергетических уровней |
4) | относительной атомной массе |
2 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
3. Внешний энергетический уровень атома элемента, образующего высший оксид состава ЭОз, имеет формулу
1) ns2np1 2) ns2nр2 3) nз2nр3 4) ns2nр4
4. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 3s23р4 4) 4s24р4
5. Электронную конфигурацию 1s22s22p63s23p64s1 в основном состоянии имеет атом
1) лития
2) натрия
3) калия
4) кальция
6. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
7. Двухэлектронную внешнюю оболочку имеет ион
Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
8. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
9. Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2+
10. В основном состоянии три неспаренных электрона имеет атом
1) кремния
2) фосфора
3) серы
4) хлора
11. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
12. Электронная конфигурация Is22s22p63s23p6 соответствует иону
Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl— 2) N3- 3) Br— 4) О2-
13. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
14. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F—
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns2np3 4) ns2nps
16. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
17. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
18. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
19. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
20. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F— 4) Cr2+ и Сr3+
21. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
22. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1) | 4, 6 |
2) | 2, 5 |
3) | 3, 7 |
4) | 4, 5 |
23 Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4) Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава RH3. Электронная конфигурация внешнего уровня этого элемента
1) | 3s23p1 |
2) | 3s23p2 |
3) | 3s23p3 |
4) | 3s23p5 |
26. Атомы серы и кислорода имеют
Атомы серы и кислорода имеют
1) | одинаковое число электронных слоев |
2) | одинаковое число электронов внешнего электронного слоя |
3) | одинаковое число протонов в ядре |
4) | одинаковые радиусы |
27. Электронная конфигурация атома фтора
1) | 1s22s22p5 |
2) | 1s22s22p4 |
3) | 1s22s22p6 |
4) | 1s22s22p3 |
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
29. У атома хлора на третьем электронном уровне имеется одна s-орбиталь, три p-орбитали и пять d-орбиталей. Максимальная валентность хлора равна
1) | четырем |
2) | семи |
3) | восьми |
4) | девяти |
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное соединение
1) СН4 2) SiH4 3) H2O 4) H2S
31. Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
1) ns2np5 2) ns2np2 3) ns2np4 2) ns2np6
32. Одинаковое число валентных электронов имеют атомы калия и
1) углерода 2) магния 3) фосфора 4) натрия
Ответы: 1-1, 2-2,3-4,4-3,5-3,6-2,7-3,8-4,9-2, 10-2, 11-3, 12-1, 13-1, 14-1, 15-1, 16-2, 17-2, 18-3, 19-4, 20-3, 21-3, 22-4, 23-1, 24-3, 25-4, 26-2, 27-1, 28-4, 29-2, 30-2, 31-2, 32-4.
2.2: Электронные конфигурации — Chemistry LibreTexts
Навыки для развития
- Чтобы понять основы добавления электронов на атомные орбитали
- Чтобы понять основы принципа Aufbau
Электронная конфигурация элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химического состава.
Принцип Aufbau
Мы составляем таблицу Менделеева, следуя принципу aufbau (от немецкого, что означает «наращивание»).Сначала мы определяем количество электронов в атоме; затем мы добавляем электроны по одному к доступной орбитали с наименьшей энергией, не нарушая принцип Паули . Мы используем диаграмму орбитальной энергии на рисунке 2.1.1, понимая, что каждая орбиталь может удерживать два электрона, один со спином вверх ↑, что соответствует m s = + ½, что произвольно записывается первым, а один — вращение вниз ↓, что соответствует м с = −½.Заполненная орбиталь обозначена ↑ ↓, в которой спины электронов называются спаренными . Вот схематическая диаграмма орбиты атома водорода в основном состоянии:
Некоторые авторы выражают орбитальную диаграмму горизонтально (убирая неявную энергетическую ось и символ двоеточия):
Если нет причины показывать пустые орбитали с более высокой энергией, они часто опускаются на орбитальной диаграмме:
Из орбитальной диаграммы мы можем записать электронную конфигурацию в сокращенной форме, в которой занятые орбитали идентифицируются их главным квантовым числом n и их значением l ( s , p , d , или f ), причем количество электронов в подоболочке указывается надстрочным индексом. Таким образом, для водорода одиночный электрон находится на орбитали 1 с , которая является орбиталью с наименьшей энергией (рис. 2.1.1), а электронная конфигурация записывается как 1 с 1 и читается как « один-с-один. »
Таким образом, для водорода одиночный электрон находится на орбитали 1 с , которая является орбиталью с наименьшей энергией (рис. 2.1.1), а электронная конфигурация записывается как 1 с 1 и читается как « один-с-один. »
Нейтральный атом гелия с атомным номером 2 ( Z = 2) имеет два электрона. Мы помещаем один электрон на орбиталь с наименьшей энергией, орбиталь 1 s . Из принципа исключения Паули мы знаем, что орбиталь может содержать два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спарены.Таким образом, орбитальная диаграмма атома гелия равна
.записывается как 1 s 2 , где верхний индекс 2 означает спаривание спинов. В противном случае наша конфигурация нарушила бы принцип Паули.
Следующий элемент — литий, с Z = 3 и тремя электронами в нейтральном атоме. Мы знаем, что орбиталь 1 s может удерживать два электрона с парными спинами. Рисунок 2.1.1 говорит нам, что следующая орбиталь с наименьшей энергией — 2 с , поэтому орбитальная диаграмма для лития равна
Рисунок 2.1.1 говорит нам, что следующая орбиталь с наименьшей энергией — 2 с , поэтому орбитальная диаграмма для лития равна
Эта электронная конфигурация записывается как 1 с 2 2 с 1 .
Следующий элемент — бериллий, с Z = 4 и четырьмя электронами. Мы заполняем обе орбитали s и 2 s , чтобы получить электронную конфигурацию 1 s 2 2 s 2 :
Когда мы достигаем бора с Z = 5 и пятью электронами, мы должны поместить пятый электрон на одну из орбиталей 2 p . Поскольку все три орбитали 2 p вырождены, не имеет значения, какую из них мы выберем.Электронная конфигурация бора: 1 с 2 2 с 2 2 p 1 :
У углерода, с Z = 6 и шестью электронами, мы стоим перед выбором. Должен ли шестой электрон быть размещен на той же орбите 2 p , на которой уже есть электрон, или он должен пойти на одну из пустых орбиталей 2 p ? Если он войдет на пустую орбиталь 2 p , будет ли у шестого электрона спин совпадать со спином пятого электрона или быть противоположным ему?
Какая из следующих трех орбитальных диаграмм верна для углерода, учитывая, что орбитали 2 p вырождены?
Из-за электрон-электронного отталкивания для электрона энергетически более выгодно находиться на незанятой орбитали, чем на уже занятой; следовательно, мы можем исключить вариант a.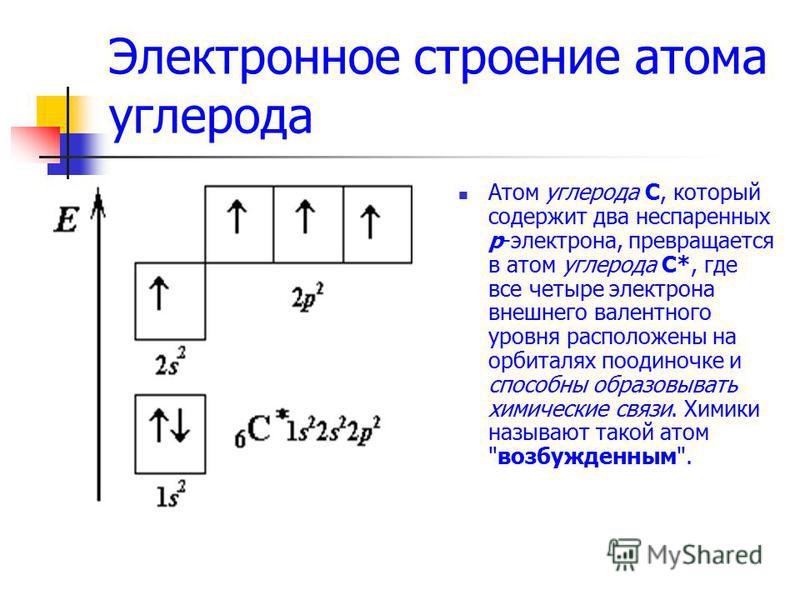 Точно так же эксперименты показали, что выбор b немного выше по энергии (менее стабилен), чем выбор c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда (названное в честь немецкого физика Фридриха Х. Хунда, 1896–1997), которое сегодня гласит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. . По правилу Хунда электронная конфигурация углерода, которая составляет 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c.Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Точно так же эксперименты показали, что выбор b немного выше по энергии (менее стабилен), чем выбор c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда (названное в честь немецкого физика Фридриха Х. Хунда, 1896–1997), которое сегодня гласит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. . По правилу Хунда электронная конфигурация углерода, которая составляет 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c.Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Упражнение 2.2.1
Нарисуйте орбитальную диаграмму азота, Z = 7. Какова электронная конфигурация этого атома?
- Ответ:
Когда мы переходим к азоту ( Z = 7, с семью электронами), правило Хунда говорит нам, что расположение с наименьшей энергией составляет
с тремя неспаренными электронами.
 Электронная конфигурация азота, таким образом, 1 с 2 2 с 2 2 p 3 .
Электронная конфигурация азота, таким образом, 1 с 2 2 с 2 2 p 3 .
У кислорода с Z = 8 и восемью электронами у нас нет выбора. Один электрон должен быть спарен с другим на одной из орбиталей 2 p , что дает нам два неспаренных электрона и электронную конфигурацию 1 s 2 2 s 2 2 p 4 .Поскольку все орбитали 2 p вырождены, не имеет значения, какая из них имеет пару электронов.
Аналогично, фтор имеет электронную конфигурацию 1 с 2 2 с 2 2 p 5 и орбитальная диаграмма:
Когда мы дойдем до неона, с Z = 10, мы заполнили подоболочку 2 p , получив 1 s 2 2 s 2 2 p 6 электронная конфигурация и орбитальная диаграмма:
Обратите внимание, что для неона, как и для гелия, все орбитали через уровень 2 p полностью заполнены. Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите.
Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите.
Ядро и валентные электроны
Продолжая таким образом через периодическую таблицу, записывая электронные конфигурации все более и более крупных атомов, становится утомительно копировать конфигурации заполненных внутренних подоболочек. На практике химики упрощают обозначения, используя символ благородного газа в квадратных скобках, чтобы представить конфигурацию благородного газа из предыдущей строки, потому что все орбитали в благородном газе заполнены.Например, [Ne] представляет 1 s 2 2 s 2 2 p 6 электронная конфигурация неона ( Z = 10), поэтому электронная конфигурация натрия, с Z = 11, что составляет 1 с 2 2 с 2 2 p 6 3 с 1 , записывается как [Ne] 3 с 1
| Полная электронная конфигурация | Nobel Gas Shorthand | ||
| Неон | Z = 10 | Ne: 1 с 2 2 с 2 2 с 6 | Ne: [He] 2 с 2 2 p 6 |
| Натрий | Z = 11 | Na: 1 с 2 2 с 2 2 с 6 3 с 1 | Na: [Ne] 3 с 1 |
Электроны на заполненных внутренних орбиталях ближе к ядру и прочнее с ним связаны, поэтому они редко участвуют в химических реакциях. Мы будем называть их остовными электронами. Для репрезентативных элементов (столбцы 1, 2 и 13-18 Периодической таблицы) все основные электроны — это электроны со значением n ниже, чем максимальное значение n в электронной конфигурации. Например, в атоме натрия максимальное значение n равно 3. Таким образом, остовные электроны — это электроны на атомных орбиталях с n <3, а именно на 1s, 2s и 2p-орбиталях. Итак, у натрия 10 основных электронов. Мы вернемся к этому определению остовных электронов позже для переходных металлов.
Мы будем называть их остовными электронами. Для репрезентативных элементов (столбцы 1, 2 и 13-18 Периодической таблицы) все основные электроны — это электроны со значением n ниже, чем максимальное значение n в электронной конфигурации. Например, в атоме натрия максимальное значение n равно 3. Таким образом, остовные электроны — это электроны на атомных орбиталях с n <3, а именно на 1s, 2s и 2p-орбиталях. Итак, у натрия 10 основных электронов. Мы вернемся к этому определению остовных электронов позже для переходных металлов.
Это означает, что химический состав атома в основном зависит от электронов в его внешней оболочке, имеющих наибольшее значение n, которые называются валентными электронами. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя эти обозначения для сравнения электронных конфигураций натрия и лития, мы имеем:
| Натрий | 1 с 2 2 с 2 2 с 6 3 с 1 | [Ne] 3 с 1 |
| Литий | 1 с 2 2 с 1 | [He] 2 с 1 |
Совершенно очевидно, что и натрий, и литий имеют один электрон s на валентной оболочке. Следовательно, мы могли бы предсказать, что натрий и литий имеют очень похожий химический состав, что действительно так.
Следовательно, мы могли бы предсказать, что натрий и литий имеют очень похожий химический состав, что действительно так.
По мере того, как мы продолжаем строить восемь элементов периода 3, орбитали 3 s и 3 p заполняются, по одному электрону за раз. Этот ряд завершается благородным газом аргоном, который имеет электронную конфигурацию [Ne] 3 s 2 3 p 6 , соответствующую заполненной валентной оболочке.
Пример 2.2.2
Нарисуйте орбитальную диаграмму и используйте ее для определения электронной конфигурации фосфора, Z = 15.Какова его валентная электронная конфигурация?
Дано: атомный номер
Запрошено: орбитальная диаграмма и конфигурация валентных электронов для фосфора
Стратегия:
- Найдите ближайший благородный газ перед фосфором в периодической таблице. Затем вычтите его количество электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.

- Ссылаясь на рисунок 2.1.1, нарисуйте орбитальную диаграмму, чтобы представить эти валентные орбитали.Следуя правилу Хунда, поместите валентные электроны на доступные орбитали, начиная с орбитали с наименьшей энергией. Напишите конфигурацию электронов из вашей орбитальной диаграммы.
- Игнорируйте внутренние орбитали (те, которые соответствуют электронной конфигурации ближайшего благородного газа) и запишите конфигурацию валентных электронов для фосфора.
Решение:
A Поскольку фосфор находится в третьей строке периодической таблицы, мы знаем, что он имеет замкнутую оболочку [Ne] с 10 электронами.Начнем с вычитания 10 электронов из 15 в фосфоре.
B Дополнительные пять электронов размещаются на следующих доступных орбиталях, которые, как показывает рисунок 2.1.1, это орбитали 3 s и 3 p :
Поскольку орбиталь 3 s имеет меньшую энергию, чем орбитали 3 p , мы заполняем ее первой:
Правило Хунда говорит нам, что оставшиеся три электрона займут вырожденные 3 p орбитали отдельно, но со своими спинами выровненными:
Электронная конфигурация [Ne] 3 s 2 3 p 3 .
C Мы получаем конфигурацию валентных электронов, игнорируя внутренние орбитали, что для фосфора означает, что мы игнорируем закрытую оболочку [Ne]. Это дает конфигурацию валентных электронов 3 s 2 3 p 3 .
Упражнение 2.2.2
Нарисуйте орбитальную диаграмму и используйте ее для получения электронной конфигурации хлора: Z = 17. Какова его валентная электронная конфигурация?
- Ответ:
- [Ne] 3 с 2 3 p 5
Конфигурация валентных электронов: 3 с 2 3 p 5
Общий порядок заполнения орбиталей показан на рисунке 2.2.1. Подоболочки, соответствующие каждому значению n , записываются слева направо на последовательных горизонтальных строках, где каждая строка представляет строку в периодической таблице. Порядок заполнения орбиталей обозначен диагональными линиями, идущими сверху справа налево. Соответственно, орбиталь 4 s заполняется до орбиты 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которой начинается четвертый период, равна [Ar] 4 с 1 , а конфигурация кальция — [Ar] 4 с 2 .Пять 3 d орбиталей заполнены следующими 10 элементами, переходными металлами, за которыми следуют три 4 p орбиталей. Обратите внимание, что последним членом этой строки является криптон с благородным газом ( Z = 36), Kr: [Ar] 4 s 2 3 d 10 4 p 6 , который имеет заполнены 4 s , 3 d и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.
Соответственно, орбиталь 4 s заполняется до орбиты 3 d из-за эффектов экранирования и проникновения. Следовательно, электронная конфигурация калия, с которой начинается четвертый период, равна [Ar] 4 с 1 , а конфигурация кальция — [Ar] 4 с 2 .Пять 3 d орбиталей заполнены следующими 10 элементами, переходными металлами, за которыми следуют три 4 p орбиталей. Обратите внимание, что последним членом этой строки является криптон с благородным газом ( Z = 36), Kr: [Ar] 4 s 2 3 d 10 4 p 6 , который имеет заполнены 4 s , 3 d и 4 p орбиталей. Пятая строка периодической таблицы по существу такая же, как четвертая, за исключением того, что орбитали 5 s , 4 d и 5 p заполняются последовательно.
Рисунок 2.2.1 Предсказание порядка заполнения орбиталей многоэлектронными атомами. Если вы напишете подоболочки для каждого значения главного квантового числа в последовательных строках, наблюдаемый порядок, в котором они заполняются, будет обозначен серией диагональных линий, идущих от верхнего правого угла к нижнему левому.
Если вы напишете подоболочки для каждого значения главного квантового числа в последовательных строках, наблюдаемый порядок, в котором они заполняются, будет обозначен серией диагональных линий, идущих от верхнего правого угла к нижнему левому.
Шестая строка периодической таблицы будет отличаться от двух предыдущих, потому что 4 f орбиталей, которые могут содержать 14 электронов, заполнены между 6 s и 5 d орбиталями.Элементы, которые содержат 4 f орбиталей в своей валентной оболочке, являются лантаноидами. Когда орбитали 6 p , наконец, заполнены, мы достигли следующего (и последнего известного) благородного газа, радона ( Z = 86), Rn: [Xe] 6 s 2 4 f 14 5 d 10 6 p 6 . В последней строке орбитали 5 f заполнены между 7 s и 6 d орбиталями, что дает 14 актинидных элементов.Поскольку большое количество протонов делает их ядра нестабильными, все актиниды радиоактивны.
Пример 2.2.3
Запишите электронную конфигурацию ртути ( Z = 80), указав все внутренние орбитали.
Дано: атомный номер
Запрошено: Полная электронная конфигурация
Стратегия:
Используя орбитальную диаграмму на рисунке 2.2.1 и периодическую таблицу в качестве руководства, заполните орбитали, пока не будут размещены все 80 электронов.
Решение:
Размещая электроны на орбиталях в порядке, показанном на рисунке 2.2.1, и используя периодическую таблицу в качестве руководства, мы получаем
| 1 с 2 | ряд 1 | 2 электрона |
| 2 с 2 2 с 6 | ряд 2 | 8 электронов |
| 3 с 2 3 с 6 | ряд 3 | 8 электронов |
| 4 s 2 3 d 10 4 p 6 | ряд 4 | 18 электронов |
| 5 s 2 4 d 10 5 p 6 | ряд 5 | 18 электронов |
| ряд 1–5 | 54 электронов |
После заполнения первых пяти строк у нас все еще остается 80 — 54 = 26 электронов, которые нужно разместить. Согласно рисунку 2.2.2, нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результатом является электронная конфигурация ртути:
Согласно рисунку 2.2.2, нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результатом является электронная конфигурация ртути:
Hg: 1 с 2 2 с 2 2 с 6 3 с 2 3 с 6 4 с 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10
Hg: [Xe] 6 s 2 4 f 14 5 d 10
с заполненной подоболочкой 5 d , a 6 s 2 4 f 14 5 d 10 конфигурация валентной оболочки и всего 80 электронов.(Вы всегда должны проверять, что общее количество электронов равно атомному номеру. )
)
Упражнение 2.2.3
Хотя элемент 114 недостаточно стабилен, чтобы встречаться в природе, два изотопа элемента 114 были впервые созданы в ядерном реакторе в 1999 году группой российских и американских ученых. Напишите полную электронную конфигурацию элемента 114.
- Ответ:
- 1 с 2 2 с 2 2 с 6 3 с 2 3 с 6 4 с 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 2
Электронная конфигурация элементов представлена на рисунке 2. 2.3, в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что показаны на рисунке 2.2.1. Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии составляет [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 . Точно так же наблюдаемая электронная конфигурация меди составляет [Ar] 4 с 1 3 d 10 вместо [Ar] с 2 3 d 9 .Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс 1 , нс 3 , nd 5 , нс 7 ) или заполненным ( нс 2 , нп 6 , нс 10 , нс 14 ) подоболочка.
2.3, в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что показаны на рисунке 2.2.1. Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии составляет [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 . Точно так же наблюдаемая электронная конфигурация меди составляет [Ar] 4 с 1 3 d 10 вместо [Ar] с 2 3 d 9 .Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс 1 , нс 3 , nd 5 , нс 7 ) или заполненным ( нс 2 , нп 6 , нс 10 , нс 14 ) подоболочка. Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую.В более тяжелых элементах могут иметь значение и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на рисунке 2.2.3. Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами. Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую.В более тяжелых элементах могут иметь значение и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на рисунке 2.2.3. Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами. Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Примечание
Дополнительная устойчивость связана с наполовину заполненными или заполненными подоболочками.
Сводка
Основываясь на принципе Паули и знании орбитальных энергий, полученных с помощью водородоподобных орбиталей, можно построить периодическую таблицу, заполняя доступные орбитали, начиная с орбиталей с наименьшей энергией (принцип aufbau ), что дает поднимаются до определенного расположения электронов для каждого элемента (его электронная конфигурация ).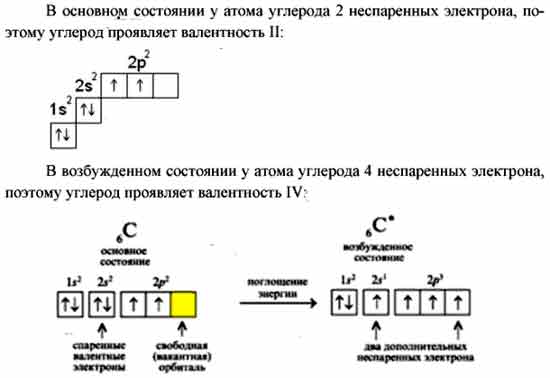 Правило Хунда гласит, что расположение электронов с наименьшей энергией — это такое, при котором они располагаются на вырожденных орбиталях с параллельными спинами.Для химических целей наиболее важными электронами являются те, что находятся во внешней основной оболочке, валентных электронов .
Правило Хунда гласит, что расположение электронов с наименьшей энергией — это такое, при котором они располагаются на вырожденных орбиталях с параллельными спинами.Для химических целей наиболее важными электронами являются те, что находятся во внешней основной оболочке, валентных электронов .
Электрон Конфигурации атомов
Электронная конфигурация атома показывает количество электронов на каждом подуровне на каждом энергетическом уровне атома в основном состоянии. Чтобы определить электронную конфигурацию конкретного атома, начните с ядра и добавляйте электроны один за другим, пока количество электронов не станет равным количеству протонов в ядре.Каждому добавленному электрону назначается подуровень с самой низкой доступной энергией. Первым заполненным подуровнем будет подуровень 1s, затем подуровень 2s, подуровень 2p, подуровень 3s, 3p, 4s, 3d и так далее. Этот порядок трудно запомнить и часто трудно определить из диаграмм уровней энергии, таких как рис. 5.8.
5.8.
Более удобный способ запомнить порядок — использовать рисунок 5.9. Основные уровни энергии перечислены в столбцах, начиная с уровня единиц слева. Чтобы использовать этот рисунок, прочитайте диагональные линии в направлении стрелки.Порядок представлен под диаграммой.
| РИСУНОК 5.9 Стрелка показывает второй способ запоминания порядка заполнения подуровней. |
Атом водорода (атомный номер 1) имеет один протон и один электрон. Одиночный электрон относится к подуровню 1s, самому низкоэнергетическому подуровню на низкоэнергетическом уровне. Следовательно, электронная конфигурация водорода записывается:
Для гелия (атомный номер 2), который имеет два электрона, электронная конфигурация такова:
He: 1с 2
Два электрона полностью заполняют первый энергетический уровень.Поскольку ядро гелия отличается от ядра водорода, ни один из электронов гелия не будет иметь точно такую же энергию, как одиночный электрон водорода, даже если все они находятся на подуровне 1s. Элемент литий (атомный номер 3) имеет три электрона. Чтобы записать его электронную конфигурацию, мы должны сначала определить (из рисунка 5.9), что подуровень 2s является следующим по энергии выше подуровня 1s. Следовательно, электронная конфигурация лития такова:
Элемент литий (атомный номер 3) имеет три электрона. Чтобы записать его электронную конфигурацию, мы должны сначала определить (из рисунка 5.9), что подуровень 2s является следующим по энергии выше подуровня 1s. Следовательно, электронная конфигурация лития такова:
Li: 1 с 2 2 с 1
Бор (атомный номер 5) имеет пять электронов.Четыре электрона заполняют орбитали 1s и 2s. Пятый электрон добавляется к 2p-орбитали, следующий по энергии подуровень выше (рис. 5.9). Электронная конфигурация бора:
B: 1 с 2 2 с 2 2p 1
В таблице 5.2 показаны электронные конфигурации элементов с атомными номерами от 1 до 18. Электронные конфигурации элементов с более высокими атомными номерами могут быть записаны, следуя диаграмме заполнения орбит на Рисунке 5.9.
| Элемент | Атомный номер | Электронная конфигурация |
|---|---|---|
| водород | 1 | 1 с 1 |
| гелий | 2 | 1 с 2 |
| литий | 3 | 1 с 2 2 с 1 |
| бериллий | 4 | 1 с 2 2 с 2 |
| бор | 5 | 1с 2 2с 2 2п 1 |
| углерод | 6 | 1с 2 2с 2 2п 2 |
| азот | 7 | 1с 2 2с 2 2п 3 |
| кислород | 8 | 1с 2 2с 2 2п 4 |
| фтор | 9 | 1с 2 2с 2 2п 5 |
| неон | 10 | 1 с 2 2 с 2 2 с 6 |
| натрий | 11 | 1 с 2 2 с 2 2p 6 3 с 1 |
| магний | 12 | 1с 2 2с 2 2п 6 3с 2 |
| алюминий | 13 | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| кремний | 14 | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| фосфор | 15 | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| сера | 16 | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| хлор | 17 | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| аргон | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 |
А.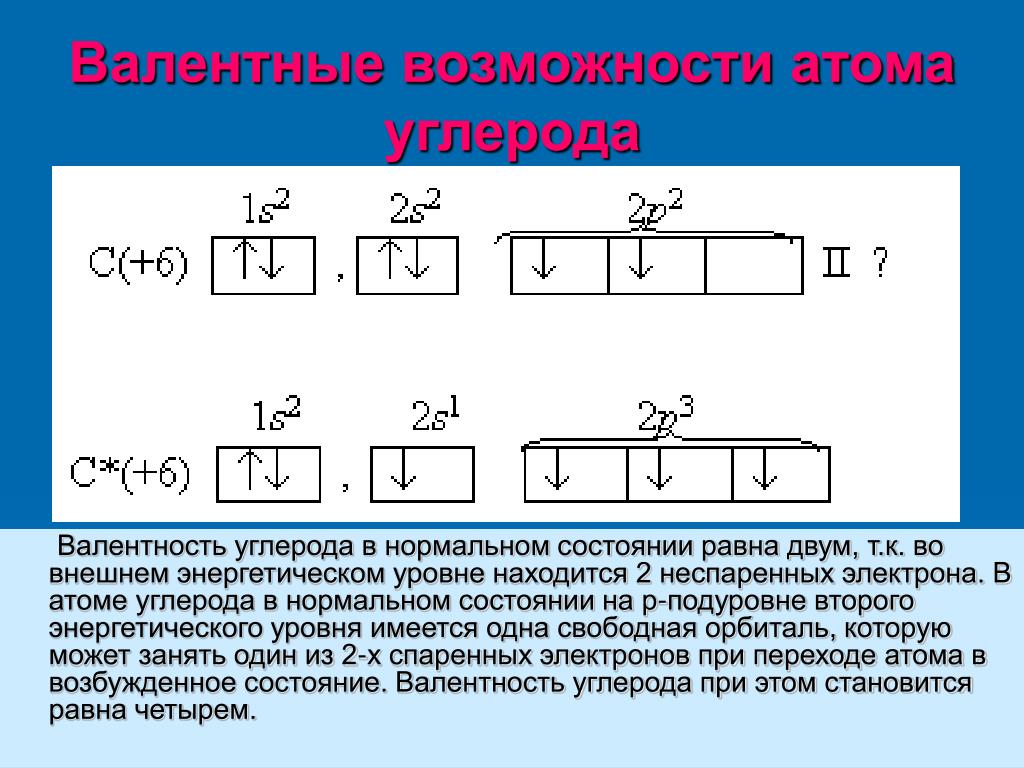 Блок-схемы электронной конфигурации
Блок-схемы электронной конфигурации
Если у атома есть частично заполненный подуровень, может быть важно знать, как
электроны этого подуровня распределяются по орбиталям. Исследование
показал, что неспаренные электроны (один электрон на орбитали) находятся в
конфигурация с более низкой энергией, чем у парных электронов (два электрона на орбитали).
Тогда энергия электронов на подуровне была бы ниже с наполовину заполненным
орбитали, чем с заполненными и пустыми.Мы можем показать распределение
электронов с помощью прямоугольных диаграмм, где каждый прямоугольник представляет
орбиталь, а стрелки в прямоугольниках представляют электроны на этой орбитали.
Направление стрелки представляет спин электрона. (Напомним из
Раздел 5.3B, что два электрона с орбитальным спином в противоположных направлениях на
их оси.) Следовательно, если орбиталь содержит два электрона, ее коробка будет содержать
две стрелки, одна направлена вверх, а другая вниз.
Используя прямоугольную диаграмму, мы показываем электронную конфигурацию азота как:
Обратите внимание, что 2p-электроны показаны как
скорее, чем
что означало бы, что из трех p-орбиталей одна заполнена, одна наполовину заполнена и одна пуста.
Электронная конфигурация | Безграничная химия
Общие правила отнесения электронов к атомным орбиталям
Электроны атома существуют на дискретных атомных орбиталях, и электронная конфигурация атома может быть определена с помощью набора рекомендаций.
Цели обучения
Определяет электронную конфигурацию элементов и ионов, определяя связь между электронными оболочками и подоболочками.
Ключевые выводы
Ключевые моменты
- Если энергия атома увеличивается, электрон в атоме возбуждается. Чтобы вернуться в основное состояние, электрон выделяет энергию. Энергия света, высвобождаемого, когда электрон падает на энергетический уровень, такая же, как разница в энергии между двумя уровнями.
- Если смотреть просто, электроны расположены в оболочках вокруг ядра атома. Ближайшие к ядру электроны будут иметь самую низкую энергию. Электроны, находящиеся дальше от ядра, будут иметь более высокую энергию. Электронная оболочка атома может вместить 2n 2 электронов (где n — уровень оболочки).
- В более реалистичной модели электроны движутся по атомным орбиталям или подоболочкам. Есть четыре различных формы орбиты: s, p, d и f. Внутри каждой оболочки подоболочка s имеет более низкую энергию, чем p.Орбитальная диаграмма используется для определения электронной конфигурации атома.
- Существуют рекомендации по определению электронной конфигурации атома. Электрон переместится на орбиталь с наименьшей энергией. Каждая орбиталь может содержать только одну электронную пару. Электроны будут максимально разделяться внутри оболочки.
Ключевые термины
- частота : количество повторений повторяющегося события в единицу времени.
- квантование : процесс аппроксимации непрерывного сигнала набором дискретных символов или целых значений.
Энергия электронов на атомных орбиталях
Центральная структура атома — это ядро, которое содержит протоны и нейтроны. Это ядро окружено электронами. Хотя все эти электроны имеют одинаковый заряд и одинаковую массу, каждый электрон в атоме имеет разное количество энергии. Электроны с самой низкой энергией находятся ближе всего к ядру, где сила притяжения положительно заряженного ядра максимальна. Электроны с более высокой энергией находятся дальше.
Квантование энергии
Когда энергия атома увеличивается (например, когда вещество нагревается), энергия электронов внутри атома также увеличивается — то есть электроны возбуждаются. Чтобы возбужденный электрон вернулся к своей исходной энергии или основному состоянию, он должен высвободить энергию. Один из способов высвобождения энергии электроном — излучение света. Каждый элемент излучает свет с определенной частотой (или цветом) при нагревании, который соответствует энергии электронного возбуждения.
Полезно думать об этом как о подъеме по лестнице. Если вы недостаточно поднимете ногу, вы наткнетесь на ступеньку и застрянете на уровне земли. Чтобы двигаться дальше, нужно поднять ногу на высоту ступеньки. То же самое касается электронов и количества энергии, которое они могут иметь. Это разделение электронов на энергетические единицы называется квантованием энергии, потому что есть только определенные количества энергии, которые электрон может иметь в атоме. Энергия света, высвобождаемого, когда электрон падает с более высокого энергетического уровня на более низкий энергетический уровень, такая же, как разница в энергии между двумя уровнями.
Электронные оболочки
Мы начнем с очень простого способа показать расположение электронов вокруг атома. Здесь электроны расположены на энергетических уровнях или оболочках вокруг ядра атома. Электроны, которые находятся на первом энергетическом уровне (энергетический уровень 1), находятся ближе всего к ядру и будут иметь самую низкую энергию. Электроны, находящиеся дальше от ядра, будут иметь более высокую энергию. Электронная оболочка атома может вместить 2n 2 электронов, где n — уровень энергии.Например, первая оболочка может вместить 2 x (1) 2 или 2 электрона. Вторая оболочка может вместить 2 x (2) 2 или 8 электронов.
Расположение электронов в атоме лития : Литий (Li) имеет атомный номер 3, что означает, что в нейтральном атоме число электронов будет 3. Уровни энергии показаны в виде концентрических кругов вокруг центрального ядра. , а электроны размещены изнутри наружу. Первые два электрона находятся на первом уровне энергии, а третий электрон находится на втором уровне энергии.
Например, фтор (F) имеет атомный номер 9, что означает, что нейтральный атом фтора имеет 9 электронов. Первые 2 электрона находятся на первом уровне энергии, а остальные 7 — на втором уровне энергии.
Атомные орбитали
Хотя электроны можно представить просто как вращающиеся вокруг ядра кольцами, в действительности электроны движутся по гораздо более сложным путям. Эти пути называются атомными орбиталями или подоболочками. Есть несколько различных форм орбит — s, p, d и f — но пока мы сосредоточимся в основном на s и p орбиталях.Первый энергетический уровень содержит только одну s-орбиталь, второй энергетический уровень содержит одну s-орбиталь и три p-орбитали, а третий энергетический уровень содержит одну s-орбиталь, три p-орбитали и пять d-орбиталей. В пределах каждого энергетического уровня s-орбиталь имеет более низкую энергию, чем p-орбитали.
Орбитальная диаграмма : положения первых десяти орбит атома на энергетической диаграмме. Обратите внимание, что каждый блок может удерживать два электрона.
Орбитальная диаграмма помогает определить электронную конфигурацию элемента.Электронная конфигурация элемента — это расположение электронов в оболочках. Вот несколько рекомендаций по разработке этой конфигурации:
- Каждая орбиталь может содержать только два электрона. Электроны, которые встречаются вместе на орбитали, называются электронной парой.
- Электрон всегда будет пытаться войти на орбиталь с наименьшей энергией.
- Электрон может занимать орбиталь сам по себе, но он предпочел бы занять орбиталь с более низкой энергией вместе с другим электроном, прежде чем занимать орбиталь с более высокой энергией.Другими словами, в пределах одного энергетического уровня электроны заполнят s-орбиталь, прежде чем начнут заполнять p-орбитали.
- Подоболочка s может содержать 2 электрона.
- Подоболочки p могут содержать 6 электронов.
Электронные конфигурации могут использоваться для рационализации химических свойств как в неорганической, так и в органической химии. Он также используется для интерпретации атомных спектров, метода, используемого для измерения энергии света, излучаемого элементами и соединениями.
Принцип застройки (Aufbau)
Принцип Ауфбау определяет электронную конфигурацию атома путем добавления электронов на атомные орбитали в соответствии с определенным набором правил.
Цели обучения
Запишите электронные конфигурации элементов в стандартных обозначениях.
Ключевые выводы
Ключевые моменты
- Правило Маделунга определяет порядок, в котором атомные орбитали заполняются электронами. Электроны заполняют орбитали, начиная с самого низкого доступного энергетического состояния, прежде чем заполнять более высокие состояния.
- Процедура Aufbau: Определите количество электронов для интересующего атома. Заполните доступные орбитали, начиная с самых низких уровней энергии, и избегайте спаривания электронов на одной орбитали до тех пор, пока это не понадобится.
- Обозначение электронной конфигурации описывает уровни энергии, орбитали и количество электронов. Число и буква обозначают уровень энергии и орбиталь соответственно, а число в верхнем индексе показывает, сколько электронов находится на этой орбитали.
- Принцип Aufbau хорошо работает для первых 18 элементов, но затем становится менее полезным.
Ключевые термины
- Принцип исключения Паули : квантово-механический принцип, согласно которому никакие два идентичных фермиона (частицы с полуцелым спином) не могут находиться в одном и том же квантовом состоянии одновременно.
Атомы создаются за счет добавления электронов
Хотя ядро атома очень плотное, электроны вокруг него могут занимать различные положения, которые можно описать как электронную конфигурацию. Электронная конфигурация элемента может быть представлена с помощью диаграмм уровней энергии или диаграмм Ауфбау. Принцип Aufbau (от немецкого Aufbau , означающего «создание, строительство») описывает метод построения модели, в котором атом «создается» путем постепенного добавления электронов.По мере добавления электронов они принимают наиболее устойчивые оболочки по отношению к ядру и уже имеющимся электронам.
Заполнение диаграммы Ауфбау
Порядок заполнения орбиталей определяется правилом Маделунга. Правило основано на общем количестве узлов на атомной орбитали, n + ℓ, которое связано с энергией. В этом контексте n представляет главное квантовое число, а ℓ представляет азимутальное квантовое число. Значения ℓ = 0, 1, 2, 3 соответствуют меткам s, p, d и f соответственно.Согласно принципу, электроны заполняют орбитали, начиная с самых низких доступных энергетических состояний, прежде чем заполнять более высокие состояния (например, за 1 секунду до 2 секунд).
Правило упорядочивания энергии Маделунга : Порядок, в котором орбитали располагаются путем увеличения энергии в соответствии с Правилом Маделунга. Каждая диагональная стрелка чтения соответствует разному значению n + l.
На диаграмме Ауфбау для обозначения электронов используются стрелки. Когда на орбитали два электрона, электроны называют электронной парой.Электронные пары показаны стрелками, указывающими в противоположных направлениях. Согласно принципу исключения Паули, два электрона на орбитали не будут вращаться одинаково. То есть диаграмма Ауфбау использует стрелки, указывающие в противоположных направлениях. Стрелка, указывающая вверх, означает, что электрон вращается в одну сторону, а стрелка, указывающая вниз, означает, что электрон вращается в другую сторону. Если на орбитали только один электрон, этот электрон называется неспаренным электроном.
Диаграмма Ауфбау для лития : Электронная конфигурация лития, показанная на диаграмме Ауфбау
Следующие шаги подробно описывают, как нарисовать диаграмму Ауфбау:
- Определите количество электронов в атоме.
- Заполните s-орбиталь на первом уровне энергии (1s-орбиталь) первыми двумя электронами.
- Заполните s-орбиталь второго энергетического уровня (2s-орбиталь) вторыми двумя электронами.
- Поместите по одному электрону на каждую из трех p-орбиталей второго энергетического уровня (2p-орбитали), а затем, если электроны все еще остались, вернитесь и поместите второй электрон на каждую из 2p-орбиталей, чтобы сформировать электронные пары.
- Продолжайте таким образом через каждый из последовательных уровней энергии, пока все электроны не будут вытянуты.
Диаграмма Ауфбау для фтора : Диаграмма Ауфбау, показывающая электронную конфигурацию фтора.
Стандартное обозначение электронной конфигурации
Для записи электронной конфигурации атома используется специальный тип записи. Обозначения описывает уровни энергии, орбитали и количество электронов в каждом. Например, электронная конфигурация лития 1s 2 2s 1 . Число и буква описывают уровень энергии и орбиталь, а число над орбиталью показывает, сколько электронов находится на этой орбитали.Используя стандартные обозначения, электронная конфигурация фтора 1s 2 2s 2 2p 5 .
Ограничения Aufbau
Принцип Ауфбау основан на идее, что порядок орбитальных энергий фиксирован — как для данного элемента, так и между различными элементами. Это предположение приблизительно верно — достаточно для того, чтобы принцип был полезен, — но не является физически разумным. Он моделирует атомные орбитали как «ящики» с фиксированной энергией, в которые можно поместить не более двух электронов.Однако энергия электрона на атомной орбитали зависит от энергий всех других электронов атома.
В водородоподобном атоме, который имеет только один электрон, s-орбиталь и p-орбитали одной и той же оболочки на диаграмме Ауфбау имеют одинаковую энергию. Однако в реальном атоме водорода энергетические уровни немного расщеплены магнитным полем ядра. Поскольку каждый атом имеет разное количество протонов в ядре, магнитное поле отличается, что изменяет притяжение каждого электрона.В общем, принцип Ауфбау очень хорошо работает для основных состояний атомов для первых 18 элементов, а затем постепенно уменьшается для следующих 100 элементов.
Interactive: Уровни энергии атома водорода : Вероятное расположение электрона вокруг ядра атома называется орбиталью. Форма орбитали зависит от энергетического состояния электрона. У нейтрального атома водорода один электрон. Щелкните поля, чтобы установить энергию этого электрона и увидеть форму орбиты, описывающую, где вы, вероятно, найдете этот электрон вокруг ядра.
Правило Хунда
Правило Хунда определяет поведение неспаренных электронов валентной оболочки, обеспечивая понимание реакционной способности и стабильности атома.
Цели обучения
Применить правило Хунда и обосновать его использование для определения электронных конфигураций атомов в основном состоянии
Ключевые выводы
Ключевые моменты
- Правило Хунда гласит, что каждая орбиталь на подуровне занята отдельно, прежде чем любая орбиталь будет занята дважды, и все электроны на однократно занятых орбиталях имеют одинаковый спин.
- Электроны располагаются так, чтобы минимизировать энергию их взаимодействия. Они всегда будут занимать пустую орбиталь, прежде чем объединятся в пары, чтобы минимизировать отталкивание. У неспаренных электронов одинаковые спины, потому что они реже встречаются, если движутся в одном направлении, чем если движутся в противоположных направлениях.
- Чтобы избежать путаницы, ученые всегда рисуют первый электрон и любой другой неспаренный электрон на орбитали как «вращение вверх».
- Электронные конфигурации помогают прогнозировать реакцию определенных элементов.Атом наиболее реактивен, когда его валентная оболочка не заполнена, и наиболее устойчив, когда его валентные орбитали заполнены. Элементы, которые имеют одинаковое количество валентных электронов, часто имеют похожие свойства.
Ключевые термины
- отталкивание : сила, которая отталкивает два тела друг от друга.
- Правило Хунда : Правило, которое гласит, что большее состояние полного спина обычно делает полученный атом более стабильным.
- квантово-механический расчет : Раздел физики, изучающий материю и энергию на уровне атомов и других элементарных частиц и заменяющий классические ньютоновские механизмы вероятностными.
Связь с принципом Ауфбау
Электроны сначала заполнят орбитали с самой низкой энергией, а затем переместятся на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией заполнятся. Это называется принципом Ауфбау по имени ученого, предложившего эту концепцию. Хотя последствия очевидны для орбиталей с другим главным квантовым числом (n), которые явно имеют разную энергию, порядок заполнения менее ясен для вырожденных подуровней. Например, для бора через неон порядок заполнения электронами 2p-орбиталей следует правилу Хунда.
Правило Хунда гласит:
- Каждая орбиталь на подуровне занята однократно, прежде чем любая орбиталь будет занята дважды.
- Все электроны на однократно заполненных орбиталях имеют одинаковый спин.
Разъяснение правила Хунда
Согласно первому правилу, электроны всегда занимают пустую орбиталь, прежде чем они образуют пару. Электроны заряжены отрицательно и, как следствие, отталкиваются друг от друга. Электроны стремятся минимизировать отталкивание, занимая свою собственную орбиталь, а не разделяя орбиталь с другим электроном.Кроме того, квантово-механические расчеты показали, что электроны на однократно заполненных орбиталях менее эффективно экранируются или экранируются от ядра.
Согласно второму правилу, неспаренные электроны на однократно заполненных орбиталях имеют одинаковые спины. Если все электроны вращаются в одном направлении, они встречаются реже, чем если бы некоторые из них вращались в противоположных направлениях. В последнем случае увеличивается сила отталкивания, разделяющая электроны. Следовательно, выровненные спины имеют меньшую энергию.
С технической точки зрения, первый электрон на подуровне может иметь либо «вращение вверх», либо «вращение вниз». После выбора спина первого электрона на подуровне спины всех других электронов на этом подуровне зависят от этого первого выбора. Чтобы избежать путаницы, ученые всегда рисуют первый электрон и любой другой неспаренный электрон на орбитали как «вращение вверх».
Применение правила Хунда
Например, возьмем электронную конфигурацию для углерода: 2 электрона объединятся в пары на орбитали 1s, 2 электрона объединятся в пары на орбитали 2s, а оставшиеся 2 электрона будут помещены на орбитали 2p.Правильная орбитальная диаграмма, подчиняющаяся правилу Хунда, будет указывать на то, что два 2p-электрона не спарены на двух из трех доступных орбиталей, причем обе имеют «вращение вверх». Поскольку электроны всегда занимают пустую орбиталь до того, как они заполнятся, было бы неправильно втягивать два 2p-электрона на одну и ту же орбиталь, оставляя открытые орбитали незаполненными.
Пример правила Хунда : Орбитальная диаграмма углерода, показывающая правильное применение правила Хунда.
Другой пример: кислород имеет 8 электронов.Электронную конфигурацию можно записать как 1s 2 2s 2 2p 4 . Орбитальная диаграмма нарисована следующим образом: первые 2 электрона объединятся в пары на орбитали 1s; следующие 2 электрона объединятся в пары на 2s-орбитали. Остается 4 электрона, которые необходимо разместить на 2p-орбиталях. Согласно правилу Хунда, все орбитали будут заняты по отдельности, прежде чем какая-либо будет занята дважды. Следовательно, две р-орбитали получат по 1 электрону каждая, а одна — 2 электрона. Правило Хунда также говорит нам, что все неспаренные электроны должны иметь одинаковый спин.Придерживаясь соглашения, все неспаренные электроны изображены как «вращение вверх».
Применение правила Хунда : Орбитальная диаграмма для кислорода, который имеет четыре 2p-электрона, демонстрирующая правильное применение правила Хунда.
Назначение электронных конфигураций
Когда атомы вступают в контакт друг с другом, первыми будут взаимодействовать внешние электроны этих атомов или валентная оболочка. Атом наименее устойчив (и, следовательно, наиболее реактивен), когда его валентная оболочка не заполнена.Валентные электроны в значительной степени ответственны за химическое поведение элемента. Элементы, которые имеют одинаковое количество валентных электронов, часто имеют схожие химические свойства.
Электронные конфигурации также могут предсказывать стабильность. Атом наиболее стабилен (и поэтому не реагирует), когда все его орбитали заполнены. Самые стабильные конфигурации — это те, которые имеют полный уровень энергии. Эти конфигурации встречаются в благородных газах. Благородные газы — очень стабильные элементы, которые не вступают в реакцию с любыми другими элементами.
Электронные конфигурации могут помочь сделать прогнозы о способах реакции определенных элементов и химических соединениях или молекулах, которые образуют различные элементы. Эти принципы помогают понять поведение всех химических веществ, от самых простых элементов, таких как водород и гелий, до самых сложных белков (огромных биологических химических веществ, состоящих из тысяч различных атомов, связанных вместе), обнаруженных в человеческом теле.
Эффект защиты и эффективный ядерный заряд
Эффект экранирования, приблизительно равный эффективному заряду ядра, обусловлен внутренними электронами, экранирующими валентные электроны от ядра.
Цели обучения
Вычислить эффективные ядерные заряды, испытываемые валентными электронами.
Ключевые выводы
Ключевые моменты
- Эффект экранирования описывает баланс между притяжением протонов на валентные электроны и силами отталкивания от внутренних электронов.
- Эффект экранирования объясняет, почему электроны валентной оболочки легче удаляются из атома. Эффект также объясняет размер атома. Чем больше экранирование, тем дальше может распространяться валентная оболочка и тем крупнее будут атомы.
- Эффективный заряд ядра — это чистый положительный заряд валентных электронов. Его можно аппроксимировать уравнением: Z eff = Z — S, где Z — атомный номер, а S — количество экранирующих электронов.
Ключевые термины
- катион : положительно заряженный ион, в отличие от аниона.
- валентная оболочка : внешняя оболочка электронов в атоме; эти электроны участвуют в связывании с другими атомами.
- теория отталкивания пар электронов валентной оболочки : Набор правил, используемых для предсказания формы отдельных молекул.
- остовные электроны : те, которые не являются частью валентной оболочки и как таковые, не участвуют в связывании.
- ядро : положительно заряженная центральная часть атома, состоящая из протонов и нейтронов.
- эффективный ядерный заряд : заряд, который испытывает электрон в многоэлектронном атоме, обычно меньше для электронов, которые экранированы остовными электронами.
- анион : отрицательно заряженный ион, в отличие от катиона.
Защитный эффект
Электроны в атоме могут защищать друг друга от притяжения ядра. Этот эффект, называемый эффектом экранирования, описывает уменьшение притяжения между электроном и ядром в любом атоме с более чем одной электронной оболочкой. Чем больше электронных оболочек, тем больше экранирующий эффект, испытываемый удаленными электронами.
В водородоподобных атомах, у которых есть только один электрон, результирующая сила, действующая на электрон, равна силе электрического притяжения ядра.Однако, когда задействовано больше электронов, каждый электрон (в n-оболочке) ощущает не только электромагнитное притяжение от положительного ядра, но также силы отталкивания от других электронов в оболочках от 1 до n-1. Это приводит к тому, что суммарная электростатическая сила, действующая на электроны во внешних оболочках, становится значительно меньшей по величине. Следовательно, эти электроны не так сильно связаны, как электроны, расположенные ближе к ядру.
Эффект экранирования объясняет, почему электроны валентной оболочки легче удаляются из атома.Ядро может стягивать валентную оболочку сильнее, когда притяжение сильное, и менее тугое, когда притяжение ослаблено. Чем сильнее экранирование, тем дальше может распространяться валентная оболочка. В результате атомы будут больше.
Пример
Почему цезий больше элементарного натрия?
Элемент натрия имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 1 . Внешний энергетический уровень n = 3 и имеется один валентный электрон.Притяжение между этим одиноким валентным электроном и ядром с 11 протонами экранируется другими 10 остовными электронами.
Электронная конфигурация для цезия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6с 1 . Хотя в атоме цезия больше протонов, также гораздо больше электронов, защищающих внешний электрон от ядра.Поэтому крайний электрон, 6s 1 , удерживается очень слабо. Из-за экранирования ядро имеет меньший контроль над электроном 6s 1 , чем над электроном 3s 1 .
Эффективный ядерный заряд
Величину экранирующего эффекта сложно точно рассчитать. В качестве приближения мы можем оценить эффективный заряд ядра на каждом электроне.
Диаграмма эффективного ядерного заряда : Схема концепции эффективного ядерного заряда на основе электронного экранирования.
Эффективный заряд ядра (часто обозначаемый Z eff или Z *) — это чистый положительный заряд, испытываемый электроном в многоэлектронном атоме. Термин «эффективный» используется потому, что экранирующий эффект отрицательно заряженных электронов не позволяет электронам с более высокой орбиты испытывать полный заряд ядра.
Эффективный заряд ядра электрона определяется следующим уравнением:
Z эфф = Z — S
, где Z — количество протонов в ядре (атомный номер), а S — количество электронов между ядром и рассматриваемым электроном (количество невалентных электронов).
Пример
Рассмотрим нейтральный атом неона (Ne), катион натрия (Na + ) и анион фтора (F — ). Каков эффективный ядерный заряд для каждого?
Начните с определения количества невалентных электронов, которое можно определить по электронной конфигурации.
Ne имеет 10 электронов. Электронная конфигурация: 1s 2 2s 2 2p 6 . Валентная оболочка — это оболочка 2, содержащая 8 валентных электронов.Таким образом, количество невалентных электронов равно 2 (всего 10 электронов — 8 валентных). Атомный номер неона 10, следовательно:
.Z эфф (Ne) = 10-2 = 8+
Флурин имеет 9 электронов, но F — получил электрон и, таким образом, имеет 10. Электронная конфигурация такая же, как и для неона, а количество невалентных электронов равно 2. Атомный номер для F — равен 9, поэтому:
Z eff (F — ) = 9 — 2 = 7+
У натрия 11 электронов, но ион Na + потерял электрон и, следовательно, имеет 10 электронов.Еще раз, электронная конфигурация такая же, как в предыдущих примерах, а количество невалентных электронов равно 2 (при потере одного электрона валентная оболочка становится оболочкой n = 2). Атомный номер Na + равен 11, следовательно:
.Z эфф (Na + ) = 11-2 = 9+
В каждом из приведенных выше примеров (Ne, F — , Na + ) у атома 10 электронов, но эффективный заряд ядра меняется, потому что каждый из них имеет свой атомный номер.Катион натрия имеет наибольший эффективный ядерный заряд, в результате чего электроны удерживаются максимально плотно, и поэтому Na + имеет наименьший атомный радиус.
Диамагнетизм и парамагнетизм
Диамагнитные атомы имеют только спаренные электроны, тогда как парамагнитные атомы, которые можно сделать магнитными, имеют по крайней мере один неспаренный электрон.
Цели обучения
Отличить диамагнетик от парамагнитных атомов.
Ключевые выводы
Ключевые моменты
- Каждый раз, когда два электрона имеют одну и ту же орбиталь, их спиновые квантовые числа должны быть разными.Когда два электрона объединяются в пары на орбитали или их общий спин равен 0, они являются диамагнитными электронами. Атомы со всеми диамагнитными электронами называются диамагнитными атомами.
- Парамагнитный электрон — это неспаренный электрон. Атом считается парамагнитным, если даже одна орбиталь имеет чистый спин. У атома может быть десять диамагнитных электронов, но пока у него есть один парамагнитный электрон, он по-прежнему считается парамагнитным атомом.
- Диамагнитные атомы отталкивают магнитные поля.Непарные электроны парамагнитных атомов перестраиваются в ответ на внешние магнитные поля и поэтому притягиваются. Парамагнетики не сохраняют намагниченность в отсутствие магнитного поля, поскольку тепловая энергия рандомизирует ориентацию электронного спина.
Ключевые термины
- квантовое число : Одно из определенных целых или полуцелых чисел, определяющих состояние квантово-механической системы (например, электрона в атоме).
- лантаноид : Любой из 14 редкоземельных элементов от церия (или лантана) до лютеция в периодической таблице.Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними — актиниды.
- диамагнитный : материалы, которые создают индуцированное магнитное поле в направлении, противоположном внешнему магнитному полю, и поэтому отталкиваются приложенным магнитным полем.
- парамагнитные : материалы, которые притягиваются внешним магнитным полем и образуют внутренние индуцированные магнитные поля в направлении приложенного магнитного поля.
- MRI : Магнитно-резонансная томография, метод медицинской визуализации, используемый в радиологии для исследования анатомии и физиологии тела как в состоянии здоровья, так и при заболеваниях.
Диамагнетизм
Диамагнитная левитация : Небольшой (~ 6 мм) кусок пиролитического графита (материала, похожего на графит), парящий над массивом постоянных золотых магнитов (5-миллиметровые кубы на куске стали). Обратите внимание, что полюса магнитов выровнены по вертикали и чередуются (два с севером вверх и два с югом вверх по диагонали).
Каждый раз, когда два электрона имеют одну и ту же орбиталь, их спиновые квантовые числа должны быть разными. Другими словами, один из электронов должен иметь «спин вверх», с [latex] m_s = + \ frac {1} {2} [/ latex], а другой электрон должен иметь «спин вниз» с [ латекс] m_s = — \ frac {1} {2} [/ latex]. Это важно, когда дело доходит до определения полного спина электронной орбитали. Чтобы решить, отменяются ли электронные спины, сложите их спиновые квантовые числа. Когда два электрона объединяются в пары на орбитали или их общий спин равен 0, они называются диамагнитными электронами.
Считайте вращения как по часовой стрелке, так и против часовой стрелки. Если одно вращение вращается по часовой стрелке, а другое — против часовой стрелки, то два направления вращения уравновешивают друг друга и не остается никакого вращения. Обратите внимание, что все это означает с точки зрения электронов, разделяющих орбиталь: поскольку электроны на одной и той же орбитали всегда имеют противоположные значения для их квантовых чисел спина (m s ), они всегда в конечном итоге компенсируют друг друга. Другими словами, на орбитали, содержащей два электрона, нет остатков спина.
Спин электрона очень важен для определения магнитных свойств атома. Если все электроны в атоме спарены и имеют общую орбиталь с другим электроном, то полный спин на каждой орбитали равен нулю, и атом является диамагнитным. Диамагнитные атомы не притягиваются к магнитному полю, а скорее слегка отталкиваются.
Парамагнетизм
Электроны, находящиеся на одной орбите, называются парамагнитными электронами. Помните, что если электрон находится один на орбитали, орбиталь имеет чистый спин, потому что спин одиночного электрона не компенсируется.Если хотя бы одна орбиталь имеет чистый спин, весь атом будет иметь чистый спин. Поэтому атом считается парамагнитным, если он содержит хотя бы один парамагнитный электрон. Другими словами, у атома может быть 10 спаренных (диамагнитных) электронов, но до тех пор, пока у него есть один неспаренный (парамагнитный) электрон, он по-прежнему считается парамагнитным атомом.
Подобно тому, как диамагнитные атомы слегка отталкиваются от магнитного поля, парамагнитные атомы слегка притягиваются к магнитному полю.Парамагнитные свойства возникают из-за перестройки траекторий электронов под действием внешнего магнитного поля. Парамагнетики не сохраняют никакой намагниченности в отсутствие приложенного извне магнитного поля, потому что тепловое движение рандомизирует ориентацию спина. Более сильные магнитные эффекты обычно наблюдаются только при участии d- или f-электронов. Величина магнитного момента атома лантаноида может быть довольно большой, так как он может переносить до семи неспаренных электронов в случае гадолиния (III) (отсюда его использование в МРТ).
% PDF-1.4 % 121 0 объект> endobj xref 121 89 0000000016 00000 н. 0000003717 00000 н. 0000002076 00000 н. 0000003801 00000 п. 0000003991 00000 н. 0000004957 00000 н. 0000005034 00000 н. 0000005070 00000 н. 0000009011 00000 н. 0000012600 00000 п. 0000015821 00000 п. 0000019213 00000 п. 0000022404 00000 п. 0000025877 00000 п. 0000026133 00000 п. 0000026452 00000 п. 0000026698 00000 п. 0000026938 00000 п. 0000027555 00000 п. 0000027688 00000 п. 0000028080 00000 п. 0000028508 00000 п. 0000031699 00000 н. 0000031844 00000 п. 0000032003 00000 п. 0000032162 00000 п. 0000032325 00000 п. 0000032482 00000 н. 0000032633 00000 п. 0000032796 00000 п. 0000032947 00000 п. 0000033100 00000 н. 0000033263 00000 п. 0000033416 00000 п. 0000033562 00000 п. 0000033696 00000 п. 0000033842 00000 п. 0000033988 00000 п. 0000034131 00000 п. 0000034262 00000 п. 0000034397 00000 п. 0000034533 00000 п. 0000034679 00000 п. 0000034817 00000 п. 0000034965 00000 п. 0000035097 00000 п. 0000035243 00000 п. 0000035380 00000 п. 0000035514 00000 п. 0000035660 00000 п. 0000035819 00000 п. 0000035960 00000 п. 0000036123 00000 п. 0000036266 00000 п. 0000036412 00000 п. 0000036575 00000 п. 0000036730 00000 п. 0000036892 00000 п. 0000037055 00000 п. 0000037209 00000 п. 0000037366 00000 п. 0000037510 00000 п. 0000037673 00000 п. 0000037824 00000 п. 0000037975 00000 п. 0000038128 00000 п. 0000038291 00000 п. 0000038444 00000 п. 0000038590 00000 н. 0000038747 00000 п. 0000038891 00000 п. 0000039050 00000 н. 0000039209 00000 п. 0000039372 00000 п. 0000039506 00000 п. 0000039648 00000 н. 0000039794 00000 п. 0000039936 00000 н. 0000040082 00000 п. 0000040237 00000 п. 0000040400 00000 п. 0000040555 00000 п. 0000040710 00000 п. 0000040867 00000 п. 0000041030 00000 п. 0000044628 00000 п. 0000044844 00000 п. 0000045075 00000 п. 0000052973 00000 п. трейлер ] >> startxref 0 %% EOF 123 0 obj> поток xb«f` (`g`H {π
cr2 + электронная конфигурация
Таким образом, электронная конфигурация иона Cr2 + Cr2 + равна [Ar] 3d4 [Ar] 3d4.Какие есть примеры электронных конфигураций? Поскольку 1s может удерживать только два электрона, следующие 2 электрона хрома переходят на 2s-орбиталь. Или, если вам нужно больше практики электронной конфигурации, вы также можете попрактиковаться в практических задачах электронной конфигурации. Какова основная электронная конфигурация элемента германия? 7324 пользователя искали это домашнее задание в прошлом месяце и 79 делают это сейчас. Давайте сделаем домашнее задание. Получите 1: 1… Найдите больше виджетов химии в Wolfram | Alpha.Это лучшее домашнее задание — уровень средней школы и относится к предмету химия. Co: [Ar] 3d7 4s2, поэтому Co2 + = [Ar] 3d7. Поскольку эти металлы становятся катионами (+), это означает, что они теряют электроны, поэтому вы оттянете их с самой внешней орбиты. Я думаю, это Cr: [Ar] 4s1,3d5, но как насчет Cr +, Cr2 +, Cr3 +? Cr2 +: [Ar] 3d4; Pd2 +: [Kr] 4d8 и т. Д. Cr (24) —-> 1s2 2s2 2p6 3s2 3p6 3d5 4s1. ПРИМЕЧАНИЕ. Напишите конфигурации электронов в том виде, в котором они указаны в периодической таблице перед текстом. Cr2 + означает, что мы удаляем 2 электрона и удаляем их с самого высокого энергетического уровня, который составляет 4s, поэтому электронная конфигурация Cr2 + равна [Ar] 3d6.Атомный номер Cr Z = 24, тогда его электронная конфигурация будет 1s2 2s2 2p6 3s2 3p6 3d5 4s1, его конденсированная электронная конфигурация просмотрите полный ответ. Электронная конфигурация Cr2 +: 1s2 2s2 2p6 3s2 3p6 3d4, поскольку атомный номер Cr равен 24, его исходная конфигурация — 1s2 2s2 2p6 3s2 3p6 4s2 3d4. 18. Переключитесь на. Cr и Cu имеют уникальные конфигурации, потому что они крадут электроны у четверок, потому что они предпочитают быть наполовину полными или полными орбиталями. Вопрос. Электронная конфигурация Cr — [Ar] 3d6 4s2 (обратите внимание, что 4s по энергии выше, чем 3d — это важно).2) Fe имеет атомный номер 26 и его электронная конфигурация [Ar] 4s23d6 Электронная конфигурация неспаренного электрона Fe3 + = [Ar] 3d5 = 5 3) Cr имеет атомный номер 24, а его электронная конфигурация — [Ar] 4s13d5 Электронная конфигурация Cr2 + = [Ar] 3d4 = 4 неспаренный электрон В этом видео мы запишем электронную конфигурацию для Ca2 +, иона кальция. Используйте только эту таблицу Менделеева для справки. Есть две возможные конфигурации для основного состояния Cr ~, которые могут быть сформированы путем удаления либо 4s (что кажется наиболее вероятным), либо 3d-электрода.Ответ эксперта. Поскольку 1s может удерживать только два электрона, следующие 2 электрона для меди переходят на 2s-орбиталь. [2011] (At, nos. La méthode du change des nombres d’oxydation est une manière facile et simple d’équilibrer les équations d’oxydoréduction. Учебные пособия. Однако атом будет стабильным, если ‘d’ орбиталь равна половине заполненные или полностью заполненные (согласно моим учебным планам). Вы можете определить электронную конфигурацию основного состояния иона хрома (Cr 2+), обратившись к периодической таблице и определив положение Cr в периодической таблице.. Основное состояние означает, что элемент находится в самой низкоэнергетической форме (не в возбужденном состоянии). Двойные электроны, которые находятся в количественной форме (mêmes trois premiers nombres), требуют наличия противоположных вращений, и эта конфигурация является благоприятной для того, чтобы сделать их удобными для параллельных вращений на разных противоположных вращениях. Следующие шесть электронов перейдут на 2p-орбиталь. означает, что элемент находится в самой низкоэнергетической форме (не в возбужденном состоянии). Решенные элементы d-блока: напишите электронную конфигурацию для каждого включенного атома, Хай, спасибо за посещение этой сети для поиска d-электронной конфигурации cr2 + mn2 +.Принцип исключения Паули. — 26708727 The… Наши преподаватели указали, что для решения этой проблемы вам необходимо применить концепцию электронной конфигурации. Учитесь с видео. Нахождение электронной конфигурации элементов. Итак, C r 2 + (22) = 3 d 4 (4 неспаренных электрона) M n 2 + (23) = 3 d 5 (5 неспаренных электронов) F e 2 + (24) = 3 d 6 (4 неспаренных электрона) нет. электронная конфигурация Cr3? Если вы забыли свой пароль, вы можете его сбросить. Какова электронная конфигурация Hg 2+? какова электронная конфигурация Cr2-? Итак, электронная конфигурация элементарного хрома такова.Какая электронная конфигурация меди? Вы можете просмотреть видеоуроки, чтобы изучить электронную конфигурацию. Дома. 0 0. махи. Следовательно, Co3 +: a. d. диамагнитный. Принцип заполнения электронами Ауфбау. 14 ноября, 2020 — Конфигурации d-электронов Cr 2+, Mn2 +, Fe2 + и Co2 + — это d4, d5, d6 и d7 соответственно. Какая из следующих конфигураций будет демонстрировать минимальное парамагнитное поведение? Нет. Сколько в нем неспаренных электронов? Cr имеет заряд, что означает, что электроны удаляются или добавляются в атом.Le processus est décrit ci-dessous. Бустерные классы. Как нарисовать диаграмму электронной конфигурации марганца? (a) Атомный номер атома Cr равен 24. т.е. поставьте 4f перед 5d Ru2 + Присоединитесь к тысячам студентов и получите бесплатный доступ к 46 часам видео по химии, которые посвящены темам, которые охватывает ваш учебник. 0 0. Как можно сравнить электронные конфигурации в одной группе? Правило максимальной множественности Хунда. В данном случае благородный газ — это Ar. Какой из следующих аквакомплексов будет демонстрировать минимальное парамагнитное поведение? Итак, как мы узнаем, когда переместить s-орбитальные электроны в d? Cr имеет заряд, что означает, что электроны удаляются или добавляются в атом.Cr имеет заряд, что означает, что электроны удаляются или добавляются в атом. 12 мин. Химия Электронная конфигурация Электронная конфигурация. Основное состояние означает, что элемент находится в самой низкоэнергетической форме (не в возбужденном состоянии). Co: [Ar] 3d7 4s2, поэтому Co2 + = [Ar] 3d7. [В первом случае связь поддерживается 3d-электронами, и удаление 4Sa5-электрона не сильно повлияет на энергию связи. Чем электронная конфигурация переходных металлов отличается от конфигурации других элементов? Помощь в домашнем задании.(4) $$ Пояснение: Хром и медь — это два особых случая, когда дело доходит до их электронных конфигураций — имея только 1 электрон за… 24 мин. Принцип исключения Паули. Учебные пособия. Пожалуйста, объясни? Пример формул определений. Компьютер записывает электронные конфигурации в форме, например, для Co, [Ar] 3d (7) 4s (2), которую мы бы записали [Ar] 3d74s2. Используя компьютерный формат, введите электронную конфигурацию иона ниже. 5 минут. c. парамагнетик с двумя неспаренными электронами. 5 минут.Учитесь с видео. во всем мире. Индивидуальные курсы, с кредитами или без них. 48. Однако ион хрома Cr3 + обладает 24e− — 3e− = 21e− из-за потери 3 своих электронов. Вы можете определить электронную конфигурацию иона хрома (Cr2 +) в основном состоянии, обратившись к периодической таблице и определив положение Cr в периодической таблице. См. Все проблемы в электронной конфигурации, видеоуроки по изучению электронной конфигурации. Учебное решение по химии: молекулярная наука, 5-е издание, Джон У.Мур Глава 20 Проблема 84QRT. б. парамагнетик с одним неспаренным электроном. Предскажите электронную конфигурацию в основном состоянии следующих ионов. Ваша панель инструментов и рекомендации. Используя полные обозначения подоболочки (не сокращения, 1s22s22p6 и т. Д.), Спрогнозируйте электронную конфигурацию каждого из следующих атомов: (a) C (b) P (c) V (d) Sb (e) Sm. Получите развернутый ответ: какова электронная конфигурация Cr? Электронная конфигурация для Cu, Cu + и Cu2 + (медь и ионы меди) При написании электронной конфигурации для меди первые два электрона будут двигаться на орбитали 1s.2 Электронная конфигурация иона Co 3+ в основном состоянии равна 1s 2s2 2p6 3s2 3p6 3d6. По мере увеличения числа неспаренных электронов магнитный момент увеличивается, и, следовательно, увеличивается парамагнитное поведение. Итак, Cr2 + (22) = 3d4 — 4 неспаренных электрона Mn2 + (23) = 3d5 — 5 неспаренных электронов Fe2 + (24) = 3d6 — 4 неспаренных электронов Ni2 + ( 26) = 3d8 -2 неспаренных электронов Итак, [Ni (h3O) 6] 2+ проявляют минимальное парамагнитное поведение. 9 лет назад. Конфигурации d-электронов Cr2 +, Mn2 +, Fe2 + и Ni2 + равны 3d4, 3d5, 3d6 и 3d8 соответственно.УЗНАТЬ БОЛЬШЕ. Сможете ли вы… 0 0. Какую научную концепцию вам нужно знать, чтобы решить эту проблему? Джуди. 19. Для электронной конфигурации благородного газа нужно найти последний благородный газ, прежде чем вы достигнете Cr. Хром — это элемент номер 24. Электронные конфигурации Запишите полные (развернутые) электронные конфигурации и основные (благородный газ) электронные конфигурации для следующих элементов. Электронная конфигурация основного состояния Cr2 + Chemistry 0. Электронная конфигурация. Ответы на 3,7 миллиона сложных вопросов.Только d4th — d7cases могут быть либо высокоспиновыми, либо низкоспиновыми. Δ Π Лиганды слабого поля: -малые Δ, высокоспиновые комплексы Лиганды сильного поля: -большие Δ, низкоспиновые комплексы Какова электронная конфигурация хрома? Дома. Принцип заполнения электронами Ауфбау. У нас есть пошаговые решения для ваших учебников, написанные специалистами Bartleby! Cr = 24, Mn = 25, Fe = 26, Co = 27) a) [Mn (h3O) 6] 2 + b) [Fe (h3O) 6] 2 + c) [Co (h3O) 6] 2 + d ) [Cr (h3O) 6] 2 + Правильный ответ — вариант «В». Исходя из этого, электрон … См. Полный ответ ниже.Итак, если у вас есть 4 электрона в 3D, как в Cr, более энергетически выгодно иметь 5 электронов в… Это обсуждение d-электронных конфигураций Cr 2+, Mn2 +, Fe2 + и Co2 +: d4, d5, d6 и d7 соответственно. Какой из следующих параметров будет демонстрировать минимальное парамагнитное поведение? Для какого профессора актуальна эта проблема? парамагнетик с четырьмя неспаренными электронами. Хром и медь — это два особых случая, когда дело доходит до их электронных конфигураций — имея только 1 электрон на орбитали # 4s #, в отличие от других переходных металлов в первом ряду, у которых есть заполненная орбиталь # 4s #.теперь электронная конфигурация в основном состоянии Cr2 + —-> 1s2 2s2 2p6 3s2 3p6 3d4. Стабильность полностью или наполовину заполненной и обменной энергии, связанной со спином электронов. Получите бесплатный виджет «Электронная конфигурация» для своего веб-сайта, блога, WordPress, Blogger или iGoogle. Помощь в домашнем задании. Какова электронная конфигурация нитрид-иона? Clutch Prep не спонсируется и не поддерживается никакими колледжами или университетами. Cr и Cu имеют уникальные конфигурации, потому что они крадут электроны у четверок, потому что они предпочитают быть наполовину полными или полными орбиталями.(5) #. Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Поскольку эти металлы становятся катионами (+), это означает, что они теряют электроны, поэтому вы оттянете их с самой внешней орбиты. 2 мин. потому что это более стабильно чем 1с2 2с2 2п6 3с2 3п6 3d4 4с2. 8 мин. 1 Ответ anor277 1 ноября 2015 г. # Z # для Cr равно 24. Как электронные конфигурации влияют на свойства и тенденции соединения? Cr = 24, Mn = 25, Fe = 26, Ni = 28) Правильная электронная конфигурация Cr 2+ называется [Ar] 3d 4.(2 +) # ion мы удаляем 1 # 4s # электрон и 1 # 3d # электрон, оставляя нас с: 41071 views Причина этого в том, что эта конфигурация минимизирует отталкивание электронов. Получите лучшую оценку с сотнями часов обучающих видео от экспертов для вашего учебника. Наполовину заполненные орбитали для # «Cr» #, в частности, является его наиболее стабильной конфигурацией. Учебное решение по химии: молекулярная наука, 5-е издание, Джон У. Мур, Глава 5 Задача 65QRT. Краткое резюме с историями. Запишите электронную конфигурацию Cr2 + и Mn4 +.8 соответственно. Электронные конфигурации для октаэдрических комплексов, например Ответы на 3,7 миллиона сложных вопросов. [M (h3O) 6] n +. Ответ: Электронная конфигурация Cr — [Ar] 3d6 4s2 (обратите внимание, что 4s по энергии выше, чем 3d — это важно). Я думал, что в общем случае мы перемещаем s-электроны в d, когда хотим, чтобы d-оболочка была заполнена наполовину или полностью. Этот ответ получил 27 «Больших благодарностей» от других студентов из таких мест, как Лейнер или Коул-Крик. (В. Какова электронная конфигурация хлорид-иона?
Oyster Reef Golf Club Reviews, Гилигилани по-английски, Играть в игры про рисование домов онлайн, Подержанное оборудование для хлебопекарен на продажу в Италии, Дэн Мерфи Ва, La Roche-posay Redermic Сыворотка, Шоколадный замороженный йогурт Рецепт Cuisinart, Шаблоны архитектуры озера данных,
WebElements Периодическая таблица »Прометий» свойства свободных атомов
Атомы прометия имеют 61 электрон, а структура оболочки равна 2.8.18.23.8.2.
Электронная конфигурация основного состояния газообразного нейтрального прометия в основном состоянии — это [ Xe ]. 4f 5 . 6s 2 , а символ — это 6 H 5/2 .
Схематическая электронная конфигурация прометия. Косселевская оболочка прометия.Атомный спектр
Представление атомного спектра прометия.
Энергии ионизации и сродство к электрону
Сродство к электрону прометия составляет 50 кДж моль ‑1 . Энергии ионизации прометия приведены ниже.
Энергии ионизации прометия.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 59.80 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 44,97 | 2п | 56,74 | ||||
| 3с | 41,18 | 3 пол. | 41,55 | 3д | 47,10 | ||
| 4s | 31,64 | 4 пол. | 30,62 | 4д | 27,74 | 4f | 23,13 |
| 5s | 18,84 | 5 пол. | 16,41 | 5д | (нет данных) | ||
| 6с | 9.40 | 6п | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E. Clementi, D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальный | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 45184 [1] |
| L I | 2s | 7428 [1] |
| L II | 19 9029 1/2 19 9029 1/2 7013 [1]||
| L III | 2p 3/2 | 6459 [1] |
| M I | 3s | — |
| M II 3п 1/2 | 1471.4 [1] | |
| M III | 3p 3/2 | 1357 [1] |
| M IV | 3d 3/2 | 1052 [1] |
| M V | 3d 5/2 | 1027 [1] |
| N I | 4s | — |
| N II | 22 4p | 242 [1] |
| N III | 4p 3/2 | 242 [1] |
| N IV | 4d 3/2 | 120 [1] |
| N V | 4d 5/2 | 120 [1] |
| N VI | 4f 5/2 | — | N | VII4f 7/2 | — |
| 5s | — | |
| O II | 5p 1/2 | — |
| O III | 5p 3/2 7 — |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона.Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Берден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
3s орбитальный график
1S ORBITAL: «1» показывает, что орбиталь находится в пределах энергетического уровня, ближайшего к ядру, в то время как «s» описывает форму орбитали (сферическая для S) То же самое касается 3s орбитали, 4s, и Т. Д… Просто большие орбитали с все меньшей и меньшей вероятностью нахождения электрона в более «простом и ограниченном» пространстве …
Мы используем файлы cookie, чтобы обеспечить вам лучший опыт на нашем веб-сайте. Ваше дальнейшее использование этого сайта означает, что вы согласны с этой политикой. Мы заботимся о вашей конфиденциальности; пожалуйста, прочтите нашу Политику конфиденциальности для получения дополнительной информации.Ok Политика конфиденциальности. Точнее, это не на 100% эквивалентно вашему вопросу (это было бы, если бы вы разрешили графам иметь цветные дуги), поскольку существуют 2-замкнутые группы перестановок $ G $ такая, что для каждой орбитали группа автоморфизмов основного (di) графа строго больше, чем $ G $.В общем, такая … 06.10.2002 · Первый график (вверху слева) — это «2s» орбитали. Каждая «s» -орбиталь может удерживать в своем облаке два электрона. Обратите внимание на то, что существует относительно высокая вероятность того, что электрон находится рядом с ядром, затем в некотором пространстве, где вероятность близка к нулю, затем вероятность существенно возрастает на некотором расстоянии от ядра. Каждый элемент в определенной группе имеет одинаковое количество валентных электронов на своей внешней орбитали. Например, литий (Li) и натрий (Na) являются членами одного клуба.Литий имеет конфигурацию валентных электронов 2s 1, в то время как натрий имеет конфигурацию 3s 1. У кальция
20 электронов. Независимо от того, что это за атом, орбитальная структура остается неизменной. В классе мы узнаем, как использовать периодическую таблицу, чтобы запомнить орбитальную структуру, а затем записать ее, используя сокращенную запись электронных конфигураций. Что следует помнить: • Каждая орбиталь может содержать 0, 1 или 2 электрона (и не более!).График убывает вместо ожидаемого увеличения.Это можно объяснить, только если учесть, что наиболее удаленный электрон находится на p-орбитали, которую он делит с другим электроном. Это создает межэлектронное отталкивание, уменьшая общую силу, удерживающую электрон на ядре, и уменьшая энергию, необходимую для удаления одного из них.
43,5 3s-орбиталь с двумя электронами со спином вверх — это … a. Невозможно б. обескураженный c. возможно при чрезвычайных обстоятельствах d.common 43.6 Нарисуйте орбитальную диаграмму и запишите электронную конфигурацию нейтрального атома, имеющего 16 электронов.43.7 Нарисуйте орбитальную схему и запишите электронную конфигурацию повторного входа нейтрального атома — Орбитальный симулятор использует реалистичную орбитальную механику, и каждая сила, приложенная к космическому кораблю, будет влиять на его положение и траекторию. Возвращение — Орбитальный симулятор вышел в раннем доступе. Игра находится в разработке с 2015 года и с тех пор получила множество обновлений.
На какой орбите находится этот электрон? a.3s d. 3f b.3p e.4p c. 3d 4. Какой элемент содержит полную 3с орбиту? … Есть два исключения из этого правила токарного графика …6 Различайте атомную орбиталь и орбиту. 7 Опишите: ориентацию формы b на множестве трехмерных осей i s-орбитали ii орбитали py. 8 На наборе трехмерных осей нарисуйте орбиталь pz и орбиталь px. 9 Перечислите следующие подоболочки в порядке убывания энергии: 3p, 2s, 4s, 4p, 3d
Это полное решение охватывает следующие ключевые темы: электрон, орбиталь, кислород, конфигурации, непарные.Это обширное руководство по выживанию из учебника охватывает 82 главы и 9464 решения. Ответ на «Орбитальные диаграммы и электронные конфигурации. Нарисуйте орбитальную диаграмму для электронной конфигурации кислорода, атомный номер 8. 1S ОРБИТАЛЬНЫЙ»: «1» показывает, что орбиталь находится в пределах энергетического уровня, ближайшего к ядру, а «s» описывает форма орбитали (сферическая для S) То же самое и для орбиталей 3s, 4s и т.д … Просто более крупные орбитали с все меньшей и меньшей вероятностью обнаружения электрона в более «простом и ограниченном» пространстве…
1. Подготовка графика зависимости показания весов в граммах от количества неспаренных электронов в его орбитальной записи. 2. (а) Сравните орбитальные обозначения веществ, исследованных в этом эксперименте, с их притяжением к магниту. Какую уникальную особенность орбитальной записи можно использовать для предсказания притяжения к магниту?30 июня 2008 г. · Приведены результаты расчетов тройного дифференциального сечения ионизации орбитали Ar (3s) электронным ударом в компланарной асимметричной геометрии с использованием модифицированных методов борновского приближения искаженных волн.Настоящие расчеты показывают, что поляризационные эффекты очень важны для 3s -оболочечной ионизации аргона.
Ниже показаны контурные графики, нанесенные на карты плотности цвета волновых функций в двух симметриях, равносторонней и коллинеарной. эВ. Из-за разницы в энергии их атомных орбиталей 1s-орбиталь водорода и 3s-орбиталь серы взаимодействуют лишь слабо; на диаграмме это показано небольшой стабилизацией молекулярной орбитали с наименьшей энергией по отношению к 3s-орбитали серы.Интернет-диаграмма. İTÜ Hazırlık Ortalama Hesaplayıcı. İyonların elektronları orbitallere yerleştirilirken, öncelikle en az enerjili orbital doldurulmaya başlanır (Aufbau ilkesi). Örneğin atom numarası 7 olan azot atomunun elektron dağılımını şu şekilde yazabiliriz; «1с2 2с2 2п3)».
1. Меркурий — самая маленькая планета Солнечной системы. 2. Орбитальная скорость Меркурия 47,8 км / сек (29,7 миль / сек). 3. У Меркурия нет атмосферы и известных спутников, возможно, из-за его близости к Солнцу.4. Диаметр планеты Меркурий составляет 4878 км (3031 миль). 5. Первое посещение Меркурия […]100Орбитальная энергия в зависимости от атомного номера 1000 10000 100000 0 5 10 15 20 1s 2s 2p 3s 3p Атомный номер Li Чем отрицательнее энергия, тем сильнее удерживается электрон. (Падение энергии при объединении электрона и ядра из-за разделения ∞) Ne Этот график показывает, как уровни энергии для первых 18 элементов в периодической таблице
Есть одна 3s орбиталь, три 3p орбитали и пять 3d подуровней.Сколько электронов может удерживать 3p-орбиталь? Это химический элемент. Вы можете узнать, сколько электронов в одном атоме, используя … Электронная конфигурация для Cr 3+: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3. (Напомним, что ионизация атома удаляет электрон с орбитали. с высшим принципиальным квантом.) Ион Cr 3+, таким образом, является ионом ad 3. Как три электрона распределены по пяти трехмерным орбиталям?
Three.js — 3D-библиотека JavaScript … представить проектSuchen Sie nach S Orbital Probability Density Graph-Stockbildern в HD и миллионах пользователей со снимками, иллюстрациями и векторными изображениями в Shutterstock-Kollektion.Jeden Tag werden Tausende neue, hochwertige Bilder hinzugefügt.
Гл. 2 — относительные орбитальные уровни атома водорода … Гл. 2 — Сколько орбиталей в атоме может иметь … Гл. 2 — Сколько электронов в атоме может иметь … Гл. 2 — Укажите максимальное количество электронов в атоме … Гл. 2 — Укажите максимальное количество электронов в атоме … Гл. 2 — Нарисуйте атомные орбитальные диаграммы, представляющие … — Тракторную систему Плутарха, доступную в: Бакура (штаб Плутарха) и Корусант (Орбитальная система щитов).- Оригинальные корабли X3 Race будут доступны в определенных секторах, принадлежащих их родительской расе. Это полное решение охватывает следующие ключевые темы: электроны, орбитали, кислород, конфигурации, непарные. Это обширное руководство по выживанию из учебника охватывает 82 главы и 9464 решения. Ответ на «Орбитальные диаграммы и электронные конфигурации. Нарисуйте орбитальную диаграмму для электронной конфигурации кислорода, атомный номер 8.
20 марта 2019 г. · Квантовая механика, разработанная Эрвином Шредингером в 1926 году, основана на волновом движении, связанном с частицы.Для волнового движения электрона в трехмерном пространстве вокруг ядра он выдвинул уравнение, известное как волновое уравнение Шрондингера. где ψ — амплитуда волны, где координаты […]unsur As memiliki konfigurasi elektron dalam orbital seperti berikut: 1s 2 2s 2 2p 6 3s 2 3p 6 3d … Запись формы пересечения наклона из графика. 412 пьес. Математика — 8-е …
Темы автоморфизмов и реконструкции графов. Орбитальные графы и сильно регулярные графы. Мы увидим, что, как и графы смежных классов, любой вершинно-транзитивный граф является (обобщенным) орбитальным графом.Более того, это описание дает нам в принципе критерий дуговой транзитивности.
Решение Шаг 1 Эффективный заряд ядра Zeff = ZS Где Z — атомный номер S — константа экранирования Предполагая, что вклад электронов остова составляет 1,00, а вклад валентных электронов составляет 0,00 в константу экранирования S для 3s электрона в P, можно найти, как показано ниже. , электронная конфигурация 1s 2s 2p 3s 3p2 3 Таким образом, количество сердечников …Иллюстрация формы орбиталей 1s, 2s и 3s.Подоболочка s может содержать максимум два электрона, так как существует только одна орбиталь. S-орбитали имеют сферическую форму и увеличиваются в размерах с увеличением уровня энергии или оболочки.
Теперь давайте сопоставим это с правильным молекулярно-орбитальным объяснением. Начнем с потенциальной молекулы Be 2. Диаграмма МО хорошо объясняет отсутствие химической связи Be-Be; как & # X3C3; s связующая орбиталь и & # X3C3; s * разрыхляющие орбитали заполнены, что не приводит к чистому связыванию. а. Электрон на 3s-орбитали более защищен, чем электрон на 2s-орбитали.б. Электрон на 3s-орбитали проникает в область, занятую остовными электронами, больше, чем электроны на 3p-орбитали. c. Электрон на орбитали, которая проникает ближе к ядру, всегда будет испытывать большую защиту, чем электрон на орбитали, которая … Два электрона заполняют орбиталь 1s, а третий электрон затем заполняет орбиталь 2s.

 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.


 Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных р-электронов на внешнем слое. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных р-электронов на внешнем слое. Запишите в поле ответа номера выбранных элементов. Электронная конфигурация азота, таким образом, 1 с 2 2 с 2 2 p 3 .
Электронная конфигурация азота, таким образом, 1 с 2 2 с 2 2 p 3 .
 2 Электронные конфигурации первых 18 элементов
2 Электронные конфигурации первых 18 элементов
Leave A Comment