ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §8 Вещества молекулярного и немолекулярного строения » Крутые решение для вас от GDZ.cool
ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §8 Вещества молекулярного и немолекулярного строения
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам.
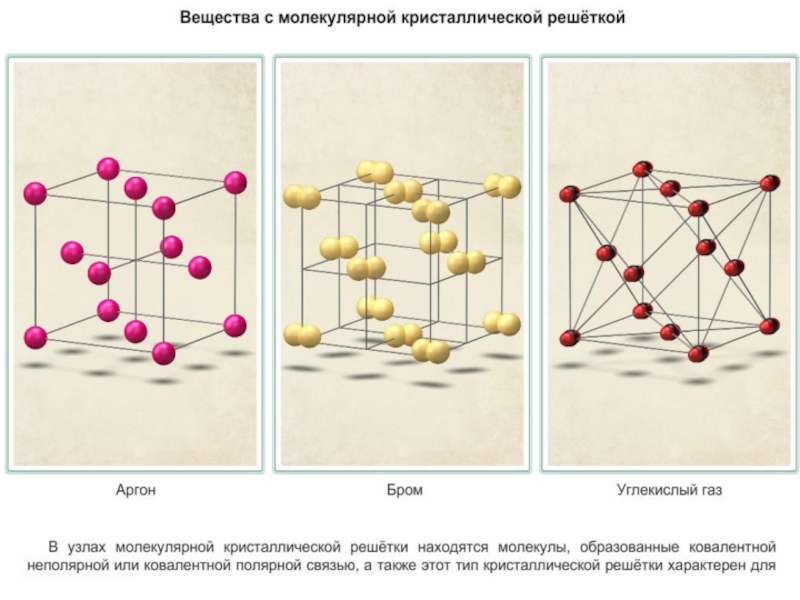
С молекулярным строением: вода, кислород, азот, водород, углекислый газ, хлор, бром, аммиак.
С немолекулярным строением: алмаз, кремний, хлорид натрия, медь, алюминий.
Вещества с молекулярным строением чаще всего газы и жидкости, имеют низкие температуры плавления, а с немолекулярным ― твердые вещества, имеют высокие температуры плавления.
Задание 2 Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет – молекулярное или немолекулярное.
Можно определить. Вещества с молекулярным строением, в отличии от веществ с немолекулярным строением, чаще всего газы и жидкости, имеют более низкие температуры плавления и кипения.
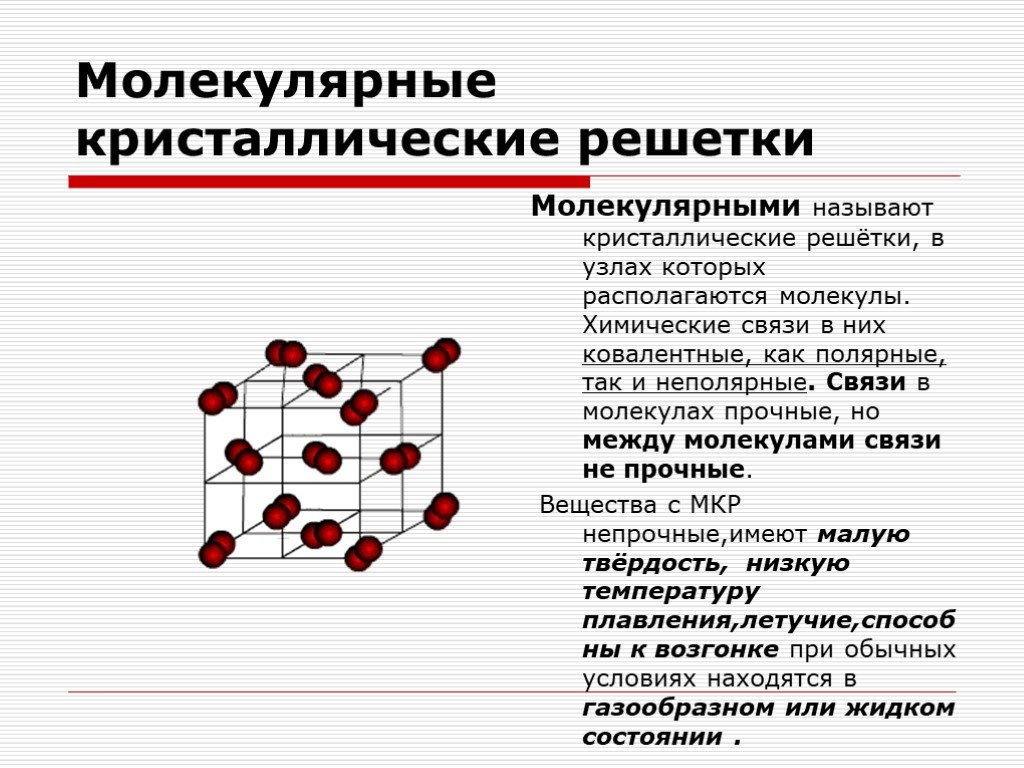
Задание 3 Какие типы кристаллических решёток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решётки. Составьте схему: типы кристаллических решёток.
| Типы кристаллических решёток: | Атомная | Молекулярная | Ионная |
| В узлах решётки располагаются: | атомы | молекулы | противоположно заряженные ионы |
| Свойства веществ: | твердые, температура плавления очень высокая, нелетучие | хрупкие, температура плавления низкая, летучие | твердые, температура плавления высокая, нелетучие |
| Примеры веществ: | алмаз, графит, кремний | вода, кислород, иод, аммиак | поварённая соль, сульфид железа |
Задание 4 Углекислый газ при нормальном давлении переходит в твёрдое состояние при температуре около -70°С, а речной песок (кремнезём) плавится при температуре около 1700°C. Какие выводы о строении этих веществ в твёрдом состоянии можно сделать?
Какие выводы о строении этих веществ в твёрдом состоянии можно сделать?
ТЕСТ 1
Для углекислого газа характерна кристаллическая решётка:
1) молекулярная
2) атомная
3) ионная
Ответ: 1)
ТЕСТ 2
Установите соответствие между типом кристаллической решётки вещества и его свойствами.
| кристаллической решётки вещества | Свойства |
| 1) молекулярная 2) ионная 3) атомная | А. твёрдое, тугоплавкое, не растворяется в воде Б. хрупкое, легкоплавкое, не проводит электрический ток В. твёрдое, тугоплавкое, хорошо растворяется в воде |
Ответ 1) ― Б, 2) ― В, 3) ― А
Другие задания смотри здесь…
Меню сайта | ГДЗ к § 08.
| Новые файлы Статистика Онлайн всего: 1 Гостей: 1 Пользователей: 0 | |||||||||||||||
Кристаллы диоксида углерода
Кристаллы диоксида углерода| Главная OPOD Новости Лучи и тени Капли воды Радуга Ледяные ореолы Содержание Кристаллы Частые ореолы Нечастые ореолы Несколько дисплеев Другие миры Марс CO2 Кристаллы Юпитер Сатурн Наблюдение за гало HaloSim Высокая атмосфера Ссылки и ресурсы Поиск — индекс |
| ||||
|
| Пока нет знать, какие формы кристаллы CO2 на самом деле имеют на Марсе
облака — но мы можем делать разумные прогнозы. Все кристаллы принадлежат к одной из шести систем симметрии. Водяной лед в Перистые облака Земли, Ice Ih , имеют гексагональную симметрию и образует шестиугольные призмы и пирамиды. Напротив, твердый углекислый газ имеет кубическую симметрию. Это не означает, что CO2 кристаллизуется только в
микроскопические кубики. Представьте, что вы идете вокруг невероятно увеличенного кристалла. Микроскопический СО2-лед был обнаружен еще в 1912 году (ссылка 1) иметь кубические, октаэдрические и кубооктаэдрические кристаллы, а недавно (ссылка 2) они были перефотографированы с использованием современных технологий. Все эти могут существовать в облаках, а также могут существовать ромбододекаэдрические кристаллы. Каждая из этих кристаллических форм может также иметь форму плоских тромбоцитов. — представьте, что форма получается путем механической обработки противоположных граней обычный кристалл. Как и в случае с земными кристаллами, форма плиты позволяет даже более увлекательные возможности гало! Наконец, CO2 прозрачен в видимом диапазоне длин волн.
и обладает гораздо более сильным преломлением, чем водяной лед. Вооружившись этим
прогнозы и данные вполне можно делать точные прогнозы
возможных гало в марсианском небе. | |||
| Последние электронные микрофотографии лабораторных кристаллов CO2. Вверху кубооктаэдр, в нижней рамке несколько октаэдров. Эти некоторые кристаллы имеют диаметр менее микрона и не образуют ореолов. и, конечно, существование в лаборатории не является доказательством того, что эти формы происходят в облаках! | |||
| Арт. 1 | (а)
ОН. Бенкен, Phys. Rev. 35, 66-73 (1912) (b) W. Wahl, Z. Physik. хим. 88, 129-171 (1914) | ||
| Арт. 2 | (а)
Вергин, В. П., Дж. Л. Фостер, А. Т. С. Чанг, Д. К. Холл, А. Ранго и
Э. Ф. Эрбе. 1997. Структура кристаллов углекислого газа (марсианский снег) как
наблюдается в репликах ПЭМ и низкотемпературных изображениях СЭМ. микроск. и
Микроанализ. (доп. 2): 1235-36. Эрбе. 1997. Структура кристаллов углекислого газа (марсианский снег) как
наблюдается в репликах ПЭМ и низкотемпературных изображениях СЭМ. микроск. и
Микроанализ. (доп. 2): 1235-36. (b) Фостер, Дж. Л., В. П. Вергин, Э. Эрбе, А. Т. С. Чанг и Д. К. Холл. 1997. Наблюдения и сравнения кристаллов h3O (снега) и CO2. с помощью низкотемпературной сканирующей электронной микроскопии. Семинар на удаленке зондирование планетарных льдов: Земли и других твердых тел. Флагстафф, Аризона Июнь. | ||
физическая химия — Почему силикаты твердые, а углекислый газ — газ?
спросил
Изменено 1 год, 9 месяцев назад
Просмотрено 84k раз
$\begingroup$
У меня сложилось впечатление, что в химии почти исключительно участвуют валентные электроны, потому что не хватает энергии, чтобы оторвать электроны, расположенные ближе к ядру.
Если это так, и элементы одного и того же периода имеют схожие свойства, потому что у них одинаковое число валентных электронов, то почему $\ce{SiO2}$ является твердым телом, а $\ce{CO2}$ – газом? Конечно, разница в массе в 2,5 раза не может быть такой уж большой проблемой.
Это из-за разницы сил Ван-дер-Ваальса, потому что кремний имеет дополнительные электроны, в результате чего соединения, образованные из него, более симметричны, чем соединения, образованные из углерода?
- физико-химия
- кристаллическая структура
- семейство углерода
- оксиды
- диоксид углерода
$\endgroup$
6
$\begingroup$
Причина, по которой двуокись углерода является газом, а двуокись кремния — твердым телом, заключается в том, что их химические структуры различны.
Двуокись углерода представляет собой линейную структуру с двумя двойными связями между углеродом и кислородом. Это небольшая и неполярная молекула со слабыми связями между молекулами. Следовательно, это газ.
Диоксид кремния не состоит из малых молекул. Он состоит из бесконечного множества силиконов, где каждый кремний связан с четырьмя отдельными атомами кислорода (и каждый кислород делится между двумя кремниями). Это создает сильное тугоплавкое твердое вещество (стекло и песок в основном состоят из диоксида кремния, также известного как кремнезем). Таким образом, та же кажущаяся общая формула не описывает фактических состав соединений вообще. Но структур объясняют разницу в поведении.
Конечно, это не объясняет , почему кремний предпочитает связываться с четырьмя атомами кислорода, тогда как углерод предпочитает только два. Это не совсем просто и является результатом относительной прочности связей углерод-кислород, двойных связей углерод-кислород и эквивалентных связей для кремния и кислорода. Простая версия состоит в том, что кремний-кислородные связи сильнее по сравнению с их эквивалентами с двойной связью, тогда как двойные связи углерод-кислород сильнее по сравнению с их эквивалентами с одинарными связями. Или, точнее, если бы мы могли сделать углеродно-кислородную сеть твердой со структурой, эквивалентной кремнезему, она бы рассыпалась на двуокись углерода. Если бы мы могли создать молекулы диоксида кремния, они бы реагировали с выделением энергии, образуя кремнезем.
Простая версия состоит в том, что кремний-кислородные связи сильнее по сравнению с их эквивалентами с двойной связью, тогда как двойные связи углерод-кислород сильнее по сравнению с их эквивалентами с одинарными связями. Или, точнее, если бы мы могли сделать углеродно-кислородную сеть твердой со структурой, эквивалентной кремнезему, она бы рассыпалась на двуокись углерода. Если бы мы могли создать молекулы диоксида кремния, они бы реагировали с выделением энергии, образуя кремнезем.
Для более глубоких объяснений нужно было бы посмотреть, почему относительные силы двойных и одинарных связей оказались такими, но это попало бы в молекулярную квантовую механику и было бы не намного полезнее в качестве объяснения.
Самое простое объяснение состоит в том, что структуры разные.
$\endgroup$
2
$\begingroup$
Если вы посмотрите на кристаллическую структуру диоксида кремния ($\ce{SiO2}$), вы увидите, что он состоит из тетраэдров (один кремний окружен 4 атомами кислорода), и эти тетраэдры, в свою очередь, связаны друг с другом, и впоследствии образуют двумерную сеть, которая достаточно велика, чтобы сделать это вещество твердым.
Кроме того, большое значение имеет коэффициент 2,5 по массе, но он не имеет отношения к данному обсуждению. Я бы порекомендовал прочитать любую книгу по неорганической химии, где такие темы подробно обсуждаются. Силы Ван-дер-Ваальса играют существенную роль только в длинноцепочечных углеводах, таких как жиры, и практически не наблюдаются в «неорганических» молекулах.
Молекулы $\ce{CO_2}$ не могут образовать кристалл так, как это делают единицы $\ce{SiO2}$, и я не думаю, что должен объяснять, почему. Кроме того, у него нет ни дипольного момента, ни ван-дер-ваальсовых сил между молекулами.
$\endgroup$
6
$\begingroup$
Элементы ответа также содержатся в других ответах здесь, но это требует дополнительной поддразнивания. Это связано с энергиями связи CO, Si-O, C=O и Si=O. У меня нет под рукой цифр, но поработайте, и они укажут вам, что углерод наиболее стабилен в форме $\ce{CO2}$, а кремний наиболее стабилен в виде тетраэдрической сетки (подобно алмазу.

 Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения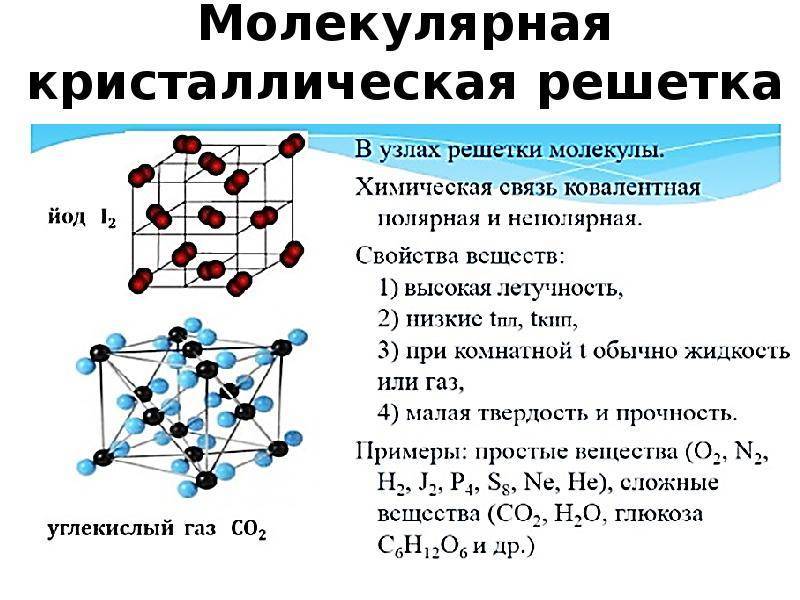


 Слева направо, куб.
кубооктаэдрические, октаэдрические и ромбододекаэдрические формы. Кристаллы
не обязательно должны быть правильными при условии сохранения межфазных углов,
как в привычке кубооктаэдрических пластинок.
Слева направо, куб.
кубооктаэдрические, октаэдрические и ромбододекаэдрические формы. Кристаллы
не обязательно должны быть правильными при условии сохранения межфазных углов,
как в привычке кубооктаэдрических пластинок.  где видны отдельные атомы. Они лежат очень упорядоченными рядами
и самолеты — в нескольких конкретных направлениях есть четкие проспекты
и пути через решетку. Это направления, принятые
хрустальные грани. Фасеты, идущие в других направлениях, повлекут за собой
общее увеличение энергии и беспорядка и будет менее стабильным. Таким образом, каждый
из шести кристаллографических систем симметрии, в свою очередь, дает ограниченное
количество точных кристаллов формы . Решетка кубической симметрии
могли дать кубическую, октаэдрическую, двенадцатигранную робо-додекаэдрическую и другие
более сложные кристаллы. Комбинации этих форм могут
встречаются и так кубооктаэдры, твердые тела с шестью гранями, имеющими одинаковое направление
как куб и еще восемь, как октаэдр, также могут встречаться. Как с
гексагональный водяной лед, кристаллы не обязательно должны быть правильными — при условии, что поверхность раздела
углы остаются постоянными.
где видны отдельные атомы. Они лежат очень упорядоченными рядами
и самолеты — в нескольких конкретных направлениях есть четкие проспекты
и пути через решетку. Это направления, принятые
хрустальные грани. Фасеты, идущие в других направлениях, повлекут за собой
общее увеличение энергии и беспорядка и будет менее стабильным. Таким образом, каждый
из шести кристаллографических систем симметрии, в свою очередь, дает ограниченное
количество точных кристаллов формы . Решетка кубической симметрии
могли дать кубическую, октаэдрическую, двенадцатигранную робо-додекаэдрическую и другие
более сложные кристаллы. Комбинации этих форм могут
встречаются и так кубооктаэдры, твердые тела с шестью гранями, имеющими одинаковое направление
как куб и еще восемь, как октаэдр, также могут встречаться. Как с
гексагональный водяной лед, кристаллы не обязательно должны быть правильными — при условии, что поверхность раздела
углы остаются постоянными. Относительные размеры граней могут изменяться для получения
разнообразие привычки каждой формы.
Относительные размеры граней могут изменяться для получения
разнообразие привычки каждой формы.
Leave A Comment