Что такое устьица и для чего их используют растения? Садоводство
Хотя мы видим, что растения развиваются нормально, перед ними постоянно стоит большая дилемма. Они должны попытаться получить как можно больше углекислого газа в процессе фотосинтеза и удержать как можно больше воды. Чтобы поглощать углекислый газ из атмосферы, им нужны органы, известные как устьица. Это специализированные клетки, которые находятся в эпидермисе растений и выполняют эту функцию.
В этой статье мы расскажем вам все, что вам нужно знать об устьицах и их функциях у растений.
Индекс
- 1 Что такое устьица
- 2 Características principales
- 3 Виды листьев в зависимости от расположения устьиц
Что такое устьица
В атмосфере присутствует углекислый газ, но он очень разбавлен. Только 0.03% воздуха, содержащегося в атмосфере, составляет углекислый газ. . Следовательно, им нужны определенные органы, чтобы они могли поглощать этот газ и осуществлять фотосинтез. Органами, отвечающими за поглощение углекислого газа, являются устьица. Эти устьицы представляют собой не что иное, как поры или отверстия, которые можно регулировать и которые можно найти в эпидермальной ткани. Они состоят из пары специализированных ячеек, называемых окклюзионными ячейками.
. Следовательно, им нужны определенные органы, чтобы они могли поглощать этот газ и осуществлять фотосинтез. Органами, отвечающими за поглощение углекислого газа, являются устьица. Эти устьицы представляют собой не что иное, как поры или отверстия, которые можно регулировать и которые можно найти в эпидермальной ткани. Они состоят из пары специализированных ячеек, называемых окклюзионными ячейками.
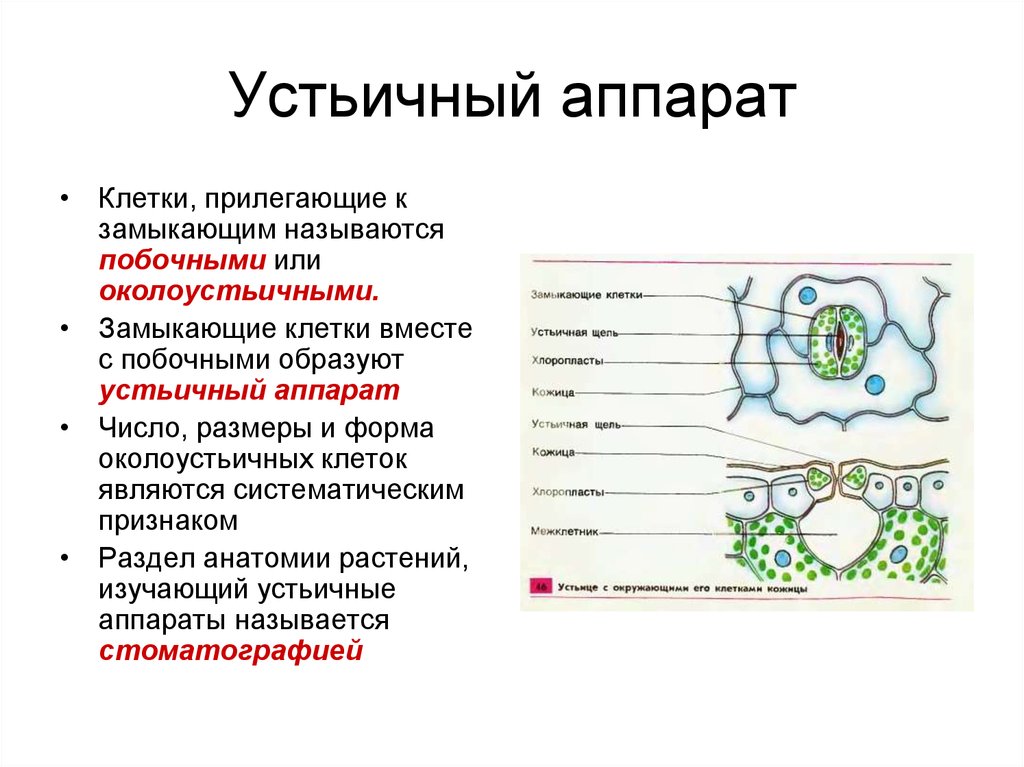
Пора, которая формируется через устьица, называется остиолой. Остиолус отвечает за сообщение с растением с полостью, называемой субоматической камерой. По бокам каждой окклюзионной клетки обычно находится несколько эпидермальных клеток, которые называются вспомогательными клетками или дополнительными клетками. Когда дело доходит до открытия или закрытия устьиц, это контролируют окклюзионные клетки.
Подпишитесь на наш Youtube-канал
Можно сказать, что устьица Они представляют собой интерфейс между окружающей средой и растением. Происхождение этих устьиц, скорее всего, возникло, когда растения изменили свою естественную среду из водной части и заселили землю.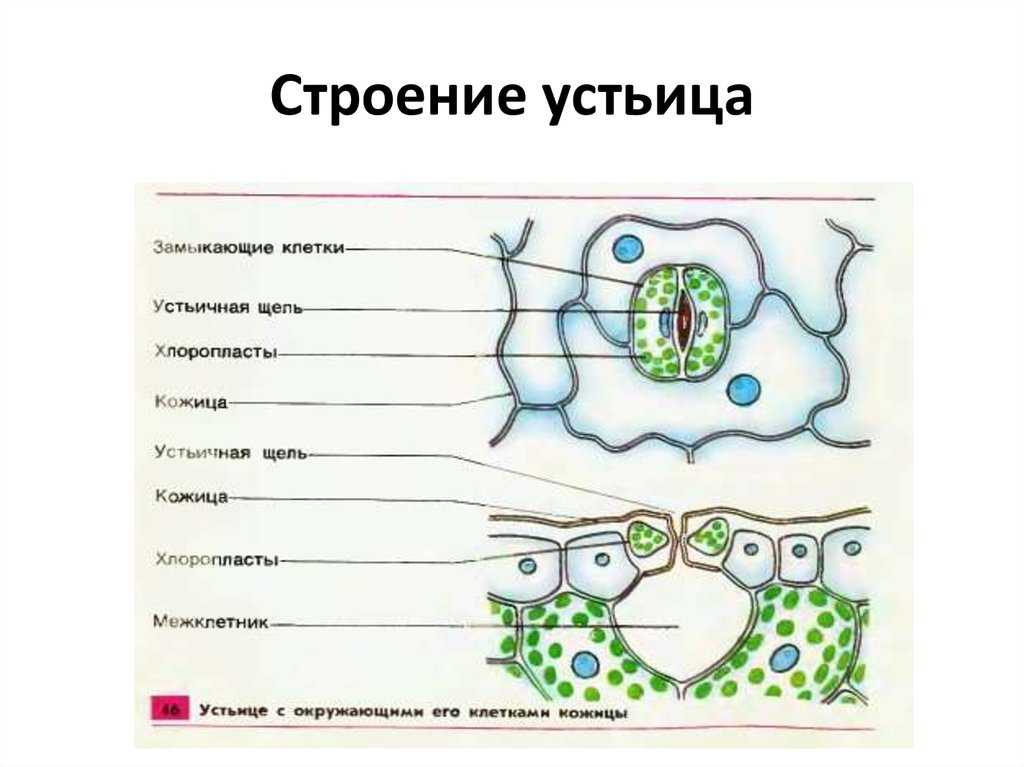 Был изменен способ включения растворенного в окружающей среде диоксида углерода. От проникновения через растворенный в воде углекислый газ до необходимости фильтровать его из воздуха.
Был изменен способ включения растворенного в окружающей среде диоксида углерода. От проникновения через растворенный в воде углекислый газ до необходимости фильтровать его из воздуха.
Características principales
Устьицы присутствуют в эпидермисе всех надземных частей растения. Эти надземные части составляют
На сегодняшний день ни один из этих органов не обнаружен у водорослей, грибов или других паразитарных растений, не содержащих хлорофилла. Однако они присутствуют в мохообразные, птеридофиты и сперматофиты. В зависимости от типа листа у него обычно большее количество устьиц. И это воздушная часть, которая имеет наибольшее количество газов для обмена с атмосферой.
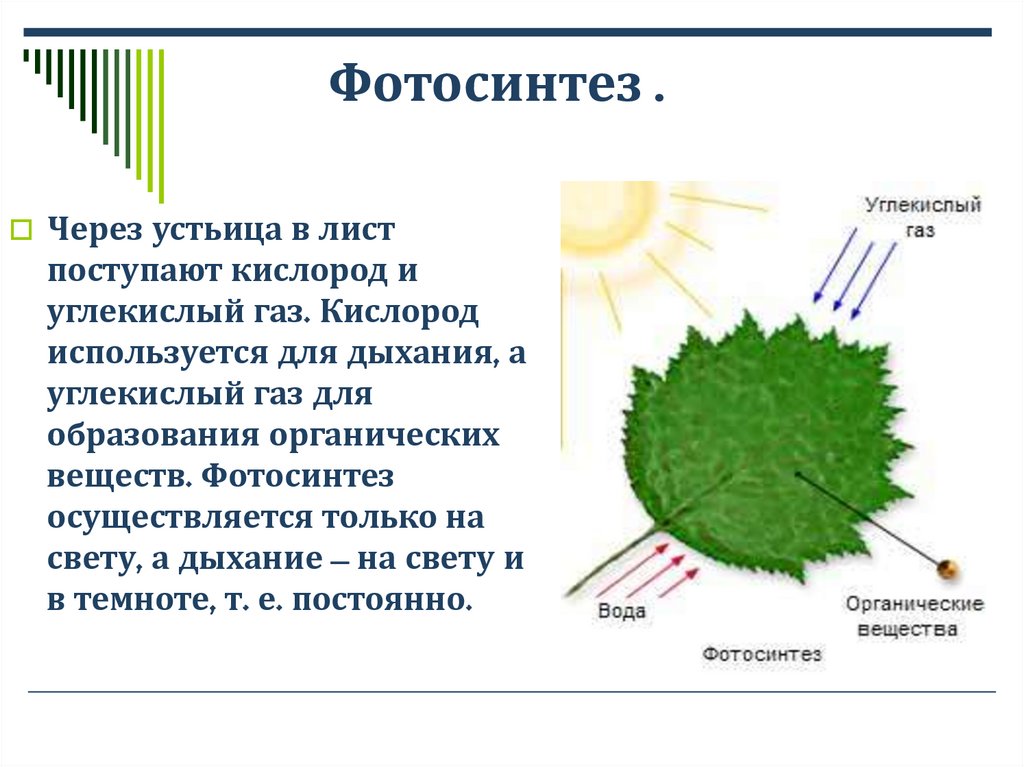
Одна из проблем, с которыми растения сталкиваются во время засухи или летом, — потеря воды из-за этого газообмена. И дело в том, что при открытии устьиц происходит обмен не только газов изнутри растения наружу, но и часть воды, находящейся внутри растения, испаряется. По этой причине фотосинтез необходимо постепенно увеличивать в то время дня, когда температура ниже, а количество потоотделения минимально. Таким образом, растения гарантируют меньшую потерю воды за счет этого газообмена.
И дело в том, что при открытии устьиц происходит обмен не только газов изнутри растения наружу, но и часть воды, находящейся внутри растения, испаряется. По этой причине фотосинтез необходимо постепенно увеличивать в то время дня, когда температура ниже, а количество потоотделения минимально. Таким образом, растения гарантируют меньшую потерю воды за счет этого газообмена.
Вопреки распространенному мнению, существует множество растений, которые
Чтобы уменьшить количество солнечного излучения на устьицах и поверхности растения в целом, будет меньше потери воды из-за потоотделения.
Виды листьев в зависимости от расположения устьиц
Как мы уже упоминали ранее, листья — это те части растений, у которых больше всего устьиц. Это потому, что они являются частями, есть дни, которые организованы более оптимальным образом, чтобы иметь возможность обмениваться этими газами с атмосферой. В зависимости от количества устьиц и места их нахождения он будет называться по-разному.
Вот имена, которые они получают в зависимости от своего местоположения:
- Эпиестоматика: Это листья, у которых устьица есть только на адаксиальной грани или пучке. Эти растения обычно требуют длительного пребывания на солнце в конце дня. Это единственный способ, которым они могут обмениваться газами с атмосферой и осуществлять фотосинтез.
- Гипостоматический: те листья, у которых есть устьица только на нижней или нижней стороне. Эти типы листьев наиболее часто встречаются практически на всех деревьях. И дело в том, что, вопреки распространенному мнению, именно нижняя сторона листьев, где расположены устьица, служит для обмена этими газами с атмосферой.

- Амфистоматический: это листья с устьицами с обеих сторон. Хотя у них есть устьица с обеих сторон, желательно, чтобы их было больше внизу. Это происходит в основном с растениями семейства травянистых.
Необходимо учитывать, что в зависимости от вида, ареала распространения, экосистемы, климата, количества солнечных лучей, количества осадков и т. Д. Будут разные виды растений, которые могут адаптироваться к этим условиям окружающей среды. Таким образом, мы можем наблюдать, что частота или плотность числа устьиц растения может широко варьироваться.
Я надеюсь, что с этой информацией вы сможете больше узнать об устьицах и их функциях у растений.
Устьица вьюнка • Олег Соколенко • Научная картинка дня на «Элементах» • Ботаника
На этом снимке, который был отмечен жюри международного конкурса микрофотографии Nikon’s Small World — 2020, запечатлена поверхность листа вьюнка (
 Клетки эпидермиса имеют извилистые края, что повышает площадь контакта их стенок и придает соединениям прочность. Среди клеток эпидермиса видны устьица — поры, состоящие из пары замыкающих клеток и устьичной щели между ними.
Клетки эпидермиса имеют извилистые края, что повышает площадь контакта их стенок и придает соединениям прочность. Среди клеток эпидермиса видны устьица — поры, состоящие из пары замыкающих клеток и устьичной щели между ними.Устьица возникли у растений, когда они вышли из воды на сушу. Назначение устьиц — обеспечивать растению газообмен (то есть поглощать углекислый газ и выделять кислород в ходе фотосинтеза, выделять углекислый газ и поглощать кислород в процессе дыхания), сводя при этом к минимуму испарение воды. Испарение происходит только когда устьица открыты и только из межклетников — расположенных под ними микропустот, воздух в которых насыщен водяным паром. Остальная поверхность листьев покрыта непроницаемым для воды воскообразным слоем — кутикулой (ее вырабатывают клетки внешнего покровного слоя — эпидермиса). Испарение воды через устьица — транспирация — создает ток воды через растение. 99–99,5% воды при транспирации испаряется через устьица, остальная усвоенная корнями из почвы вода тратится на нужды роста и метаболизма растения.
Длина устьичной щели колеблется от 0,01 до 0,06 мм, крупнее бывают устьица полиплоидных растений и у листьев, растущих в тени, где испарение происходит менее интенсивно. Самые крупные устьица — 0,12 мм — были обнаружены у вымершего растения
Устьиц больше на листьях, но на стебле они тоже есть: интенсивность стеблевого фотосинтеза может достигать 60% от интенсивности листового. У двудольных растений, как правило, больше устьиц находится с нижней стороны листа, которая меньше нагревается днем на солнце (хотя у водных растений, листья которых лежат на поверхности воды, устьица, по понятной причине, есть только сверху). У таких однодольных, как злаки, листья ориентированы вертикально, освещенность обеих их сторон примерно одинакова, как и плотность устьиц.
Плотность расположения устьиц, от которой зависит интенсивность фотосинтеза, варьирует не только у особей одного вида, но даже у листьев одного растения и зависит от внешних факторов, связанных с обеспечением растения водой. Например, недавно было показано, что увеличение засоленности почвы существенно снижает устьичный индекс — отношение числа замыкающих клеток устьиц к общему числу клеток эпидермиса на единице ее поверхности. Проще говоря, устьиц на листьях растений, растущих на таких почвах, становится меньше — видимо, из-за снижения интенсивности транспирации: из засоленной почвы корням труднее усваивать воду.
Например, недавно было показано, что увеличение засоленности почвы существенно снижает устьичный индекс — отношение числа замыкающих клеток устьиц к общему числу клеток эпидермиса на единице ее поверхности. Проще говоря, устьиц на листьях растений, растущих на таких почвах, становится меньше — видимо, из-за снижения интенсивности транспирации: из засоленной почвы корням труднее усваивать воду.
У растений, живущих в жарких странах, — например, ананаса или толстянковых — выработалось еще одно приспособление: они раскрывают устьица в темное время суток, когда воздух прохладнее и воды испаряется меньше. При этом усвоенный в темноте из воздуха углекислый газ они запасают в виде яблочной кислоты, чтобы днем использовать его для фотосинтеза, уже с закрытыми устьицами (такой тип называется CAM-фотосинтез, от crassulacean acid metabolism (CAM) — «кислотный метаболизм толстянковых»).
Через устьица в ткани растений могут проникать не только газообразные вещества, но и патогенные бактерии.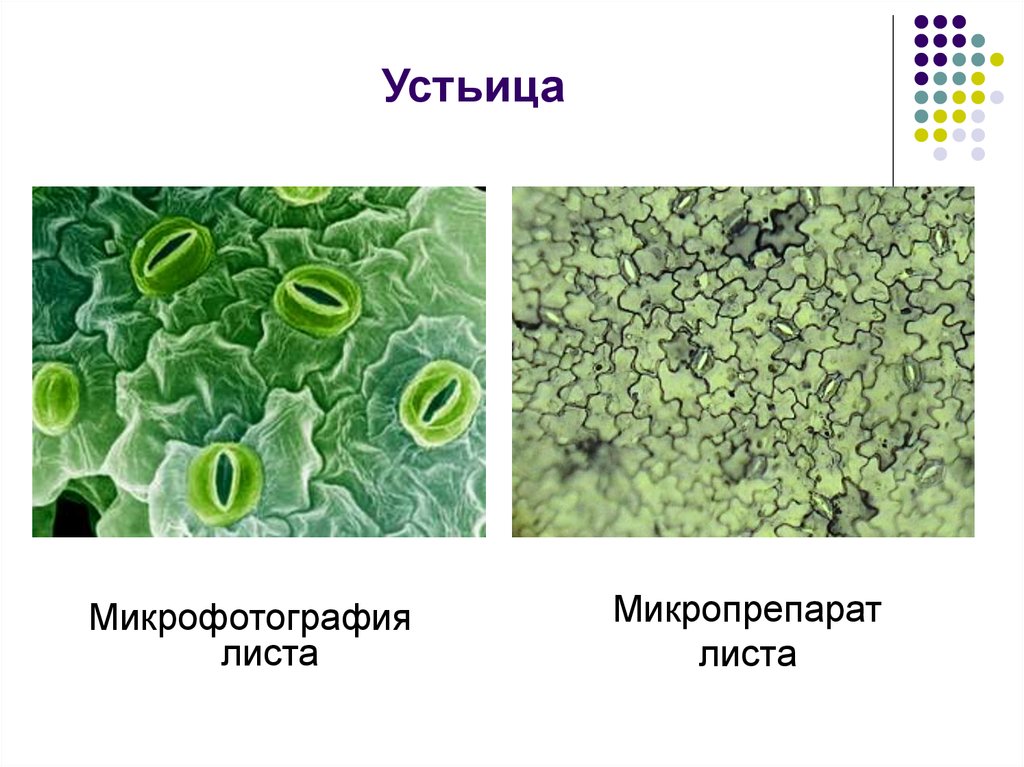 Известно, что бактерия Pseudomonas syringae, вызывающая у многих растений бурую пятнистость, выделяет вещество коронатин (см. Coronatine), способствующее открыванию устьиц.
Известно, что бактерия Pseudomonas syringae, вызывающая у многих растений бурую пятнистость, выделяет вещество коронатин (см. Coronatine), способствующее открыванию устьиц.
Механизм работы устьиц определяется их строением, которое изучает специальный раздел анатомии растений — стоматография (от греческого στόμα ‘рот’). Устьичный аппарат состоит из двух замыкающих клеток, которые непосредственно открывают и закрывают щель, и прилегающих к ним побочных клеток эпидермиса (на главном фото их можно опознать по «волосам» — токам воды). Замыкающие клетки имеют более толстые стенки вдоль щели; когда в этих клетках (точнее, в их вакуолях) становится больше воды, она сильнее растягивает внешние тонкие стенки, а внутренние толстые втягиваются внутрь, и щель открывается.
Замыкающие клетки набухают после того, как «протонный насос» выкачивает из них протоны (ионы H+). Вместо них из побочных клеток через каналы в мембранах поступают ионы калия (K+). После этого вода начинает проникать в замыкающие клетки из окрестных клеток эпидермиса, пытаясь выровнять между ними концентрацию ионов калия — этот процесс называется осмосом. При закрывании устьиц между замыкающими и побочными клетками происходит обратный ионный обмен. Как раз в снабжении замыкающих клеток ионами K+ и заключается роль побочных клеток. Показано, что мутантные растения, у которых побочные клетки не развиваются, не могут открывать устьица так же широко, как нормальные (см. Открыт молекулярный механизм формирования устьиц у растений, «Элементы», 30.01.2009).
При закрывании устьиц между замыкающими и побочными клетками происходит обратный ионный обмен. Как раз в снабжении замыкающих клеток ионами K+ и заключается роль побочных клеток. Показано, что мутантные растения, у которых побочные клетки не развиваются, не могут открывать устьица так же широко, как нормальные (см. Открыт молекулярный механизм формирования устьиц у растений, «Элементы», 30.01.2009).
Форма замыкающих клеток бывает разной: у двудольных цветковых растений она бобовидная, у однодольных — гантелевидная:
Побочных клеток может быть разное количество, они могут иметь разную форму, и по-разному прилегать к замыкающим. Все эти признаки также являются систематическими, то есть их можно использовать при определении принадлежности растения к определенному таксону — например, классу, семейству или роду.
Строение устьиц не зря столь разнообразно. Во-первых, оно, во всяком случае отчасти, усложнялось в процессе эволюции наземных растений: сравните дизайн устьиц с одной побочной клеткой у многоножковых папоротников с более сложными вариантами некоторых цветковых растений:
Во-вторых, строение устьиц имеет адаптивное значение. В частности, показано, что устьица с гантелевидными замыкающими клетками открываются быстрее и требуют для этого поступления в них меньшего количества воды. Поэтому такие устьица выгодно иметь травянистым растениям, которые живут в очень переменчивых условиях, например, степных, где воды то много (во время ливней), то практически нет вовсе. Как раз травянистые формы преобладают среди однодольных растений, имеющих гантелевидные замыкающие клетки. Тонкости формы и расположения побочных клеток, по-видимому, отражают дальнейшую адаптивную радиацию растений к разным условиям. Этот вопрос еще нуждается в подробном изучении.
В частности, показано, что устьица с гантелевидными замыкающими клетками открываются быстрее и требуют для этого поступления в них меньшего количества воды. Поэтому такие устьица выгодно иметь травянистым растениям, которые живут в очень переменчивых условиях, например, степных, где воды то много (во время ливней), то практически нет вовсе. Как раз травянистые формы преобладают среди однодольных растений, имеющих гантелевидные замыкающие клетки. Тонкости формы и расположения побочных клеток, по-видимому, отражают дальнейшую адаптивную радиацию растений к разным условиям. Этот вопрос еще нуждается в подробном изучении.
Представители семейства вьюнковых, один из которых запечатлен на главном фото, могут иметь парацитные (две побочные клетки параллельны замыкающим), аномоцитные (несколько побочных клеток не отличаются по форме от прочих клеток эпидермиса) и анизоцитные устьица (замыкающие клетки окружены тремя разными по размерам побочными) — и на главном фото мы видим, что форма устьиц запечатленного листа действительно разная. Снимок сделан методом рейнберговского освещения (см. Rheinberg illumination), когда между источником света и собирающей линзой вставляется двухцветный фильтр так, что центральные лучи окрашиваются в один цвет, а боковые — в другой, что позволяет получать эффектные по цветовой гамме снимки.
Снимок сделан методом рейнберговского освещения (см. Rheinberg illumination), когда между источником света и собирающей линзой вставляется двухцветный фильтр так, что центральные лучи окрашиваются в один цвет, а боковые — в другой, что позволяет получать эффектные по цветовой гамме снимки.
Фото © Michael Gibson с сайта nikonsmallworld.com, увеличение: 20×.
Олег Соколенко
Роль устьиц в врожденном иммунитете растений и лиственных бактериальных заболеваниях
1. Альфано Дж. Р., Коллмер А. Эффекторные белки системы секреции III типа: двойные агенты при бактериальных заболеваниях и защите растений. Анну. Преподобный Фитопат. 2004;42:385–414. [PubMed] [Google Scholar]
2. Anderson JP, Badruzsaufari E, Schenk PM, Manners JM, Desmond OJ, et al. Антагонистическое взаимодействие между абсцизовой кислотой и сигнальными путями жасмоната-этилена модулирует экспрессию защитных генов и устойчивость к болезням у арабидопсиса. Растительная клетка. 2004; 16:3460–79.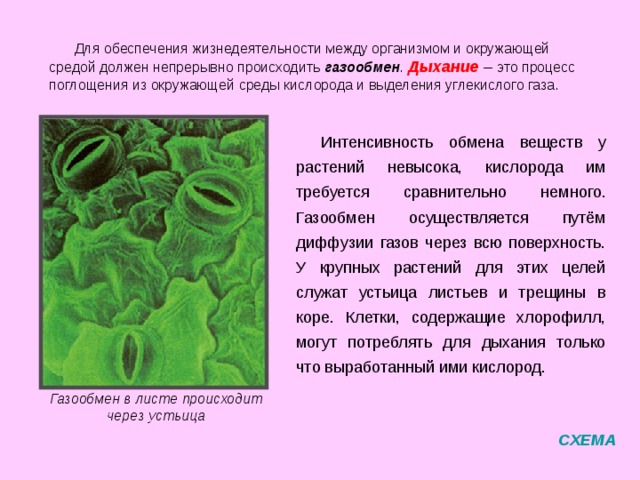 . [Бесплатная статья PMC] [PubMed] [Google Scholar]
. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Asai T, Tena G, Plotnikova J, Willmann MR, Chiu W-L, et al. Передача сигналов киназы MAP во врожденном иммунитете арабидопсиса. Природа. 2002; 415:977–83. [PubMed] [Google Scholar]
4. Ausubel FM. Сохраняются ли врожденные иммунные сигнальные пути у растений и животных? Нац. Иммунол. 2005; 6: 973–79. [PubMed] [Google Scholar]
5. Байот Р.Г., Рис С.М. Роль подвижности в заражении цветков яблони Erwinia amylovora и исследования борьбы с бактериальным ожогом с помощью аттрактантов и репеллентов. Фитопатология. 1986;76:41–45. [Google Scholar]
6. Битти Г.А., Линдоу С.Е. Тайная жизнь лиственных бактериальных возбудителей на листьях. Анну. Преподобный Фитопат. 1995; 33: 145–72. [PubMed] [Google Scholar]
7. Битти Г.А., Lindow SE. Бактериальная колонизация листьев: спектр стратегий. Фитопатология. 1999; 89: 353–59. [PubMed] [Google Scholar]
8. Бендер CL, Alarcon-Chaidez F, Gross DC. Pseudomonas syringae фитотоксины: механизм действия, регуляция и биосинтез пептидными и поликетидсинтетазами. микробиол. Мол. биол. Откр. 1999;63:266–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Pseudomonas syringae фитотоксины: механизм действия, регуляция и биосинтез пептидными и поликетидсинтетазами. микробиол. Мол. биол. Откр. 1999;63:266–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Всесторонний обзор основных бактериальных токсинов: липодепсипептидов, коронатина, фазолотоксина и табтоксина.
9. Бент А.Ф., Макки Д. Элиситоры, эффекторы и гены R : новая парадигма и жизненный запас вопросов. Анну. Преподобный Фитопат. 2007; 45: 399–436. [PubMed] [Google Scholar]
10. Bessire M, Chassot C, Jacquat A-C, Humphry M, Borel S, et al. Проницаемая кутикула арабидопсиса приводит к сильной устойчивости к Botrytis cinerea . EMBO J. 2007; 26: 2158–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Beuchat LR. Экологические факторы, влияющие на выживаемость и рост патогенов человека на сырых фруктах и овощах. микробы заражают. 2002; 4: 413–23. [PubMed] [Google Scholar]
12. Blatt MR, Grabov A, Brearley J, Hammond-Kosack K, Jones JDG. K + каналов Cf-9 трансгенных замыкающих клеток табака в качестве мишеней для элиситор-зависимой передачи сигнала Cladosporium fulvum Avr9 . Завод Ж. 1999;19:453–62. [PubMed] [Google Scholar]
K + каналов Cf-9 трансгенных замыкающих клеток табака в качестве мишеней для элиситор-зависимой передачи сигнала Cladosporium fulvum Avr9 . Завод Ж. 1999;19:453–62. [PubMed] [Google Scholar]
13. Block A, Schmelz E, Jones JB, Klee HJ. Коронатин и салициловая кислота: битва между Arabidopsis и Pseudomonas за контроль фитогормонов. Мол. Завод Патол. 2005; 6: 79–83. [PubMed] [Google Scholar]
14. Boureau T, Routtu J, Roine E, Taira S, Romantschuk M. Локализация hrpA -индуцированного Pseudomonas syringae pv. томат DC3000 в зараженных листьях томата. Мол. Завод Патол. 2002; 3: 451–60. [PubMed] [Академия Google]
15. Брандл М. Приспособленность патогенов человека к растениям и последствия для безопасности пищевых продуктов. Анну. Преподобный Фитопат. 2006; 44: 367–92. [PubMed] [Google Scholar]
16. Брукс Д.М., Бендер С.Л., Кункель Б.Н. Фитотоксин коронатин Pseudomonas syringae повышает вирулентность, преодолевая защиту, зависящую от салициловой кислоты, у Arabidopsis thaliana . Мол. Завод Патол. 2005; 6: 629–39. [PubMed] [Google Scholar]
Мол. Завод Патол. 2005; 6: 629–39. [PubMed] [Google Scholar]
17. Brooks DM, Hernández-Guzmán G, Kloek AP, Alarcón-Chaidez F, Sreedharan A, et al. Идентификация и характеристика четко определенной серии биосинтетических мутантов коронатина Pseudomonas syringae pv. помидор DC3000. Мол. Взаимодействие растений и микробов. 2004; 17: 162–74. [PubMed] [Google Scholar]
18. Budde IP, Ullrich MS. Взаимодействие Pseudomonas syringae pv. глицинеа с растениями-хозяевами и нехозяевами в зависимости от температуры и синтеза фитотоксинов. Мол. Взаимодействие растений и микробов. 2000; 9: 951–61. [PubMed] [Google Scholar]
19. Bunster L, Fokkema NJ, Schippers B. Эффект поверхностно-активного Pseudomonas вид. на смачиваемость листьев. заявл. Окружающая среда. микробиол. 1989; 55: 1340–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Chassot C, Nawrath C, Métraux JP. Дефекты кутикулы приводят к полному иммунитету к основному патогену растений.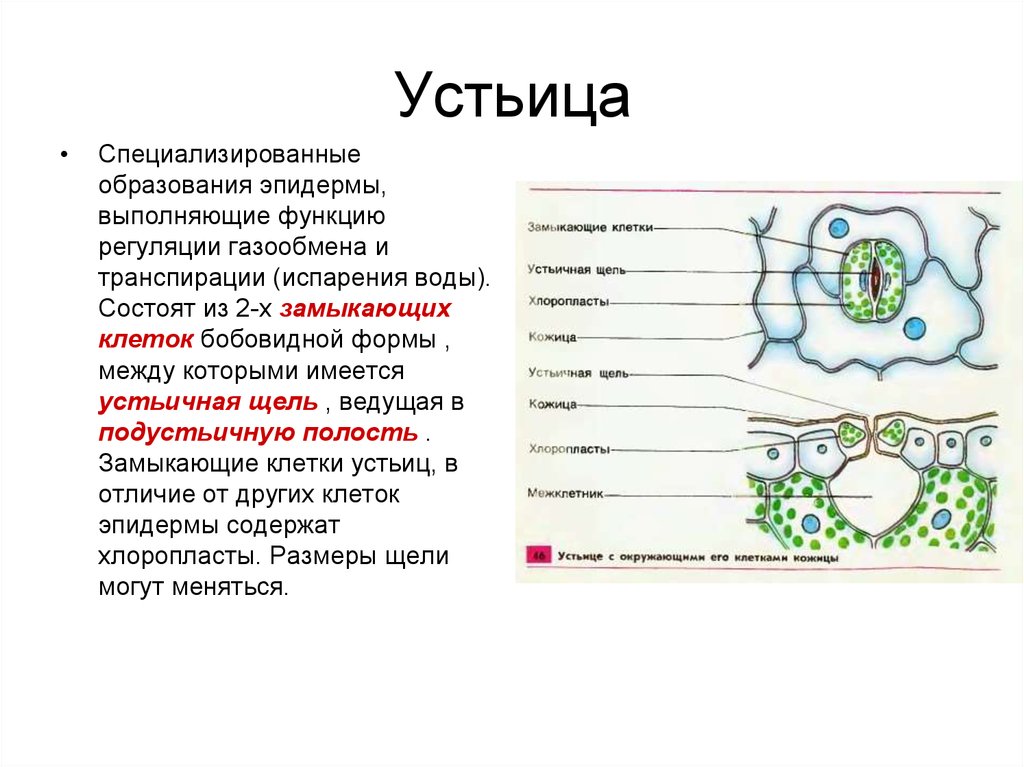 Плант Дж. 2007; 49: 972–80. [PubMed] [Google Scholar]
Плант Дж. 2007; 49: 972–80. [PubMed] [Google Scholar]
21. Шиншилла Д., Боллер Т., Робацек С. Передача сигналов флагеллина в иммунитете растений. Доп. Эксп. Мед. биол. 2007; 598: 358–71. [PubMed] [Google Scholar]
22. Chini A, Fonseca S, Fernández G, Adie B, Chico JM, et al. Семейство репрессоров JAZ является недостающим звеном в передаче сигналов жасмоната. Природа. 2007; 448: 666–71. [PubMed] [Академия Google]
Авторы идентифицировали белки-репрессоры JAZ, мишени убиквитинлигазы SCF COI1 E3 у арабидопсиса. Кроме того, они показывают, что JAZ3 взаимодействует с COI1 и AtMYC2, транскрипционным фактором, участвующим в передаче сигналов жасмоната, что иллюстрирует сигнальный каскад, в котором SCF COI1 -опосредованная деградация белков JAZ подавляет активность AtMYC2 и, возможно, других факторов транскрипции.
23. Чисхолм С.Т., Коакер Г., День Б., Стаскавич Б.Дж. Взаимодействие хозяин-микроб: формирование эволюции иммунного ответа растений. Клетка. 2006; 124:803–14. [PubMed] [Академия Google]
Клетка. 2006; 124:803–14. [PubMed] [Академия Google]
24. Cui J, Bahrami AK, Pringle EG, Hernandez-Guzman G, Bender CL, et al. Pseudomonas syringae воздействует на системную защиту растений от патогенов и травоядных. проц. Натл. акад. науч. США. 2005; 102:1791–96. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Авторы приводят интригующие доказательства того, что коронатин необходим для P. syringae , чтобы вызвать системную восприимчивость к вторичным инфекциям.
25. Danhorn T, Fuqua C. Образование биопленки бактериями, ассоциированными с растениями. Анну. Преподобный Микробиолог. 2007; 61: 401–22. [PubMed] [Академия Google]
26. DebRoy S, Thilmony R, Kwack YB, Nomura K, He SY. Семейство консервативных бактериальных эффекторов ингибирует базальный иммунитет, опосредованный салициловой кислотой, и способствует некрозу болезни у арабидопсиса. проц. Натл. акад. науч. США. 2004; 101:9927–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Delaney TP, Uknes S, Vernooij B, Friedrich L, Weymann K, et al. Центральная роль салициловой кислоты в устойчивости растений к болезням. Наука. 1994; 266:1247–50. [PubMed] [Google Scholar]
Delaney TP, Uknes S, Vernooij B, Friedrich L, Weymann K, et al. Центральная роль салициловой кислоты в устойчивости растений к болезням. Наука. 1994; 266:1247–50. [PubMed] [Google Scholar]
28. Девото А., Ньето-Ростро М., Се Д., Эллис С., Хармстон Р. и соавт. COI1 связывает передачу сигналов jasmonate и фертильность с комплексом убиквитин-лигазы SCF у Arabidopsis. Плант Дж. 2002; 32: 457–66. [PubMed] [Академия Google]
29. Дхармасири Н., Дхармасири С., Эстель М. Белок F-box TIR1 является рецептором ауксина. Природа. 2005; 435:441–45. [PubMed] [Google Scholar]
30. Эль-Баноби Ф.Е., Рудольф К. Индукция пропитывания водой листьев растений внеклеточными полисахаридами фитопатогенных псевдомонад и ксантомонад. Физиол. Завод Патол. 1979; 15: 341–49. [Google Scholar]
31. Фан Л.М., Чжао З., Ассманн С.М. Охранные клетки: модель динамической сигнализации. Курс. мнение биол. растений 2004; 7: 537–46. [PubMed] [Академия Google]
Характерное описание биологии устьиц во время абиотического стресса с акцентом на механизмы и молекулярные факторы, участвующие в движении замыкающих клеток.
32. Feil H, Feil WS, Chain P, Larimer F, DiBartolo G, et al. Сравнение полных последовательностей генома Pseudomonas syringae pv. шприцы B728a и pv. помидор DC3000. проц. Натл. акад. науч. США. 2005; 102:11064–69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В этой статье описывается интересное полногеномное сравнение между Pseudomonas syringae pv. syringae штамм B728a, имеющий ярко выраженную эпифитную фазу, и P. syringae pv. томат штамм DC3000, имеющий слабую эпифитную фазу. Несколько генов (оперонов) были идентифицированы как кандидаты на адаптацию к образу жизни.
33. Феликс Г.Т., Боллер Т. Молекулярное зондирование бактерий в растениях. Высококонсервативный РНК-связывающий мотив RNP-1 бактериальных белков холодового шока распознается в табаке как элиситорный сигнал. Дж. Биол. хим. 2003; 278:6201–08. [PubMed] [Академия Google]
34. Feys BJF, Benedetti CE, Penfold CN, Turner JG. Мутанты арабидопсиса, отобранные по устойчивости к фитотоксину коронатину, обладают мужской стерильностью, нечувствительны к метилжасмонату и устойчивы к бактериальному патогену. Растительная клетка. 1994; 6: 751–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мутанты арабидопсиса, отобранные по устойчивости к фитотоксину коронатину, обладают мужской стерильностью, нечувствительны к метилжасмонату и устойчивы к бактериальному патогену. Растительная клетка. 1994; 6: 751–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Gardan L, Shafik H, Belouin S, Broch R, Grimont F, Grimont PAD. Родство ДНК среди патоваров Pseudomonas syringae и описание Pseudomonas tremae sp. ноябрь и Pseudomonas cannabina sp. ноябрь [ ex Sutic and Dowson 1959] Int. Дж. Сист. бактериол. 1999; 49: 469–78. [PubMed] [Google Scholar]
36. Glazebrook J. Контрастные механизмы защиты от биотрофных и нектротрофных патогенов. Анну. Преподобный Фитопат. 2005;43:205–27. [PubMed] [Google Scholar]
37. Gómez-Gómez L, Boller T. FLS2: киназа, подобная рецептору LRR, участвующая в восприятии флагеллина бактериального элиситора у арабидопсиса. Мол. Клетка. 2000;5:1003–11. [PubMed] [Академия Google]
38. Грант С. Р., Фишер Э.Дж., Чанг Д.Х., Моул Б.М., Дангл Д.Л. Хитрость и манипуляция: эффекторные белки III типа фитопатогенных бактерий. Анну. Преподобный Микробиолог. 2006; 60: 425–49. [PubMed] [Google Scholar]
Р., Фишер Э.Дж., Чанг Д.Х., Моул Б.М., Дангл Д.Л. Хитрость и манипуляция: эффекторные белки III типа фитопатогенных бактерий. Анну. Преподобный Микробиолог. 2006; 60: 425–49. [PubMed] [Google Scholar]
39. Greulich F, Yoshihara T, Ichihara A. Коронатин, бактериальный фитотоксин, действует как стереоспецифический аналог сигналов жасмонатного типа в клетках томатов и тканях картофеля. J. Физиол растений. 1995; 147: 359–66. [Google Scholar]
40. Гимарайнш Р.Л., Стоц Х.У. Производство оксалатов на Sclerotinia sclerotiorum нарушает регуляцию замыкающих клеток во время инфекции. Завод Физиол. 2004; 136:3703–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Haefele DM, Lindow SE. Подвижность жгутиков придает преимущества эпифитной приспособленности Pseudomonas syringae . заявл. Окружающая среда. микробиол. 1987; 53: 2528–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Hancock JG, Huisman OC. Движение питательных веществ в системах хозяин-патоген. Анну. Преподобный Фитопат. 1981; 19: 309–31. [Академия Google]
Анну. Преподобный Фитопат. 1981; 19: 309–31. [Академия Google]
43. Хаттерманн Д.Р., Рис С.М. Подвижность Pseudomonas syringae pv. глицинеа и его роль в инфекции. Фитопатология. 1989; 79: 284–89. [Google Scholar]
44. Хе П., Шан Л., Шин Дж. Выявление и подавление связанного с микробами иммунитета, запускаемого молекулярным паттерном, при взаимодействии растений и микробов. Клетка. микробиол. 2007; 9: 1385–96. [PubMed] [Google Scholar]
45. He SY, Nomura K, Whittam TS. Механизм секреции белка типа III у патогенов млекопитающих и растений. Биохим. Биофиз. Акта. 2004; 1694:181–206. [PubMed] [Google Scholar]
46. Хирано С.С., Upper CD. Популяционная биология и эпидемиология Pseudomonas syringae . Анну. Преподобный Фитопат. 1990; 28: 155–77. [Google Scholar]
47. Хирано С.С., Upper CD. Бактерии в экосистеме листа с акцентом на Pseudomonas syringae — патоген, ледяное ядро и эпифит. микроб. Мол. биол. 2000; 64:624–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Обзор, объединяющий исследования, проведенные в полевых условиях и в лаборатории Pseudomonas syringae эпидемиология и биология в филлосфере.
48. Hosy E, Vavasseur A, Mouline K, Dreyer I, Gaymard F, et al. Внешний K+ канал GORK арабидопсиса участвует в регуляции движений устьиц и транспирации растений. проц. Натл. акад. науч. США. 2003; 100:5549–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Hugouvieux V, Barber CE, Daniels MJ. Запись Xanthomonas campestris pv. campestris в гидатоды из Листья Arabidopsis thaliana : Система для изучения ранних инфекционных событий в бактериальном патогенезе. Мол. Взаимодействие растений и микробов. 1998; 11: 537–43. [PubMed] [Google Scholar]
50. Hutchison ML, Johnstone K. Доказательства участия поверхностно-активных свойств внеклеточного токсина толаазин в проявлении симптомов бурой пятнистости с помощью Pseudomonas tolaasii на Agaricus bisporus . Физиол. Мол. Путь растений. 1993; 42: 373–84. [Академия Google]
Физиол. Мол. Путь растений. 1993; 42: 373–84. [Академия Google]
51. Исраэльссон М., Зайгель Р.С., Янг Дж., Хашимото М., Иба К., Шредер Дж.И. Охранная ячейка ABA и CO 2 обновляет сигнальную сеть и гипотеза запуска сенсора Ca 2+ . Курс. мнение биол. растений 2006; 9: 654–63. [PubMed] [Google Scholar]
52. Janse JD. Фитобактериология: принципы и практика. Издательство КАБИ; Кембридж, Массачусетс: 2005. с. 352. [Google Scholar]
53. Jones JDG, Dangl JL. Иммунная система растений. Природа. 2006; 444: 323–29. [PubMed] [Академия Google]
54. Катагири Ф., Тилмони Р., Хе С.Ю. Взаимодействие Arabidopsis thaliana — Pseudomonas syringae . В: Somerville CR, Meyerowitz EM, редакторы. Книга Арабидопсис. Американское общество биологов растений; Роквилл, Мэриленд: 2002. doi: 10.1199/табл.0039. [Google Scholar]
55. Kepinski S, Leyser O. Индуцированное ауксином взаимодействие SCF TIR1 -Aux/IAA включает стабильную модификацию комплекса SCF TIR1 . проц. Натл. акад. науч. США. 2004; 101:12381–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2004; 101:12381–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Кинкель Л.Л., Уилсон М., Линдоу С.Е. Виды растений и условия инкубации растений влияют на изменчивость размера популяции эпифитных бактерий. микроб. Экол. 2000; 39:1–11. [PubMed] [Google Scholar]
57. Клемент З. Гиперчувствительность. В: Mount MS, Lacy GH, редакторы. Фитопатогенные прокариоты. Том. 2. Академическая пресса; Нью-Йорк: 1982. С. 149–177. [Google Scholar]
58. Kloek AP, Verbsky ML, Sharma SB, Schoelz JE, Vogel J, et al. Устойчивость к Pseudomonas syringae , вызванный мутацией Arabidopsis thaliana , нечувствительной к коронатину ( coi1 ), происходит посредством двух различных механизмов. Плант Дж. 2001; 26: 509–22. [PubMed] [Google Scholar]
59. Klüsener B, Young JJ, Murata Y, Allen GJ, Mori IC, et al. Конвергенция кальциевых сигнальных путей патогенных элиситоров и абсцизовой кислоты в замыкающих клетках арабидопсиса. Завод Физиол. 2002; 130:2152–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Завод Физиол. 2002; 130:2152–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Кода Ю., Кикута Ю., Китахара Т., Ниши Т., Мори К. Сравнение различных биологических активностей стереоизомеров метилжасмоната. Фитохимия. 1992;31:1111–14. [Google Scholar]
61. Крамм Т., Бандемер К., Боланд В. Индукция биосинтеза летучих веществ в лимской фасоли ( Phaseolus lunatus ) с помощью лейцин- и изолейциновых конъюгатов 1-оксо- и 1-гидроксииндан-4-карбоновой кислоты. кислота: данные о аминокислотных конъюгатах жасмоновой кислоты в качестве промежуточных продуктов в октадеканоидном сигнальном пути. ФЭБС лат. 1995; 377: 523–29. [PubMed] [Google Scholar]
62. Кункель Б.Н., Брукс Д.М. Перекрестные помехи между сигнальными путями в защите от патогенов. Курс. мнение Растение. биол. 2002; 5: 325–31. [PubMed] [Академия Google]
В этом обзоре подчеркивается молекулярное взаимодействие между тремя растительными гормонами, салициловой кислотой, жасмоновой кислотой и этиленом, во время защиты растений от различных патогенов.
63. Kunze G, Zipfel C, Robatzek S, Niehaus K, Boller T, Felix G. N-конец бактериального фактора элонгации Tu вызывает врожденный иммунитет у растений арабидопсиса. Растительная клетка. 2004; 16:3496–507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Lake JA, Quick WP, Beerling DJ, Woodward FI. Сигналы от зрелых к новым листьям. Природа. 2001; 411:154. [PubMed] [Академия Google]
65. Лори-Берри Н., Джоардар В., улица И.Х., Кункель Б.Н. Ген Arabidopsis thaliana JASMONATE INSENSITIVE 1 необходим для подавления защиты, зависящей от салициловой кислоты, во время инфекции Pseudomonas syringae . Мол. Взаимодействие растений и микробов. 2006; 19: 789–800. [PubMed] [Google Scholar]
66. Lee J-S. Механизм закрытия устьиц салициловой кислотой у Commelina communis L. J. Plant Biol. 1998; 41: 97–102. [Google Scholar]
67. Lee S, Choi H, Suh S, Doo I-S, Oh K-Y и др. Олигогалактуроновая кислота и хитозан уменьшают устьичную апертуру, индуцируя выделение активных форм кислорода из замыкающих клеток томата и Коммелина обыкновенная . Завод Физиол. 1999; 121:147–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Завод Физиол. 1999; 121:147–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Leon-Kloosterziel KM, Gil MA, Ruijs GJ, Jacobsen SE, Olszewski NE, et al. Выделение и характеристика мутантов Arabidopsis с дефицитом абсцизовой кислоты в двух локусах. Плант Дж. 1996; 10: 655–61. [PubMed] [Google Scholar]
69. Li J, Brader G, Karioli T, Palva ET. WRKY70 модулирует выбор сигнальных путей в защите растений. Плант Дж. 2006; 46: 477–91. [PubMed] [Академия Google]
70. Линдгрен П.Б. Роль генов hrp во взаимодействиях растений и бактерий. Анну. Преподобный Фитопат. 1997; 35: 129–52. [PubMed] [Google Scholar]
71. Lindgren PB, Peet RC, Panopoulos NJ. Кластер генов Pseudomonas syringae pv. « Phaseolicola » контролирует патогенность растений фасоли и гиперчувствительность к растениям, не являющимся хозяевами. Дж. Бактериол. 1986; 168: 512–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Lindow SE, Brandl MT. Микробиология филлосферы. заявл. Окружающая среда. микробиол. 2003;69: 1875–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 2003;69: 1875–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Проницательный обзор, в котором освещаются уникальные и интригующие особенности микробной биологии в филлосфере и необходимость исследования реальных условий микросреды, которым подвергаются колонизаторы поверхности листьев.
73. Лоренцо О., Солано Р. Молекулярные игроки, регулирующие сигнальную сеть жасмоната. Курс. мнение биол. растений 2005; 8: 532–40. [PubMed] [Google Scholar]
74. Ma SW, Morris VL, Cuppels DA. Характеристика участка ДНК, необходимого для производства фитотоксина коронатина Pseudomonas syringae pv. помидор . Мол. Взаимодействие растений и микробов. 1991; 4: 69–77. [Google Scholar]
75. Manthe B, Schulz M, Schnable H. Влияние салициловой кислоты на рост и устьичные движения Vicia faba L.: доказательства метаболизма салициловой кислоты. Дж. Хим. Экол. 1992; 18:1525–39. [PubMed] [Google Scholar]
76. Марре Э. Фузикокцин: инструмент в физиологии растений. Анну. Преподобный Завод Физиол. 1979; 30: 273–288. [Google Scholar]
Марре Э. Фузикокцин: инструмент в физиологии растений. Анну. Преподобный Завод Физиол. 1979; 30: 273–288. [Google Scholar]
77. Мелотто М., Андервуд В., Кочан Дж., Номура К., Хе С.Ю. Устьица растений функционируют во врожденном иммунитете против бактериальной инвазии. Клетка. 2006;126:969–80. [PubMed] [Google Scholar]
Авторы приводят доказательства того, что замыкающие клетки устьиц реагируют на живые бактерии и PAMP, и что коронатин предотвращает закрытие устьиц, вызванное бактериями/PAMP.
78. Mendgen K, Hahn M, Deising H. Морфогенез и механизмы проникновения фитопатогенных грибов. Анну. Преподобный Фитопат. 1996; 34: 367–86. [PubMed] [Google Scholar]
79. Mino Y, Matsuchita Y, Sakai R. Влияние коронатина на открытие устьиц в листьях бобов и райграса итальянского. Анна. Фитопат. соц. Япония. 1987;53:53–55. [Google Scholar]
80. Миттал С.М., Дэвис К.Р. Роль фитотоксина коронатина в заражении Arabidopsis thaliana Pseudomonas syringae pv. помидор . Мол. Взаимодействие растений и микробов. 1995; 8: 165–71. [PubMed] [Google Scholar]
помидор . Мол. Взаимодействие растений и микробов. 1995; 8: 165–71. [PubMed] [Google Scholar]
81. Monier JM, Lindow SE. Дифференциальная выживаемость одиночных и агрегированных бактериальных клеток способствует образованию агрегатов на поверхности листьев. проц. Натл. акад. науч. США. 2003; 100:15977–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Monier JM, Lindow SE. Частота, размер и локализация скоплений бактерий на поверхности листьев фасоли. заявл. Окружающая среда. микробиол. 2004; 70: 346–55. [Статья бесплатно PMC] [PubMed] [Google Scholar]
83. Mori IC, Pinontoan R, Kawano T, Muto S. Участие образования супероксида в закрытии устьиц, вызванном салициловой кислотой, у Vicia faba . Физиология клеток растений. 2001;42:1383–88. [PubMed] [Google Scholar]
84. Mustilli AC, Merlot S, Vavasseur A, Fenzi F, Giraudat J. Протеинкиназа OST1 Arabidopsis опосредует регуляцию устьичного отверстия абсцизовой кислотой и действует выше по течению производства активных форм кислорода. Растительная клетка. 2002;12:3089–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Растительная клетка. 2002;12:3089–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Naimi JS, Wicklund JH, Olsen SJ, Krause G, Wells JG, et al. Параллельные вспышки Shigella sonnei и энтеротоксигенных инфекций Escherichia coli , связанных с петрушкой: значение для эпиднадзора и борьбы с болезнями пищевого происхождения. Дж. Пищевая защита. 2003; 66: 535–41. [PubMed] [Google Scholar]
86. Nejad AR, van Meeteren U. Роль абсцизовой кислоты в нарушении характеристик устьичной реакции Tradescantia virginiana в период роста при высокой относительной влажности воздуха. Дж. Эксп. Бот. 2007; 58: 627–36. [PubMed] [Google Scholar]
87. Благородный PS. Введение в биофизическую физиологию растений. Фримен; Сан-Франциско: 1974. с. 488. [Google Scholar]
88. Nomura K, Melotto M, He SY. Подавление защиты хозяина в совместимых взаимодействиях растений и Pseudomonas syringae . Курс. мнение биол. растений 2005; 8: 361–68. [PubMed] [Google Scholar]
89. Палмер Д.А., Бендер CL. Ультраструктура ткани листьев томатов, обработанных фитотоксином псевдомонад коронатином, и сравнение с метилжасмонатом. Мол. Взаимодействие растений и микробов. 1995;8:683–92. [Google Scholar]
Палмер Д.А., Бендер CL. Ультраструктура ткани листьев томатов, обработанных фитотоксином псевдомонад коронатином, и сравнение с метилжасмонатом. Мол. Взаимодействие растений и микробов. 1995;8:683–92. [Google Scholar]
90. Panopoulos HI, Schroth MN. Роль подвижности жгутиков в инвазии листьев фасоли штаммом Pseudomonas Phaseolicola . Фитопатология. 1974; 64: 1389–97. [Google Scholar]
91. Park S, Worobo RW, Durst RA. Escherichia coli O157:H7 как новый патоген пищевого происхождения: обзор литературы. крит. Преподобный Биотехнолог. 2001; 21: 27–48. [PubMed] [Google Scholar]
92. Parker JE, Barber CE, Fan MJ, Daniels MJ. Взаимодействие Xanthomonas campestris с Arabidopsis thaliana: характеристика гена из X. c . пв. raphani , который придает авирулентность большинству образцов A. thaliana . Мол. Взаимодействие растений и микробов. 1993; 6: 216–24. [PubMed] [Google Scholar]
93. Petersen M, Brodersen P, Naested H, Andreasson E, Lindhart U, et al. Киназа 4 карты Arabidopsis негативно регулирует системную приобретенную резистентность. Клетка. 2000;103:1111–1120. [PubMed] [Академия Google]
Киназа 4 карты Arabidopsis негативно регулирует системную приобретенную резистентность. Клетка. 2000;103:1111–1120. [PubMed] [Академия Google]
94. Roelfsema MR, Hedrich R. В свете открытия устьиц: новый взгляд на «Уотергейт» New Phytol. 2005; 167: 665–91. [PubMed] [Google Scholar]
95. Романчук М. Прикрепление фитопатогенных бактерий к поверхности растений. Анну. Преподобный Фитопат. 1992; 30: 225–43. [PubMed] [Google Scholar]
96. Schroeder JI, Allen GJ, Hugouvieux V, Kwak JM, Waner D. Передача сигналов гвардейских клеток. Анну. Преподобный Завод Физиол. Завод Мол. биол. 2001; 52: 627–58. [PubMed] [Академия Google]
97. Шредер Дж.И., Квак Дж.М., Аллен Дж.Дж. Сигнализация абсцизовой кислоты замыкающими клетками и обеспечение засухоустойчивости растений. Природа. 2001; 410:327–30. [PubMed] [Google Scholar]
98. Spoel SP, Koornneef A, Claessens SMC, Korzelius JP, van Pelt JA, et al. NPR1 модулирует взаимодействие между салицилат- и жасмонат-зависимыми путями защиты посредством новой функции в цитозоле. Растительная клетка. 2003; 15: 760–70. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Растительная клетка. 2003; 15: 760–70. [Статья бесплатно PMC] [PubMed] [Google Scholar]
99. Staswick PE, Tiryaki I. Жасмоновая кислота сигнала оксилипина активируется ферментом, который конъюгирует его с изолейцином в арабидопсисе. Растительная клетка. 2004;16:2117–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Suhita D, Raghavendra AS, Kwak JM, Vavasseur A. Подщелачивание цитоплазмы предшествует производству активных форм кислорода во время закрытия устьиц, вызванного метилжасмонатом и абсцизовой кислотой. Завод Физиол. 2004; 134:1536–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Sundin GW. Ультрафиолетовое излучение листьев: его влияние на микробные сообщества и их адаптации. В: Линдоу С.Е., Хехт-Пойнар Э.И., Эллиотт В.Дж., редакторы. Микробиология филлосферы. АПС Пресс; Сент-Пол, Миннесота: 2002. стр. 27–41. [Академия Google]
102. Такеда К., Кайшо Т., Акира С. Толл-подобные рецепторы. Анну. Преподобный Иммунол. 2003; 21: 335–376. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
103. Talbott LD, Rahveh E, Zeiger E. Относительная влажность является ключевым фактором в адаптации устьичной реакции к CO 2 . Дж. Эксп. Бот. 2003;54:2141–47. [PubMed] [Google Scholar]
104. Тамогами С., Кодама О. Коронатин вызывает выработку фитоалексина в листьях риса ( Oryza sativa L ) так же, как и жасмоновая кислота. Фитохимия. 2000;54:689–94. [PubMed] [Google Scholar]
105. Tan X, Calderon-Villalobos LIA, Sharon M, Zheng C, Robinson CV, et al. Механизм восприятия ауксина убиквитинлигазой TIR1. Природа. 2007; 446: 640–45. [PubMed] [Google Scholar]
106. Тан Д., Симонич М.Т., Иннес Р.В. Мутации в LACS2, длинноцепочечной ацил-коэнзим А-синтетазе, повышают чувствительность к авирулентному Pseudomonas syringae , но придают арабидопсису устойчивость к Botrytis cinerea . Завод Физиол. 2007;144:1093–103. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Thilmony R, Underwood W, He SY. Полногеномный транскрипционный анализ взаимодействия Arabidopsis thaliana с фитопатогеном Pseudomonas syringae pv. помидор DC3000 и человеческий патоген Escherichia coli O157:H7. Плант Дж. 2006; 46: 34–53. [PubMed] [Google Scholar]
Полногеномный транскрипционный анализ взаимодействия Arabidopsis thaliana с фитопатогеном Pseudomonas syringae pv. помидор DC3000 и человеческий патоген Escherichia coli O157:H7. Плант Дж. 2006; 46: 34–53. [PubMed] [Google Scholar]
108. Thines B, Katsir L, Melotto M, Niu Y, Mandaokar A, et al. JAZ1 является целью SCF COI1 убиквитинлигаза во время передачи сигнала жасмонатом. Природа. 2007; 448: 661–65. [PubMed] [Google Scholar]
Авторы идентифицировали белки-репрессоры JAZ, мишени убиквитинлигазы SCF COI1 E3 у арабидопсиса. Кроме того, они показывают, что белки JAZ физически взаимодействуют с белком COI1 в присутствии жасмоноилизолейцина (JA-Ile) в дрожжевых клетках (т. -Иле, структурно сходный с коронатином.
109. Тернер Дж. Г., Эллис С., Девото А. Сигнальный путь жасмоната. Растительная клетка. 2002; 14:S153–S164. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Underwood W, Melotto M, He SY. Роль устьиц в бактериальной инвазии. Клетка. микробиол. 2007; 9: 1621–29. [PubMed] [Google Scholar]
Роль устьиц в бактериальной инвазии. Клетка. микробиол. 2007; 9: 1621–29. [PubMed] [Google Scholar]
111. Uppalapati SR, Ayoubi P, Weng H, Palmer DA, Mitchell RE, et al. Фитотоксин коронатин и метилжасмонат воздействуют на многочисленные пути фитогормонов в томатах. Плант Дж. 2005; 42: 201–17. [PubMed] [Академия Google]
112. Uppalapati SR, Ishiga Y, Wangdi T, Kunkel BN, Anand A, et al. Фитотоксин коронатин способствует приспособленности патогенов и необходим для подавления накопления салициловой кислоты в томатах, инокулированных Pseudomonas syringae pv. помидор DC3000. Мол. Взаимодействие растений и микробов. 2007; 20: 955–65. [PubMed] [Google Scholar]
113. Weiler E, Kutchan WTM, Gorba T, Brodschhelm W, Neisel U, Bublitz F. Фитотоксин Pseudomonas коронатин имитирует октадеканоидные сигнальные молекулы высших растений. ФЭБС лат. 1994;345:9–13. [PubMed] [Google Scholar]
114. Whalen MC, Innes RW, Bent AF, Staskawicz BJ. Идентификация Pseudomonas syringae патогенов арабидопсиса и бактериального гена, определяющего авирулентность арабидопсиса и сои. Растительная клетка. 1991; 3: 49–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Растительная клетка. 1991; 3: 49–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115. Wildermuth MC, Dewdney J, Wu G, Ausubel FM. Изохоризматсинтаза необходима для синтеза салициловой кислоты для защиты растений. Природа. 2001; 414: 562–65. [PubMed] [Академия Google]
116. Вудворд Ф.И. Численность устьиц чувствительна к увеличению концентрации CO 2 по сравнению с доиндустриальным уровнем. Природа. 1987; 327: 617–18. [Google Scholar]
117. Xie DX, Feys BF, James S, Nieto-Rostro M, Turner JG. COI1 : ген арабидопсиса, необходимый для регулируемой жасмонатом защиты и фертильности. Наука. 1998; 280:1091–94. [PubMed] [Google Scholar]
118. Xie X, Wang Y, Williamson L, Holroyd GH, Tagliavia C, et al. Идентификация генов, участвующих в реакции устьиц на пониженную относительную влажность воздуха. Курс. биол. 2006; 16: 882–87. [PubMed] [Академия Google]
119. Xu LH, Liu FQ, Lechner E, Genschik P, Crosby WL, et al. Комплексы убиквитин-лигазы SCF COI1 необходимы для жасмонатного ответа у арабидопсиса. Растительная клетка. 2002; 14:1919–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Растительная клетка. 2002; 14:1919–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
120. Zeidler D, Zähringer U, Gerber I, Dubery I, Hartung T, et al. Врожденный иммунитет у Arabidopsis thaliana : липополисахариды активируют синтазу оксида азота (NOS) и индуцируют защитные гены. проц. Натл. акад. науч. США. 2004; 101:15811–816. [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Чжао Ю., Тилмони Р., Бендер С.Л., Шаллер А., Хе С.Ю., Хоу Г.А. Системы вирулентности Pseudomonas syringae pv. томат способствуют развитию бактериальной пятнистости томатов, воздействуя на сигнальный путь жасмоната. Плант Дж. 2003; 36: 485–99. [PubMed] [Google Scholar]
122. Zipfel C, Kunze G, Chinchilla D, Caniard A, Jones JD, et al. Восприятие бактериального PAMP EF-Tu рецептором EFR ограничивает трансформацию, опосредованную Agrobacterium . Клетка. 2006;125:749–60. [PubMed] [Google Scholar]
123. Zipfel C, Robatzek S, Navarro L, Oakeley EJ, Jones JDG, et al. Устойчивость к бактериальным заболеваниям у арабидопсиса через восприятие флагеллина. Природа. 2004; 428: 764–67. [PubMed] [Google Scholar]
Устойчивость к бактериальным заболеваниям у арабидопсиса через восприятие флагеллина. Природа. 2004; 428: 764–67. [PubMed] [Google Scholar]
Устьица — поры растений, которые дают нам жизнь — возникают благодаря гену под названием MUTE, сообщают ученые
Пресс-релизы | Исследования | Наука
7 мая 2018 г.
Растения умеют делать хитрые трюки.
Благодаря фотосинтезу они используют солнечный свет и углекислый газ для производства пищи, выделяя в качестве побочного продукта кислород, которым мы дышим. Это эволюционное новшество настолько важно для идентичности растений, что почти все наземные растения используют одни и те же поры, называемые устьицами, для поглощения углекислого газа и выделения кислорода.
Устьица крошечные, микроскопические и имеют решающее значение для фотосинтеза. Тысячи их усеивают поверхность растений. Понимание того, как формируются устьица, является важной базовой информацией для понимания того, как растения растут и производят биомассу, за счет которой мы процветаем.
Крупный план поверхности растения Arabidopsis , сделанный под микроскопом. Устья в форме пончика разбросаны по всей поверхности. Сун-Ки Хань/Сингюнь Ци
В статье, опубликованной 7 мая в журнале Developmental Cell, группа под руководством Вашингтонского университета описывает тонкую клеточную симфонию, которая производит крошечные, функциональные устьица. Ученые обнаружили, что ген растений, известный как MUTE управляет развитием устьиц. MUTE управляет активностью других генов, которые сообщают клеткам, когда делиться, а когда не делиться, подобно тому, как дирижер говорит музыкантам, когда играть, а когда молчать.
MUTE является основным регулятором развития устьиц у Arabidopsis . Кейко Тории и ее дочери Эрики
«Ген MUTE действует как главный регулятор развития устьиц», — говорит старший автор Кейко Тории, профессор биологии Университета Вашингтона. и исследователь Медицинского института Говарда Хьюза. «MUTE осуществляет точный контроль над правильным формированием устьиц, инициируя один раунд клеточного деления — всего один — в клетке-предшественнике, из которой развиваются устьица».
Устьица напоминают пончики — круглые поры с отверстием посередине для входа или выхода газа из растения. Пора состоит из двух клеток, каждая из которых известна как замыкающая клетка. Они могут набухать или сжиматься, открывая или закрывая поры, что имеет решающее значение для регуляции газообмена для фотосинтеза, а также уровня влажности в тканях.
«Если растения не могут образовывать устьица, они нежизнеспособны — они не могут «дышать», — сказал Тории, который также является профессором Университета Нагоя в Японии.
Тори и ее команда исследовали, какие гены управляют образованием устьиц у Arabidopsis thaliana , небольшого сорняка, который является одним из наиболее широко изученных растений на планете. Прошлые исследования, проведенные командой Тории и другими исследователями, показали, что у Arabidopsis MUTE играет центральную роль в формировании устьиц. Ген MUTE кодирует инструкции для клеточного белка, который может контролировать состояние «включено» или «выключено» других генов растений.
Исследователи создали штамм Arabidopsis , которые могут искусственно производить большое количество белка MUTE, поэтому они могли легко определить, какие гены белка MUTE включаются или выключаются. Они обнаружили, что многие активированные гены контролируют деление клеток — процесс, критически важный для развития устьиц.
Крупный план эпидермиса проростков арабидопсиса , сделанный с помощью микроскопа. (A) и (C): проростки с типичным расположением устьиц по всей поверхности. (B) и (D): Проростки, которые искусственно производят много белка MUTE и в результате имеют много устьиц. Шкала баров составляет 50 микрометров. Сун-Ки Хань / Синюнь Ци
У Arabidopsis , как и почти у всех растений, устьица образуются из клеток-предшественников, известных как замыкающие материнские клетки, или GMC. Чтобы сформировать рабочую устьицу — единственную для устьиц — GMC делится один раз, чтобы уступить место парным замыкающим клеткам. Поскольку их данные показали, что белки MUTE включают гены, регулирующие клеточное деление, Тори и ее команда задались вопросом, является ли MUTE геном, который активирует этот единственный раунд клеточного деления. Если да, то это должен быть строго регламентированный процесс. Генетическая программа должна была бы включить деление клеток в GMC, а затем быстро выключить его обратно, чтобы гарантировать, что происходит только один цикл деления.
Если да, то это должен быть строго регламентированный процесс. Генетическая программа должна была бы включить деление клеток в GMC, а затем быстро выключить его обратно, чтобы гарантировать, что происходит только один цикл деления.
Команда Тории показала, что одним из генов, активируемых белком MUTE в его ДНК, является CYCD5;1 , ген, который вызывает деление GMC. Исследователи также обнаружили, что белки MUTE включают два гена, называемые FAMA и FOUR LIPS. Это было важным открытием, потому что в то время как CYCD5;1 включает клеточное деление GMC, FAMA и FOUR LIPS выключают — или подавляют — программу клеточного деления.
Без MUTE, растения Arabidopsis не могут образовывать устьица и не развиваются дальше стадии проростков. Сун-Ки Хань/ Синюнь Ци
«Наши эксперименты показали, что MUTE включает как активаторы клеточного деления, так и репрессоры клеточного деления, что кажется нелогичным — зачем ему делать и то, и другое?» — сказал Тории. «Это очень заинтересовало нас в понимании временной регуляции этих генов в GMC и устьицах».
С помощью точных экспериментов они собрали данные о времени активации MUTE этих активаторов и репрессоров клеточного деления. Они включили эту информацию в математическую модель, которая моделировала, как MUTE активирует и подавляет деление клеток в GMC. Во-первых, MUTE включает активатор CYCD5;1, который запускает один раунд клеточного деления. Затем FAMA и FOUR LIPS предотвращают дальнейшее деление клеток, образуя одно функциональное устьица, состоящее из двух замыкающих клеток.
«Подобно дирижеру на подиуме, MUTE сигнализирует своим генам-мишеням, каждый из которых играет определенную и даже противоположную роль в последующем произведении», — сказал Тории. «Результатом является тесно связанная последовательность активации и подавления, которая приводит к возникновению одной из самых древних структур наземных растений».
Ведущими авторами статьи являются Сун-Ки Хан, бывший научный сотрудник UW с докторской степенью, ныне работающий в Университете Нагоя, и научный сотрудник UW Синюнь Ци.

Leave A Comment