Электролитическая диссоциация
1. Электролитическая диссоциация — это распад электролитов на ионы при расплавлении или растворении в воде.
2. Кислоты диссоциируют с образованием иона H+(H3O+) и ионов кислотного остатка.
3. Основания диссоциируют с образованием гидроксид-иона OH— и ионов металла.
4. Средние соли диссоциируют с образованием ионов металла и ионов кислотного остатка.
5. Катионы — положительные ионы.
6. Анионы — отрицательные ионы.
Давайте порассуждаем вместе
1. Наибольшая концентрация фосфат-ионов в растворе
1) K3PO4
2) K2HPO4
3) KH2PO4
4) H3PO4
Ответ: наибольшая концентрация фосфат-ионов в растворе хорошо растворимой соли фосфата калия K
3PO4 = 3K+ + PO43-
2. Сульфид-ионы образуются при электролитической диссоциации
Сульфид-ионы образуются при электролитической диссоциации
1) MgSO4
2) FeS
3) Cs2S
4) K2SO3
Ответ: сульфид-ионы образуются при диссоциации хорошо растворимой соли сульфида цезия Cs2S = 2Cs+ + S2-
3. Наибольшее количество ионов образуется при электролитической диссоциации 1 моль
1) сульфата калия
2) сульфата алюминия
3) хлорида натрия
4) фосфата натрия
Ответ: составим уравнения электролитической диссоциации
K2SO4 = 2K+ + SO42- 2 + 1 = 3 моль
Al2(SO4)3= 2Al 3+ + 3SO42- 2 + 3 = 5 моль
NaCl = Na+ + Cl— 1 + 1 = 2 моль
Na3PO4 = 3Na+ + PO43- 3 + 1 = 4 моль
Из уравнений видно, что наибольшее количество ионов образуется при диссоциации 1 моль сульфата алюминия
4.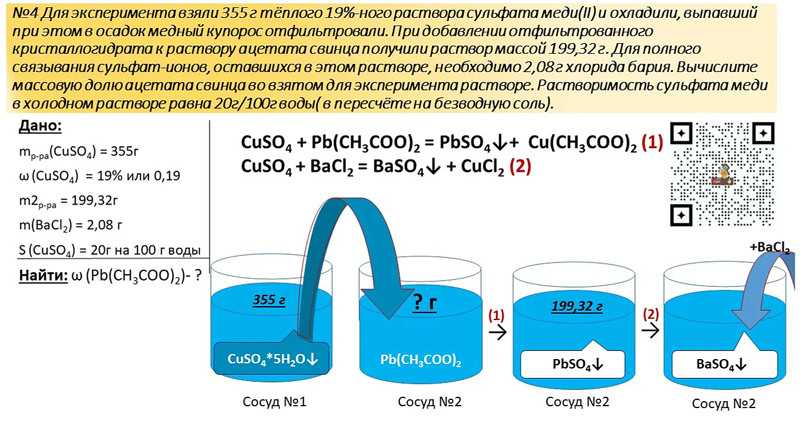 Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа (III) равна
Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа (III) равна
1) 3
2) 4
3) 5
4) 6
Ответ: составим уравнение электролитической диссоциации Fe2(SO4)3 = 2Fe 3+ + 3SO42-
сумма коэффициентов равна 1 + 2 + 3 = 6
5. Наибольшее число катионов образуется при диссоциации 1 моль
1) K3PO4
2) MgCl2
3) Al(NO3)3
4) Na2CO3
Ответ: составим уравнения электролитической диссоциации
K3PO4 = 3K+ + PO43- 3 моль катионов калия
MgCl2 = Mg2+ + 2Cl— 1 моль катионов магния
Al(NO3)3 = Al3+ + 3NO3— 1 моль катионов алюминия Na2CO3 = 2Na+ + CO32- 2 моль катионов натрия
Из уравнений видно, что наибольшее количество катионов образуется при диссоциации фосфата калия
6. В качестве анионов только гидроксид-ионы образуются при диссоциации:
В качестве анионов только гидроксид-ионы образуются при диссоциации:
1) карбоната натрия
2) гидроксида бария
3) гидроксохлорида меди (II)
4) гидросульфата натрия
Ответ: только гидроксид-ионы образуются при диссоциации щелочей Ba(OH)2 = Ba2+ + 2OH—
7. В качестве катионов только ионы водорода образуются при диссоциации
1) гидрокарбоната натрия
2) соляной кислоты
3) гидроксида меди (II)
4) гидросульфата натрия
Ответ: только ионы водорода образуются при диссоциации кислот HCl = H+ + Cl—
Тест по теме Электролитическая диссоциация ЕГЭ химия
Тест по теме Электролитическая диссоциация ЕГЭ химияУчебник Курсы Книги Тесты Вопросы
Личный кабинет
Вас ждет интересная статья по данной теме 🙂
N. B. Разделение на темы вопросов по химии носит приблизительный характер, так как сам формат большинства вопросов ЕГЭ по химии исключает возможность однозначного отнесения вопроса к одной определённой теме.
B. Разделение на темы вопросов по химии носит приблизительный характер, так как сам формат большинства вопросов ЕГЭ по химии исключает возможность однозначного отнесения вопроса к одной определённой теме.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
иодид калия, гидроксид алюминия, сульфат меди(II), сульфид натрия, соляная кислота. Допустимо использование водных растворов веществ.
7057. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
Возможна реакция: Na2S + 2HCl = 2NaCl +H2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 7057.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
нитрат бария, сульфит калия, гидроксид натрия, хлорид железа(III), гидрокарбонат калия. Допустимо использование водных растворов веществ.
7022. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 7022.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
нитрат хрома(III), нитрат бария, бром, хлорид калия, гидроксид калия. Допустимо использование водных растворов веществ.
6987. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 6987.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
сульфид натрия, нитрат алюминия, нитрат калия, подкисленный раствор перманганата натрия, гидроксид бария. Допустимо использование водных растворов веществ.
6952. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
Можно записать другую реакцию: Al(NO3)3 + Na2S + H2O = Al(OH)3 + NaNO3 + H2S
P. S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 6952.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
оксид алюминия, хлорид кальция, медь, серная кислота, ацетат натрия. Допустимо использование водных растворов веществ.
6917. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 6917.
Для вас приятно генерировать тесты, создавайте их почаще
Бензол— Sciencemadness Wiki
Бензол — органическое химическое соединение с молекулярной формулой C 6 H 6 . Это простейший ароматический углеводород.
Это простейший ароматический углеводород.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Галерея
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ароматическое кольцо бензола участвует в сложных реакциях. В стандартных условиях бензол не очень реакционноспособен, но он может реагировать с галогенами, алкенами, галогеналкенами, ангидридами органических кислот в присутствии кислоты Льюиса (безводный хлорид алюминия, хлорид железа (III)), процесс, известный как Фриделя-Крафтса. реакция.
Нитрование бензола происходит раствором концентрированной серной и азотной кислот с образованием нитробензола.
Бензол легко воспламеняется и сгорает на воздухе с выделением большого количества сажи.
Физический
Бензол представляет собой бесцветную легковоспламеняющуюся жидкость со сладковатым запахом. Он не смешивается с водой, но смешивается со многими другими органическими растворителями, такими как галогеналканы, эфиры, этанол. Бензол растворяет некоторые пластиковые материалы, такие как полистирол. Это также хороший растворитель для серы.
Доступность
Бензол можно приобрести у поставщиков органических химикатов, но из-за опасности для окружающей среды цена на него несколько завышена. В большинстве стран он был исключен из большинства продуктов, и его также трудно найти в чистом виде, поскольку большинство поставщиков продают его только компаниям, особенно в большинстве стран ЕС.
Приготовление
Бензол можно легко получить декарбоксилированием бензоата натрия гидроксидом натрия путем нагревания смеси и конденсации полученного бензола.
- C 6 H 5 COONA + NAOH → C 6 H 6 + NA 2 CO 3
Тот же результат может быть достигнут с использованием оксида кальцием и бензоической кислоты.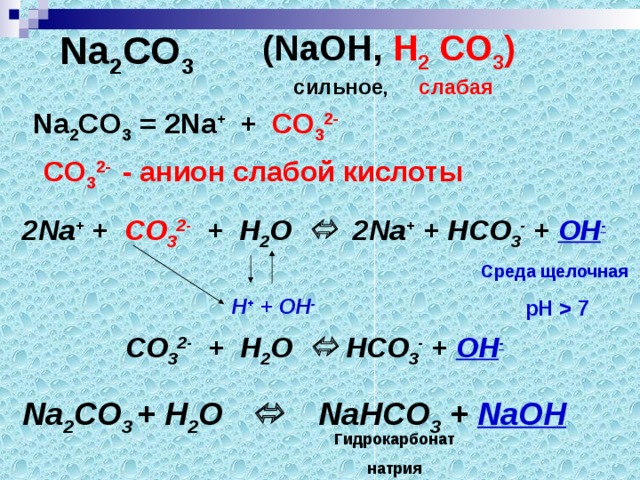 Метод декарбоксилирования приводит к образованию бифенила, бифенилена, бензофенона (который образуется в качестве основного продукта при использовании соли кальция) и других побочных продуктов, придающих конденсату оранжевый или оранжево-красный цвет. Его можно удалить простой перегонкой, получив кристально чистый бензол, хотя некоторые следы воды все еще могут существовать.
Метод декарбоксилирования приводит к образованию бифенила, бифенилена, бензофенона (который образуется в качестве основного продукта при использовании соли кальция) и других побочных продуктов, придающих конденсату оранжевый или оранжево-красный цвет. Его можно удалить простой перегонкой, получив кристально чистый бензол, хотя некоторые следы воды все еще могут существовать.
Бензол также может быть получен пиролизом пластика (обычно полиэтилена) и гидроксида натрия. Этот метод дает бензол вместе с другими углеводородами, поэтому может потребоваться фракционная перегонка. [1]
Лучшим пластиковым материалом, однако, является полиэтилентерефталат (ПЭТ), который легко доступен. Сначала вам нужно будет гидролизовать его гидроксидом натрия в растворителе с высокой температурой кипения, таком как этиленгликоль, который дает терефталат натрия, который можно декарбоксилировать до бензола с помощью гидроксида натрия. Полученный продукт представляет собой оранжево-красную жидкость с большим количеством щелочной воды, которую можно отделить с помощью делительной воронки с последующей перегонкой. Однако выход этой реакции ниже, чем у бензоата натрия (~ 15% по сравнению с 45-60%), и большое количество терефталата может обуглиться, если температура слишком высока. Образуется много побочных продуктов, которые могут засорить перегонный аппарат. [2] [3] [4]
Однако выход этой реакции ниже, чем у бензоата натрия (~ 15% по сравнению с 45-60%), и большое количество терефталата может обуглиться, если температура слишком высока. Образуется много побочных продуктов, которые могут засорить перегонный аппарат. [2] [3] [4]
CHROMIUM опубликовал в библиотеке Sciencemadness pdf-файл о многих методах синтеза бензола, собранный у разных участников. [5]
Проекты
- Изготовление напалма
- Синтез толуола
- Синтез хлорбензола
- Синтез нитробензола
- Извлечение серы
Обращение
Безопасность
Бензол является сильным канцерогеном, поэтому работа должна выполняться в вытяжном шкафу или на открытом воздухе. Требуется защитное снаряжение, так как оно может проникнуть через кожу. Если возможно, используйте толуол или ксилол, которые дешевле, безопаснее и более доступны.
Хранение
Бензол следует хранить в стеклянных бутылях с хорошей пластиковой крышкой и четкой этикеткой со знаком опасности, вдали от любых источников открытого огня.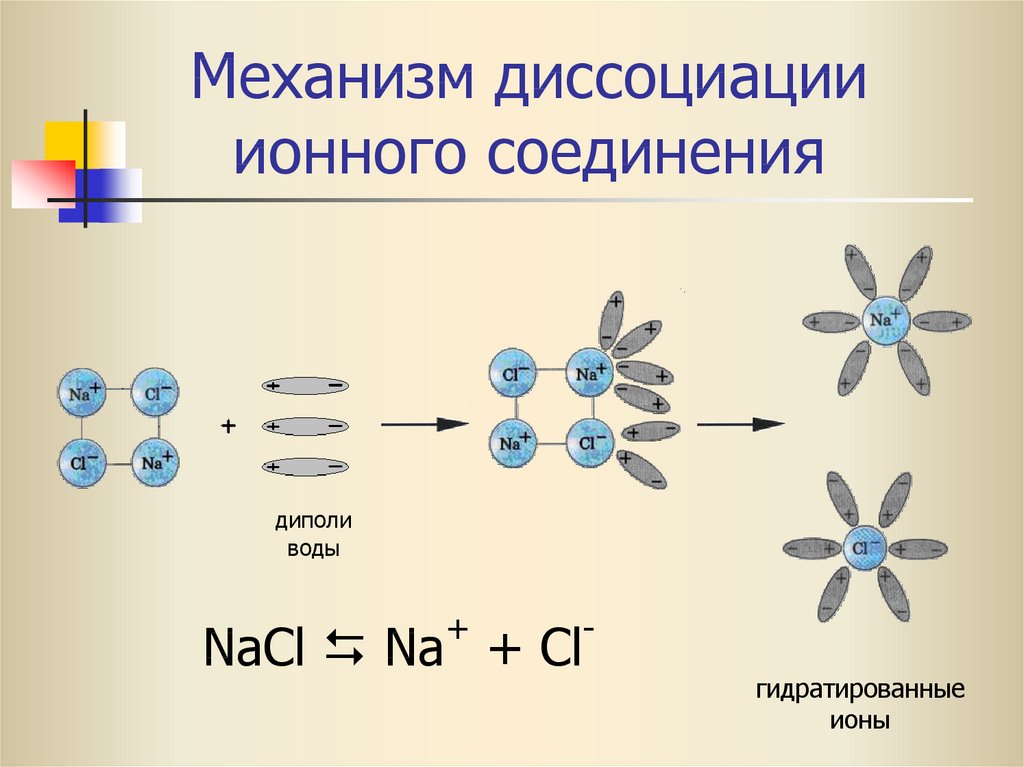
Утилизация
Бензол можно уничтожить путем его сжигания, но при этом будет выделяться много сажи, угарного газа, других ароматических соединений и несгоревших паров бензола, если только это не будет сделано в специальной мусоросжигательной печи. Если вы действительно хотите нейтрализовать бензол путем сжигания, хорошей идеей будет сначала разбавить его спиртом, так как пламя будет производить меньше сажи. Делайте это на улице, подальше от людей.
Бензол также можно разрушить с помощью реактива Фентона. Если окисление неполное, образуются фенол и бифенил. Если добавить слишком много бензола, образующиеся газы будут распылять некоторое количество бензола, что опасно в замкнутом пространстве, несет в себе опасность как пожара/взрыва, так и вдыхания опасных и канцерогенных паров бензола. Это неудобство можно уменьшить, добавляя бензол по каплям или барботируя (негорючий) газообразный бензол через газорассеивающий камень через раствор Фентона, чтобы ограничить утечку паров. Либо проводить нейтрализацию в вытяжном шкафу, либо на улице, предпочтительнее последнее. Фотохимическая нейтрализация с помощью УФ-лампы улучшит выход процесса окисления.
Либо проводить нейтрализацию в вытяжном шкафу, либо на улице, предпочтительнее последнее. Фотохимическая нейтрализация с помощью УФ-лампы улучшит выход процесса окисления.
Галерея
Ссылки
- ↑ http://www.youtube.com/watch?v=JhUxaNesnxs
- ↑ https://www.youtube.com/watch?v=JuvczYeM3kk
- ↑ https://www.youtube.com/watch?v=uRTrjaAb4NA
- ↑ https://www.youtube.com/watch?v=Zh0RK0an8f4
- ↑ http://www.sciencemadness.org/member_publications/benzene_production.pdf
Соответствующие темы Sciencemadness
- Синтез бензола
- Бензол из ПЭТ
Хлороформ — Sciencemadness Wiki
Трихлорметан или хлороформ — химическое соединение с формулой CHCl 3 . Это один из многих примеров галогеналкана, который часто используется в качестве неполярного растворителя в органической химии.
Содержание
- 1 Свойства
- 1.
 1 Химическая
1 Химическая - 1.2 Физический
- 1.
- 2 Наличие
- 3 Подготовка
- 4 варианта использования
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Пары хлороформа медленно реагируют с кислородом в присутствии света с образованием фосгена, высокотоксичного газа с запахом, похожим на запах свежескошенной травы. По этой причине хлороформ обычно хранят в бутылках из непрозрачного или янтарного стекла с небольшим верхним зазором. Этанол часто добавляют для нейтрализации образовавшегося фосгена, что приводит к накоплению соляной кислоты в хлороформе. По этой причине хлороформ часто промывают бикарбонатом натрия и перегоняют перед использованием после хранения.
Хлороформ будет реагировать с гидроксидом натрия с образованием промежуточного соединения дихлоркарбена, хлорида натрия и воды.
- HCl 3 + NaOH → CCl 2 + NaCl + H 2 O
Дихлоркарбен нестабилен в этих условиях и будет реагировать с дополнительным количеством гидроксида натрия с образованием потенциально полезного формиата натрия в процессе, который лучше всего с помощью межфазного катализатора, такого как этанол:
- CCl 2 + 3 NaOH → HCOONa + 2 NaCl + H 2 O
Хлороформ можно восстановить соляной кислотой и металлическим цинком в этаноле до дихлорметана.
- CHCl 3 + Zn + 2 HCl → CH 2 Cl 2 + ZnCl 2 + HCl [1]
реагируют с парами хлорформа при высоких температурах и реагируют с хлорформиевой кислотой монооксид углерода.
- CHCl 3 + H 2 O → CO + 3 HCl
Физический
При комнатной температуре хлороформ представляет собой прозрачную, летучую, неполярную густую жидкость с характерным сладким запахом, подобным другим галометанам. Он плохо растворяется в воде, но смешивается с большинством органических растворителей. Хлороформ и другие хлорированные органические растворители особенно полезны в качестве растворителей для высокореакционноспособных окислителей, таких как элементарный бром или хромилхлорид. Хлороформ также часто используется в качестве растворителя для биологических экстрактов, таких как алкалоиды из различных растений, включая кофеин, и даже РНК или белки.
Он плохо растворяется в воде, но смешивается с большинством органических растворителей. Хлороформ и другие хлорированные органические растворители особенно полезны в качестве растворителей для высокореакционноспособных окислителей, таких как элементарный бром или хромилхлорид. Хлороформ также часто используется в качестве растворителя для биологических экстрактов, таких как алкалоиды из различных растений, включая кофеин, и даже РНК или белки.
Доступность
Хлороформ используется во многих акриловых клеях. Однако его использование во многих безрецептурных продуктах с годами сократилось, и он был заменен менее токсичным дихлорметаном.
Хлороформ можно приобрести у поставщиков химикатов.
Приготовление
Реакционная смесь после проведения галоформной реакции с хлороформом, образующим на дне отдельный слой. Обратите внимание на высокий показатель преломления хлороформа.
Поскольку хлороформ снят с полок большинства магазинов из-за его опасности и негативного имиджа в СМИ, хлороформ, как правило, должен производиться в лаборатории. Наиболее удобным и легкодоступным методом является галоформная реакция. Чтобы получить хлороформ с помощью этого метода, к каждым трем молям гипохлорита натрия в растворе добавляют один моль ацетона, полученную смесь встряхивают и дают достаточно времени для полной реакции с образованием хлороформа и гидроксида натрия, среди других веществ. Реакция чрезвычайно экзотермична и может легко выйти из-под контроля; по этой причине рекомендуется хранить реагенты как можно более холодными (рекомендуется замороженный гипохлорит натрия) перед объединением и проводить реакцию на открытом воздухе или в вытяжном шкафу. Требуется два или более часа, прежде чем реакция полностью завершится, но если смесь оставить стоять слишком долго, хлороформ медленно удаляется водным раствором гидроксида натрия, образующимся в реакции. После завершения реакционный сосуд содержит на дне слой неочищенного хлороформа; этот слой необходимо экстрагировать, высушить для удаления воды и перегнать для получения конечного продукта, который затем стабилизируют этанолом и хранят в контейнере из непрозрачного или темного стекла.
Наиболее удобным и легкодоступным методом является галоформная реакция. Чтобы получить хлороформ с помощью этого метода, к каждым трем молям гипохлорита натрия в растворе добавляют один моль ацетона, полученную смесь встряхивают и дают достаточно времени для полной реакции с образованием хлороформа и гидроксида натрия, среди других веществ. Реакция чрезвычайно экзотермична и может легко выйти из-под контроля; по этой причине рекомендуется хранить реагенты как можно более холодными (рекомендуется замороженный гипохлорит натрия) перед объединением и проводить реакцию на открытом воздухе или в вытяжном шкафу. Требуется два или более часа, прежде чем реакция полностью завершится, но если смесь оставить стоять слишком долго, хлороформ медленно удаляется водным раствором гидроксида натрия, образующимся в реакции. После завершения реакционный сосуд содержит на дне слой неочищенного хлороформа; этот слой необходимо экстрагировать, высушить для удаления воды и перегнать для получения конечного продукта, который затем стабилизируют этанолом и хранят в контейнере из непрозрачного или темного стекла. Поскольку в воде растворимы значительные количества хлороформа, выход этого процесса увеличивается за счет использования более высоких концентраций гипохлорита. Растворимость хлороформа в воде также можно уменьшить, насыщая водный раствор хлоридом натрия.
Поскольку в воде растворимы значительные количества хлороформа, выход этого процесса увеличивается за счет использования более высоких концентраций гипохлорита. Растворимость хлороформа в воде также можно уменьшить, насыщая водный раствор хлоридом натрия.
Галоформную реакцию также можно проводить с использованием этанола вместо ацетона, также может существовать способ с использованием изопропанола.
В более крупных и промышленных синтезах газообразный метан реагирует при высокой температуре с хлором, образуя хлорметан, дихлорметан, хлороформ и четыреххлористый углерод, которые можно разделить перегонкой. Хлорирование дихлорметана также дает хлороформ и четыреххлористый углерод.
Применение
Трихлорметан находит широкое применение в домашней лаборатории в качестве общего неполярного растворителя и особенно хорошо известен тем, что используется для извлечения алкалоидов и других биологических соединений, таких как кофеин и пиперин, из их природных источников. Хлороформ уникален среди неполярных растворителей тем, что он негорючий, что позволяет использовать его в условиях, которые менее чем безопасны для таких растворителей, как диэтиловый эфир.
Хлороформ уникален среди неполярных растворителей тем, что он негорючий, что позволяет использовать его в условиях, которые менее чем безопасны для таких растворителей, как диэтиловый эфир.
Соединение хлорбутанол со сладким запахом легко производится из ацетона и хлороформа. Однако основное промышленное использование хлороформа связано с производством хлордифторметана, прекурсора при производстве политетрафторэтилена (ПТФЭ) или тефлона.
Хлороформ также можно использовать для получения дихлорметана и метана. ДХМ можно получить восстановлением хлороформа соляной кислотой и металлическим цинком в этаноле.
- CHCl 3 + Zn + 2 HCl → CH 2 Cl 2 + ZnCl 2 + HCl
Если рН раствора нейтральный, то будет образовываться метан, а не ДХМ.
- CHCl 3 + Zn + H 2 O → CH 4 + ZnCl 2 + HCl [2]
Хлороформ также может быть очень полезным реагентом для нехимических целей. Поскольку он избирательно растворяет некоторые пластмассы, такие как акрил, его можно использовать для создания смол и клеев для ремонта или крепления пластиковых предметов.
Поскольку он избирательно растворяет некоторые пластмассы, такие как акрил, его можно использовать для создания смол и клеев для ремонта или крепления пластиковых предметов.
Обращение
Безопасность
Хлороформ представляет множество опасностей для неопытного химика, но все эти опасности можно преодолеть, следуя простым правилам. Хлороформ сам по себе действует как мощный депрессант центральной нервной системы и может при достаточном количестве времени вызвать потерю сознания. Таким образом, более высокие дозы в течение длительного времени могут привести к смерти. Это также подозреваемый канцероген.
Металлический натрий и хлороформ могут взорваться при легком ударе. В результате взрыв может быть очень сильным и опасным. [3] [4]
Хранение
Хлороформ следует хранить в закрытых бутылях темного цвета вдали от любых источников тепла или света. При неправильном хранении существует риск образования фосгена при длительном контакте с кислородом или солнечным светом. Настоятельно рекомендуется, чтобы все образцы хлороформа были стабилизированы, по крайней мере, однопроцентным этанолом, хранились в хорошо закрытых бутылях из темного янтарного стекла и не хранились в течение длительного периода времени без периодического проветривания. Фосген бесцветен и имеет запах, напоминающий запах свежескошенной травы, что никоим образом не является адекватным предупреждением о его присутствии, поэтому надлежащее обращение с хлороформом и его хранение являются ужасными.
Настоятельно рекомендуется, чтобы все образцы хлороформа были стабилизированы, по крайней мере, однопроцентным этанолом, хранились в хорошо закрытых бутылях из темного янтарного стекла и не хранились в течение длительного периода времени без периодического проветривания. Фосген бесцветен и имеет запах, напоминающий запах свежескошенной травы, что никоим образом не является адекватным предупреждением о его присутствии, поэтому надлежащее обращение с хлороформом и его хранение являются ужасными.
Анализ на фосген можно провести с помощью полоски фильтровальной бумаги, смоченной в спиртовом растворе 5% дифениламина и 5% диметиламинобензальдегида, а затем высушенной. Бумага станет желтой, если присутствует фосген.
Утилизация
Хлороформ может попасть в систему водоснабжения и не может быть надлежащим образом удален во время процедур очистки, и, таким образом, представляет значительную угрозу для населения, когда это происходит; по этой причине хлороформ НИКОГДА не следует выливать в раковину или канализацию.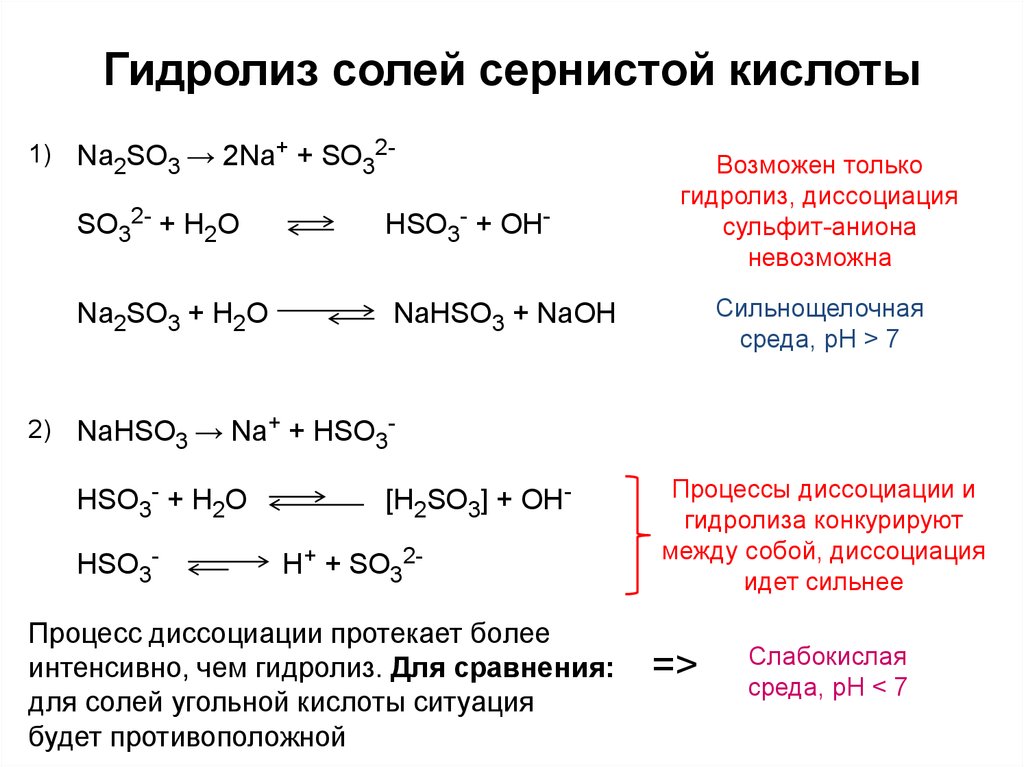 Более приемлемым способом избавления от хлороформа является сначала обработка его водным раствором гидроксида натрия в течение длительного периода времени, который постепенно превращает хлороформ в дихлоркарбен. Атмосферный хлороформ представляет значительно меньшую опасность, поэтому допустимо его кипячение после использования в качестве растворителя, но только в небольшом количестве и на открытой местности, иначе пары хлороформа могут разъесть краску для стен, некоторые пластмассы и резину.
Более приемлемым способом избавления от хлороформа является сначала обработка его водным раствором гидроксида натрия в течение длительного периода времени, который постепенно превращает хлороформ в дихлоркарбен. Атмосферный хлороформ представляет значительно меньшую опасность, поэтому допустимо его кипячение после использования в качестве растворителя, но только в небольшом количестве и на открытой местности, иначе пары хлороформа могут разъесть краску для стен, некоторые пластмассы и резину.
Хлороформ также можно разрушить реактивом Фентона. Поскольку некоторое количество хлороформа будет распыляться, лучше всего делать это на улице или в вытяжном шкафу. Добавьте по каплям хлороформ.
Другой способ нейтрализации хлороформа путем осторожного восстановления его металлическим цинком и водой в среде этанола при нейтральном pH. Это дает метан и хлорид цинка.
- CHCl 3 + Zn + H 2 O → CH 4 + ZnCl 2 + HCl
Также можно использовать железо.

 1 Химическая
1 Химическая
Leave A Comment