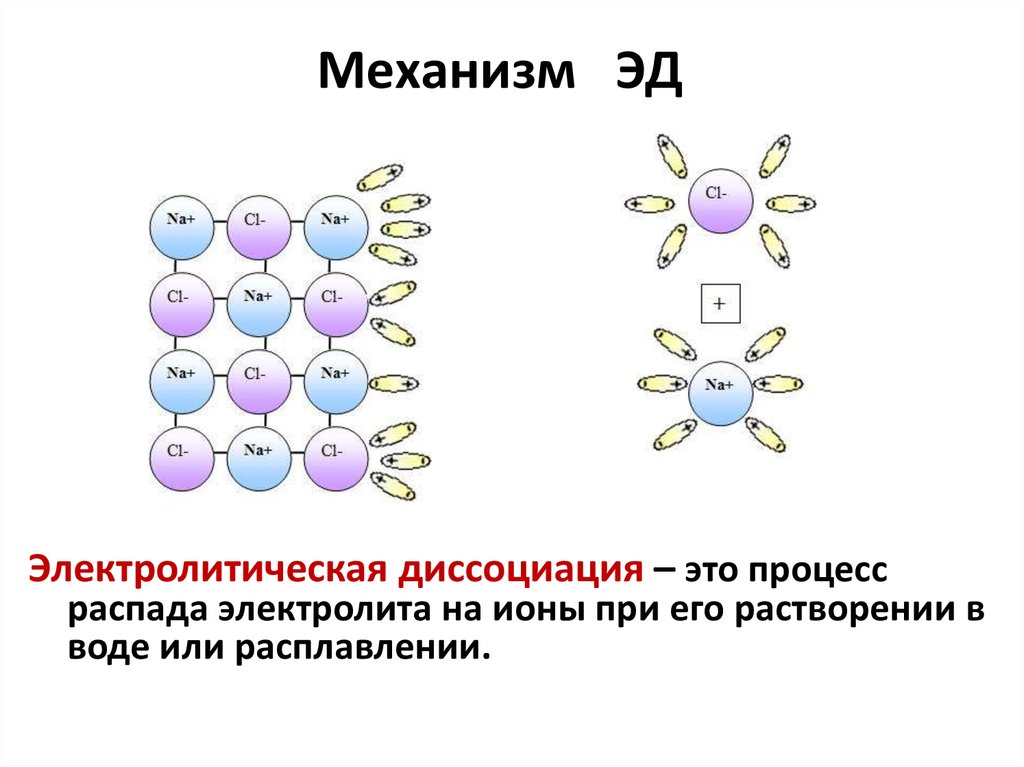
К вопросу о расчетах множественных химических равновесий
Большинство химических реакций, протекающих в разбавленных растворах слабых электролитов, основаны на равновесных процессах с участием ионов. Правильный расчет физико-химических равновесий позволяет контролировать и управлять химическими реакциями, а также создавать необходимые условия для оптимального протекания технологических процессов, качественных и количественных аналитических определений.
В данной статье приведены основы математического расчета различных химических равновесий, условий и полноты протекания реакций и определения равновесных концентраций веществ в реагирующих системах.
Ключевые слова: химическое равновесие, равновесная концентрация, константа ионизации, слабая кислота, слабое основание, ступенчатая диссоциация, материальный баланс, фосфорная кислота, гидрат аммиака, константа автопротолиза, ионное произведение воды, гидролиз солей, константа гидролиза, произведение растворимости солей
Keywords. Chemical equilibrium, equilibrium concentration, ionization constant, weak acid, weak base, stepwise dissociation, material balance, phosphoric acid, ammonium hydroxide, autoprotolysis constant, ionic product of water, hydrolysis of salts, hydrolysis constant, solubility product of salts.
Chemical equilibrium, equilibrium concentration, ionization constant, weak acid, weak base, stepwise dissociation, material balance, phosphoric acid, ammonium hydroxide, autoprotolysis constant, ionic product of water, hydrolysis of salts, hydrolysis constant, solubility product of salts.
Рассмотрение вопросов о расчете химических равновесий начнем с конкретных примеров.
Задача 1. Вычислить концентрацию продуктов ступенчатой диссоциации ортофосфорной кислоты в 0,1 М водном растворе. Рассчитать степень диссоциации кислоты в этом растворе.
Решение. Вразбавленных водных растворах ортофосфорная кислота ведет себя как сильная кислота, однако только один из протонов отщепляется легко, и константа ионизации по первой ступени достаточно высокая. Вторая и третья константы ионизации последовательно снижаются на пять порядков.
Запишем уравнения ступенчатой диссоциации ортофосфорной кислоты:
(I ступень) H3PO4 + H2O H3O+ + H2PO4–, ;
(II ступень) H2PO4– + H2O H3O+ + HPO42–, ;
(III ступень) HPO42–
Здесь и далее pK = — lgKравн — логарифмический показатель констант равновесия, а все расчеты проводятся для стандартных состояний веществ и t=25°C.
С учетом всех трех стадий ступенчатой диссоциации фосфорной кислоты можно составить уравнение материального баланса. Одним из условий материального баланса является неизменность содержания определенного вида атомов (или групп атомов) в процессе химического превращения веществ в изолированной системе. Например, водород в рассматриваемой системе находится в виде гидратированных ионов H
.
Баланс по числу атомов фосфора можно представить в следующем виде:
.
Каждое химическое равновесие характеризуется своей константой равновесия. Для рассматриваемых случаев — это ступенчатые константы ионизации:
Для рассматриваемых случаев — это ступенчатые константы ионизации:
;
;
.
Поскольку значения и различаются приблизительно в 105 раз, концентрацию протонов можно вычислить с учетом диссоциации H3PO4 только по первой ступени. Данное допущение не вызывает больших погрешностей расчетов, если многоосновной кислоты превышает примерно в 103 раз и более.
Предположим, что в процессе диссоциации фосфорной кислоты по первой ступени образуется равное количество ионов H+ и H2PO4–, а их равновесную концентрацию обозначим x моль/л. Тогда равновесная концентрация фосфорной кислоты составит (0,1 — x), моль/л:
H3PO4 + H
(0,1 – x) xx
Подставим равновесные концентрации этих ионов в выражение для константы равновесия :
,
или .
Решая квадратное уравнение, получаем:
моль/л.
В том случае, если кислота очень слабая, то [H+]0HA и C0HA — [H+] ≈ C0HA. Равновесную концентрацию протонов в таких растворах вычисляют по следующей формуле:
.
Данное допущение оправдано для кислот с pK≥4 (при условии, что C
Значения и различаются в 105 раз, поэтому концентрацию иона HPO42– определим с учетом диссоциации кислоты по II ступени:
моль/л.
Концентрация аниона, образующегося в результате диссоциации слабой кислоты H2A по II ступени, численно равна , т. е. [A2–] =·(H2A).
Зная равновесные концентрации ионов H3O+ и HPO42–, вычислим концентрацию иона PO43–:
(или 1,14·10–18моль/л).
По равновесным концентрациям продуктов диссоциации фосфорной кислоты найдем степень диссоциации (α) по всем трем ступеням:
или 23,3 %;
или 2,7·10–4 %;
или 1,8·10–9 %.
В растворах, где [H3O+]0HA, степень диссоциации (α) можно определить по следующему уравнению:
.
Математическими расчетами были определены области преобладания частиц в водном растворе ортофосфорной кислоты в зависимости от pH среды: H
Задача 2. Определите, какие продукты будут образовываться при взаимодействии ортофосфорной кислоты и гидрата аммиака в разбавленном водном растворе.
Решение. Для ответа на вопрос рассчитаем константу равновесия следующей реакции в предположении того, что гидрат аммиака (NH
H3PO4 + 3 NH3·H2O 3 NH4+ + PO43– + 3 H2O.
С учетом закона действующих масс константу равновесия можно записать в следующем виде:
;
или .
К данному выражению мы пришли с учетом следующих допущений:
а) в водном растворе происходит диссоциация гидрата аммиака:
3 NH3·H2O 3 NH4+ + 3 OH–.
Запишем выражение для константы равновесия данной реакции:
;
выражение носит название константы диссоциации (ионизации) основания NH
б) В водном растворе происходит ионизация молекул фосфорной кислоты:
H3PO4 + 3 H2O 3 H3O+ + PO43–.
Запишем выражение для константы равновесия данной реакции с учетом выражений для констант диссоциации фосфорной кислоты по трем ступеням:
.
После преобразований получаем следующее равенство:
,
.
в) Вода (H2O) — слабый электролит и в незначительной степени подвергается ионизации. Этот процесс называется автопротолизом. Схематично его можно представить так:
H2O + H2O H3O+ + OH–.
Константу равновесия автопротолиза представим в следующем виде:
.
Посредствам измерения электропроводности абсолютно чистой воды было показано, что концентрации ионов H3O+ и OH– составляют 10–7 моль/л, а концентрация молекул H2O составляет 1000/18 = 55,56 моль/л. Отсюда была вычислена константа автопротолиза воды:
.
Диссоциация воды весьма незначительна, поэтому ее концентрацию считают практически неизменной, и выражение для константы диссоциации воды можно представить в следующем виде:
.
Иными словами, произведение концентрации ионов, образующихся в процессе диссоциации воды — есть величина постоянная при данной температуре (25°C), и данная константа называется ионным произведением воды Kw.
С учетом приведенных выше уточнений (а — в) рассчитаем константу равновесия реакции:
.
Величина Kравн служит характеристикой необратимости реакции в данных условиях. Так, если значение Kравн очень велико, то это означает, что при равновесии, концентрации продуктов реакции намного превышают концентрации исходных веществ, и реакция прошла почти до конца, — слева направо.
Предположим, что гидрат аммиака отщепляет от фосфорной кислоты один протон. Рассчитаем константу равновесия данной реакции с учетом представленных выше допущений.
H3PO4 + NH3·H2O H2PO4– + NH4+ + H2O.
,
.
Расчет показал, что химическое равновесие существенно смещено вправо, и реакция в стандартных условиях идет до конца, поскольку значение константы равновесия этой реакции также достаточно велико (Kравн˃˃1).
Пусть на следующей стадии процесса происходит отщепление второго протона. Рассчитаем вероятность этого процесса и сравним с рассмотренными случаями.
H2PO4– + NH3·H2O HPO42– + NH4+ + H2O.
,
.
Расчет показывает, что данная стадия также термодинамически вероятна, поскольку значение константы равновесия положительное, и равновесие существенно смещено вправо, однако величина константы равновесия на пять порядков ниже. Это свидетельствует о меньшей вероятности протекания данного процесса по сравнению с предыдущей реакцией.
Наконец, если предположить отщепление третьего протона на следующей стадии, то реакцию можно представить в следующем виде:
HPO42– + NH3·H2O PO43– + NH4+ + H2O.
,
.
Величина константы равновесия данной реакции свидетельствует о ее неполном прохождении. Равновесие существенно смещено влево.
Равновесие существенно смещено влево.
Таким образом, взаимодействие фосфорной кислоты с гидратом аммиака в основном протекает по схемам:
1) H3PO4 + NH3·H2O NH4H2PO4 + H2O,
2) NH4H2PO4 + NH3·H2O (NH4)2HPO4 + H2O;
или H3PO4 + 2 NH3·H2O 2 (NH4)2HPO4 + 2 H2O.
Задача 3. Рассчитайте концентрации ионов H2PO4– и PO43– в растворе, в котором общая концентрация фосфат-ионов C0n составляет 0,5 моль/л, а pH раствора равен 5.
Решение. Зная pH раствора, находим концентрацию протонов: [H3O+]=10–5 моль/л.
Для любого слабого электролита состава AHn с учетом уравнения материального баланса (например, по числу атомов A) и выражений констант равновесия (пусть n=2 и диссоциация AHn идет по двум ступеням), после несложных математических преобразований можно записать следующее выражение для концентрации :
.
Если – доля недиссоциированных молекул, то с учетом выражения для , получим:
.
Доли продуктов диссоциации не зависят от общей концентрации электролита, а зависят от концентрации ионов H3O+ и — через константы диссоциации — от природы электролита. Поэтому, если известен pH раствора, то легко можно рассчитать концентрации продуктов диссоциации.
Для любого слабого электролита состава AB2 можно написать общее выражение знаменателя в формуле для расчета долей продуктов диссоциации (α):
[B]n + K1· [B]n-1 + K1·K2· [B]n-2 + … + K1·K2…Kn-1· [B] + K1·K2…Kn.
Например, долю ионов ABn-2 можно определить по следующей формуле:
.
Если из выражений констант ступенчатой диссоциации фосфорной кислоты выразить концентрации соответствующих ионов (H2PO4–, HPO42–, PO43–) и подставить в выражение материального баланса по атомам фосфора, то можно получить следующее уравнение для истинной концентрации фосфорной кислоты :
, , ;
Если перед нами встала задача определения мольной доли, например, фосфорной кислоты, оставшейся в недиссоциированном (молекулярном) состоянии, нам необходимо найти отношение концентрации частиц [H3PO4] к суммарной концентрации всех частиц :
.
Вернемся к нашему примеру. Зная значения констант диссоциации фосфорной кислоты аналогичным образом определим долю ионов, образующихся по первой ступени (H2PO4–):
;
;
.
Тогда концентрацию ионов H2PO4– определим следующим образом:
[H2PO4–] = · C0n = 0,99·0,5 = 0,495 моль/л.
Доля ионов, образующихся по второй ступени, определяется по выведенной выше формуле и после подстановки соответствующих значений составит . Концентрацию ионов PO43– определим аналогично:
[PO43–] = · C0n = 3,3·10–10·0,5 = 16,5·10–11 моль/л.
Задача 4. Определить pH 0,1 М водных растворов ортогидрофосфата и ортофосфата натрия с учетом процесса гидролиза солей. Возможно ли растворение цинка в данных растворах?
Решение. а)Соль Na2HPO4 в водном растворе диссоциирована практически полностью:
а)Соль Na2HPO4 в водном растворе диссоциирована практически полностью:
Na2HPO4 → 2 Na+ + HPO42–.
Гидрофосфат-ион (HPO42–) подвергается гидролизу по первой ступени в соответствии со следующей схемой:
HPO42– + H2O H2PO4– + OH–,
далее дигидрофосфат-ион подвергается гидролизу по второй ступени:
H2PO4– + H2O H3PO4 + OH–.
Запишем выражения для констант гидролиза и определим их значения:
,
где , так как H2PO4– + H2O HPO42– + H3O+, а , так как H2O + H2O H3O+ + OH–.
.
В данных расчетах, как и в предыдущих мы использовали следующий прием: умножили числитель и знаменатель дроби на концентрацию ионов H3O+, тем самым пришли к выражениям для константы ионизации и константы автопротолиза.
KIгидр превышает KIIгидр практически в 105 раз, поэтому гидролизом по второй ступени можно пренебречь.
Гидрофосфат-ион (HPO42–) диссоциирует в водном растворе по следующей схеме:
HPO42– + H2O H3O+ + PO43–.
Для данного процесса запишем выражение для константы равновесия:
.
Протоны, появляющиеся в результате диссоциации гидрофосфат-ионов, реагируют с OH–-ионами, образующимися при гидролизе HPO42–-иона. Учитывая, что [H3O+] = [PO43–] и [OH–] = [H2PO4–], равновесная концентрация протонов в растворе Na2HPO4 определяется разностью [H3O+]= = [PO43–] — [H2PO4–] или [OH–] = [H2PO4–] — [PO43–].
Выразим концентрацию ионов H2PO4– и PO43– через константы равновесий реакций гидролиза и диссоциации иона H2PO4–:
,
.
Из ионного произведения воды следует, что , поэтому после подстановки соотношение примет следующий вид:
.
Теперь, зная концентрации фосфат- и дигидрофосфат-ионов, определим равновесную концентрацию протонов:
.
Далее, после преобразований получаем следующее уравнение:
,
где ; она намного меньше концентрации ионов HPO42– и практически равна начальной концентрации соли Na2HPO4, т. е. 0,1 моль/л. Поэтому сумма упрощается: , и уравнение примет следующий вид:
.
В итоге, величину pH можно определить следующим образом:
.
По данной формуле рассчитаем величину pH в 0,1 М растворе Na2HPO4:
.
Аналогично можно показать, что в растворе соли NaH2PO4 pH вычисляется по формуле:
.
б) Рассчитаем pH 0,1 М раствора Na3PO4. Здесь приведем упрощенный расчет. В данном случае также после диссоциации соли протекает протолиз аниона:
Na3PO43 Na+ + PO43–,
PO43– + H2O HPO42– + OH–.
Запишем выражение для константы равновесия:
,
откуда ,
.
Высокие значения pH среды в данных растворах (0,1 М Na2HPO4 pH=9,8; 0,1 М Na3PO4 pH=12,7) свидетельствуют о сильнощелочной среде. В задаче стоял вопрос о растворимости цинка в этих растворах. Основываясь на знании химических свойств цинка, в частности, его способности взаимодействовать с растворами щелочей, можно предложить следующие реакции для процессов растворения цинка в растворах Na2HPO4 и Na3PO4:
2 Na2HPO4 + Zn + 4 H2O = Na2 [Zn(OH)4] + 2 NaH2PO4 + H2↑,
2 Na3PO4 + Zn + 4 H2O = Na2 [Zn(OH)4] + 2 Na2HPO4 + H2↑.
Задача 5. Вычислить без учета гидролиза и с учетом гидролиза произведение растворимости фосфата серебра , если растворимость этой соли в воде при комнатной температуре равна 4,68·10–6 моль/л. Вычислить pH насыщенного раствора Ag3PO4.
Решение. Внасыщенном растворе Ag3PO4 существует равновесие:
Ag3PO4 (крист.) 3 Ag+ + PO43–
3·4,68·10–6 моль/л 4,68·10–6 моль/л.
а) Если растворимость соли составляет 4,68·10–6 моль/л, то в соответствии с уравнением процесса, но без учета гидролиза получим следующее: [PO43–] = 4,68·10–6 моль/л, а [Ag+] = 3· [PO43–] = 3·4,68·10–6 моль/л.
По этим данным вычислим :
.
Справочная величина составляет: .
б) Вычислим с учетом процесса гидролиза фосфата серебра.
Образующийся при растворении в воде Ag3PO4 ион PO43– подвергается гидролизу:
PO43– + H2O HPO42— + OH–
Пусть подверглось гидролизу x моль/л иона PO43–, а образовалось в результате гидролиза по (4,68·10–6 — x) моль/л ионов HPO42– и OH–, соответственно.
Запишем выражение для константы гидролиза:
.
Гидролиз иона PO43– по первой ступени при концентрации 4,68·10–6 моль/л протекает практически полностью, поэтому за наименьшую равновесную концентрацию x принимаем равновесную концентрацию ионов PO43–, т. е. [PO43–] = x, [HPO42–] = [OH–] = 4,68·10–6 — x, моль/л.
Подставим равновесные концентрации в выражение для константы гидролиза:
.
Допустим, что 4,68·10–6 — x ≈ 4,68·10–6. Тогда 2,37·10–2 · x = (4,68·10–6)2 и x = 9,24·10–10 моль/л. Эта величина достаточно мала и в приближенных расчетах ей можно пренебречь.
Следовательно, [OH–] ≈ 4,68·10–6 моль/л и pH = 14 + lg 4,68·10–6 = 8,67.
Гидролиз Ag3PO4 по катиону протекает незначительно. Константа гидролиза Ag+ очень мала (). При [Ag+] = 3·4,68·10–6 = 1,4·10–5 моль/л и [OH–] = 4,68·10–6 моль/л концентрация AgOH составит: [AgOH] = βAgOH [Ag+] [OH–] = 2·102·1,4·10–5·4,68·10–6 = 1,31·10–8 моль/л, т. е. всего около 0,1 % от начальной концентрации ионов Ag+. Здесь β — общая константа устойчивости AgOH, которая определяет следующее равновесие:
Ag+ + OH–AgOH,
.
Следовательно, поправка к pH, учитывающая гидролиз соли по катиону в насыщенном растворе Ag3PO4, невелика.
Рассчитаем значение произведения растворимости соли с учетом гидролиза:
.
Данное значение существенно отличается от величины, найденной без учета гидролиза соли.
На простых примерах мы убедились, что расчет химических равновесий с применением простейших алгебраических алгоритмов и приемов, позволяет предсказать принципиальную возможность (вероятность) протекания химической реакции, а также сделать вывод о влиянии тех или иных факторов на смещение химического равновесия с целью достижения необходимого положительного эффекта процесса. На основании значений констант химического равновесия конкурентно протекающих реакций можно сделать вывод о преобладающем значении той или иной реакции в общем массиве термодинамически вероятных процессов.
Литература:
- Гольбрайх З. Е., Маслов Е. И. Сборник задач и упражнений по химии: Учебное пособие для хим.
 -технол. спец. вузов. — М.: Высш. шк., 1997.
-технол. спец. вузов. — М.: Высш. шк., 1997. - Михайлов В. А. Химическое равновесие: учебное пособие / В. А. Михайлов, О. В. Сорокина, Е. В. Савинкина, М. Н. Давыдова; Под ред. А. Ю. Цевадзе. — М.: БИНОМ. Лаборатория знаний, 2011.
- Сборник вопросов и задач по аналитической химии. Учебное пособие для вузов / В. П. Васильев, В. Е. Калинина, Л. А. Кочергина и др. Под ред. В. П. Васильева. — М.: Высш. шк., 1976.
Основные термины (генерируются автоматически): ступенчатая диссоциация, фосфорная кислота, константа ионизации, материальный баланс, ортофосфорная кислота, равновесная концентрация, III, константа равновесия, ступень, химическое равновесие.
Диссоциация — фосфорная кислота — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
| Распределительная диаграмма фосфорной кислоты в. зависимости от рН. [31] |
Как обычно мы должны рассмотреть важнейшие источники ионов водорода в этой системе. В принципе фосфорная кислота может поставлять протоны в результате каждой ступени диссоциации, вода также является потенциальным источником ионов водорода. Однако, принимая во внимание сравнительно большое значение константы первой диссоциации фосфорной кислоты, имеет смысл здесь пренебречь иными источниками протонов. Поэтому эта задача очень похожа на задачи, поставленные в примерах 4 — 3, 4 — 4 и 4 — 5, в которых рассматриваются слабые монопротонные кислоты.
[32]
В принципе фосфорная кислота может поставлять протоны в результате каждой ступени диссоциации, вода также является потенциальным источником ионов водорода. Однако, принимая во внимание сравнительно большое значение константы первой диссоциации фосфорной кислоты, имеет смысл здесь пренебречь иными источниками протонов. Поэтому эта задача очень похожа на задачи, поставленные в примерах 4 — 3, 4 — 4 и 4 — 5, в которых рассматриваются слабые монопротонные кислоты.
[32]
Подобные исследования были проведены и с фосфатными электродами, содержащими в качестве активного компонента фосфат исмута. Однако при потенциометрическом титровании фосфор-лой кислоты раствором едкого натра наблюдаются два скачка, соответствующие первой и второй ступеням диссоциации фосфорной кислоты. [33]
Реакция образования СаНРО4 затрудняется тем, что нитрат кальция взаимодействует с фосфорной кислотой, полученной в результате гидролиза одноза-мещенного фосфата. Кроме того, замещение второго атома водорода в фосфорной кислоте идет значительно медленнее, чем первого. Это видно из сопоставления констант разных ступеней диссоциации фосфорной кислоты ( стр.
[34]
Кроме того, замещение второго атома водорода в фосфорной кислоте идет значительно медленнее, чем первого. Это видно из сопоставления констант разных ступеней диссоциации фосфорной кислоты ( стр.
[34]
Интересно, что для ряда кислот р имеет одинаковое значение, а именно 5 — 10 — 5; это показывает, что если изобразить Ig / Ca — Ig / Ce графически для ряда кислот в зависимости от соответствующих значений t — в, то все точки попадут на одну параболическую кривую. Температура, при которой константа диссоциации имеет максимальное значение, зависит от природы кислоты; для уксусной кислоты она равна 22 6, для других кислот были найдены более высокие и более низкие значения этой температуры. Для некоторых кислот, например хлоруксусной и для первой ступени диссоциации фосфорной кислоты, максимум константы диссоциации получается при температурах ниже точки замерзания воды. [35]
Изменение степени разложения фосфорной кислотой вятского флотационного концентрата во времени при разных температурах.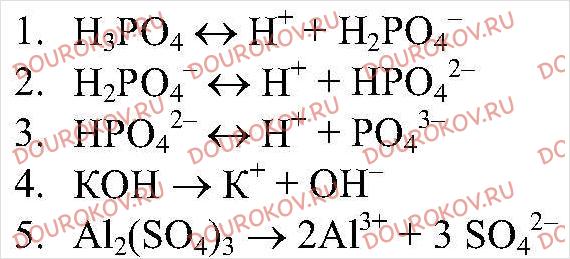 [36]
[36] |
Большое влияние на скорость разложения имеет природа фосфата ( общая удельная поверхность элементарных зерен) 6566, Хибинский апатит обладает очень малой общей удельной поверхностью ( см. гл. XXIII), поэтому он разлагается кислотами относительно медленно. Кривые, приведенные на рис. 230, характерны также для егорьевского и актюбинского фосфоритов. При разложении фосфата в две ступени по уравнениям ( 2) и ( 3) в первой ступени процесса диссоциация фосфорной кислоты постепенно подавляется вследствие роста концентрации монокальцийфосфата в растворе. Поэтому растворение апатита замедляется. [37]
Интерес представляет метод разделения неметаллов и металлов. В качестве примера описан простой и удобный метод отделения борной кислоты от соли никеля поглощением последнего на катионите. В то же время применение этого метода связано с серьезными затруднениями, особенно в присутствии металлов высшей валентности. Так, например, отделение трехвалентного железа от фосфорной кислоты возможно лишь ограниченно. Для поглощения фосфорной кислоты на анионите необходимо перевести молекулы фосфорной кислоты в анионы; для этого следует повысить рН раствора. Если же применять сильнокислую среду, когда гидроокись и фосфат железа полностью растворимы, то будет подавлена диссоциация фосфорной кислоты. Это уменьшает ее поглощение на анионите. Затруднение усиливается также в связи с конкуренцией со стороны других анионов, введение которых неизбежно при подкислении.
[38]
Для поглощения фосфорной кислоты на анионите необходимо перевести молекулы фосфорной кислоты в анионы; для этого следует повысить рН раствора. Если же применять сильнокислую среду, когда гидроокись и фосфат железа полностью растворимы, то будет подавлена диссоциация фосфорной кислоты. Это уменьшает ее поглощение на анионите. Затруднение усиливается также в связи с конкуренцией со стороны других анионов, введение которых неизбежно при подкислении.
[38]
Страницы: 1 2 3
Первая константа диссоциации фосфорной кислоты от 0°C до 60°C; Ограничения метода ЭДС для кислот средней силы
%PDF-1.4 % 122 0 объект > эндообъект 117 0 объект >поток application/pdf
 Документы находятся в общественном достоянии и не защищены авторским правом в США. Тем не менее, обратите особое внимание на отдельные работы, чтобы убедиться, что не указаны ограничения авторского права. Для отдельных произведений может потребоваться получение других разрешений от первоначального правообладателя.
Документы находятся в общественном достоянии и не защищены авторским правом в США. Тем не менее, обратите особое внимание на отдельные работы, чтобы убедиться, что не указаны ограничения авторского права. Для отдельных произведений может потребоваться получение других разрешений от первоначального правообладателя. adobe.com/xap/1.0/mm/xmpMMXMP Media Management
adobe.com/xap/1.0/mm/xmpMMXMP Media ManagementОпределение внутриклеточного pH методом 31P-ЯМР.
 Вторая константа диссоциации фосфорной кислоты в биологической системе | Журнал биохимии
Вторая константа диссоциации фосфорной кислоты в биологической системе | Журнал биохимииФильтр поиска панели навигации Журнал биохимииЭтот выпускБиохимияКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Журнал биохимииЭтот выпускБиохимияКнигиЖурналыOxford Academic Введите поисковый запрос
Расширенный поиск
Журнальная статья
Получить доступ
Йошитеру SEO,
Ёситеру SEO
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Масатака МУРАКАМИ,
Масатака МУРАКАМИ
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Хироши ВАТАРИ,
Хироши ВАТАРИ
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Юсуке Имаи,
Юсуке ИМАИ
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Кадзуо ЁШИЗАКИ,
Казуо ЁШИЗАКИ
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Хироясу НИШИКАВА,
Хироясу НИШИКАВА
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Такетоши МОРИМОТО
Такетоши МОРИМОТО
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google Scholar
Журнал биохимии , том 94, выпуск 3, июль 1983 г. , страницы 729–734, https://doi.org/10.1093/oxfordjournals.jbchem.a134413
, страницы 729–734, https://doi.org/10.1093/oxfordjournals.jbchem.a134413
Опубликовано:
01 июля 1983 г.
История статьи
Получено:
7 марта 1983 г.
Опубликовано:
01 июля 1983 г.
Фильтр поиска панели навигации Журнал биохимииЭтот выпускБиохимияКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Журнал биохимииЭтот выпускБиохимияКнигиЖурналыOxford Academic Введите поисковый запрос
Advanced Search
Abstract
Для оценки точности определения pH методом 31 P-ЯМР факторы, влияющие на значение pK фосфата, оценивали на основе титрования 1 мМ фосфатного буферного раствора. Когда этот метод используется для определения рН цитоплазмы, ионная сила является основным фактором, вызывающим сдвиги кажущегося значения pK ( pK’ ), и величина сдвига может быть предсказана по ионной силе, рассчитанной с помощью уравнение Дебая-Хюккеля. Ионы (Na + , K + , Mg 2+ и Ca 2+ ) и белок слюны влияли на значение pK’ на 0,1–0,3 единицы в растворе с заданной ионной силой в зависимости от вида. иона. Форма кривой титрования менялась в зависимости от температуры. На основании этих результатов было получено значение 6,75 с погрешностью 0,12 для внутриклеточного pK’ мышцы лягушки при 24°C.
Когда этот метод используется для определения рН цитоплазмы, ионная сила является основным фактором, вызывающим сдвиги кажущегося значения pK ( pK’ ), и величина сдвига может быть предсказана по ионной силе, рассчитанной с помощью уравнение Дебая-Хюккеля. Ионы (Na + , K + , Mg 2+ и Ca 2+ ) и белок слюны влияли на значение pK’ на 0,1–0,3 единицы в растворе с заданной ионной силой в зависимости от вида. иона. Форма кривой титрования менялась в зависимости от температуры. На основании этих результатов было получено значение 6,75 с погрешностью 0,12 для внутриклеточного pK’ мышцы лягушки при 24°C.
Этот контент доступен только в формате PDF.
© 1983, Японское биохимическое общество
Раздел выпуска:
Статьи
В настоящее время у вас нет доступа к этой статье.
Скачать все слайды
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. См. ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи, в которой выполнен вход, и доступ к функциям управления учетной записью.

- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
Покупка
Стоимость подписки и заказ этого журнала
Варианты покупки книг и журналов в Oxford Academic
Кратковременный доступ
Чтобы приобрести краткосрочный доступ, пожалуйста, войдите в свой личный аккаунт выше.

 -технол. спец. вузов. — М.: Высш. шк., 1997.
-технол. спец. вузов. — М.: Высш. шк., 1997.
Leave A Comment