Тест по физике по теме «Дисперсия света. Интерференция света» 11 класс. | Тест по физике (11 класс) на тему:
ТЕСТ ДИСПЕРСИЯ, ИНТЕРФЕРЕНЦИЯ СВЕТА.
1 вариант
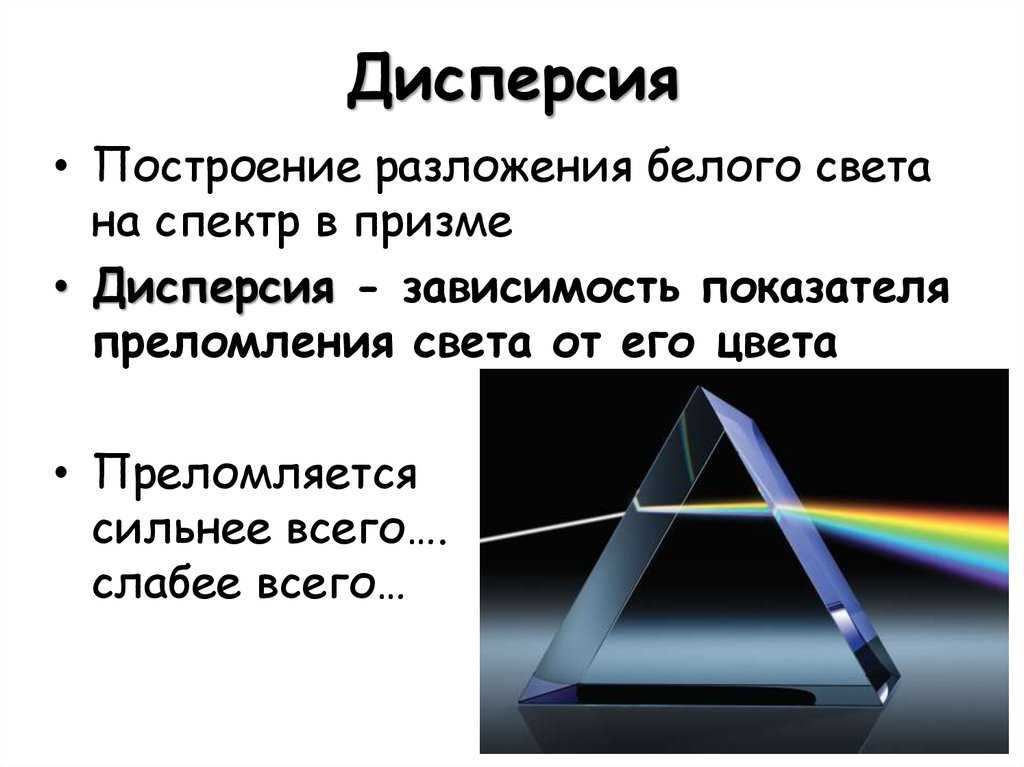
1. Разложение пучка солнечного света в спектр при прохождении его через призму объясняется тем, что свет состоит из набора электромагнитных волн разной длины, которые, попадая в призму,
А.движутся с разной скоростью
Б.имеют одинаковую частоту
В.поглощаются в разной степени
Г.имеют одинаковую длину волны
2. После прохождения белого света через красное стекло свет становится красным. Это происходит из-за того, что световые волны других цветов в основном
А.отражаются
Б.рассеиваются
В.преломляются
Г.поглощаются
3. Узкий световой пучок после прохождения через прозрачную призму дает на экране спектр. Укажите правильную последовательность цветов в спектре.
А. ор-зел-син-гол Б. гол-син-зел-фиол
гол-син-зел-фиол
В. ор-жел-зел-гол Г. жел-ор-зел-гол
4. При выдувании мыльного пузыря при некоторой толщине пленки он приобретает радужную окраску. Какое физическое явление лежит в основе этого наблюдения?
А.интерференция
Б.дифракция
В.поляризация
Г.дисперсия
5. На переднюю грань прозрачной стеклянной призмы падают параллельные друг другу зеленый и красный «лучи» лазеров. После прохождения призмы
зел
А.они останутся параллельными
кр Б.они разойдутся так, что не будут
пересекаться
В.они пересекутся
Г.ответ зависит от сорта стекла
6. Интерфереция света – это…
А.отклонение от прямолинейности в распространении световых волн
Б.зависимость показателя преломления вещества от частоты световой волны
В. перераспределение энергии волн в пространстве при наложении волн друг на друга
перераспределение энергии волн в пространстве при наложении волн друг на друга
Г.исчезновение преломленных лучей
7. Каким образом можно на опыте получить когерентные волны?
А.от двух источников одинаковой частоты
Б.от двух произвольных источников света
В.пропустив свет через стеклянную призму
Г.разделив световой пучок на две части
8. Ученик рассматривает записи в тетради, сделанные синими чернилами через оранжевое стекло. Какой цвет букв он увидит?
А. черный
Б. синий
В. зеленый
Г. оранжевый
9. Условие минимума интерференции когерентных световых волн…
А.∆d=kλ
Б.∆d=kλ/2
В.∆d=2kλ
Г.∆d=(2k+1).λ/2
ТЕСТ ДИСПЕРСИЯ, ИНТЕРФЕРЕНЦИЯ СВЕТА.
2 вариант
1.Укажите правильное утверждение. Дисперсия проявляется в следующих природных явлениях:
1) цветные разводы на мыльной пленке 2) радуга
А. только1 Б.только2
только1 Б.только2
В.и1, и2 Г.ни 1, ни2
2.Верно утверждение (-я):
Дисперсией света объясняется физическое явление:
1)фиолетовый цвет мыльной пленки, освещаемой белым светом
2)окрашивание белого света проходящего через фиолетовое стекло
А.только1
Б.только2
В.и1, и2
Г.ни 1, ни2
3.Для определения длин волн угол преломления световых лучей на границе воздух-стекло уменьшается с увеличением длины волны излучения. Ход лучей для трех цветов при падении белого света из воздуха на границу раздела показан на рисунке. Цифрам соответствуют цвета:
А.1-син Б.1-син В.1-кр Г.1-кр
2-зел 2-кр 2-зел 2-син
3-кр 3-зел 3-син 3-зел
1 2 3
5. На переднюю грань прозрачной стеклянной призмы падают параллельные друг другу оранжевый и фиолетовый «лучи» лазеров. После прохождения призмы
На переднюю грань прозрачной стеклянной призмы падают параллельные друг другу оранжевый и фиолетовый «лучи» лазеров. После прохождения призмы
ор
А.они останутся параллельными
фиол Б.они разойдутся так, что не будут
пересекаться
В.они пересекутся
Г.ответ зависит от сорта стекла
6.Дисперсия света – это…
А.огибание волнами препятствий
Б.сложение в пространстве волн
В.разложение бело света на составляющие семь цветов
Г.преломление на границе раздела двух сред
7. Световые волны когерентны, если у них
А.совпадают амплитуды
Б.совпадают частоты
В.постоянен сдвиг фаз
Г.Б и В
8. Ученик рассматривает записи в тетради, сделанные красными чернилами через красное стекло. Какой цвет букв он увидит?
Какой цвет букв он увидит?
А.белый Б.красный
В.черный Г.ничего не увидит
9.Условие максимума интерференции когерентных волн
А.∆d=kλ
Б.∆d=kλ/2
В.∆d=2kλ
Г.∆d=(2k+1).λ/2
Ответы:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
Вариант 1 | А | Г | В | А | В | В | Г | А | Г |
Вариант 2 | В | В | В | В | Б | В | Б | Г | А |
Дисперсия света | Камень
Albert Свойства камней
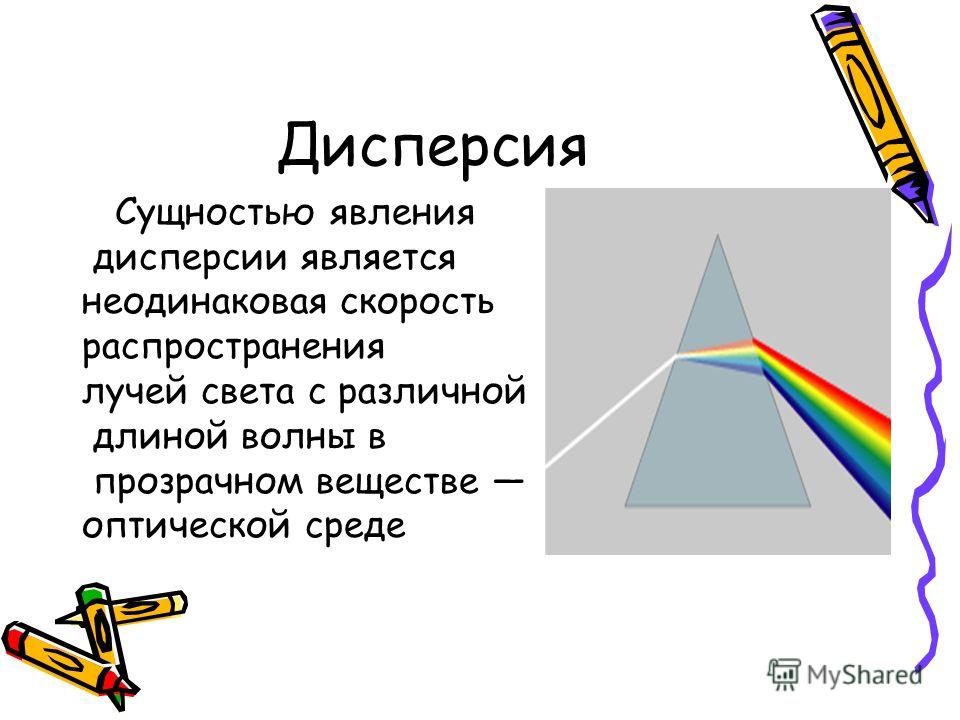
Белый свет при прохождении через кристалл испытывает не только преломление но и распадается на спектральные цвета. Это происходит потому, что показатели светопреломления кристаллов и камней зависят от длины волны проходящего света. Из-за того что некоторые цвета спектра белого света имеют волны разной длины то они и преломляются по разному. Такое явление распада белого света на различные спектральные цвета называется дисперсия света.
Это происходит потому, что показатели светопреломления кристаллов и камней зависят от длины волны проходящего света. Из-за того что некоторые цвета спектра белого света имеют волны разной длины то они и преломляются по разному. Такое явление распада белого света на различные спектральные цвета называется дисперсия света.
Очень хорошо дисперсия проявляется в следующих явлениях только у бесцветных камней. Например у алмаза показатель преломления для красных лучей с длиной волны 687 нм будет составлять 2,407, для жёлтых лучей с длиной волны 589 нм будет составлять 2,417, для зелёных лучей с длиной волны 527 нм будет составлять 2,427, для фиолетовых с длиной волны 397 нм будет составлять 2,465. Природные и синтетические камни имеющие высокое явление дисперсии света используется в ювелирном деле как заменителей алмаза к таковым относятся фабулит, циркон, титанит, сфалерит, рутил. У драгоценных камней дисперсия измеряется в разности между показателем преломления для красных частей спектра с длиной волны 687 нм по линии B и показателем преломления для фиолетовых частей спектра с длиной волны 430,8 нм по линии G.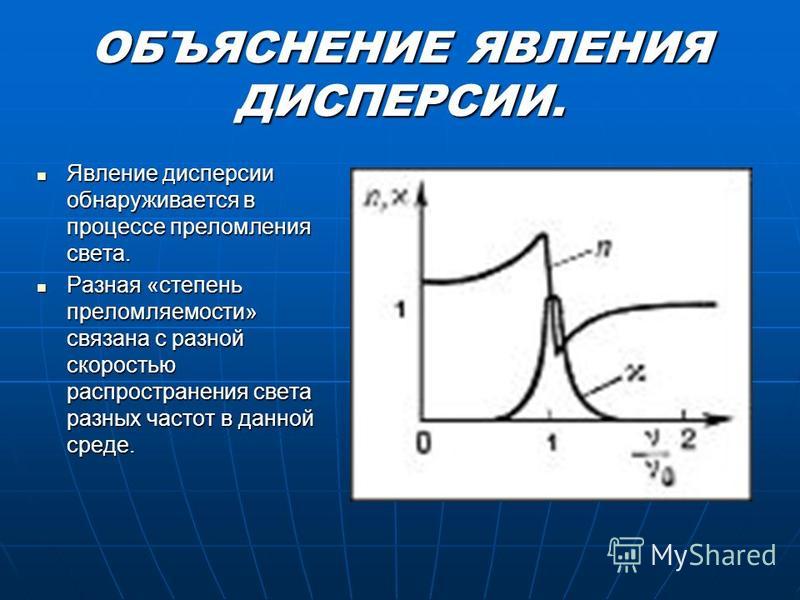
Ниже приведена таблица в которой указана дисперсия цвета в интервале В—G. В таблице у некоторых камней указаны два значения это нормальная и аномальная дисперсия света. Это означает что камень имеет очень сильное двупреломление света и первое число указывает нормальную дисперсию света при наименьшем значении, а второе число указывает аномальную дисперсию света при наибольшем значении.
| Камень | Дисперсия |
|---|---|
| Рутил | 0,280 |
| Анатаз | 0,213 и 0,259 |
| Фабулит | 0,190 |
| Сфалерит | 0,156 |
| Касситерит | 0,071 |
| Джевалит | 0,063 |
| Демантоид | 0,057 |
| Меланит | 0,057 |
| Церуссит | 0,051 |
| Титанит | 0,051 |
| Бенитоит | 0,039 и 0.046 |
| Алмаз | 0,044 |
| Циркон | 0,039 |
| Бенитоит | 0,046 и 0,039 |
| Галлиант | 0,038 |
| С митсонит | 0,014 и 0. 031 031 |
| Эпидот | 0,030 |
| Танзанит | 0,030 |
| Гроссуляр | 0,027 |
| Гессонит | 0,027 |
| Спессартин | 0,027 |
| Виллемит | 0,027 |
| Шеелит | 0,026 |
| Шпинель | 0,026 |
| Альмандин | 0,024 |
| Родолит | 0,024 |
| Ставролит | 0,023 |
| Диоптаз | 0,022 |
| Пироп | 0,022 |
| Кианит | 0,020 |
| Перидот | 0,020 |
| Таафеит | 0,019 |
| Везувиан | 0,019 |
| Корнерупин | 0,018 |
| Рубин | 0,018 |
| Сапфир | 0,018 |
| С ингалит | 0,018 |
| Кальцит | 0,008 и 0,017 |
| Кордиерит | 0,017 |
| Данбурит | 0,017 |
| Г идденит | 0,017 |
| Кунцит | 0,017 |
| Скаполит | 0,017 |
| Турмалин | 0,017 |
| Андалузит | 0,016 |
| Апатит | 0,016 |
| Датолит | 0,016 |
| Эвклаз | 0,016 |
| Александрит | 0,015 |
| Хризоберилл | 0,015 |
| Г амбергит | 0,015 |
| Фенакит | 0,015 |
| Силлиманит | 0,015 |
| Аквамарин | 0,014 |
| Берилл | 0,014 |
| Бразилианит | 0,014 |
| Петалит | 0,014 |
| Изумруд | 0,014 |
| Смитсонит | 0,031 и 0.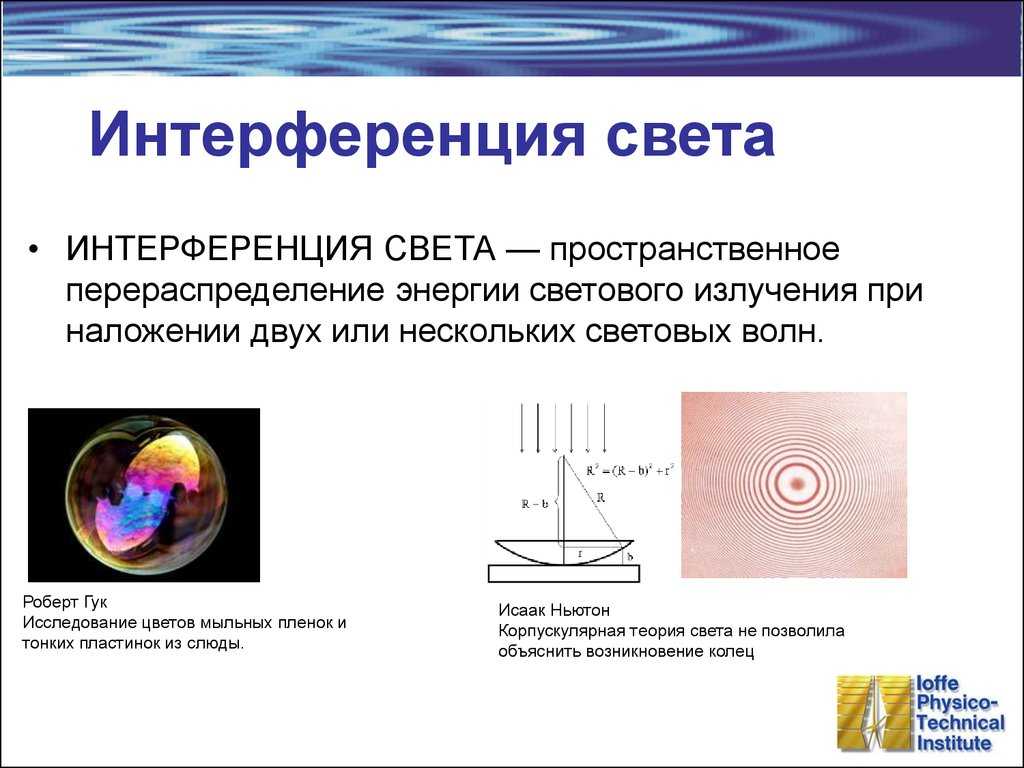 014 014 |
| Топаз | 0,014 |
| Аметист | 0,013 |
| Аметистовый кварц | 0.013 |
| Авантюрин | 0,013 |
| Горный хрусталь | 0,013 |
| Цитрин | 0,013 |
| Празиолит | 0,013 |
| Дымчатый кварц | 0,013 |
| Розовый кварц | 0,013 |
| Тигровый глаз | 0,013 |
| Амазонит | 0,012 |
| Лунный камень | 0,012 |
| Ортоклаз | 0,012 |
| 0,010 | |
| Канкринит | 0,010 |
| Лейцит | 0,010 |
| Обсидиан | 0,010 |
| Кварцевое стекло | 0,010 |
| Кальцит | 0,017 и 0,08 |
| Флюорит | 0,007 |
Дисперсионные явления в уравнениях с частными производными
Artbazar G, Yajima K (2000) The L p -непрерывность волновых операторов для одномерных операторов Шредингера. J Math Sci Univ Tokyo 7(2):221–240
J Math Sci Univ Tokyo 7(2):221–240
MathSciNet МАТЕМАТИКА Google Scholar
Beals M (1994) Optimal L ∞ распада для решений волнового уравнения с потенциалом. J Commun Partial Differ Equ 19(7–8): 1319–1369
MathSciNet МАТЕМАТИКА Google Scholar
Бен-Арци М., Тревес Ф. (1994) Равномерные оценки для одного класса эволюционных уравнений. J Funct Anal 120(2):264–299
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Bergh J, Löfström J (1976) Интерполяционные пространства. Введение. В: Grundlehren der mathematischen Wissenschaften, vol 223. Springer, Berlin 9.0010
Букле Дж.-М., Цветков Н. (2008) О глобальных оценках Стрихарца для метрик без ловушек. J Funct Anal 254(6):1661–1682
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Бургейн Дж. (1993) Явления ограничения преобразования Фурье для некоторых подмножеств решетки и приложения к нелинейным эволюционным уравнениям. I. Уравнения Шредингера. Geom Funct Anal 3 (2): 107–156
(1993) Явления ограничения преобразования Фурье для некоторых подмножеств решетки и приложения к нелинейным эволюционным уравнениям. I. Уравнения Шредингера. Geom Funct Anal 3 (2): 107–156
Перекрёстная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Bourgain J (1995a) Некоторые новые оценки колебательных интегралов. В: (1991) Очерки анализа Фурье в честь Элиаса М. Штейна, Принстонская математическая серия, том 42. Princeton Univ Press, Принстон, стр. 83–112
Google Scholar
Бургейн Дж. (1995b) Оценки конусных множителей. В: Геометрические аспекты функционального анализа, Успехи и приложения теории операторов, т. 77. Биркхойзер, Базель, стр. 41–60 9.0010
Перекрёстная ссылка Google Scholar
Бургейн Дж. (1998) Уточнения неравенства Стрихарца и приложения к 2D-NLS с критической нелинейностью.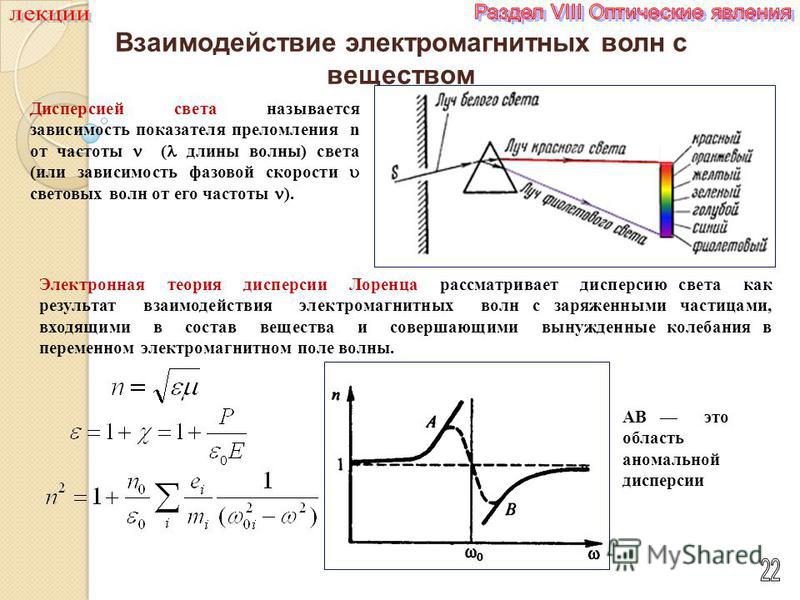
CrossRef МАТЕМАТИКА Google Scholar
Бреннер П. (1975) На L р − Л стр’ оценок для волнового уравнения. Math Z 145(3):251–254
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Бреннер П. (1977) Л р − Л стр’ — оценки интегральных операторов Фурье, связанных с гиперболическими уравнениями. Math Z 152(3):273–286
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Бурк Н., Жерар П., Цветков Н. (2003) Задача Коши для нелинейного уравнения Шредингера на компактном многообразии. J Nonlinear Math Phys 10(1):12–27
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Казенав Т. (2003) Полулинейные уравнения Шрёдингера. Лекционные заметки Куранта по математике, том 10. Нью-Йоркский университет, Институт математических наук Куранта, Нью-Йорк,
(2003) Полулинейные уравнения Шрёдингера. Лекционные заметки Куранта по математике, том 10. Нью-Йоркский университет, Институт математических наук Куранта, Нью-Йорк,
. Google Scholar
Choquet-Bruhat Y (1950) Теорема существования для уравнений эйнштейновской гравитации в неаналитических целях. CR Acad Sci Paris 230:618–620
МАТЕМАТИКА Google Scholar
Christodoulou D, Klainerman S (1989) Нелинейная устойчивость метрики Минковского в общей теории относительности. В: Бордо (1988) Нелинейные гиперболические задачи, Лекционные заметки по математике, том 1402. Springer, Берлин, стр. 128–145 9.0010
Перекрёстная ссылка Google Scholar
Д’Анкона П., Фанелли Л. (2006a) Оценки затухания для волнового уравнения и уравнения Дирака с магнитным потенциалом. Связь Чистая. Appl Anal 29: 309–323
Google Scholar
Д’Анкона П. , Фанелли Л. (2006b) Л p – ограниченность волнового оператора для одномерного оператора Шредингера. Коммунальная математика, физика 268: 415–438
, Фанелли Л. (2006b) Л p – ограниченность волнового оператора для одномерного оператора Шредингера. Коммунальная математика, физика 268: 415–438
Перекрёстная ссылка ОБЪЯВЛЕНИЯ МАТЕМАТИКА Google Scholar
Д’Анкона П., Фанелли Л. (2008) Стрихарц и оценки сглаживания для дисперсионных уравнений с магнитными потенциалами. Commun Partial Differ Equ 33(6):1082–1112
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Д’Анкона П., Пьерфеличе В. (2005) О волновом уравнении с большим грубым потенциалом. J Funct Anal 227 (1): 30–77
Перекрёстная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Д’Анкона П., Георгиев В., Кубо Х. (2001) Оценки взвешенного затухания для волнового уравнения. J Differ Equ 177(1):146–208
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Foschi D (2005) Неоднородные оценки Стрихарца.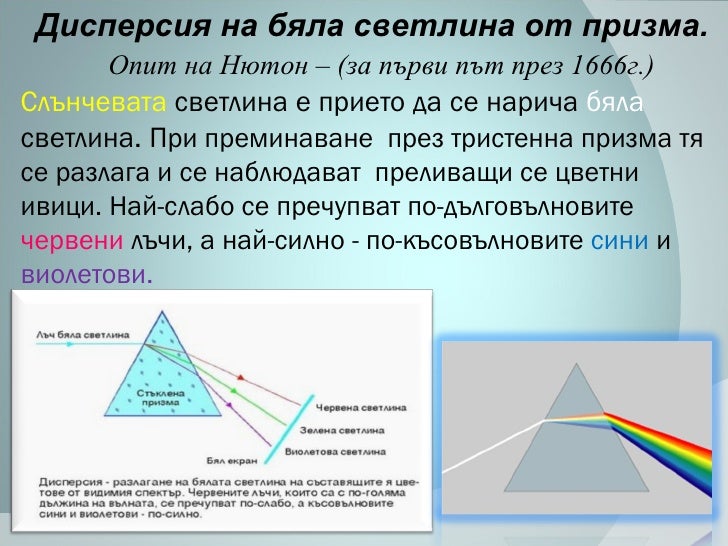 J Hyperbolic Differ Equ 2(1):1–24
J Hyperbolic Differ Equ 2(1):1–24
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Джинибре Дж., Вело Г. (1985) Новый взгляд на глобальную задачу Коши для нелинейного уравнения Шрёдингера. Ann Inst Poincaré H Anal Non Lineaire 2(4):309–327
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Джинибре Дж., Вело Г. (1995) Обобщенные неравенства Стрихарца для волнового уравнения. J Funct Anal 133(1):50–68
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Хассел А., Тао Т., Вунш Дж. (2006) Точные оценки Стрихарца на асимптотически конических многообразиях без ловушек. Am J Math 128(4):963–1024
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Хёрмандер Л. (1997) Лекции по нелинейным гиперболическим дифференциальным уравнениям. Mathématiques & Applications (Математика и приложения), том 26. Springer, Berlin
Mathématiques & Applications (Математика и приложения), том 26. Springer, Berlin
MATH Google Scholar
Джон Ф. (1979) Разрушение решений нелинейных волновых уравнений в трехмерном пространстве. рукописьa math 28(1–3):235–268
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
John F, Klainerman S (1984) Почти глобальное существование нелинейных волновых уравнений в трех измерениях пространства. Commun Pure Appl Math 37(4):443–455
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Journé J-L, Soffer A, Sogge CD (1991) Оценки затухания для операторов Шредингера. Commun Pure Appl Math 44(5):573–604
CrossRef МАТЕМАТИКА Google Scholar
Като Т. (1965/ (1966) Волновые операторы и подобие некоторых несамосопряженных операторов. Math Ann 162:258–279
Math Ann 162:258–279
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Кил М., Тао Т. (1998) Оценки конечной точки Стрихарца. Am J Math 120(5):955–980
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Клайнерман С. (1980) Глобальное существование нелинейных волновых уравнений. Commun Pure Appl Math 33(1):43–101
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Клайнерман С. (1981) Классические решения нелинейных волновых уравнений и нелинейное рассеяние. В: Тенденции в приложениях чистой математики к механике, том III, Монография и исследования по математике, том 11. Питман, Бостон, стр. 155–162
Google Scholar
Клайнерман С. (1982) Долговременное поведение решений нелинейных эволюционных уравнений. Arch Ration Mech Anal 78(1):73–98
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Клайнерман С. (1985) Долговременное поведение решений нелинейных волновых уравнений. В: Нелинейные вариационные задачи, Исследовательские заметки по математике, том 127. Питман, Бостон, стр. 65–72 9.0010
(1985) Долговременное поведение решений нелинейных волновых уравнений. В: Нелинейные вариационные задачи, Исследовательские заметки по математике, том 127. Питман, Бостон, стр. 65–72 9.0010
Google Scholar
Клайнерман С., Николо Ф. (1999) О локальных и глобальных аспектах проблемы Коши в общей теории относительности. Класс Quantum Gravity 16(8):R73–R157
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Марзуола Дж., Меткалф Дж., Татару Д. (2008) Оценки Стрихарца и оценки локального сглаживания для асимптотически плоских уравнений Шредингера. J Funct Anal 255 (6): 1497–1553
Перекрёстная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Меткалф Дж., Татару Д. (2012) Глобальные параметры и дисперсионные оценки для волнового уравнения с переменным коэффициентом. Math Ann 353(4):1183–1237
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Pecher H (1974) Die Existenz regulärer Lösungen für Cauchy- und Anfangs-Randwert-probleme nichtlinearer Wellengleichungen. Математика Z 140: 263–279. (на немецком языке)
Математика Z 140: 263–279. (на немецком языке)
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Рид М., Саймон Б. (1978) Методы современной математической физики IV. В кн.: Анализ операторов. Academic Press (Харкорт Брейс Йованович), Нью-Йорк
Google Scholar
Сегал И. (1968) Дисперсия для нелинейных релятивистских уравнений. II. Ann Sci École Norm Sup 1(4):459–497
перекрестная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Shatah J (1982) Глобальное существование малых решений нелинейных эволюционных уравнений. J Differ Equ 46(3):409–425
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Shatah J (1985) Нормальные формы и квадратичные нелинейные уравнения Клейна-Гордона. Commun Pure Appl Math 38(5):685–696
перекрестная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Шата Дж. , Струве М. (1998) Геометрические волновые уравнения. В: Конспект лекций Куранта по математике, том 2. Университет Куранта, Институт математических наук, Нью-Йорк,
, Струве М. (1998) Геометрические волновые уравнения. В: Конспект лекций Куранта по математике, том 2. Университет Куранта, Институт математических наук, Нью-Йорк,
. Google Scholar
Стрихартц Р.С. (1970a) Свертки с ядрами, имеющими особенности на сфере. Trans Am Math Soc 148: 461–471
перекрестная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Стрихартц Р.С. (1970b) Априорные оценки для волнового уравнения и некоторые приложения. J Funct Anal 5: 218–235
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Стрихартц Р.С. (1977) Ограничения преобразований Фурье на квадратичные поверхности и убывание решений волновых уравнений. J Duke Math 44 (3): 705–714
Перекрёстная ссылка MathSciNet МАТЕМАТИКА Google Scholar
Tao T (2000) Сферически усредненные оценки конечной точки Стрихарца для двумерного уравнения Шредингера. Commun Partial Differ Equ 25(7–8):1471–1485
Commun Partial Differ Equ 25(7–8):1471–1485
МАТЕМАТИКА Google Scholar
Тао Т. (2003) Локальная корректность уравнения Янга–Миллса во временной калибровке ниже энергетической нормы. J Дифференциальное уравнение 189(2):366–382
Перекрёстная ссылка ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Тейлор М.Е. (1991) Псевдодифференциальные операторы и нелинейные УЧП. В: Прогресс в математике, том 100. Биркхойзер, Бостон,
. Google Scholar
von Wahl W (1970) Über die klassische Lösbarkeit des Cauchy-Problems für nichtlineare Wellengleichungen bei kleinen Anfangswerten und das asymptotische Verhalten der Lösungen. Математика Z 114: 281–299. (на немецком языке)
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Wolff T (2001) Точная билинейная оценка ограничения конуса. Ann Math 153(3):661–698
Ann Math 153(3):661–698
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Ядзима К. (1987) Существование решений эволюционных уравнений Шредингера. Commun Math Phys 110(3):415–426
CrossRef ОБЪЯВЛЕНИЯ МАТЕМАТИКА Google Scholar
Яджима К. (1995a) W k , p -непрерывность волновых операторов для операторов Шредингера. J Math Soc Japan 47(3):551–581
CrossRef MathSciNet МАТЕМАТИКА Google Scholar
Яджима К. (1995b) Вт k , p -непрерывность волновых операторов для операторов Шредингера. III. четномерные случаи m ≥ 4. J Math Sci Univ Tokyo 2(2):311–346
MathSciNet МАТЕМАТИКА Google Scholar
Яджима К. (1999) Л p -ограниченность волновых операторов для двумерных операторов Шредингера. Commun Math Phys 208(1):125–152
(1999) Л p -ограниченность волновых операторов для двумерных операторов Шредингера. Commun Math Phys 208(1):125–152
CrossRef ОБЪЯВЛЕНИЯ MathSciNet МАТЕМАТИКА Google Scholar
Водородная связь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1660
Водородная связь — это межмолекулярная сила (IMF), которая образует особый тип диполь-дипольного притяжения, когда атом водорода, связанный с сильно электроотрицательным атомом, существует вблизи другого электроотрицательного атома с неподеленной парой электронов. Межмолекулярные силы (IMF) возникают между молекулами. Другие примеры включают обычные диполь-дипольные взаимодействия и дисперсионные силы. Водородные связи, как правило, прочнее обычных диполь-дипольных и дисперсионных сил, но слабее истинных ковалентных и ионных связей.
Другие примеры включают обычные диполь-дипольные взаимодействия и дисперсионные силы. Водородные связи, как правило, прочнее обычных диполь-дипольных и дисперсионных сил, но слабее истинных ковалентных и ионных связей.
Доказательства водородной связи
Многие элементы образуют соединения с водородом. Если вы начертите точки кипения соединений элементов группы 14 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Рис. 1: Температуры кипения галогенидов 14-й группы.Повышение температуры кипения происходит из-за того, что молекулы становятся больше с большим количеством электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше. Если вы повторите это упражнение с соединениями элементов групп 15, 16 и 17 с водородом, произойдет нечто странное.
Рисунок 2: Температуры кипения галогенидов элементов 15-17 групп. Хотя те же рассуждения применимы к группе 4 периодической таблицы, температура кипения соединения водорода с первым элементом в каждой группе аномально высока. В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
Происхождение водородных связей
К молекулам, способным образовывать водородные связи, относятся следующие:
Рисунок 3: Неподеленные пары, ответственные за водородные связи в \(NH_3\), \(H_2O\) и \(HF\). Сплошная линия представляет собой связь в плоскости экрана или бумаги. Точечные связи уходят обратно в экран или бумагу от вас, а клиновидные выходят к вам.Обратите внимание, что в каждой из этих молекул:
- Водород присоединяется непосредственно к сильно электроотрицательным атомам, в результате чего водород приобретает сильно положительный заряд.
- Каждый из сильно электроотрицательных атомов приобретает высокий отрицательный заряд и имеет по крайней мере одну «активную» неподеленную пару.
 У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
Если вы не знакомы с электроотрицательностью, вам следует перейти по этой ссылке, прежде чем продолжить. 9+\) водород настолько сильно притягивается к неподеленной паре, что создается впечатление, будто вы начинаете формировать координационную (дательную ковалентную) связь. Это не заходит так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие. Водородные связи имеют примерно одну десятую прочности средней ковалентной связи и постоянно разрываются и восстанавливаются в жидкой воде. Если вы сравните ковалентную связь между кислородом и водородом со стабильным браком, водородная связь имеет статус «просто хороших друзей». 9+\) атомов водорода и неподеленных пар, каждый из которых участвует в образовании водородных связей.
Вот почему температура кипения воды выше, чем у аммиака или фтористого водорода. В случае аммиака количество водородных связей ограничено тем фактом, что каждый атом азота имеет только одну неподеленную пару. В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода. Во фтороводороде проблема заключается в нехватке водорода. В воде две водородные связи и две неподеленные пары позволяют образовывать взаимодействия водородных связей в решетке молекул воды. Таким образом, вода считается идеальной системой с водородными связями.
Более сложные примеры водородных связей
Гидратация отрицательных ионов
Когда ионное вещество растворяется в воде, молекулы воды группируются вокруг разделенных ионов. Этот процесс называется гидратацией. Вода часто присоединяется к положительным ионам координационными (дательными ковалентными) связями. Он связывается с отрицательными ионами с помощью водородных связей.
Если вас интересует связь в гидратированных положительных ионах, вы можете перейти по этой ссылке, чтобы ознакомиться с координационной (дательной ковалентной) связью.
На схеме показаны потенциальные водородные связи, образованные ионом хлора Cl-. Хотя неподеленные пары в ионе хлорида находятся на уровне 3 и обычно недостаточно активны для образования водородных связей, в этом случае они становятся более привлекательными за счет полного отрицательного заряда хлора.
Рис. 5: Водородная связь между ионами хлора и водой.Каким бы сложным ни был отрицательный ион, всегда будут неподеленные пары, с которыми атомы водорода из молекул воды могут водородно связываться.
Водородная связь в спиртах
Спирт представляет собой органическую молекулу, содержащую группу -ОН. Любая молекула, в которой атом водорода присоединен непосредственно к кислороду или азоту, способна образовывать водородные связи. Водородные связи также возникают, когда водород связан со фтором, но группа HF не появляется в других молекулах. Молекулы с водородными связями всегда будут иметь более высокую температуру кипения, чем молекулы аналогичного размера, которые не имеют группы -ОН или -NH.
Водородная связь делает молекулы «более липкими», так что для их разделения требуется больше тепла (энергии). Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу.
Этанол, \(\ce{Ch4Ch3-O-H}\), и метоксиметан, \(\ce{Ch4-O-Ch4}\), имеют одинаковую молекулярную формулу, \(\ce{C2H6O}\).
У них одинаковое количество электронов и одинаковая длина. Притяжение Ван-дер-Ваальса (как дисперсионные силы, так и диполь-дипольное притяжение) в каждом из них будет одинаковым. Однако у этанола атом водорода присоединен непосредственно к кислороду; здесь у кислорода все еще есть две неподеленные пары, как у молекулы воды. Водородная связь может возникать между молекулами этанола, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола имеется только один водород с достаточным зарядом +.
В метоксиметане неподеленные пары кислорода все еще присутствуют, но атомов водорода недостаточно + для образования водородных связей.
За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к самому электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола:
этанол (с водородными связями) 78,5°С метоксиметан (без водородной связи) -24,8°С Водородная связь в этаноле подняла его точку кипения примерно на 100°C. Важно понимать, что помимо притяжения Ван-дер-Ваальса существуют водородные связи. Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют одинаковую длину цепи. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН) оба имеют высокие температуры кипения из-за дополнительной водородной связи; однако значения не совпадают.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
Водородная связь в органических молекулах, содержащих азот
Водородная связь также возникает в органических молекулах, содержащих группы N-H; вспомните водородные связи, возникающие с аммиаком. Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК. Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной цепи, и неподеленными парами на другой азот или кислород на другой.
Доноры и акцепторы
Для образования водородной связи должны присутствовать как донор водорода, так и акцептор. Донором в водородной связи обычно является сильно электроотрицательный атом, такой как N, O или F, который ковалентно связан с водородной связью.
Акцептор водорода представляет собой электроотрицательный атом соседней молекулы или иона, который содержит неподеленную пару, участвующую в водородной связи.
Почему возникает водородная связь?
Поскольку донор водорода (N, O или F) является сильно электроотрицательным, он притягивает ковалентно связанную электронную пару ближе к своему ядру и от атома водорода. Затем атом водорода остается с частичным положительным зарядом, создавая диполь-дипольное притяжение между атомом водорода, связанным с донором, и неподеленной электронной парой акцептора. Это приводит к образованию водородной связи (см. Взаимодействие между молекулами с постоянными диполями)
Типы водородных связей
Хотя водородные связи хорошо известны как тип IMF, эти связи также могут возникать внутри одной молекулы, между двумя идентичными молекулами или между двумя разнородными молекулами.
Внутримолекулярные водородные связи
Внутримолекулярные водородные связи возникают внутри одной единственной молекулы.
Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
Межмолекулярные водородные связи
Межмолекулярные водородные связи возникают между отдельными молекулами вещества. Они могут возникать между любым количеством одинаковых или разных молекул, если доноры и акцепторы водорода находятся в положениях, в которых они могут взаимодействовать друг с другом. Например, межмолекулярные водородные связи могут возникать между NH 9Только молекулы 0072 3 , только молекулы H 2 O или молекулы NH 3 и H 2 O.
Свойства и влияние водородных связей
О температуре кипения
Когда мы рассматриваем точки кипения молекул, мы обычно ожидаем, что молекулы с большей молярной массой будут иметь более высокие нормальные точки кипения, чем молекулы с меньшей молярной массой. Это, без учета водородных связей, связано с большими дисперсионными силами (см. Взаимодействие между неполярными молекулами). Более крупные молекулы имеют больше места для распределения электронов и, следовательно, больше возможностей для мгновенного дипольного момента. Однако, если мы рассмотрим приведенную ниже таблицу, то увидим, что это не всегда так.
Соединение Молярная масса Нормальная температура кипения \(H_2O\) 18 г/моль 373 К \(ВЧ\) 20 г/моль 292,5 К \(NH_3\) 17 г/моль 239,8 К \(H_2S\) 34 г/моль 212,9 К \(HCl\) 36,4 г/моль 197,9 К \(PH_3\) 34 г/моль 185,2 К Мы видим, что H 2 O, HF и NH 3 имеют более высокие точки кипения, чем одно и то же соединение, образованное водородом и следующим элементом, движущимся вниз по соответствующей группе, что указывает на то, что первые обладают более высокими межмолекулярными силами.
. Это потому, что Н 2 O, HF и NH 3 все имеют водородную связь, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.
О вязкости
Тот же эффект, что и при температуре кипения в результате образования водородных связей, можно наблюдать и в отношении вязкости некоторых веществ. Вещества, способные образовывать водородные связи, как правило, имеют более высокую вязкость, чем те, которые не образуют водородных связей. Как правило, вещества, которые могут иметь несколько водородных связей, обладают еще более высокой вязкостью.
Факторы, препятствующие образованию водородной связи
Электроотрицательность
Водородная связь не может возникнуть без значительных различий в электроотрицательности между водородом и атомом, с которым он связан. Таким образом, мы видим такие молекулы, как PH 3 , которые не участвуют в водородных связях.
PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
Размер атома
Размер доноров и акцепторов также может влиять на способность к образованию водородных связей. Это может объяснить относительно низкую способность Cl образовывать водородные связи. Когда радиусы двух атомов сильно различаются или велики, их ядра не могут достичь непосредственной близости при взаимодействии, что приводит к слабому взаимодействию.
Водородные связи в природе
Водородные связи играют решающую роль во многих биологических процессах и могут объяснить многие природные явления, такие как необычные свойства воды.
Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.
Растения
Когезионно-адгезионная теория транспорта в сосудистых растениях использует водородные связи для объяснения многих ключевых компонентов движения воды через ксилему растения и другие сосуды. Молекулы воды внутри сосуда водородно связываются не только друг с другом, но и с цепочкой целлюлозы, из которой состоит стенка растительной клетки. Поскольку сосуд относительно мал, притяжение воды к целлюлозной стенке создает своего рода капиллярную трубку, обеспечивающую капиллярное действие. Этот механизм позволяет растениям втягивать воду в свои корни. Кроме того, водородные связи могут создать длинную цепочку молекул воды, которая может преодолеть силу гравитации и подняться на большие высоты листьев.
Белки
Водородные связи в изобилии присутствуют во вторичной структуре белков, а также редко в третичной конформации.
Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.
В третичной структуре белка взаимодействия в основном происходят между функциональными R-группами полипептидной цепи; одно такое взаимодействие называется гидрофобным взаимодействием. Эти взаимодействия происходят из-за водородных связей между молекулами воды вокруг гидрофоба, что еще больше укрепляет конформацию белка.
Ссылки
- Brown, et al. Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г.

 У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.

 Водородная связь делает молекулы «более липкими», так что для их разделения требуется больше тепла (энергии). Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу.
Водородная связь делает молекулы «более липкими», так что для их разделения требуется больше тепла (энергии). Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу. За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к самому электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола:
За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к самому электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола: Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
 Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
 . Это потому, что Н 2 O, HF и NH 3 все имеют водородную связь, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.
. Это потому, что Н 2 O, HF и NH 3 все имеют водородную связь, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше. PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость) Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.
Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.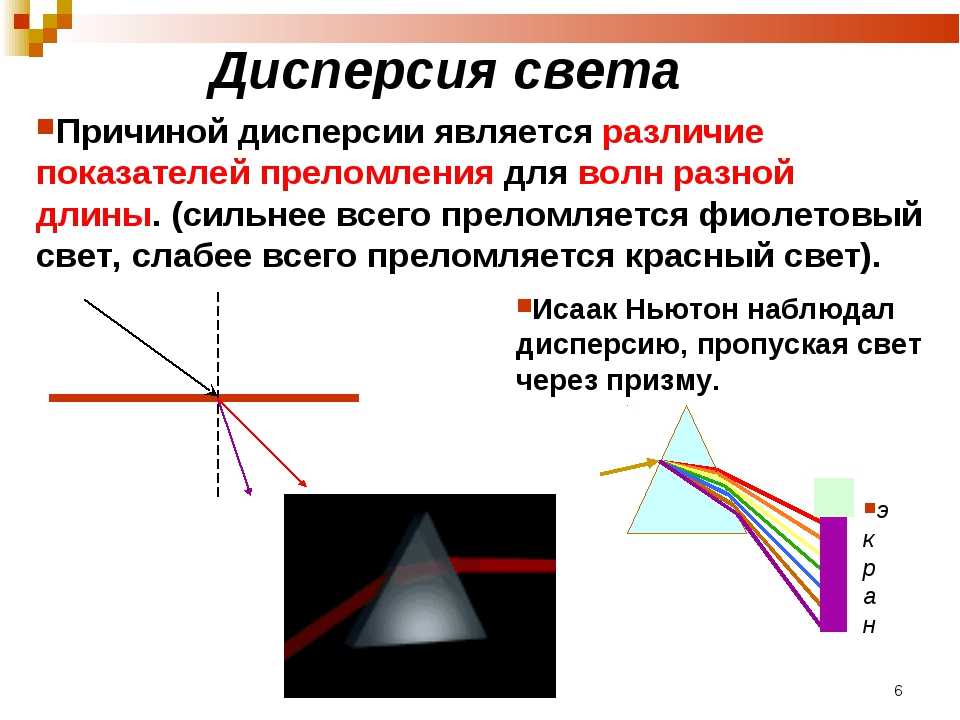 Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.
Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.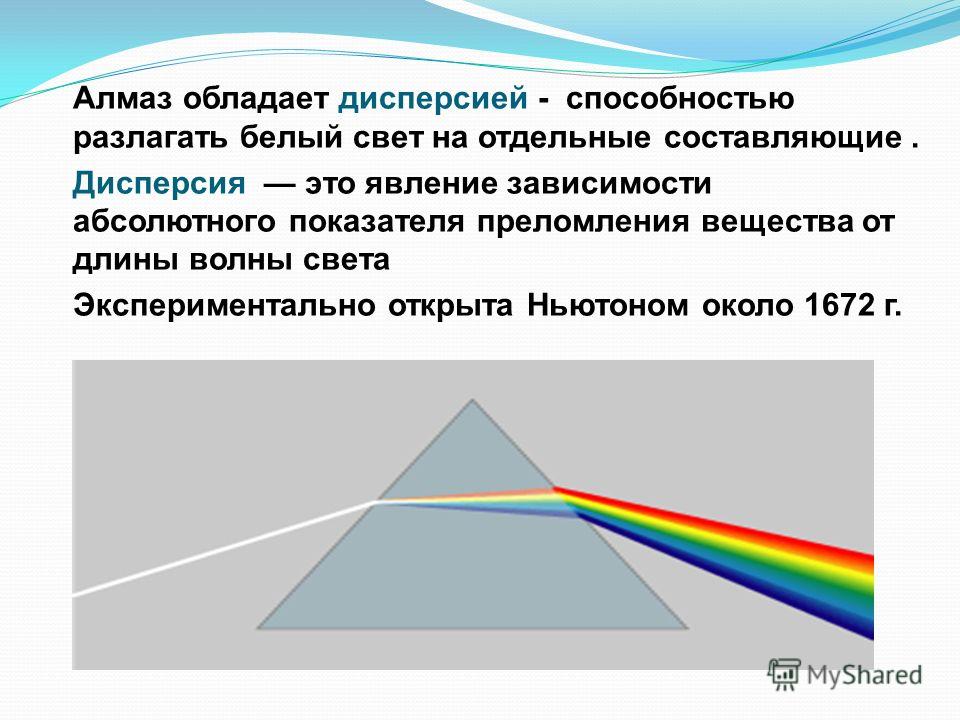
Leave A Comment