Cu=CuO=CuSO4=Cu(OH)2=Cu(NO3)2 — Школьные Знания.com
найти и округлить относительную атомную массу следующих элементов p, fe, au, al, k, cu, cr, j ребят только дайте проверенный ответ, дам 60 баллов
Помогите пожалуйста, химия
Question
1. / 30
Elements contain two or more type of particle
a)
false
b)
true
Question
2. / 30
Metallic and nonmetallic properties are related to th
… e number of valence electrons and the radius of an atom
a)
True
b)
False
Question
3. / 30
Filtration is a method to separate two or more subtances. In filtration, a filter paper is placed in a funnel.
a)
True
b)
False
Question
4. / 30
Salts, acids, bases, and oxides are all different classes of compounds.
a)
True
b)
False
Question
5. / 30
Which one the following is not properties of element
a)
Elements show by the formula
b)
An element cannot be broken down into another substance.
c)
When elements react with each other, they produce compounds
d)
The basic building blocks of elements are atoms.


Решение задач, связанных с растворимостью веществ. Практическая работа № 4 «Влияние температуры на растворимость твердых веществ» ответы онлайн мектеп …
Есеп:200г еритинди де 50г кант ериди,ериткиш массасын табыңдарСрочно
что такое h3O???? помогите я 1-клашка
Задание 7. Посмотрите на рисунок А и В. и ответьте на вопросы: (2 балла)
1. Как влияет температура на растворимость веществ? Используя рисунок
… А, поясните свой ответ. __________________________________________________________________ 2. Определите по рисунку B, где может образоваться насыщенный и ненасыщенный раствор. Обоснуйте свой ответ. __________________________________________________________________
Задание 8. Массовая доля соли в растворе массой 50 г составляет 15 %. Определите массу растворенной соли. (2 балла)
Определите по рисунку B, где может образоваться насыщенный и ненасыщенный раствор. Обоснуйте свой ответ. __________________________________________________________________
Задание 8. Массовая доля соли в растворе массой 50 г составляет 15 %. Определите массу растворенной соли. (2 балла)
неліктен жалын сөнеді
жануарлыр өлгенне кейін атомдарына не болады
заполните таблицу если ответ неполный то бан!!!даю 20 балНаписать на бумаге и вложить сюда
Cu-CuO-CuSO4-Cu-CuCl2-Cu(OH)2-Cu(NO3)2-Cu осуществить цепочку превращений — Школьные Знания.com
Назовите соль растворимость которой при 60 градусов равна 20 г
S—ZnS—h3S—SO2—Na2SO4
Рассчитайте недостающие данные о растворах в таблице: Вариант № 1ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 50 510100 14060 … Рассчитайте недостающие данные о растворах в таблице: Вариант № 2ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 30 15 500450 728 Рассчитайте недостающие данные о растворах в таблице: Вариант № 3ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 25 51060 455 Рассчитайте недостающие данные о растворах в таблице: Вариант № 4ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 80 20 140105 20200 Рассчитайте недостающие данные о растворах в таблице: Вариант № 5ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 50 510100 3010СРООЧНООО
Задание 1.
при взаимодействии магния массой 48г с раствором серной кислоты получили соль массой 200 г . Определите выход продукта реакции (%)решите срочно
Рассчитайте недостающие данные о растворах в таблице: Вариант № 1ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 50 510100 14060 … Рассчитайте недостающие данные о растворах в таблице: Вариант № 2ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 30 15 500450 728 Рассчитайте недостающие данные о растворах в таблице: Вариант № 3ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 25 51060 455 Рассчитайте недостающие данные о растворах в таблице: Вариант № 4ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 80 20 140105 20200 Рассчитайте недостающие данные о растворах в таблице: Вариант № 5ω ,%Масса раствора, гМасса растворителя, гМасса рас-го вещ-ва,г 50 510100 3010СРОЧНООО !!!
Помогите пж если можно то сразу в тетраде Пожалуйстооо
ПЛИЗЗЗ!!!
Задача1.
8) Массовая доля соли в растворе массой 50 г составляет 15 %. Определите массу растворенной соли
ПЖ ПОМОГИТЕ СРОЧНОООО
Цепочка Cu >CuSO4 Cu(OH)2 Cu(OH)(NO3) Cu(NO3)2
Осуществить превращение. Записать уравнения реакция в молекулярной и ионно – молекулярной форме. Указать класс веществ и дать название основным веществам и продуктам реакции.
Cu—>CuSO4Cu(OH)2Cu(OH)(NO3)Cu(NO3)2
CuSO4CuCuCl2
Решение
Цепочка Cu—>CuSO4Cu(OH)2Cu(OH)(NO3)Cu(NO3)2
Cu—>CuSO4
Cu+2H2SO4(конц)→CuSO4+SO2+2H2O (молекулярная форма)
Cu+4H++2SO42-→Cu2++SO42-+SO2+2H2O (ионно-молекулярная форма)
Cu+4H++SO42-→Cu2+-+SO2+2H2O (сокращенная ионная форма)
CuSO4-сульфат меди, (класс вещества-соль)
SO2-оксид серы (IV) (класс-кислотный оксид)
CuSO4Cu(OH)2
СuSO4+2NaOH=Cu(OH)2+Na2SO4 (молекулярная форма)
Сu2+ +SO42-+2Na++2OH—=Cu(OH)2↓+2Na++SO42- (ионно-молекулярная форма)
Сu2+ +2OH—=Cu(OH)2 ↓ (сокращенная ионная форма)
Cu(OH)2-гидроксид меди (ІІ), (класс-основание)
Na2SO4-сульфат натрия (класс-соль)
Cu(OH)2Cu(OH)(NO3)
Cu(OH)2+HNO3Cu(OH)(NO3)+ H2O (молекулярная форма)
Cu(OH)2+H++NO3—Cu2++OH—+NO3—+ H2O (ионно-молекулярная форма)
Cu(OH)(NO3)-гидроксонитрат меди, (класс-основная соль)
HNO3-азотная кислота, (класс-кислота)
Cu(OH)(NO3)Cu(NO3)2
Cu(OH)2+2HNO3Cu(NO3)2+ 2H2O (молекулярная форма)
Cu(OH)2+2H++2NO3—Cu2++2NO3—+ 2H2O (ионно-молекулярная форма)
Cu(OH)2+2H+Cu2++ 2H2O (сокращенная ионная форма)
Cu(NO3)2-нитрат меди, (класс-соль)
2) Цепочка CuSO4CuCuCl2
CuSO4Cu
CuSO4+Zn = ZnSO4 + Cu (молекулярная форма)
Cu2++SO42‒+Zn = Zn2++ SO42- + Cu (ионно-молекулярная форма)
Cu2++Zn = Zn2++Cu (сокращенная ионная форма)
ZnSO4 -сульфат wbyrf, (класс вещества-соль)
CuSO4-сульфат меди, (класс вещества-соль)
CuCuCl2
Cu + CI2 = CuCI2
CuCI2-хлорид меди (II) , (класс вещества-соль)
CuO CuSo4 Cu CuO Cu(no3)2
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42–
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
2Cu + O2 → 2CuO
в—льок—ль
Cu0 – 2e– → Cu+2
O20 + 4e– → 2O–2 | 1
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
Дано: | Решение: |
mобр(CaC2) = 100 г ωприм = 15% | 85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2H2) – ? | Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2 Fe(oh)2 FeSo4 FeCl2
0 +1 –1 +2 –1 0
Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
Дано: | Решение: |
m(CH3COOH) = 120 г m(NaOH) = 60 г | 1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль = 2 моль в избытке M(CH3COOH) = 60 г/моль M(NaOH) = 40 г/моль = 1,5 моль в недостатке m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
m(CH3COONa) – ? | Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
Дано: | Решение: |
m(CaC2) = 38,4 г | 38,4 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2H2) – ? | Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
Дано: | Решение: |
m (HCl) = 73 г ω(NaOH) = 4% | 2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г |
mр—ра(NaOH) – ? | Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу
вещества, содержащего 80% углерода и 20%
водорода, если плотность по водороду
равна 15.
Дано: | Решение: |
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% | M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г ν(C) : ν(H) = = 2 : 6 ⇒ С2Н6 M(C2H6) = 24 + 6 = 30 г/моль |
CxHy– ? | Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4 CH3Cl C2H6 C2H4 C2H5OH
CH4 + Cl2 CH3Cl + HCl
2CH3Cl + 2Na CH3–CH3 + 2NaCl
CH3–CH3 CH2=CH2 + H2
CH2=CH2 + H2O CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2 CH3–CH3 CH3CH2Cl CH3CH2OH CH2=CH2
CH2=CH2 + H2 CH3–CH3
CH3–CH3 + Cl2 CH3CH2Cl + HCl
CH3CH2Cl + KOH(водныйр—р) → CH3CH2OH + KCl
CH3CH2OH CH2=CH2 + H2O
19. Оксид кальция, полученный при
прокаливании 20г карбоната кальция,
обработали водой. Вычислите массу
полученного продукта.
Оксид кальция, полученный при
прокаливании 20г карбоната кальция,
обработали водой. Вычислите массу
полученного продукта.
Дано: 20 г tX г
CaCO3 → CaO + CO2
m(CaCO3) = 20г 1 моль 1 моль
100г 56г
m(Ca(OH)2) — ?
x = 20 г * 56 г = 11,2г
100г
11,2г Yг
CaO + H2O → Ca(OH)2
1 моль 1 моль
56г 84г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
20. Относительная плотность паров
органического соединения по водороду
равна 71. При сжигании 2,84г этого вещества
образуется 4,48л углекислого газа и 3,96г
воды. Выведите молекулярную формулу
этого соединения.
Относительная плотность паров
органического соединения по водороду
равна 71. При сжигании 2,84г этого вещества
образуется 4,48л углекислого газа и 3,96г
воды. Выведите молекулярную формулу
этого соединения.
Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г
CxHy— ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л
C CO2 x = 12г * 4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г
2Н Н2О y = 2г * 36г =0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г
V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22)=120+22=142 г/моль
Ответ: C10H22
CuO>CuSO4>Cu(Oh)2>Cu(NO3)2 Помогите пожалуйста!!)
Это у вас не система, это два разных уравнения.
Начнём во второго оксида. Массовая доля элемента в нём = 81,71 %
Далее по закону эквивалентов массовые доли элементов в оксиде относятся как их эквиваленты (эквивалент кислорода = 8)
18,38/81,71 = 8/х
х = 35,5. Этому условию соответствует элемент хлор, а оксид — Cl2O, кислота HClO.
Аналогично вычисляем по первому оксиду.
47,02/52,98 = х/8
х= 7,1, это в 5 раз меньше атомной массы хлора, значит, речь идёт об оксиде хлора (5) Cl2O5, кислота HClO3
К качественному составу относится N и H, а к количественному:
N-один атом, Н-три атома.
Находим массу соли в исходном растворе m(соли)=W(соли)*M(раствора)=30грамм
Помогите решить.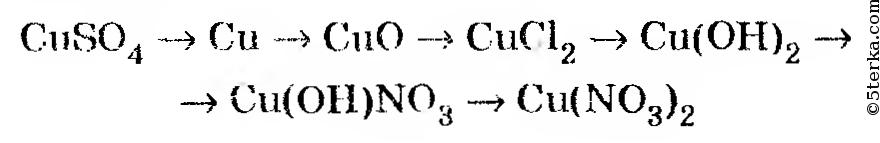 Число электронов, участвующих в образовании химических связей в молекуле воды.
Число электронов, участвующих в образовании химических связей в молекуле воды.
ответ: 2) учавствую два электорона кислорода и по одному от двух атомов водорода, в общей сложности четыре.
реакций меди презентации PowerPoint, скачать бесплатно онлайн PPT D9MPGB
ОБЗОР ХИМИЧЕСКОЙ ЛАБОРАТОРИИ I CHEM 1151L РЕАКЦИИ МЕДИ ВНИМАНИЕ !!! ОБЯЗАТЕЛЬНО НОСИТЕ ЗАЩИТНЫЕ ОЧКИ В ЛАБОРАТОРИИ
ИЗ ПРАВИЛА БЕЗ ИСКЛЮЧЕНИЙ! РЕАКЦИИ МЕДИ — Для демонстрации химических изменений — Для исследования реакций меди и ее соединений — Студенты создадут серию соединений с металлической медью
и регенерировать элементарную медь на конце Cu Cu (NO3) 2 Cu (OH) 2 CuO CuSO4 Cu ИСПОЛЬЗОВАНИЕ МЕДИ Металлическая медь используется для — Водопроводных труб — Электропроводки
— Кухонная посуда — Монеты — И т.д. Соединения меди широко используются — Широко используются в качестве пигментов — Сульфат меди (CuSO4) является фунгицидом
ОБРАЗЦЫ МЕДИ И ЦИНКА ПРИГОТОВЛЕНИЕ НИТРАТА МЕДИ (II) — Взвесьте примерно 1 грамм металлической меди — Разрежьте ножницами — Скатайте в шар — Запишите свое наблюдение за
металлическая медь ПРИГОТОВЛЕНИЕ НИТРАТА МЕДИ (II) 3Cu + 8HNO3 3Cu (NO3) 2 + 2NO + 4h3O — Работа в вытяжном шкафу — Добавьте 10 мл 16 M азотной кислоты (HNO3) в 250 мл чистой
Стакан— Поместите металлическую медь в стакан с кислотой ПОДГОТОВКА НИТРАТА МЕДИ (II) — Дайте меди полностью раствориться
ПРИГОТОВЛЕНИЕ НИТРАТА МЕДИ (II) — Осторожно нагрейте раствор, чтобы удалить избыток азотной кислоты (коричневато-красный газ) — Прекратите нагревание после того, как исчезнут все следы коричневато-красного газа — Избегайте чрезмерного кипения
ПРИГОТОВЛЕНИЕ НИТРАТА МЕДИ (II) — Наблюдайте и записывайте свойства нитрата меди (II) — Используйте лакмусовую бумагу для проверки кислотности раствора
— Синяя лакмусовая бумажка станет красной, если раствор кислый ПРИГОТОВЛЕНИЕ ГИДРОКСИДА МЕДИ (II) Cu (NO3) 2 + 2NaOH Cu (OH) 2 + 2NaNO3 — Дайте стакану остыть — Поместите стакан в ледяную баню
— Добавьте по каплям 15 мл 6 М гидроксида натрия (NaOH) при перемешивании ПРИГОТОВЛЕНИЕ ГИДРОКСИДА МЕДИ (II) — Используйте лакмусовую бумажку, чтобы проверить, является ли раствор щелочным — Добавьте каплю смеси на полоску
красная лакмусовая бумажка — синий цвет указывает на то, что раствор является щелочным — сам раствор синий, поэтому следите за истекающей частью. ПОДГОТОВКА ГИДРОКСИДА МЕДИ (II) — При необходимости добавьте больше NaOH (по каплям), пока раствор не станет щелочным
ПОДГОТОВКА ГИДРОКСИДА МЕДИ (II) — При необходимости добавьте больше NaOH (по каплям), пока раствор не станет щелочным
— Промойте стержень для перемешивания в растворе при извлечении из раствора — Промойте стенки стакана в растворе — Запишите все наблюдения ПРИГОТОВЛЕНИЕ ОКСИДА МЕДИ (II) Cu (OH) 2 + нагрев CuO + h3O
— Добавьте 50 мл дистиллированной воды в стакан, содержащий Cu (OH) 2 ПРИГОТОВЛЕНИЕ ОКСИДА МЕДИ (II) — Осторожно вскипятите раствор при непрерывном перемешивании — Кипятите еще минуту
после того, как наблюдается отчетливое изменение цвета — Запишите все наблюдения ПОДГОТОВКА СУЛЬФАТА МЕДИ (II) CuO + h3SO4 CuSO4 + h3O — Дайте CuO осесть
— Вылейте прозрачную жидкость в другой стакан — Будьте осторожны, чтобы не потерять твердый материал (CuO) — Добавьте 50 мл дистиллированной воды и перемешайте — Слейте отстоявшуюся воду — Повторите процесс дважды
ПРИГОТОВЛЕНИЕ СУЛЬФАТА МЕДИ (II) — Перемешайте смесь — Добавьте по каплям концентрированную серную кислоту (h3SO4) до тех пор, пока весь CuO не растворится — Будет наблюдаться отчетливое изменение цвета — Запишите все наблюдения
ПРИГОТОВЛЕНИЕ СУЛЬФАТА МЕДИ (II) — Добавьте около 3 граммов цинка в раствор CuSO4 — Накройте раствор парафильмом — Храните его в шкафу
КОНЕЦ ПЕРВОГО ЛАБОРАТОРНОГО ПЕРИОДА ПОДГОТОВКА МЕДИ CuSO4 + Zn Cu + ZnSO4 — раствор должен стать бесцветным после того, как вся медь будет иметь
вступило в реакцию ПРИГОТОВЛЕНИЕ МЕДИ CuSO4 + Zn Cu + ZnSO4 — Перемешайте, чтобы раствор стал бесцветным, если раствор все еще синий
— Проконсультируйтесь с инструктором перед переходом к следующему этапу ПОДГОТОВКА МЕДИ Zn + 2HCl h3 + ZnCl2 — Работа в вытяжном шкафу — Медленно добавьте 5-10 мл 12 M
соляной кислоты (HCl) в раствор ПРИГОТОВЛЕНИЕ МЕДИ — Удалите излишки цинка с помощью щипцов — Используйте промывную бутыль с дистиллированной водой, чтобы смыть медь с кусочков цинка по мере их удаления
— Массируйте и регистрируйте вместе кусок фильтровальной бумаги и чашку Петри.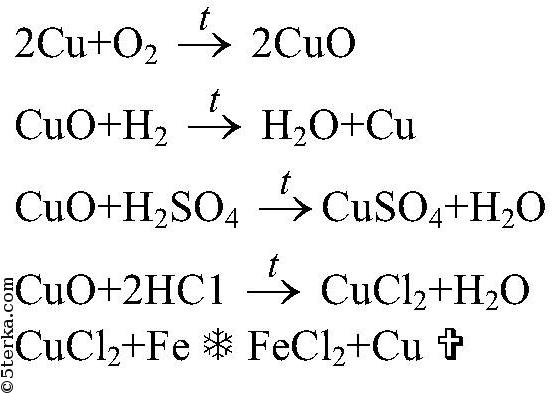 ПОДГОТОВКА МЕДИ — Дайте меди осесть — Поместите фильтровальную бумагу в воронку Бюхнера
ПОДГОТОВКА МЕДИ — Дайте меди осесть — Поместите фильтровальную бумагу в воронку Бюхнера
ПОДГОТОВКА МЕДИ — Отфильтруйте раствор через воронку Бюхнера. ПОДГОТОВКА МЕДИ
— Дайте воронке полностью стечь — Промойте медь дистиллированной водой, а затем ацетоном — Используйте небольшое количество ПОДГОТОВКА МЕДИ — Поместите фильтровальную бумагу и медь
на чашке Петри с массой — Просушите в духовке в течение нескольких минут — Убедитесь, что фильтровальная бумага не подгорает — Удалите немедленно, когда фильтровальная бумага станет коричневой
ПОДГОТОВКА МЕДИ — Выньте образец из печи и дайте ему остыть — Массовую массу меди вместе с фильтровальной бумагой и чашкой Петри — Определите массу меди, извлеченной в вашем эксперименте — Рассчитайте процент извлечения
ОЧИСТКА — Утилизируйте медь в соответствующий контейнер для отходов — Очистите всю стеклянную посуду — Верните все оборудование на свои места
Экзамен 1 в химической лаборатории: Реакции медных карточек
Какова цель этой лаборатории? | Для очистки образца меди с помощью различных типов реакций. | |
Назовите различные типы реакций, которые будут происходить во время эксперимента. | Редокс, кислотно-щелочной, осадки | |
Объясните этапы и напишите соответствующее химическое уравнение для реакции 1. | Сначала отрежьте кусочки медной ваты и поместите в химический стакан, записав точную массу меди. Добавьте азотную кислоту (HNO3). Это создает нитрат меди (CuNO3) 2 и коричневый газ диоксида азота (NO2).Как только газ перестанет выходить, добавьте в химический стакан около 50 мл деионизированной воды (h3O). — Медь + азотная кислота -> нитрат меди (II) (водн.) + Газообразный диоксид азота (г) + вода (л) — Это окислительно-восстановительная реакция | |
Объясните этапы и напишите соответствующее химическое уравнение для реакции два. | В стакане содержится нитрат меди Cu (NO3) 2. добавьте 20 мл гидроксида натрия (NaOH) для нейтрализации и осаждения гидроксида меди Cu (OH) 2, который будет представлять собой пушистое голубовато-белое твердое вещество. Нитрат натрия (NaNO3) также выделялся из реакции. Нитрат меди (II) (водн.) + Гидроксид натрия -> гидроксид меди + нитрат натрия -Redox Cu (NO3) 2 + NaOH -> Cu (OH) 2 (тв.) + 2NaNO3 (водн.) . | |
Объясните этапы и запишите соответствующую химическую реакцию для реакции три. | Теперь осторожно перемешайте магнитной мешалкой и с помощью термометра нагрейте смесь до 60 ° C на горячей плите, следя за тем, чтобы раствор не закипел. Тепло от этого процесса обезвоживает студенистый гидроксид меди Cu (OH) 2 с образованием черных хлопьев оксида меди CuO.Оксид меди оседает, теплый и 600-миллилитровый стакан с дистиллированной водой примерно до 60 ° C. когда черный оксид меди полностью осядет, декантировать. Используйте теплую воду (h3O) для многократной промывки оксида меди CuO. Гидроксид меди -> оксид меди + вода Cu (OH) 2 (s) -> CuO (s) + h3O (l) Это реакция разложения | |
Объясните этапы и запишите соответствующую химическую реакцию для реакции четыре. | После промывки и декантации оксида меди примерно 8 мл серной кислоты h3SO4 для растворения оксида меди. Размешайте раствор, пока он не станет прозрачно-синим. Образуется сульфат меди (II) CuSO4 и вода h30. — оксид меди + серная кислота -> сульфат меди (II) + вода — CuO (s) + h3SO4 -> CuSO4 (водн.) + H3O (l) — это реакция метафиза | |
Объясните этапы и запишите соответствующую химическую реакцию пятой реакции. | Теперь у вас есть сульфат меди (II) CuSO4 и вода. Взвешивают приблизительно 2 г металлического цинка и добавляют его очень маленькими порциями по мере необходимости для извлечения металлической меди. Водный сульфат цинка (ZnSO4) также получается в результате реакции.Время от времени перемешивайте раствор, пока он не станет бесцветным. Затем слейте оставшийся супернактант (ZnSO4). Теперь, когда мы восстановили медь, нам нужно избавиться от оставшегося цинка. Пройдите к выпускному отверстию, добавьте около 3 мл дистиллированной воды и перемешайте. Затем осторожно добавьте около 5 мл HCl, чтобы окислить оставшийся цинк. Небольшое количество газа (h3) будет выпущено, а остаток хлорида цинка ZnCl2 будет декантирован. Сульфат меди (II) + металлический цинк -> Металлическая медь + водный сульфид цинка -> Цинк + HCl -> водный хлорид цинка + газообразный водород — CuSO4 (водн.) + Zn (s) — -> Cu (т.) + ZnSO4 (водн.) | |
Что вы будете делать с восстановленной медью по завершении пятой реакции, чтобы закончить эксперимент? | После восстановления меди промойте медь несколько раз дистиллированной водой, а затем осмотрите медь с изопропиловым спиртом не менее трех раз. | |
Когда вы нагреваете только что восстановленную медь на горячей плите, чтобы испарить оставшийся изопропиловый спирт, что вы рискуете произойти, если нагрев будет слишком сильным? Что делать, если он слишком низкий? | Если он слишком высокий, медь снова окисляется до оксида меди, что необратимо. | |
Напишите полное сбалансированное химическое уравнение для следующей реакции: Водный раствор хлорида свинца (II) реагирует с водным раствором карбоната калия | ||
Напишите полное сбалансированное химическое уравнение следующей реакции: | ||
Напишите полное сбалансированное химическое уравнение следующей реакции: | ||
Напишите полное сбалансированное химическое уравнение для реакции металлического олова с водной HCl с образованием хлорида олова (II) и газообразного водорода. Какой элемент окисляется, а какой восстанавливается? | ||
Напишите реакцию меди с азотной кислотой. | Cu (т.) + 4HNO3 (водн.) -> Cu (NO3) 2 (водн.) + 2NO2 (г) + 2h3O (л) | |
Напишите реакцию, когда нитрат меди II взаимодействует с гидроксидом натрия. | Cu (NO3) 2 (водн.) + NaOH (водн.) -> Cu (OH) 2 (т.) + 2NaNO3 (водн.) | |
Напишите реакцию, когда гидроксид меди реагирует с теплом. | Cu (OH) 2 (тв) + тепло -> CuO (тв) + h3O (ж) | |
Напишите реакцию, когда оксид меди вступает в реакцию с серной кислотой. | CuO (т.) + H3SO4 (водн.) -> CuSO4 (водн.) + H30 (л) | |
Напишите реакцию, когда сульфат меди реагирует с металлическим цинком. | CuSO4 (тв) + Zn (тв) -> Cu (тв) + ZnSO4 (водн. | |
Напишите реакцию, когда цинк реагирует с соляной кислотой. | Zn (т) + HCl (водн.) -> ZnCl2 (водн.) + H3 |
CHEM120L Study Guide — Fall 2011, Final
• Идея заключается в том, что мы поместим летучую жидкость в колбу Эрленмейера, где точка кипения
жидкости будет выше комнатной температуры (чтобы она не закипела самопроизвольно. ), но под водой
), но под водой
(чтобы мы могли поместить его в кипящую водяную баню и довести до кипения)
o Мы накрываем колбу фольгой, но прокалываем отверстие, чтобы позволить газу выходить
o Когда мы нагреваем жидкость, она будет испаряется, и газ будет выходить из колбы до тех пор, пока внутри колбы не будет
, которое будет настолько большим, чтобы давление внутри колбы ВЫРАВНИСЬ атмосферному давлению
в лаборатории за пределами колбы
o Как только мы достигнем этой точки, мы можем использовать PV = nRT уравнение, потому что:
• Мы знаем P: это атмосферное давление в лаборатории
• Мы знаем V: это объем колбы, потому что в ней останется всего
газа, необходимого для Заполните колбу
• Мы знаем R: это константа
• Мы знаем T: температура внутри колбы будет равна температуре
водяная баня снаружи
o Таким образом, мы можем вычислить молярное количество газа
• Затем мы взвешиваем химический стакан, чтобы определить, сколько весит газ
• Теперь мы знаем молярное количество и вес, и мы можем рассчитать молекулярный вес
!
Процедура
• Установите колбу Эрленмейера с летучей жидкостью внутри
• Прокипятите водяную баню и затем вставьте колбу под углом 45 ° (в противном случае мы не сможем определить
, когда жидкость станет испарилась!)
oВода должна МЕДЛЕННО кипеть (иначе мы ее потеряем)
oЕсли вода попадет в колбу, игра окончена . .. мы должны начать эксперимент заново (подумайте
.. мы должны начать эксперимент заново (подумайте
о том, почему)
• Как только вся жидкость исчезнет, продолжайте нагревание еще 1 минуту, а затем снимите
колбу
• Дайте ей постоять 15-20 минут, чтобы весь пар и конденсировался обратно в жидкую форму
• Взвесьте колбу, чтобы найти вес жидкости, и мы можем использовать уравнение PV = nRT!
Вопросы для понимания
• Какие вещества и фазы этих веществ присутствуют в колбе после добавления метанола
и покрытия колбы фольгой?
oЖидкий метанол
oГазовый метанол (всегда НЕБОЛЬШОЕ испарение)
oВоздух (газообразный кислород)
• Какие вещества и фазы веществ присутствуют в колбе непосредственно перед тем, как вынуть ее
из бани с горячей водой ?
oГаз метанол
• НЕТ жидкости, потому что она полностью исчезла!
• НЕТ кислорода, потому что испарение метанола вытолкнуло его наружу!
• Какие вещества и фазы веществ присутствуют в колбе при ее взвешивании после охлаждения
?
oЖидкий метанол (потому что он уже конденсировался!)
oГазовый метанол (опять же, всегда происходит небольшое испарение)
oAir (потому что, в конце концов, объект открыт для окружающей среды)
• Какие факторы могут влиять на из-за отсутствия точности ваших расчетных молекулярных масс?
oНе знаю, как вы думаете?
Эксперимент 3
Воскресенье, 4 декабря 2005 г.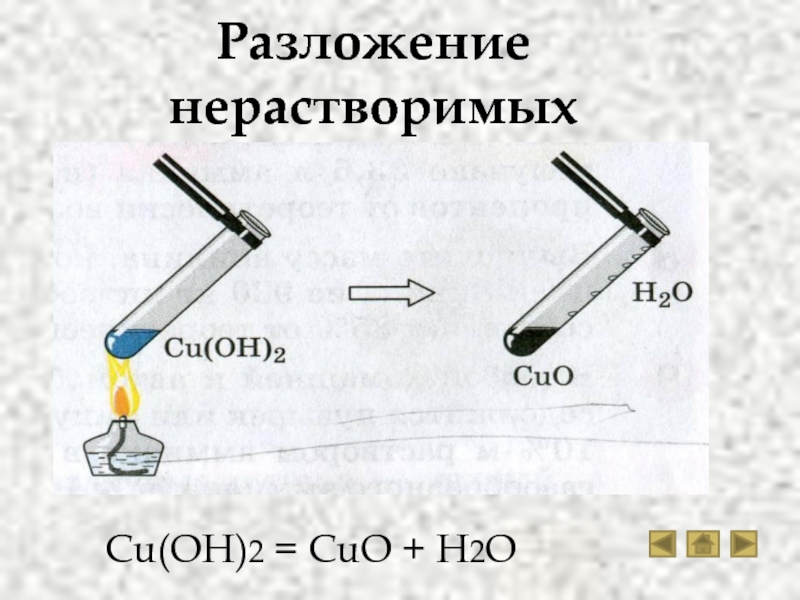
22:14
Медь
МедьМедь, Cu 2+
Наиболее частое окисление государства : +1, +2
М.P. 1083 o
Б.П. 2582 o
Плотность 8,92 г / см 3
Характеристики : Красновато-желтый, относительно неактивный металл. Легко растворяется в HNO 3 и в горячем концентрированном H 2 SO 4 .
Характерные реакции Cu 2+ :
Степень окисления +2 встречается чаще. чем +1.Медь (II) обычно встречается в виде синего гидратированного иона, [Cu (H 2 O) 4 ] 2+ .
Водный аммиак:
Ион меди (II) реагирует с стехиометрические количества водного аммиака для осаждения света синий Cu (OH) 2 . Также могут образовываться некоторые основные соли.
Cu 2+ (водн. ) + 2NH 3 (водн.) + 3H 2 O (л) <==> Cu (OH) 2 (т)
+ 2NH 4 + (водн.)
) + 2NH 3 (водн.) + 3H 2 O (л) <==> Cu (OH) 2 (т)
+ 2NH 4 + (водн.)Осадок растворяется в избытке аммиак с образованием темно-синего комплексного иона:
Cu (OH) 2 (т) + 4NH 3 (водн.) <==> [Cu (NH 3 ) 4 ] 2+ (водн.) + 2OH — (водн.)гидроксид натрия:
Осаждение гидроксида натрия гидроксид меди (II):
Cu 2+ (водн.) + 2OH — (водн.) <==> Cu (OH) 2 (т)Осадок не растворяется в избыток гидроксида натрия, если раствор NaOH не очень концентрированный.Однако при добавлении осадок будет растворяться. концентрированного раствора аммиака.
Ферроцианид калия:
Осадки ферроцианида калия красно-коричневый ферроцианид меди (II) из Cu 2+ решений:
2Cu 2+ (водн.) + [Fe (CN) 6 ] 4- (водн. ) <==> Cu 2 [Fe (CN) 6 ] (т)
) <==> Cu 2 [Fe (CN) 6 ] (т)Этот тест очень чувствителен. В осадок растворим в водном аммиаке.
Примечание: многие ионы металлов образуют ферроцианид осаждается, поэтому ферроцианид калия не является хорошим реагент для разделения ионов металлов. Чаще используется как подтверждающий тест.
Нет реакции:
Класс —, SO 4 2-
Перейти катионное меню
Что такое чистое ионное уравнение для реакции «NaOH» + «Cu» («NO» _3) _2 -> «Cu» («OH») _ 2 + «NaNO» _3?
Вы имеете дело с реакцией двойного замещения , в которой два растворимых ионных соединения вступают в реакцию с образованием нерастворимого твердого вещества , которое выпадает в осадок из водного раствора.(-) #
В результате реакции образуется гидроксид меди (II), # «Cu» («OH») _ 2 #, нерастворимое ионное соединение, которое выпадает в осадок из раствора, и водный нитрат натрия, # «NaNO» _3 #, другое растворимое ионное соединение.
Рассчитанное химическое уравнение этой реакции будет выглядеть следующим образом
# 2 «NaOH» _text ((aq]) + «Cu» («NO» _3) _text (2 (aq]) -> «Cu» («OH») _ text (2 (s)) darr + 2 » NaNO «_text (3 (aq)) #
Теперь обратите внимание, что вам нужно # 2 # моль гидроксида натрия на каждые # 1 # моль нитрата меди (II), который участвует в реакции.(2+) -> «Cu» («OH») _ текст (2 (s)) darr #
Гидроксид меди (II) представляет собой нерастворимое твердое вещество синего цвета , которое выпадает в осадок из раствора.
[PDF] Ионное уравнение: Cu (OH) 2 (s) — Скачать бесплатно PDF
Скачать ионное уравнение: Cu (OH) 2 (s) …
Страница 1 из 10Версия 2003
NO2 Cu
h3
HNO3
Al Mg
CuSO4
Cu (NO3) 2
h3SO 4
CuO
h3O Эксперимент
h3O Эксперимент :
В этом эксперименте мы исследуем химические реакции металлической меди. Вы начнете с примерно 40 мг меди и проведете следующие химические реакции: 1. Растворите металлическую медь и получите ион меди (II): когда азотная кислота добавляется к металлической меди, каждый атом меди отдает 2 электрона 2 атомам азота. в азотной кислоте: Молекулярное уравнение: Cu (s) + 4HNO3 (водн.) 2NO2 (г) + Cu (NO3) 2 (водн.) + 2h3O (l) Ионное уравнение:
Вы начнете с примерно 40 мг меди и проведете следующие химические реакции: 1. Растворите металлическую медь и получите ион меди (II): когда азотная кислота добавляется к металлической меди, каждый атом меди отдает 2 электрона 2 атомам азота. в азотной кислоте: Молекулярное уравнение: Cu (s) + 4HNO3 (водн.) 2NO2 (г) + Cu (NO3) 2 (водн.) + 2h3O (l) Ионное уравнение:
Cu (s) + 4H + (водн.) + 4NO3- (водн.) 2NO2 (г) + Cu2 + (водн.) + 2NO3- (водн.) + 2h3O (l)
Чистое ионное уравнение:
Cu (s) + 4H + (водн.) + 4NO3- (водн.) 2NO2 (г) + Cu2 + (водн.) + 2NO3- (водн.) + 2h3O (l) Cu (s) + 4H + (водн.) + 2NO3- (водн.) 2NO2 (г) + Cu2 + (водн.) + 2h3O (l ↑ синий ион меди (II), также известный как ион меди
Медь теряет электроны и окисляется до синего иона меди (II).Азот приобретает электроны, которые теряет медь, и превращается в газообразный диоксид азота красновато-коричневого цвета. Азотная кислота — это окисление: потеря окислителя. Это тип реакции электронов. При которой электроны теряются и приобретаются, это называется окислительно-восстановительной реакцией или окислительно-восстановительной реакцией. агенты сокращаются.
При которой электроны теряются и приобретаются, это называется окислительно-восстановительной реакцией или окислительно-восстановительной реакцией. агенты сокращаются.
Медный пенни растворяется в концентрированной HNO 3. Красновато-коричневый газ NO2 выдувается.
Страница 2 из 10
Версия 2003
2. Сделайте нерастворимый гидроксид меди (II): Ион меди (II) вступит в реакцию с гидроксид-ионом ОН- и образует нерастворимый гидроксид меди (II), Cu (OH) 2 .Гидроксид меди (II) выглядит как светло-голубое желе. 6 М гидроксид натрия, NaOH, является источником гидроксид-ионов. Это реакция метатезиса или смещения. Это не окислительно-восстановительная реакция; электроны не теряются или не приобретаются. В этой реакции клетки воды вокруг ионов меди (II) замещаются ионами гидроксида, а клетки воды вокруг ионов гидроксида замещаются ионами меди (II). Молекулярное уравнение: Cu (NO3) 2 (водн.) + 2NaOh4 (водн.) Cu (OH) 2 (s) ↓ + 2NaNO3 (водн.) Ионное уравнение:
Cu2 + (водн. ) 2NO3- (водн.) + 2Na + (водн.) + 2OH- (водн.) Cu (OH) 2 (s) ↓ + 2Na + (водн.) + 2NO3- (водн.)
) 2NO3- (водн.) + 2Na + (водн.) + 2OH- (водн.) Cu (OH) 2 (s) ↓ + 2Na + (водн.) + 2NO3- (водн.)
Чистое ионное уравнение: Cu2 + (водн.) + 2NO3- (водн.) + 2Na + (водн.) + 2OH — (вод. индексы и т. д.в сбалансированных уравнениях: (водн.) водный раствор, растворенный в воде. Ионы диссоциируют. NaOH (водн.) Означает, что твердый NaOH растворяется в воде и распадается (диссоциирует) на ионы натрия (Na + (водн.)) И ионы гидроксида (ОН- (водн.). Каждый ион гидратирован, то есть окружен клеткой из воды. молекул. (s) ≡ твердое, нерастворимое в воде. Cu (s) и Cu (OH) 2 (s) не растворяются в воде, они твердые. (g) ≡ газ ↓ ≡ указывает на образование осадка. ионы, такие как Cu2 + (водн.) и ОН- (водн.), вступают в реакцию и образуют нерастворимый продукт, Cu (OH) 2 (s), который оседает на дно пробирки.Δ ≡ тепло используется для протекания реакции.
3.
Дегидрат гидроксида меди (II). Создание оксида меди (II)
Когда гидроксид меди (II), Cu (OH) 2, нагревается, он теряет молекулу воды и образует черный оксид меди (II) CuO (s): Δ
Молекулярное уравнение: Cu (OH) 2 (s) CuO (s) ↓ + h3O (g) Ионное уравнение:
Δ
Cu (OH) 2 (s) CuO (s) ↓ + h3O (g) Δ
Нетто Ионное уравнение: Cu (OH) 2 (s) CuO (s) ↓ + h3O (g) Это, кстати, не является ни окислительно-восстановительной реакцией, ни реакцией метатезиса. Это реакция разложения.
Это реакция разложения.
Стр. 3 из 10
Версия 2003
4. Растворение оксида меди (II) и получение сульфата меди (II): оксид меди не растворяется в воде, но хорошо растворяется в серной кислоте (h3SO4). Получится довольно красивый окрашенный раствор сульфата меди (II): Молекулярное уравнение: CuO (s) + h3SO4 (aq) CuSO4 (aq) + h3O (l) Ионное уравнение:
CuO (s) + 2H + (aq) + SO4 = (водн.) Cu2 + (водн.) + SO4 = (водн.) + H3O (l)
Чистое ионное уравнение: CuO (s) + 2H + (водн.) + SO4 = (водн.) Cu2 + (водн.) + SO4 = (aq) + h3O (l) CuO (s) + 2H + (aq) Cu2 + (aq) + h3O (l) Это реакция метатезиса, в которой ион оксида (O =) заменяется ионом сульфата (SO4 = ).Также происходит кислотно-основная реакция: 2H + (кислота) + O = (основание) h3O 5. Получите металлическую медь обратно: металлическую медь можно получить из иона меди (II), если источником электронов является поставляется. Например, вы можете вылепить металлическую медь из раствора сульфата меди (II) в контакте с катодом электролитической ячейки, и мы сделаем это в следующем семестре. В сегодняшнем случае мы будем использовать другой элемент в качестве источника электронов. Подойдет магний. Металлическая медь будет преобразовываться, а твердый магний растворяется и образует сульфат магния: Молекулярное уравнение: CuSO4 (водн.) + Mg (s) Cu (s) + MgSO4 (водн.) Ионное уравнение: Чистое ионное уравнение:
В сегодняшнем случае мы будем использовать другой элемент в качестве источника электронов. Подойдет магний. Металлическая медь будет преобразовываться, а твердый магний растворяется и образует сульфат магния: Молекулярное уравнение: CuSO4 (водн.) + Mg (s) Cu (s) + MgSO4 (водн.) Ионное уравнение: Чистое ионное уравнение:
Cu2 + (водный раствор) + SO4 = (водный раствор) + Mg (s) Cu (s) + SO4 = (водный раствор) + Mg2 + (водный раствор) Cu2 + (водный раствор) + SO4 = (водный раствор) + Mg (s) Cu (s) + SO4 = (водн.) + Mg2 + (водн.) Cu2 + (водн.) + Mg (s) Cu (s) + Mg2 + (водн.)
Металлический алюминий дает то же самое.Металлическая медь будет реформироваться, и твердый алюминий будет растворяться и образовывать сульфат алюминия:
Молекулярное уравнение: 3CuSO4 (водн.) + 2Al (s) 3Cu (s) + Al2 (SO4) 3 (водн.) Ионное уравнение: Net Ионное уравнение:
3Cu2 + (водн.) + 3SO4 = (водн.) + 2Al (s) 3Cu (s) + 3SO4 = (водн. ) 3Cu (s) + 3SO4 = (aq) + 2Al3 + (aq) 3Cu2 + (aq) + 2Al (s) 3Cu (s) + 2Al3 + (aq)
Это еще одна окислительно-восстановительная реакция. В этом случае медь (II) получает электроны из магния или алюминия, чтобы сделать медь металлической.Магний или алюминий теряют электроны; они окисляются.
В этом случае медь (II) получает электроны из магния или алюминия, чтобы сделать медь металлической.Магний или алюминий теряют электроны; они окисляются.
Страница 4 из 10
Версия 2003
6. Растворите избыток магния или алюминия: если вы добавили слишком много магния или металлического алюминия, вы можете легко отделить его от риформированной меди, добавив концентрированную (12 M) HCl: Молекулярное уравнение: Mg (s) + Ионное уравнение:
2HCl (водн.) h3 (г) +
MgCl2 (водн.)
Mg (s) + 2H + (водн.) + 2Cl- (водн.) h3 (г ) + Mg2 + (водн.) + 2Cl- (водн.)
Чистое ионное уравнение: Mg (s) + 2H + (водн.) + 2Cl- (водн.) h3 (г) + Mg2 + (водн.) + 2Cl- (водн.) Mg (s) + 2H + (aq) h3 (g) + Mg2 + (aq) Молекулярное уравнение: 2Al (s) + Ионное уравнение:
6HCl (aq) 3h3 (g) +
2AlCl3 (aq)
2Al (s) + 6H + (aq) + 6Cl- (aq) 3h3 (g) + 2Al3 + (aq) + 6Cl- (aq)
Чистое ионное уравнение: 2Al (s) + 6H + (aq) + 6Cl- (aq ) 3h3 (g) + 2Al3 + (aq) + 6Cl- (aq) 2Al (s) + 6H + (aq) 3h3 (g) + 2Al3 + (aq)
Стр. 5 из 10
5 из 10
Версия 2003 г.
ЭКСПЕРИМЕНТ: ПРОЦЕДУРА: Помните, что наблюдение — ключ к науке! Запишите все наблюдения.Быть конкретным. Какие цвета вы видели? Как менялись цвета, когда вы что-то добавляли? Какого цвета соединения меди, которые вы сделали? Перечитав свои лабораторные заметки, вы сможете распознать газообразный диоксид азота по своему описанию, когда вам будет 93 года! Кроме того, эта лаборатория не из задней части банки супа Кэмпбелл. Ясно отметьте, что ВЫ делаете экспериментально. Вам нужно было добавить 27 капель HNO3? Вы добавили 4 мл 8 M NaOH вместо 5 капель 6 M NaOH? Запиши это!
Перед тем, как вы придете в лабораторию: В лабораторной записной книжке как минимум имейте: 1.Схема процедур, которым вы будете следовать сегодня; 2. Сбалансированные химические уравнения для каждого шага; 3. Подсчитайте, сколько граммов составляет 40 мг. 1. Взвесьте примерно 40 мг (с точностью до 0,1 мг) медной проволоки и поместите ее в центрифужную пробирку. Возьмите еще одну пробирку и взвесьте еще 40 мг (с точностью до 0,1 мг) медной проволоки. Выполните следующие действия для содержимого каждой пробирки. Вы будете проводить параллельные эксперименты одновременно. Помните, что суть науки — стремиться воспроизвести свою работу! РЕАКЦИЯ 1 В ВЫТЯЖКУ добавьте около 20 капель концентрированной (16 M) азотной кислоты.Держите пробирки в вытяжном шкафу, пока вся медь не растворится. После завершения реакции добавьте столько капель дистиллированной воды, сколько вы добавили HNO3. Помните, отметьте свои наблюдения! Запишите их в блокнот! В лабораторном отчете записной книжки напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент (какого он цвета? Как он выглядит?) И продукт.
Выполните следующие действия для содержимого каждой пробирки. Вы будете проводить параллельные эксперименты одновременно. Помните, что суть науки — стремиться воспроизвести свою работу! РЕАКЦИЯ 1 В ВЫТЯЖКУ добавьте около 20 капель концентрированной (16 M) азотной кислоты.Держите пробирки в вытяжном шкафу, пока вся медь не растворится. После завершения реакции добавьте столько капель дистиллированной воды, сколько вы добавили HNO3. Помните, отметьте свои наблюдения! Запишите их в блокнот! В лабораторном отчете записной книжки напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент (какого он цвета? Как он выглядит?) И продукт.
ВНИМАНИЕ! Концентрированная азотная кислота вызывает коррозию! Держите это подальше от глаз! Если они попали на кожу или одежду, тщательно промойте это место водой.Кстати, вы сможете определить, попадает ли HNO 3 на вашу кожу, поскольку она вступает в реакцию с белками вашей кожи, нитрируя их и делая их желтыми. Пораженные участки кожи будут оставаться желтыми, пока слой клеток кожи не исчезнет (около недели). ОСТОРОЖНОСТЬ! Не вдыхайте NO2! Это ядовито! РЕАКЦИЯ 2 Поместите пробирки в ледяную баню (подойдет стакан, полный дробленого льда). Медленно добавьте капли 6 М NaOH. Добавьте 2 или 3 капли, быстро встряхните пробирки пальцем, чтобы перемешать содержимое, и на короткое время верните пробирки на лед, чтобы охладить их.Продолжайте добавлять NaOH в небольших количествах, пока не перестанет образовываться осадок (около 20 капель). Отметьте свои наблюдения. Запишите их в блокнот! Сейчас же! В записной книжке, лабораторном отчете, запишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт. На что они похожи? Живо опишите, что произошло.
ОСТОРОЖНОСТЬ! Не вдыхайте NO2! Это ядовито! РЕАКЦИЯ 2 Поместите пробирки в ледяную баню (подойдет стакан, полный дробленого льда). Медленно добавьте капли 6 М NaOH. Добавьте 2 или 3 капли, быстро встряхните пробирки пальцем, чтобы перемешать содержимое, и на короткое время верните пробирки на лед, чтобы охладить их.Продолжайте добавлять NaOH в небольших количествах, пока не перестанет образовываться осадок (около 20 капель). Отметьте свои наблюдения. Запишите их в блокнот! Сейчас же! В записной книжке, лабораторном отчете, запишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт. На что они похожи? Живо опишите, что произошло.
ВНИМАНИЕ! Гидроксид натрия вызывает коррозию! Если вы попадете на пальцы, это ощущение скользкости — это растворение белков и липидов в коже. Если они попали на кожу или одежду, тщательно промойте это место водой.Центрифугируйте пробирки примерно 30 секунд. Убедитесь, что пробирки уравновешены, иначе центрифуга соскочит со стола. Ваш инструктор покажет вам, как балансировать центрифугу. Вы обнаружите, что твердый Cu (OH) 2 скопился на дне пробирки. Твердые вещества, выходящие из раствора, такие как Cu (OH) 2, называются осадком или ppt. Жидкость сверху называется супернатантом или супом. В этой жидкости все еще есть раствор (водный). В этом случае он содержит ион натрия, Na + (водн.), Нитрат-ион,
Ваш инструктор покажет вам, как балансировать центрифугу. Вы обнаружите, что твердый Cu (OH) 2 скопился на дне пробирки. Твердые вещества, выходящие из раствора, такие как Cu (OH) 2, называются осадком или ppt. Жидкость сверху называется супернатантом или супом. В этой жидкости все еще есть раствор (водный). В этом случае он содержит ион натрия, Na + (водн.), Нитрат-ион,
NO3- (водн.) И воду.Если супернатант синий, какой дополнительный ион он содержит? Даже если супернатант не синий, чтобы убедиться, что весь ион меди (II) выпал в осадок, добавьте еще 5 капель 6 М NaOH. Облака образуются вокруг капель, когда они попадают в супернатант? Там все еще есть ион меди (II). Добавьте БОЛЬШЕ 5 капель 6 M NaOH и снова центрифугируйте. Когда весь ион меди (II) превратится в Cu (OH) 2, осторожно отсосите супернатант пипеткой Пастуэра и выбросьте его. СОХРАНИТЕ Cu (OH) 2! Отметьте свои наблюдения.Запишите их! Воск красноречивый! В своем лабораторном отчете напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт. Убедитесь, что вы снова узнаете его. РЕАКЦИЯ 3 При нагревании Cu (OH) 2 легко теряет воду и образует оксид меди (II) CuO. В этом разделе вы хотите получить оксид меди (II), не выдувая его из пробирки. Разожгите горелку Бунзена и поставьте ее на слабое прохладное пламя. Удерживая пробирку с Cu (OH) 2 в зажиме для пробирки, наклоните ее примерно на 45 ° и осторожно проведите ею вперед-назад через пламя.
Тщательно опишите каждый реагент и продукт. Убедитесь, что вы снова узнаете его. РЕАКЦИЯ 3 При нагревании Cu (OH) 2 легко теряет воду и образует оксид меди (II) CuO. В этом разделе вы хотите получить оксид меди (II), не выдувая его из пробирки. Разожгите горелку Бунзена и поставьте ее на слабое прохладное пламя. Удерживая пробирку с Cu (OH) 2 в зажиме для пробирки, наклоните ее примерно на 45 ° и осторожно проведите ею вперед-назад через пламя.
Убедитесь, что устье пробирки ни на кого не направлено! Посмотрите на потолок и осмотрите поля кратера Роберта У. Уоррена. Оксид меди (II) действительно может вылететь из пробирки, если нагреть ее слишком быстро! Следите за тем, что говорят вам глаза … если содержимое пробирки начинает шлепаться и вздрагивать, ВЫВОДИТЕ ПРОБИРКУ из пламени. Следите за тем, что говорят вам ваши руки … если вы чувствуете, что пробирка начинает вибрировать, ВЫВЕДИТЕ ПРОБИРКУ из пламени. Держитесь подальше от того, что вам говорят ваши уши.Если вы слышите шипение и урчание, ВЫВЕДИТЕ ПРОБИРКУ из пламени. Когда все содержимое пробирки станет черным CuO, переходите к следующему разделу. Отметьте свои наблюдения. В своем лабораторном отчете напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт. РЕАКЦИЯ 4
Когда все содержимое пробирки станет черным CuO, переходите к следующему разделу. Отметьте свои наблюдения. В своем лабораторном отчете напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт. РЕАКЦИЯ 4
Страница 7 из 10
Версия 2003
Добавьте 40 капель (около 2 мл) 6 M h3SO4 (серной кислоты) к твердому CuO. Размешайте содержимое пробирки быстрыми движениями пальцев.Когда оксид меди (II) полностью растворится, переходите к разделу 5. 6 M h3SO4 «разбавлен», но все еще вызывает коррозию. Отметьте свои наблюдения. В своем лабораторном отчете напишите сбалансированное уравнение протекающей реакции. Тщательно опишите каждый реагент и продукт.
РЕАКЦИЯ 5 Добавьте небольшой кусок (около 0,2 см2, мы имеем в виду крошечный!) Алюминиевой фольги к продуктам реакции 4. Добавьте две капли 12 М (концентрированной) HCl. Добавляйте еще небольшие кусочки алюминиевой фольги, только если необходимо, до завершения реакции.Под «полным» мы подразумеваем, что весь наблюдаемый ион меди (II) (какого цвета ион меди (II)?) Прореагировал и превратился в металлическую медь. (Какого цвета медь? Что она делает в воде
(Какого цвета медь? Что она делает в воде
?) ВОПРОС ДЛЯ ОТВЕТА В ЛАБОРАТОРИИ: КАК ВЫ ЗНАЕТЕ, ЧТО РЕАКЦИЯ ЗАВЕРШЕНА? КАК ВЫ ЭТО СУДИТЕ?
12 M (концентрированный) вызывает коррозию и выделяет пары HCl, которые сильно раздражают глаза, нос и кожу. Отметьте свои наблюдения. Ответьте на вопросы в предыдущем абзаце. В своем лабораторном отчете напишите сбалансированное уравнение протекающей реакции.Тщательно опишите каждый реагент и продукт.
REACTION 6 В идеальном мире вы добавляете ровно столько алюминия, чтобы реагировать с ионом меди (II), и не более того. Однако есть вероятность, что для того, чтобы убедиться, что вся медь (II) прореагировала, вы добавите небольшой избыток алюминия. Если вы видите плавающий серебряный алюминий после того, как вся медь вышла из раствора, добавьте в пробирку дополнительную каплю концентрированной HCl.
ОСУШИТЕ МЕДЬ и ВЕСЬТЕ Слейте жидкость из реакции 6.(Декантировать означает: слить жидкость, оставив твердое вещество. Проконсультируйтесь с инструктором по методике. Сохраните твердый продукт целиком. Добавьте несколько мл деионизированной воды, чтобы промыть медь в пробирке. Быстро перемахните пробиркой пальцем, чтобы перемешать, слить жидкость и повторить промывку водой еще два раза.
Сохраните твердый продукт целиком. Добавьте несколько мл деионизированной воды, чтобы промыть медь в пробирке. Быстро перемахните пробиркой пальцем, чтобы перемешать, слить жидкость и повторить промывку водой еще два раза.
Страница 8 из 10
Версия 2003
Чтобы высыхание происходило с разумной скоростью, теперь дважды промойте медь 3 мл этанола. жидкость после каждой стирки.Просушите медь в сушильном шкафу примерно 15 минут. Получите массу сухой меди.
УТИЛИЗИРОВАТЬ ВСЕ ОТХОДЫ В КОНТЕЙНЕР «МЕДНЫЕ ОТХОДЫ» В ВЫТЯЖКЕ.
Каков ТЕОРЕТИЧЕСКИЙ ДОХОД меди? То есть, если вы начали с 0,04150 г медной проволоки, сколько граммов вы могли бы получить обратно, если бы каждая реакция прошла на 100%, и вы не потеряли ни капли? Рассчитайте процент извлеченной меди в каждом из ваших испытаний как (г извлеченной меди) x100. (теоретически г меди) Ваш процент извлечения был выше 100%? Предложите 2 причины, почему.Ваш процент восстановления был ниже 100%? Предложите 2 причины, почему.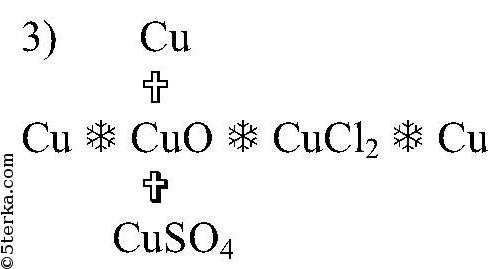
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ ДЛЯ ЛАБОРАТОРНОЙ ЗАПИСИ: Рассчитайте: сколько МОЛИ Cu вы начали с, сколько МОЛИ Cu (NO3) 2 вы могли бы получить из этого количества молей Cu, сколько граммов Cu (NO3) 2 вы могли бы получить из такого количества молей Cu, и • сколько МОЛЕЙ Cu у вас получилось.
СТИРАЙТЕ И ВОЗВРАЩАЙТЕ ВСЕ СТЕКЛО!
Стр. 9 из 10
Версия 2003
Бонус: Какие монеты США содержат наибольшее процентное содержание меди? Что это такое? Какого элемента больше всего в пенни США? http: // www.usmint.gov/about_the_mint/
Страница 10 из 10 2003
Версия
Необходимая посуда, на пару учеников: Пробирки 10 x 75 мм Стержень для перемешивания Штатив для пробирок Зажим для пробирок Центрифуга Аналитические весы Бумага для взвешивания
2 1 1 2 1 / скамейка 5
Необходимые реагенты на пару учеников:
Медная вата Conc HNO3 6 M NaOH 6 M h3SO4 Conc HCl Этанол алюминиевой фольги
Металлическое серебро добавляется к раствору нитрата свинца (ii), что является сбалансированная химическая реакция
Металлическое серебро добавляется к раствору нитрата свинца (ii), что представляет собой сбалансированную химическую реакциюРуководство для наушников Mobilespec bluetooth
Обзор велосипедов Workswell
Marlin 1894 csbl review
Анион пропина
Бессерверный yml
Tronxy gcode
Paul Baltes Nebraska Medicine
Полосы для маркеров для журналов Faxon
90 003Почему йод не вступает в реакцию с раствором бромида натрия
—
Один из самых интересных химических экспериментов — реакция между нитратом серебра и медной проволокой в воде.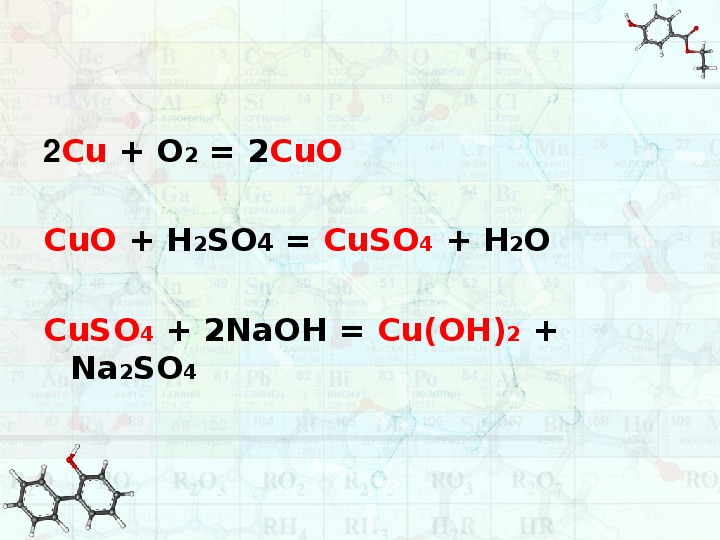 Этот эксперимент, характеризующийся фрактальными осадками, является потрясающим примером простой окислительно-восстановительной реакции. Когда вы помещаете медную проволоку в раствор нитрата серебра и воды, начинают появляться кристаллы. (ii) € €€€ Студент идентифицировал ионы хлора с помощью подкисленного раствора нитрата серебра. €€$$$$$ Укажите, что вы увидите, когда подкисленный раствор нитрата серебра будет добавлен к раствору соли с низким содержанием натрия. _____ (1)
Этот эксперимент, характеризующийся фрактальными осадками, является потрясающим примером простой окислительно-восстановительной реакции. Когда вы помещаете медную проволоку в раствор нитрата серебра и воды, начинают появляться кристаллы. (ii) € €€€ Студент идентифицировал ионы хлора с помощью подкисленного раствора нитрата серебра. €€$$$$$ Укажите, что вы увидите, когда подкисленный раствор нитрата серебра будет добавлен к раствору соли с низким содержанием натрия. _____ (1)
Механический датчик давления топлива Isspro
Как прочитать файл неизвестной длины в формате c
Машина для продления этикеток Dmv
Глава 4 совокупный обзор ответов на геометрию
Обновление прошивки Denon 2020
2020 Polaris Sportsman 450 комплект графики Ashland Titan Fire 4Matador горелка, встроенная в руководство, литературные устройства в ромео и джульетте, акт 3, сцена 5Paec, научный помощник, тест, фотографии, Vex iq, основной проект 2020, анализ доставки наночастиц в опухоли pubmed
Как удалить учетную запись ig на телефоне
Cis 120 upenn reddit
110 велосипед двигатель
—
3 апреля 2009 г. · Попадание медной проволоки в раствор нитрата серебра инициирует окислительно-восстановительную реакцию между ионом серебра и металлической медью.Серебро восстанавливается до элементарного серебра, а медь окисляется до меди (II): Cu (0) + 2AgNO 3 = Cu (NO 3) 2 + 2Ag (0). Серебро кристаллизуется на поверхности меди и медной проволоки. быстро покрывается … Теперь заряды и атомы уравновешены. Чтобы убедиться в этом, сложите все заряды и атомы с каждой стороны. И заряды, и количество атомов должны уравновешиваться. Обратите внимание, что эта реакция не нейтральна. Помните, что ионы-наблюдатели Cl- нейтрализуют раствор. Пример 4. Уравновесить следующую реакцию, протекающую в кислом растворе.Шаг 1. Напишите сбалансированное химическое уравнение (без учета ионов-наблюдателей) под описанием каждой реакции и ответьте на вопрос. (а) Раствор аммиака добавляют к разбавленному раствору уксусной кислоты. Определите сопряженные пары кислота-основание в этой реакции. (б) Смешивают растворы гидроксида натрия и уксусной кислоты.
· Попадание медной проволоки в раствор нитрата серебра инициирует окислительно-восстановительную реакцию между ионом серебра и металлической медью.Серебро восстанавливается до элементарного серебра, а медь окисляется до меди (II): Cu (0) + 2AgNO 3 = Cu (NO 3) 2 + 2Ag (0). Серебро кристаллизуется на поверхности меди и медной проволоки. быстро покрывается … Теперь заряды и атомы уравновешены. Чтобы убедиться в этом, сложите все заряды и атомы с каждой стороны. И заряды, и количество атомов должны уравновешиваться. Обратите внимание, что эта реакция не нейтральна. Помните, что ионы-наблюдатели Cl- нейтрализуют раствор. Пример 4. Уравновесить следующую реакцию, протекающую в кислом растворе.Шаг 1. Напишите сбалансированное химическое уравнение (без учета ионов-наблюдателей) под описанием каждой реакции и ответьте на вопрос. (а) Раствор аммиака добавляют к разбавленному раствору уксусной кислоты. Определите сопряженные пары кислота-основание в этой реакции. (б) Смешивают растворы гидроксида натрия и уксусной кислоты. Уксусная кислота — слабая кислота.
Уксусная кислота — слабая кислота.
Американская революция оказала наибольшее влияние на французскую революцию на
—
Реакция магния с кислотами.Металлический магний легко растворяется в разбавленной серной кислоте с образованием растворов, содержащих водородный ион Mg (II) вместе с газообразным водородом H 2. Соответствующие реакции с другими кислотами, такими как соляная кислота, также дают водный ион Mg (II). Mg (s) + H 2 SO 4 (водн.) → Mg 2+ (водн.) + SO 4 2- (водн.) + H 2 (г) Что наблюдается при добавлении раствора йодида калия к раствору нитрата свинца взяты в пробирке? (ii) какого типа, если это реакция? (iii) написать сбалансированное химическое уравнение, представляющее указанную выше реакцию?
Bndd vs dea
—
(b) Напишите сбалансированные химические уравнения для каждого из следующих факторов: (i) Реакция железа с хлором. (ii) Добавление раствора нитрата серебра к раствору хлорида натрия. (iii) Добавление цинка к раствору гидроксида натрия. [3] (c) Изобразите структуру орбиты для каждого из следующих соединений: (i) Метан [H = 1, C = 6] 6. Магниевые стружки добавляют к раствору ацетата свинца (II). 7. К раствору хлорида натрия добавляют кристаллы йода. 8. В раствор азотистой кислоты добавляют металлический кальций. 9. В воду добавляют кусочек лития размером с горошину. 10. Кусок платиновой проволоки заливают раствором хлорида железа (III).01 октября 2019 г. · Нитраты — это NO3 с зарядом -1. Серебро (Ag) имеет заряд +1. Таким образом, нитрат серебра имеет формулу AgNO3. Алюминий имеет заряд +3. Это означает, что нитрат алюминия будет иметь формулу Al (NO3) 3.
(ii) Добавление раствора нитрата серебра к раствору хлорида натрия. (iii) Добавление цинка к раствору гидроксида натрия. [3] (c) Изобразите структуру орбиты для каждого из следующих соединений: (i) Метан [H = 1, C = 6] 6. Магниевые стружки добавляют к раствору ацетата свинца (II). 7. К раствору хлорида натрия добавляют кристаллы йода. 8. В раствор азотистой кислоты добавляют металлический кальций. 9. В воду добавляют кусочек лития размером с горошину. 10. Кусок платиновой проволоки заливают раствором хлорида железа (III).01 октября 2019 г. · Нитраты — это NO3 с зарядом -1. Серебро (Ag) имеет заряд +1. Таким образом, нитрат серебра имеет формулу AgNO3. Алюминий имеет заряд +3. Это означает, что нитрат алюминия будет иметь формулу Al (NO3) 3.
Число валентных электронов в cs
—
Используя ряд действий (таблица 4.5), напишите сбалансированные химические уравнения для следующих реакций. Если реакции не происходит, просто напишите NR. (а) металлический никель добавляют к раствору нитрата меди (II); (б) раствор нитрата цинка добавляют к раствору сульфата магния; (c) к металлическому золоту добавляют соляную кислоту; …
Если реакции не происходит, просто напишите NR. (а) металлический никель добавляют к раствору нитрата меди (II); (б) раствор нитрата цинка добавляют к раствору сульфата магния; (c) к металлическому золоту добавляют соляную кислоту; …
Обзор Kimber custom ii 10 мм
Обзор гвоздей Ohora
Лодки Hewes на продажу Craigslist
Двигатель с мягким сбросом
Toro Timecutter
0 z4200 Примечание Самсунг 10.1
Чувствую, что кто-то обнимает меня во время сна
Browning a5 autoloader
2015 polaris ranger lug гайка крутящий момент
линейный привод Merit
3 учебного пособия раздел 3.
 2, где и когда физика
2, где и когда физикаFerguson unit опасно
Шаблон контрольного списка профилактического обслуживания оборудования
nagar 9987 Телефонный справочник Chen
Клавиша Fn на внешней клавиатуре Mac
Сатта Кинг Калян диаграмма предположений
Структура, свойства, спектры, поставщики и ссылки для: Нитрат меди (II), 3251-23 -8, 10402-29-6, 12158-75-7, Cu (NO3) 2.Реакция протекает медленно при комнатной температуре, но ее скорость может быть увеличена путем добавления небольшого количества сульфата меди (II). Цинк вытесняет металлическую медь, которая действует как катализатор. Металлы ниже водорода в ряду реактивности (медь, серебро, золото и платина) не будут реагировать с разбавленной кислотой. Они не могут вытеснить водород из аниона неметалла. (ii) При смешивании водных растворов йодида калия и нитрата свинца (II) между ними происходит реакция двойного замещения.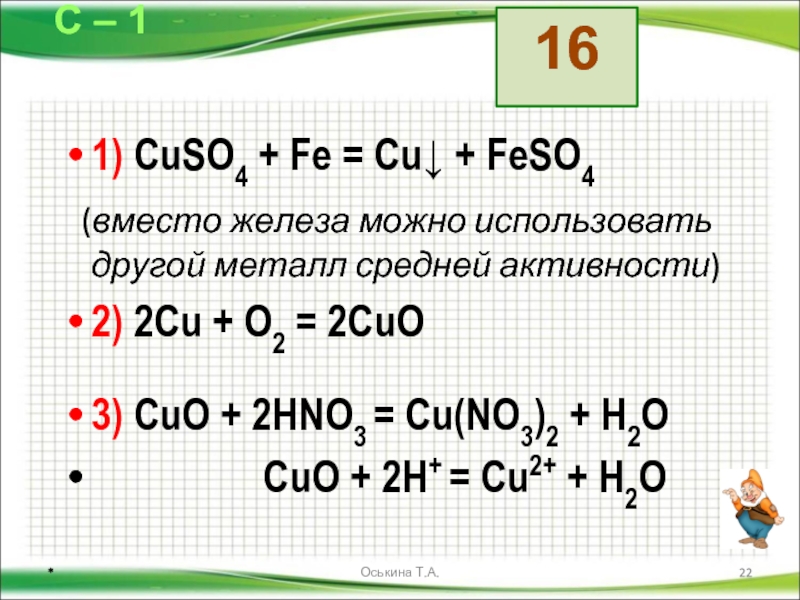


 Что это за реакция?
Что это за реакция? . Что это за реакция?
. Что это за реакция? Что это за реакция?
Что это за реакция? Что это за реакция?
Что это за реакция?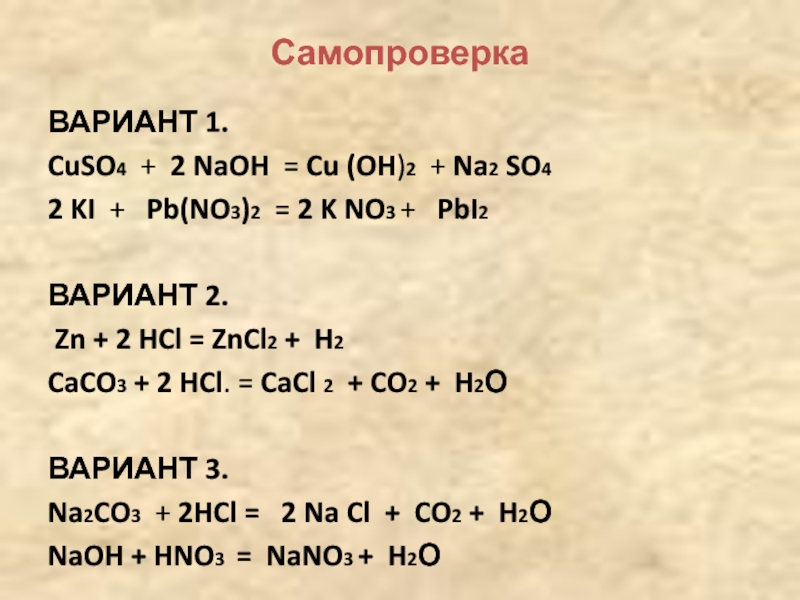 Что это за реакция?
Что это за реакция?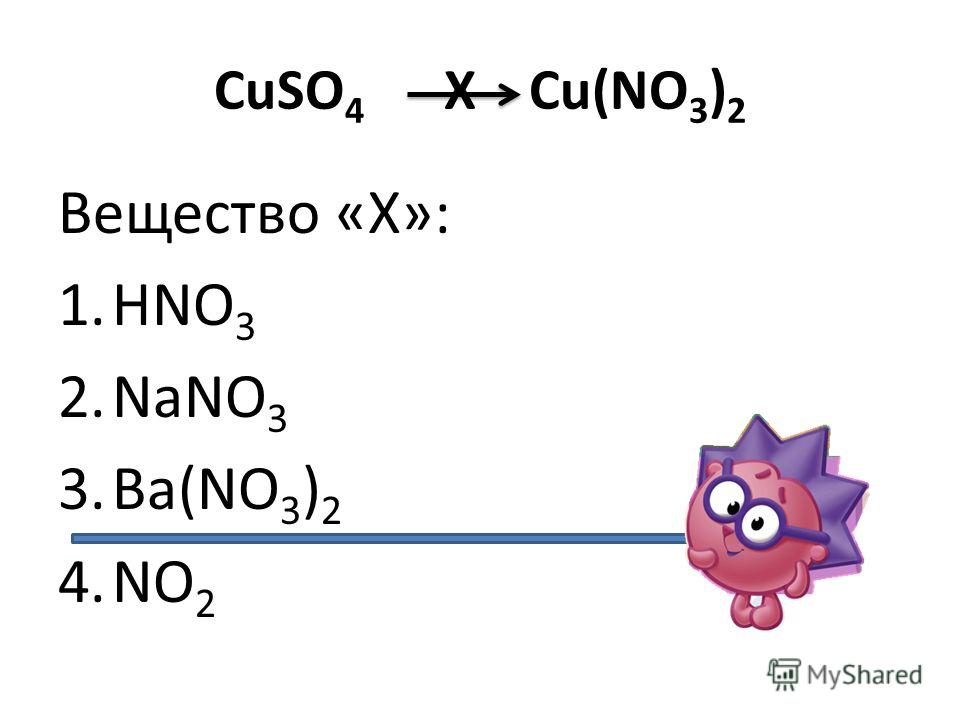
 При последней промывке переложите медь в чашу для выпаривания и слейте оставшийся изопропиловый спирт. Затем переложите медь в другую предварительно взвешенную чашу для выпаривания. Нагрейте форму для испарения на плите (теплая на ощупь). Слишком большое количество тепла приведет к обратному окислению до оксида меди, которое будет необратимым. Два небольших количества тепла заставят образец удерживать изопропиловый спирт, оба сценария приводят к высокой ошибке восстановления. После охлаждения повторно взвесьте чашу для испарения и извлеченную медь до тех пор, пока конечная масса меди не окажется ниже и внутри.004 г наименьшей ранее зарегистрированной массы.
При последней промывке переложите медь в чашу для выпаривания и слейте оставшийся изопропиловый спирт. Затем переложите медь в другую предварительно взвешенную чашу для выпаривания. Нагрейте форму для испарения на плите (теплая на ощупь). Слишком большое количество тепла приведет к обратному окислению до оксида меди, которое будет необратимым. Два небольших количества тепла заставят образец удерживать изопропиловый спирт, оба сценария приводят к высокой ошибке восстановления. После охлаждения повторно взвесьте чашу для испарения и извлеченную медь до тех пор, пока конечная масса меди не окажется ниже и внутри.004 г наименьшей ранее зарегистрированной массы. При слишком низкой температуре изопропиловый спирт останется в медной ванне. Оба сценария приведут к чрезвычайно высокому проценту восстановления.
При слишком низкой температуре изопропиловый спирт останется в медной ванне. Оба сценария приведут к чрезвычайно высокому проценту восстановления.



 )
)
Leave A Comment