Cu(no3)2 → CuO → CuSo4 → CuS →СuO → Cu(no3)2
Домашняя страница » Методические материалы » О. В. Овчинникова. ЕГЭ по химии, задание С2
Новая версия задачи С2 в ЕГЭ по химии 2012. Особенности и подводные камни
В 2012 году предложена новая форма задания С2 — в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций. Трудность такого задания состоит в том, что школьники очень плохо представляют себе экспериментальную, не бумажную химию, не всегда понимают используемые термины и протекающие процессы. Попробуем разобраться. Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно, не так, как предполагалось. В словаре приведены примеры неправильного понимания.
Словарь непонятных терминов.
Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). Она не имеет никакого отношения к навесу над крыльцом.

Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
«Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
Отфильтровать — отделить осадок от раствора.
Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
Фильтрат — это профильтрованный раствор.
Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария).

Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет.
Осадок и остаток. Очень часто путают эти термины. Хотя это совершенно разные понятия. «Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы). «Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать

Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется. Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным. Разбавленный
Для
того, чтобы решать такие задачи, надо
чётко знать свойства большинства
металлов, неметаллов и их соединений:
оксидов, гидроксидов, солей. Необходимо
повторить свойства азотной и серной
кислот, перманганата и дихромата калия,
окислительно-восстановительные свойства
различных соединений, электролиз
растворов и расплавов различных веществ,
реакции разложения соединений разных
классов, амфотерность, гидролиз солей
и других соединений, взаимный гидролиз
двух солей.
Кроме того, необходимо
иметь представление о цвете и агрегатном
состоянии большинства изучаемых веществ
— металлов, неметаллов, оксидов,
солей.
Именно поэтому мы разбираем
этот вид заданий в самом конце изучения
общей и неорганической химии. Рассмотрим
несколько примеров подобных заданий.
Необходимо
повторить свойства азотной и серной
кислот, перманганата и дихромата калия,
окислительно-восстановительные свойства
различных соединений, электролиз
растворов и расплавов различных веществ,
реакции разложения соединений разных
классов, амфотерность, гидролиз солей
и других соединений, взаимный гидролиз
двух солей.
Кроме того, необходимо
иметь представление о цвете и агрегатном
состоянии большинства изучаемых веществ
— металлов, неметаллов, оксидов,
солей.
Именно поэтому мы разбираем
этот вид заданий в самом конце изучения
общей и неорганической химии. Рассмотрим
несколько примеров подобных заданий.
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития: 6Li + N2 = 2Li3N
При взаимодействии нитридов с водой образуется аммиак: Li3N + 3H2O = 3LiOH + NH3
Аммиак реагирует с кислотами, образуя средние и кислые соли.
 Слова в тексте «до
прекращения химических реакций»
означают, что образуется средняя соль,
ведь первоначально получившаяся кислая
соль далее будет взаимодействовать с
аммиаком и в итоге в растворе будет
сульфат аммония:
2NH
Слова в тексте «до
прекращения химических реакций»
означают, что образуется средняя соль,
ведь первоначально получившаяся кислая
соль далее будет взаимодействовать с
аммиаком и в итоге в растворе будет
сульфат аммония:
2NHОбменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария: (NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
NH4Cl + NaNO2
t°
N2 + 2H2O + NaCl
→
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество.
 К
полученному раствору добавили карбонат
натрия до полного прекращения выделения
газа. Выпавший
К
полученному раствору добавили карбонат
натрия до полного прекращения выделения
газа. Выпавший
Решение:
Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот: 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O
Al0 − 3e = Al3+
|
10
2N+5 + 10e = N20
3
Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой).
 Образуется
осадок гидроксида алюминия и выделяется
углекислый газ:
2Al(NO3)3 + 3Na2
Образуется
осадок гидроксида алюминия и выделяется
углекислый газ:
2Al(NO3)3 + 3Na2Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
2Al(OH)3
t°
Al2O3 + 3H2O
→
В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония): NaNO
Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот: 3N2O + 2NH3 = 4N2 + 3H2O
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде.
 Через полученный раствор
пропускали сернистый газ до полного
прекращения взаимодействия. Выпавший
осадок отфильтровали, а к профильтрованному
раствору прибавили бромную воду.
Полученный раствор нейтрализовали
гидроксидом натрия.
Через полученный раствор
пропускали сернистый газ до полного
прекращения взаимодействия. Выпавший
осадок отфильтровали, а к профильтрованному
раствору прибавили бромную воду.
Полученный раствор нейтрализовали
гидроксидом натрия.
Решение:
Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты: Al2O3 + Na2CO3 = 2NaAlO2 + CO2
Алюминат натрия при растворении в воде образует гидроксокомплекс: NaAlO2 + 2H2O = Na[Al(OH)4]
Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия: Na[Al(OH)4] + SO2 = NaHSO3 + Al(OH)3
Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата: NaHSO3 + Br2 + H2O = NaHSO4 + 2HBr
Полученный раствор содержит гидросульфат калия и бромоводородную кислоту.
 При добавлении
щелочи нужно учесть взаимодействие с
ней обоих веществ:
При добавлении
щелочи нужно учесть взаимодействие с
ней обоих веществ:
NaHSO4 + NaOH = Na2SO4 + H2O HBr + NaOH = NaBr + H2O
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород: ZnS + HCl = ZnCl2 + H2S
Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия: H2S + NaOH = Na2S + H2O
Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II): Na2S + FeCl2 = FeS + NaCl
Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре.
 При обжиге сульфидов выделяется
сернистый газ и образуется оксид железа
(III):
FeS
+ O2 = Fe2O3 + SO2
При обжиге сульфидов выделяется
сернистый газ и образуется оксид железа
(III):
FeS
+ O2 = Fe2O3 + SO2Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид: SO2 + O2 = SO3
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
SiO2 + Mg = MgO + Si Si + Mg = Mg2Si
Можно записать при большом избытке магния суммарное уравнение реакции: SiO2 + Mg = MgO + Mg2Si
При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении): Mg2Si + H2O = Mg(OH)2 + SiH4
Силан при сгорании образует оксид кремния: SiH4 + O2 = SiO2 + H2O
Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты: SiO2 + CsOH = Cs2SiO3 + H2O
При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка: Cs2SiO3 + HCl = CsCl + H2SiO3
Задания
для самостоятельной работы.
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария.
 К полученному раствору прилили раствор
сульфата калия. Полученный осадок
сплавили с углем. Полученное вещество
обработали соляной кислотой.
К полученному раствору прилили раствор
сульфата калия. Полученный осадок
сплавили с углем. Полученное вещество
обработали соляной кислотой.Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.

Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
(МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
(МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели.
 Выделившийся осадок
отфильтровали и прокалили с карбонатом
кальция. Напишите уравнения описанных
реакций.
Выделившийся осадок
отфильтровали и прокалили с карбонатом
кальция. Напишите уравнения описанных
реакций.
Ответы к заданиям для самостоятельного решения:
2Cu(NO3)2 = 2CuO + 4NO2 + O2 CuO + H2SO4 = CuSO4 + H2O CuSO4 + H2S = CuS + H2SO4 2CuS + 3O2 = 2CuO + 2SO2 CuO + 2HNO3 = Cu(NO3)2 + H2O
Ca3(po4)2 → p → p2o5 →Na3po4 → Ba3(po4)2 → BaHpo4 или Ba(h3po4)2
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO 4P + 5O2 = 2P2O5 P2O5 + 6NaOH = 2Na3PO4 + 3H2O 2Na3PO4 + 3BaCl2 = Ba3(PO4)2 + 6NaCl Ba3(PO4)2 + 4H3PO4 = 3Ba(H2PO4)2
Cu → NO2 → HNO3 → Zn(NO3)2 → Na2[Zn(OH)4]
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O 4NO2 + O2 + 2H2O = 4HNO3 ZnO + 2HNO3 = Zn(NO3)2 + H2O Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
NaCl → hCl →BaCl2 → BaSo4 → BaS → h3s
2NaCl + H2SO4 = 2HCl + Na2SO4 2HCl + Ba(OH)2 = BaCl2 + 2H2O BaCl2 + K2SO4 = BaSO4 + 2KCl BaSO4 + 4C = BaS + 4CO BaS + 2HCl = BaCl2 + H2S
Al2S3
→ H2S → PbS →PbSO4
↓
AlCl3
→ Al(OH)3
Al2S3 + 6HCl = 3H2S + 2AlCl3 AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl H2S + Pb(NO3)2 = PbS + 2HNO3 PbS + 4H2O2 = PbSO4 + 4H2O
Al → Al2s3 → Al(oh)3 →k[Al(oh)4] → kAlO2 →AlCl3
2Al + 3S = Al2S3 Al2S3 + 6H2O = 3H2S + 2Al(OH)3 Al(OH)3 + KOH = K[Al(OH)4] K[Al(OH)4] = KAlO2 + 2H2O KAlO2 + 4HCl = KCl + AlCl3 + 2H2O
KI →
I2
→ HI → AgI
↓
Na2SO4 → BaSO4
2KI + Cl2 = 2KCl + I2 I2 + Na2SO3 + H2O = 2HI + Na2SO4 BaCl2 + Na2SO4 = BaSO4 + 2NaCl HI + AgNO3 = AgI + HNO3
Cr2o3 → kCrO2 → k[Cr(oh)4] →k2CrO4 →k2Cr2o7 → Cr2(so4)3
Cr2O3 + 2KOH = 2KCrO2 + H2O 2KCrO2 + 3H2O2 + 2KOH = 2K2CrO4 + 4H2O 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
Al → k[Al(oh)4] → Al(oh)3 → Al2o3 → NaAlO2
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2 K[Al(OH)4] + CO2 = KHCO3 + Al(OH)3
2Al(OH)3
t°
Al2O3 + 3H2O
→
Al2O3 + Na2CO3 = 2NaAlO2 + CO2
Si → k2SiO3 → h3SiO3 → SiO2 → CaSiO3
Si + 2KOH + H2O = K2SiO3 + 2H2 K2SiO3 + 2HCl = H2SiO3 + 2KCl
H2SiO3
t°
H2O + SiO2
→
SiO2 + CaCO3 = CaSiO3 + CO2
Cu(NO3)2 + Na2SO4 → | , Пхан Унг Трао Дай
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Cu(NO3)2 | нитрат | + Na2SO4 | сульфат натрия | = , Жиукин
Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(для версии 1.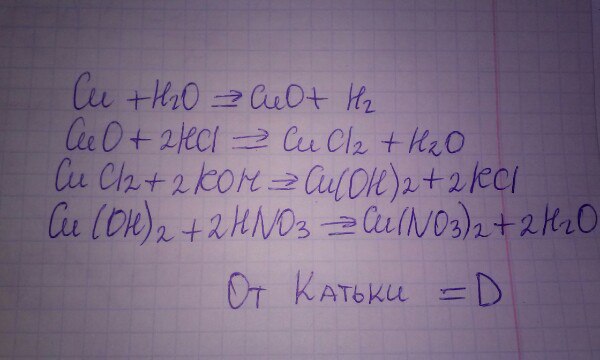 204.214 скачать бесплатно)
204.214 скачать бесплатно)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
Mục Lục
- Cách viết phong bong trng tr0004
- Thông tin chi tiết về phương trình Cu (NO 3 ) 2 + Na 2 SO 4 →
- Điều kiện phản ứng để Cu(NO3)2 (нитрат) tác dụng Na2SO4 (сульфат натрия) là gì ?
- Làm cách nào để Cu(NO3)2 (нитрат натрия) tác dụng Na2SO4 (сульфат натрия)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Cu(NO 3 ) 2 + Na 2 SO 4 → là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Cu (NO 3 ) 2 + Na 2 SO 4 → ?
- Giải thích chi tiết về cac phân loại của phương trình Cu(NO 3 ) 2 + Na 2 SO 4 4
- Phản ứng trao đổi là gì ?
- Phương trình không xảy ra phản ứng la gì ?
- Chuỗi phương trình hoa học có sử dụng Cu(NO 3 ) 2 + Na 2 SO 4 →
Английская версия Тим Ким Мо Ронг
Phản ứng trao đổi Phương trình không xảy ra phản ứng




 Слова в тексте «до
прекращения химических реакций»
означают, что образуется средняя соль,
ведь первоначально получившаяся кислая
соль далее будет взаимодействовать с
аммиаком и в итоге в растворе будет
сульфат аммония:
2NH
Слова в тексте «до
прекращения химических реакций»
означают, что образуется средняя соль,
ведь первоначально получившаяся кислая
соль далее будет взаимодействовать с
аммиаком и в итоге в растворе будет
сульфат аммония:
2NH К
полученному раствору добавили карбонат
натрия до полного прекращения выделения
газа. Выпавший
К
полученному раствору добавили карбонат
натрия до полного прекращения выделения
газа. Выпавший  Образуется
осадок гидроксида алюминия и выделяется
углекислый газ:
2Al(NO3)3 + 3Na2
Образуется
осадок гидроксида алюминия и выделяется
углекислый газ:
2Al(NO3)3 + 3Na2 Через полученный раствор
пропускали сернистый газ до полного
прекращения взаимодействия. Выпавший
осадок отфильтровали, а к профильтрованному
раствору прибавили бромную воду.
Полученный раствор нейтрализовали
гидроксидом натрия.
Через полученный раствор
пропускали сернистый газ до полного
прекращения взаимодействия. Выпавший
осадок отфильтровали, а к профильтрованному
раствору прибавили бромную воду.
Полученный раствор нейтрализовали
гидроксидом натрия. При добавлении
щелочи нужно учесть взаимодействие с
ней обоих веществ:
При добавлении
щелочи нужно учесть взаимодействие с
ней обоих веществ: При обжиге сульфидов выделяется
сернистый газ и образуется оксид железа
(III):
FeS
+ O2 = Fe2O3 + SO2
При обжиге сульфидов выделяется
сернистый газ и образуется оксид железа
(III):
FeS
+ O2 = Fe2O3 + SO2 К полученному раствору прилили раствор
сульфата калия. Полученный осадок
сплавили с углем. Полученное вещество
обработали соляной кислотой.
К полученному раствору прилили раствор
сульфата калия. Полученный осадок
сплавили с углем. Полученное вещество
обработали соляной кислотой.
 Выделившийся осадок
отфильтровали и прокалили с карбонатом
кальция. Напишите уравнения описанных
реакций.
Выделившийся осадок
отфильтровали и прокалили с карбонатом
кальция. Напишите уравнения описанных
реакций. Từ sự trao đổi này, chúng Hình thành nên nhung chất mới.
Trong phản ứng trao đổi, số oxi hoa của cac nguyên tố không thay đổi. Cac phản ứng trao đổi không phải la phản ung oxi hoa — khử.
Từ sự trao đổi này, chúng Hình thành nên nhung chất mới.
Trong phản ứng trao đổi, số oxi hoa của cac nguyên tố không thay đổi. Cac phản ứng trao đổi không phải la phản ung oxi hoa — khử. phng SO 2 + ZnO → ZnSO 3 2NH 3 + 3MgO → 3H 2 O + 3Mg + N 2 H 2 O + NH 3 + Cr(OH) 3 → 2Al(OH) 3 + 3H 2 S → Al 2 S 3 + 6H 2 O Br 2 + 2NaCl → Cl 2 + 2NaBr NaNO 3 + CuSO 4 → C + 2I 2 →
phng SO 2 + ZnO → ZnSO 3 2NH 3 + 3MgO → 3H 2 O + 3Mg + N 2 H 2 O + NH 3 + Cr(OH) 3 → 2Al(OH) 3 + 3H 2 S → Al 2 S 3 + 6H 2 O Br 2 + 2NaCl → Cl 2 + 2NaBr NaNO 3 + CuSO 4 → C + 2I 2 →
 Наряду с этой темой вы должны пройти Решения 10 класса Науки.
Наряду с этой темой вы должны пройти Решения 10 класса Науки. 2H 2 O
2H 2 O 7H 2 O
7H 2 O Вы должны предоставить MCQ
викторина ниже, чтобы проверить свои знания. Вы можете занять все свое время. Окончательно,
Вы сможете получить свою оценочную карту.
Вы должны предоставить MCQ
викторина ниже, чтобы проверить свои знания. Вы можете занять все свое время. Окончательно,
Вы сможете получить свою оценочную карту. Напишите формулу
органическая кислота
Напишите формулу
органическая кислота Что такое химическое
формула сульфата аммония?
Что такое химическое
формула сульфата аммония? AlOH
AlOH
Leave A Comment