Третичный атом — углерод — Большая Энциклопедия Нефти и Газа, статья, страница 4
Cтраница 4
Атом водорода при третичном атоме углерода в молекуле изомасляной кислоты связан наименее прочно и отрыв этого атома соответствует наибольшему тепловому эффекту. С неполярным метальным радикалом реакция идет по этому пути в согласии с правилом Поляни. Однако атом хлора отрывает более прочно связанный метильный атом водорода. Это различие объясняется тем, что для реакций с атомом хлора существенное значение имеет поляризация переходного состояния, снижающая уровень переходного состояния. Так как метильный углерод более электроположителен или менее электроотрицателен, чем третичный атом углерода вследствие влияния карбонильной группы, то большая степень поляризации переходного состояния достигается при отрыве атома углерода от метальной группы, чем от третичного атома углерода. [46]
Насыщенные углеводороды, содержащие третичный атом углерода, в некоторых случаях также легко поддаются окислению, как это, например, имеет место при взбалтывании метилдиэтилметана е раствором перманганата на холоду.
Атака кислорода направляется на третичные атомы углерода и метиленовые группы. [48]
Замещенные циклопарафины, содержащие третичный атом углерода, легко нитру тся разбавленной азотной кислотой. Так, метилциклопентан46 нитруется в 1-нитро — 1-метилциклопентан азотной кислотой уд. [49]
При этом легко затрагиваются третичные атомы углерода, а также атомы водорода, связанные с атомами углерода, находящимися в а-положении к ненасыщенным связям. Для хранения чистых углеводородов должны применяться специальные меры предосторожности. [50]
Из трех изомеров пентана третичный атом углерода, требуемый для изомеризации при помощи серной кислоты, имеет только изопентан. Миграцию одной из метильных групп из положения 2 в положение 3, как показано уравнением ( 32), нельзя было бы обнаружить обычными методами. [51]
Однако в этом кетоне третичный атом углерода находится в голове моста бициклической системы.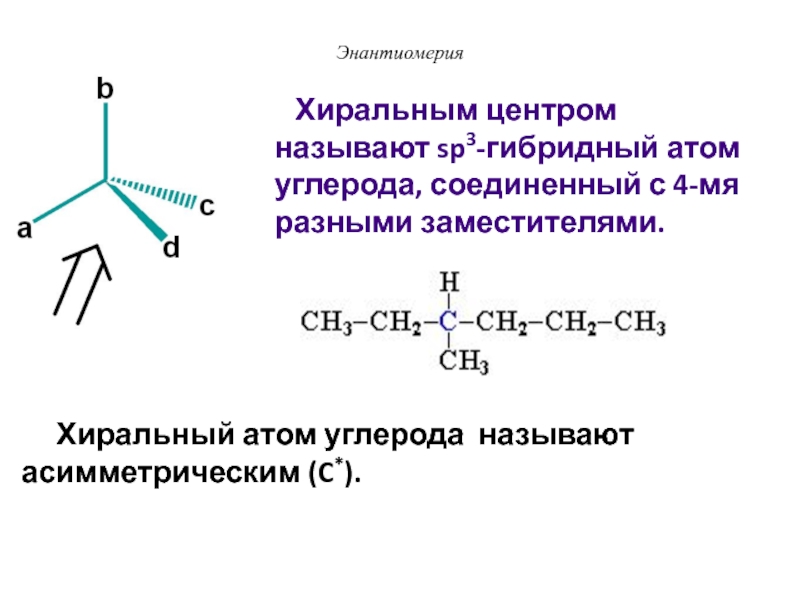 [52]
[52]
Несмотря на то что данный третичный атом углерода может обладать — конфигурацией и что этот атом может являться частью длинной изотактической цепи, состоящей целиком из одинаковых конфигураций, например d — конфигураций, оптической активности всей молекулы может не наблюдаться, так как, за исключением концевых групп, в цепи не будет истинно асимметрических атомов углерода. В случае относительно коротких цепей, когда концевые группы представляют собой существенную часть общего количества вещества, оптическая активность может проявляться, однако, вообще говоря, она всегда будет компенсироваться наличием энантиоморфных цепей. В синдиотактических и атактических полимерах с случайным распределением заместителей оптическая активность отсутствует благодаря двойной мен. [53]
Страницы: 1 2 3 4
Алканы — Химики
Алка́ны— ациклические углеводороды линейного или
разветвлённого строения, содержащие только простые связи и образующие
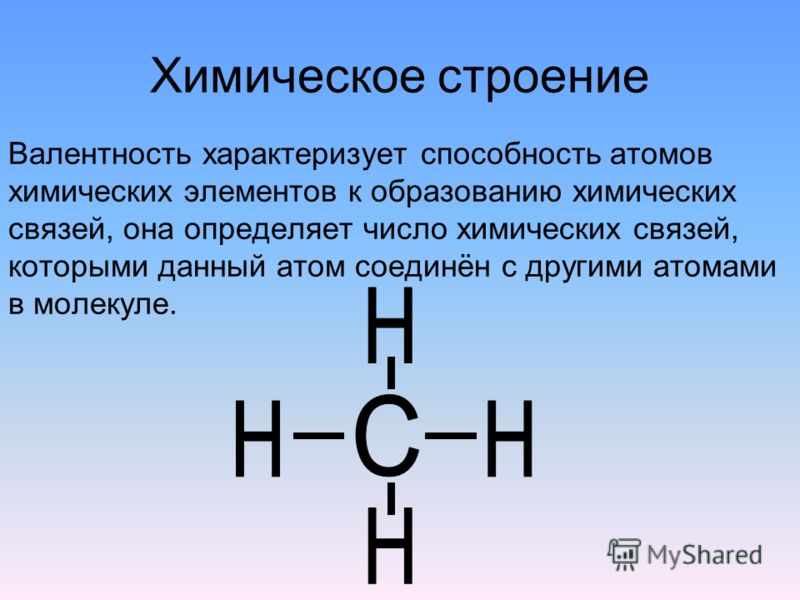
гомологический ряд с общей формулой Cnh3n+2. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм. Номенклатура По номенклатуре ИЮПАК названия алканов образуются при помощи
суффикса -ан путём добавления к соответствующему корню от названия
углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь
так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В
названии соединения цифрой указывают номер углеродного атома, при котором
находится замещающая группа или гетероатом, затем название группы или
гетероатома и название главной цепи.
Алканы образуют гомологический ряд. Гомологический ряд алканов (первые 10 членов). Физические свойства 1.Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи 2.При нормальных условиях неразветвлённые алканы с Ch5 до C4h20 — газы; с C5h22 до C13h38 — жидкости; начиная с C14h40 и далее — твёрдые вещества. 3.Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ. 4.Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства Алканы имеют низкую химическую активность.
Реакции радикального замещения
Галогенирование Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть. Хлорирование метана не останавливается на стадии получения
метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к
образованию всех возможных продуктов замещения, от хлорметана до
тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов
замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования
зависит от температуры. Скорость хлорирования первичных, вторичных и третичных
атомов зависит от температуры, при низкой температуре скорость убывает в ряду:
третичный, вторичный, первичный. Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона. Галогенирование — это одна из реакций замещения. В первую
очередь галогенируется наименее гидрированый атом углерода (третичный атом,
затем вторичный, первичные атомы галогенируются в последнюю очередь).
Галогенирование алканов проходит поэтапно с последовательным образованием
хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается
не более одного атома водорода. Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах. Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя. С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем. Горение Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения.
Каталитическое окисление В реакциях каталитического окисления алканов могут
образовываться спирты, альдегиды, карбоновые кислоты. При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться. Разложение Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Крекинг При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в
промышленности для получения сложной смеси алканов и алкенов, содержащих от
пяти до десяти атомов углерода. Он получил название «термический крекинг». С
помощью термического крекинга удавалось увеличить количество бензиновой фракции
за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов
углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Дегидрирование 1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода: Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана. 2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан,
2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например,
бутадиена-1,3 и бутадиена-1,2 из бутана. 3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных. Изомеризация: Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4h20), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан. С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют. Нахождение в природе В небольших количествах алканы содержатся в атмосфере
внешних газовых планет Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 %
этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране —
соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5·10−10,
соответственно. На спутнике Сатурна Титане метан (1,6 %) содержится в жидком
виде, причем, подобно воде, находящейся на Земле в круговороте, на Титане
существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. Нахождение на Земле Добыча нефти В земной атмосфере метан присутствует в очень небольших количествах (около 0,0001 %), он производится некоторыми археями (архебактериями), в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе. Высшие алканы содержатся в кутикуле растений, предохраняя их
от высыхания, паразитных грибков и мелких растительноядных организмов. Это
обыкновенно цепи с нечётным числом атомов углерода, образующиеся при
декарбоксилировании жирных кислот с чётным количеством углеродных атомов. |
органическая химия. Ограничена ли номенклатура «первичных», «вторичных», «третичных» и «четвертичных» атомов углерода атомами углерода sp3?
Задавать вопрос
спросил
Изменено 5 лет, 10 месяцев назад
Просмотрено 44к раз 9\circ$ атом углерода, потому что он связан с тремя другими атомами углерода.
- органическая химия
- номенклатура
$\endgroup$
$\begingroup$
Насколько мне известно, классификация от первичной до четвертичной используется для обсуждения реакционной способности углеводородов, то есть алканов. Там количество заместителей имеет значение, так как от него зависит устойчивость карбокатиона, стерические затруднения и т.д…
Там количество заместителей имеет значение, так как от него зависит устойчивость карбокатиона, стерические затруднения и т.д…
Во всех остальных случаях электронная структура молекулы определяет реакционную способность. Раз уж вы упомянули алкены, алкины или аромататы, то нет смысла обсуждать такой тонкий эффект, как количество соседних атомов углерода, когда под рукой есть $\pi$-система.
Запись в Золотой книге ИЮПАК для алкильных групп поддерживает это различие:
Группы $\ce{RCh3}$, $\ce{R2CH}\ (\ce{R} ≠ \ce{H})$ и $\ce{R3C}\ (\ce{R} ≠ \ce {H})$ представляют собой первичные, вторичные и третичные алкильные группы соответственно.
$\endgroup$
2
$\begingroup$
правильное определение «третичный атом углерода имеет 3 связи с ЛЮБЫМ числом атомов углерода»
атомы углерода в ацетилене являются третичными, а не первичными (это тоже стало для меня шоком, когда я впервые услышал об этом).
Причина этого в том, что вы можете дополнительно улучшить классификацию, добавив гибридизацию атома C, поэтому в ацетилене оба атома углерода являются третичными SP, а в изобутане центральный атом углерода является третичным sp3.
Если бы мы следовали ошибочному определению «третичный углерод связан с 3 другими атомами углерода», то добавление гибридизации было бы бесполезным, так как это не изменило бы классификацию, поэтому это определение ошибочно.
$\endgroup$
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Уловка с карандашом для классификации первичных, вторичных и третичных атомов углерода
Как репетитор по органической химии, одна из первых и более сложных тем, с которой мои ученики нуждаются в помощи, — это как быстро распознать первичных, вторичных и третичных атомов углерода в молекуле. . Есть несколько способов сделать это.
Я объясню их, а затем покажу вам прием, который поможет вам быстро получить ответ на экзамене. Я называю это трюком с карандашом.
После прочтения обязательно просмотрите пошаговое видеоруководство внизу этой страницы.
Обзор первичных, вторичных и третичных атомов
Первичный, вторичный или третичный углерод относится к числу атомов углерода, непосредственно связанных с рассматриваемым углеродом.
Другими словами:
- Первичный углерод может быть записан как 1° (#1 с символом степени) имеет один углерод, присоединенный к этому атому углерода.

- Вторичный углерод, обозначенный цифрой 2° (#2 с символом градуса), представляет собой углерод, присоединенный к двум другим атомам углерода.
- Третичный углерод, обозначаемый цифрой 3° (#3 с символом градуса), представляет собой углерод, присоединенный к трем другим атомам углерода.
- А четвертичный углерод, записанный как 4° (#4 с символом градуса), представляет собой углерод, присоединенный к четырем другим атомам углерода.
Я хочу, чтобы вы поняли, что четвертичный углерод связан ТОЛЬКО с углеродом. Это связано с тем, что наличие четырех связей с углеродом означает, что углерод уже имеет свой полный октет. Но к первичному, вторичному и третичному углероду будут присоединены другие атомы. Эти атомы могут включать водород, галогены (F, Cl, Br, I), кислород, азот и так далее.
Степень замещения
Степень замещения означает, сколько атомов углерода присоединено к рассматриваемому атому углерода. Ответ будет примерно таким: первичный, вторичный или третичный, в зависимости от того, что у вас есть.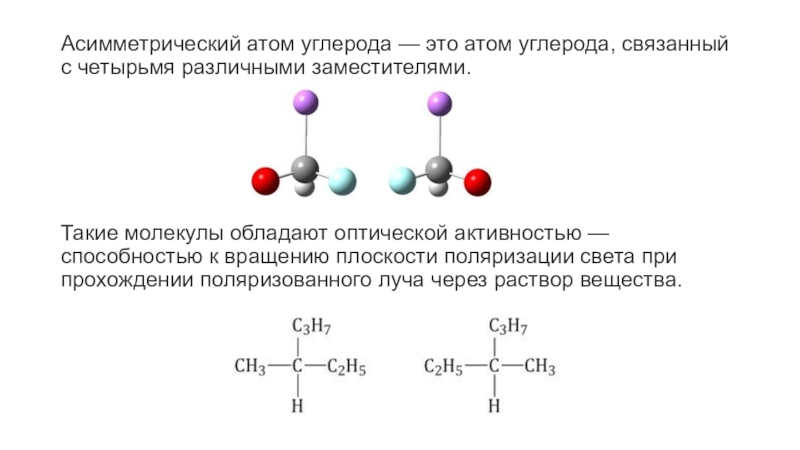 Самый быстрый способ узнать степень замещения — это посмотреть на рассматриваемый углерод и подсчитать, сколько атомов углерода происходит от него.
Самый быстрый способ узнать степень замещения — это посмотреть на рассматриваемый углерод и подсчитать, сколько атомов углерода происходит от него.
Когда у вас есть молекула, записанная в структуре Льюиса, это легко увидеть, но , когда молекула написана в виде строки, это может быть сложно.
Вот здесь и пригодится трюк с карандашом
Вот как быстро определить, является ли атом углерода первичным, вторичным, третичным или четвертичным, используя трюк с карандашом. Определите рассматриваемый углерод и поместите свой карандаш на этот атом углерода. Затем проверьте, сколько линий исходит от атома углерода, которые присоединяются к другому углероду — это означает, что линия не ведет к водороду, кислороду или галогену. Количество линий, происходящих от этого углерода, представляет собой степень замещения. Посмотрите на изображение выше.
На изображении я выделил желтым цветом один атом углерода, от которого, если навести на него карандаш, отходят три линии, что делает его третичным углеродом. Если вы поместите карандаш на другой атом углерода, выделенный зеленым цветом, вы увидите две исходящие от него линии, что делает его вторичным углеродом.
Если вы поместите карандаш на другой атом углерода, выделенный зеленым цветом, вы увидите две исходящие от него линии, что делает его вторичным углеродом.
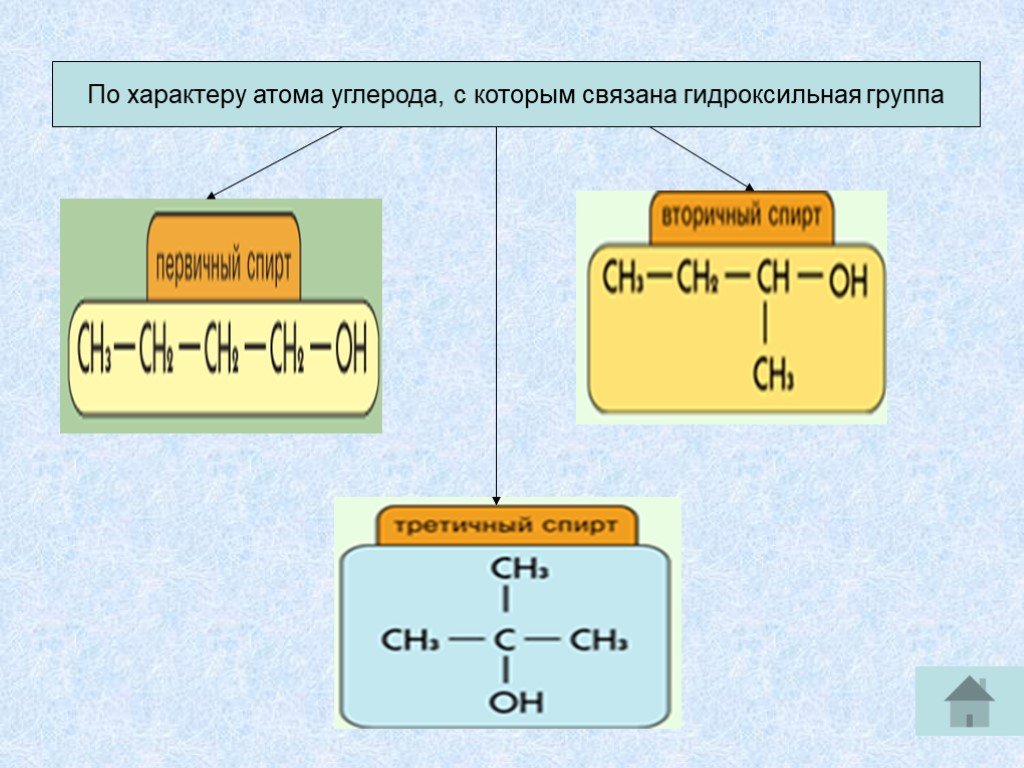
Замещение спирта и галогена
Говоря о степени замещения галогена или спирта, вы смотрите не на сам галоген или спирт, а скорее на углерод, удерживающий его.
Так, например, если вы посмотрите на бром в молекуле, нарисованной здесь, вы увидите, что бром присоединен к одному углероду. Но этот бром не является первичным галогеном, даже если он присоединен к одному углероду. Вместо этого вы должны смотреть на углерод. Проделайте трюк с карандашом и убедитесь, что этот углерод присоединен к двум другим атомам углерода. Поскольку углерод вторичен, то и бром.
То же самое относится и к алкоголю. Например, если спирт находится на третичном углероде, то спирт считается третичным; не потому, что он присоединен к одному атому углерода, а потому, что углерод, содержащий спирт, присоединен к трем другим атомам углерода.
Амины (азот) классифицируются по-разному
Степень замещения аминов немного отличается от спиртов и галогенов, потому что в этом случае мы фактически рассматриваем атом азота.
Первичный амин – это амин, в котором азот или группа Nh3 непосредственно присоединены к одному углероду. Нам все равно, первичный это углерод, вторичный или третичный, потому что мы исследуем азот.
Вторичный амин представляет собой группу NH, присоединенную к двум другим атомам углерода.
Третичный амин представляет собой атом азота, присоединенный к трем другим атомам углерода.
Иногда можно встретить соль аммония, представляющую собой положительно заряженный азот, присоединенный к четырем различным атомам углерода.
Причина, по которой я назвал Nh3, NH и N для первичных, вторичных и третичных, заключается в том, что мы предполагаем, что наши амины нейтральны. Если азот может иметь в общей сложности три связи и одну неподеленную пару, мы ожидаем, что когда азот связан с одним углеродом, он будет иметь два атома водорода.



 Это объясняется
тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить.
Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей
малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по
гомолитическому механизму, то есть с образованием радикалов.
Это объясняется
тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить.
Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей
малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по
гомолитическому механизму, то есть с образованием радикалов.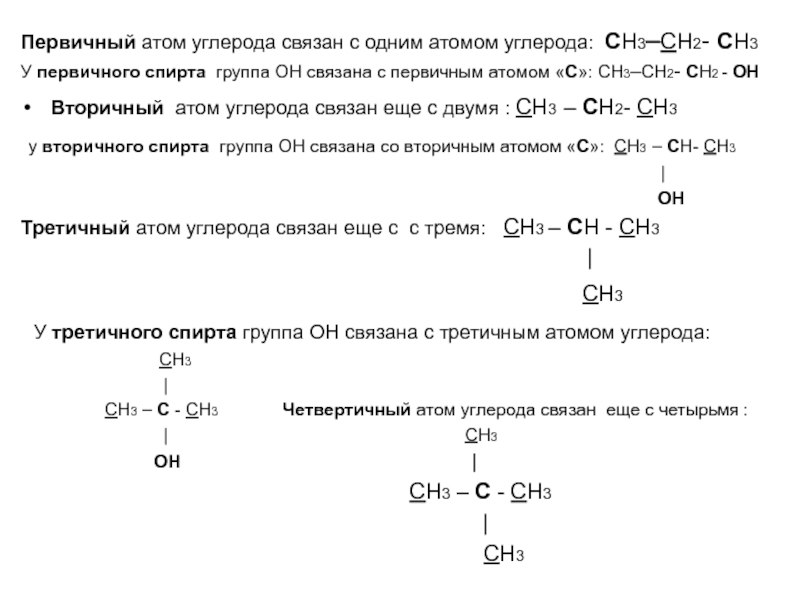


 Однако октановое число бензина, полученного при термическом крекинге, не
Однако октановое число бензина, полученного при термическом крекинге, не
 К тому
же, как предполагается, метан поступает в атмосферу Титана в результате
деятельности вулкана. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах
(углистых хондритах). Предполагается также, что метановые и этановые кометные
льды образовались в межзвёздном пространстве.
К тому
же, как предполагается, метан поступает в атмосферу Титана в результате
деятельности вулкана. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах
(углистых хондритах). Предполагается также, что метановые и этановые кометные
льды образовались в межзвёздном пространстве. У
животных алканы встречаются в качестве феромонов у насекомых, в частности у
мухи цеце (2-метилгептадекан C18h48, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан
C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи
алканов-феромонов привлекают опылител
У
животных алканы встречаются в качестве феромонов у насекомых, в частности у
мухи цеце (2-метилгептадекан C18h48, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан
C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи
алканов-феромонов привлекают опылител
Leave A Comment