Диссимиляция
Диссимиляция
Энергетический обмен – это совокупность химических реакций постепенного распада органических соединений, сопровождающихся высвобождением энергии, часть которой расходуется на синтез АТФ. Процессы расщепления органических соединений у аэробных организмов происходят в три этапа, каждый из которых сопровождается несколькими ферментативными реакциями.
Первый этап – подготовительный. В желудочно-кишечном тракте многоклеточных организмов он осуществляется пищеварительными ферментами. У одноклеточных – ферментами лизосом. На первом этапе происходит расщепление белков до аминокислот, жиров до глицерина и жирных кислот, полисахаридов до моносахаридов, нуклеиновых кислот до нуклеотидов. Этот процесс называется пищеварением.
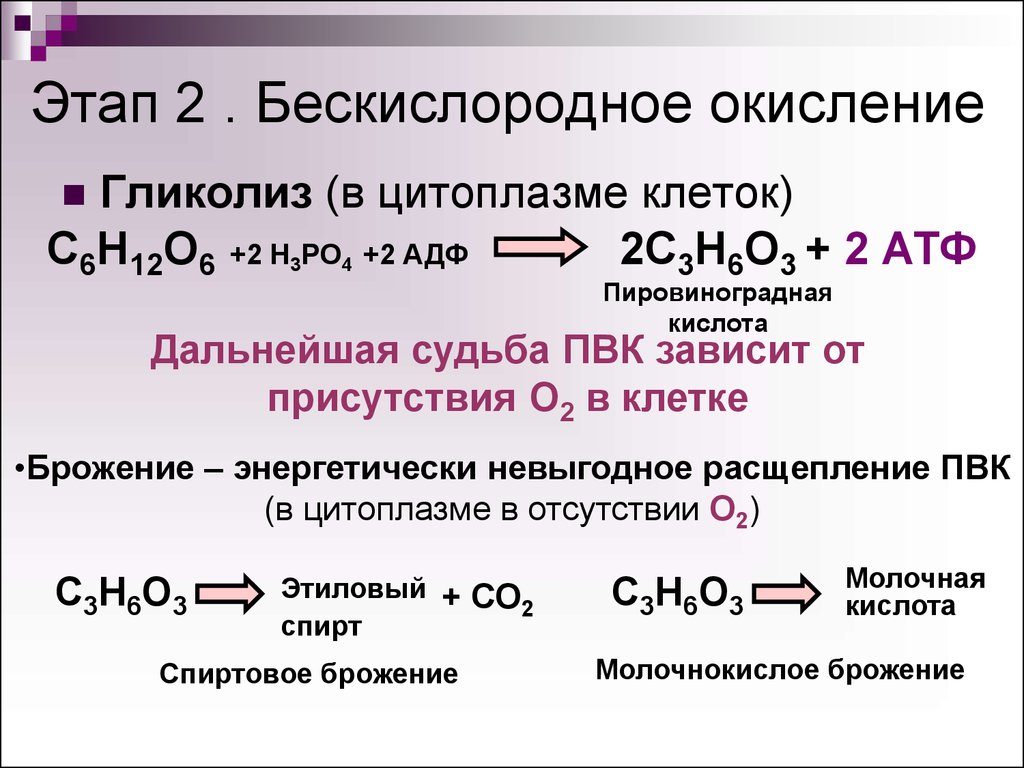
Второй этап – бескислородный (гликолиз, анаэробный). Его биологический смысл заключается в начале постепенного расщепления и окисления глюкозы с накоплением энергии в виде 2 молекул АТФ.
Глюкоза претерпевает ряд последовательных превращений. Вначале одна ее молекула изомеризуется, фосфорилизуется (активируется двумя молекулами АТФ), превращаясь во фруктозодифосфат, который далее распадается на два триозофосфата (глицерофосфат). Триозы окисляются, теряя два атома водорода, которые соединяются с переносчиком водорода НАД+ (никотинамидадениндинуклеотид). Он является таким же переносчиком водорода, как и НАДФ+, но участвует в реакциях энергетического обмена. Восстановленные молекулы НАД*2Н в дальнейшем поступают в митохондрии, Где окисляются, отдавая водород.
Таким образом, гликолиз состоит из нескольких последовательных реакций превращения молекулы глюкозы в две молекулы пировиноградной кислоты (пирувата, ПВК) и две молекулы АТФ, в виде которой запасается часть энергии, выделившейся при гликолизе:
С6Н12O6 + 2АДФ + 2Ф → 2С3Н4O3 + 2АТФ. Остальная энергия рассеивается в виде тепла.
В клетках дрожжей и растений (при недостатке кислорода) пируват распадается на этиловый спирт и углекислый газ.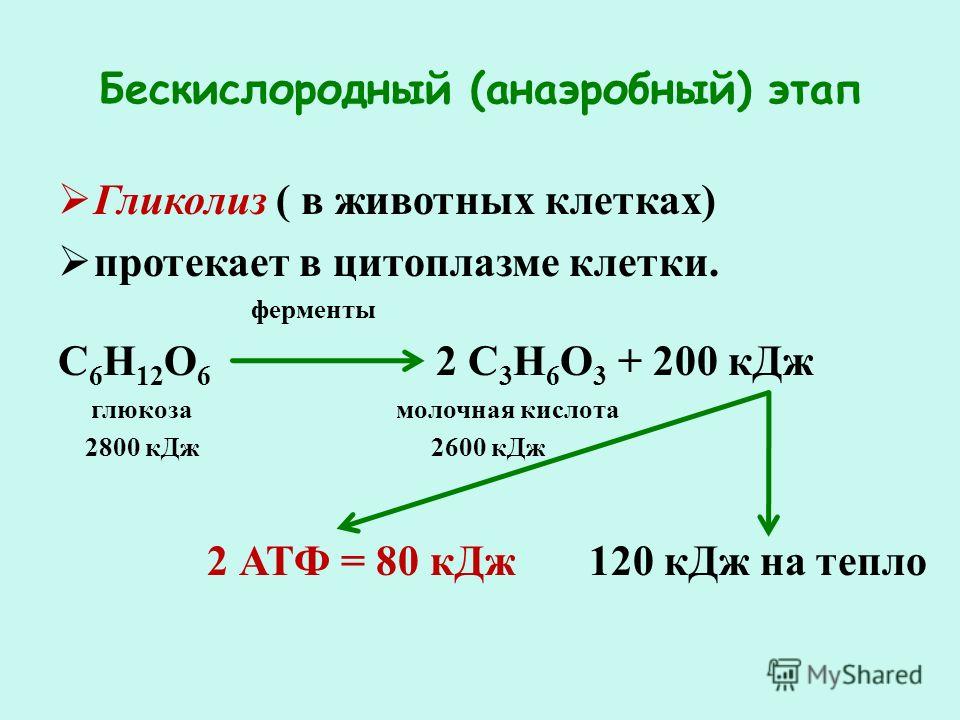 Этот процесс называется спиртовым брожением.
Этот процесс называется спиртовым брожением.
В некоторых случаях при отсутствии кислорода, из двух молекул ПВК, образуется 2 молекулы
Энергии, накопленной при гликолизе, слишком мало для организмов, использующих кислород для своего дыхания. Вот почему в мышцах животных, в том числе и у человека, при больших нагрузках и нехватке кислорода образуется молочная кислота (С3Н6O3), которая накапливается в виде лактата. Появляется боль в мышцах. У нетренированных людей это происходит быстрее, чем у людей тренированных.
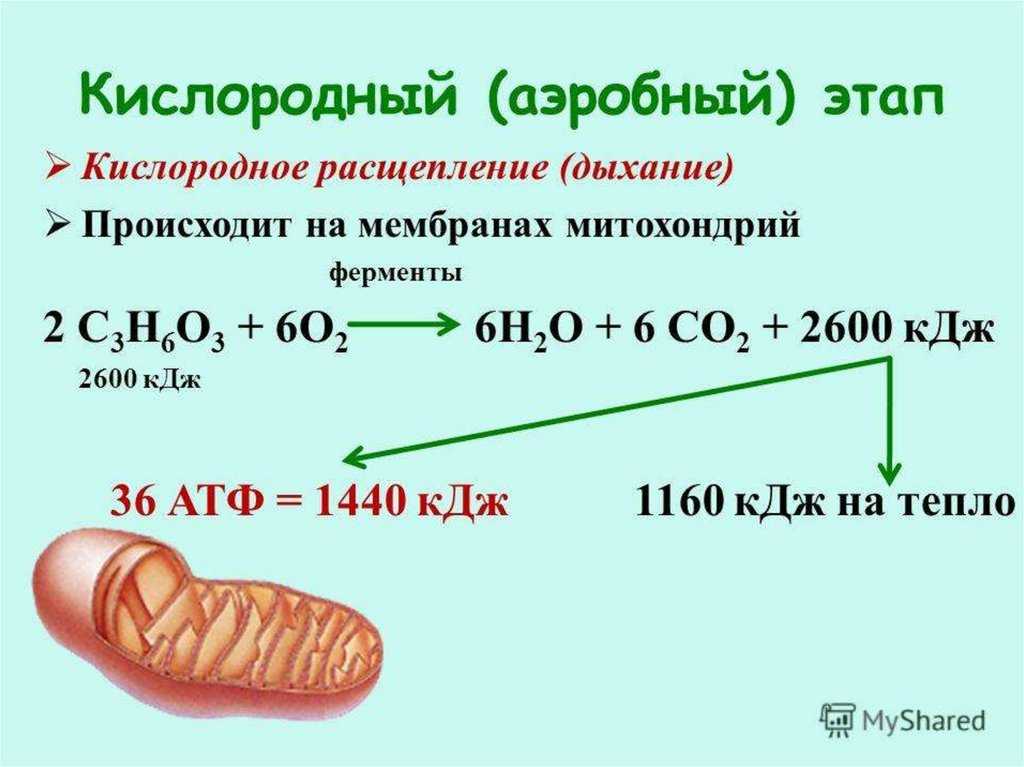
Третий этап – кислородный (аэробный), состоящий из двух последовательных процессов – цикла Кребса (цикл трикарбоновых кислот) (протекает в матриксе митохондрий), названного по имени Нобелевского лауреата Ганса Кребса, и
Смысл аэробного этапа заключается в том, что при кислородном дыхании пируват окисляется до окончательных продуктов – углекислого газа и воды, а энергия, выделяющаяся при окислении, запасается в виде 36 молекул АТФ. Эта энергия распада органических соединений обеспечивает реакции их синтеза в пластическом обмене. Кислородный этап возник после накопления в атмосфере достаточного количества молекулярного кислорода и появления аэробных организмов.
Эта энергия распада органических соединений обеспечивает реакции их синтеза в пластическом обмене. Кислородный этап возник после накопления в атмосфере достаточного количества молекулярного кислорода и появления аэробных организмов.
ПВК соединяется с коферментом А (КоА), образуя ацетил-кофермент А. Ацетил-КоА вступает в цикл ферментативных реакций, соединяясь с щавелевоуксусной кислотой и образуя при этом лимонную кислоту. Лимонная кислота окисляется, теряя атомы водорода и электроны, присоединяемые переносчиками НАД+ и ФАД+, и образуя СО2. Высвобождающаяся энергия используется для синтеза двух молекул АТФ.
Щавелевоуксусная кислота, образовавшаяса в результате реакций, вновь вступает в цикл, соединяясь с новой молекулой ацетил-КоА.
Окислительное фосфорилирование или клеточное дыхание происходит, на внутренних мембранах митохондрий, в которые встроены молекулы-переносчики электронов.
Цепь переноса электронов (дыхательная цепь) состоит из коферментов и белковых пигментов, расположенных на внутренней мембране митохондрий. Протоны Н+ от НАД*2Н и ФАД*2Н транспортируются в наружной мембране через протонную помпу (особый белок в мембране) Протоны Н+ накапливаются в пространстве между наружной и внутренней мембранами (Н+-резервуар). Энергия протонов при перемещении их обратно вовнутрь сквозь протонные каналы в мембране используется ферментом АТФазой для синтеза АТФ из АДФ. Внутри митохондрий Н+ соединяются с О2 и электронами, образуя Н2О.
Протоны Н+ от НАД*2Н и ФАД*2Н транспортируются в наружной мембране через протонную помпу (особый белок в мембране) Протоны Н+ накапливаются в пространстве между наружной и внутренней мембранами (Н+-резервуар). Энергия протонов при перемещении их обратно вовнутрь сквозь протонные каналы в мембране используется ферментом АТФазой для синтеза АТФ из АДФ. Внутри митохондрий Н+ соединяются с О2 и электронами, образуя Н2О.
Просмотров: 4923
Этапы энергетического обмена – Российский учебник
Живой организм построен из клеток. А некоторые, например, амеба или инфузория, состоят из одной клетки. Сложные многоклеточные особи представлены сочетаниями клеток, которые образуют различные системы организма: дыхательную или пищеварительную. Весь организм пронизан клетками нервной ткани, которые обеспечивают регуляцию и управление макроорганизмом.
Живая клетка от неживой отличается тем, что в ней постоянно и непрерывно протекает два разнонаправленных процесса:
- синтез, или строительство новых органелл (пластический обмен или ассимиляция)
- катаболизм, или разрушение питательных элементов с образованием энергии (энергетический обмен или диссимиляция)
В живых особях баланс между ассимиляцией и диссимиляцией поддерживается не всегда.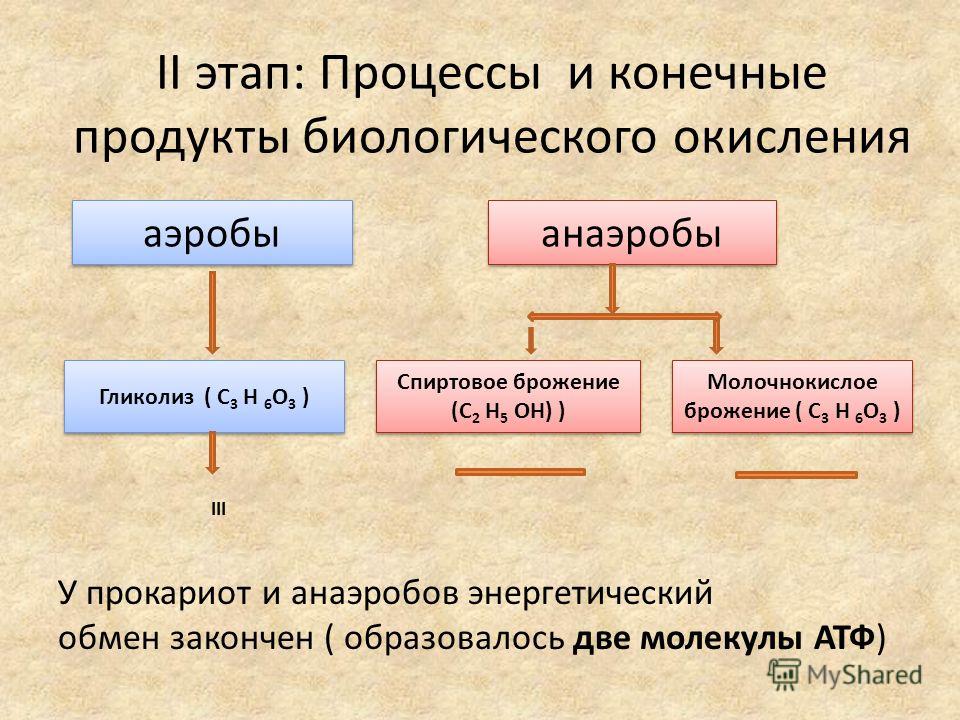 Если наблюдать за жизнью организма, можно заметить, что сначала тело становится больше по размерам, крепче и выносливее. Чем старше становится организм, тем меньше заметен рост, а в старости начинают преобладать процессы распада, организм не успевает восстанавливаться и погибает.
Если наблюдать за жизнью организма, можно заметить, что сначала тело становится больше по размерам, крепче и выносливее. Чем старше становится организм, тем меньше заметен рост, а в старости начинают преобладать процессы распада, организм не успевает восстанавливаться и погибает.
Чтобы машина ехала, ей нужен бензин. А бензин делают из нефти. Чтобы макроорганизм существовал, ему нужна энергия. В учебниках биологии часто можно встретить фразу глюкоза — ресурс энергии для клетки. Это так. Но глюкоза — как нефть для автомобиля. Поэтому сначала глюкозу нужно превратить в бензин. И таким бензином для клетки будет молекула АТФ.
Молекула АТФ известна миру довольно давно. Через десять лет, в 2029 году отпразднует сто лет со дня открытия вещество, благодаря которому в живой клетке поддерживается упорядоченность структур и она может противостоять хаосу и растущей энтропии (почему так происходит, подробно рассказано на странице 30 учебника «Естествознание 11 класс» под редакцией Титова С.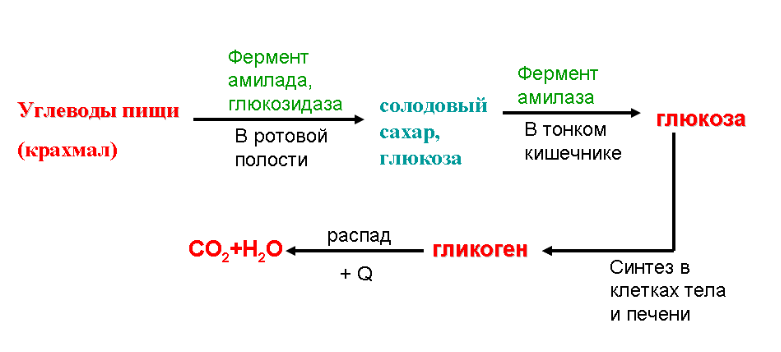 А.).
А.).
В 1929 году, практически одновременно, сотрудники Института биологии кайзера Вильгельма в Берлине Карл Ломан и Отто Мейергоф и ученые Гарвардской Медицинской школы Сайрус Фиске и Йеллапрагад Суббарао в Гарвардской Медицинской школе опубликовали работы, в которых описали молекулу АТФ.
В 30 годах ХХ века в лаборатории Мейергофа появился молодой ученый, Фриц Липман, который заинтересовался энергетическими аспектами клеточного метаболизма, и в 1941 году талантливый биохимик доказал, что АТФ – основной двигатель энергетических реакций в живой клетке. А в 1953 году его вклад в физиологию совместно с Х. Кребсом был удостоен Нобелевской премии.
АТФ — аденозинтрифосфат, нуклеотид, глобальный ресурс энергии для сложных реакций обмена веществ, происходящих в клетках организма. Схематично молекула АТФ представлена на странице 99 учебника «Естествознание 11 класс» под редакцией Титова С.А..
Вся суть энергетического обмена сводится к решению задачи, как энергию из сложных молекул пищи превратить в молекулу АТФ. В процессе эволюции эта задача была решена.
В процессе эволюции эта задача была решена.
Так как же булочка из Макдональдса превращается в энергию макроэргических связей АТФ?
В энергетическом обмене выделяют несколько процессов, разделенных не только временем, но и протекающих в различных частях клетки:
- Подготовительный этап
- Гликолиз
- Кислородное окисление
Подготовительный этап у человека и других многоклеточных макроорганизмов начинается в ротовой полости, продолжается в желудочно-кишечном тракте и представляет собой многоступенчатый процесс распада сложных полимеров белков, жиров и углеводов пищи до мономеров.
Из курса химии помним, что во время разрыва связей элементов выделяется энергия. Для образования аденозинтрифосфата этой энергии недостаточно, и она вся уходит во внешнюю среду.
Что же происходит у простых одноклеточных организмов, у которых нет ротиков и животиков? Пища, захваченная одноклеточным организмом, попадает в пищеварительную вакуоль или лизосому, где при помощи ферментов-катализаторов, способствующих пищеварению, протекает начальный этап диссимиляции.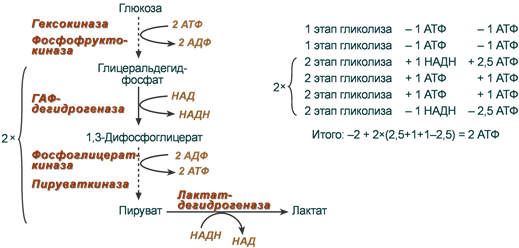
Подготовленные во время предварительного этапа вещества переходят во второй бескислородный этап энергетического обмена, который называется гликолиз.
Два греческих слова (гликос – «сладкий» и лизис – «расщеплять») дали название второй бескислородной фазе энергетического обмена — глико́лизу.
Гликолиз является цепочкой из 10 биохимических превращений, итогом которых является трансформация стабильной молекулы глюкозы в трехуглеродные молекулы пирувата, – или пировиноградной кислоты.
Что ещё почитать?
Химические и физические свойства водорода
Основные химические свойства кислот
Теория электролитической диссоциации
Массовая доля вещества
«Подождите, – могут сказать дотошные ученики, – глюкоза у нас находится в пищеварительной системе. А процессы метаболизма идут в клетках по всему организму, например, на кончике носа или задней лапе. Как же попадает глюкоза в цитоплазму клетки во всем организме?».
Как же попадает глюкоза в цитоплазму клетки во всем организме?».
Глюкоза всасывается в желудочно-кишечном тракте, попадает в кровоток, током крови разносится ко всем тканям и клеткам организма, и благодаря белку-переносчику инсулину попадает в клетку.
Цитоплазма отдельной клетки – место осуществления реакций гликолиза. Энергии при этом выделяется совсем немного. Ее хватает лишь на формирование 2-х молекул АТФ. Казалось бы, энергия получена, и процесс может остановиться. Так и происходит у некоторых бактерий. Но никакому нормальному многоклеточному организму таких запасов АТФ не хватит. В пировиноградной кислоте остался еще достаточный запас энергии, которую тоже хотелось бы использовать макроорганизму.
У многоклеточных тел пируват переходит в третью фазу диссимиляции — клеточное дыхание в митохондриях. Дыханием процесс называется, поскольку в ходе химических реакций в митохондриях происходит потребление кислорода и выделение углекислого газа в цитоплазму клетки, а дальше, с помощью кровообращения и дыхания, – во внешнюю среду.
Клеточное дыхание представлено двумя этапами:
- цикл Кребса, протекающий в матриксе митохондрий
- окислительное фосфорилирование, протекающее на кристах митохондрий при участии ферментов дыхательной цепи
Итогом кислородного этапа энергетического обмена является выделение количества энергии, достаточного для образования 36 молекул АТФ, воды и СО2. При этом нужно помнить, что аденозинтрифосфат содержит три остатка фосфата, а макроэргических связей образуется только две. Суммарное уравнение биохимических реакций, протекающих в третьей фазе диссимиляции, можно записать так:
2C3H4O3+6O2+36H3PO4+36АДФ=6CO2+42H2O+36АТФ
В итоге этих реакций происходит накопление огромного количества энергии — 36 молекул аденозинтрифосфата против 2-х, что запасаются в процессе гликолиза. Однако поскольку эта фаза требует кислорода для своих реакций, в бескислородной среде процесс протекать не может.
При дефиците кислорода пируват окисляется до лактата. Именно ему принадлежит ощущение приятной боли после хорошей тренировки. У хорошо тренированных людей с активным кровоснабжением и хорошо развитой сетью капилляров нужно затратить большую физическую нагрузку перед тем, как начнет накапливаться молочная кислота.
Вспомним, что еще 2 молекулы аденозинтрифосфата накапливаются на этапе гликолиза. Таким образом, при распаде одной молекулы глюкозы образуется 38 молекул АТФ.
На портале LECTA В параграфе 22 учебника «Естествознание 11 класс» под редакцией Титова С.А. внимательные ученики найдут ответ на вопрос, почему цианистый калий – любимое средство убийц в детективных романах.
ТестГлюкосенсоры в желудочно-кишечном тракте: влияние на метаболизм глюкозы
1. Adachi A, Shimizu N, Oomura Y, Kobashi M.
Конвергенция чувствительных к глюкозе гепатопортальных афферентных сигналов к чувствительным к глюкозе единицам в ядре солитарного тракта. Neurosci Lett
46: 215–218, 1984. [PubMed] [Google Scholar]
Neurosci Lett
46: 215–218, 1984. [PubMed] [Google Scholar]
2. Ahren B. Вегетативная регуляция секреции островковых гормонов – последствия для здоровья и болезней. Диабетология 43: 393–410, 2000. [PubMed] [Google Scholar]
3. Арен Б. Глюкагон – ранние прорывы и недавние открытия. пептиды 67: 74–81, 2015. [PubMed] [Google Scholar]
4. Amato A, Cinci L, Rotondo A, Serio R, Faussone-Pellegrini MS, Vannucchi MG, Mule F. Периферическое моторное действие глюкагоноподобного пептида-1 через кишечные нейрональные рецепторы. Нейрогастроэнтерол Мотил 22: 664–e203, 2010. [PubMed] [Google Scholar]
5. Balkan B, Li X. Портальное введение GLP-1 крысам усиливает реакцию инсулина на глюкозу через нейрональные механизмы. Am J Physiol Regul Integr Comp Physiol 279: R1449–R1454, 2000. [PubMed] [Google Scholar]
6. Blouet C, Schwartz GJ.
Чувствительность двенадцатиперстной кишки к липидам активирует афференты блуждающего нерва, чтобы регулировать термогенез бурого жира без дрожи у крыс. PLoS один
7: e51898, 2012. [Бесплатная статья PMC] [PubMed] [Google Scholar]
PLoS один
7: e51898, 2012. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Burcelin R, Crivelli V, Perrin C, Da Costa A, Mu J, Kahn BB, Birnbaum MJ, Kahn CR, Vollenweider P, Торенс Б. GLUT4, киназа AMP, но не рецептор инсулина, необходимы для стимулируемого гепатопортальным датчиком глюкозы использования глюкозы мышцами. Джей Клин Инвест 111: 1555–1562, 2003. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Бурселин Р., Да Коста А., Друкер Д., Торенс Б. Глюкозная компетенция датчика гепатопортальной вены требует присутствия активированного рецептора глюкагоноподобного пептида-1. Диабет 50: 1720–1728, 2001. [PubMed] [Google Scholar]
9. Burcelin R, Dolci W, Thorens B. Восприятие глюкозы гепатопортальным датчиком зависит от GLUT2: анализ in vivo у мышей с нулевым GLUT2. Диабет 49: 1643–1648, 2000. [PubMed] [Google Scholar]
10. Burcelin R, Dolci W, Thorens B.
Портальная инфузия глюкозы у мышей вызывает гипогликемию: свидетельство того, что гепатопортальный сенсор глюкозы стимулирует утилизацию глюкозы. Диабет
49: 1635–1642, 2000. [PubMed] [Google Scholar]
Диабет
49: 1635–1642, 2000. [PubMed] [Google Scholar]
11. Burcelin R, Knauf C, Cani PD. Дисфункция альфа-клеток поджелудочной железы при сахарном диабете. Диабет Метаб 34, Suppl 2: S49–S55, 2008. [PubMed] [Google Scholar]
12. Cabou C, Cani PD, Campistron G, Knauf C, Mathieu C, Sartori C, Amar J, Scherrer U, Burcelin R. Центральный инсулин регулирует частоту сердечных сокращений и артериальный кровоток: эндотелиальный механизм, зависящий от синтазы оксида азота, изменяется во время диабета. Диабет 56: 2872–2877, 2007. [PubMed] [Google Scholar]
13. Кай Х., Модсли С., Мартин Б. Какова роль метаболических гормонов во вкусовых сосочках языка. Переднее хорм.сопротивление 42: 134–146, 2014. [PubMed] [Google Scholar]
14. Чандрашекар Дж., Хун М.А., Рыба Н.Дж., Цукер С.С. Рецепторы и клетки вкуса млекопитающих. Природа 444: 288–294, 2006. [PubMed] [Google Scholar]
15. Коут К.С., Крафт Г., Иримия Дж.М., Смит М.С., Фармер Б., Нил Д.В., Роуч П.Дж., Шиота М.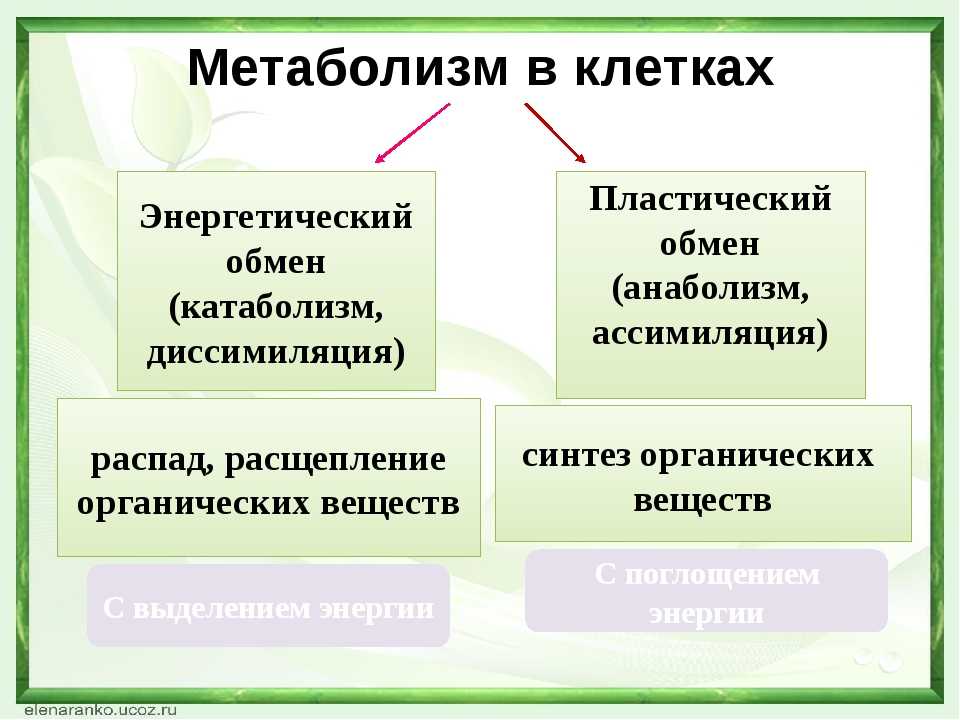 , Черрингтон А.Д.
Поступление глюкозы в портальную вену вызывает скоординированный клеточный ответ, который усиливает поглощение и накопление глюкозы печенью у нормальных собак, но не у собак, получающих корм с высоким содержанием жиров/фруктозы. Диабет
62: 392–400, 2013. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Черрингтон А.Д.
Поступление глюкозы в портальную вену вызывает скоординированный клеточный ответ, который усиливает поглощение и накопление глюкозы печенью у нормальных собак, но не у собак, получающих корм с высоким содержанием жиров/фруктозы. Диабет
62: 392–400, 2013. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Colombani AL, Carneiro L, Benani A, Galinier A, Jaillard T, Duparc T, Offer G, Lorsignol A, Magnan C, Casteilla Л., Пенико Л., Лелуп С. Усиление чувствительности гипоталамуса к глюкозе при ожирении: изменение передачи окислительно-восстановительных сигналов. Диабет 58: 2189–2197, 2009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Cotero VE, Zhang BB, Routh VH. Реакция возбужденных глюкозой нейронов вентромедиального гипоталамуса на снижение уровня глюкозы усиливается в мышиной модели сахарного диабета 2 типа. J Нейроэндокринол 22: 65–74, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Кросс Д.А., Алесси Д.Р., Коэн П., Анджелкович М. , Хеммингс Б.А.
Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа
378: 785–789, 1995. [PubMed] [Google Scholar]
, Хеммингс Б.А.
Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа
378: 785–789, 1995. [PubMed] [Google Scholar]
19. Damak S, Rong M, Yasumatsu K, Kokrashvili Z, Varadarajan V, Zou S, Jiang P, Ninomiya Y, Margolskie RF. Обнаружение сладкого вкуса и вкуса умами при отсутствии вкусового рецептора T1r3. Наука 301: 850–853, 2003. [PubMed] [Google Scholar]
20. Delaere F, Duchampt A, Mounien L, Seyer P, Duraffourd C, Zitoun C, Thorens B, Mithieux G. Роль связанного с натрием котранспортера глюкозы 3 в эффекте насыщения портального восприятия глюкозы. Мол Метаб 2: 47–53, 2012. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Депортере И. Вкусовые рецепторы кишечника: новая роль в здоровье и болезни. кишки 63: 179–190, 2014. [PubMed] [Google Scholar]
22. Diez-Sampedro A, Hirayama BA, Osswald C, Gorboulev V, Baumgarten K, Volk C, Wright EM, Koepsell H.
Сенсор глюкозы прячется в семействе транспортеров. Proc Natl Acad Sci USA
100: 11753–11758, 2003.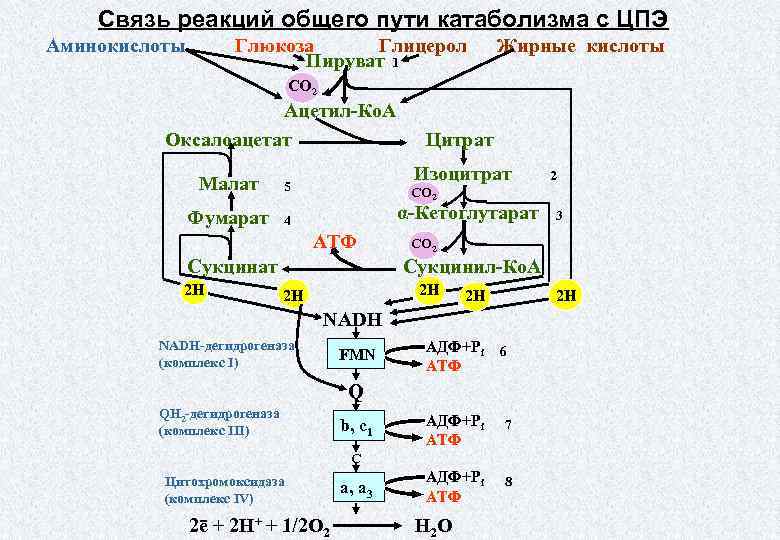 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Duca FA, Bauer PV, Hamr SC, Lam TK. Глюкорегуляторная значимость определения питательных веществ в тонкой кишке в физиологии, бариатрической хирургии и фармакологии. Сотовый метаб 22: 367–380, 2015. [PubMed] [Google Scholar]
24. Duparc T, Colom A, Cani PD, Massaly N, Rastrelli S, Drougard A, Le Gonidec S, Mouledous L, Frances B, Leclercq I, Llorens-Cortes C, Pospisilik JA, Delzenne NM, Valet P, Castan -Лаурелл И, Кнауф С. Центральный апелин контролирует гомеостаз глюкозы через зависимый от оксида азота путь у мышей. Антиоксидный окислительно-восстановительный сигнал 15: 1477–1496, 2011. [PubMed] [Google Scholar]
25. Duparc T, Naslain D, Colom A, Muccioli GG, Massaly N, Delzenne NM, Valet P, Cani PD, Knauf C.
Воспаление тощей кишки у мышей с ожирением и диабетом ухудшает обнаружение кишечной глюкозы и модифицирует высвобождение оксида азота в гипоталамусе. Антиоксидный окислительно-восстановительный сигнал
14: 415–423, 2011. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
26. Фингер Т.Е., Данилова В., Барроуз Дж., Бартель Д.Л., Вигерс А.Дж., Стоун Л., Хеллекант Г., Киннамон С.К. Передача сигналов АТФ имеет решающее значение для связи от вкусовых рецепторов к вкусовым нервам. Наука 310: 1495–1499, 2005. [PubMed] [Google Scholar]
27. Fioramonti X, Marsollier N, Song Z, Fakira KA, Patel RM, Brown S, Duparc T, Pica-Mendez A, Sanders NM, Knauf C , Валет П., МакКриммон Р.Дж., Бёв А., Маньян С., Рут В.Х. Вентромедиальная гипоталамическая продукция оксида азота необходима для обнаружения и контррегуляции гипогликемии. Диабет 59: 519–528, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Fioramonti X, Song Z, Vazirani RP, Beuve A, Routh VH. Гипоталамический оксид азота в обнаружении гипогликемии и контррегуляции: палка о двух концах. Антиоксидный окислительно-восстановительный сигнал 14: 505–517, 2011. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Fournel A, Drougard A, Duparc T, Marlin A, Brierley SM, Castro J, Le-Gonidec S, Masri B, Колом А. , Лукас А., Руссе П., Сенак Н., Верньолле Н., Вале П., Кани П.Д., Кнауф К.
Апелин нацелен на сокращение кишечника, чтобы контролировать метаболизм глюкозы через мозг. кишки
В прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Лукас А., Руссе П., Сенак Н., Верньолле Н., Вале П., Кани П.Д., Кнауф К.
Апелин нацелен на сокращение кишечника, чтобы контролировать метаболизм глюкозы через мозг. кишки
В прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Гардеманн А., Струлик Х., Юнгерманн К. Портально-артериальный градиент концентрации глюкозы как сигнал для инсулинозависимого чистого поглощения глюкозы в перфузируемой печени крысы. FEBS Lett 202: 255–259, 1986. [PubMed] [Google Scholar]
31. Geraedts MC, Munger SD. Вкусовые стимулы, представляющие различные перцептивные качества, вызывают различные паттерны секреции нейропептидов вкусовыми рецепторами. Джей Нейроски 33: 7559–7564, 2013. [Бесплатная статья PMC] [PubMed] [Google Scholar] Retracted
32. Гершпах А.С., Штайнерт Р.Е., Шоненбергер Л., Грабер-Майер А., Беглингер К. Роль кишечного рецептора сладкого вкуса в регуляции высвобождения GLP-1, PYY и CCK у людей. Am J Physiol Endocrinol Metab 301: E317–E325, 2011. [PubMed] [Google Scholar]
33. Гоке Б.
Функция островковых клеток: альфа- и бета-клетки – партнеры по нормогликемии. Приложение Int J Clin Pract
2–7, 2008. [PubMed] [Google Scholar]
Гоке Б.
Функция островковых клеток: альфа- и бета-клетки – партнеры по нормогликемии. Приложение Int J Clin Pract
2–7, 2008. [PubMed] [Google Scholar]
34. Gu W, Lloyd DJ, Chinookswong N, Komorowski R, Sivits G Jr, Graham M, Winters KA, Yan H, Boros LG, Lindberg RA, Veniant MM . Фармакологическое нацеливание на рецепторы глюкагона и глюкагоноподобного пептида 1 по-разному влияет на энергетический статус и гомеостаз глюкозы у мышей с ожирением, вызванным диетой. J Pharmacol Exp Ther 338: 70–81, 2011. [PubMed] [Google Scholar]
35. Хамано К., Накагава Ю., Оцу Ю., Ли Л., Медина Дж., Танака Ю., Масуда К., Комацу М., Кодзима И. Лактизол ингибирует чувствительный к глюкозе рецептор T1R3, экспрессируемый в бета-клетках поджелудочной железы мышей. Дж Эндокринол 226: 57–66, 2015. [PubMed] [Google Scholar]
36. Havel PJ, Akpan JO, Curry DL, Stern JS, Gingerich RL, Ahren B.
Автономный контроль секреции полипептидов поджелудочной железы и глюкагона при нейроглюкопении и гипогликемии у мышей.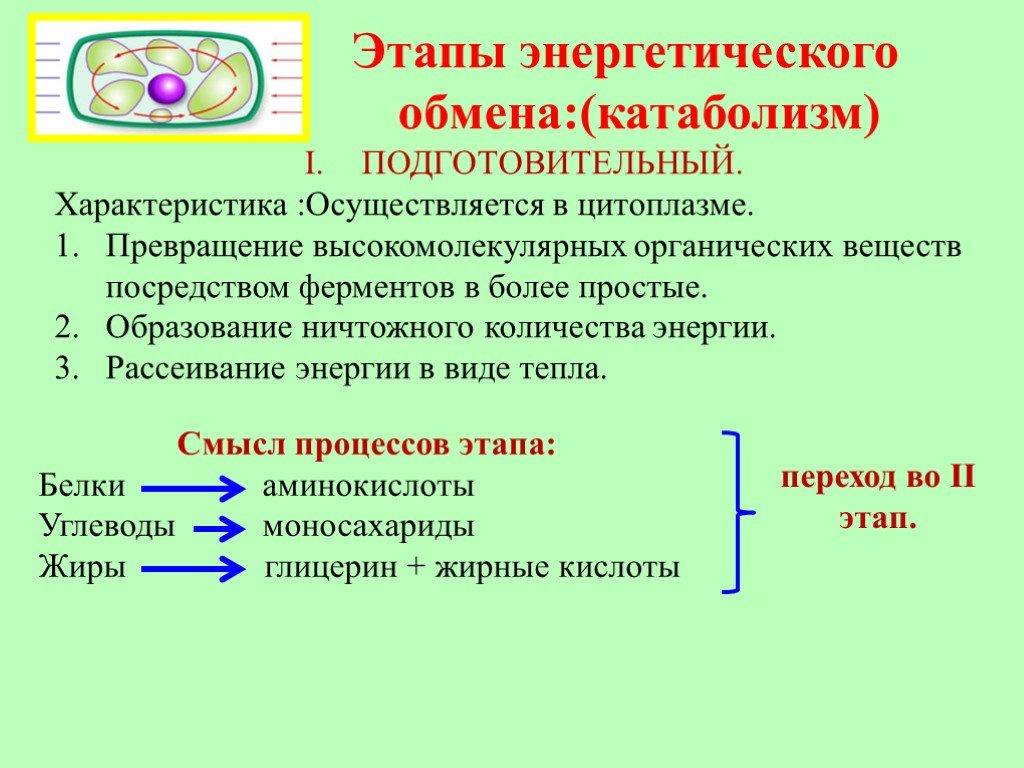 Am J Physiol Regul Integr Comp Physiol
265: Р246–Р254, 1993. [PubMed] [Google Scholar]
Am J Physiol Regul Integr Comp Physiol
265: Р246–Р254, 1993. [PubMed] [Google Scholar]
37. Heimberg H, De Vos A, Moens K, Quartier E, Bouwens L, Pipeleers D, Van Schaftingen E, Madsen O, Schuit F. Сенсорный белок глюкокиназа экспрессируется в альфа-клетках, продуцирующих глюкагон. Proc Natl Acad Sci USA 93: 7036–7041, 1996. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Hevener AL, Bergman RN, Donovan CM. Новый глюкозосенсор для обнаружения гипогликемии, локализованной в воротной вене. Диабет 46: 1521–1525, 1997. [PubMed] [Google Scholar]
39. Хевенер А.Л., Бергман Р.Н., Донован СМ. Афференты воротной вены имеют решающее значение для симпатоадреналового ответа на гипогликемию. Диабет 49: 8–12, 2000. [PubMed] [Google Scholar]
40. Holst JJ. Физиология глюкагоноподобного пептида 1. Physiol Rev. 87: 1409–1439, 2007. [PubMed] [Google Scholar]
41. Jacobson DA, Wicksteed BL, Philipson LH.
Загадка альфа-клеток: АТФ-чувствительные К+-каналы и чувствительность к глюкозе.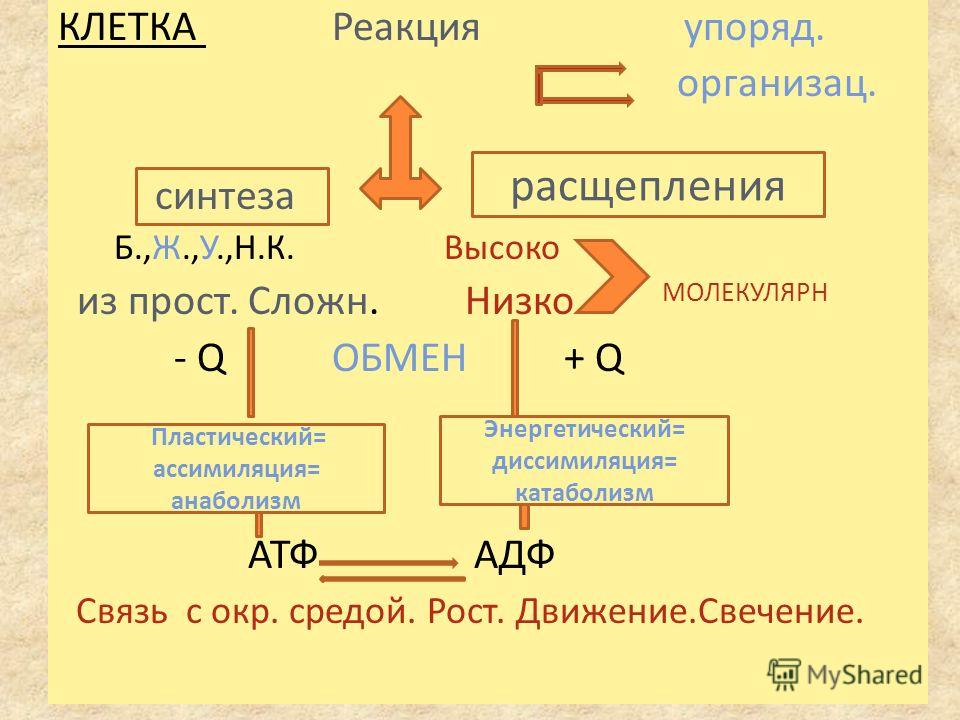 Диабет
58: 304–306, 2009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Диабет
58: 304–306, 2009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Келлетт Г.Л., Брот-Ларош Э. Апикальный GLUT2: основной путь всасывания сахара в кишечнике. Диабет 54: 3056–3062, 2005. [PubMed] [Google Scholar]
43. Knauf C, Cani PD, Kim DH, Iglesias MA, Chabo C, Waget A, Colom A, Rastrelli S, Delzenne NM, Drucker DJ, Seeley Р.Дж., Бурселин Р. Роль глюкагоноподобных рецепторов пептида-1 центральной нервной системы в восприятии кишечной глюкозы. Диабет 57: 2603–2612, 2008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Laffitte A, Neiers F, Briand L. Функциональная роль рецептора сладкого вкуса в тканях полости рта и вне полости рта. Curr Opin Clin Nutr Metab Care 17: 379–385, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Leloup C, Allard C, Carneiro L, Fioramonti X, Collins S, Penicaud L. Глюкоза и астроциты гипоталамуса: больше, чем роль топлива? неврология В прессе. [PubMed] [Google Scholar]
46. Leloup C, Casteilla L, Carriere A, Galinier A, Benani A, Carneiro L, Penicaud L. Балансировка митохондриальной редокс-сигнализации: ключевой момент в регуляции метаболизма. Антиоксидный окислительно-восстановительный сигнал
14: 519–530, 2011. [PubMed] [Google Scholar]
Балансировка митохондриальной редокс-сигнализации: ключевой момент в регуляции метаболизма. Антиоксидный окислительно-восстановительный сигнал
14: 519–530, 2011. [PubMed] [Google Scholar]
47. Лелуп С., Маньян С., Бенани А., Боннет Э., Алькье Т., Оффер Г., Карьер А., Перике А., Фернандес Ю., Кторза А., Кастейлья Л., Пенико Л. Митохондриальные активные формы кислорода необходимы для восприятия глюкозы гипоталамусом. Диабет 55: 2084–2090, 2006. [PubMed] [Google Scholar]
48. Liu M, Seino S, Kirchgessner AL. Идентификация и характеристика глюкочувствительных нейронов в энтеральной нервной системе. Джей Нейроски 19: 10305–10317, 1999. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Лопер Х.Б., Ла Сала М., Дотсон С., Стейнле Н. Восприятие вкуса, связанная с этим гормональная модуляция и потребление питательных веществ. Нутр Рев 73: 83–91, 2015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Lotfy M, Kalasz H, Szalai G, Singh J, Adeghate E.
Недавний прогресс в использовании глюкагона и антагонистов глюкагоновых рецепторов при лечении сахарного диабета. Открытая медицинская химия J
8: 28–35, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Открытая медицинская химия J
8: 28–35, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. MacDonald PE, Joseph JW, Rorsman P. Глюкозочувствительные механизмы в бета-клетках поджелудочной железы. Philos Trans R Soc Lond B Biol Sci 360: 2211–2225, 2005. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Мейс О.Дж., Аффлек Дж., Патель Н., Келлетт Г.Л. Рецепторы сладкого вкуса в тонком кишечнике крыс стимулируют всасывание глюкозы через апикальный GLUT2. Дж Физиол 582: 379–392, 2007. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Marty N, Dallaporta M, Foretz M, Emery M, Tarussio D, Bady I, Binnert C, Beermann F, Thorens B . Регуляция секреции глюкагона транспортером глюкозы типа 2 (glut2) и астроцит-зависимыми сенсорами глюкозы. Джей Клин Инвест 115: 3545–3553, 2005. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Матчинский Ф., Лян Ю., Кесаван П., Ван Л., Фрогел П., Вельо Г., Коэн Д., Пермутт М.А., Танидзава И., Джеттон Т.Л.
Глюкокиназа как сенсор глюкозы бета-клеток поджелудочной железы и ген диабета. Джей Клин Инвест
92: 2092–2098, 1993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест
92: 2092–2098, 1993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Мэй Н. Кишечная химиочувствительность. Физиол Преподобный 65: 211–237, 1985. [PubMed] [Google Scholar]
56. Мериго Ф., Бенати Д., Кристофолетти М., Оскулати Ф., Сбарбати А. Транспортеры глюкозы экспрессируются в клетках вкусовых рецепторов. Джей Анат 219: 243–252, 2011. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Mierson S, DeSimone SK, Heck GL, DeSimone JA. Активированный сахаром ионный транспорт в язычном эпителии собак. Последствия для преобразования вкуса сахара. J Ген Физиол 92: 87–111, 1988. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Miki T, Liss B, Minami K, Shiuchi T, Saraya A, Kashima Y, Horiuchi M, Ashcroft F, Minokoshi Y , Ропер Дж., Сейно С. АТФ-чувствительные К+-каналы в гипоталамусе необходимы для поддержания гомеостаза глюкозы. Нат Нейроски 4: 507–512, 2001. [PubMed] [Google Scholar]
59. Митье Г., Андреелли Ф., Маньян К. Кишечный глюконеогенез: ключевой сигнал центрального контроля гомеостаза энергии и глюкозы. Curr Opin Clin Nutr Metab Care
12: 419–423, 2009. [PubMed] [Google Scholar]
Кишечный глюконеогенез: ключевой сигнал центрального контроля гомеостаза энергии и глюкозы. Curr Opin Clin Nutr Metab Care
12: 419–423, 2009. [PubMed] [Google Scholar]
60. Mohammad S, Ramos LS, Buck J, Levin LR, Rubino F, McGraw TE. Желудочный ингибирующий пептид контролирует чувствительность жировой ткани к инсулину посредством активации белка, связывающего цАМФ-ответный элемент, и изоформы р110бета фосфатидилинозитол-3-киназы. J Биол Хим 286: 43062–43070, 2011. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Moore MC, Coat KC, Winnick JJ, An Z, Cherrington AD. Регуляция поглощения и хранения глюкозы печенью in vivo. Ад Нутр 3: 286–294, 2012. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Mwangi S, Anitha M, Mallikarjun C, Ding X, Hara M, Parsadanian A, Larsen CP, Thule P, Sitaraman SV , Анания Ф., Шринивасан С.
Нейротрофический фактор глиальной клеточной линии увеличивает массу бета-клеток и улучшает толерантность к глюкозе. Гастроэнтерология
134: 727–737, 2008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Наук М.А., Нидеррайххольц У., Эттлер Р., Холст Дж.Дж., Орсков С., Ритцель Р., Шмигель У.Х. Ингибирование опорожнения желудка глюкагоноподобным пептидом 1 перевешивает его инсулинотропные эффекты у здоровых людей. Am J Physiol Endocrinol Metab 273: E981–E988, 1997. [PubMed] [Google Scholar]
64. Ниидзима А. Глюкозочувствительные афферентные нервные волокна в печеночной ветви блуждающего нерва морской свинки. Дж Физиол 332: 315–323, 1982. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Ninomiya Y, Sako N, Imai Y. Усиленные вкусовые нейронные реакции на сахар у диабетиков db / db мышь. Am J Physiol Regul Integr Comp Physiol 269: R930–R937, 1995. [PubMed] [Google Scholar]
66. Nonogaki K. Новое понимание симпатической регуляции метаболизма глюкозы и жиров. Диабетология 43: 533–549, 2000. [PubMed] [Google Scholar]
67. Oomura Y, Kimura K, Ooyama H, Maeno T, Iki M, Kuniyoshi M.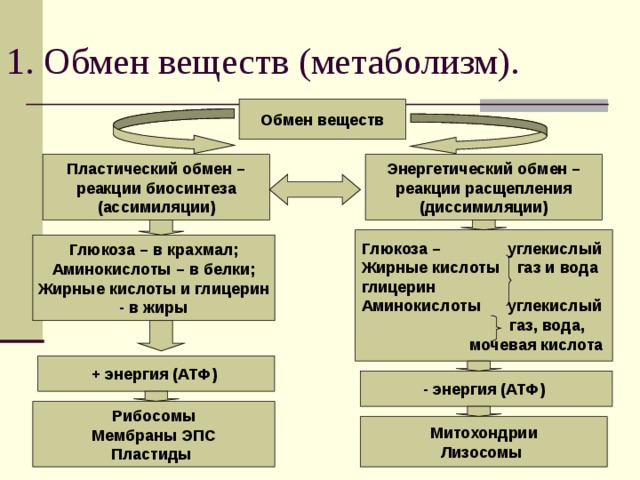 Реципрокная активность вентромедиальной и латеральной областей гипоталамуса кошек. Наука
143: 484–485, 1964. [PubMed] [Google Scholar]
Реципрокная активность вентромедиальной и латеральной областей гипоталамуса кошек. Наука
143: 484–485, 1964. [PubMed] [Google Scholar]
68. Orci L, Thorens B, Ravazzola M, Lodish HF. Локализация переносчика глюкозы бета-клетками поджелудочной железы в специфические домены плазматической мембраны. Наука 245: 295–297, 1989. [PubMed] [Google Scholar]
69. Ояма Ю., Ямано Х., Окума А., Огавара К., Хигаки К., Кимура Т. Системы переноса глюкозы в клетках слизистой оболочки полости рта человека. Джей Фарм Сай 88: 830–834, 1999. [PubMed] [Google Scholar]
70. Pagliassotti MJ, Holste LC, Moore MC, Neal DW, Cherrington AD. Сравнение временных курсов инсулина и портального сигнала на метаболизм глюкозы и гликогена в печени у собак, находящихся в сознании. Джей Клин Инвест 97: 81–91, 1996. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Pai MH, Ko TL, Chou HC.
Влияние диабета, вызванного стрептозотоцином, на вкусовые рецепторы желобчатых сосочков крыс. Акта Гистохим
109: 200–207, 2007.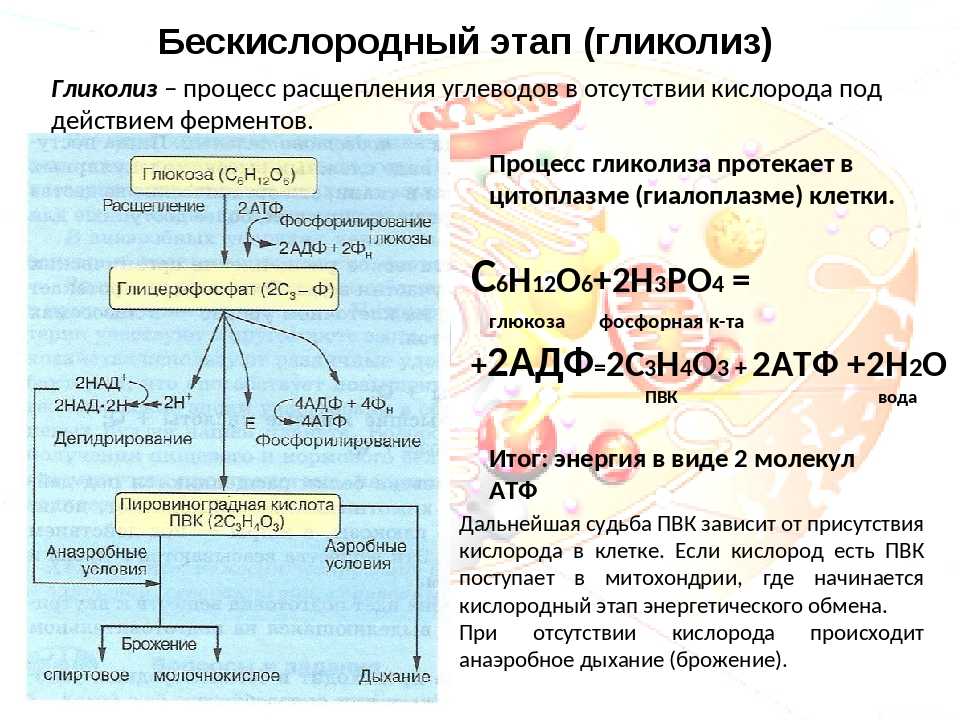 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
72. Переа А., Винамбрес С., Клементе Ф., Вильянуэва-Пенакаррильо М.Л., Вальверде И. Амид GLP-1 (7–36): влияние на транспорт и метаболизм глюкозы в жировой ткани крыс. Горм Метаб Рез 29: 417–421, 1997. [PubMed] [Google Scholar]
73. Pfannkuche H, Gabel G. Глюкоза, эпителий и кишечная нервная система: диалог в темноте. J Anim Physiol Anim Nutr (Берл) 93: 277–286, 2009. [PubMed] [Google Scholar]
74. Pocai A, Lam TK, Gutierrez-Juarez R, Obici S, Schwartz GJ, Bryan J, Aguilar-Bryan L, Rossetti L. Гипоталамические К(АТФ) каналы контролируют выработку глюкозы в печени. Природа 434: 1026–1031, 2005. [PubMed] [Google Scholar]
75. Psichas A, Reimann F, Gribble FM. Механизмы химиочувствительности кишечника. Джей Клин Инвест 125: 908–917, 2015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Quesada I, Tuduri E, Ripoll C, Nadal A.
Физиология секреции альфа-клеток поджелудочной железы и глюкагона: роль в гомеостазе глюкозы и диабете. Дж Эндокринол
199: 5–19, 2008. [PubMed] [Google Scholar]
Дж Эндокринол
199: 5–19, 2008. [PubMed] [Google Scholar]
77. Richards P, Parker HE, Adriaenssens AE, Hodgson JM, Cork SC, Trapp S, Gribble FM, Reimann F. Идентификация и характеристика клеток, экспрессирующих рецептор GLP-1, с использованием новой модели трансгенных мышей. Диабет 63: 1224–1233, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Рорсман П., Элиассон Л., Ренстром Э., Громада Дж., Барг С., Гопел С. Клеточная физиология двухфазной секреции инсулина. Новости Physiol Sci 15: 72–77, 2000. [PubMed] [Google Scholar]
79. Росси Дж., Сантамаки П., Айраксинен М.С., Герциг К.Х. Для парасимпатической иннервации и функции эндокринной поджелудочной железы необходим рецептор семейства факторов глиальной клеточной линии альфа2 (GFRalpha2). Диабет 54: 1324–1330, 2005. [PubMed] [Google Scholar]
80. Routh VH. Глюкозочувствительные нейроны вентромедиального гипоталамуса. Датчики (Базель) 10: 9002–9025, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Routh VH, Hao L, Santiago AM, Sheng Z, Zhou C.
Гипоталамическая чувствительность к глюкозе: сводим концы с концами. Фронт Сист Нейроски
8: 236, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Routh VH, Hao L, Santiago AM, Sheng Z, Zhou C.
Гипоталамическая чувствительность к глюкозе: сводим концы с концами. Фронт Сист Нейроски
8: 236, 2014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Руссек М. Участие печеночных глюкорецепторов в контроле приема пищи. Природа 197: 79–80, 1963. [PubMed] [Google Scholar]
83. Saltiel AR, Kahn CR. Передача сигналов инсулина и регуляция метаболизма глюкозы и липидов. Природа 414: 799–806, 2001. [PubMed] [Google Scholar]
84. Sayegh AI, Covasa M, Ritter RC. Кишечные инфузии олеата и глюкозы активируют отдельные кишечные нейроны у крыс. Автон Нейроски 115: 54–63, 2004. [PubMed] [Google Scholar]
85. Schuit FC, Huypens P, Heimberg H, Pipeleers DG. Чувство глюкозы в бета-клетках поджелудочной железы: модель для изучения других клеток, регулируемых глюкозой, в кишечнике, поджелудочной железе и гипоталамусе. Диабет 50: 1–11, 2001. [PubMed] [Google Scholar]
86. Shepherd PR, Kahn BB.
Транспортеры глюкозы и действие инсулина – последствия инсулинорезистентности и сахарного диабета [комментарий]. N Engl J Med
341: 248–257, 1999. [PubMed] [Google Scholar]
N Engl J Med
341: 248–257, 1999. [PubMed] [Google Scholar]
87. Shigemura N, Ohta R, Kusakabe Y, Miura H, Hino A, Koyano K, Nakashima K, Ninomiya Y. Лептин модулирует поведенческие реакции на сладкие вещества, влияя на периферические вкусовые структуры. Эндокринология 145: 839–847, 2004. [PubMed] [Google Scholar]
88. Симадзу Т., Амакава А. Регуляция метаболизма гликогена в печени вегетативной нервной системой. III. Дифференциальные эффекты стимуляции симпатического нерва и катехоламинов на фосфорилазу печени. Биохим Биофиз Акта 165: 349–356, 1968. [PubMed] [Google Scholar]
89. Симадзу Т., Амакава А. Регуляция метаболизма гликогена в печени вегетативной нервной системой. II. Нейронная регуляция гликогенолитических ферментов. Биохим Биофиз Акта 165: 335–348, 1968. [PubMed] [Google Scholar]
90. Shin YK, Martin B, Golden E, Dotson CD, Maudsley S, Kim W, Jang HJ, Mattson MP, Drucker DJ, Egan JM, Munger SD.
Модуляция вкусовой чувствительности с помощью передачи сигналов GLP-1. Джей Нейрохим
106: 455–463, 2008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Нейрохим
106: 455–463, 2008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Steinbusch L, Labouebe G, Thorens B. Чувствительность мозга к глюкозе в гомеостатической и гедонистической регуляции. Тенденции Эндокринол Метаб 26: 455–466, 2015. [PubMed] [Google Scholar]
92. Villar-Palasi C. О механизме инактивации мышечной гликогенфосфорилазы инсулином. Биохим Биофиз Акта 1224: 384–388, 1994. [PubMed] [Google Scholar]
93. Вебер С. Нейрогастроэнтерология: улучшение толерантности к глюкозе через ось кишечник-мозг. Нат Рев Гастроэнтерол Гепатол 13: 4, 2016. [PubMed] [Google Scholar]
94. Райт Э.М., Мартин М.Г., Терк Э. Кишечная абсорбция в норме и при болезни – сахара. Best Pract Res Clin Gastroenterol 17: 943–956, 2003. [PubMed] [Google Scholar]
95. Yamamoto H, Lee CE, Marcus JN, Williams TD, Overton JM, Lopez ME, Hollenberg AN, Baggio L, Saper CB, Drucker DJ, Elmquist Дж.К.
Стимуляция рецептора глюкагоноподобного пептида-1 повышает кровяное давление и частоту сердечных сокращений и активирует вегетативные регуляторные нейроны.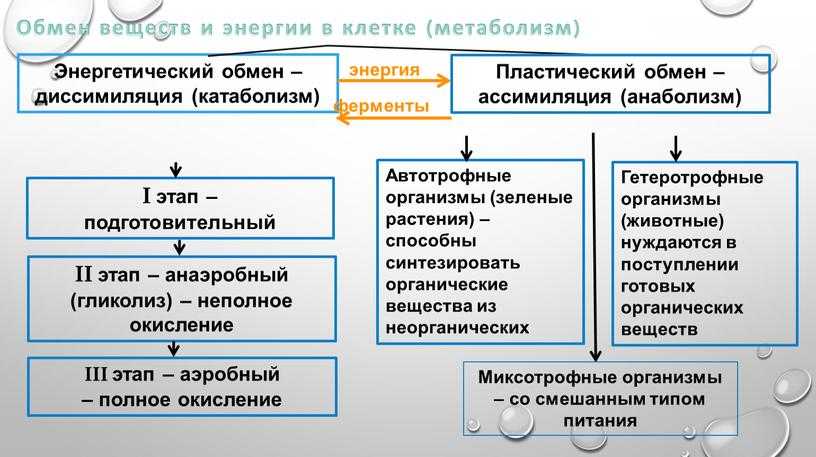 Джей Клин Инвест
110: 43–52, 2002. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест
110: 43–52, 2002. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Zhang XJ, Wang YQ, Long Y, Wang L, Li Y, Gao FB, Tian HM. Изменение сладкого вкуса в рационе с высоким содержанием жиров вызывало ожирение у крыс после 4-недельного лечения эксенатидом. пептиды 47: 115–123, 2013. [PubMed] [Google Scholar]
97. Zhou LH, Liu XM, Feng XH, Han LO, Liu GD. Экспрессия альфа-густдуцина в желобовидных сосочках вкусовых рецепторов крыс с диабетом. Акта Гистохим 111: 145–149, 2009. [PubMed] [Google Scholar]
98. Zhu W, Czyzyk D, Paranjape SA, Zhou L, Horblitt A, Szabo G, Seashore MR, Sherwin RS, Chan O. Глюкоза предотвращает падение уровня ГАМК в вентромедиальном гипоталамусе, что необходимо для полной активации контррегуляторных реакций глюкозы во время гипогликемии. Am J Physiol Endocrinol Metab 298: E971–E977, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Zou CY, Gong Y, Liang J.
Метаболическая сигнализация секреции инсулина бета-клетками поджелудочной железы и ее нарушение при диабете 2 типа.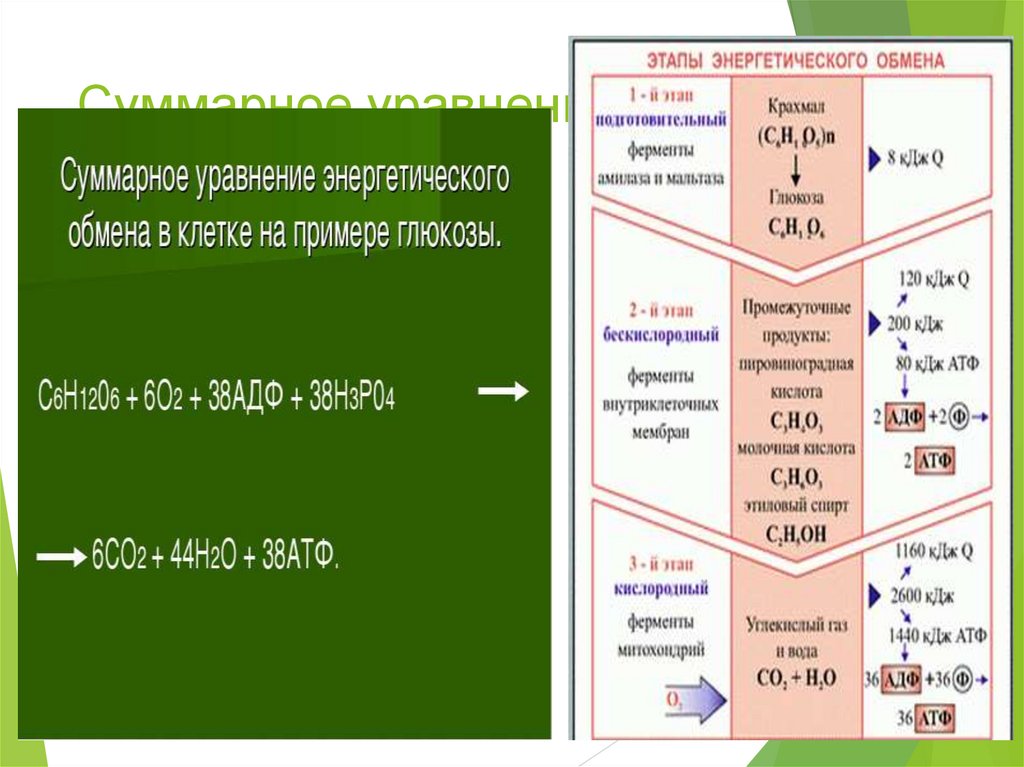 Eur Rev Med Pharmacol Sci
18: 2215–2227, 2014. [PubMed] [Google Scholar]
Eur Rev Med Pharmacol Sci
18: 2215–2227, 2014. [PubMed] [Google Scholar]
Сахар в печени и крови :: Diabetes Education Online
Печень и уровень сахара в крови
- Уровень сахара в крови и другие гормоны »
- « Контроль уровня сахара в крови
Во время еды ваша печень откладывает сахар на потом.
Когда вы не едите, печень поставляет сахар, превращая гликоген в глюкозу в процессе, называемом гликогенолизом.
Печень хранит и производит сахар…
Печень действует как резервуар глюкозы (или топлива) в организме и помогает поддерживать стабильный и постоянный уровень циркулирующего в крови сахара и других видов топлива. Печень хранит и производит глюкозу в зависимости от потребности организма. О необходимости запасать или высвобождать глюкозу в первую очередь сигнализируют гормоны инсулин и глюкагон.
Во время еды ваша печень будет запасать сахар или глюкозу в виде гликогена на более позднее время, когда он понадобится вашему телу.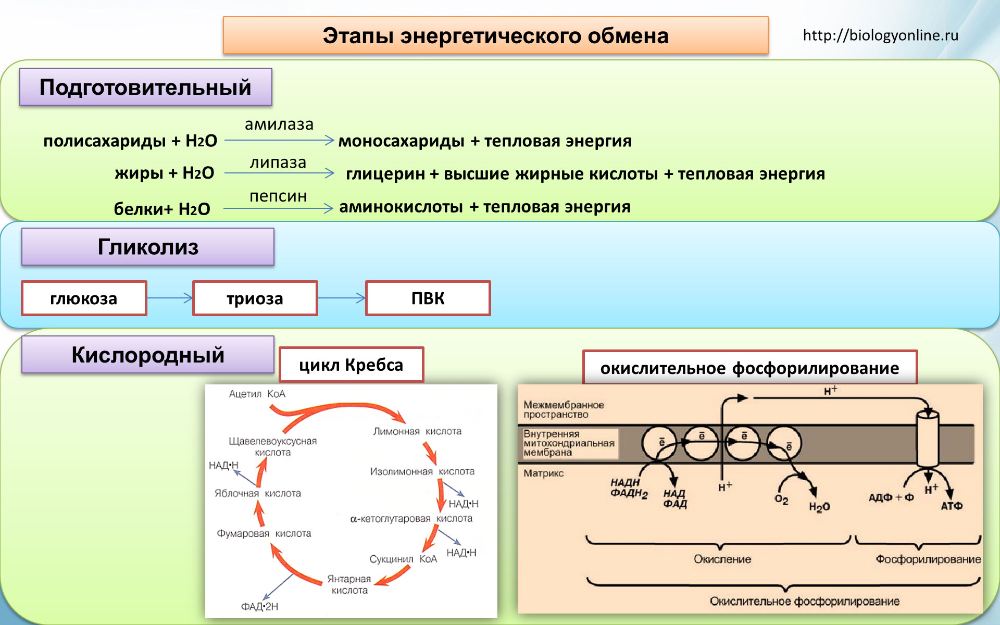 Высокий уровень инсулина и сниженный уровень глюкагона во время еды способствуют накоплению глюкозы в виде гликогена.
Высокий уровень инсулина и сниженный уровень глюкагона во время еды способствуют накоплению глюкозы в виде гликогена.
Печень вырабатывает сахар, когда он вам нужен….
Когда вы не едите, особенно ночью или между приемами пищи, организму приходится вырабатывать собственный сахар. Печень поставляет сахар или глюкозу, превращая гликоген в глюкозу в процессе, называемом 9.0229 гликогенолиз. Печень также может производить необходимый сахар или глюкозу, собирая аминокислоты, отходы и побочные продукты жира. Этот процесс называется глюконеогенезом .
Печень также производит другое топливо, кетоны, когда сахара не хватает….
Когда запасы гликогена в вашем организме заканчиваются, организм начинает сохранять запасы сахара для органов, которым всегда требуется сахар. К ним относятся: головной мозг, эритроциты и части почек. Чтобы дополнить ограниченный запас сахара, печень вырабатывает из жиров альтернативное топливо, называемое кетонами.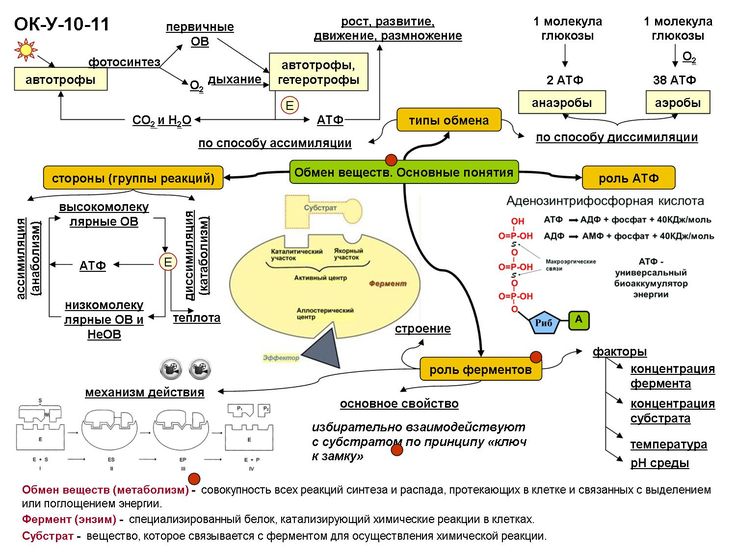 Этот процесс называется кетогенез . Гормональный сигнал для начала кетогенеза — низкий уровень инсулина. Кетоны сжигаются в качестве топлива мышцами и другими органами тела. А сахар сохраняется для органов, которые в нем нуждаются.
Этот процесс называется кетогенез . Гормональный сигнал для начала кетогенеза — низкий уровень инсулина. Кетоны сжигаются в качестве топлива мышцами и другими органами тела. А сахар сохраняется для органов, которые в нем нуждаются.
Термины «глюконеогенез, гликогенолиз и кетогенез» могут показаться сложными понятиями или словами в тесте по биологии. Найдите минутку, чтобы просмотреть определения и иллюстрации выше. При диабете эти процессы могут быть выведены из равновесия, и если вы полностью понимаете, что происходит, вы можете предпринять шаги для устранения проблемы.
Глюконеогенез? Гликогенолиз? Кетогенез? Кто они такие? Ты должен знать.
Тест для самооценки
Тесты для самооценки доступны по темам, освещаемым на этом веб-сайте. Чтобы узнать, как много вы узнали о фактах о диабете , пройдите наш тест для самооценки, когда заполните этот раздел. Викторина представляет собой множественный выбор.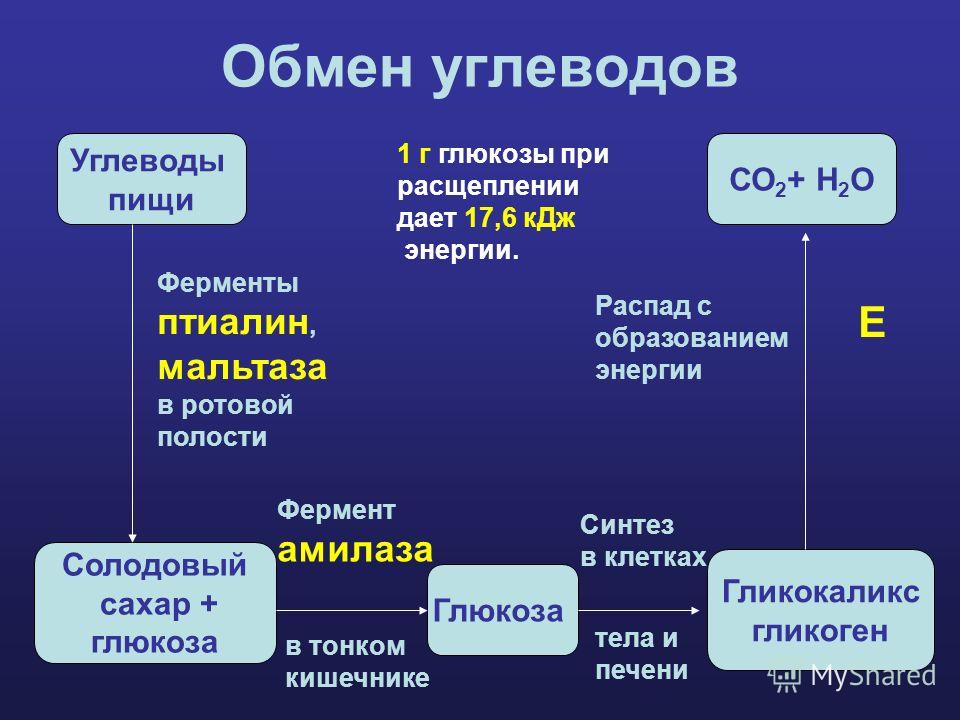

Leave A Comment