Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Похожие презентации:
Периодический закон и Периодическая система химических элементов
Периодический закон Д.И. Менделеева
Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева
Периодическая система Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева
Водород. Положение в периодической системе
1. Положение в периодической системе химических элементов Д. И. Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элеме
Положение в периодической системе химическихэлементов Д.
 И. Менделеева водорода, лантаноидов,
И. Менделеева водорода, лантаноидов,актиноидов и искусственно полученных элементов
l
ml
0
(s)
0
Число АО
на подуровне =
= (2l+1)
Направление в
пространстве
z
y
x
1
(p)
2
(d)
-1
0
+1
-2;-1; 0;
+1;+2
3 -3;-2;-1;0;
(f) +1;+2;+3
z
y
x
z
z
y
x
сложные структуры
сложные структуры
y
x
Энергетическая диаграмма атома
4. Задание для закрепления:
•• Каким набором квантовых чисел
описывается движение 4 электрона в атоме
бора; последнего электрона в атоме хлора;
25 электрона в атоме меди.
5. Положение водорода в периодической системе
• Водород – самый распространённый химическийэлемент, самый лёгкий. Ядро водорода состоит
из одного протона, вокруг которого вращается
один электрон. Электронная формула 1s1.
• С учётом его свойств его помещают как в 1А так и
в 7А группу.Возникает вопрос – почему?
• Водород относится к химически активным веществам.
 Он
Он может выступать в роли восстановителя и окислителя.
• 1) с некоторыми металлами он образует гидриды
• 2Na+h3=2NaH,
• здесь водород – окислитель H0 + 1e- → H-1
• Сходный процесс происходит при взаимодействии
галогенов – неметаллов 7А группы
•
• 2Na+Cl2=2NaCl
•
• Поэтому, водород помещают в 7А группу
• 2) с неметаллами, проявляющими более сильные окислительные
свойства, чем водород
• h3+Cl2 =2HCl
• здесь водород – восстановитель H0 — 1e- → H+1
• Сходный процесс происходит при взаимодействии щелочных
металлов –металлов 1А группы
•
• 2К+Cl2=2КCl
•
• Поэтому, водород помещают в 1А группу
•
• ИЮПАК рекомендует размещать водород только в 1А группе.
8. Положение в ПСХЭ Д. И. Менделеева лантаноидов и актиноидов
• В шестом периоде вслед залантаном располагаются 14 элементов с
порядковыми номерами 58-71,
называемых лантаноидами (слово
“лантаноиды” означает «подобные
лантану», а “актиноиды” — «подобные
актинию»).

• У лантана (Z= 57) один электрон поступает
на 5d-подуровень, после чего заполнение
этого подуровня приостанавливается, а
начинает заполняться 4f-уровень, семь
орбиталей которого могут быть заняты 14
электронами.
• Это происходит у атомов всех лантаноидов
с Z = 58 — 71. Поскольку у этих элементов
заполняется глубинный 4fподуровеиь третьего снаружи уровня, они
обладают весьма близкими химическими
свойствами.
• В седьмом периоде 14 элементов с порядковыми
номерами 90-103 составляют
семейство актиноидов.
• У актиния и актиноидов заполнение уровней
электронами подобно лантану и лантаноидам.
• Они в своих соединениях проявляют больше
различных степеней окисления. Например, степень
окисления актиния +3, а урана +3, +4, +5 и +6.
• Изучение химических свойств актиноидов крайне
сложно вследствие неустойчивости их ядер.
11. Положение в периодической системе химических элементов Д. И. Менделеева искусственно полученных элементов
• К 2016 г. известно 119 химических
известно 119 химических элементов, из них 94 обнаружены в природе
(некоторые — лишь в следовых
количествах), остальные получены
искусственно в результате ядерных реакций
• Первые 112 элементов имеют постоянные
названия, остальные — временные.
12. Ответьте на вопросы тестов
1. Чему равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
1) массовое число; 2) число протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%),
какой ещё изотоп входит в состав кремния, если атомная масса кремния 28,1.

1) 27; 2) 31; 3) 32; 4) 30.
9. Набор квантовых чисел (n, l, ml, ms) последнего электрона в атоме кислорода:
10. Сумма значений n+l максимальна для орбиталей:
1) 5s; 2) 4p; 3) 3d; 4) 6s.
11. На внешнем энергоуровне элементов главных подгрупп число
электронов :
1) равно 2; 2) равно номеру периода; 3) равно номеру группы; 4) равно 1.
12. Элементу 2-го периода до завершения внешнего уровня не хватает 3 электронов. Это элемент-…
1) бор; 2) углерод; 3) азот; 4) фосфор.
13. Элемент проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию
валентных электронов может иметь этот элемент в основном состоянии?
14. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов
может иметь этот элемент в основном состоянии?
1) 4d6; 2) 2s22p4; 3) 3s23p4; 4) 3s13d5.
15.
 Атому элемента марганец соответствует сокращённая электронная формула
Атому элемента марганец соответствует сокращённая электронная формула1) [18Ar]4s23d5; 2) [18Ar,3d10]4s22p5; 3) [10Ne]3s23p5; 4) [36Kr]4d55s2.
16. Строение внешнего и предвнешнего электронных слоёв атома меди
1) 3s23p63d94s2; 2) 3s23p63d104s0; 3) 3s23p64s13d10; 4) 3s23p63d11.
17. Движение электрона в атоме описывается … квантовыми числами.
18. Изотопы одного элемента различаются
1) числом протонов 2) числом нейтронов 3) числом электронов 4) зарядом ядра
19. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
20. В периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
• 21. Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
• 22.
 Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления
Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
• 23. Все атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
• 24. Номер периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
• 25. В группе сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
• 26. Основные свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются в группах
2) уменьшаются в периодах и увеличиваются в группах
3) увеличиваются в периодах и уменьшаются в группах
4) увеличиваются в периодах и увеличиваются в группах
• 27.
 Формула основания, соответствующая элементу четвертой группы в его высшей степени окисления
Формула основания, соответствующая элементу четвертой группы в его высшей степени окисления• 28. Электронная формула валентного уровня 3d84s2 имеется у атомов
1) скандия 2) никеля 3) марганца 4) титана
• 29. Электронная формула атома натрия
1) ls22s22p63s23p1 2) 1s22s22p63s23p3
3) 1s22s22p63s1 4) ls22s1
• 30. Число неспаренных электронов в основном состоянии атома бериллия равно
1) 0 2) 1 3) 2 4) 4
• 31. Элемент, атомы которого имеют в основном состоянии 4 неспаренных
электронов
1) марганец 2) железо 3) ванадий 4) хром
• 32. Является f-элементом
1) Sr 2) Se 3) Sc 4) Sm
• 33. Никель является
1) s-элементом 2) р-элементом
3) d-элементом 4) f-элементом
• 34. Какой подуровень из перечисленных заполняется электронами первым?
English Русский Правила
Супербомба: история и мифы.
12 августа 1953-го в СССР взорвали первую «практичную» термоядерную бомбу. Корреспондент «Чердака» рассказывает об истории ее создания и разбирается, правда ли, что такой боеприпас почти не загрязняет среду, но может уничтожить мир.
Корреспондент «Чердака» рассказывает об истории ее создания и разбирается, правда ли, что такой боеприпас почти не загрязняет среду, но может уничтожить мир.
Идея термоядерного оружия, где ядра атомов сливаются, а не расщепляются, как в атомной бомбе, появилась не позднее 1941 года. Она пришла в головы физикам Энрико Ферми и Эдварду Теллеру. Примерно в то же время они стали участниками Манхэттенского проекта и помогли создать бомбы, сброшенные на Хиросиму и Нагасаки. Сконструировать термоядерный боеприпас оказалось намного сложнее.
Приблизительно понять, насколько термоядерная бомба сложнее атомной, можно и по тому факту, что работающие АЭС давно обыденность, а работающие и практичные термоядерные электростанции — все еще научная фантастика.
Чтобы атомные ядра сливались друг с другом, их надо нагреть до миллионов градусов. Схему устройства, которое позволило бы это проделать, американцы запатентовали в 1946 году (проект неофициально назывался Super), но вспомнили о ней только спустя три года, когда в СССР успешно испытали ядерную бомбу.
Президент США Гарри Трумэн заявил, что на советский рывок нужно ответить «так называемой водородной, или супербомбой».
К 1951 году американцы собрали устройство и провели испытания под кодовым названием «Джордж». Конструкция представляла собой тор — проще говоря, бублик — с тяжелыми изотопами водорода, дейтерием и тритием. Выбрали их потому, что такие ядра сливать проще, чем ядра обычного водорода. Запалом служила ядерная бомба. Взрыв сжимал дейтерий и тритий, те сливались, давали поток быстрых нейтронов и зажигали обкладку из урана. В обычной атомной бомбе он не делится: там есть только медленные нейтроны, которые не могут заставить делиться стабильный изотоп урана. Хотя на энергию слияния ядер пришлось примерно 10% от общей энергии взрыва «Джорджа», «поджиг» урана-238 позволил поднять мощность взрыва вдвое выше обычного, до 225 килотонн.
За счет дополнительного урана взрыв получился вдвое мощнее, чем с обычной атомной бомбой. Но на термоядерный синтез приходилось только 10% выделившейся энергии: испытания показали, что ядра водорода сжимаются недостаточно сильно.
Тогда математик Станислав Улам предложил другой подход — двухступенчатый ядерный запал. Его задумка заключалась в том, чтобы поместить в «водородной» зоне устройства плутониевый стержень. Взрыв первого запала «поджигал» плутоний, две ударные волны и два потока рентгеновских лучей сталкивались — давление и температура подскакивали достаточно, чтобы начался термоядерный синтез. Новое устройство испытали на атолле Эниветок в Тихом океане в 1952 году — взрывная мощность бомбы составила уже десять мегатонн в тротиловом эквиваленте.
Айви Майк — первые атмосферные испытания водородной бомбы, проведенные США на атоллле Эниветок 1 ноября 1952 года. Фото: CTBTOТем не менее и это устройство было непригодно для использования в качестве боевого оружия.
Чтобы ядра водорода сливались, расстояние между ними должно быть минимальным, поэтому дейтерий и тритий охлаждали до жидкого состояния, почти до абсолютного нуля. Для этого требовалась огромная криогенная установка. Второе термоядерное устройство, по сути увеличенная модификация «Джорджа», весило 70 тонн — с самолета такое не сбросишь.
Советский подход
СССР начал разрабатывать термоядерную бомбу позднее: первая схема была предложена советскими разработчиками лишь в 1949 году. В ней предполагалось использовать дейтерид лития. Это металл, твердое вещество, его не надо сжижать, а потому громоздкий холодильник, как в американском варианте, уже не требовался. Не менее важно и то, что литий-6 при бомбардировке нейтронами от взрыва давал гелий и тритий, что еще больше упрощает дальнейшее слияние ядер.
Бомба РДС-6с была готова в 1953 году. В отличие от американских и современных термоядерных устройств плутониевого стержня в ней не было. Такая схема известна как «слойка»: слои дейтерида лития перемежались урановыми. 12 августа РДС-6с испытали на Семипалатинском полигоне.
Мощность взрыва составила 400 килотонн в тротиловом эквиваленте — в 25 раз меньше, чем во второй попытке американцев. Зато РДС-6с можно было сбросить с воздуха. Такую же бомбу собирались использовать и на межконтинентальных баллистических ракетах. А уже в 1955 году СССР усовершенствовал свое термоядерное детище, оснастив его плутониевым стержнем.
Такую же бомбу собирались использовать и на межконтинентальных баллистических ракетах. А уже в 1955 году СССР усовершенствовал свое термоядерное детище, оснастив его плутониевым стержнем.
Сегодня практически все термоядерные устройства — судя по всему, даже северокорейские — представляют собой нечто среднее между ранними советскими и американскими моделями. Все они используют дейтерид лития как топливо и поджигают его двухступенчатым ядерным детонатором.
Как известно из утечек, даже самая современная американская термоядерная боеголовка W88 похожа на РДС-6c: слои дейтерида лития перемежаются ураном.
Разница в том, что современные термоядерные боеприпасы — это не многомегатонные монстры вроде «Царь-бомбы», а системы мощностью в сотни килотонн, как РДС-6с. Мегатонных боеголовок в арсеналах ни у кого нет, так как в военном отношении десяток менее мощных зарядов ценнее одного сильного: это позволяет поразить больше целей.
Техники работают с американской термоядерной боеголовкой W80. Фото: US DOD
Фото: US DODЧего не может термоядерная бомба
Водород — элемент чрезвычайно распространенный, достаточно его и в атмосфере Земли.
Одно время поговаривали, что достаточно мощный термоядерный взрыв может запустить цепную реакцию и весь воздух на нашей планете выгорит. Но это миф.
Не то что газообразный, но и жидкий водород недостаточно плотный, чтобы начался термоядерный синтез. Его нужно сжимать и нагревать ядерным взрывом, желательно c разных сторон, как это делается двухступенчатым запалом. В атмосфере таких условий нет, поэтому самоподдерживающиеся реакции слияния ядер там невозможны.
Это не единственное заблуждение о термоядерном оружии. Часто говорят, что взрыв «чище» ядерного: мол, при слиянии ядер водорода «осколков» — опасных короткоживущих ядер атомов, дающих радиоактивное загрязнение, — получается меньше, чем при делении ядер урана.
Заблуждение это основано на том, что при термоядерном взрыве большая часть энергии якобы выделяется за счет слияния ядер. Это неправда. Да, «Царь-бомба» была такой, но только потому, что ее урановую «рубашку» для испытаний заменили на свинцовую. Современные двухступенчатые запалы приводят к значительному радиоактивному загрязнению.
Это неправда. Да, «Царь-бомба» была такой, но только потому, что ее урановую «рубашку» для испытаний заменили на свинцовую. Современные двухступенчатые запалы приводят к значительному радиоактивному загрязнению.
Правда, зерно истины в мифе о «чистой» бомбе все же есть. Взять лучшую американскую термоядерную боеголовку W88. При ее взрыве на оптимальной высоте над городом площадь сильных разрушений практически совпадет с зоной радиоактивного поражения, опасного для жизни. Погибших от лучевой болезни будет исчезающе мало: люди погибнут от самого взрыва, а не радиации.
Еще один миф гласит, что термоядерное оружие способно уничтожить всю человеческую цивилизацию, а то и жизнь на Земле. Это тоже практически исключено. Энергия взрыва распределена в трех измерениях, поэтому при росте мощности боеприпаса в тысячу раз радиус поражающего действия растет всего в десять раз — мегатонная боеголовка имеет радиус поражения всего в десять раз больше, чем тактическая, килотонная.
66 миллионов лет назад столкновение с астероидом привело к исчезновению большинства наземных животных и растений. Мощность удара составила около 100 млн мегатонн — это в 10 тыс. раз больше суммарной мощности всех термоядерных арсеналов Земли. 790 тыс. лет назад с планетой столкнулся астероид, удар был мощностью в миллион мегатонн, но никаких следов хотя бы умеренного вымирания (включая наш род Homo) после этого не случилось. И жизнь в целом, и человек куда крепче, чем они кажутся.
Правда о термоядерном оружии не так популярна, как мифы. На сегодня она такова: термоядерные арсеналы компактных боеголовок средней мощности обеспечивают хрупкий стратегический баланс, из-за которого никто не может свободно утюжить другие страны мира атомным оружием. Боязнь термоядерного ответа — более чем достаточный сдерживающий фактор.
Александр Березин
32.1: Радиоактивные изотопы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 364128
- Дэвид Харви
- Университет ДеПау 9A E\), где E — атомный символ элемента, Z — атомный номер элемента, а A — атомный массовый номер элемента.

Типы частиц радиоактивного распада
Наиболее важными типами радиоактивных частиц являются альфа-частицы, бета-частицы, гамма-лучи и рентгеновские лучи. Альфа-частица \(\alpha\) эквивалентна ядру гелия \({}_2^4 \text{He}\).
 Когда атом испускает альфа-частицу, продуктом является новый атом, чей атомный номер и атомная масса соответственно на 2 и 4 меньше, чем у его нестабильного родителя. Распад урана на торий является одним из примеров альфа-излучения. 9{0} \beta \nonumber \]
Когда атом испускает альфа-частицу, продуктом является новый атом, чей атомный номер и атомная масса соответственно на 2 и 4 меньше, чем у его нестабильного родителя. Распад урана на торий является одним из примеров альфа-излучения. 9{0} \beta \nonumber \]Негатрон, наиболее распространенный тип бета-частицы, эквивалентен электрону.
Испускание альфа- или бета-частицы часто приводит к образованию изотопа в нестабильном высокоэнергетическом состоянии. Эта избыточная энергия высвобождается в виде гамма-излучения \(\gamma\) или рентгеновского излучения. Гамма-излучение и рентгеновское излучение также могут происходить без высвобождения альфа- или бета-частиц.
Скорость радиоактивного распада
Скорость распада или активность радиоактивного изотопа следует кинетике первого порядка 9{-\lambda t} \label{13.3} \]
Если мы измерим активность образца в момент времени t , мы сможем определить начальную активность образца, A 0 , или количество радиоактивных атомов, первоначально присутствующих в образец, N 0 .

Важным характерным свойством радиоактивного изотопа является его период полураспада, t 1/2 , который представляет собой время, необходимое для распада половины радиоактивных атомов. Для кинетики первого порядка период полураспада составляет
\[t_{1 / 2}=\frac{0,693}{\lambda} \label{13,4} \]
Поскольку период полураспада не зависит от количества радиоактивных атомов, он остается постоянным на протяжении всего процесса распада . Например, если после одного периода полураспада остается 50 % радиоактивных атомов, то после двух периодов полураспада остается 25 %, а после трех периодов полураспада остается 12,5 %.
Предположим, мы начинаем с N 0 из 1200 атомов В течение первого периода полураспада 600 атомов распадаются и 600 остаются. Во время второго периода полураспада 300 из 600 оставшихся атомов распадаются, оставляя 300 атомов или 25% исходных 1200 атомов. Из оставшихся 300 атомов после третьего периода полураспада остается только 150, или 12,5% от первоначальных 1200 атомов.
 9{90}\text{Sr}\) в образце остается практически постоянным в течение короткого периода времени.
9{90}\text{Sr}\) в образце остается практически постоянным в течение короткого периода времени.Статистика подсчета
Радиоактивность не подчиняется нормальному распределению, поскольку возможные результаты не являются непрерывными; то есть образец может излучать 1, 2 или 3 альфа-частицы (или какое-либо другое целое число) в фиксированном интервале, но он не может излучать 2,59 альфа-частиц в течение того же интервала. Распределение Пуассона обеспечивает вероятность того, что заданное количество событий произойдет в фиксированный интервал времени или пространства, если событие имеет известную среднюю скорость и если каждое новое событие не зависит от предыдущего события. Математически распределение Пуассона определяется уравнением 92\), каждый из которых равен \(\lambda\).
Примечание
Более подробное обсуждение распределения данных, включая нормальное распределение и распределение Пуассона, см. в Приложении 1.
Точность и прецизионность радиохимических методов обычно находится в пределах 1–5%.
 Мы можем повысить точность — которая ограничена случайным характером радиоактивного распада — путем подсчета испускания радиоактивных частиц за столько времени, сколько это практически возможно. Если количество отсчетов, M , достаточно велико ( M ≥ 100), а период счета значительно меньше, чем период полураспада изотопа, тогда относительное стандартное отклонение активности в процентах \((\sigma_A)_{rel}\ ), составляет примерно
Мы можем повысить точность — которая ограничена случайным характером радиоактивного распада — путем подсчета испускания радиоактивных частиц за столько времени, сколько это практически возможно. Если количество отсчетов, M , достаточно велико ( M ≥ 100), а период счета значительно меньше, чем период полураспада изотопа, тогда относительное стандартное отклонение активности в процентах \((\sigma_A)_{rel}\ ), составляет примерно\[\left(\sigma_{A}\right)_{\mathrm{rel}}=\frac{1}{\sqrt{M}} \times 100 \nonumber \]
Для Например, если мы определяем активность, подсчитывая 10 000 радиоактивных частиц, то относительное стандартное отклонение составляет 1%. Чувствительность радиохимического метода обратно пропорциональна \((\sigma_A)_{rel}\), что означает, что мы можем улучшить чувствительность, подсчитывая больше частиц. 9{90}\text{Sr} \nonumber \]
Прямой анализ короткоживущего радиоактивного изотопа с использованием метода, описанного в примере 32.
 {14}\text{C}\) мигрирует в нижние слои атмосферы, где окисляется с образованием C-14, помеченного как CO 9.{14}\text{C}\) во время испытаний ядерного оружия. Калибровочная кривая, построенная с использованием образцов известного возраста — примеры образцов включают годичные кольца деревьев, глубоководные отложения океана, образцы кораллов и пещерные отложения — ограничивает этот источник неопределенности.
{14}\text{C}\) мигрирует в нижние слои атмосферы, где окисляется с образованием C-14, помеченного как CO 9.{14}\text{C}\) во время испытаний ядерного оружия. Калибровочная кривая, построенная с использованием образцов известного возраста — примеры образцов включают годичные кольца деревьев, глубоководные отложения океана, образцы кораллов и пещерные отложения — ограничивает этот источник неопределенности.Нет необходимости готовить калибровочную кривую для каждого анализа. Вместо этого существует универсальная калибровочная кривая, известная как IntCal. Калибровочная кривая IntCal13 от 2013 года описана в следующей статье: Reimer, P.J., et. др. «Калибровочная кривая радиоуглеродного возраста IntCal13 и Marine 13 0–50 000 лет кал. лет назад», 9{210}\text{Pb}\), который присутствует.
Эта страница под названием 32.1: Радиоактивные изотопы распространяется в соответствии с лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Дэвид Харви.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Дэвид Харви
- Тип страницы
- Аналитическая химия
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- радиоактивный распад
- Радиоактивные изотопы
DOE объясняет.
 .. Изотопы | Департамент энергетики
.. Изотопы | Департамент энергетикиУправление Наука
Водород и два его природных изотопа, дейтерий и тритий. Все три имеют одинаковое количество протонов (обозначено p+), но разное количество нейтронов (обозначено n).
Изображение предоставлено Викискладом
Семья людей часто состоит из связанных, но не идентичных лиц. Элементы также имеют семейства, известные как изотопы. Изотопы являются членами семейства элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов.
Количество протонов в ядре определяет атомный номер элемента в периодической таблице. Например, углерод имеет шесть протонов и атомный номер 6. Углерод встречается в природе в трех изотопах: углерод 12, который имеет 6 нейтронов (плюс 6 протонов равняется 12), углерод 13, который имеет 7 нейтронов, и углерод 14, который имеет 8 нейтронов. нейтроны. Каждый элемент имеет свое количество изотопов.
Добавление даже одного нейтрона может кардинально изменить свойства изотопа.
 Углерод-12 стабилен, то есть никогда не подвергается радиоактивному распаду. Углерод-14 нестабилен и подвергается радиоактивному распаду с периодом полураспада около 5730 лет (это означает, что половина материала исчезнет через 5730 лет). Этот распад означает, что количество углерода-14 в объекте служит часами, показывающими возраст объекта в процессе, называемом «углеродное датирование».
Углерод-12 стабилен, то есть никогда не подвергается радиоактивному распаду. Углерод-14 нестабилен и подвергается радиоактивному распаду с периодом полураспада около 5730 лет (это означает, что половина материала исчезнет через 5730 лет). Этот распад означает, что количество углерода-14 в объекте служит часами, показывающими возраст объекта в процессе, называемом «углеродное датирование».Изотопы обладают уникальными свойствами, и эти свойства делают их полезными в диагностике и лечении. Они важны в ядерной медицине, разведке нефти и газа, фундаментальных исследованиях и национальной безопасности.
Управление науки и изотопов Министерства энергетики США
Изотопы необходимы для исследований, торговли, медицинской диагностики и лечения, а также для обеспечения национальной безопасности. Однако изотопы не всегда доступны в достаточном количестве или по разумным ценам. Программа Министерства энергетики США по изотопам направлена на удовлетворение этой потребности.
 В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.
В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.Факты об изотопах
- У всех элементов есть изотопы.
- Существует два основных типа изотопов: стабильные и нестабильные (радиоактивные).
- Известно 254 стабильных изотопа.
- Все искусственные (лабораторные) изотопы нестабильны и поэтому радиоактивны; ученые называют их радиоизотопами.
- Некоторые элементы могут существовать только в нестабильной форме (например, уран).
- Водород — единственный элемент, изотопы которого имеют уникальные названия: дейтерий для водорода с одним нейтроном и тритий для водорода с двумя нейтронами.



 Когда атом испускает альфа-частицу, продуктом является новый атом, чей атомный номер и атомная масса соответственно на 2 и 4 меньше, чем у его нестабильного родителя. Распад урана на торий является одним из примеров альфа-излучения. 9{0} \beta \nonumber \]
Когда атом испускает альфа-частицу, продуктом является новый атом, чей атомный номер и атомная масса соответственно на 2 и 4 меньше, чем у его нестабильного родителя. Распад урана на торий является одним из примеров альфа-излучения. 9{0} \beta \nonumber \]
 9{90}\text{Sr}\) в образце остается практически постоянным в течение короткого периода времени.
9{90}\text{Sr}\) в образце остается практически постоянным в течение короткого периода времени. Мы можем повысить точность — которая ограничена случайным характером радиоактивного распада — путем подсчета испускания радиоактивных частиц за столько времени, сколько это практически возможно. Если количество отсчетов, M , достаточно велико ( M ≥ 100), а период счета значительно меньше, чем период полураспада изотопа, тогда относительное стандартное отклонение активности в процентах \((\sigma_A)_{rel}\ ), составляет примерно
Мы можем повысить точность — которая ограничена случайным характером радиоактивного распада — путем подсчета испускания радиоактивных частиц за столько времени, сколько это практически возможно. Если количество отсчетов, M , достаточно велико ( M ≥ 100), а период счета значительно меньше, чем период полураспада изотопа, тогда относительное стандартное отклонение активности в процентах \((\sigma_A)_{rel}\ ), составляет примерно {14}\text{C}\) мигрирует в нижние слои атмосферы, где окисляется с образованием C-14, помеченного как CO 9.{14}\text{C}\) во время испытаний ядерного оружия. Калибровочная кривая, построенная с использованием образцов известного возраста — примеры образцов включают годичные кольца деревьев, глубоководные отложения океана, образцы кораллов и пещерные отложения — ограничивает этот источник неопределенности.
{14}\text{C}\) мигрирует в нижние слои атмосферы, где окисляется с образованием C-14, помеченного как CO 9.{14}\text{C}\) во время испытаний ядерного оружия. Калибровочная кривая, построенная с использованием образцов известного возраста — примеры образцов включают годичные кольца деревьев, глубоководные отложения океана, образцы кораллов и пещерные отложения — ограничивает этот источник неопределенности.
 .. Изотопы | Департамент энергетики
.. Изотопы | Департамент энергетики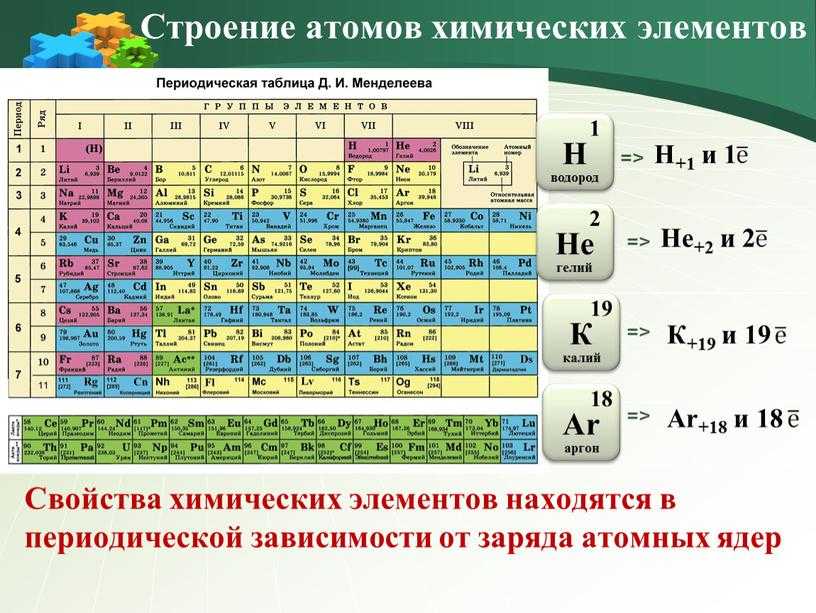 Углерод-12 стабилен, то есть никогда не подвергается радиоактивному распаду. Углерод-14 нестабилен и подвергается радиоактивному распаду с периодом полураспада около 5730 лет (это означает, что половина материала исчезнет через 5730 лет). Этот распад означает, что количество углерода-14 в объекте служит часами, показывающими возраст объекта в процессе, называемом «углеродное датирование».
Углерод-12 стабилен, то есть никогда не подвергается радиоактивному распаду. Углерод-14 нестабилен и подвергается радиоактивному распаду с периодом полураспада около 5730 лет (это означает, что половина материала исчезнет через 5730 лет). Этот распад означает, что количество углерода-14 в объекте служит часами, показывающими возраст объекта в процессе, называемом «углеродное датирование». В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.
В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.
Leave A Comment