Суммативное оценивание за раздел 8.3А «Периодическая система химических элементов» — Республикалық білім порталы
Каратаева Г.Т.
| Суммативное оценивание за раздел 8.3А «Периодическая система химических элементов» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цель обучения | 8.2.1.1 -объяснять физический смысл атомного номера, группы, периода 8.2.1.2 -понимать, что элементы одной группы содержат на внешнем уровне одинаковое количество электронов 8.2.1.3 -объяснять закономерности изменения свойств элементов в группах и периодах 8.2.1.4 -характеризовать химический элемент по положению в периодической системе 8.2.1.6 -знать естественные семейства химических элементов и приводить примеры щелочных металлов, галогенов, инертных газов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критерии оценивания | -определяет физический смысл атомного номера, номера группы, номера периода. -определяет элементы с одинаковым числом электронов на внешнем электронном слое -объясняет закономерности изменения свойств элементов в группах и периодах. -характеризует химический элемент по положению в периодической системе. -приводит примеры щелочных металлов, галогенов, инертных газов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Уровень мыслительных навыков | Знание и понимание, применение. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Время выполнения | 25 мин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Задания 1.Определите истинность утверждений
2.
A) Из данного списка элементов, выберите элементы с одинаковым числом электронов на внешнем электронном слое-Na,F,Ca, Mg, Cl, Al.S,I, Be, Fe, Br, Hg, Au.At
____________________________________________________________________
Б)Из данных элементов выберите элементы, находящиеся в одном периоде и охарактеризуйте изменение их свойств с возрастанием заряда атомного ядра.
____________________________________________________________________
____________________________________________________________________
В)Из данных элементов выберите элементы находящиеся в одной группе и охарактеризуйте изменение их свойств с возрастанием заряда атомного ядра.
_____________________________________________________________________
_____________________________________________________________________
3.Пользуясь периодической системой химических элементов:
А) Заполните таблицу для следующих элементов № 7,8,14,16,19
В) Дайте характеристику элементу №16 _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________
4. А) Образуемые ими простые вещества – летучие вещества, которые растворяясь в воде образуют кислоты. ______________________________________________________________________________
Б) Образуемые ими простые вещества имеют малую плотность,пластичны, легкоплавки,горючи и энергично взаимодействуют с водой. _________________________________________________________________________
______________________________________________________________________________ В) Молекулы простых веществ состоят из одного атома, они малоактивны и практически ни с чем не реагируют.
__________________________________________________________________________
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Этот химический элемент преимущественно концентрируется в ногтях. Определите положение этого элемента в периодической системе элементов (период, группа, подгруппа) по электронной формуле:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 .
(Ответ: ванадий).
- Розовые лепестки роз при избытке этого элемента становятся голубыми и даже черными. Определите положение этого элемента в периодической системе элементов (период, группа, подгруппа) по электронной формуле:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
8.3А «Периодическая система химических элементов» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цель обучения | 8.2.1.1 -объяснять физический смысл атомного номера, группы, периода 8.2.1.2 -понимать, что элементы одной группы содержат на внешнем уровне одинаковое количество электронов 8.2.1.3 -объяснять закономерности изменения свойств элементов в группах и периодах 8. 8.2.1.6 -знать естественные семейства химических элементов и приводить примеры щелочных металлов, галогенов, инертных газов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критерии оценивания | -определяет физический смысл атомного номера, номера группы, номера периода. -определяет элементы с одинаковым числом электронов на внешнем электронном слое -объясняет закономерности изменения свойств элементов в группах и периодах. -характеризует химический элемент по положению в периодической системе. -приводит примеры щелочных металлов, галогенов, инертных газов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Уровень мыслительных навыков | Знание и понимание, применение. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Время выполнения | 25 мин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Задания 1.Определите истинность утверждений
2. Используя периодическую систему химических элементов:
A) Из данного списка элементов, выберите элементы с одинаковым числом электронов на внешнем электронном слое-Na,F,Ca, Mg, Cl, Al.S,I, Be, Fe, Br, Hg, Au.At
____________________________________________________________________
Б)Из данных элементов выберите элементы, находящиеся в одном периоде и охарактеризуйте изменение их свойств с возрастанием заряда атомного ядра.
____________________________________________________________________
____________________________________________________________________
В)Из данных элементов выберите элементы находящиеся в одной группе и охарактеризуйте изменение их свойств с возрастанием заряда атомного ядра.
_____________________________________________________________________
_____________________________________________________________________
3.Пользуясь периодической системой химических элементов:
А) Заполните таблицу для следующих элементов № 7,8,14,16,19
В) Дайте характеристику элементу №16 _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________
4. А) Образуемые ими простые вещества – летучие вещества, которые растворяясь в воде образуют кислоты. ______________________________________________________________________________
Б) Образуемые ими простые вещества имеют малую плотность,пластичны, легкоплавки,горючи и энергично взаимодействуют с водой. _________________________________________________________________________
______________________________________________________________________________ В) Молекулы простых веществ состоят из одного атома, они малоактивны и практически ни с чем не реагируют.
__________________________________________________________________________
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Этот химический элемент преимущественно концентрируется в ногтях. Определите положение этого элемента в периодической системе элементов (период, группа, подгруппа) по электронной формуле:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 .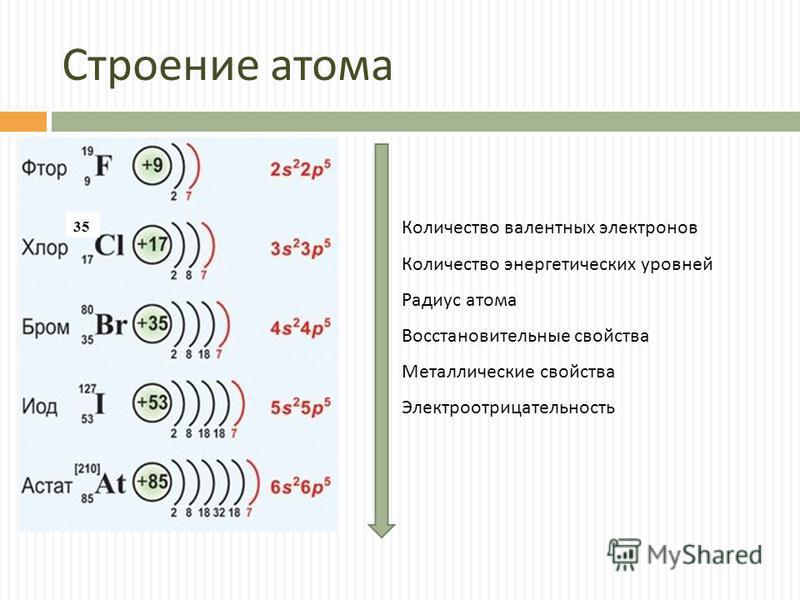
(Ответ: ванадий).
- Розовые лепестки роз при избытке этого элемента становятся голубыми и даже черными. Определите положение этого элемента в периодической системе элементов (период, группа, подгруппа) по электронной формуле:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
Презентация к уроку химии в 8 классе «Изменение числа электронов на внешнем энергетическом уровне» | Презентация к уроку по химии (8 класс) на тему:
Опубликовано 03.02.2016 — 21:41 — Вакенгут Ирина Эгоновна
Восьмой урок химии в 8 классе по учебнику О. С. Габриеляна, Знания и умения по стандарту. Физический смысл порядкового номера элемента, номера группы, номера периода. Причины изменения свойств химических элементов в периодах и группах.
С. Габриеляна, Знания и умения по стандарту. Физический смысл порядкового номера элемента, номера группы, номера периода. Причины изменения свойств химических элементов в периодах и группах.
Скачать:
Предварительный просмотр:
Подписи к слайдам:
Слайд 1
Изменение числа электронов на внешнем энергетическом уровне атомов 8 класс Тюменская область, Ханты-Мансийский автономный округ – Югра , г. Когалым , МАОУ СОШ № 7 Разработала учитель химии высшей квалификационной категории Вакенгут И.Э.
Слайд 2
1 H +1 1e — Строение электронных оболочек атомов 2 He +2 2e — 3 Li +3 2 e — 1 e — 4 Be +4 2 e — 2e — 5 B +5 2 e — 3e — 6 C +6 2 e — 4e — 7 N +7 2 e — 5e — 9 F +9 2 e — 7e — 8 O +8 2 e — 6e — 11 Na +11 2 e — 8e — 1e — 10 Ne +10 2 e — 8e — 12 Mg +12 2 e — 8e — 2e — 13 Al +13 2 e — 8e — 3e — 14 Si +14 2 e — 8e — 4e — 15 P +15 2 e — 8e — 5e — 16 S +16 2 e — 8e — 6e — 17 Cl +17 2 e — 8e — 7e — 18 Ar +18 2 e — 8e — 8e —
Слайд 3
Строение электронных оболочек атомов Электроны в атомах располагаются на энергетических уровнях . 2. На первом энергетическом уровне могут находиться только 2 электрона, на втором – 8 . Такие уровни называются завершенными . 3. Число заполняемых энергетических уровней равно номеру периода , в котором находится элемент. 4. Число электронов на внешнем уровне атома химического элемента равно номеру его группы (для элементов главных подгрупп). 5. Свойства химических элементов периодически повторяются , так как повторяется строение внешних энергетических уровней у их атомов.
2. На первом энергетическом уровне могут находиться только 2 электрона, на втором – 8 . Такие уровни называются завершенными . 3. Число заполняемых энергетических уровней равно номеру периода , в котором находится элемент. 4. Число электронов на внешнем уровне атома химического элемента равно номеру его группы (для элементов главных подгрупп). 5. Свойства химических элементов периодически повторяются , так как повторяется строение внешних энергетических уровней у их атомов.
Слайд 4
Заполняется: 2-й энергетический уровень 3-й энергетический уровень 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl Периодическое изменение свойств элементов Свойства: (слева направо по периоду) Заряды ядер увеличиваются Число электронов на внешнем уровне увеличивается Число заполняемых энергетических уровней постоянно Радиусы атомов уменьшаются Свойства: (сверху вниз по главной подгруппе) Заряды ядер атомов увеличиваются Число электронов на внешнем уровне постоянно Число заполняемых энергетических у уровней увеличивается Радиус атома увеличивается I II III IV V VI VII
Слайд 5
2 8 1 + 2 8 7 2 8 2 8 8 ион ион атом атом Ионная связь образуется между ионами и осуществляется электростатическим притяжением [Na + ][ Cl — ]
Слайд 6
Установите соответствие Строение атома Положение химического элемента в периодической системе 1.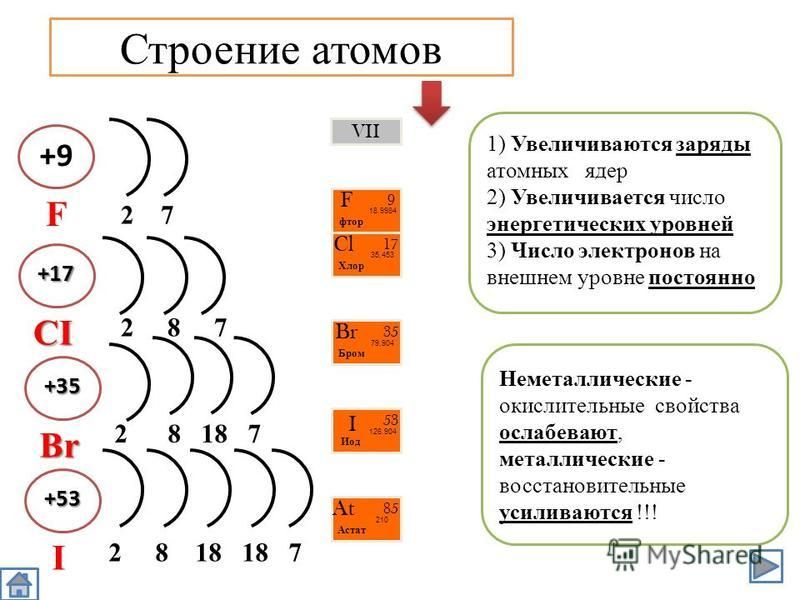 Заряд ядра атома 2. Общее число электронов в атоме 3. Число протонов в ядре атома 4. Число электронов на внешнем электронном уровне 5. Число энергетических уровней (электронных оболочек) Б) Номер периода А) Порядковый номер элемента В) Номер группы
Заряд ядра атома 2. Общее число электронов в атоме 3. Число протонов в ядре атома 4. Число электронов на внешнем электронном уровне 5. Число энергетических уровней (электронных оболочек) Б) Номер периода А) Порядковый номер элемента В) Номер группы
По теме: методические разработки, презентации и конспекты
Презентация к урокам математики «Решение задач. Сумма углов треугольника. Внешний угол треугольника.» 7 класс.
Данная разработка содержит 24 задачи по темам: «Внешний угол треугольника», «Сумма углов треугольника». В презентации представлены задачи с подсказками для правильного решения — 6 задач; задачи для ре…
Электронная презентация к уроку химии в 8 классе по теме: «Вода — растворитель. Растворы»
Электронная презентация может быть использована при проведении уроков химии в 8 классе по всем рекомендованным на сегодняшний день авторским линиям учебников. Гиперссылки данной презентации позв…
Электронная презентация к уроку химии в 10 классе: «Получение спиртов.
 Применение»
Применение»Данная электронная презентация позволяет наглядно представить последствия употребления алкогольных напитков, расширяет знания о направлениях применения спиртов, их общих и специфических способах получ…
Презентация к уроку по теме «Натуральные числа. Числа великаны»
Предлагаемый материал расширяет понятие о натуральных числах, выводит ученика за рамки школьного учебника…
Пезентация к уроку «Изменение числа электронов на внешнем энергетическом уровне. Ионная связь» 8 класс
Презентация является сопровождением рассказа учителя по теме «Химическая связь»…
Урок химии 9 класс «Строение электронных оболочек атомов химических элементов №1-20»
Цели урока:-сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;- рассмотреть электронное строение атомов элементов первых трех периодов….
Презентация к уроку химии в 11 классе по теме «Геометрия молекул. Гибридизация электронных орбиталей»
. ..
..
Поделиться:
Химическое соединение | Биология для неспециалистов I
Результаты обучения
- Дайте определение правилу октета и его роли в химических связях
Не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, но атом наиболее стабилен, когда все электронные позиции в самой внешней оболочке заполнены . Из-за этих вакансий в самых внешних оболочках мы наблюдаем образование химических связей или взаимодействий между двумя или более одинаковыми или разными элементами, что приводит к образованию молекул. Для достижения большей стабильности атомы стремятся полностью заполнить свои внешние оболочки и для достижения этой цели будут связываться с другими элементами, делясь электронами, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку самые внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется 9.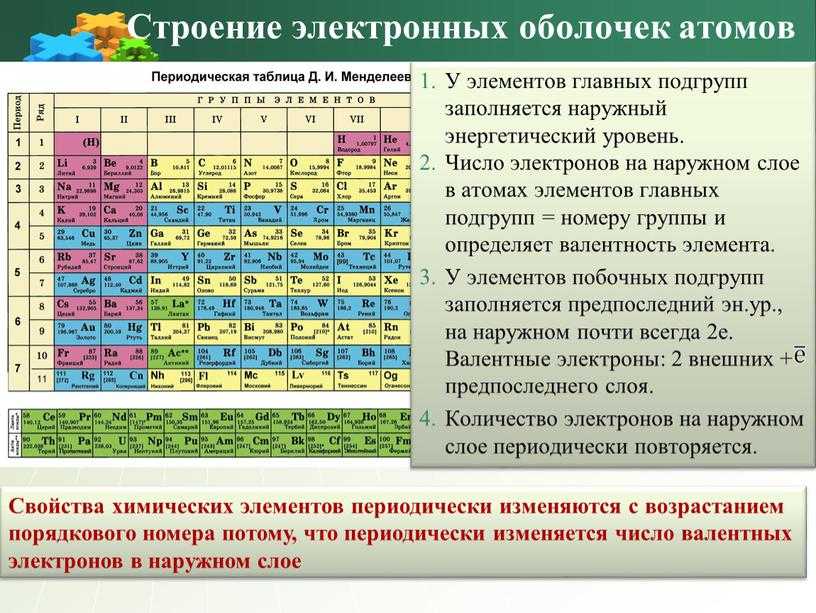 0011 правило октета . Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
0011 правило октета . Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Ранняя модель атома была разработана в 1913 году датским ученым Нильсом Бором (1885–1962). Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны, с электронами в круглых электронных оболочках на определенных расстояниях от ядра, подобно планетам, вращающимся вокруг Солнца. Каждая электронная оболочка имеет различный энергетический уровень, при этом те оболочки, которые находятся ближе всего к ядру, имеют меньшую энергию, чем те, которые находятся дальше от ядра. По соглашению каждой оболочке присваивается номер и символ n — например, ближайшая к ядру электронная оболочка называется 1n. Чтобы перемещаться между оболочками, электрон должен поглотить или выделить количество энергии, точно соответствующее разнице энергий между оболочками. Например, если электрон поглощает энергию фотона, он может возбудиться и перейти на более высокоэнергетическую оболочку; и наоборот, когда возбужденный электрон падает обратно на более низкоэнергетическую оболочку, он высвобождает энергию, часто в виде тепла.
Боровская модель атома, показывающая энергетические уровни в виде концентрических окружностей, окружающих ядро. Энергия должна быть добавлена, чтобы переместить электрон наружу на более высокий энергетический уровень, и энергия высвобождается, когда электрон падает с более высокого энергетического уровня на более близкий. Изображение предоставлено: изменено из OpenStax Biology
Атомы, как и другие объекты, управляемые законами физики, имеют тенденцию принимать самую низкоэнергетическую и наиболее стабильную конфигурацию, которую они могут. Таким образом, электронные оболочки атома заполняются изнутри наружу, при этом электроны заполняют низкоэнергетические оболочки ближе к ядру, прежде чем они переместятся в оболочки с более высокой энергией дальше. Ближайшая к ядру оболочка, 1n, может содержать два электрона, тогда как следующая оболочка, 2n, может содержать восемь, а третья оболочка, 3n, может содержать до восемнадцати.
Количество электронов на внешней оболочке конкретного атома определяет его реакционную способность или склонность к образованию химических связей с другими атомами.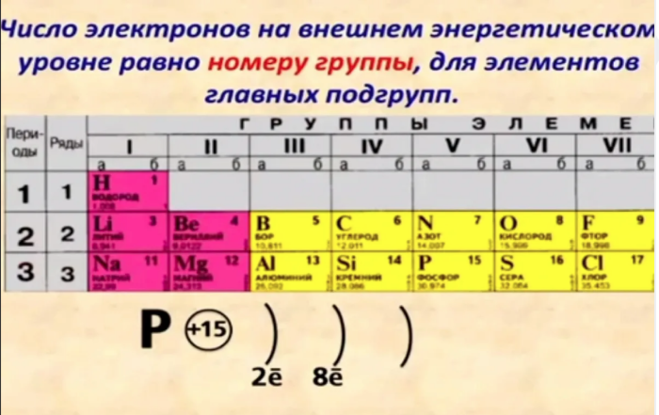 Эта самая внешняя оболочка известна как валентная оболочка , а электроны, находящиеся в ней, называются валентными электронами . В общем, атомы наиболее стабильны, наименее реакционноспособны, когда их самая внешняя электронная оболочка заполнена. Большинству элементов, важных для биологии, требуется восемь электронов на внешней оболочке, чтобы быть стабильными, и это эмпирическое правило известно как 9.0027 правило октета . Некоторые атомы могут быть стабильными с октетом, даже если их валентная оболочка представляет собой 3n-оболочку, которая может содержать до 18 электронов. Мы рассмотрим причину этого, когда будем обсуждать электронные орбитали ниже.
Эта самая внешняя оболочка известна как валентная оболочка , а электроны, находящиеся в ней, называются валентными электронами . В общем, атомы наиболее стабильны, наименее реакционноспособны, когда их самая внешняя электронная оболочка заполнена. Большинству элементов, важных для биологии, требуется восемь электронов на внешней оболочке, чтобы быть стабильными, и это эмпирическое правило известно как 9.0027 правило октета . Некоторые атомы могут быть стабильными с октетом, даже если их валентная оболочка представляет собой 3n-оболочку, которая может содержать до 18 электронов. Мы рассмотрим причину этого, когда будем обсуждать электронные орбитали ниже.
Примеры некоторых нейтральных атомов и их электронных конфигураций показаны ниже. В этой таблице вы можете видеть, что гелий имеет полную валентную оболочку с двумя электронами в его первой и единственной, 1n, оболочке. Точно так же неон имеет полную внешнюю оболочку 2n, содержащую восемь электронов.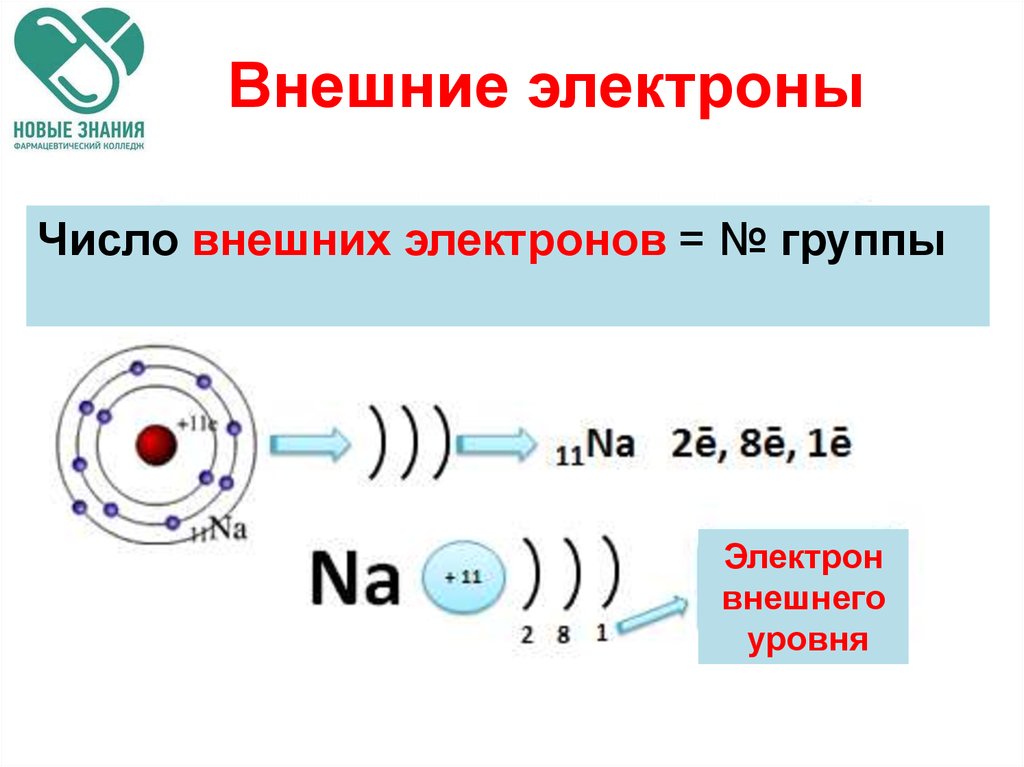 Эти электронные конфигурации делают гелий и неон очень стабильными. Хотя аргон технически не имеет полной внешней оболочки, поскольку 3n-оболочка может содержать до восемнадцати электронов, он стабилен, как неон и гелий, поскольку имеет восемь электронов в 3n-оболочке и, таким образом, удовлетворяет правилу октетов. Напротив, у хлора только семь электронов на внешней оболочке, а у натрия всего один. Эти паттерны не заполняют самую внешнюю оболочку и не удовлетворяют правилу октета, делая хлор и натрий реактивными, стремящимися получить или потерять электроны, чтобы достичь более стабильной конфигурации.
Эти электронные конфигурации делают гелий и неон очень стабильными. Хотя аргон технически не имеет полной внешней оболочки, поскольку 3n-оболочка может содержать до восемнадцати электронов, он стабилен, как неон и гелий, поскольку имеет восемь электронов в 3n-оболочке и, таким образом, удовлетворяет правилу октетов. Напротив, у хлора только семь электронов на внешней оболочке, а у натрия всего один. Эти паттерны не заполняют самую внешнюю оболочку и не удовлетворяют правилу октета, делая хлор и натрий реактивными, стремящимися получить или потерять электроны, чтобы достичь более стабильной конфигурации.
Диаграммы Бора показывают, сколько электронов заполняет каждую основную оболочку. Элементы группы 18 (гелий, неон и аргон) имеют полную внешнюю, или валентную, оболочку. Полная валентная оболочка является наиболее стабильной электронной конфигурацией. Элементы других групп имеют частично заполненные валентные оболочки и приобретают или теряют электроны для достижения стабильной электронной конфигурации.
Электронные конфигурации и периодическая таблица
Элементы расположены в периодической таблице по порядку в зависимости от их атомного номера и количества протонов. В нейтральном атоме количество электронов будет равно количеству протонов, поэтому мы можем легко определить число электронов по атомному номеру. Кроме того, положение элемента в периодической таблице — его столбец или группа, строка или период — дает полезную информацию о том, как устроены эти электроны.
Если мы рассмотрим только первые три строки таблицы, которые включают основные элементы, важные для жизни, то каждая строка соответствует заполнению различных электронных оболочек: гелий и водород размещают свои электроны в 1n-оболочке, а вторая строка такие элементы, как Li, начинают заполнять оболочку 2n, а элементы третьего ряда, такие как Na, продолжают заполнять оболочку 3n. Точно так же номер столбца элемента дает информацию о количестве его валентных электронов и реакционной способности.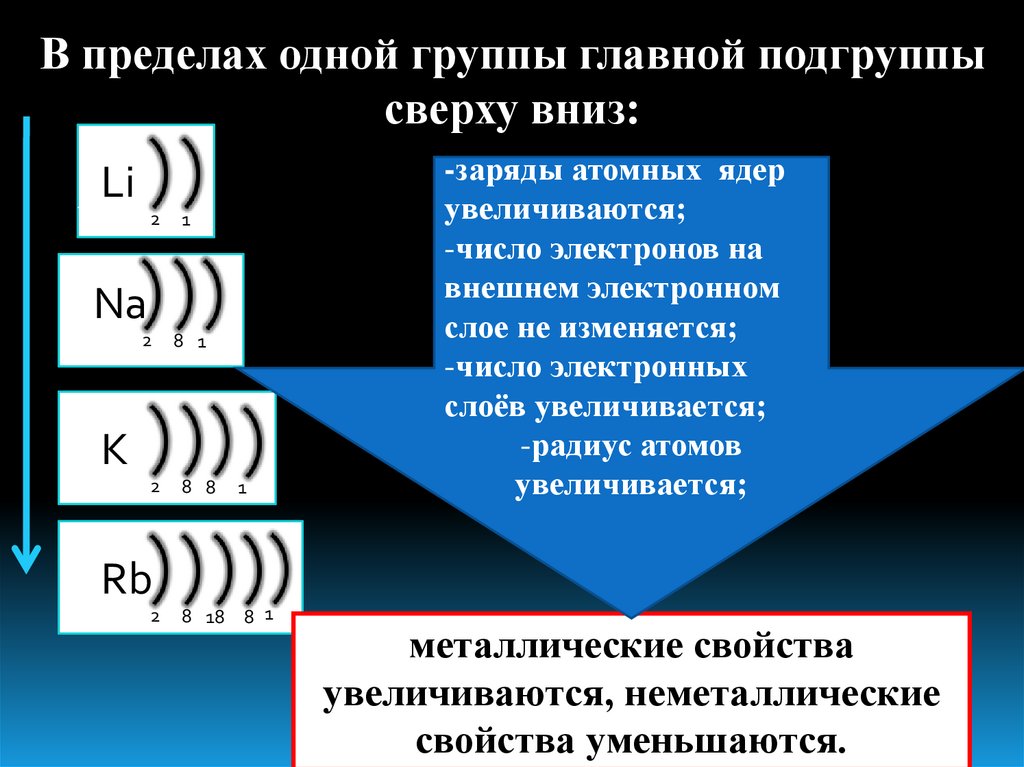 В целом число валентных электронов одинаково в столбце и увеличивается слева направо в ряду. Элементы группы 1 имеют только один валентный электрон, а элементы группы 18 — восемь, за исключением гелия, у которого всего два электрона. Таким образом, номер группы является хорошим показателем того, насколько реактивным будет каждый элемент:
В целом число валентных электронов одинаково в столбце и увеличивается слева направо в ряду. Элементы группы 1 имеют только один валентный электрон, а элементы группы 18 — восемь, за исключением гелия, у которого всего два электрона. Таким образом, номер группы является хорошим показателем того, насколько реактивным будет каждый элемент:
- Гелий (He), неон (Ne) и аргон (Ar), как элементы группы 18, имеют внешние электронные оболочки, которые заполнены или удовлетворяют правилу октета. Это делает их очень стабильными как отдельные атомы. Из-за своей нереакционноспособности их называют инертными газами или инертными газами .
- Водород (H), литий (Li) и натрий (Na), как элементы группы 1, имеют только один электрон на своих внешних оболочках. Они нестабильны как отдельные атомы, но могут стать стабильными, потеряв или разделив свой один валентный электрон.
 Если эти элементы полностью теряют электрон — как это обычно делают Li и Na — они становятся положительно заряженными ионами: Li + , Na + .
Если эти элементы полностью теряют электрон — как это обычно делают Li и Na — они становятся положительно заряженными ионами: Li + , Na + . - Фтор (F) и хлор (Cl), как элементы группы 17, имеют семь электронов на своих внешних оболочках. Они имеют тенденцию достигать стабильного октета, забирая электрон у других атомов, становясь отрицательно заряженными ионами: F — и Cl — .
- Углерод (C), как элемент группы 14, имеет четыре электрона на внешней оболочке. Углерод обычно делит электроны для достижения полной валентной оболочки, образуя связи с несколькими другими атомами.
Таким образом, столбцы периодической таблицы отражают количество электронов, находящихся в валентной оболочке каждого элемента, что, в свою очередь, определяет реакцию элемента.
Попробуйте
Внесите свой вклад!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
2.5: Атомы, изотопы, ионы и молекулы – электронные оболочки и модель Бора
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12660
- Boundless (теперь LumenLearning)
- Boundless 900 07
- Построить атом по модели Бора
- В модели атома Бора ядро содержит большую часть массы атома в виде протонов и нейтронов.
- Вокруг положительно заряженного ядра вращаются отрицательно заряженные электроны, которые вносят небольшой вклад с точки зрения массы, но электрически эквивалентны протонам в ядре.
- В большинстве случаев электроны сначала заполняют орбитали с более низкой энергией, затем следующую орбиталь с более высокой энергией, пока она не заполнится, и так далее, пока не будут размещены все электроны.
- Атомы, как правило, наиболее стабильны с полной внешней оболочкой (та, которая после первой содержит 8 электронов), что приводит к тому, что обычно называют «правилом октета».

- Свойства элемента определяются его самыми внешними электронами или электронами на орбите с самой высокой энергией.
- Атомы, которые не имеют полных внешних оболочек, будут иметь тенденцию приобретать или терять электроны, что приводит к полной внешней оболочке и, следовательно, стабильности.
- Правило октета : Правило, утверждающее, что атомы теряют, приобретают или делят электроны, чтобы иметь полную валентную оболочку из 8 электронов. (Водород исключен, поскольку он может удерживать максимум 2 электрона на своей валентной оболочке.)
- электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одно и то же главное квантовое число (представленное как орбита, по которой движутся электроны).
Цели обучения
Электронные оболочки и модель Бора
Рисунок \(\PageIndex{1}\): Орбитали в модели Бора: Модель Бора была разработана Нильсом Бором в 1913 году. В этой модели электроны существуют внутри основных оболочек. Электрон обычно существует в самой низкой доступной энергетической оболочке, которая находится ближе всего к ядру. Энергия фотона света может поднять его на более высокую энергетическую оболочку, но эта ситуация нестабильна, и электрон быстро распадается обратно в основное состояние. При этом высвобождается фотон света.
Энергия фотона света может поднять его на более высокую энергетическую оболочку, но эта ситуация нестабильна, и электрон быстро распадается обратно в основное состояние. При этом высвобождается фотон света.Как обсуждалось ранее, существует связь между количеством протонов в элементе, атомным номером, который отличает один элемент от другого, и количеством электронов, которые он имеет. Во всех электрически нейтральных атомах количество электронов равно количеству протонов. Каждый элемент, когда он электрически нейтрален, имеет число электронов, равное его атомному номеру.
Ранняя модель атома была разработана в 1913 году датским ученым Нильсом Бором (1885–1962). Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны с электронами на круговых орбиталях на определенных расстояниях от ядра. Эти орбиты образуют электронные оболочки или энергетические уровни, которые позволяют визуализировать количество электронов в различных оболочках. Эти энергетические уровни обозначаются числом и символом «n». Например, 1n представляет собой первый энергетический уровень, расположенный ближе всего к ядру.
Например, 1n представляет собой первый энергетический уровень, расположенный ближе всего к ядру.
Электроны заполняют орбитальные оболочки в последовательном порядке. В стандартных условиях атомы сначала заполняют внутренние оболочки (ближе к ядру), что часто приводит к различному количеству электронов на самой внешней оболочке. Самая внутренняя оболочка имеет максимум два электрона, но каждая из следующих двух электронных оболочек может иметь максимум восемь электронов. Это известно как правило октета, которое гласит, что, за исключением самой внутренней оболочки, атомы более энергетически стабильны, когда они имеют восемь электронов в своей валентной оболочке, самой внешней электронной оболочке. Примеры некоторых нейтральных атомов и их электронных конфигураций показаны на . Как показано, гелий имеет полную внешнюю электронную оболочку, первую и единственную оболочку которой заполняют два электрона. Точно так же неон имеет полную внешнюю оболочку 2n, содержащую восемь электронов. Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильны, если бы следовали правилу октетов и имели восемь.
Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильны, если бы следовали правилу октетов и имели восемь.
Атом может приобретать или терять электроны для достижения полной валентной оболочки, наиболее стабильной электронной конфигурации. Периодическая таблица организована в столбцы и строки в зависимости от количества электронов и того, где эти электроны расположены, что дает инструмент для понимания того, как электроны распределяются во внешней оболочке атома. Как показано на рисунке, атомы гелия (He), неона (Ne) и аргона (Ar) группы 18 имеют заполненные внешние электронные оболочки, поэтому им нет необходимости приобретать или терять электроны для достижения стабильности; они очень стабильны как отдельные атомы. Их нереакционная способность привела к тому, что они были названы инертными газами (или благородными газами). Для сравнения, элементы группы 1, включая водород (H), литий (Li) и натрий (Na), имеют один электрон на своих внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон. В результате потери отрицательно заряженного электрона они превращаются в положительно заряженные ионы. Когда атом теряет электрон и становится положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например, Na + . Элементы группы 17, включая фтор и хлор, имеют семь электронов на самых внешних оболочках; они имеют тенденцию заполнять эту оболочку, получая электрон от других атомов, превращая их в отрицательно заряженные ионы.
Как показано на рисунке, атомы гелия (He), неона (Ne) и аргона (Ar) группы 18 имеют заполненные внешние электронные оболочки, поэтому им нет необходимости приобретать или терять электроны для достижения стабильности; они очень стабильны как отдельные атомы. Их нереакционная способность привела к тому, что они были названы инертными газами (или благородными газами). Для сравнения, элементы группы 1, включая водород (H), литий (Li) и натрий (Na), имеют один электрон на своих внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон. В результате потери отрицательно заряженного электрона они превращаются в положительно заряженные ионы. Когда атом теряет электрон и становится положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например, Na + . Элементы группы 17, включая фтор и хлор, имеют семь электронов на самых внешних оболочках; они имеют тенденцию заполнять эту оболочку, получая электрон от других атомов, превращая их в отрицательно заряженные ионы. Когда атом получает электрон и становится отрицательно заряженным ионом, на это указывает знак минус после символа элемента; например, Ф-. Таким образом, столбцы периодической таблицы представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их сходные химические характеристики.
Когда атом получает электрон и становится отрицательно заряженным ионом, на это указывает знак минус после символа элемента; например, Ф-. Таким образом, столбцы периодической таблицы представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их сходные химические характеристики.
Ключевые положения
Основные термины
Эта страница под названием 2.5: Атомы, изотопы, ионы и молекулы — электронные оболочки и модель Бора опубликована под лицензией CC BY-SA 4.


 Используя периодическую систему химических элементов:
Используя периодическую систему химических элементов: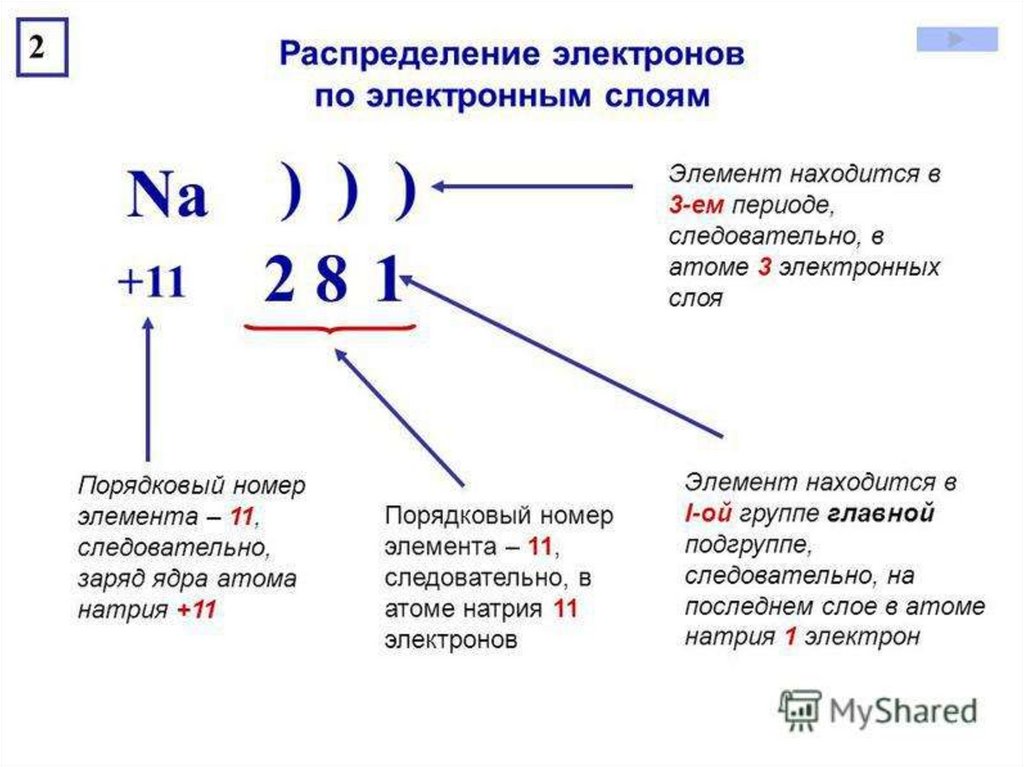 Определите семейство элементов и приведите не менее 2 примеров элементов данного семейства.
Определите семейство элементов и приведите не менее 2 примеров элементов данного семейства.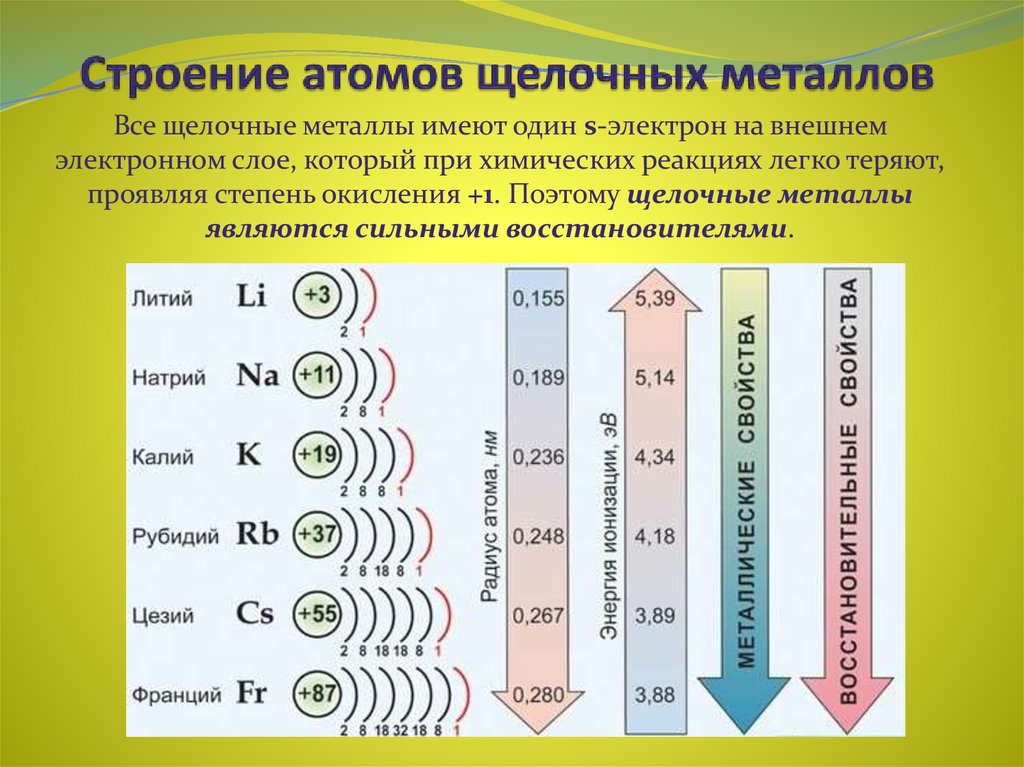 2.1.4 -характеризовать химический элемент по положению в периодической системе
2.1.4 -характеризовать химический элемент по положению в периодической системе

 Определите семейство элементов и приведите не менее 2 примеров элементов данного семейства.
Определите семейство элементов и приведите не менее 2 примеров элементов данного семейства. Если эти элементы полностью теряют электрон — как это обычно делают Li и Na — они становятся положительно заряженными ионами: Li + , Na + .
Если эти элементы полностью теряют электрон — как это обычно делают Li и Na — они становятся положительно заряженными ионами: Li + , Na + .
Leave A Comment