Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов. Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон (\(p\)) — частица, имеющая заряд \(+1\) и относительную массу, равную
Нейтрон (\(n\)) — частица без заряда с относительной массой \(1\).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 11840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).
Частицы | Обозначения | Относительная масса | Относительный заряд |
| Протон | \(p\) | \(1\) | \(+1\) |
| Нейтрон | \(n\) | \(1\) | \(0\) |
| Электрон | \(e\) | \(1/1840\) | \(–1\) |
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.
Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента.
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Обрати внимание!
Порядковый номер элемента \(=\) заряд ядра атома \(=\) число протонов в ядре \(=\) число электронов в атоме.
Водород — элемент № \(1\). Заряд ядра его атома равен \(+1\). В ядре находится один протон, а в электронной оболочке — один электрон.
Углерод — элемент № \(6\). Заряд ядра его атома равен \(+6\), в нём — \(6\) протонов. В атоме содержится \(6\) электронов с общим зарядом \(–\)\(6\).
Обрати внимание!
Заряд ядра — главная характеристика атома.
Изучение строения атомных ядер привело к уточнению формулировки периодического закона. Современная формулировка звучит следующим образом:
cвойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Химические элементы, подготовка к ЕГЭ по химии
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
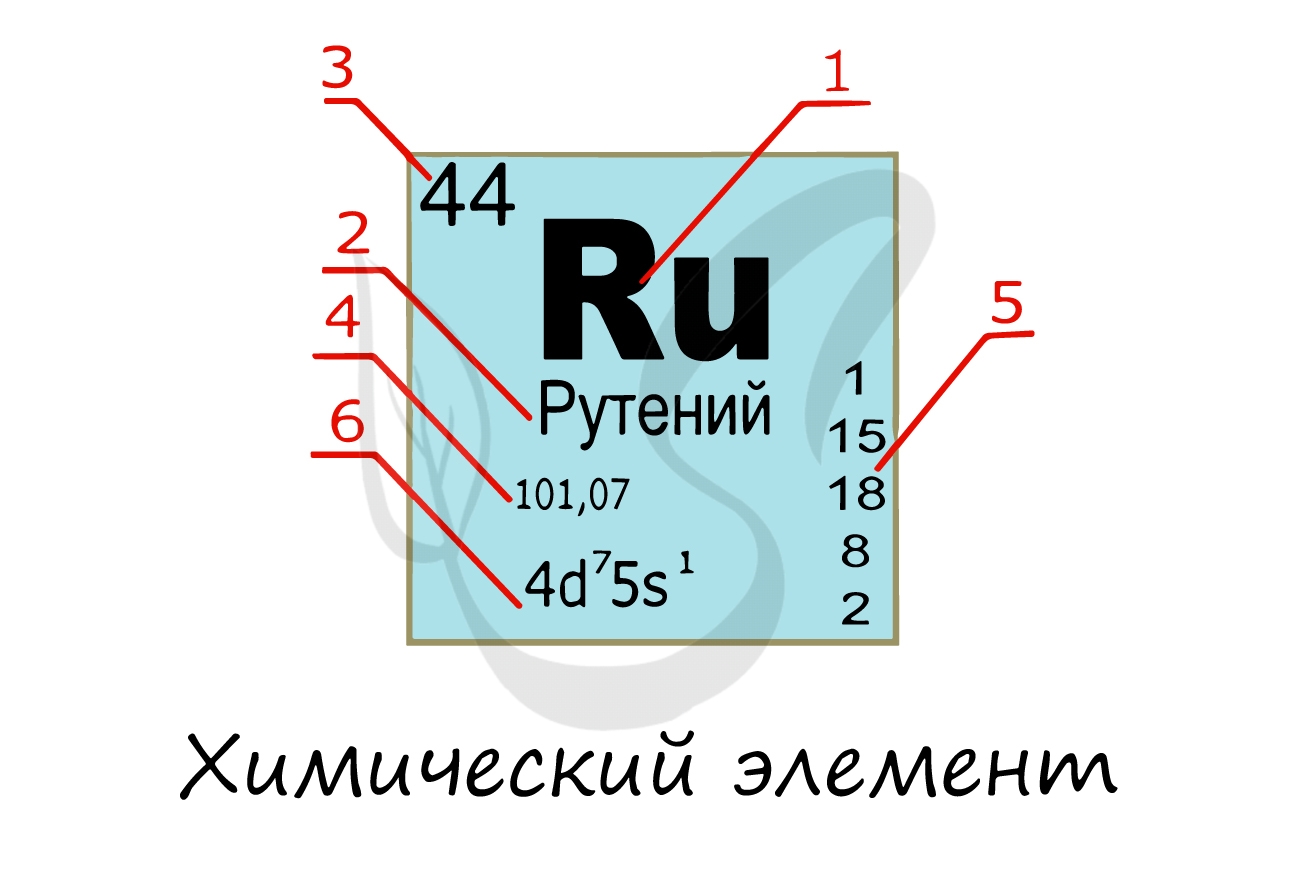
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
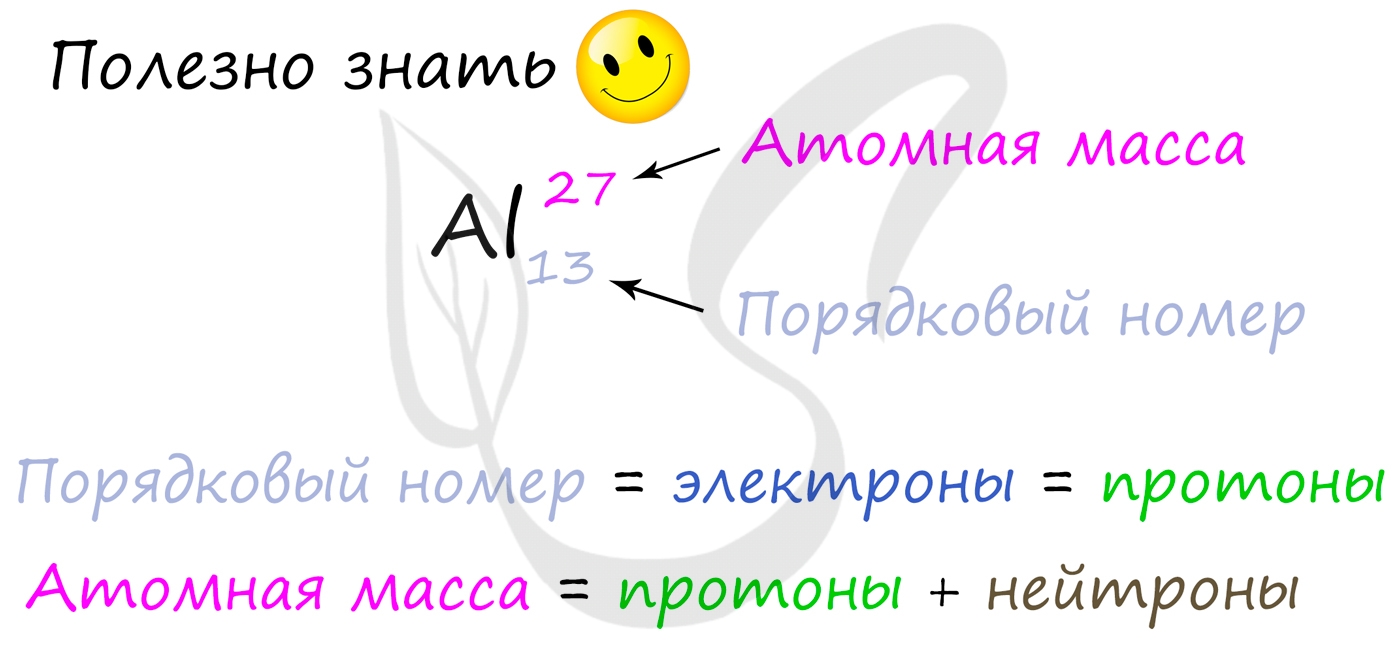
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента, имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
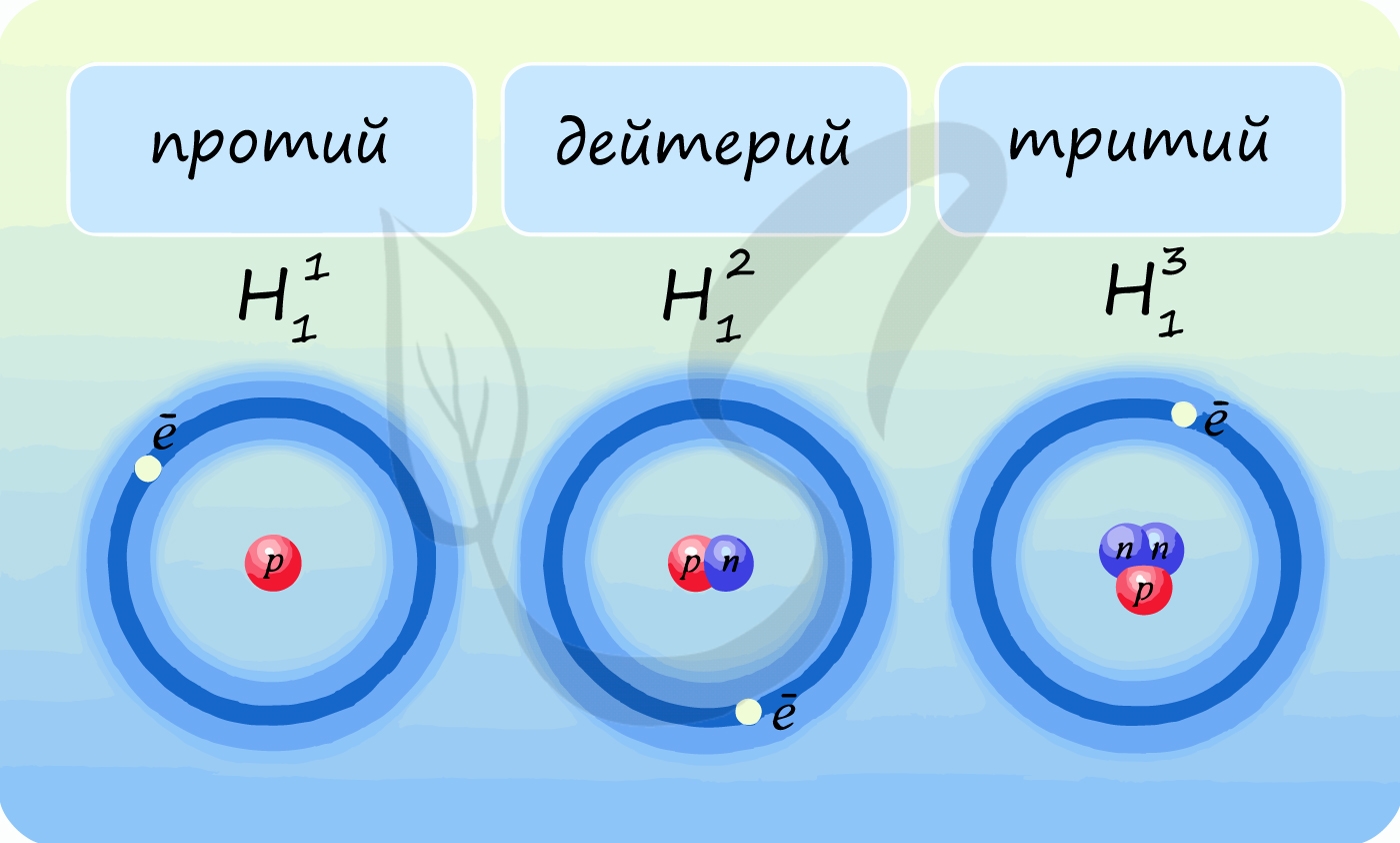
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
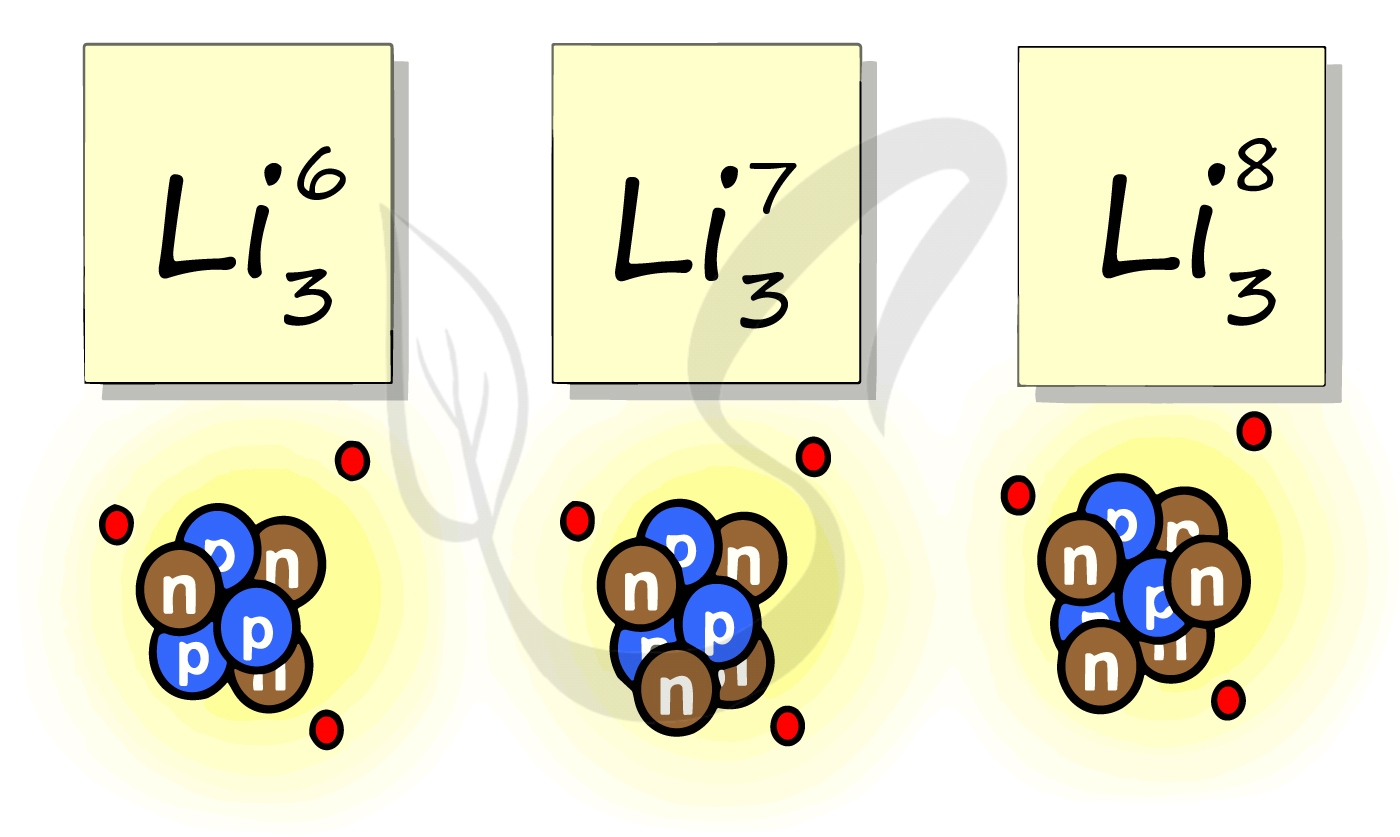
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Строение атома | CHEMEGE.RU
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.

И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.

Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это на заряженная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) равна суммарной массе крупных частиц, которе входят в состав атома — протонов и нейтронов. Поскольку масса протона и нетрона примерно равна 1 атомной единице массы, можно использовать формулу: M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.

Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:

Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.

В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так:  , а не так:
, а не так: 
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:

Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s 
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s  2s
2s 
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s  2s
2s 
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s  2s
2s  2p
2p 
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s  2s
2s  2p
2p 
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s  2s
2s  2p
2p 
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s  2s
2s  2p
2p  3s
3s 
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s 
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s 
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s  3d
3d 
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s  3d
3d 
+23V [Ar]3d34s2 [Ar] 4s  3d
3d 
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s  3d
3d 
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденнео состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s  2s
2s  2p
2p 
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s  2s
2s  2p
2p 
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора обраузется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s  2s
2s  2p
2p 
6. Электронная формула кислорода:
+8О 1s22s22p4 1s  2s
2s  2p
2p 
7. Электронная формула фтора:

8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s  2s
2s  2p
2p  3s
3s 
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s  2s
2s  2p
2p  3s
3s  3p
3p 
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s  2s
2s  2p
2p  3s
3s  3p
3p 
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s  2s
2s  2p
2p  3s
3s  3p
3p 
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s  2s
2s  2p
2p  3s
3s  3p
3p 
13. Электронная формула хлора:

14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s  2s
2s  2p
2p  3s
3s  3p
3p 
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s  2s
2s  2p
2p 
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s  2s
2s  2p
2p 
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Строение атома — параграф 52 ГДЗ химия 8 Рудзитис
1. Какие сведения о строении атома химического элемента можно получить на основании его положения в периодической таблице Д. И. Менделеева?
На основании положения атома в периодической таблице можно узнать о заряде ядра (равно порядковому номеру элемента), количестве протонов ядре (равно заряду ядра), общем числе электронов в атоме (равно заряду ядра), количестве нейтронов в ядре атома (из массового числа атома нужно вычесть его порядковый номер).
Например, углерод: порядковый номер 6, значит заряд ядра +6. В атоме 6 электронов, 6 протонов и 6 нейтронов.
2. Число каких частиц в ядре атома химического элемента можно узнать по его порядковому номеру?
Число протонов в ядре атома = заряду ядра = порядковому номеру элемента.
3. Какое из чисел, приведенных в периодической таблице, указывает на число электронов в электронной оболочке атома данного элемента?
Атом электронейтрален, поэтому общее число электронов в атоме = заряду его ядра = порядковому номеру элемента.
Тестовые задания
1. Изотопы одного и того же химического элемента различаются1) числом электронов 3) числом нейтронов 2) числом протонов 4) зарядом ядра
Думаю, нужно прокомментировать.
Если разница в числе электронов — то это ионы. Если электронов меньше, чем должно быть, то атом имеет общий положительный заряд и называется катионом. Если общее число электронов больше, чем должно быть, то общий заряд атома имеет отрицательную величину, а сам такой атом называется анионом.
Заряд ядра = числу протонов в ядре = порядковому номеру элемента. То есть, атом с иным зарядом ядра будет представлять из себя уже другой элемент.
Определение: химический элемент — это вид атомов с одинаковым зарядом ядра.
Определение: изотопами называют разновидности одного и того же элемента с разным числом нейтронов в ядре атома.
Ответ: 3) Изотопы одного и того же химического элемента различаются числом нейтронов в ядре атома.
2. Ядро атома 2713 Al содержит1) 27 протонов и 13 нейтронов 3) 14 протонов и 13 нейтронов 2) 13 протонов и 14 нейтронов 4) 13 протонов и 27 нейтронов
Порядковый номер алюминия 13, значит заряд ядра = +13 = число протонов. Число нейтронов = массовое число (27) — порядковый номер (число протонов) = 27 — 13 = 14.
Ответ: 2) 13 протонов и 14 нейтронов

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
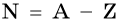
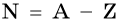
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
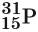
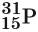
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
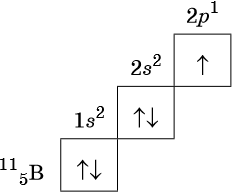

В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.

Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
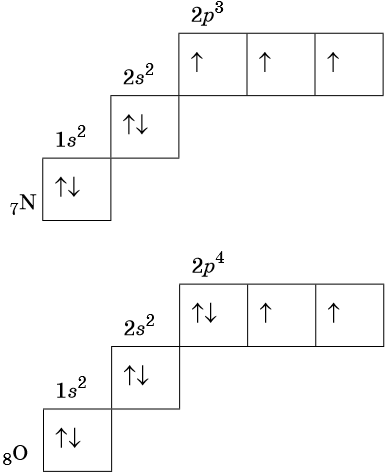
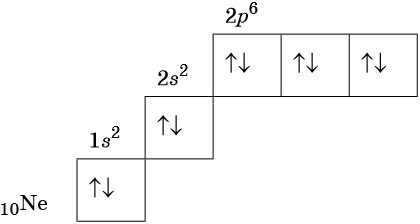
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.


Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы

Количество протонов и нейтронов
Количество протонов и нейтронов — атом определяет элемент
Чистейший тип атома называется элементом. Атомы состоят из трех видов более мелких частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны состоят из еще более мелких частиц, называемых кварками. Количество протонов, число нейтронов и количество электронов, которые имеет атом, определяет, что это за элемент.
- Атомы состоят из 3 видов мелких частиц: протонов, нейтронов и электронов
- Атомы должны иметь одинаковое количество протонов и электронов
Ядро находится в середине атома и содержит протоны и нейтроны.Эти более мелкие частицы — протоны, нейтроны и электроны — все имеют разные свойства.
Количество протонов и нейтронов
Количество протонов и нейтронов — Что такое электроны?
Напоминание об определении, прежде чем узнавать, как рассчитать числа. Электроны — это крошечные, очень легкие частицы, которые имеют отрицательный электрический заряд. Атомы должны иметь одинаковое количество протонов и электронов.
Количество протонов и нейтронов — что такое протоны?
Протоны намного больше и тяжелее электронов и имеют положительный заряд.Атомы должны иметь одинаковое количество протонов и электронов.
Количество протонов и нейтронов — что такое нейтроны?
Нейтроны большие и тяжелые, как протоны, однако нейтроны не имеют электрического заряда.
Количество протонов и нейтронов — Как найти атомный номер элемента
Каждый элемент имеет уникальный символ элемента и уникальный атомный номер, к которому можно получить доступ через Периодическую таблицу с атомной массой.
- Определение: атомный номер — это число протонов в атоме элемента.
Периодическая таблица — это действительно важный инструмент для студентов-химиков, позволяющий им узнавать названия элементов по их атомному номеру. Химические элементы таблицы Менделеева перечислены в порядке атомного номера. Вы также можете обратиться к нижней части этой страницы к краткой таблице всех элементов и их атомных номеров в числовом порядке.
Количество протонов и нейтронов — Как найти количество протонов — Примеры
Атомный номер основан на количестве протонов в атоме элемента.(Примечание: атомы также должны иметь одинаковое количество протонов и электронов.) Итак, если мы знаем атомный номер элемента, то мы также знаем, сколько протонов в элементе.
- Пример 1. Число протонов в золоте. Элемент Золото (символ Au) имеет атомный номер 79. Любой атом, который содержит ровно 79 протонов в своем ядре, является атомом золота. Следовательно, число протонов в атоме золота равно 79.
- Пример 2 — Количество протонов в серебре: Элемент Silver (Symbol Ag) имеет атомный номер 47.Любой атом, который содержит ровно 47 протонов в своем ядре, является атомом серебра. Следовательно, число протонов в атоме серебра равно 47.
- Пример 3 — Количество протонов в неоне: элемент Неон (символ Ne) имеет атомный номер 10. Любой атом, который содержит ровно 10 протонов в своем ядре, является атомом. из золота. Следовательно, число протонов в атоме золота равно 10.
Добавление или удаление протонов из ядра атома создает другой элемент. Например, , удаляя одного протона из атома золота, создает атом платины (платина имеет атомный номер 78, поэтому число протонов = 78.) Добавление одного протона из атома золота создает атом Меркурия (Меркурий имеет атомный номер 80, поэтому число протонов = 80.). Обратитесь к таблице ниже и определите количество протонов в различных элементах.
Количество протонов и нейтронов — Как найти число атомной массы
Вычислить количество нейтронов в атоме или элементе немного сложнее. Для этого расчета вам нужно установить атомный вес, из которого вы сможете установить А, , , номер атомной массы .Атомный вес или масса — это, в основном, измерение общего количества частиц в ядре атома. Атомная масса определяется путем округления атомной массы до ближайшего целого числа. Периодическая таблица с атомной массой даст вам атомный вес или атомную массу элементов.
Атомная масса = атомный вес элемента, округленный до ближайшего целого числа
Итак, если мы знаем число протонов и нейтронов в атоме (элементе), мы можем определить атомную массу
- Пример 1 — Атомная масса of Gold: Элемент Gold (Символ Au) имеет атомный номер 79.Следовательно, число протонов в атоме золота равно 79. Масса атома составляет 196,97. Округлить до ближайшего целого числа. Следовательно, атомная масса золота равна 197.
- Пример 2. Атомная масса серебра. Элемент Серебро (Символ Ag) имеет атомный номер 47. Следовательно, число протонов в атоме серебра равно 47. Серебро имеет атомный номер. Масса груза 107,87. Округлить до ближайшего целого числа. Следовательно, атомная масса серебра равна 108.
- Пример 3 — Атомная масса неона: Элемент Неон (символ Ne) имеет атомный номер 10.Следовательно, число протонов в атоме неона равно 10. Неон имеет атомную массу 20,18. Округлить до ближайшего целого числа. Следовательно, атомное массовое число неона равно 20.
Количество протонов и нейтронов — Как найти число нейтронов
Мы можем идентифицировать количество нейтронов в атоме или элементе, используя информацию, которая у нас уже есть. Чтобы найти число нейтронов, вычтите атомное массовое число из атомного номера.
Количество нейтронов = массовое число — атомный номер
- Пример 1 — Элемент Золото (символ Au).Атомная масса золота равна 197 и имеет атомный номер 79. Число нейтронов в золоте составляет 197 — 79 = 118
- Пример 2 — Элемент Серебро (Символ Ag). Количество нейтронов в серебре: атомная масса нет. серебра — 108 и имеет атомный номер 47. Число нейтронов в неоне — 108 — 47 = 61
- Пример 3 — Элемент Неон (Символ Ne). Атомно-массовое число неона равно 20 и имеет атомный номер. из 10. Число нейтронов в неоне равно 20 — 10 = 10
Добавление или удаление протонов из ядра атома создает другой элемент, но добавление или удаление нейтронов из ядра атома не создать другой элемент.Сравните количество нейтронов и протонов в таблице ниже.
Числовой список атомных номеров элементов
Числовой список атомных номеров элементов
.Структура атома
Атом и электромагнитное излучение
Фундаментальный субатомный Частицы
| Частица | Символ | Заряд | Масса | |
| электрон | и — | -1 | 0.0005486 amu | |
| протон | р + | +1 | 1,007276 аму | |
| нейтрон | n o | 0 | 1,008665 Аму | |
Число протонов, нейтронов и электронов в атоме может быть определенным из набора простых правил.
- Число протонов в ядре атома равно на атомный номер ( Z ).
- Количество электронов в нейтральном атоме равно на количество протонов.
- Массовое число атома ( М, ) равно сумма числа протонов и нейтронов в ядре.
- Количество нейтронов равно разнице между массовое число атома ( М, ) и атомного номер ( Z ).
Примеры: Давайте определим количество протонов, нейтронов и электроны в следующих изотопах.
| 12 C | 13 C | 14 C | 14 N |
Различные изотопы элемента идентифицируются в письменной форме массовое число атомов в верхнем левом углу символ для элемента. 12 C, 13 C и 14 C являются изотопами углерода ( Z = 6) и, следовательно, содержат шесть протоны. Если атомы нейтральны, они также должны содержать шесть электроны. Единственная разница между этими изотопами количество нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6 нейтроны
13 C: 6 электронов, 6 протонов и 7 нейтроны
14 C: 6 электронов, 6 протонов и 8 нейтронов
Электромагнитный Излучение
Многое из того, что известно о структуре электронов в атом был получен путем изучения взаимодействия между материя и различные формы электромагнитное излучение .Электромагнитное излучение обладает некоторыми свойствами как частица и волна.
Частицы имеют определенную массу и занимают пространство. Волны не имеют массы, и все же они несут энергию, когда они проходят через пространство. В дополнение к их способности нести энергию, волны имеют четыре других характерных свойства: скорость, частота, длина волны и амплитуда. Частота ( в ) является количество волн (или циклов) в единицу времени.Частота волна сообщается в единицах циклов в секунду (с -1 ) или герц (Гц).
Идеализированный рисунок волны на рисунке ниже иллюстрирует определения амплитуды и длины волны. Длина волны ( l ) — наименьшее расстояние между повторяющимися точками на волна. Амплитуда волны является расстоянием между самой высокой (или самой низкой) точкой на волне и центром тяжести волны.
Если мы измерим частоту ( против ) волны в циклах на вторая и длина волны ( л, ) в метрах, произведение эти два числа имеют единицы метров в секунду. Продукт частоты ( v ), умноженной на длину волны ( l ) Таким образом, волна — это скорость ( с ), с которой волна распространяется сквозь пространство
vl = с
Свет и другие формы Электромагнитное излучение
Свет — это волна с электрическим и магнитным составные части.Поэтому форма электромагнитного излучение .
Видимый свет содержит узкую полосу частот и длины волн в части электромагнитного спектра, который наши глаза могут обнаружить. Включает излучение с длинами волн от около 400 нм (фиолетовый) до 700 нм (красный). Потому что это волна, свет изгибается, когда входит в стеклянную призму. Когда белый свет ориентирован на призму, лучи света разные длины волн изгибаются по-разному, и свет превращается в спектр цветов.Начиная со стороны спектр, где свет изгибается наименьшим углом, Цвета: красный, оранжевый, желтый, зеленый, синий и фиолетовый.
Как видно из следующей диаграммы, энергия переносится свет увеличивается, когда мы переходим от красного к синему через видимое спектр.
Потому что длина волны электромагнитного излучения может быть как длиной 40 м или 10 -5 нм, видимый Спектр — это лишь малая часть общего диапазона электромагнитное излучение.
электромагнитный спектр включает в себя радио и телевизионные волны, микроволны, инфракрасный, видимый свет, ультрафиолет, рентгеновские лучи, рентгеновские лучи, и космические лучи, как показано на рисунке выше. Эти разные все формы излучения движутся со скоростью света ( c ). Однако они различаются по частоте и длине волны. произведение частоты на длину волны электромагнитного излучение всегда равно скорости света.
vl = c
В результате электромагнитное излучение который имеет большую длину волны, имеет низкую частоту, и излучение с высокой частотой имеет короткую длину волны.
,
Что такое атом? | Живая наука
Атомы являются основными единицами материи и определяющей структурой элементов. Термин «атом» происходит от греческого слова «неделимый», потому что когда-то считалось, что атомы — это самые маленькие вещи во вселенной и их невозможно разделить. Теперь мы знаем, что атомы состоят из трех частиц: протонов, нейтронов и электронов, которые состоят из еще более мелких частиц, таких как кварков .
Атомов были созданы после Большого взрыва 13.7 миллиардов лет назад. По мере охлаждения горячей, плотной новой вселенной условия стали подходящими для образования кварков и электронов. Кварки собрались вместе, чтобы сформировать протоны и нейтроны, и эти частицы объединились в ядра. Все это произошло в течение первых нескольких минут существования вселенной, в соответствии с ЦЕРН .
Вселенной потребовалось 380 000 лет, чтобы охладиться настолько, чтобы замедлить электроны, чтобы ядра могли захватить их, чтобы сформировать первые атомы. Согласно данным Jefferson Lab , самыми ранними атомами были в основном водорода, и гелия , которые до сих пор являются наиболее распространенными элементами во вселенной.Гравитация в конечном итоге заставила облака газа слиться и образовать звезды, и более тяжелые атомы были (и остаются) созданы внутри звезд и отправлены по всей вселенной, когда звезда взорвалась (сверхновая).
Атомные частицы
Протоны и нейтроны тяжелее электронов и находятся в ядре в центре атома. Электроны чрезвычайно легки и существуют в облаке, вращающемся вокруг ядра. Облако электронов имеет радиус в 10 000 раз больше ядра, согласно Лос-Аламосской национальной лаборатории .
Протоны и нейтроны имеют примерно одинаковую массу. Однако один протон примерно в 1835 раз массивнее электрона. Атомы всегда имеют одинаковое количество протонов и электронов, и число протонов и нейтронов обычно одинаково. Добавление протона в атом создает новый элемент, в то время как добавление нейтрона делает изотоп или более тяжелую версию этого атома.
Ядро
Ядро было открыто в 1911 году Эрнестом Резерфордом, физиком из Новой Зеландии.В 1920 году Резерфорд предложил название протона для положительно заряженных частиц атома. Он также предположил, что внутри ядра была нейтральная частица, которую Джеймс Чедвик, британский физик и ученик Резерфорда, смог подтвердить в 1932 году.
Практически вся масса атома находится в его ядре, согласно Химия LibreTexts . Протоны и нейтроны, составляющие ядро, имеют примерно одинаковую массу (протон немного меньше) и имеют одинаковый момент импульса или спин.
Ядро удерживается сильной силой , одной из четырех основных сил в природе. Эта сила между протонами и нейтронами преодолевает отталкивающую электрическую силу, которая иначе раздвинула бы протоны в соответствии с правилами электричества. Некоторые атомные ядра нестабильны, потому что сила связи варьируется для разных атомов в зависимости от размера ядра. Эти атомы затем распадутся на другие элементы, такие как углерод-14, распадающийся на азот-14.
Вот простой рисунок структуры атома.(Фото предоставлено: Shutterstock)Протоны
Протоны — это положительно заряженные частицы, найденные в атомных ядрах. Резерфорд открыл их в экспериментах с электронно-лучевыми трубками, которые проводились между 1911 и 1919 годами. Протоны примерно на 99,86% массивнее нейтронов.
Число протонов в атоме уникально для каждого элемента. Например, атомов углерода, имеют шесть протонов, атомов водорода, атомов имеют один, а атомов кислорода, имеют восемь. Число протонов в атоме называется атомным номером этого элемента.Количество протонов также определяет химическое поведение элемента. Элементы расположены в периодической таблице элементов в порядке возрастания атомного номера.
Три кварка составляют каждый протон — два «восходящих» кварка (каждый с положительным зарядом в две трети) и один «нижний» кварк (с отрицательным зарядом в одну треть) — и они удерживаются вместе другими субатомными частицами, называемыми глюоны, которые безмассовые.
электронов
электроны крошечные по сравнению с протонами и нейтронами, более чем в 1800 раз меньше, чем протон или нейтрон.По данным Jefferson Lab , электроны примерно на 0,054% массивнее нейтронов.
Джозеф Джон (J.J.) Томсон, британский физик, открыл электрон в 1897 году, согласно Института истории науки . Первоначально известные как «корпускулы», электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро путями, называемыми орбиталями, — идея, выдвинутая австрийским физиком Эрвином Шредингером в 1920-х годах.Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, являются сферическими, но внешние орбитали намного сложнее.
Электронная конфигурация атома относится к расположению электронов в типичном атоме. Используя электронную конфигурацию и принципы физики, химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость, согласно Лос-Аламосской национальной лаборатории .
Нейтроны
Существование нейтрона было теоретизировано Резерфордом в 1920 году и открыто Чедвиком в 1932 году, согласно Американскому физическому обществу . Нейтроны были обнаружены в ходе экспериментов, когда атомы были расстреляны из тонкого листа бериллия . Субатомные частицы без заряда были выпущены — нейтрон.
Нейтроны — это незаряженные частицы, обнаруженные во всех атомных ядрах (кроме водорода). Масса нейтрона немного больше, чем у протона.Как и протоны, нейтроны также состоят из кварков — одного «восходящего» кварка (с положительным зарядом 2/3) и двух «нижних» кварков (каждый с отрицательным зарядом в одну треть).
История атома
Теория атома датируется, по крайней мере, еще 440 годом до нашей эры. Демокриту, греческому ученому и философу. Демокрит, скорее всего, построил свою теорию атомов на работах прошлых философов, согласно Эндрю Г. Ван Мелсену, автору «От атома к атому: история понятия атома» (Duquesne University Press, 1952).
Объяснение Демокритом атома начинается с камня. Камень, разрезанный пополам, дает две половинки одного и того же камня. Если бы камень нужно было постоянно резать, в какой-то момент мог бы существовать кусок камня, достаточно маленький, чтобы его больше нельзя было резать. Термин «атом» происходит от греческого слова «неделимый», которое, как заключил Демокрит, должно быть точкой, в которой существо (любая форма материи) больше не может быть разделено.
Его объяснение включало идеи о том, что атомы существуют отдельно друг от друга, что существует бесконечное количество атомов, что атомы могут двигаться, что они могут объединяться вместе, чтобы создать материю, но не сливаются, чтобы стать новым атомом, и что они не могут быть разделены, согласно Вселенной сегодня .Однако, поскольку большинство философов того времени — особенно очень влиятельный Аристотель — полагали, что вся материя была создана из земли, воздуха, огня и воды, атомная теория Демокрита была отложена.
Джон Далтон, британский химик, опирался на идеи Демокрита в 1803 году, когда он выдвинул свою собственную атомную теорию, согласно химическому отделу в Университете Пердью . Теория Дальтона включала в себя несколько идей Демокрита, такие как атомы неразделимы и неразрушимы, и что разные атомы образуются вместе, чтобы создать всю материю.Дополнения Дальтона к теории включали следующие идеи: что все атомы одного элемента идентичны, что атомы одного элемента будут иметь разные веса и свойства, чем атомы другого элемента, что атомы не могут быть созданы или уничтожены, и что материя образована атомы объединяются в простые целые числа.
Томсон, британский физик, открывший электрон в 1897 году, доказал, что атомы можно разделить, согласно фонда химического наследия .Он смог определить наличие электронов, изучив свойства электрического разряда в электронно-лучевых трубках. Согласно статье Томсона 1897 года, лучи отклонялись внутри трубки, что доказывало, что внутри вакуумной трубки было что-то отрицательно заряженное. В 1899 году Томсон опубликовал описание своей версии атома, широко известной как «модель сливового пудинга». Отрывок из этой статьи можно найти на сайте Chem Team . Модель атома Томсона включала большое количество электронов, взвешенных в чем-то, что производило положительный заряд, давая атому общий нейтральный заряд.Его модель напоминала сливовый пудинг, популярный британский десерт с изюмом, подвешенным в виде круглого шарика, похожего на торт.
Следующим ученым, который продолжил модифицировать и развивать атомную модель, был Резерфорд, который учился у Томсона, согласно химическому отделу в Университете Пердью . В 1911 году Резерфорд опубликовал свою версию атома, которая включала положительно заряженное ядро, вращающееся вокруг электронов. Эта модель возникла, когда Резерфорд и его помощники выпустили альфа-частицы по тонким листам золота.Альфа-частица состоит из двух протонов и двух нейтронов, удерживаемых вместе одной и той же сильной ядерной силой, которая связывает ядро, согласно лаборатории Джефферсона.
Ученые заметили, что небольшой процент альфа-частиц рассеивался под очень большими углами к первоначальному направлению движения, в то время как большинство проходило сквозь почти не нарушенные. Резерфорд смог приблизиться к размеру ядра атома золота, обнаружив, что он по крайней мере в 10000 раз меньше размера всего атома, причем большая часть атома является пустым пространством.Модель атома Резерфорда по-прежнему является базовой моделью, которая используется сегодня.
Несколько других ученых продвигали атомную модель, в том числе Niels Bohr (построенный по модели Резерфорда, включающей свойства электронов на основе спектра водорода), Эрвин Шредингер (разработавший квантовую модель атома), Вернер Гейзенберг (заявил, что один не может знать и положение, и скорость электрона одновременно), а Мюррей Гелл-Манн и Джордж Цвейг (независимо разработали теорию, согласно которой протоны и нейтроны состояли из кварков).
Дополнительные ресурсы:
Эта статья была обновлена 10 сентября 2019 года участником Live Science Трейси Педерсен.
,Как найти протоны, нейтроны и электроны
В попытке понять основную конструкцию атомов, важно получить информацию о методологии для обнаружения протонов, нейтронов и электронов. В данной статье рассматриваются основные методы определения количества субатомных частиц в атоме.
Элементарная физика и химия имеют дело с атомами, электронами и протонами. Понимание основных понятий этих фундаментальных частей атома может помочь нам расшифровать сложные химические процессы в этом мире.Более того, зная простые методы определения количества протонов, нейтронов и электронов, мы можем понять из более близкой перспективы, как изменение количества этих частиц влияет на физические и химические свойства химических элементов.
- Электроны : Это субатомная частица, которая несет отрицательный заряд (-1). Он был обнаружен группой британских физиков, включая сэра Дж. Дж. Томпсона, в 1897 году.
- Протон: Положительно заряженный протон частицы (заряд +1) подобен положительному иону водорода.Эрнест Резерфорд установил существование протонов в 1918 году, посылая альфа-частицы через газообразный азот.
- Нейтрон : Это нейтральные субатомные частицы, найденные в центре ядра. Они были обнаружены Джеймсом Чедвиком в 1932 году.
Нахождение протонов, нейтронов и электронов в элементе
Хотите написать для нас? Ну, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Будь то физика или химия, ученики элементарных наук должны знать, как найти протоны, нейтроны и электроны.Вот некоторые простые основы, о которых студенты должны знать:
- Количество протонов = Атомный номер
- Количество электронов = Количество протонов = Атомный номер
- Количество нейтронов = массовое число — атомный номер
- Массовое число = сумма протонов и нейтронов
Нахождение протонов, нейтронов и электронов изотопов
Изотопы — это атомы одного и того же элемента с одинаковым числом протонов, но с разным числом нейтронов.Например, углерод-12, углерод-13 и углерод-14 — это три изотопа углерода, каждый из которых имеет 6 электронов. Однако число нейтронов в каждом из этих изотопов углерода равно 6, 7 и 8 соответственно. Чтобы узнать, как найти протоны, нейтроны и электроны в изотопе, рассмотрим пример изотопов хлора, хлора 35 ( 17 Cl 35 ) и хлора 37 ( 17 Cl 37 )
Хлор — 35 ( 17 Cl 35 )
Количество электронов = Количество протонов = Атомный номер = 17
Массовое число = 35
Количество Нейтрон = Массовое число — Атомный номер = 35 — 17 = 18
Если рассмотреть хлора — 37 ( 17 Cl 37 )
Количество электронов = Количество протонов = Атомный номер = 17
Массовое число = 37
Количество Нейтрон = Массовое число — Атомный номер = 37 — 17 = 20
Нахождение протонов, нейтронов и электронов ионов
Важно знать о катионах и анионах, прежде чем мы научимся простому методу обнаружения протонов, электронов и нейтронов в них.
- Катионы : Ионы с положительными зарядами называются катионами. Они потеряны после потери электронов в атоме.
- Анион : Это отрицательно заряженные ионы, которые образуются в результате добавления дополнительных электронов в атом.
Рассмотрим случай Na + .
Хотите написать для нас? Ну, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим…
Давайте работать вместе!
Что касается атомной структуры натрия, мы знаем, что атомное число натрия (Na) равно 11. Однако, поскольку ион натрия несет положительный заряд, он должен либо получить протон, либо потерять электрон. Поскольку Na не может получить один протон, так как он станет магнием, он, должно быть, потерял один электрон. Следовательно, исходное число электронов и протонов в натрии равно 11, но, поскольку он потерял один электрон, число электронов = количество протонов = атомный номер = 10.
Аналогично, количество нейтронов в Na + = массовое число — атомный номер = 23 — 10 = 13
Просто узнать количество протонов, электронов и нейтронов, используя периодическую таблицу. На этой таблице написано атомное и массовое число. Пытаясь узнать больше о том, как найти эти субатомные частицы в нескольких других элементах, студенты могут освоить эту простую технику.
,
Leave A Comment