Ответов пока нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
рисунок и подробные пояснения —
Этан Льюис Точечная Структура будет относиться к образованию структуры соединения этана с химическим описанием. В этом исследовании будет представлена подробная структура путем объяснения фактов, показанных структурой Льюиса.
Факторы, которые будут рассмотрены в этой статье, перечислены ниже:
Валансные электроны этанаОдна молекула этана состоит из двух атомов углерода и шести атомов кислорода. Химическая формула молекулы C2H6. Общее число валентных электронов в этом соединении равно 14.
Очень важно понимать расчет ионного валентного электрона, делающего Точечная структура Льюиса если молекулы. Валансные электроны являются основными участниками образования связей между различными атомами.
В случае расчета числа валентных электронов каждого атома необходимо определить число валентных электронов, удерживаемых атомами. Поэтому найдем общее число электронов в каждом из атомов углерода и водорода.
Молекула этана из ВикипедияОбщее число электронов в углероде равно шести, а общее число выборов в одном атоме водорода равно одному. В первой электронной оболочке углерода два электрона, а вторая оболочка, то есть высший энергетический уровень атома, имеет четыре электрона, что не удовлетворяет октету. Поэтому, число валентных электронов в углероде равно четырем.
Поэтому, число валентных электронов в углероде равно четырем.
Кроме того, поскольку один атом водорода содержит только один единственный электрон в своей единственной электронной оболочке, валентность атома водорода равна единице. Таким образом, очевидно, что при формировании Точечная структура Льюиса имеют место четыре валентных электрона от каждого из двух атомов углерода и по одному валентному электрону от каждого из шести атомов водорода.
Общее количество валентных электронов в C2H6 равно 4*(2) + 6*(1) = 14.
Обмен этими валентными электронами происходит для создания связей между атомами. Было установлено, что связи в этой органической молекуле представляют собой одинарные ковалентные связи. Это разделение происходит из-за стремления атомов заполнить октет, что обеспечивает внешнюю стабильность атомам, подобным инертным газам.
Рисунок точечной структуры Этана ЛьюисаЭтапы создания Точечная структура Льюиса этого органического соединения будет нарисовано в этом разделе. Рисунок будет актуален для обсуждения систематического формирования структуры C2H6. Участие валентных электронов могло бы описать процедуру и создать ценные знания о химии, стоящей за существованием C2H6.
Рисунок будет актуален для обсуждения систематического формирования структуры C2H6. Участие валентных электронов могло бы описать процедуру и создать ценные знания о химии, стоящей за существованием C2H6.
В случае если подготовка Точечная структура Льюиса молекул необходимо понимать критерий участия валентных электронов в процедуре связывания, происходящей между атомами.
Давайте нарисовать точечную структуру Льюиса этана, C2H6:
На приведенном выше рисунке показано положение валентных электронов в C2H6. Это основное Точечная структура Льюиса молекулы. Точки — это символ валентных электронов.
В этом обмене участвуют два атома углерода. Каждый из них делит один электрон друг с другом и создает одинарную связь. Остальные три валентных электрона атомов углерода являются общими с тремя атомами водорода.
Один углерод делит три электрона с тремя атомами водорода, а другой делит свои три валентных электрона с тремя другими атомами водорода. Вот как они создают одинарные связи и ящики C2H6, используя все валентные электроны.
Атомы водорода также делят свои электроны с атомами углерода. Следовательно, происходит взаимное совместное использование электронов и доказывает, что соединение является ковалентным соединением.
Структура одинарной связи этанаТаким образом, атомы заполняют свой октет. Все атомы, включая углерод и водород, становятся стабильными, как их ближайший благородный газ. Поскольку гелий является ближайшим к водороду благородным газом и содержит два электрона в своей структуре, водород стремится получить ту же электронную конфигурацию, что и гелий. Неон является ближайшим к углероду и, следовательно,; Carbon стремится получить электронную конфигурацию Neon.
Это стремление иметь одинаковую электронную конфигурацию гелия и неона для водорода и углерода соответственно толкает их к этой реакции совместного использования электронов. Это заставляет их связываться друг с другом ковалентной связью.
Факты, представленные точечной структурой Льюиса этанаЕсть несколько фактов о соединении, разделяемом Точечная структура Льюиса. Эти факты касаются внутренней формы молекулы и подробной информации о формировании молекулы.
Эти факты касаются внутренней формы молекулы и подробной информации о формировании молекулы.
Точечная структура этана по Льюису помогает идентифицировать электронное устройство внутри молекулы. Об этом расположении и всплеске наличия определенного количества электронов в конфигурации элементов этана сообщает точечная структура Льюиса.
Согласно теории ВСЕПР, этан обладает тетраэдрической геометрией. Эта теория относится к концепции отталкивания пар электронов валентной оболочки внутри молекул. Он подчеркивает электронную структуру и геометрию соединений, определяя силу отталкивания электронов связывающей пары и неподеленных пар.
У Этана нет одинокой пары. Это sp3-гибридизированная тетраэдрическая молекула. Эта теория ВСЕПР объясняется Точечная структура Льюиса из Этана. Молекулярная структура этана говорит о том, что это ковалентное соединение и следует правилу октета.
Равное распределение электронов среди каждого из электронов в соответствии с их потребностями представлено этой точечной структурой. Доля электронов и теория, стоящая за ней, объясняется и обосновывается Точечная структура Льюиса.
Доля электронов и теория, стоящая за ней, объясняется и обосновывается Точечная структура Льюиса.
Ответ: Теория VSEPR (отталкивания электронных пар валентной оболочки) показывает участие валентных электронов в создании связей между элементами. Эта теория представляет характеристики отталкивания, проявляемые связывающими, несвязывающими электронами и электронами неподеленной пары в молекуле. Он подчеркивает концепцию создания стабильной молекулярной геометрии соединения.
Вопрос 2: Почему этан считается ковалентным соединением?Ответ: В случае образования этана электроны являются общими для элементов. И углерод, и водород делят свои электроны друг с другом. Ни один элемент не передает свои электроны другим. Поэтому он считается ковалентным соединением.
Вопрос 3: Как атомы водорода заполняют свой октет в C2H6?Ответ: У углерода четыре валентных электрона, поэтому ему нужно еще четыре, чтобы заполнить октет. Плохой водород имеет 1 валентный электрон, поэтому ему нужен еще один электрон, чтобы получить ту же конфигурацию, что и у гелия.
Плохой водород имеет 1 валентный электрон, поэтому ему нужен еще один электрон, чтобы получить ту же конфигурацию, что и у гелия.
Оба углерода друг с другом делят один валентный электрон из четырех, а остальные три — общие с молекулами водорода. Кроме того, молекулы водорода также делят с ними свой единственный электрон.
Вопрос 4: В чем разница между молекулярной структурой этана и этилена?Ответ: В молекулярной структуре этана в качестве участников встречается шесть атомов водорода. Оба атома углерода делят друг с другом только один электрон и создают между собой одинарную связь.
В молекулярной структуре этилена участвуют четыре атома водорода. Атомы углерода делят два своих избрания друг с другом и создают между собой двойную связь.
Вопрос 5: Каково общее количество валентных электронов, присутствующих в этилене?Ответ: В Этене четыре молекулы водорода, которые разделяют атомы водорода, равно 4*1=4, а общее количество валентных электронов, общих для атомов углерода, равно 2*4=8.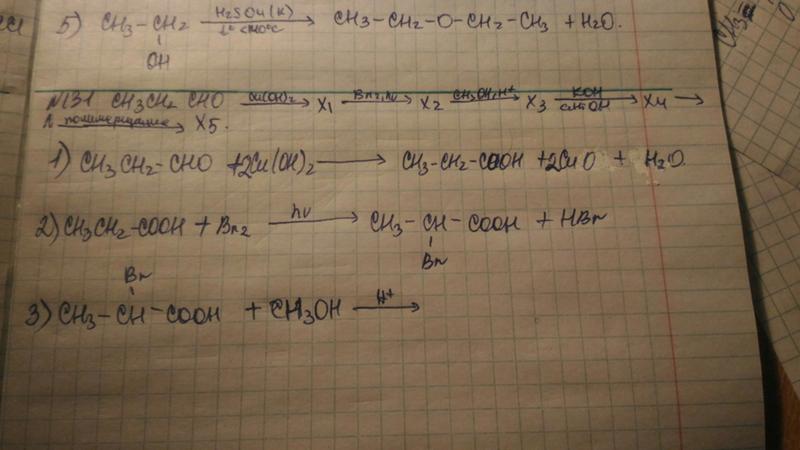 Следовательно, общее количество валентных электронов, присутствующих в Этене, равно (8=4) = 12.
Следовательно, общее количество валентных электронов, присутствующих в Этене, равно (8=4) = 12.
Ответ: Поскольку число участвующих атомов водорода в этане равно шести, химическая формула этана — C2H6. Таким образом, число участвующих атомов водорода в Этене равно четырем; химическая формула этилена C2h5. Однако принципиальным отличием их структурной формулы является разное количество атомов водорода в соединениях.
Гибридизация этана, молекулярная геометрия и форма
Структура Льюиса
- Сообщение от Приянка
26 Январь
Этан представляет собой органическое соединение с химической формулой C2H6. Это бесцветная молекула без запаха, существующая в виде газа при стандартной комнатной температуре. Это соединение является одним из простейших существующих углеводородов, имеющих одинарную связь между атомами углерода. Этан имеет довольно много применений в различных отраслях промышленности и имеет одну из самых простых углеводородных структур. Его также называют метилметаном, биметилом и диметилом. Как правило, имя Этан используется чаще, чем другие имена.
Этан имеет довольно много применений в различных отраслях промышленности и имеет одну из самых простых углеводородных структур. Его также называют метилметаном, биметилом и диметилом. Как правило, имя Этан используется чаще, чем другие имена.
Чтобы понять его физические и химические свойства, необходимо знать его структуру по Льюису, образование связей, форму и многое другое. Продолжайте читать этот пост в блоге, чтобы найти все подробности о структуре точек Льюиса Этана, ее молекулярной геометрии и гибридизации.
| Name of molecule | Ethane ( C2H6) |
| No of Valence Electrons in the molecule | 14 |
| Hybridization of C2H6 | sp3 hybridization |
| Bond Angles | 109.5 degrees |
| Molecular Geometry of C2H6 | Trigonal Pyramidal |
Содержимое
C2H6 Валентные электроныЭтан содержит два атома углерода и шесть атомов водорода. Чтобы узнать структуру Льюиса молекулы, жизненно важно знать общее количество валентных электронов этана.
У углерода четыре валентных электрона, а у каждого атома водорода один валентный электрон.
Общее количество валентных электронов в этане – валентные электроны углерода + валентные электроны водорода
= 2* 4 + 6*1 (так как есть два атома углерода и шесть атомов водорода, мы будем учитывать их все, чтобы получить общее число валентных электронов)
= 14
Следовательно, в этане 14 валентных электронов.
Структура Льюиса C2H6 Структура Льюиса помогает понять расположение атомов в структуре вместе с ее валентными электронами. В этой структуре показано, что отдельные атомы со всеми их валентными электронами знают формирование связи, молекулярную геометрию и форму молекулы.
Теперь, когда у нас есть общее количество валентных электронов, мы можем начать рисовать точечную структуру Льюиса этана.
Оба атома углерода будут размещены в центре, поскольку атомы водорода никогда не могут находиться в центральном положении. Итак, поместите оба атома углерода вместе с их четырьмя валентными электронами вот так.
Теперь поместите все атомы водорода вокруг атомов углерода вместе с их валентными электронами.
После размещения всех атомов вы можете заметить, что каждому атому водорода нужен один электрон, чтобы достичь стабильной структуры . Точно так же углероду нужно еще четыре электрона, чтобы завершить свой октет.
Каждый атом углерода образует связи с тремя атомами водорода и разделяет электроны. Благодаря этому каждый атом водорода теперь имеет два электрона на внешней оболочке, что делает его стабильным.
Оба атома углерода также образуют одинарные связи друг с другом и делят свои электроны, завершая свой октет. Здесь, в этане, углерод образует связи с атомами водорода, что помогает этим атомам достичь стабильной структуры и в то же время формировать связь с другим атомом каброна, чтобы завершить их октет.
Здесь, в этане, углерод образует связи с атомами водорода, что помогает этим атомам достичь стабильной структуры и в то же время формировать связь с другим атомом каброна, чтобы завершить их октет.
Все валентные электроны используются для создания стабильной структуры молекулы, поэтому в ней нет неподеленных или несвязывающих пар электронов. Расположение электронов и атомов в этой молекуле симметрично.
Это точечная структура Льюиса C2H6, использующая все четырнадцать валентных электронов.
Гибридизация C2H6 Во время образования связи орбитали атомов гибридизуются, чтобы разделить электроны с другим атомом. Здесь каждый атом углерода образует три сигма-связи с атомами водорода и одну сигма-связь с атомом углерода. В результате четыре орбитали, то есть орбитали 1s, px, py и pz, гибридизуются в каждом атоме углерода. Среди этих гибридных орбиталей одна гибридная орбиталь будет перекрываться с 1s-орбиталью атома водорода, которая образует сигма-связь между атомами водорода и углерода. Образование таких гибридизованных орбиталей приводит к sp3-гибридизации.
Образование таких гибридизованных орбиталей приводит к sp3-гибридизации.
Таким образом, C2H6 представляет собой sp3-гибридизацию.
Молекулярная геометрия C2H6Если вы посмотрите на расположение атомов в молекуле, вы заметите, что все атомы водорода располагаются вокруг атомов углерода в тетраэдрической геометрии. Следовательно, C2h6 имеет тетраэдрическую молекулярную геометрию.
Валентные углы C2H6Молекулы с тетраэдрической молекулярной геометрией имеют валентные углы 109,5 градусов, на которые обычно влияют неподеленные пары электронов. Неделеные пары электронов могут изменять валентные углы за счет своих сил отталкивания, но здесь в C2H6, поскольку в молекуле нет неподеленных пар, валентные углы в C2H6 равны 109.5 градусов.
Форма C2H6 Как упоминалось выше, молекула имеет тетраэдрическую геометрию без каких-либо неподеленных пар. Однако электронных облаков , находящихся на обоих атомах углерода, будут отталкиваться друг от друга.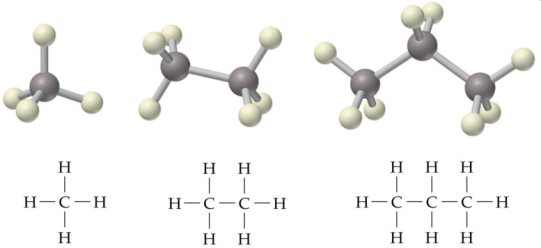 Эти силы приводят к образованию треугольной пирамидальной формы этой молекулы.
Эти силы приводят к образованию треугольной пирамидальной формы этой молекулы.
Таким образом, C2H6 имеет форму тригональной пирамиды.
Заключительные замечания
Этан по своей структуре является одним из простейших углеводородов. Он имеет только два атома углерода и симметричное распределение молекул с неподеленными парами. Можно легко понять точечную структуру Льюиса этой молекулы. Этан широко используется в нефтехимической промышленности и для производства этилена. Он также используется при приготовлении других химических веществ, таких как клеи, краски и т. д.
Я надеюсь, что эта статья поможет вам с легкостью понять структуру Льюиса C2H6.
Дайте нам знать, структуру Льюиса какой другой молекулы вы хотели бы узнать в комментариях ниже.
JEE Примечания по молекулярной геометрии C2H6 и валентным углам
Этан представляет собой соединение с химической формулой C2H6. Он не имеет цвета и запаха и остается в газообразном состоянии при стандартной комнатной температуре.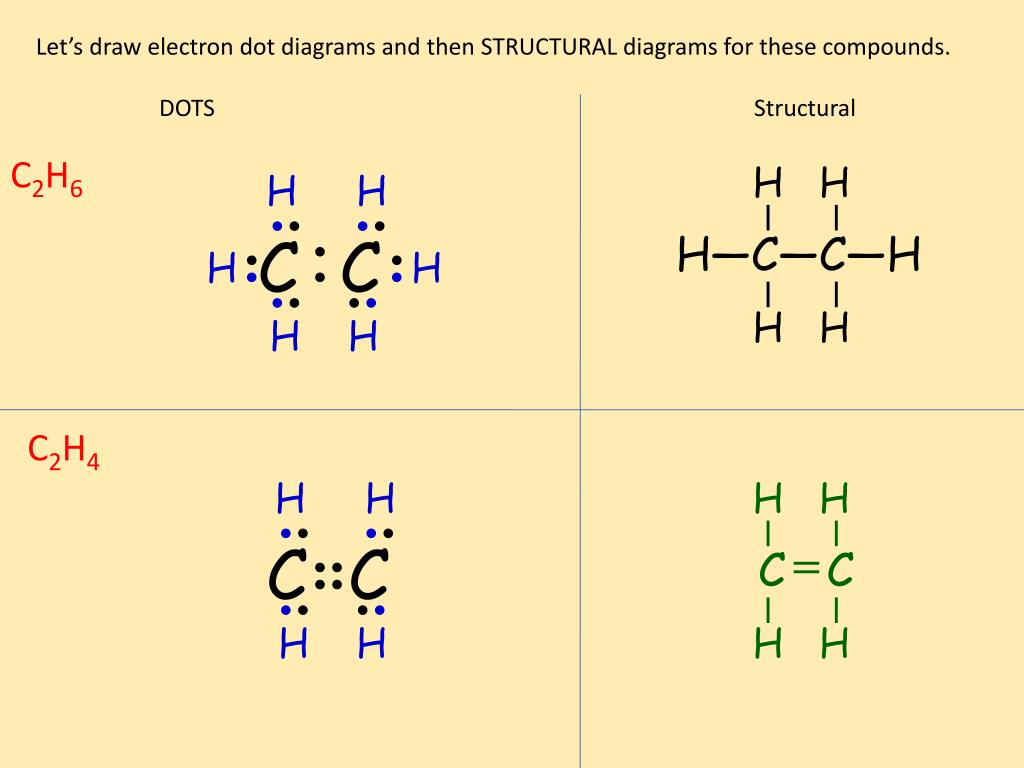 Это один из простейших углеводородов с одинарной связью между атомами углерода. Кроме того, метан имеет различное применение в различных отраслях промышленности.
Это один из простейших углеводородов с одинарной связью между атомами углерода. Кроме того, метан имеет различное применение в различных отраслях промышленности.
У него есть несколько других названий, таких как диметил и метил. Однако метан является наиболее распространенным названием, широко используемым для этого соединения. Кроме того, чтобы должным образом знать химические и физические свойства метана, необходимо знать структуру метана по Льюису, включая его связь, форму, образование и т. д.
C2H6 Молекулярная геометрия
C2H6 представляет собой sp3-гибрид. Следовательно, они создают тетраэдрическую геометрию, содержащую весь водород «H», вне плоскости, поэтому они неплоские. Более того, взглянув на структуру Льюиса C2H6, видно, что с интересующим углеродом связаны четыре атома, а неподеленные пары одновременно отсутствуют.
Согласно теории «VSEPR», электронные облака на атомах, окружающих C, будут сопротивляться друг другу. Кроме того, в результате они будут разнесены, обеспечивая тригонально-пирамидальную форму молекулы и тетраэдрическую молекулярную геометрию. Кроме того, валентный угол C2H6 будет составлять около 109,5 градусов из-за изогнутой тетраэдрической геометрии. Следовательно, трехмерная структура этана будет следующей:
Кроме того, валентный угол C2H6 будет составлять около 109,5 градусов из-за изогнутой тетраэдрической геометрии. Следовательно, трехмерная структура этана будет следующей:
Тетраэдрическая геометрия этана дает валентный угол (H-C-H или H-C-H), равный 109..5 градусов. Кроме того, длина связи С-С и С-Н составляет 153,52 пм и 109,40 пм соответственно.
C2H6 Полярность
Молекула с неравномерным распределением зарядов, приводящим к частичным положительным зарядам на одном конце и частичным положительным зарядам на другом конце, называется полярной молекулой. Если молекула полярна, она будет иметь чистый дипольный момент. Направление молекулы будет от минимального электроотрицательного атома к максимальному электроотрицательному атому. Что касается полярности, то она зависит от двух факторов:
(a) Изменение электроотрицательности атома в молекуле
(b) Несвязывающие наборы электронов в молекуле
В C2H6 существует небольшая разница в электроотрицательности между атомами водорода и атомами углерода; это означает, что связи C-H неполярны. Кроме того, отсутствуют неподеленные пары электронов. Таким образом, нет никаких изменений в появлении какого-либо толкания пар электронов за счет сил отталкивания.
Кроме того, отсутствуют неподеленные пары электронов. Таким образом, нет никаких изменений в появлении какого-либо толкания пар электронов за счет сил отталкивания.
Диаграмма молекулярных орбиталей C2H6
В C2H6 или Ch4Ch4 в процессе гибридизации происходит участие 1s-орбитали и трех р-орбиталей. Также происходит образование 4 sp3-гибридизированных орбиталей. В то время в идеальной тетраэдрической геометрии образуются четыре подобные и идентичные связи.
Кроме того, смесь атомных орбиталей помогает создать молекулярную орбиталь, которая должна иметь примерно одинаковую энергию и в то же время быть симметричной молекулярной оси.
Формирование молекулярных орбиталей
Молекулярные орбитали вырастают из разрешенной связи или взаимодействий между атомными орбиталями, которые разрешены только в том случае, если симметрии атомных орбиталей, определенные из теории групп, совместимы друг с другом. Эффективность взаимодействия атомных орбиталей легко определить по перекрытию двух атомных орбиталей, что важно, если атомные орбитали близки по силе или энергии.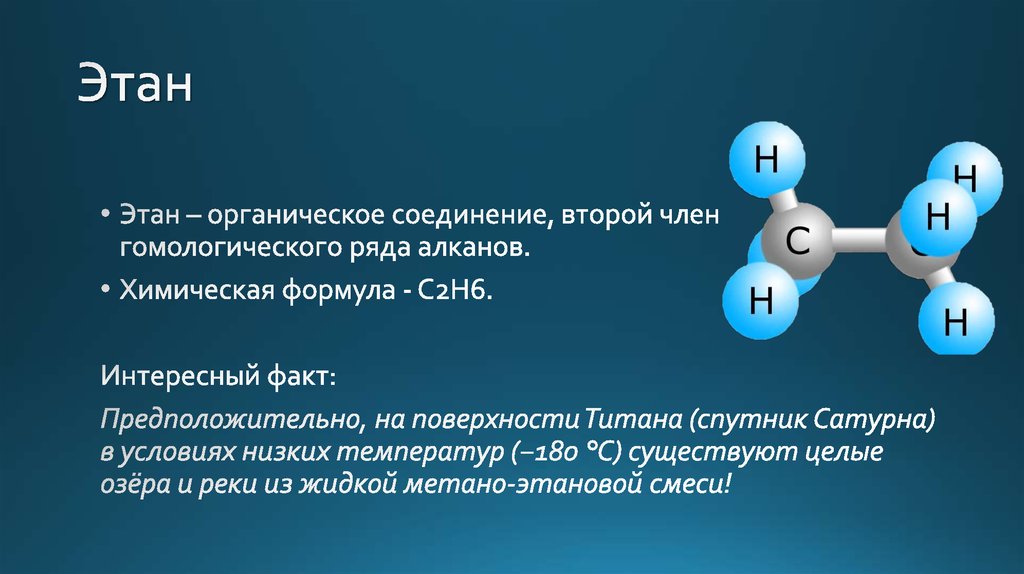




Leave A Comment