Бензол, C6H6, химические свойства, производство, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
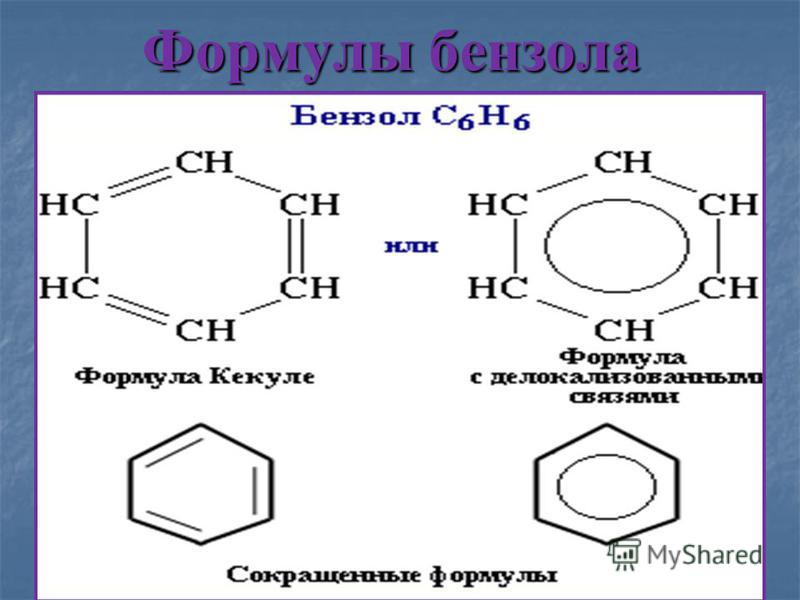
Бензол. Химические свойства
1. Реакции замещения в бензольном кольце
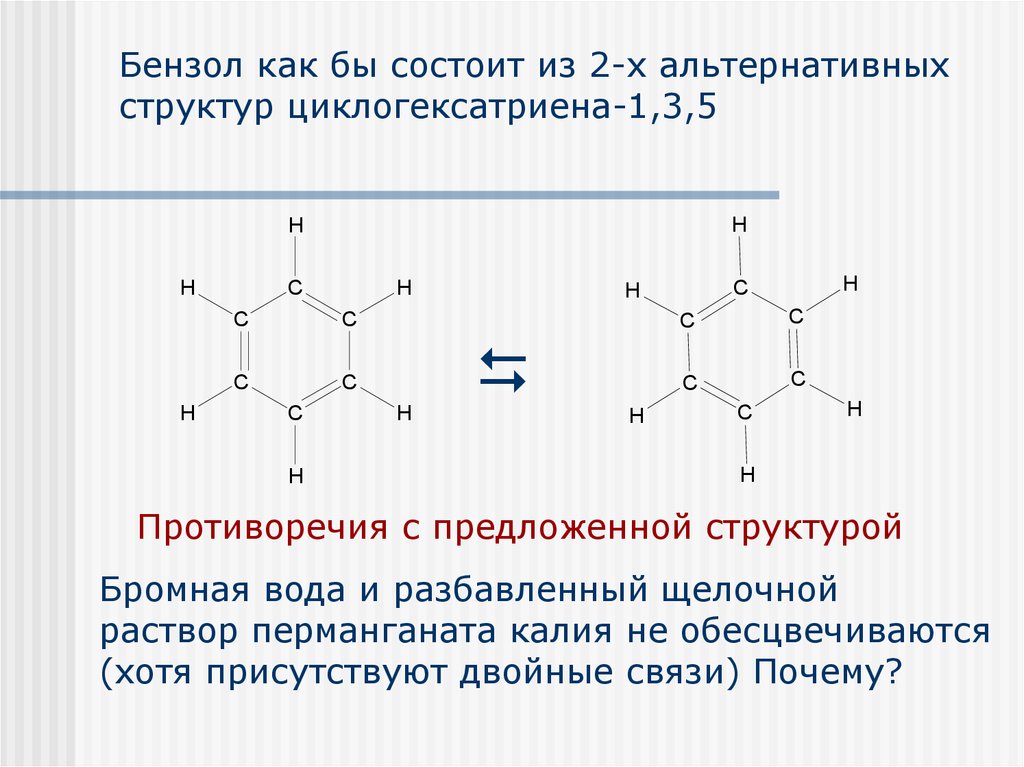
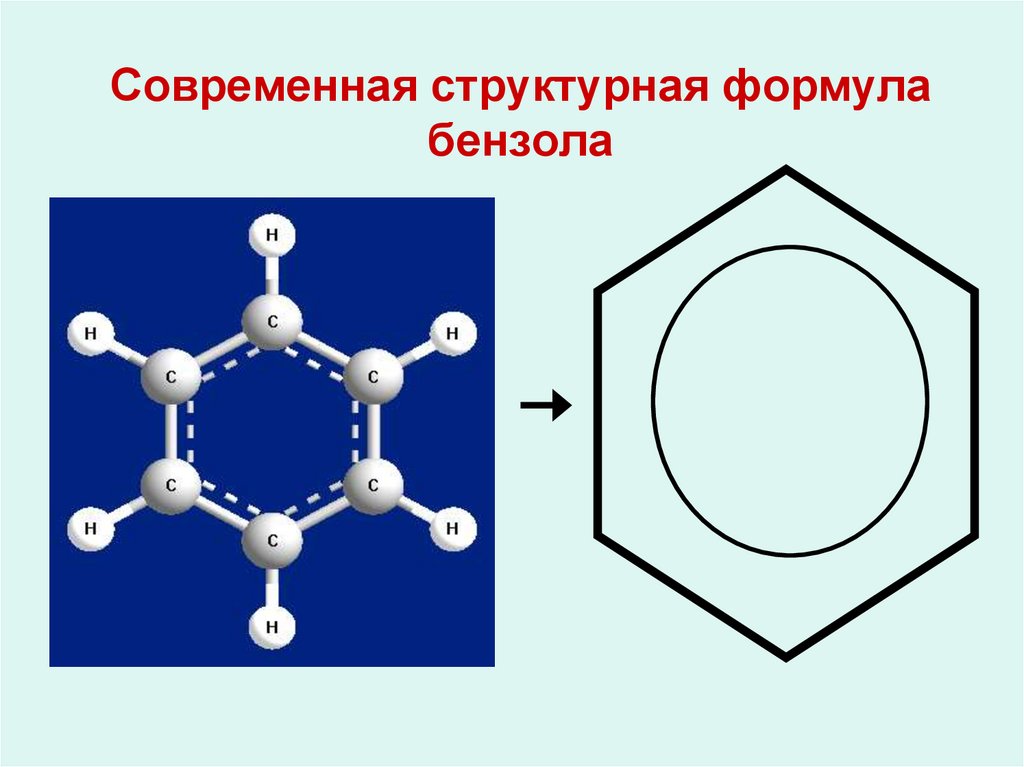
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
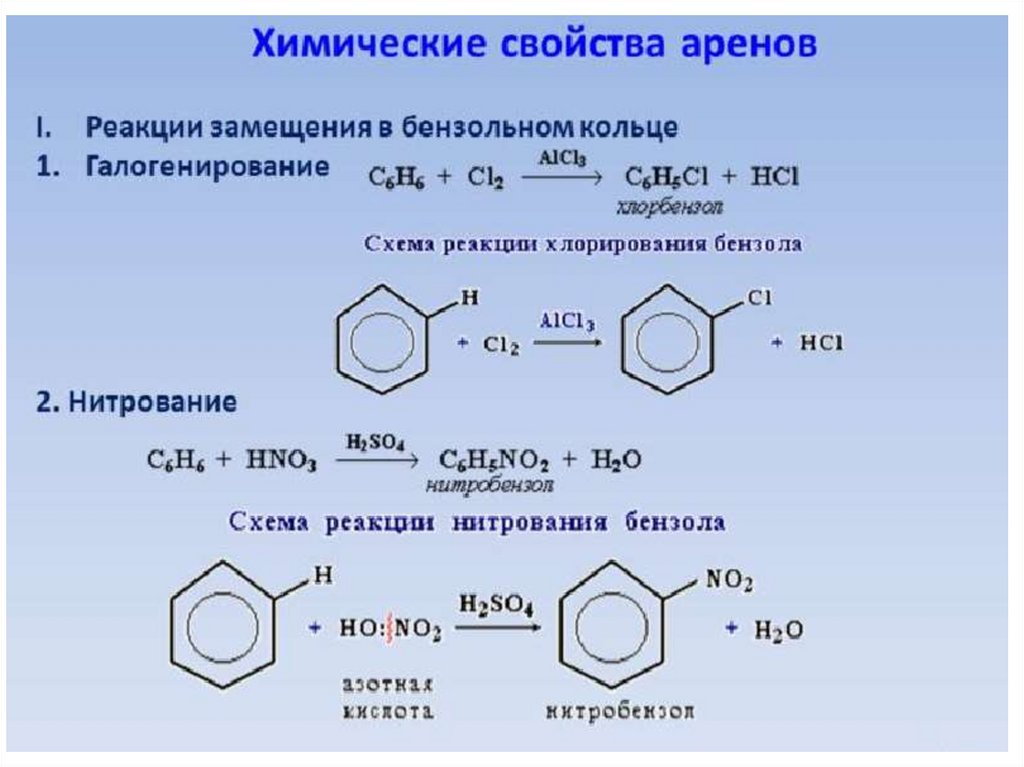
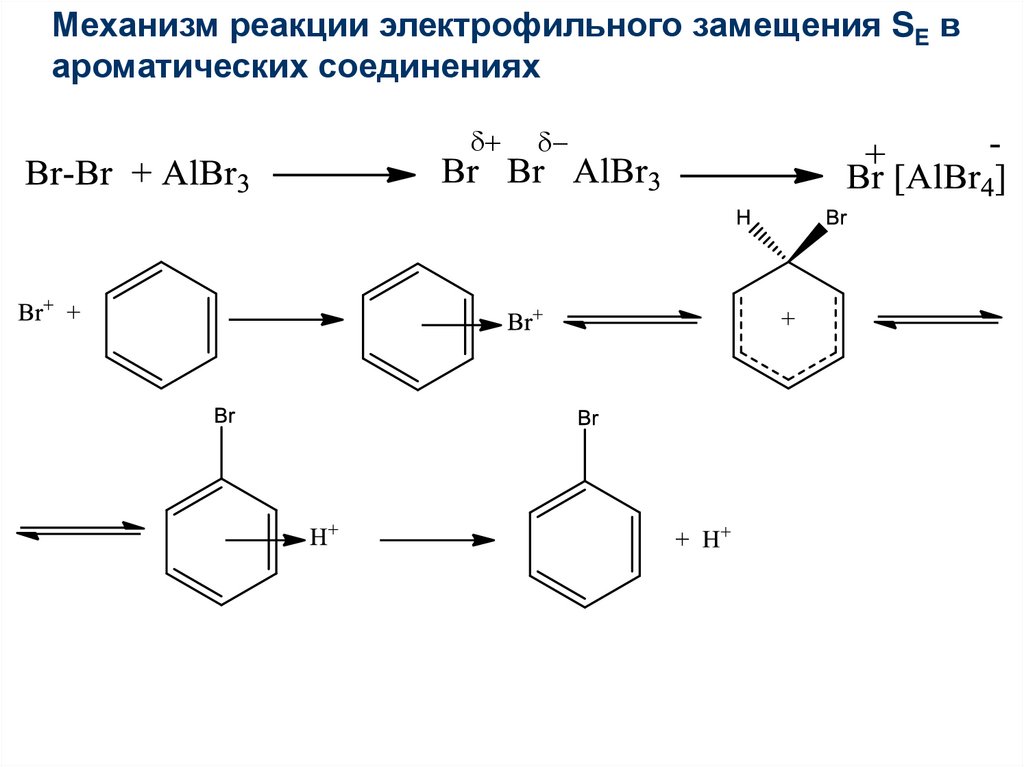
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.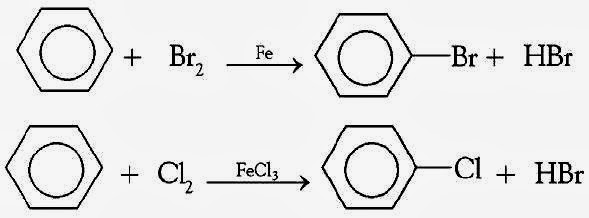
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.
Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
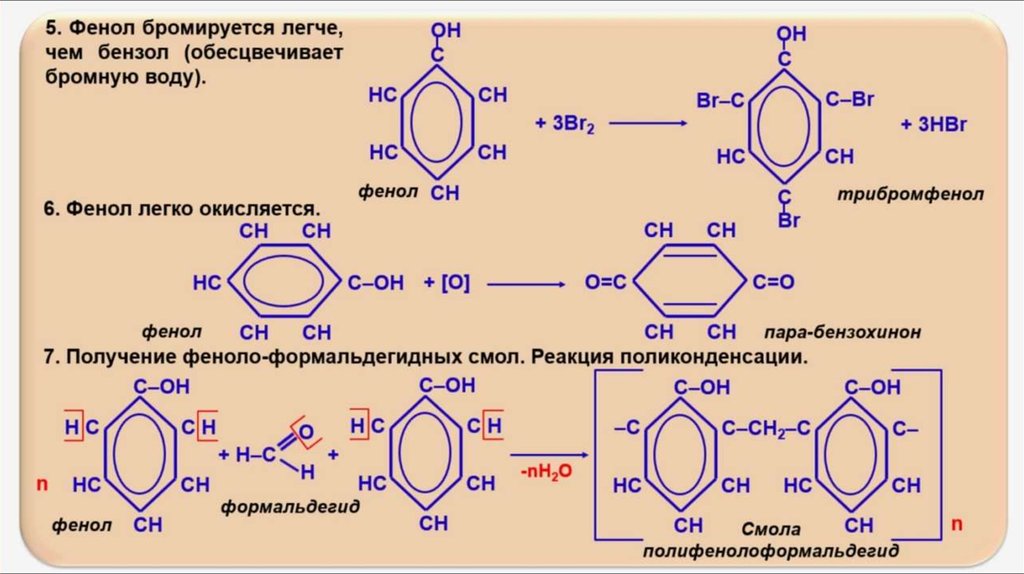
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
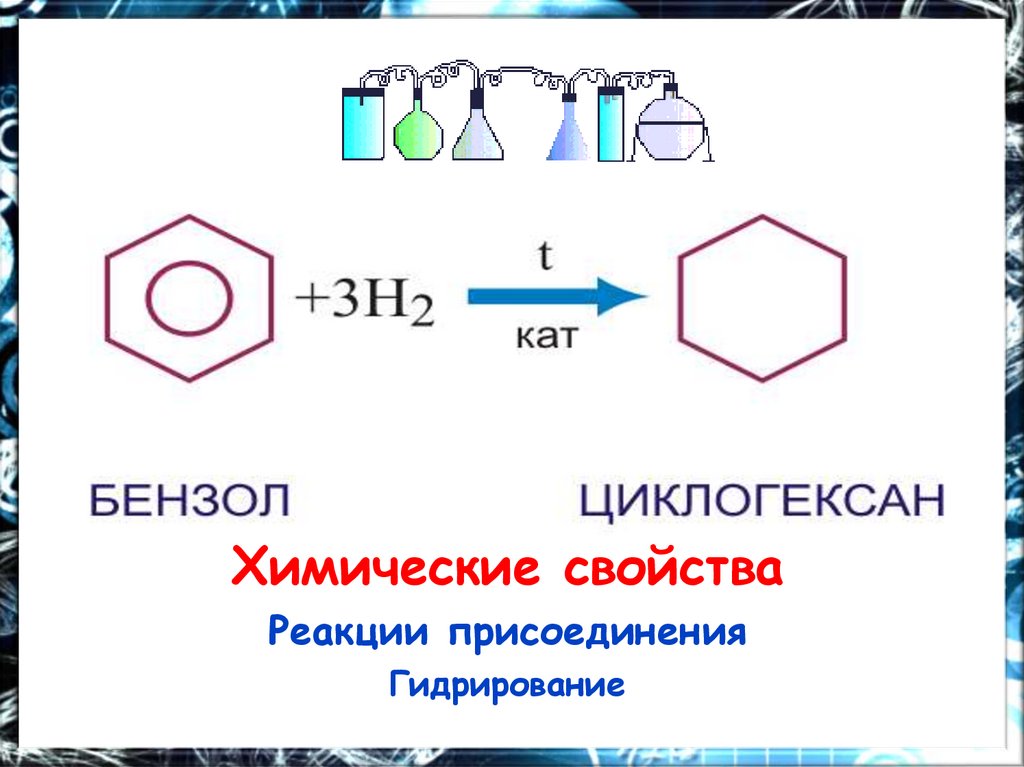
Пятое свойство в общем списке гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
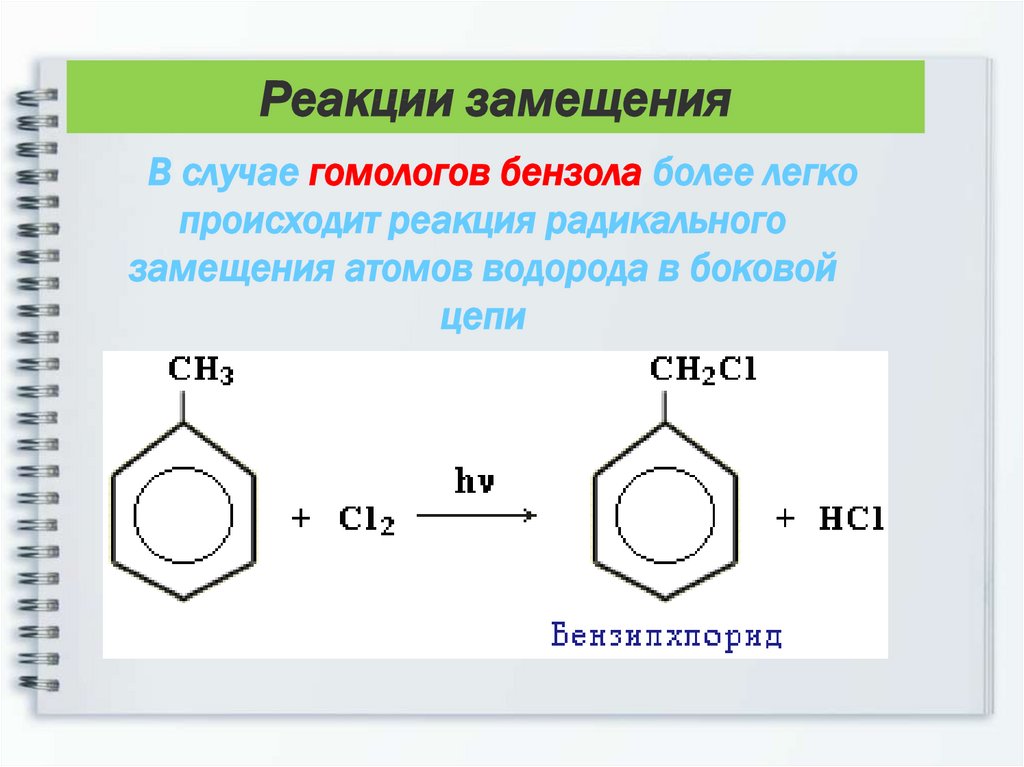
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду.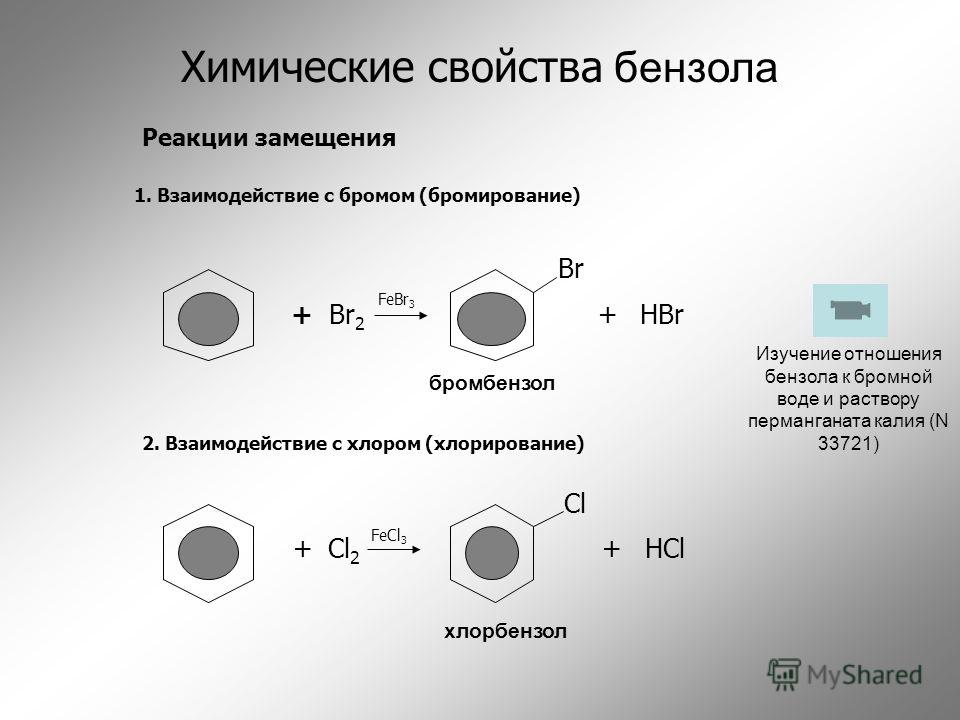 При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.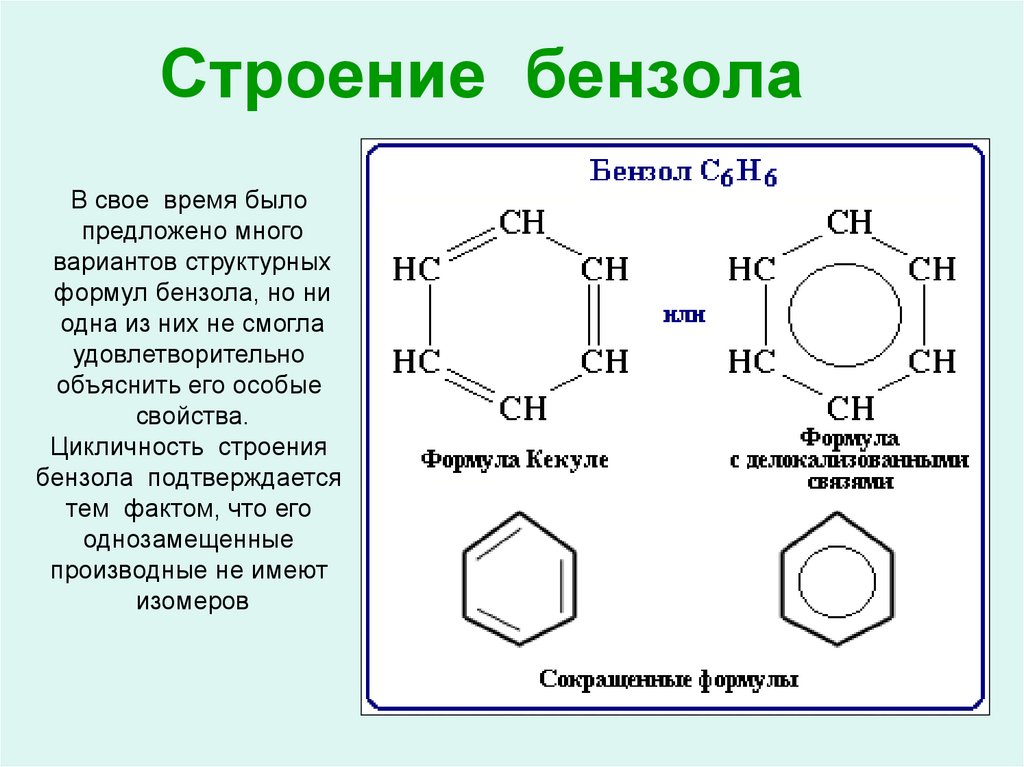
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.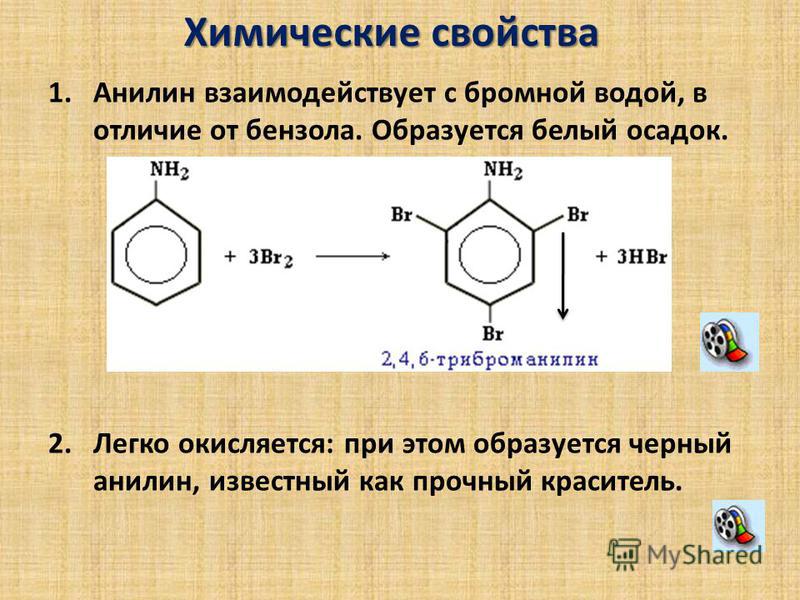
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
CDC | Факты о бензоле
Español (испанский)
Что такое бензол
- Бензол — это химическое вещество, представляющее собой бесцветную или светло-желтую жидкость при комнатной температуре. Он имеет сладкий запах и легко воспламеняется.
- Бензол очень быстро испаряется в воздухе. Его пары тяжелее воздуха и могут оседать в низинах.
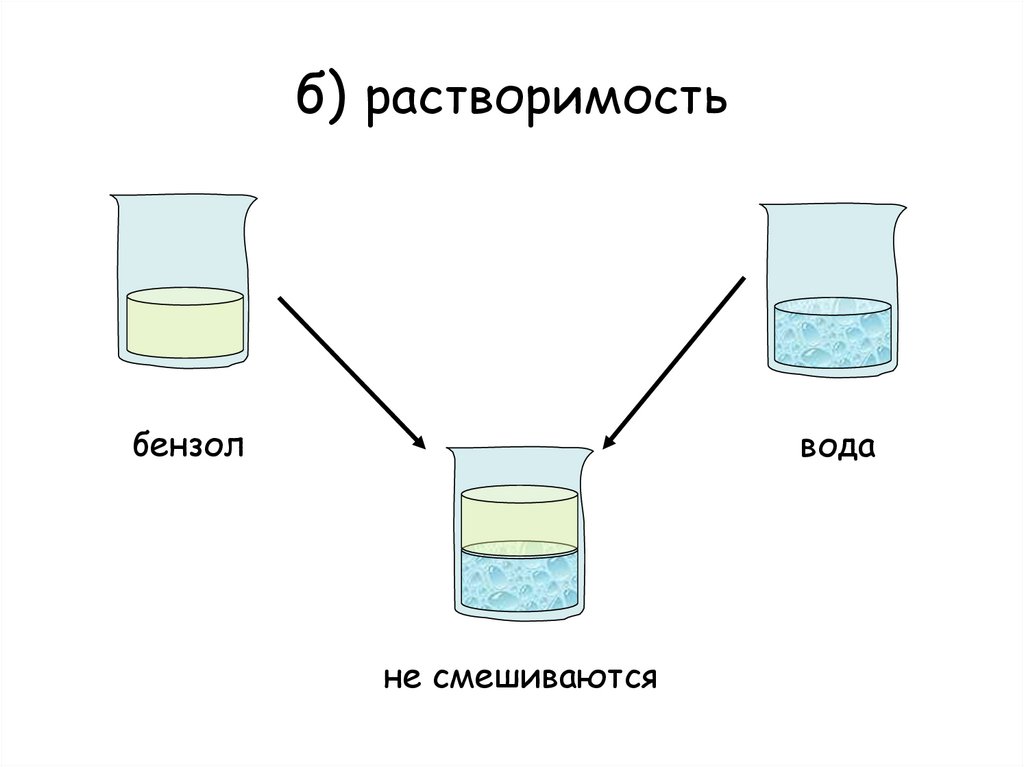
- Бензол лишь немного растворяется в воде и плавает на поверхности воды.
Где встречается бензол и как он используется
- Бензол образуется как в результате естественных процессов, так и в результате деятельности человека.

- Природные источники бензола включают вулканы и лесные пожары. Бензол также является естественным компонентом сырой нефти, бензина и сигаретного дыма. Бензол
- широко используется в США. Он входит в топ-20 химикатов по объему производства.
- Некоторые отрасли промышленности используют бензол для производства других химикатов, которые используются для производства пластмасс, смол, нейлона и синтетических волокон. Бензол также используется для производства некоторых видов смазочных материалов, каучуков, красителей, моющих средств, лекарств и пестицидов.
Как вы можете подвергнуться воздействию бензола
- Наружный воздух содержит небольшое количество бензола из-за табачного дыма, заправок, выхлопных газов автомобилей и промышленных выбросов.
- Воздух в помещении обычно содержит более высокие уровни бензола, чем наружный воздух. Бензол в воздухе помещений поступает из продуктов, содержащих бензол, таких как клеи, краски, мебельный воск и моющие средства.

- Воздух вокруг свалок опасных отходов или заправочных станций может содержать более высокие уровни бензола, чем в других местах.
- Утечки бензола из подземных резервуаров для хранения или с мест хранения опасных отходов, содержащих бензол, могут загрязнить колодезную воду.
- Люди, работающие в отраслях, производящих или использующих бензол, могут подвергаться воздействию его самых высоких концентраций.
- Основным источником воздействия бензола является табачный дым.
Как работает бензол
- Бензол действует, заставляя клетки работать неправильно. Например, это может привести к тому, что костный мозг не будет производить достаточное количество эритроцитов, что может привести к анемии. Кроме того, он может повредить иммунную систему, изменяя уровень антител в крови и вызывая потерю лейкоцитов.
- Серьезность отравления, вызванного бензолом, зависит от количества, пути и продолжительности воздействия, а также от возраста и ранее существовавшего состояния здоровья человека, подвергшегося воздействию.

Непосредственные признаки и симптомы воздействия бензола
- У людей, вдыхающих большие количества бензола, могут развиться следующие признаки и симптомы в течение нескольких минут или нескольких часов:
- Сонливость
- Головокружение
- Учащенное или нерегулярное сердцебиение
- Головные боли
- Тремор
- Путаница
- Бессознательное состояние
- Смерть (на очень высоких уровнях)
- Употребление в пищу продуктов или напитков с высоким содержанием бензола может вызвать следующие симптомы в течение от нескольких минут до нескольких часов:
- Рвота
- Раздражение желудка
- Головокружение
- Сонливость
- Судороги
- Учащенное или нерегулярное сердцебиение
- Смерть (на очень высоких уровнях)
- Если человека рвет из-за проглатывания продуктов или напитков, содержащих бензол, рвотные массы могут попасть в легкие и вызвать проблемы с дыханием и кашель.

- Прямое воздействие бензола на глаза, кожу или легкие может вызвать повреждение и раздражение тканей.
- Наличие этих признаков и симптомов не обязательно означает, что человек подвергся воздействию бензола.
Долгосрочные последствия воздействия бензола на здоровье
- Основное воздействие бензола при длительном воздействии оказывает на кровь. (Долгосрочное воздействие означает воздействие в течение года или более.) Бензол оказывает вредное воздействие на костный мозг и может вызывать снижение количества эритроцитов, что приводит к анемии. Это также может вызвать чрезмерное кровотечение и повлиять на иммунную систему, увеличивая вероятность заражения.
- У некоторых женщин, которые вдыхали высокие концентрации бензола в течение многих месяцев, наблюдались нерегулярные менструальные циклы и уменьшение размеров яичников. Неизвестно, влияет ли воздействие бензола на развивающийся плод у беременных женщин или на фертильность у мужчин.

- Исследования на животных показали низкую массу тела при рождении, замедленное формирование костей и повреждение костного мозга, когда беременные животные вдыхали бензол.
- Департамент здравоохранения и социальных служб (DHHS) установил, что бензол вызывает рак у людей. Длительное воздействие высоких концентраций бензола в воздухе может вызвать лейкемию, рак органов кроветворения.
Как вы можете защитить себя и что делать, если вы подверглись воздействию бензола
- Во-первых, если бензол попал в воздух, выйдите на свежий воздух, покинув место, где произошел выброс бензола. Переезд в место со свежим воздухом — хороший способ снизить вероятность смерти от воздействия бензола в воздухе.
- Если выброс бензола произошел снаружи, отойдите от места выброса бензола.
- Если выброс бензола произошел в помещении, выйдите из здания.
- Если вы находитесь вблизи места выброса бензола, координаторы по чрезвычайным ситуациям могут порекомендовать вам либо эвакуироваться из района, либо «укрыться на месте» внутри здания, чтобы избежать воздействия химиката.
 Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте». - Если вы считаете, что могли подвергнуться воздействию бензола, вам следует снять одежду, быстро вымыть все тело водой с мылом и как можно быстрее обратиться за медицинской помощью.
- Снятие одежды
- Быстро снимите одежду, на которой может быть бензол. Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову.
- Если вы помогаете другим людям снимать одежду, старайтесь не прикасаться к загрязненным участкам и снимайте одежду как можно быстрее.
- Мыться
- Как можно быстрее смойте бензол с кожи большим количеством воды с мылом. Мытье водой с мылом поможет защитить людей от любых химических веществ на теле.

- Если ваши глаза горят или ваше зрение затуманено, промывайте глаза простой водой в течение 10-15 минут. Если вы носите контактные линзы, снимите их после мытья рук и положите вместе с загрязненной одеждой. Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
- Как можно быстрее смойте бензол с кожи большим количеством воды с мылом. Мытье водой с мылом поможет защитить людей от любых химических веществ на теле.
- Утилизация одежды
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет. Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, ручек для инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет.
- Запечатайте пакет, а затем запечатайте этот пакет в другом пластиковом пакете. Утилизация одежды таким образом поможет защитить вас и других людей от любых химических веществ, которые могут быть на вашей одежде.

- Когда прибудут сотрудники местного или государственного департамента здравоохранения или службы экстренной помощи, сообщите им, что вы сделали со своей одеждой. Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно.
- Для получения дополнительной информации об очистке тела и утилизации одежды после выброса химикатов см. «Химические агенты: факты о личной чистке и утилизации загрязненной одежды».
- Если вы считаете, что в вашем водопроводе может быть бензол, пейте бутилированную воду, пока не убедитесь, что ваш водопровод безопасен.
- Если кто-то проглотил бензол, не пытайтесь вызвать у него рвоту или давать пить. Кроме того, если вы уверены, что человек проглотил бензол, не пытайтесь проводить сердечно-легочную реанимацию. Выполнение сердечно-легочной реанимации у человека, проглотившего бензол, может вызвать у него рвоту. Рвотные массы могут попасть в легкие и повредить их.

- Немедленно обратитесь за медицинской помощью. Наберите 911 и объясните, что произошло.
Как лечат отравление бензолом
Отравление бензолом лечат поддерживающей медицинской помощью в условиях стационара. Специфического антидота при отравлении бензолом не существует. Самое главное, чтобы пострадавшие как можно скорее обратились за медицинской помощью.
Где можно получить дополнительную информацию о бензоле
Люди могут обращаться по одному из следующих номеров:
- Региональный токсикологический центр: 1-800-222-1222
- Центры по контролю и профилактике заболеваний
- Горячая линия общественного реагирования (CDC)
- 800-CDC-ИНФО
- 888-232-6348 (TTY)
- Электронная почта: [email protected]
- Горячая линия общественного реагирования (CDC)
- Центры по контролю и профилактике заболеваний (CDC), Национальный институт безопасности и гигиены труда (NIOSH), Карманный справочник по химическим опасностям
Бензол в питьевой воде и его воздействие
Бензол (бензол)
Что такое бензол и почему он содержится в моей воде?
Бензол представляет собой летучее органическое соединение (ЛОС), прозрачную, бесцветную ароматическую жидкость без запаха и классифицируется как углеводород.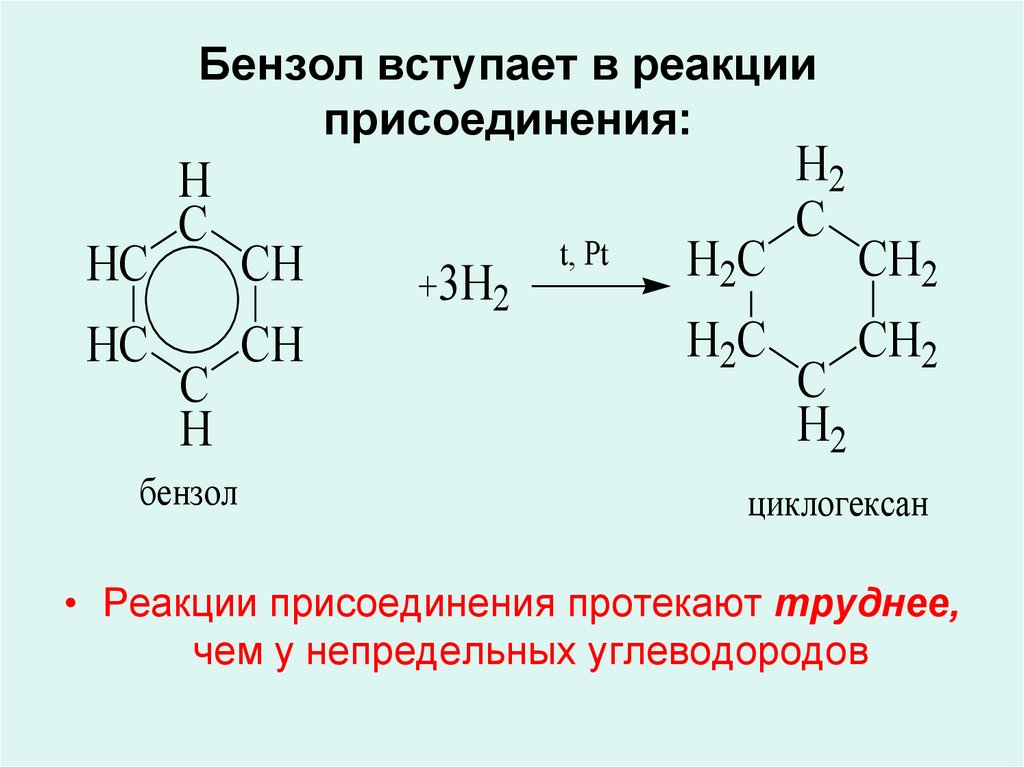 Бензол образуется в ходе промышленных процессов и используется в основном в качестве промежуточного звена для производства других химических веществ. Он также может образовываться естественным путем из-за вулканов и лесных пожаров и является естественной частью сигаретного дыма, сырой нефти и бензина. Бензол также используется в качестве растворителя в химической чистке, красках, полиграфии и т. д.
Бензол образуется в ходе промышленных процессов и используется в основном в качестве промежуточного звена для производства других химических веществ. Он также может образовываться естественным путем из-за вулканов и лесных пожаров и является естественной частью сигаретного дыма, сырой нефти и бензина. Бензол также используется в качестве растворителя в химической чистке, красках, полиграфии и т. д.
Бензол попадает в воду в результате сброса промышленных предприятий или выщелачивания из свалок и резервуаров для хранения газа.
Каковы последствия воздействия бензола на здоровье?
Краткосрочные последствия для здоровья при воздействии выше максимального уровня загрязнения (MCL) — анемия, временное расстройство нервной системы и угнетение иммунной системы. Долгосрочные последствия воздействия выше MCL бензола — это рак и хромосомные аберрации.
Регулирует ли EPA содержание бензола в воде?
Агентство по охране окружающей среды установило нулевой максимальный уровень загрязнения (MCLG) и максимальный уровень загрязнения (MCL) на уровне 5 частей на миллиард, чтобы защитить потребителей, обслуживаемых общественными системами водоснабжения, от последствий длительного хронического воздействия бензола. Штаты могут устанавливать более строгие MCLG и MCL для питьевой воды для бензола, чем EPA.
Штаты могут устанавливать более строгие MCLG и MCL для питьевой воды для бензола, чем EPA.
Удаление бензола из питьевой воды
Системы и картриджи, содержащие активированный уголь, являются наиболее эффективным средством для очистки воды в домашних условиях.
Фильтры для воды обратного осмосаФильтры для воды под раковинуНастольные фильтры для водыФильтры для воды для всего домаСистемы и картриджи EverpureКартриджи с угольным блокомКартриджи с гранулированным активированным углемКартриджи для удаления мышьяка Aries Filter Works
Ищите эту печать:
NSF 53, 58 или
62 Сертифицировано
С сайта NSF.org
Стандарт NSF/ANSI 53: Установки для очистки питьевой воды — воздействие на здоровье
Обзор: Стандарт 53 касается систем точек использования (POU) и точек входа (POE), предназначенных для снижения содержания конкретных вредных для здоровья загрязняющих веществ, таких как Cryptosporidium, Giardia, свинец, летучие органические химические вещества (VOCs), МТБЭ.(метил-трет-бутиловый эфир), которые могут присутствовать в общественной или частной питьевой воде.
Стандарт NSF/ANSI 58: Системы очистки питьевой воды с обратным осмосом
Обзор: Этот стандарт был разработан для систем очистки с обратным осмосом (RO) в месте использования (POU). Эти системы обычно состоят из предварительного фильтра, мембраны обратного осмоса и постфильтра. Стандарт 58 включает заявления об уменьшении загрязняющих веществ, которые обычно обрабатываются с использованием обратного осмоса, включая фторид, шестивалентный и трехвалентный хром, общее количество растворенных твердых веществ, нитраты и т. д., которые могут присутствовать в общественной или частной питьевой воде.
Стандарт NSF/ANSI 62: Системы дистилляции питьевой воды
Обзор: Стандарт 62 распространяется на системы дистилляции, предназначенные для уменьшения содержания определенных загрязняющих веществ, включая общее содержание мышьяка, хрома, ртути, нитратов/нитритов и микроорганизмов в водопроводах общественного и частного водоснабжения.

 Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
 (метил-трет-бутиловый эфир), которые могут присутствовать в общественной или частной питьевой воде.
(метил-трет-бутиловый эфир), которые могут присутствовать в общественной или частной питьевой воде.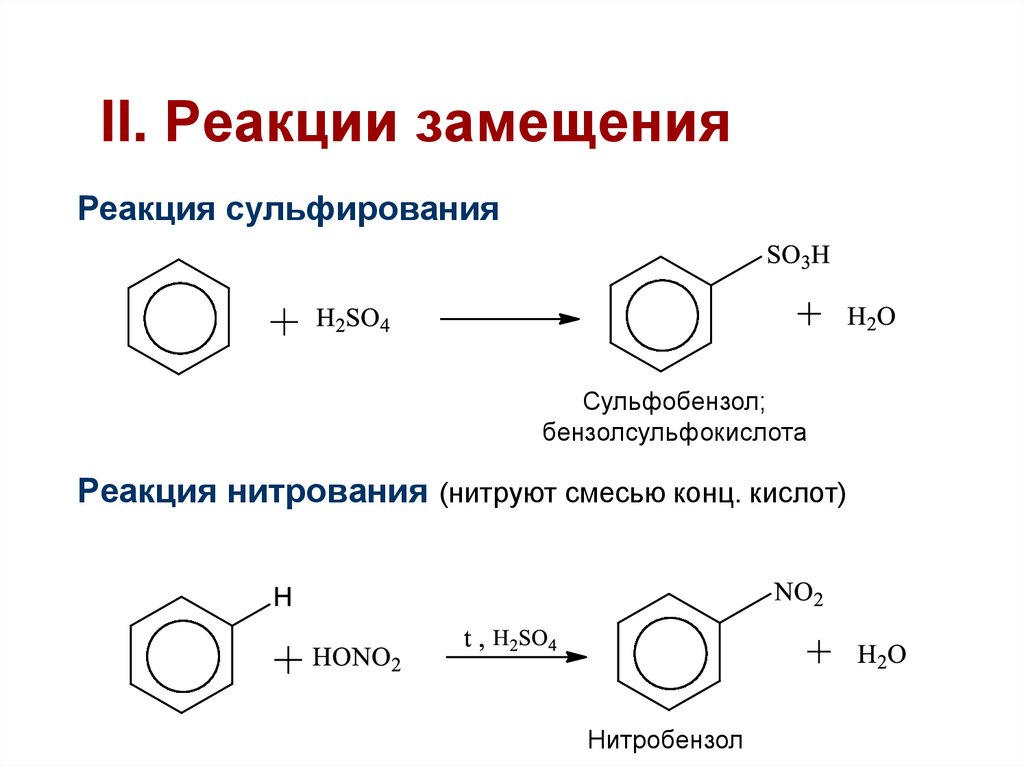
Leave A Comment