В.А. Мухин, Л.Г. Варепо, M.B. Mухина. МОДЕЛИРОВАНИЕ ПРОЦЕССА КИСЛОТНОГО ТРАВЛЕНИЯ…
В.А. Мухин, Л.Г. Варепо, M.B. Mухина. МОДЕЛИРОВАНИЕ ПРОЦЕССА КИСЛОТНОГО ТРАВЛЕНИЯ…| Вестник ОмГУ | Выпуск | Тематика | Литература |
| Вестник Омского университета, 1996, Вып. 1. С. 52-53. © Омский государственный университет, 1996 |
УДК 655.224.261.1:542:001.891.57 |
В.А. Мухин, Л.Г. Варепо, M.B. Mухина
Омский государственный университет, кафедра неорганической химии,
644077 Омск, пр. Мира, 55-А
Получена 22 марта 1996 г.
| By methods of rotating disc electrode there was researched the etchingrate of zinc in 0,7 m nitric acid with presence of the number organicsubstances. The best quality of the selective deep etching was ensuredby addition the mixture of thiodiglycol acid and benzimidazol. There wasdeduced the equation, descripted the researched process. |
При изготовлении клише в полиграфии используется размерное травление цинковых пластин, причем особенно важно исключить подтравливание под очко печатного элемента, обеспечив селективную защиту с помощью ингибирующих добавок. Для практики представляет интерес установление зависимости глубины травления от условий и концентрации добавок, создание математической модели процесса.
С этой целью на вращающемся дисковом электроде проведено
исследование в травильном растворе, основу которого составляла 0,7 М
азотная кислота. Рабочей поверхностью служил диск из сплава цинка МЦЦ,
запрессованный во фторопласт-4. Количество цинка,перешедшего в раствор,
определялось гравиметрически. Опыты проводились в условиях, моделирующих
процессы коррозионного взаимодействия травящих растворов с различными
участками цинковых пластин в процессе формообразования изделий. Выбор
моделирующих условий производился с учетом лимитирующих стадий процесса
коррозии. В данном случае моделирование проводили аналогично
процессу массопереноса. Согласно работе [1], имеется модельная
система типа:
Рабочей поверхностью служил диск из сплава цинка МЦЦ,
запрессованный во фторопласт-4. Количество цинка,перешедшего в раствор,
определялось гравиметрически. Опыты проводились в условиях, моделирующих
процессы коррозионного взаимодействия травящих растворов с различными
участками цинковых пластин в процессе формообразования изделий. Выбор
моделирующих условий производился с учетом лимитирующих стадий процесса
коррозии. В данном случае моделирование проводили аналогично
процессу массопереноса. Согласно работе [1], имеется модельная
система типа:
где Ф — формный материал, цинк; Р — растворитель, вода;
Т — травящее вещество, азотная кислота; Аi, Вi — ингибирующие
добавки.
На основании проведенных опытов было установлено, что кислоты фталевая
и диэтилентриаминпентауксусная, снижая скорость травления,не исключают
подтравливания. Наилучшее влияние на избирательность травления оказывают
такие органические добавки, как уротропин (УТ), тиодигликолевая кислота
(ТДГК), бензимидазол (БИА), а также смесь ТДГК и БИА (рис.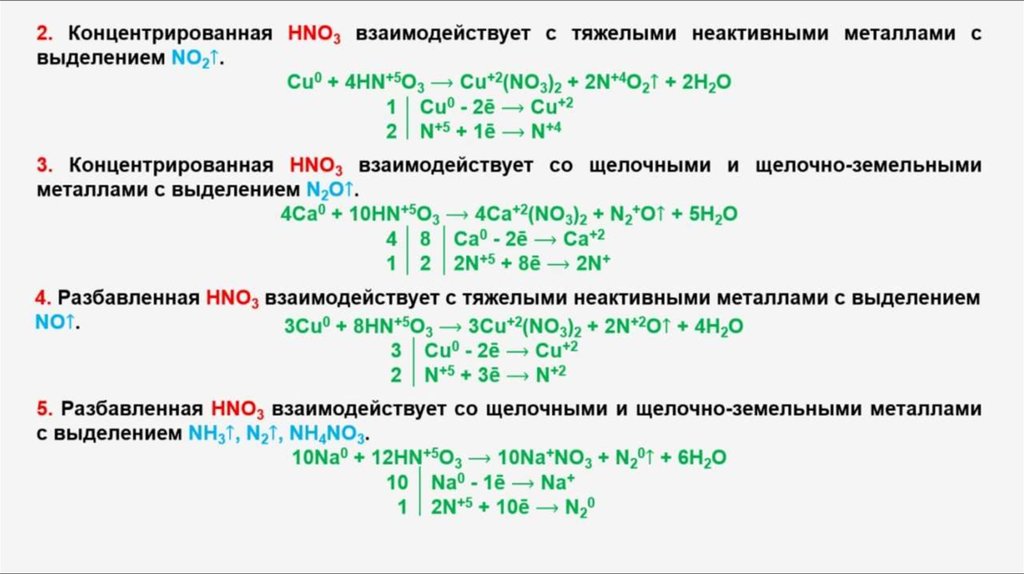
Кинетика травления цинка в растворах 0,7 М азотной
кислоты при температуре 30 oC и скорости вращения
диска 42 рад/с в присутствии добавок (моль/л): 1 — без добавок;
2 — УТ, 0,05; 3 — ТДУК, 0,07; 4 — БИА, 0,05;
5 — ТДУК, 0,1, БИА, 0,05.
На основании экспериментальных данных выведено уравнение, описывающее данный процесс и позволяющее рассчитать глубину травления в зависимости от заданных условий растворения металла и концентрации ингибиторов:
где h — глубина травления металла; V0 -скорость травления без ингибитора; C — концентрация ингибитора; b — константа равновесия десорбции ингибитора;
Полученное уравнение может служить ориентиром для оптимизации состава раствора и в некоторой мере позволяет управлять процессом размерного травления металла.
Литература
| [1] | Наумов В. А. Об адсорбционном механизме ингибирования
процессов травления при изготовлении печатных форм.
Фотометрические процессы и материалы в полиграфии. М., 1984. С.140. А. Об адсорбционном механизме ингибирования
процессов травления при изготовлении печатных форм.
Фотометрические процессы и материалы в полиграфии. М., 1984. С.140.
|
| [2] | Hinsberg O. Ber., 1910. Т.43. С.901. |
| [3] | Крылов В.С., Семина Е.В. и др. Об одной модели процесса травления форм высокой печати // Электрохимия. 1982. Т.18. С.493. |
Азотная кислота и ее соли 9 класс онлайн-подготовка на Ростелеком Лицей
Физические свойства азотной кислоты
В зависимости от степени разбавления водой, т. е. от концентрации, физические свойства азотной кислоты будут различны.
Безводная свежеполученная азотная кислота – бесцветная, похожая на воду жидкость с едким запахом, смешивающаяся с водой в любых соотношениях. При хранении под воздействием света или температуры азотная кислота частично разлагается с выделением оксида азота (IV) – бурого газа:
При хранении под воздействием света или температуры азотная кислота частично разлагается с выделением оксида азота (IV) – бурого газа:
4HNO3 = 4NO2 + O2 + 2H2O
Из-за выделяющегося кислорода тлеющая лучинка над нагретой азотной кислотой вспыхивает. Бурый газ растворяется в кислоте и окрашивает ее в желтый цвет. Вещества, содержащие белок, при попадании на них концентрированной азотной кислоты окрашиваются в желтый цвет. Поэтому на коже рук азотная кислота оставляет желтые пятна. Чтобы этого избежать, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Взаимодействие азотной кислоты с металлами
Азотная кислота относится к сильным неорганическим кислотам. Поэтому для нее характерны все общие свойства кислот: изменение окраски индикаторов, взаимодействие с основными и амфотерными оксидами, основаниями и солями. Но азотная кислота – еще очень сильный окислитель, поэтому по-особому реагирует с металлами.
Характер взаимодействия азотной кислоты с металлами достаточно сложен. Эти окислительно-восстановительные реакции не относятся к типу замещения, и состав продуктов таких реакций очень разнообразен. Причем, азотная кислота, даже разбавленная, способна взаимодействовать с металлами, стоящими в ряду активности правее водорода.
Только золото, платина, осмий, иридий и тантал не взаимодействуют с азотной кислотой ни при каких условиях.
Некоторые активные металлы, например алюминий, не реагируют с азотной кислотой из-за плотной оксидной пленки, образующейся на поверхности металла. Для того чтобы показать активность алюминия, опустим алюминиевую проволоку в раствор соляной кислоты. Алюминий энергично взаимодействует с соляной кислотой с выделением водорода.
2Al + 6HCl = 3H2↑ + 2AlCl3
Затем эту же проволоку опускаем в концентрированную азотную кислоту. Тотчас же на поверхности алюминия образуется тончайшая оксидная пленка, которая препятствует взаимодействию металла с кислотой.
В большинстве реакций концентрированной азотной кислоты с металлами продуктом восстановления азотной кислоты будет оксид азота (IV). Например, при взаимодействии железа с концентрированной азотной кислотой при нагревании образуются нитрат железа (III), оксид азота (IV) и вода:
Fe + 6HNO3 (конц.) = Fe(NO3)3 + 3NO2↑ + 3H2O
Коэффициенты в подобных реакциях расставляют с помощью метода электронного баланса.
Проведем эксперимент. Пронаблюдаем, как реагирует разбавленная и концентрированная азотная кислота с металлами. Приготовим две пробирки с раствором азотной кислоты. Положим в первую цинк, во вторую – медь.
Цинк реагирует с сильно разбавленной азотной кислотой с выделением аммиака.
4Zn + 9HNO3 = NH3↑ + 4Zn(NO3)2 + 3H2O
Влажная лакмусовая бумажка синеет у горлышка пробирки, указывая на присутствие аммиака. Медь реагирует с раствором азотной кислоты с выделением монооксида азота.
3Cu + 8HNO3 = NO↑ + 3Cu(NO3)2 + 4H2O
Концентрированная азотная кислота – еще более сильный окислитель. В пробирки с концентрированной азотной кислотой поместим цинк и медь. Цинк и медь бурно реагируют с концентрированной азотной кислотой с образованием растворимых солей и выделением бурого газа – диоксида азота (рис. 1).
Zn + 4HNO3 = 2NO2↑ + 2H2O + Zn(NO3)2
Cu + 4HNO3 = 2NO2↑ + 2H2O + Cu(NO3)2
Рис. 1. Взаимодействие меди (слева) и цинка (справа) с концентрированной азотной кислотой
При взаимодействии с большинством металлов концентрированная азотная кислота восстанавливается до диоксида азота.
Нитраты
Соли азотной кислоты называются нитратами. Кроме того, соли азотной кислоты со щелочными металлами, кальцием и ионом аммония называются селитрами. Например, NH4NO3 – аммиачная селитра.
Например, NH4NO3 – аммиачная селитра.
Все нитраты хорошо растворимы в воде и термически неустойчивы. Все они разлагаются при нагревании с выделением кислорода. Причем, в зависимости от катиона, продукты разложения могут различаться.
При термическом разложении нитрата калия преимущественно образуются нитрит калия и кислород:
2KNO3 = 2KNO2 + O2↑
При термолизе нитрата меди (II) образуются оксид меди (II), диоксид азота и кислород:
2Cu(NO3)2 = 2CuO + 4NO2 + O2↑
Применение азотной кислоты
Азотная кислота – многотоннажный продукт химической промышленности. Она находит широкое применение для получения красителей, взрывчатых веществ, азотных удобрений и лекарств.
В лабораторной практике азотная кислота и особенно ее смесь с соляной (так называемая царская водка) используются для перевода в растворимое состояние металлов, не растворимых в других кислотах.
Список литературы
- Оржековский П. А. Сборник задач и упражнений по химии: 9-й кл.: к учебнику П. А. Оржековского и др. «Химия. 9 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007.
- Оржековский П. А. Химия: 9-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013 (§24).
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.

Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
Домашнее задание
с. 160 №№ 5, 7 из учебника П. А. Оржековского «Химия: 9-й класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
неорганическая химия — Уравновешивание окислительно-восстановительной реакции цинка и горячей разбавленной азотной кислоты
$\begingroup$
Мне нужно уравновесить следующую реакцию:
$$\ce{Zn + HNO3 ->
Я присвоил все степени окисления:
$$\ce{\ overset{0}{Zn} + \overset{+1}{H}\overset{+5}{N}\overset{-2}{O_3}\longrightarrow \overset{2+}{Zn}(\overset{ +5}{N}\overset{-2}{O_3})2 +\overset{-3}{N}\overset{+1}{H_4}\overset{+5}{N}\overset{-2 }{O_3} +\overset{+1}{h3}\overset{-2}{O}},$$ 9{2+} + 2 e-}$$
— это одна полуреакция, а как насчет другой? Поскольку нитрат аммония имеет атомы азота в двух разных степенях окисления, что мне с ними делать? Я добавляю их, чтобы увидеть, сбалансирован азот или нет?
- неорганическая химия
- редокс
- водный раствор
- переходные металлы
- пниктоген
2
$\begingroup$
Вычисленная вами степень окисления $\ce{Zn}$ неверна. Правильная степень окисления $\ce{Zn}$ $+2$, так как он связан с двумя моно-отрицательно заряженными ионами $\ce{NO3-}$.
Правильная степень окисления $\ce{Zn}$ $+2$, так как он связан с двумя моно-отрицательно заряженными ионами $\ce{NO3-}$.
Таким образом, несбалансированная реакция с правильными степенями окисления будет:
$$\ce{\overset{0}{Zn} + \overset{+1}{H}\overset{+5}{N}\overset{ -2}{O_3}\longrightarrow \overset{+2}{Zn}(\overset{+5}{N}\overset{-2}{O_3})2 +\overset{-3}{N}\overset {+1}{H_4}\overset{+5}{N}\overset{-2}{O_3} +\overset{+1}{h3}\overset{-2}{O}} $$ 9{2+} + Nh5+ + 3h3O}\\\\$$
Теперь добавление к ионной реакции девяти ионов-спектаторов $\ce{NO3-}$ дает нам стандартную молекулярную реакцию.
$$\ce{4Zn + 10HNO3 -> 4Zn(NO3)2 + Nh5NO3 + 3h3O}\\\\$$
Что вы узнали из этого?
Всегда старайтесь записывать полуэлементную реакцию в ионной форме и включать только те ионы, которые претерпевают изменение степени окисления. Сначала не беспокойтесь о зрителях. После того, как вы сбалансируете уравнение в ионной форме, приведите его к молекулярной форме, добавив необходимые ионы.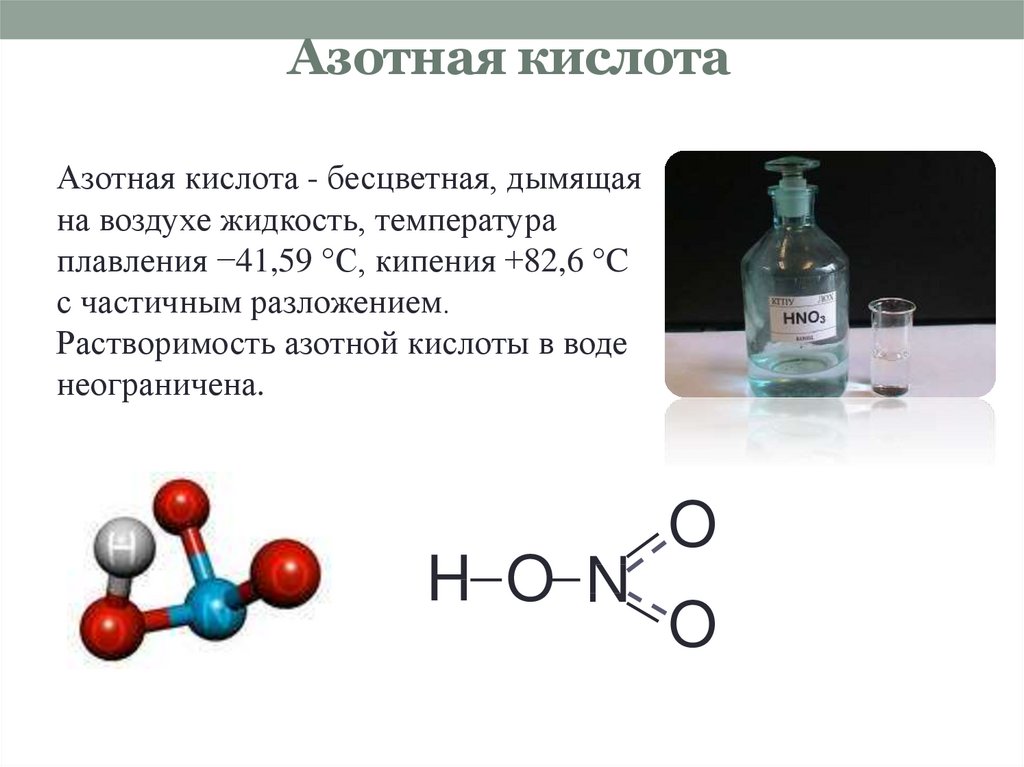 Идентификация окисляющих и восстановительных видов является ключом.
Идентификация окисляющих и восстановительных видов является ключом.
$\endgroup$
0
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Нейтрализация азотной кислотой цинкового покрытия перед хромированием
Где мир собирается для
гальванопокрытия, анодирования и отделки Вопросы и ответы с 1989 г.
——
2007
Привет друзья,
Это Мария Радж из Сингапура. Я работаю инженером-технологом в гальванической компании.
Выполняем щелочное цинкование с синим, желтым и черным хроматированием. В настоящее время азотная кислота (0,5-1%) используется для нейтрализации деталей перед преобразованием хромата. Есть ли для этого какая-то особая причина? Другие кислоты, такие как HCl или серная, могут быть использованы для той же цели?
У меня есть некоторые основные идеи о трехвалентных хроматах. Сам хромат содержит азотную кислоту, если я не ошибаюсь. Так что для нейтрализации щелочного цинка используют азотную кислоту. Но можно ли использовать азотную кислоту для нейтрализации нашего черного хромата, который представляет собой химическое вещество на основе шестивалентного хрома перед хромированием? Он также содержит нитрат серебра. Наш поставщик рекомендовал использовать серную кислоту для корректировки pH.
Наш поставщик рекомендовал использовать серную кислоту для корректировки pH.
Мои вопросы:
1. В чем необходимость предварительной обработки кислотой (азотной кислотой)? Помимо нейтрализации, есть ли за этим какая-то химия?
2. Могу ли я использовать другие кислоты для предварительного погружения перед хроматированием?
3. Могу ли я использовать для черного хроматирования серную кислоту вместо азотной?
Пожалуйста, помогите мне с подходящими ответами или ссылками. Большое спасибо за любые рекомендации, ссылки или помощь
с благодарностью,
Мария Радж
Сотрудник цеха гальванических покрытий — Сингапур
2007
Привет!
Это Картик из Бангалора. В самом вашем вопросе есть ответ. Это азотная кислота для блеска, чтобы нейтрализовать щелочь. Тогда химическое покрытие для покрытия Cr также является основанием азотной кислоты. Поэтому мы используем погружение в азотную кислоту перед нанесением покрытия Cr и во избежание загрязнения другими кислотами.
Продолжайте в соответствии с процедурой, не выполняйте RD для этого процесса. Я провел несколько исследований и разработок по нему. Но я потерпел неудачу.
Хорошего дня
П. КАРТИКЕЯН
— Бангалор, Карнатака, Индия
2007
Уважаемая Мария Рай,
Иногда азотная кислота отвердевает пленку отбеливателя, а не удаляет ее полностью на деталях, полученных из гальванических ванн на основе хлорида.
Если ваш поставщик попросил вас использовать вместо нее серную кислоту, для этого должна быть веская причина.
Если вы используете шестивалентный черный хромат, используйте промывку после серной и последующую окунание в очень разбавленную азотную кислоту, так как азотная кислота безопаснее для пассивации Hex-черного.
Khzem Vahaanwala
Saify Ind
Бангалор, Карнатака, Индия
2007
Я думаю, вы обнаружите, что ваш черный хромат основан на формуле, в которой нет азотной кислоты, за исключением небольшого количества нитрата в нитрате серебра. Эти составы фактически представляют собой оливково-серый хромат, к которому добавлено серебро для придания черного цвета, а азотная кислота является загрязнителем 9.0003
Эти составы фактически представляют собой оливково-серый хромат, к которому добавлено серебро для придания черного цвета, а азотная кислота является загрязнителем 9.0003
Джеффри Уайтлоу
— Порт Мельбурн, Австралия
2007
Храните хлориды вдали от серебра, содержащего черный хромат!
Robert H Probert
Robert H Probert Technical Services
Гарнер, Северная Каролина
нар.
(Здесь нет «мертвых тем»! Если эта страница в настоящее время не находится на горячей линии, ваши вопросы, ответы или комментарии восстановят ее)
Вопрос, ответ или комментарий в ЭТОЙ теме -или- Начать НОВУЮ тему
Отказ от ответственности: На этих страницах невозможно полностью диагностировать проблему отделки или опасность операции. Вся представленная информация предназначена для общего ознакомления и не является профессиональным мнением или политикой работодателя автора.


Leave A Comment