Серебра оксид, аммиачный раствор — Справочник химика 21
Какие из указанных ниже алкинов будут реагировать с аммиачным раствором оксида серебра 1) пропин, 2) 4-метилпентин-2, 3) 2-метилгексин-З [c.31]Окисление альдегидной группы оксидом серебра в аммиачном растворе (реакция серебряного зеркала ) [c.286]
Активно протекает еще одна реакция терминальных алкинов — с аммиачным раствором оксида серебра [c.127]
Способна ли сахароза к таутомерии Проявляет ли мутаротацию В чем сходство и в чем различие сахарозы сравнительно с мальтозой в следующих химических свойствах 1) отношение к гидролизу 2) отношение к окислению реактивом Фелинга или аммиачным раствором оксида серебра 3) образование гликозидов при действии спиртов в присутствии НО 4) способность образовывать простые и сложные эфиры. [c.71]
Опыт № 1.
Напишите уравнения взаимодействия муравьиной кислоты 1) с серной кислотой, 2) с аммиачным раствором оксида серебра. [c.68]
Б ) Из технического карбида кальция массой 7,5 г, массовая доля примесей в котором равна 4%, получили ацетилен. Газ был превращен в альдегид по реакции Кучерова. Рассчитайте массу серебра, выделившегося при взаимодействии всего полученного альдегида с аммиачным раствором оксида серебра. [c.282]
Два кислородсодержащих органических соединения различаются по составу только на два атома водорода. Одно из них вступает в реакцию с натрием и уксусной кислотой и не реагирует с оксидом серебра (в аммиачном растворе) другое, наоборот, не вступает в реакции с натрием и уксусной кислотой, но реагирует с оксидом серебра (в аммиачном растворе). Предложите возможные структуры веществ и напишите уравнения реакций.
Муравьиная кислота — сильный восстановитель выделяет серебро из аммиачного раствора оксида серебра (с. 153) и обладает сильным бактерицидным действием. Ее термостойкость невысока при нагревании под влиянием катализаторов она разлагается с образованием либо оксида углерода (И), либо оксида углерода (IV)
В тщательно вымытую пробирку наливают аммиачный раствор оксида серебра и добавляют несколько капель ацетальдегида. Пробирку помещают в баню с горячей водой. Через некоторое время на стенках образуется слой серебра ( серебряное зеркало ). Эта реакция является качественной на альдегиды. Попробуйте провести подобную реакцию с ацетоном. Объясните, почему ацетон не восстанавливает серебро. [c.56]
Обнаружение альдегидов. 1. Одна из характерных реакций альдегидов— восстановление оксида серебра в аммиачном растворе [c.285]
Алкины, содержащие тройную связь на краю цепи К—С СН, проявляют очень слабые кислотные свойства.
Одной из характерных реакций альдегидов является реакция восстановления оксида серебра в аммиачном растворе. Основной реактив — аммичный раствор окиси серебра — готовят, прибавляя к водному раствору нитрата серебра раствор аммиака. Сначала образуется осадок, который затем растворяется в избытке аммиака с образованием аммиачного комплекса
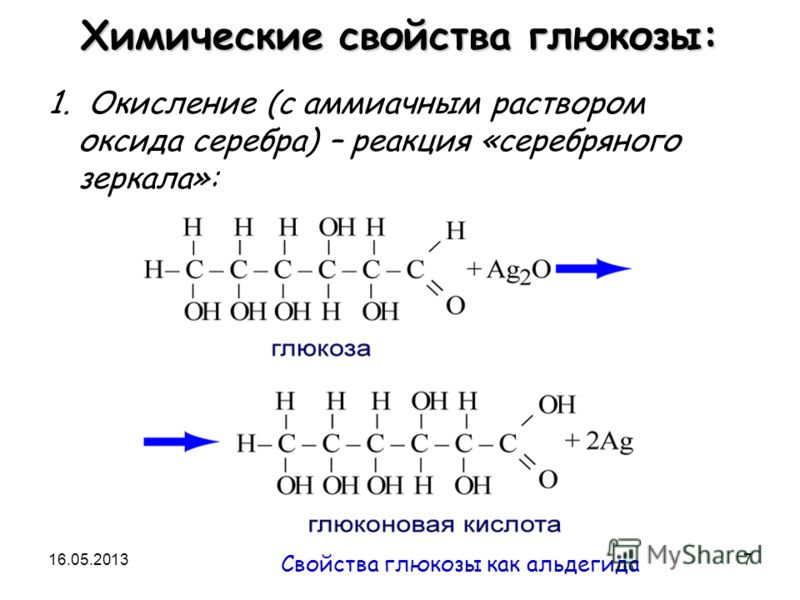
Число гидроксильных групп в молекуле глюкозы выяснил в своих работах, выполненных в конце 60-х годов прошлого столетия, А. А. Колли. Он доказал, что в молекулу глюкозы входят пять гидроксильных групп. Шестой кислородный атом, очевидно, должен входить в состав альдегидной группы, поскольку глюкоза обладает способностью выделять металлическое серебро из аммиачного раствора оксида серебра (реакция серебряного зеркала) или осуществлять другие реакции восстановления.
 О наличии альдегидной группы свидетельствует и способность глюкозы присоединять синильную кислоту. Наличие неразветвленной цепи углеродных атомов в глюкозе вытекает из ее превращения под действием иодистого водорода в 2-иодгексан СНд— Hj— Hj—СНа— HI—СН,,. Все эти факты согласуются с формулой пятиатомного альдегидоспирта
О наличии альдегидной группы свидетельствует и способность глюкозы присоединять синильную кислоту. Наличие неразветвленной цепи углеродных атомов в глюкозе вытекает из ее превращения под действием иодистого водорода в 2-иодгексан СНд— Hj— Hj—СНа— HI—СН,,. Все эти факты согласуются с формулой пятиатомного альдегидоспирта Опыт М 1. Окисление глюкозы аммиачным раствором оксида серебра (реакция серебряного зеркалам) [c.61]
К 2 мл аммиачного раствора оксида серебра в тщательно вымытой пробирке приливают 1 мл 5%-ного раствора глюкозы. Пробирку со смесью нагревают на водяной бане до осаждения на стенках металлического серебра. [c.61]
Ацетилен пропускают в пробирку с аммиачным раствором оксида серебра., Образуются бурые хлопья ацетиленида серебра.
Д 15.15. а ) Ароматический углеводород состава СдНа обесцвечивает раствор брома, присоединяя 2 молекулы Вгз, а при окислении образует кислоту С0Н5—СООН с аммиачным раствором оксида серебра дает характерный осадок.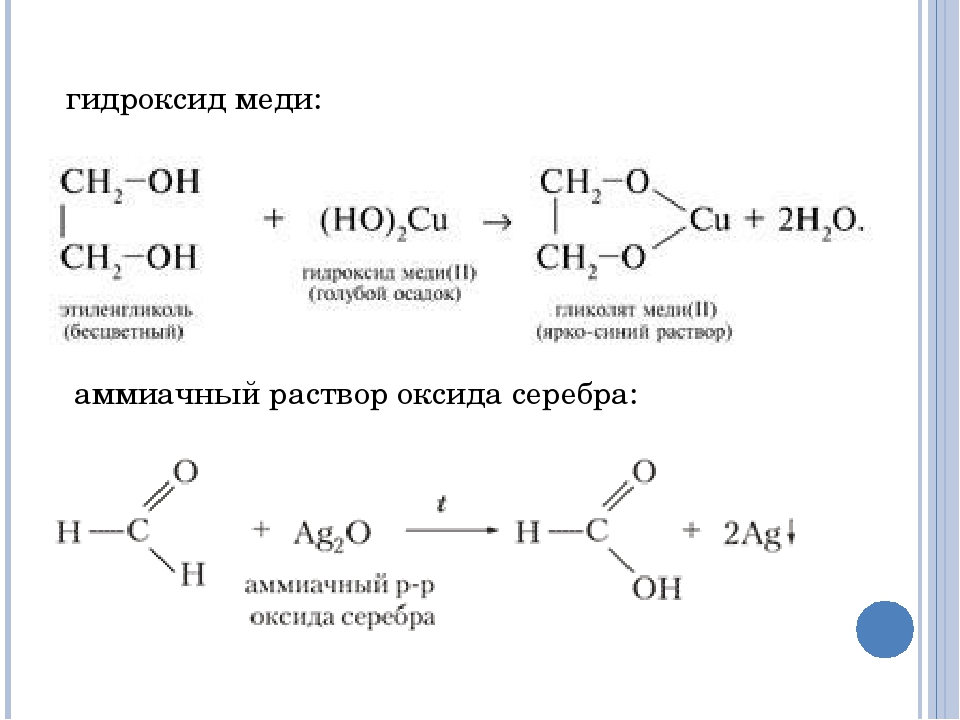 Напишите формулу и название углеводорода, а также схемы реакций, б) Некоторые изомерные углеводороды состава СюНц, ведут себя при реакциях так же, как описано в п. а . Напишите формулу одного из углеводородов, отвечающих этому условию, а также схемы соответствующих реакций, в ) Два ароматических углеводорода состава СщНю легко обесцвечивают раствор брома, при этом каждый присоединяет по две молекулы Вгз- При присоединении двух молекул водорода тот и другой превращаются в /г-диэтилбензол. Один из этих углеводородов образует характерный осадок с аммиакатом полухлористой меди [ u(NHa).2l l. Выведите формулы обоих углеводородов. Напишите схемы указанных реакций, подтверждающих строение углеводородов.
Напишите формулу и название углеводорода, а также схемы реакций, б) Некоторые изомерные углеводороды состава СюНц, ведут себя при реакциях так же, как описано в п. а . Напишите формулу одного из углеводородов, отвечающих этому условию, а также схемы соответствующих реакций, в ) Два ароматических углеводорода состава СщНю легко обесцвечивают раствор брома, при этом каждый присоединяет по две молекулы Вгз- При присоединении двух молекул водорода тот и другой превращаются в /г-диэтилбензол. Один из этих углеводородов образует характерный осадок с аммиакатом полухлористой меди [ u(NHa).2l l. Выведите формулы обоих углеводородов. Напишите схемы указанных реакций, подтверждающих строение углеводородов.
Какие вещества образуются при действии на л-бромбензальдегид 1) хлоридом фосфора (V), 2) хлором, 3) аммиачным раствором оксида серебра Напишите уравнения реакций и назовите полученные продукты. [c.174]
Ионами серебра (в аммиачном растворе реактив Толленса) или двухвалентной меди (в виде тартратного комплекса фе-лингова жидкость) также можно в щелочной среде селективно окислять альдегиды в кислоты, причем в ходе реакции указанные ионы восстанавливаются до металлического серебра и оксида меди(1).
На часовом стекле смешивают 1 каплю свежеперегнан-ного фурфурола с 1 каплей аммиачного раствора оксида серебра. Появляется черное пятно выделившегося свободного серебра. О чем это говорит [c.72]
Содержится в свободном виде во всех зеленых растениях. Особенно много Г. в соке винограда (отсюда другое название — виноградный сахар). Входит в состав клетчатки, крахмала, декстринов, мальтозы и других углеводов, в небольших количествах обнаруживается почти во всех органах и тканях человека и жи вотных. В печени из Г. синтезируется гликоген. Г.— конечный продукт гидролиза дисахаридов и полисахаридов.
Соединение X имеет состав gHgOg. Оно реагирует с гидроксидом натрия в водном растворе в мольном соотношении 1 3 и с оксидом серебра в аммиачном растворе в том же мольном соотношении. X не реагирует с гидрокарбонатом натрия. Установите возможную структуру X и напишите уравнения упомянутых реакций, применяя структурные формулы веществ.
Все соединения серебра легко восстанавливаются с выделением >деталлнческого серебра. Если к аммиачному раствору оксида серебра (I), находящемуся в стеклянном сосуде, прибавить в ка-честве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах Дьюара н о термосах для уменьшения потери теплоты лучеиспусканием.
Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах Дьюара н о термосах для уменьшения потери теплоты лучеиспусканием.
Альдегиды окисляются очень легко. Для их окисления можно использовать не только сильные окислители (КМпО , К,Сг,0,. О,), но достаточно даже ионов меди или серебра. Объпшо используют аммиачный раствор оксида серебра или AgNO,. Аммиак нужен для комплек-сообразования, а щелочная среда — дпя окисления ионом серебра [c.82]
Альдегиды количественно окисляются аммиачным раствором оксида серебра (реакция серебря1шого зеркала) [c.103]
Аммиачный раствор оксида серебра- К 100 мл 0,1 н. раствора нитрата серебра добавляют 0,5 мл 25%-ного раствора аммиака. Полученный раствор хранят в темной склянке не более 1 мес. По истечении этого срока реактив, если он полностью не израсходован, осторожно неЯтрализуют азотной кислотой и готовят новую порцию. Нельзя допускать иснарения реактива и готовить его впрок в больших количествах. [c.189]
[c.189]
Каково строение углеводорода состава С4Н6, если это вещество взаимодействует с бромом, а с аммиачным раствором оксида серебра дает осадок, взрывающийся при нагревании [c.34]
Определите строение соединения состава СяНюО, представляющего собой жидкость с температурой кипения 101,7°С. Оно взаимодействует с гидроксил-амином, с синильной кислотой дает вещество состава СбНцОЫ, с аммиачным раствором оксида серебра зеркала не образует. При окислении исследуемого вещества получаются уксусная и проииоиовая кислоты. [c.64]
Определите строение вещества состава 5h20O, если с аммиачным раствором оксида серебра оно даст реакцию иа альдегидную группу, а прн взаимодействии его с гидразином получается соединение состава 5h22N2, которое при нагревании со щелочью в присутствии платины выделяет азот и образует углеводород 5h22 нормального строения. [c.64]
Как называется вещество состава СвНвО, если известно, что оно реагирует с аммиачным раствором оксида серебра, а при действии концентрированного раствора щелочи дает два соединения СаНвОг и СаНюО. При нагревании исходного вещества с водным раствором перманганата калия образуется терефталевая (/ -фенилендикарбоновая) кислота. [c.177]
При нагревании исходного вещества с водным раствором перманганата калия образуется терефталевая (/ -фенилендикарбоновая) кислота. [c.177]
Напишите уравнения реакций образования аце-тиленидов при действии на ацетилен а) аммиачного раствора оксида серебра [Ag (ЫНз)2]ОН б) металлического натрия в) аммиачного раствора полухлористой меди [Си (NHз)2] I. [c.23]
Напишите уравнения реакций окисления аммиачным раствором оксида серебра следующих альдегидов а ) пропионового б) диметилуксусного в) 2,2-диметил-пентанала. К какому классу соединений относятся продукты окисления Почему эта реакция может служить качественной реакцией на альдегиды в отличие от кетонов Как ее называют [c.43]
Определите строение соединения состава С5Н10О, если известно, что оно не реагирует с аммиачным раствором оксида серебра, а при каталитическом гидрировании образует диэтилкарбинол. Наиишите все уравнения реакций. [c.44]
Химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.

Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.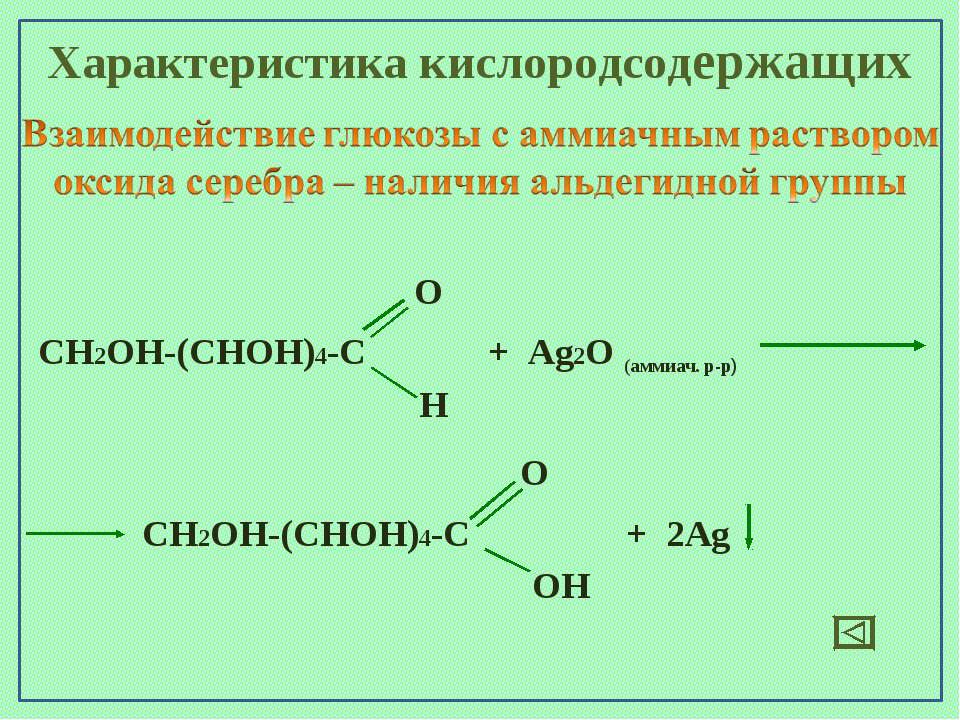
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Пентин 1 аммиачный раствор оксида серебра.
 Алкины
АлкиныЗадание №1
Выберите два утверждения, справедливые для ацетилена
1) все атомы углерода в состоянии sp 2 -гибридизации
2) имеет структурные изомеры
3) является непредельным углеводородом
4) хорошо растворим в воде
5) при нормальных условиях является газом
Ответ: 35
Задание №2
Выберите два утверждения, справедливые для алкинов
1) являются предельными углеводородами
2) вступают в реакции присоединения
3) могут существовать в виде цис- , транс- изомеров
5) обесцвечивают бромную воду
Ответ: 25
Задание №3
1) имеют общую формулу C n H 2n
2) атомы углерода в молекулах связаны между собой только σ-связями
3) реагируют с натрием
4) реагируют с бромом
5) могут быть получены из дигалогеналканов
Ответ: 45
Задание №4
Выберите два утверждения, справедливые для этина
1) плохо растворим в воде
2) имеет межклассовые изомеры
3) является основным компонентом природного газа
4) может быть получен гидролизом карбида кальция
5) молекула имеет тетраэдрическое строение
Ответ: 14
Задание №5
Выберите два утверждения, справедливые для пропина.
1) вступает в реакцию замещения без разрыва тройной связи
2) при тримеризации образует 1,3,5-триметилбензол
3) может быть получен при гидролизе карбида алюминия
4) является жидкостью, при обычных условиях
5) не обесцвечивают водный раствор перманганата калия
Ответ: 12
Задание №6
Выберите два утверждения, справедливые для бутина -1
1) вступает в реакции замещения с OH
2) в реакции гидратации образует бутанол-2
3) образуется при дегидрировании бутана
4) реагирует с бромной водой
5) является изомеров изопрена
Ответ: 14
Задание №7
Выберите два утверждения, справедливые для бутина-1.
1) не вступает в реакцию с водой
2) вступает в реакции замещения с Cl
3) при гидратации образует альдегид
4) является изомером дивинила
5) способен присоединить только 1 моль водорода
Ответ: 24
Задание №8
Выберите два утверждения, которые справедливы и для бутина-1, и для бутина-2.
1) 1 моль углеводорода при гидратации может присоединить только 1 моль воды
2) являются жидкостями при обычных условиях
3) вступают в реакции замещения с аммиачным раствором оксида серебра
4) среди продуктов реакции с подкисленным раствором KMnO 4 есть карбоновые кислоты
5) могут быть получены из 2-хлорбутана в одну стадию
Ответ: 14
Задание №9
Выберите два утверждения, которые справедливы для бутина-1 и бутина-2.
1) при гидратации образуют одно и то же вещество
2) молекулы имеют плоское строение
3) могут быть получены из 1,1-дибромбутана и 2,3-дибромбутана соответственно
4) вступают в реакции замещения с натрием
5) могут существовать в виде цис- , транс -изомеров
Ответ: 13
Задание №10
Выберите два утверждения, справедливые для всех алкинов.
1) обесцвечивание бромной воды
2) реагируют с аммиачным раствором оксида серебра
3) наличие структурных изомеров
4) хорошо растворимы в воде
5) имеют общую формулу гомологического ряда C n H 2n-2
Ответ: 15
Задание №11
Выберите два утверждения, справедливые для всех алкинов.
1) молекулы имеют плоское строение
2) все атомы углерода в молекулах связаны π-связями
3) относятся к непредельным углеводородам
4) вступают в реакциию дегидратации
5) плохо растворимы в воде
Ответ: 35
Задание №12
Выберите два утверждения, которые не справедливы в отношении алкинов.
1) могут существовать в виде цис- , транс- изомеров
2) горят на воздухе
4) вступают в реакции гидрирования
5) при взаимодействии с водным раствором перманганата калия образуют гликоли
Ответ: 15
Задание №13
Выберите два утверждения, которые справедливы и для этилена, и для ацетилена.
1) относятся к классу алкенов
2) при нормальных условиях являются газами
3) обесцвечивают бромную воду
5) имеют общую формулу гомологического ряда C n H 2 n
Ответ: 23
Задание №14
Выберите два утверждения, которые справедливы и для этана, и для ацетилена
1) обесцвечивают водный раствор перманганата калия
2) плохо растворимы в воде
3) образуют взрывчатые смеси с воздухом
Задание №15
Выберите два утверждения, которые справедливы и для пропана, и для пропина.
1) вступают в реакции гидратации
2) способны к окислению кислородом
3) имеют межклассовые изомеры
4) реагируют с бромом
5) все атомы углерода в молекулах в находятся состоянии sp 3 -гибридизации
Ответ: 24
Задание №24
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентина-2.
1) 3-метилбутин-1
2) пентин-1
3) 3-метилпентин-1
Ответ: 41
Задание №51
ацетилен Х Y
1) 1,2- дихлорэтан
4) ацетальдегид
5) 1,1-дихлорэтан
Ответ: 53
Задание №52
Представлена следующая схема превращений веществ:
карбид кальция Х Y
Определите, какие из указанных веществ являются веществами X и Y
5) HC≡C― HC=CH 2
Ответ: 34
Задание №53
Представлена следующая схема превращений веществ:
ацетиленид натрия ацетилен Y
1) водород
2) 1,3,5-триметилбензол
4) бромоводород
5) хлорметан
Ответ: 43
Задание №54
Представлена следующая схема превращений веществ:
NaC≡C-CH 3 X ацетат калия
Определите, какие из указанных веществ являются веществами X и Y
2) KMnO 4 (H 2 SO 4)
3) HC≡C-CH 2 -CH 3
4) H 3 C-C≡C-CH 3
Ответ: 45
Алкины.
 Задания на установление соответствия.
Задания на установление соответствия.Задание №1
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит:
Ответ: 2134
Задание №2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 5335
Задание №3
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 3434
Задание №4
Установите соответствие между формулой углеводорода и основным продуктом его взаимодействия с хлороводородом при мольном соотношении 1:1: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 4612
Задание №5
Установите соответствие между формулой алкина и основным продуктом его взаимодействия с избытком бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 4561
Задание №6
Установите соответствие между названием алкина и продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 6433
Задание №7
Установите соответствие между названием органического вещества и продуктом его взаимодействия со спиртовым раствором щелочи : к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ: 6153
Задание №8
Установите соответствие между дигалогеналканом и продуктом его взаимодействия со спиртовым раствором щелочи : к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТЫ | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
А) 1,2-дихлорэтан |
1. Пентин-1 реагирует с аммиачным раствором оксида серебра (выпадает осадок):
НСºС-СН 2 -СН 2 -СН 3 + OH → AgСºС-CН 2 -CH 2 -CH 3 + 2NH 3 +H 2 O
2. Циклопентен обесцвечивает бромную воду:
3. Циклопентан не реагирует ни с бромной водой, ни с аммиачным раствором оксида серебра.
Пример 3. В пяти пронумерованных пробирках находится гексен, метиловый эфир муравьиной кислоты, этанол, уксусная кислота, водный раствор фенола.
Установлено, что при действии металлического натрия на вещества из пробирок 2, 4, 5 выделяется газ. С бромной водой реагируют вещества из пробирок 3, 5; с аммиачным раствором оксида серебра – вещества из пробирок 1 и 4. С водным раствором гидроксида натрия реагируют вещества из 1, 4, 5 пробирок.
Установите содержимое пронумерованных пробирок.
Решение. Для распознавания составим таблицу 2 и сразу оговоримся, что в условии данной задачи не учитывается возможность ряда взаимодействий, например, метилформиата с бромной водой, фенола с раствором гидроксида диамминсеребра. Знаком – обозначим отсутствие взаимодействия, знаком + – происходящую химическую реакцию.
Для распознавания составим таблицу 2 и сразу оговоримся, что в условии данной задачи не учитывается возможность ряда взаимодействий, например, метилформиата с бромной водой, фенола с раствором гидроксида диамминсеребра. Знаком – обозначим отсутствие взаимодействия, знаком + – происходящую химическую реакцию.
Таблица 2
Взаимодействия определяемых веществ с предложенными реактивами
Пример 4. В шести пронумерованных пробирках находятся растворы: изопропилового спирта, гидрокарбоната натрия, уксусной кислоты, анилина солянокислого, глицерина, белка. Как определить, в какой пробирке находится каждое из веществ?
Решение. .
При добавлении бромной воды к растворам в пронумерованных пробирках образуется осадок в пробирке с анилином солянокислым в результате его взаимодействия с бромной водой. Идентифицированным раствором анилина содянокислого действуют на остальные пять растворов. В пробирке с раствором гидрокарбоната натрия выделяется углекислый газ.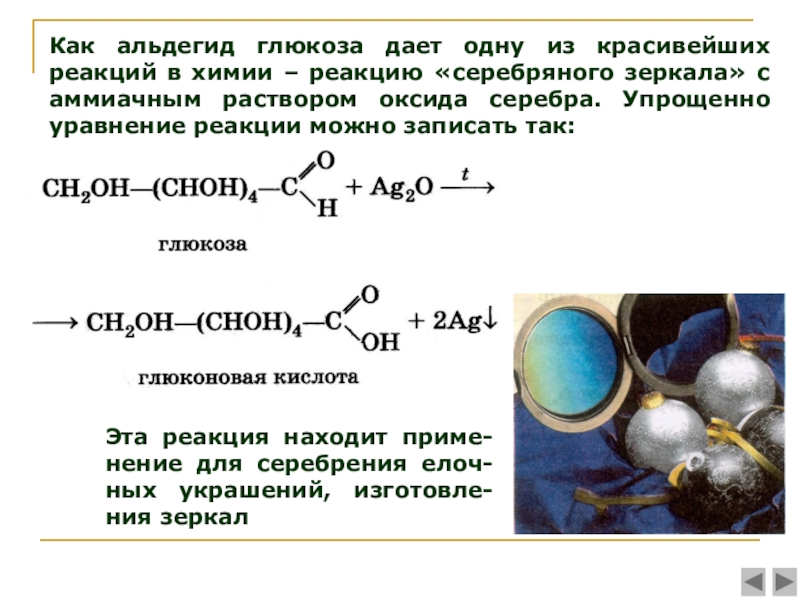 Установленным раствором гидрокарбоната натрия действуют на остальные четыре раствора. В пробирке с уксусной кислотой выделяется углекислый газ. На оставшиеся три раствора действуют раствором сульфата меди (II), который вызывает появление осадка в результате денатурации белка. Для идентификации глицерина готовят гидроксид меди (II) из растворов сульфата меди (II) и гидроксида натрия. Гидроксид меди (II) добавляют к одному из оставшихся двух растворов. В случае растворения гидроксида меди (II) с образованием прозрачного раствора глицерата меди ярко-синего цвета идентифицируют глицерин. Оставшийся раствор является раствором изопропилового спирта.
Установленным раствором гидрокарбоната натрия действуют на остальные четыре раствора. В пробирке с уксусной кислотой выделяется углекислый газ. На оставшиеся три раствора действуют раствором сульфата меди (II), который вызывает появление осадка в результате денатурации белка. Для идентификации глицерина готовят гидроксид меди (II) из растворов сульфата меди (II) и гидроксида натрия. Гидроксид меди (II) добавляют к одному из оставшихся двух растворов. В случае растворения гидроксида меди (II) с образованием прозрачного раствора глицерата меди ярко-синего цвета идентифицируют глицерин. Оставшийся раствор является раствором изопропилового спирта.
Пример 5 . В семи пронумерованных пробирках находятся растворы следующих органических соединений: аминоуксусной кислоты, фенола, изопропилового спирта, глицерина, трихлоруксусной кислоты, солянокислого анилина, глюкозы. Используя в качестве реактивов только растворы следующих неорганических веществ: 2% раствор сульфата меди (II), 5% раствор хлорида железа (III), 10% раствор гидроксида натрия и 5% раствор карбоната натрия, определите органические вещества, содержащиеся в каждой пробирке.
Решение. Сразу предупреждаем, что здесь мы предлагаем словесное объяснение идентификации веществ.
При добавлении раствора хлорида железа (III) к растворам, взятым из пронумерованных пробирок, образуется красное окрашивание с аминоуксусной кислотой и фиолетовое окрашивание с фенолом. При добавлении раствора карбоната натрия к образцам растворов, взятых из оставшихся пяти пробирок, выделяется углекислый газ в случае трихлоруксусной кислоты и солянокислого анилина, с остальными веществами реакция не идет. Солянокислый анилин можно отличить от трихлоруксусной кислоты при добавлении к ним гидроксида натрия. При этом в пробирке с солянокислым анилином образуется эмульсия анилина в воде, в пробирке с трихлоруксусной кислотой видимых изменений не наблюдается. Определение изопропилового спирта, глицерина и глюкозы проводят следующим образом. В отдельной пробирке смешиванием 4-х капель 2% раствора сульфата меди (II) и 3 мл 10% раствора гидроксида натрия получают осадок гидроксида меди (II) голубого цвета, который делят на три части.
К каждой части приливают отдельно по несколько капель изопропилового спирта, глицерина и глюкозы. В пробирке с добавлением изопропилового спирта изменений не наблюдается, в пробирках с добавлением глицерина и глюкозы осадок растворяется с образованием комплексных соединений интенсивно-синего цвета. Различить образовавшиеся комплексные соединения можно нагреванием на горелке или спиртовке верхней части растворов в пробирках до начала кипения. При этом в пробирке с глицерином не будет наблюдаться изменения окраски, а в верхней части раствора глюкозы появляется желтый осадок гидроксида меди (I), переходящий в красный осадок оксида меди (I), нижняя часть жидкости, которую не нагревали, остается синей.
Пример 6. В шести пробирках находятся водные растворы глицерина, глюкозы, формалина, фенола, уксусной и муравьиной кислоты. Используя находящиеся на столе реагенты и оборудование, определите вещества в пробирках. Опишите ход определения. Напишите уравнения реакций, на основании которых произведено определение веществ.
Реагенты: CuSO 4 5%, NaOH 5%, NaHCO 3 10%, бромная вода.
Оборудование: штатив с пробирками, пипетки, водяная баня или плитка.
Решение
1. Определение кислот.
При взаимодействии карбоновых кислот с раствором гидрокарбоната натрия выделяется углекислый газ:
HCOOH + NaHCO 3 → HCOONa + CO 2 + H 2 O;
CH 3 COOH + NaHCO 3 → CH 3 COONa + CO 2 + H 2 O.
Различить кислоты можно реакцией с бромной водой. Муравьиная кислота обесцвечивает бромную воду
HCOOH + Br 2 = 2HBr + CO 2 .
С уксусной кислотой бром в водном растворе не реагирует.
2. Определение фенола.
При взаимодействии глицерина, глюкозы, формалина и фенола с бромной водой только в одном случае наблюдается помутнение раствора и выпадение белого осадка 2,4,6-трибромфенола.
Глицерин, глюкоза и формалин окисляются бромной водой, при этом наблюдается обесцвечивание раствора. Глицерин в этих условиях может окислиться до глицеринового альдегида или 1,2-дигидроксиацетона
.
Дальнейшее окисление глицеринового альдегида приводит к глицериновой кислоте.
HCHO + 2Br 2 + H 2 O → CO 2 + 4HBr.
Реакция со свежеприготовленным осадком гидроксида меди (II) позволяет различить глицерин, глюкозу и формалин.
При добавлении глицерина к гидроксиду меди (II) голубой творожистый осадок растворяется и образуется ярко-синий раствор комплексного глицерата меди. При нагревании окраска раствора не меняется.
При добавлении глюкозы к гидроксиду меди (II) также образуется ярко-синий раствор комплекса
.
Однако при нагревании комплекс разрушается и альдегидная группа окисляется, при этом выпадает красный осадок оксида меди (I)
.
Формалин реагирует с гидроксидом меди (II) только при нагревании с образованием оранжевого осадка оксида меди (I)
HCHO + 4Cu(OH) 2 → 2Cu 2 O↓ + CO 2 + 5H 2 O.
Все описанные взаимодействия можно для удобства определения представить в таблице 3.
Таблица 3
Результаты определения
Литература
1. Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т. / В. Ф. Травень. – М.: ИКЦ «Академкнига», 2006.
Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т. / В. Ф. Травень. – М.: ИКЦ «Академкнига», 2006.
2. Смолина Т. А. и др. Практические работы по органической химии: Малый практикум. Учеб пособие для вузов. / Т. А. Смолина, Н. В. Васильева, Н. Б. Куплетская. – М.: Просвещение, 1986.
3. Кучеренко Н. Е. и др. Биохимия: Практикум /Н. Е. Кучеренко, Ю. Д. Бабенюк, А. Н. Васильев и др. – К.: Выща школа, Изд-во при Киев. ун-те, 1988.
4. Шапиро Д. К. Практикум по биологической химии. – Мн: Вышэйшая школа, 1976.
5. В. К. Николаенко. Решение задач повышенной сложности по общей и неорганической химии: Пособие для учителя, Под ред. Г.В. Лисичкина – К.: Рад.шк., 1990.
6. С. С. Чуранов. Химические олимпиады в школе: Пособие для учителей. – М.: Просвещение, 1962.
7. Московские городские химические олимпиады: Методические рекомендации. Составители В.В. Сорокин, Р.П. Суровцева – М,: 1988
8. Современная химия в задачах международных олимпиад. В. В. Сорокин, И. В. Свитанько, Ю. Н. Сычев, С. С. Чуранов – М.: Химия, 1993
В. В. Сорокин, И. В. Свитанько, Ю. Н. Сычев, С. С. Чуранов – М.: Химия, 1993
9. Е. А. Шишкин. Обучение учащихся решению качественных задач по химии. – Киров, 1990.
10. Химические олимпиады в задачах и решениях. Части 1 и 2. Составители Кебец А. П., Свиридов А. В., Галафеев В. А., Кебец П. А. – Кострома: Изд-во КГСХА, 2000.
11. С. Н. Перчаткин, А. А. Зайцев, М. В. Дорофеев. Химические олимпиады в Москве.– М.: Изд-во МИКПРО, 2001.
12. Химия 10-11: Сборник задач с решениями и ответами / В. В. Сорокин, И. В. Свитанько, Ю. Н. Сычев, С. С. Чуранов.– М.: «Издательство АСТ»: ООО «Издательство АСТРЕЛЬ», 2001.
Данная задача была предложена учащимся 11 класса на практическом туре III (регионального) этапа Всероссийской олимпиады школьников по химии в 2009-2010 учебном году.
А. бромная вода;
Б. аммиачный раствор оксида серебра;
В. раствор бромоводорода;
Г. водный раствор KMnO 4
7. В реакцию сульфирования наиболее легко вступает:
А. бензол;
бензол;
Б. толуол;
В. нитробензол;
Г. бензойная кислота;
Д. бензолсульфоновая кислота.
8. При окислении толуола образуется:
Б. бензойная кислота;
В. уксусная кислота;
Г. бензол;
Д. бензиловый спирт.
Жидкое состояние первых членов гомологического ряда спиртов
обусловлено:
А. неполярностью молекул;
Б. способностью к гидрогенизации;
В. способностью к гидратации;
Г. наличием водородной связи между его молекулами.
10. При нагревании спиртов в присутствии конц.серной кислоты образуется:
А. карбоновая кислота;
Б. алкоголят;
В. альдегид;
Г. сложный эфир;
Д. простой эфир.
11. Внешний эффект реакции глицерина с гидроксидом меди II:
А. р-р голубого цвета;
Б. р-р синего цвета;
В. осадок голубого цвета;
Г. осадок синего цвета;
Д. р-р зеленого цвета.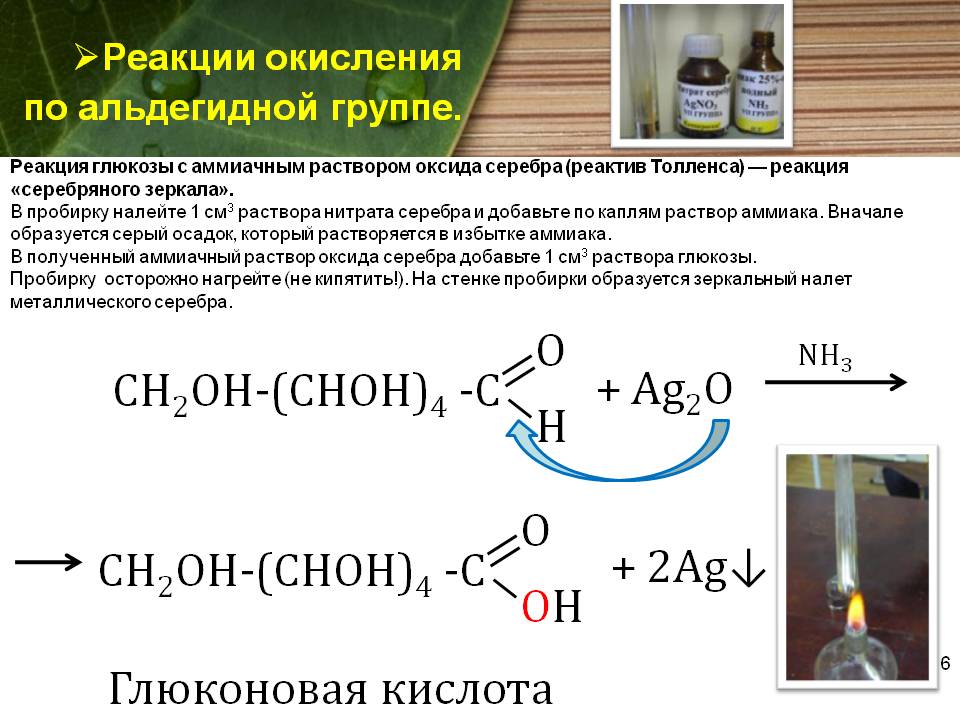
12. Для обнаружения фенольного гидроксила используют реактив:
А. р-р серной кислоты;
Б. р-р бромной воды;
В. р-р хлорида железа III;
Г. р-р перманганата калия;
Д. р-р гидроксида натрия.
13.При взаимодействии фенола с бромной водой образуется:
А. метабромфенол;
Б. пикриновая кислота;
В. карболовая кислота;
Г. 2,4,6-трибромфенол;
Д. бромбензол.
14. Группу –COOH называют:
А. карбонильной группой;
Б. гидроксильной группой;
В. карбоксильной группой;
Г. оксогруппой
15. Между карбоновой кислотой и спиртом протекает реакция:
А. гидролиза;
Б. омыления;
В. изомеризации;
Г. этерификации.
Д. гидрогенизации;
Гомологами являются
А. этан и этилен;
Б. ацетилен и этилен;
В. бензол и толуол;
Г. бензол и этилен.
17. При синтезе жира используют спирт:
А. этанол;
этанол;
Б. метанол;
В. глицерин;
Г. изопропиловый;
Д. этиленгликоль.
Реакция «серебряного зеркала» возможна с
А. бензолом;
Б. муравьиной кислотой;
В. метиловым спиртом;
Г. диметиловым эфиром.
19. Состав жидкого жира отражает название:
А. тристеарат;
Б. трипальмитат;
В. дипальмитостеарат;
Г. триолеат;
Д. дистеаратопальмитат.
20. Амины проявляют __________ свойства:
А. основные;
Б. кислотные;
В. кислотно-основные.
21. Внешний эффект реакции взаимодействия анилина с бромной водой:
А. белый осадок;
Б. желтый осадок;
В. вишнево-красное окрашивание;
Г. кирпично-красный осадок.
Д. фиолетовое окрашивание;
Лигниновая бумага окрашивается от действия раствора анилина
в ___________ цвет:
А. красный;
В. желто-оранжевый;
Г.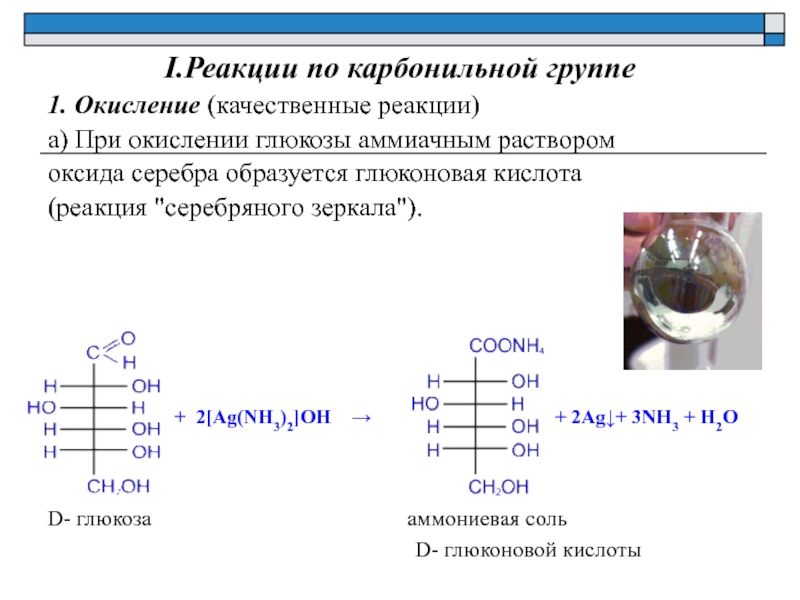 голубой;
голубой;
Д. черный.
Изомерами не являются
А. бутан и метилпропан;
Б. пентан и 2-метилпентан;
В. бутадиен-1,3 и бутин-1;
Г. этанол и диметиловый эфир.
При дегидратации этанола получают
А. ацетилен;
Б. этилен;
Г. этаналь.
Вещества, имеющие одинаковый молекулярный состав, но разное
химическое строение, называются…
А. изомеры
Б. гомологи
В. радикалы
26. Амил (пентил) имеет формулу:
А. С 4 Н 9 –
В. С 5 Н 11 –
Г. С 7 Н 15 –
27. Данное соединение СН 3 — СН — СН — СН 2 — СН 3 имеет название
CH 3 СН 3
по международной номенклатуре:
А. 2-метил-3-этил-метан
Б. изопропил-метил-этил-метан
В. 2,2-диметил-пентан
Г. 2,3-диметил-пентан
28. Алканы при обычных условиях:
А. не окисляются
Б. окисляются до спиртов
В. окисляются до альдегидов
окисляются до альдегидов
Г. окисляются до кислот
29. Атомы углерода в алкенах находятся в состоянии:
А. sp -гибридизации
Б. sp 2 — гибридизации
В. sp 3 — гибридизации
30. Найдите 3- метилгексен-2:
А. Н 3 С — СН 2 — С = СН — СН 2 — СН 3
Б. Н 3 С — СН = СН — С = СН — СН 3
В. Н 3 С — СН 2 — СН 2 — С = СН — СН 3
Г. Н 3 С – СН 2 — СН — СН 2 — СН 2 — СН 3
31. Качественная реакция на непредельные углеводороды:
А. с OH
В. с бромной водой
32. Между атомами углерода в молекуле ацетилена имеются следующие связи:
А. две s-связи и одна π — связь
Б. три s-связи
В. три π -связи
Г. одна s-связь и две π –связи
33. Радикал фенил имеет формулу:
А. С 6 Н 13 —
Б. С 6 Н 5 — СН 2 —
Г. С 6 Н 4 (СН 3) –
34. Реакции замещения в бензольном ядре идут по механизму:
А. радикального замещения
Б. нуклеофильного замещения
нуклеофильного замещения
В. электрофильного замещения
35. Для получения гомологов бензола используется реакция:
А. алкилирования
Б. восстановления
В. сульфирования
Г. нитрования
36. Йодоформ имеет формулу:
37. Не взаимодействуют со щелочами:
А. фенолы
Б. сложные эфиры
В. монокарбоновые кислоты
Г. одноатомные спирты
38. При окислении вторичных спиртов образуются:
А. кетоны
Б. карбоновые кислоты
В. альдегиды
Г. гидроперекиси
39. Фенолы являются производными:
А. алканов
Б. алкенов
В. ароматических углеводородов
Г. циклогексана
40. К двухатомным фенолам относится:
А. пирогаллол
Б. флороглюцин
Г. резорцин
41. Альдегидную группу идентифицируют реакцией образования:
А. йодоформа
Б. серебрянного зеркала
В. азокрасителя
азокрасителя
Г. сложного эфира
42. К двухосновным кислотам относится:
А. муравьиная кислота
Б. бензойная кислота
В. салициловая
Г. щавелевая
43. Соли щавелевой кислоты являются реактивом на катион:
Б. кальция
В. магния
44. Жиры являются:
А. сложными эфирами одноатомных спиртов
Б. простыми эфирами глицерина
В. сложными эфирами глицерина и высших карбоновых кислот
Г. сложными эфирами глицерина и минеральных кислот
45 Аминогруппа (-NH 2) является ориентантом 1 рода и направляет
электрофильные реагенты в положение:
Г. орто- и пара-
Качественные реакции на белки все, кроме
А. ксантопротеиновой
Б. биуретовой
В. осаждения солями тяжелых металлов
Г. образования акролеина
47. К моносахаридам относится:
А. крахмал
Б. глюкоза
В. целлюлоза
Г. гликоген
гликоген
48. Качественная реакция на крахмал:
А. с реактивом Толленса
Б. с реактивом Фелинга
В. с йодом
Г. с тимолом
49. С аммиачным раствором гидроксида серебра вступает в реакцию:
А. глюкоза
Б. гликоген
В. сахароза
Г. крахмал
Барбитураты применяют как
А. противовоспалительное средство
Б. антисептическое средство
В. антигистаминное средство
Г. снотворное средство
51. В схеме превращений этин → х → уксусная кислота – веществом х является:
А. CН 3 СОН
Б. СН 3 СН 3
В. СН 3 СООН
Г. С 2 Н 5 СОН
52. Органическое вещество, молекулярная формула которого С 8 Н 14 , может относиться к гомологическому ряду:
А. метана
Б. этилена
В. бензола
Г. ацетилена
53. Группы — ОН и — СООН являются функциональными для:
А. спиртов и фенолов
Б.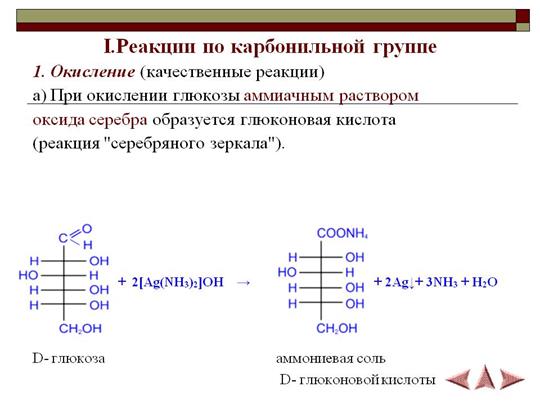 спиртов и карбоновых кислот
спиртов и карбоновых кислот
В. альдегидов и кетонов
Г. фенолов и альдегидов
54. Обесцвечивание бромной воды не произойдет при действии на неё:
А. пентена – 2
Б. пентадиена – 1, 3
В. циклопентана
Г. пентина – 2
55. В реакцию «серебряного зеркала» не вступает:
А. этанол
Б. уксусный альдегид
В. муравьиная кислота
Г. пропаналь
56. Основным продуктом реакции хлорэтана со спиртовым раствором гидроксида калия является:
А. этилен
В. этиловый спирт
Г. этилат калия
57. Вещество, в молекуле которого содержатся атомы углерода в состоянии sp 3 – и sp – гибридизации:
Б. бутен – 1
В. бутин – 1
Г. бутадиен – 1, 3
58. Фенол может реагировать с каждым из двух веществ:
А. NaOH и HNO 3
Б. Cu(OH) 2 и HCl
В. K 2 CO 3 и CuO
Г. NaOH и CH 4
59. Циклогексан является структурным изомером:
А. гексана
гексана
Б. гексена – 2
В. гексина – 2
Г. бензола
60. При гидрировании алкенов образуются:
А. алканы
Б. алкины
В. алкадиены
Г. спирты
61. Продуктом реакции пропена с хлором является:
А. 1, 2 – дихлорпропен
Б. 2 – хлорпропен
В. 2 – хлорпропан
Г. 1, 2 – дихлорпропан
62. Веществами «Х» и «Y» в схеме превращений являются:
С 2 H 5 Cl -→ C 2 H 5 OH -→ C 2 H 5 ONa
А. X – KOH; Y – NaCl
Б. X – HOH; Y – NaOH
В. X – KOH; Y – Na
Г. X – O 2 ; Y – Na
63. При гидрировании ацетальдегида образуется:
А. ацетилен
Б. уксусная кислота
В. этанол
Г. этиленгликоль
64. Гомологом уксусной кислоты является кислота:
А. хлоруксусная
Б. муравьиная
В. олеиновая
Г. бензойная
65. Муравьиная кислота способна проявлять свойства:
А. альдегида и спирта
альдегида и спирта
Б. карбоновой кислоты и спирта
В. карбоновой кислоты и альдегида
Г. карбоновой кислоты и алкена
Данное соединения
НС ≡ С – СН – СН – СН 3
СЕРЕБРО – ЕГЭ по химии
Наиболее устойчивая степень окисления серебра в соединениях – +1.
Серебро стоит в электрохимическом ряду напряжений за водородом, поэтому не реагирует с растворами кислот не окислителей. Исключение – H2S в присутствии кислорода воздуха:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
С концентрированной серной кислотой:
2Ag + 2H2SO4 → Ag2SO4 + SO2↑ + 2H2O
С азотной кислотой:
Ag + 2HNO3(конц.) → AgNO3 + 2NO2↑ + H2O
3Ag + 4HNO3(разб.) → 3AgNO3 + NO↑ + 2H2O
Серебро реагирует с галогенами:
Ag + Br2 →AgBr
Но на свету галогениды разлагаются:
AgBr → Ag + Br2
С серой при сплавлении:
Ag + S →Ag2S
С кислородом воздуха серебро не реагирует, но окисляется озоном при небольшом нагревании:
2Ag +O3 → Ag2O + O2
Полученный оксид разлагается при чуть большем нагревании, чем та температура, при которой серебро было окислено озоном:
2Ag2O→ 4Ag + O2
Ag2O – основный оксид:
Ag2O+ 2HNO3 → 2AgNO3 + H2O
С раствором аммиака образует комплексное соединение:
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH
Аммиачный раствор оксида серебра используется в реакции серебряного зеркала:
И для определения строения алкинов (водород при тройной связи):
С перекисью водорода Ag+1 проявляет окислительные свойства:
Ag2O + H2O2 → 2Ag + H2O+ O2↑
! При определении среды водных растворов солей важно помнить, что ион Ag+ не гидролизуется. Например, среда водного раствора нитрата серебра будет нейтральной.
Например, среда водного раствора нитрата серебра будет нейтральной.
Эта особенность связана с тем, что при растворении незначительных количеств малорастворимого оксида серебра в воде, среда раствора становится щелочной, а значит, оксид серебра в незначительной степени взаимодействует с водой с образованием достаточно сильного основания. AgOH существует только очень разбавленных растворах и легко разлагается на оксид и воду. Поэтому при написании реакций обмена солей серебра со щелочами следует записывать образование оксида серебра, а не его гидроксида, например:
2AgNO3 + 2NaOH → Ag2O↓ + 2NaNO3 + H2O
неорганическая химия — Почему оксид серебра образует координационный комплекс при обработке аммиаком?
На самом деле возможно оба комментария, чтобы процитировать:
, «потому что диаграммы Эллингема говорят нам, что Ag (OH), будучи нестабильным, превращается в Ag2O, который является гораздо более стабильным соединением для серебра. Однако в водных растворах такое равновесие может всегда существовать»
Однако в водных растворах такое равновесие может всегда существовать»
«Nh4 является более сильным лигандом, чем OH-»
Предполагая исходное присутствие Ag2O из реакции, некоторые ионы Ag + из-за ограниченной растворимости, и отмечая, что «появляется часть AgOH и растворяется в избытке аммиака», см. Https: // books.google.com/books?id=uwJbSFRIqyAC&pg=PA37&lpg=PA37&dq=radical+attack+on+silver+Ag+%2B+%E2%80%A2OH++—%3E+AgOH&source=bl&ots=jG9-2NG9x3&sigl=V9xvd&hl=ru&hl=ru&hlg 2ahUKEwjasar_g7ffAhWlhOAKHQEDA_4Q6AEwGHoECAcQAQ # v = onepage & q & f = false:
2 AgOH = Ag2O + h3O
оба комментария могут быть правильными.
Кроме того, в присутствии видимого света, ведущего к фотокатализатору Ag2O / Ag, который, согласно исследованию, проведенному за пределами Китая (опубликовано в 2011 г. в «Chemistry, a European Journal»), был назван мощным стабильным фотокатализатором видимого света, способным генерации электронов (e-) и дырок (h +) (см. https: // onlinelibrary. wiley.com/doi/abs/10.1002/chem.201101032):
wiley.com/doi/abs/10.1002/chem.201101032):
Ag2O / Ag + hv -> e− + h +
С электронами:
Ag + + e- -> Ag
И, в присутствии активных электронных дырок, любой OH-, созданный с помощью:
XOH = X + + OH- (где X = H или Nh4 или Ag)
можно преобразовать в • радикал ОН:
OH- (водн.) + H + -> • OH (водн.)
, который может напрямую атаковать металлическое серебро (см. Https://pubs.acs.org/doi/abs/10.1021/acs.jpca.7b08081?src=recsys&journalCode=jpcafh и окислительно-восстановительные пары, связанные с повышенной кислотностью, по адресу http: // beta.chem.uw.edu.pl/people/WGrochala/Ag2+_mechanism.pdf, а в более общем плане — радикальные атаки на металлы в их низковалентных состояниях на https://srd.nist.gov/NSRDS/NSRDS-NBS-65.pdf. , где можно было бы постулировать реакции полуячейки: Ag = Ag + + e- и • OH + e- = OH- с итоговой реакцией ниже):
Ag + • OH (водн.) -> AgOH (водн.)
2 AgOH = Ag2O + h3O
Или: AgOH (водн.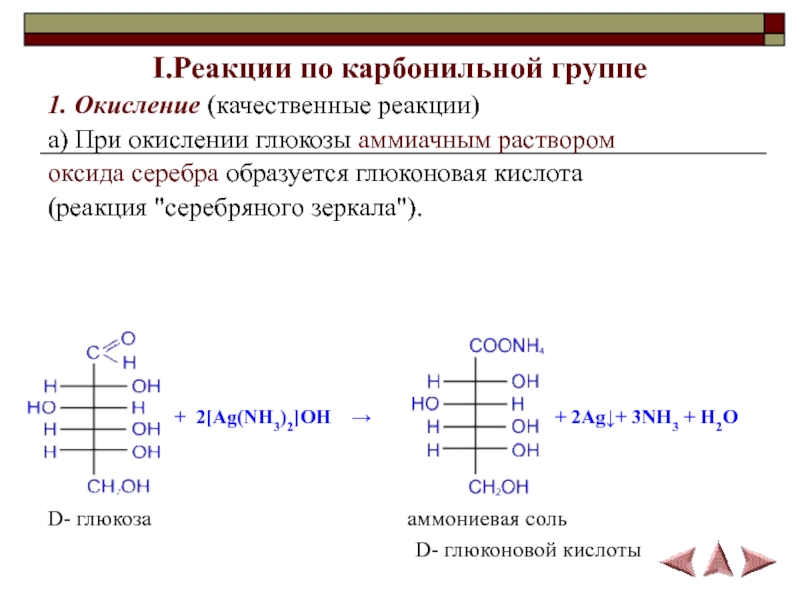 ) = Ag + (водн.) + OH- (водн.) (На основе некоторой ограниченной растворимости Ag2O)
) = Ag + (водн.) + OH- (водн.) (На основе некоторой ограниченной растворимости Ag2O)
с образованием бескислородного иона серебра для образования комплекса с Nh4 (или ОН-, в зависимости от соответствующей концентрации иона) в фотоциклической реакции.Примечание: гидроксильный радикал может в значительной степени улавливаться при высокой концентрации аммиака (создавая • Nh3), поэтому этот путь чувствителен к pH.
Реакция серебряного зеркала — MEL Chemistry
Очень эффектно смотрится эксперимент с красивым эффектом формирования зеркальной поверхности на стекле. Проведение этой реакции требует опыта и терпения. В нашей статье вы можете прочитать о необходимых реагентах, о том, как подготовить оборудование, и узнать химические уравнения реакций.
Суть реакции серебряного зеркала заключается в образовании металлического слоя серебра в результате окислительно-восстановительной реакции при взаимодействии аммиачного раствора оксида серебра в присутствии альдегидов.
Для изготовления прочного слоя серебра вам понадобится:
- Стеклянная колба 100 мл;
- 2,5-4% раствор аммиака;
- нитрат серебра 2%;
- раствор формальдегида (40%).
Вместо растворов аммиака и нитрата серебра можно также использовать реагент Толленса — аммиачный раствор оксида серебра. К 10 каплям воды добавить 1 грамм нитрата серебра (если предполагается длительное хранение жидкости, храните ее в темном месте или в бутылке из темного стекла). Перед экспериментом смешайте раствор (около 3 мл) в пропорции 1/1 с 10% раствором гидроксида натрия. Может образоваться осадок серебра, который можно разбавить, медленно добавляя раствор аммиака.Также рекомендуем провести еще один эффектный эксперимент с раствором аммиака и распечатать «химическое фото».
Реакция протекает при комнатной температуре. Для успешного результата стенки стеклянной колбы должны быть идеально чистыми и гладкими. Если на стенах есть мельчайшие частицы грязи, образовавшийся осадок будет иметь вид рассыпчатого слоя черного или темно-серого цвета.
Для успешного результата стенки стеклянной колбы должны быть идеально чистыми и гладкими. Если на стенах есть мельчайшие частицы грязи, образовавшийся осадок будет иметь вид рассыпчатого слоя черного или темно-серого цвета.
Для очистки колбы используйте разные типы щелочных растворов.Сначала используйте раствор каустической соды, а затем ополосните колбу дистиллированной водой. Промойте колбу очищающим средством много раз.
Почему так важно, чтобы емкость была чистой
Коллоидные частицы серебра, образовавшиеся в конце эксперимента, должны прочно сцепляться с поверхностью стекла, и на ней не должно быть никаких жировых или механических частиц. Дистиллированная вода не содержит солей и идеально подходит для окончательного ополаскивания колбы. Сделать его можно дома, но проще купить.
Уравнение, описывающее первую стадию реакции серебряного зеркала:
Ag₂O + 4 NH₃ · Н₂О ⇄ 2 [Ag (NН₃) ₂] ОН + 3Н₂О
где [Ag (NН₃) ₂] ОН — гидроксид диамина серебра, полученный растворением оксида металла в растворе аммиака.
NB Соблюдайте требования по концентрации аммиака, реакция возможна при низких концентрациях!
Вы можете изучить заключительную стадию реакции с помощью следующего уравнения:
R-CH = O + 2 [Ag (NH₃) ₂] OH → 2Ag ↓ + R-COONH₄ + 3NH₃ + H₂O (реакция альдегида R-CH = O и раствора гидроксида диамина серебра дает осадок серебра, угольную кислоту амид и раствор аммиака; где R представляет собой органическую функциональную группу)
Вторую стадию реакции лучше проводить, осторожно нагревая колбу на горелке, тогда процесс должен протекать без проблем.
Что может показать реакция серебряного зеркала
Эта интересная химическая реакция не только позволяет нам исследовать определенные состояния вещества, но также может дать точное определение альдегидов. Эта реакция отвечает на вопрос: есть ли в растворе альдегидная группа или нет?
Эта реакция отвечает на вопрос: есть ли в растворе альдегидная группа или нет?
Например, благодаря этому процессу мы можем узнать, какой компонент содержит раствор: глюкозу или фруктозу.Глюкоза дает положительный результат, образуется «серебряное зеркало», а фруктоза содержит кетоновую группу и не может образовывать осадок серебра. Для проведения анализа следует вместо формальдегидного раствора добавить 10% раствор глюкозы. Давайте посмотрим на уравнение, чтобы понять, почему и как растворенное серебро превращается в твердый осадок:
2 [Ag (NH₃) ₂] OH + 3H₂O + C₆H₁₂O₆ (глюкоза) = 2Ag ↓ + 4NH₃ ∙ H₂O + C₆H₁₂O₇ (формы глюконовой кислоты).
Равновесия 15.5-лекционные демонстрации-факультет химии Массачусетского университета, Амхерст
Демонстрации ›Equilibria› 15. 5
5
Эквилибрия
15,5 Равновесие серебряной соли и принцип Ле-Шатлиера (проверка)
Темы: Растворимость-Ksp, реакции осаждения, комплексные ионы, принцип Ле Шатлье
Описание: При добавлении прозрачной жидкости растворяется осадок хлорида серебра.При добавлении второй прозрачной жидкости снова образуется осадок.
Материалы (в шкафу — без корзины):
- 200 мл воды
- Стакан 500 мл
- 10 мл 0,1 М нитрата серебра ‡
- 30 мл 1,0 М хлорид натрия ‡
- 35 мл 6.0 M водный аммиак ‡
- Уксусная кислота
- Мешалка
- Мешалка *
- 2 градуированных цилиндра (1 50 мл, 1 10 мл)
‡ Решения находятся на полках с растворами.Аммиак и уксусная кислота находятся в шкафах под вытяжкой.
* Общий предмет: находится в верхнем ящике центральной скамьи напротив шкафов для хранения химикатов.
Предварительная подготовка:
1. Приготовьте осадок хлорида серебра. Налейте 200 мл воды в стакан на 600 мл. Добавьте в стакан 10 мл 0,1 M нитрата серебра и 30 мл 1,0 хлорида натрия для образования осадка.
Процедура:
1. Добавьте аммиак, чтобы растворить хлорид серебра и получить растворимый комплексный ион серебра и аммиака.
2. Попросите учащихся предсказать, что произойдет после добавления уксусной кислоты. Добавьте уксусную кислоту.
Обсуждение:
Этап 1 (этап перед классом): Добавление хлорида натрия к раствору нитрата серебра приводит к образованию осадка хлорида серебра.
AgNO 3 (водн.) -> Ag + (водн.) + NO 2 — (водн.)
AgNO 3 (водн.) + NaCl (водн.) -> AgCl (s) + NaNO 3 (водн. )
)
AgCl (s) <–> Ag + (водн.) + Cl — (водн.) Ksp = 1.8 х 10 -10
Стадия 2: При добавлении водного аммиака осадок хлорида серебра растворяется, что способствует образованию комплексного иона серебра и аммиака.
Ag + (водн.) + 2NH 3 (водн.) <–> [Ag (NH 3 ) 2+ ] (водн.) Kf = 1,6 x 10 7
Чистая реакция: AgCl (s) + 2NH 3 (водн.) <–> [Ag (NH 3 ) 2+ ] (водн.) + Cl — (водн.)
Knet = Ksp x Kf = (1.8 x 10 -10 ) (1,6 x 10 7 ) = 2,9 x 10 -3
Knet = 2,9 x 10 -3 = {[Ag (NH 3 ) 2+ ] (Cl –)} / [NH 3 ] 2
Использование большой концентрации Nh4 приведет к образованию большой концентрации комплексного иона в растворе, и, таким образом, растворимость хлорида серебра в водном растворе аммиака намного выше, чем в воде.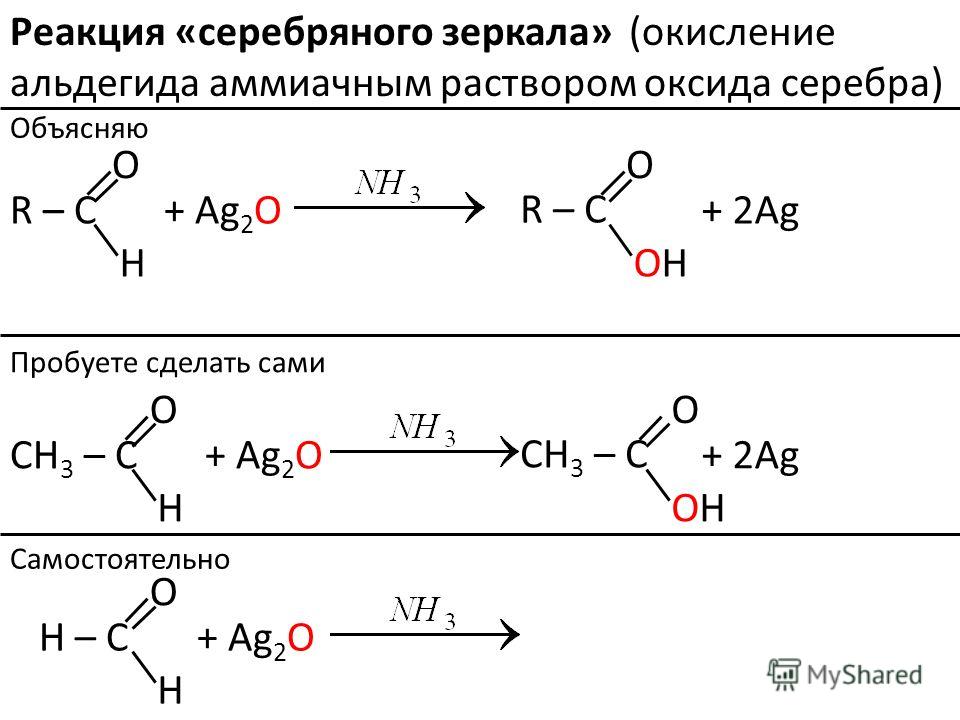
Стадия 3: Добавляют уксусную кислоту, продвигая реакцию обратно к реагенту, хлориду серебра, преобразовывая осадок.
[Ag (NH 3 ) 2 ] + (водн.) + Cl — + 2CH 3 CO 2 H (водн.) <–> AgCl (s) + 2CH 3 CO 2 NH 4 (водн.)
ПринципЛе-Шатлиер гласит, что система будет меняться, чтобы уменьшить или противодействовать эффектам изменения условий равновесия. В этом случае к раствору добавляли уксусную кислоту, нарушая равновесие хлорида серебра и аммиака. Ионы ацетата реагируют с ионами аммиака с образованием ацетата аммония, увеличивая концентрацию ионов серебра, что приводит к общему ионному эффекту.Исключение аммиака и уксусной кислоты из уравнения дает исходное уравнение диссоциации хлорида серебра. Увеличение концентрации продукта, содержащего ионы серебра, сдвигает реакцию влево, создавая более нерастворимый хлорид серебра.
AgCl (s) <–> Ag + (водн. ) + Cl — (водн.)
) + Cl — (водн.)
Безопасность:
Нитрат серебра, его растворы и концентрированные растворы аммиака могут вызывать раздражение кожи и ожоги.При проведении этих экспериментов используйте соответствующее защитное снаряжение, включая перчатки и очки.
Выбытие:
Утилизируйте раствор в соответствующий контейнер для водных отходов.
Артикул:
1. B.Z. Шахашири; Химические демонстрации: Справочник для учителей химии ; Том 1; Висконсин; 1983; п. 307-313 (вариант)
2. Коц, Трейхель, Таунсенд. Chemistry & Chemical Reactivity, 7th Ed; Teachers Ed; Брукс / Коул; 2009
3.Л. Саммерлин, К. Боргфорд, Дж. Или; Химические демонстрации: Справочник для учителей ; Том 2; 1987; п. 80 (более простая версия, производящая AgCl и [Ag (NH 3 ) 2 ] + только)
4. Проф. Ферманн — вариант уксусной кислоты
Скачать версию для печати
нитридов взрывчатых металлов — blastprep
(2) Nh5OH + (2) AgNO3 -> Ag2O + h3O + (2) Nh5NO3
Соли свинца (II) реагируют с водным раствором аммиака с осаждением белой основной соли Pb2O (NO3) 2, а не ожидаемого гидроксида свинца (II), в соответствии с реакцией: Pb [+2] + (2) Nh4 (водн. ) + (3) h3O + 2NO3 [-] <--> Pb2O (NO3) 2 + h3O + (2) Nh5 [+]
) + (3) h3O + 2NO3 [-] <--> Pb2O (NO3) 2 + h3O + (2) Nh5 [+]
Эта основная соль свинца нерастворима в избытке аммиака.
Нитрид ртути
Нитрид ртути (II) образует порошок шоколадного цвета, который медленно разлагается водой. Сухой нитрид тускнеет на воздухе. Нитрид ртути (II) очень взрывоопасен, и с ним необходимо обращаться с особой осторожностью. Он сильно взрывается, при нагревании образует белое пламя с синевато-фиолетовой каймой. Соль настолько чувствительна, что ее можно взорвать, потерев ее стеклянной палочкой для перемешивания. Он образуется при взаимодействии HgO с Nh5OH, первоначально при 10 ° C, но затем при нагревании реакции.
Нитрат ртути (I) также реагирует с аммиаком с образованием белого осадка, но я не уверен, является ли это нитрид ртути (I) или просто менее растворимый аммиачный комплекс нитрата ртути (I), оба из которых будут взрывоопасными .
http: //jchemed.chem.wisc.edu/JCESoft/CCA/CCA4/STHTM/HGNO/HGNONh4X.H . ..
..
Реакция между нитратом ртути (I) и водным раствором аммиака дает смесь белого основного амидо соль и металлическая ртуть, которые выпадают в осадок.
(2) Hg2 [+2] + (4) Nh4 (водн.) + NO3 [-] + h3O -> (2) Hg + Hg2ONh3NO3 + (3) Nh5 [+]
Интересно, что на другом сайте представлены изображения этой реакции, дающей коричневато-черных окрашенных продуктов реакции, в отличие от продуктов белого цвета, которые можно увидеть на другом сайте.http://www.public.asu.edu/~jpbirk/qual/qualanal/mercury.htmlВозможно, что разные соотношения реагентов могут давать разные продукты с соответственно совершенно разными наблюдаемыми изменениями цвета в реакции. Вероятно, что при избытке аммиака реакция станет черной вместо белого осадка. Возможное объяснение полностью белого осадка состоит в том, что аммиак, поскольку он является основанием, вызывает выпадение ртути (I) в виде двойной соли.Даже при растворении в простой воде нитрат ртути (I) имеет несколько кислую реакцию из-за медленной реакции с водой:
Hg2 (NO3) 2 + h3O -> Hg2 (NO3) (OH) + HNO3
Hg2 (NO3) (ОН) выделяется в виде желтого осадка .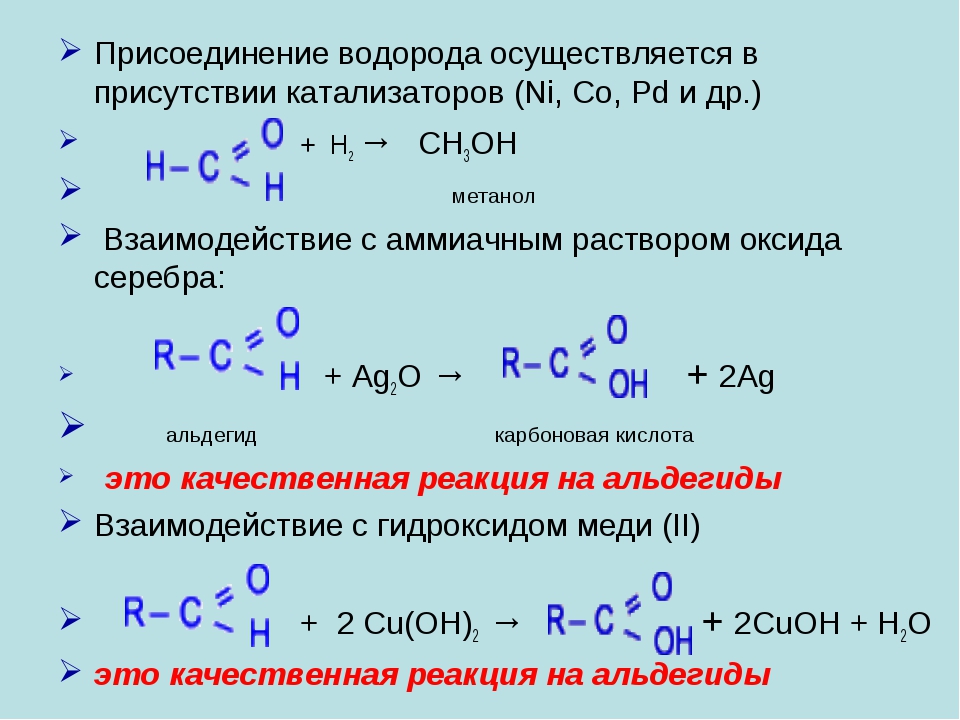 В присутствии аммиака возможно образование другой двойной соли с неизвестной структурой, имеющей белый цвет.
В присутствии аммиака возможно образование другой двойной соли с неизвестной структурой, имеющей белый цвет.
Высшие нитриды свинца и серебра?
Я бы подумал, что лучше было бы попробовать реагировать свинец ди оксид , а не оксид свинца (II).Несмотря на то, что ион Pb + 2 очень координирован, он не кажется таким же окисляющим, как Ag + 1 или Au + 3. Диоксид свинца растворяется в сильных основаниях. Кто-то здесь может попробовать прореагировать такой раствор (диоксида свинца, растворенного в водном гидроксиде натрия) с Nh5OH, чтобы увидеть, можно ли получить взрывоопасный нитрид свинца (IV).
Нитрид свинца существует, но он «очень нестабилен, взрывоопасно разлагается при вакуумной дегазации».«Справочник реактивных химических опасностей» Бретерика, страница 1884
Не уверен, является ли формула Pb2N3, что может быть смешанной степенью окисления, или, что более вероятно, Pb2N3.Также известно, что Ag2O4 (оксид серебра (I, III)) растворяется в сильных основаниях. Эти растворы могут также реагировать с Nh5OH с образованием различных форм нитрида серебра с более высокой долей азота. Ag3N2?
Эти растворы могут также реагировать с Nh5OH с образованием различных форм нитрида серебра с более высокой долей азота. Ag3N2?
(1) диоксид свинца можно получить путем окисления нитрата свинца (II) ферратом калия с последующим добавлением разбавленной азотной кислоты
(2) оксид серебра (I, III) можно легко получить из AgNO3 и персульфат натрия.Вот видео:
http://www.youtube.com/watch?v=1_a81M9p2so
Мысли о возможности нитрида свинца (IV)
Хотя ион Hg [+2] может легко образовывать нитриды, то же самое верно для иона Pb [+2], , а не . Таким образом, кажется, что чем сильнее ион окисляет, тем легче образовывать нитриды. Конечно, если ион слишком окисляет , он просто окислит аммиак, высвобождая газообразный азот.Поскольку легко образуется нитрид ртути (II), но не нитрид ртути (I), можно было бы подумать, что нитрид свинца (IV), если он существует, может быть более химически / термически стабильным, чем нитрид свинца (II).
«Диоксид свинца … окисляет аммиак до азотной кислоты с одновременным образованием нитрата аммония. Он окисляет соль марганца (не содержащую хлора) в присутствии азотной кислоты до перманганата». Британская энциклопедия. Одиннадцатое издание. Том XVI. под редакцией Хью Чизхолма. p318 (год 1911)
Это не обязательно означает, что раствор диоксида свинца, который был растворен в щелочной среде (с образованием иона гидроксиплюмбата, Pb (OH) 6 [-2]), окислял бы аммиак, поскольку окислительная способность PbO2 равна зависит от pH.
Горячее золото
«Фульминантное золото» может быть получено реакцией хлорида ауриновой кислоты, AuCl3, с водным аммиаком, Nh5OH. Взрывоопасный осадок в основном (ClAuNH 2 ) 2 NH, но при промывании избытком аммиака происходит гидролиз до более взрывоопасной формы оливково-зеленого цвета, в которой атомы золота образуют комплекс с аминогруппами в квадрате. плоская конфигурация, в которой некоторые аминогруппы образуют поперечные связи между двумя атомами золота.Точная структура неизвестна, и кристаллы кажутся аморфными. Более взрывоопасная форма, похоже, не содержит хлора. Молниеносное золото взрывается фиолетовым облаком золотых частиц. Молниеносное золото — опасно чувствительное взрывчатое вещество, и оно гораздо более чувствительно к трению, чем к ударам. Он термически стабилен до 200 ° C и разлагается при 210 ° C, часто со взрывом.
плоская конфигурация, в которой некоторые аминогруппы образуют поперечные связи между двумя атомами золота.Точная структура неизвестна, и кристаллы кажутся аморфными. Более взрывоопасная форма, похоже, не содержит хлора. Молниеносное золото взрывается фиолетовым облаком золотых частиц. Молниеносное золото — опасно чувствительное взрывчатое вещество, и оно гораздо более чувствительно к трению, чем к ударам. Он термически стабилен до 200 ° C и разлагается при 210 ° C, часто со взрывом.
5 граммов сухого хлорида аммония и 5 граммов сухого нитрата калия растирали вместе в сухой ступке с помощью пестика.Эту смесь помещали в пробирку и настраивали на сухую перегонку.
Нагревание смеси хлорида аммония и нитрата калия сначала вызывает возгонку части хлорида аммония. Затем следует образование желтого вещества, которое выделяется из смеси.
Дистиллированный пар конденсируется в другой пробирке в стакане с колотым льдом. Пар выглядит как азотная кислота без признаков хлора. Некоторое количество сублимированного хлорида аммония или соли аммония появляется в стеклянной соединительной трубке и на стенке пробирки.(Продолжительное нагревание пробирки, содержащей смесь солей, привело к расплавлению пробирки и из продувочного отверстия в нагретой области. Пары представляют собой смесь хлорида аммония и азотной кислоты. Дальнейшие эксперименты проводились с пробирками из пирекса.)
Пар выглядит как азотная кислота без признаков хлора. Некоторое количество сублимированного хлорида аммония или соли аммония появляется в стеклянной соединительной трубке и на стенке пробирки.(Продолжительное нагревание пробирки, содержащей смесь солей, привело к расплавлению пробирки и из продувочного отверстия в нагретой области. Пары представляют собой смесь хлорида аммония и азотной кислоты. Дальнейшие эксперименты проводились с пробирками из пирекса.)
Нагревание Nh5Cl с KNO3, вероятно, привело к окислению некоторых ионов аммония с оставлением KCl и выделением как водяного пара, так и различных оксидов азота. Часть Nh5Cl явно сублимирована. Также возможно, что улетучилось некоторое количество хлористого водорода или хлора.В приемной трубке оксид азота и диоксид азота вместе могли окислить ионы аммония, но более вероятно, что эти два оксида азота вступили в реакцию с воздухом в присутствии конденсированной воды с образованием азотной кислоты (вероятно, концентрации от 40 до 60%). Вероятно, существует небольшое, но сложное равновесие между концентрированной азотной кислотой и хлоридом аммония, но такая динамика здесь не обсуждается.
Вероятно, существует небольшое, но сложное равновесие между концентрированной азотной кислотой и хлоридом аммония, но такая динамика здесь не обсуждается.
Дистиллят от конденсации сначала помещали в чашу для испарения.Это светло-желтая дымящаяся жидкость, похожая на азотную кислоту. Нет запаха газообразного хлора.
Несколько хлопьев золота были помещены в дымящуюся кислоту. Золото полностью растворилось в кислоте за десять минут, образуя более глубокий желтый раствор.
Было проведено несколько испытаний образцов царской водки, чтобы попытаться установить ее состав. Желтый раствор золота, растворенного в царской водке, добавляли к олову, растворенному в соляной кислоте.Образование пурпурного осадка (Purple of Cassius) является положительным тестом на то, что золото находилось в растворе.
Нагревание образца царской водки с гидроксидом калия привело к тому, что влажная красная лакмусовая бумага на верхней части пробирки стала синей, что указывает на наличие паров основания. Это сопровождалось запахом аммиака. Оба теста показывают, что в царской водке присутствует соль аммония. Затем раствор в пробирке нагревали, чтобы обеспечить полное удаление аммиака. Раствору давали остыть и подкисляли разбавленной азотной кислотой для нейтрализации гидроксида калия.В пробирку добавляли несколько капель раствора 2% -ного нитрата серебра с образованием мутного осадка. Осадок снова растворяется при добавлении гидроксида аммония. Это указывало на присутствие либо хлорид-ионов, либо хлора в исходном образце.
Это сопровождалось запахом аммиака. Оба теста показывают, что в царской водке присутствует соль аммония. Затем раствор в пробирке нагревали, чтобы обеспечить полное удаление аммиака. Раствору давали остыть и подкисляли разбавленной азотной кислотой для нейтрализации гидроксида калия.В пробирку добавляли несколько капель раствора 2% -ного нитрата серебра с образованием мутного осадка. Осадок снова растворяется при добавлении гидроксида аммония. Это указывало на присутствие либо хлорид-ионов, либо хлора в исходном образце.
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горение Полено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в двуокись углерода, водяной пар и золу.
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, составляющей, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — пример базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, составляющей, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — пример базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по исходу реакции и по механизму реакции.Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстанавливающего агента к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая предоставляет подробные сведения о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстанавливающего агента к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая предоставляет подробные сведения о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, выплавка чугуна, изготовление стекла и керамики, пивоварение, производство вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, происходящих во всех живых системах.
Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, происходящих во всех живых системах.
Следует отличать химические реакции от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода.Однако если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH). Этим мы знаем, что произошло химическое изменение или реакция.
тающий лед Тающий лед, водопад Нижнее Чистилище, на притоке реки Соухеган между Мон Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Таяние льда — это физическое изменение, а не химическая реакция.
Исторический обзор
Концепция химической реакции возникла около 250 лет назад.Он возник в ранних экспериментах, классифицировавших вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Первые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли.Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, поскольку его идеи подтверждают важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием, касающимся химических реакций, было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который сформулировал свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ.Такой взгляд на химические реакции точно определяет текущую тему. Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили понятие химических реакций.Сегодня экспериментальная химия предоставляет бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При создании нового вещества из других веществ химики говорят, что они либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS).Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
% PDF-1.4
%
120 0 obj>
endobj
xref
120 172
0000000016 00000 н.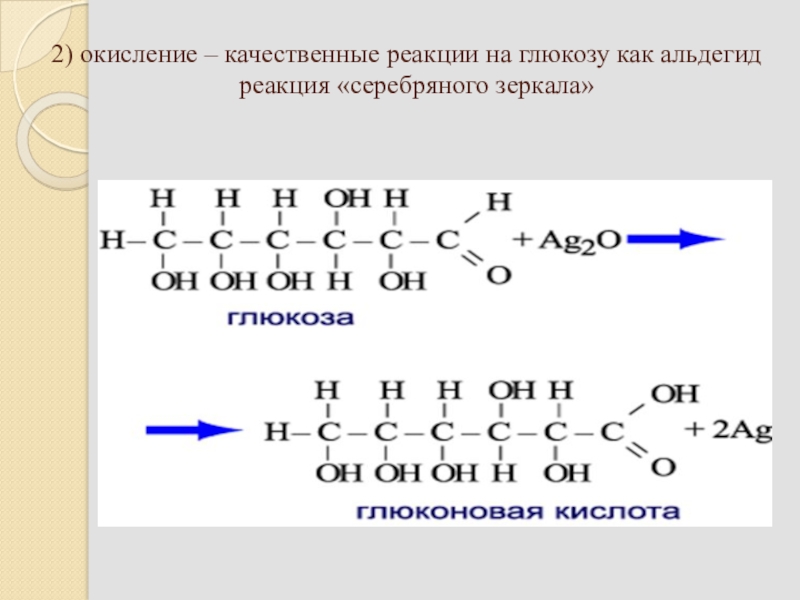 0000004439 00000 н.
0000004523 00000 н.
0000004756 00000 н.
0000006010 00000 н.
0000006055 00000 н.
0000006463 00000 н.
0000006961 00000 н.
0000007038 00000 п.
0000007112 00000 н.
0000007375 00000 н.
0000007768 00000 н.
0000008307 00000 н.
0000008353 00000 п.
0000008399 00000 н.
0000008445 00000 н.
0000008490 00000 н.
0000008535 00000 н.
0000008571 00000 н.
0000008617 00000 н.
0000008662 00000 н.
0000008708 00000 н.
0000008754 00000 н.
0000008800 00000 н.
0000008846 00000 н.
0000008892 00000 н.
0000008938 00000 п.
0000008984 00000 п.
0000009030 00000 н.
0000009076 00000 н.
0000009122 00000 н.
0000009168 00000 п.
0000009214 00000 н.
0000009260 00000 н.
0000009306 00000 н.
0000009351 00000 п.
0000009397 00000 н.
0000009443 00000 п.
0000009489 00000 н.
0000009535 00000 п.
0000009581 00000 п.
0000009626 00000 н.
0000009672 00000 н.
0000009718 00000 н.
0000009764 00000 н.
0000009810 00000 п.
0000009856 00000 н.
0000009901 00000 н.
0000009946 00000 н.
0000004439 00000 н.
0000004523 00000 н.
0000004756 00000 н.
0000006010 00000 н.
0000006055 00000 н.
0000006463 00000 н.
0000006961 00000 н.
0000007038 00000 п.
0000007112 00000 н.
0000007375 00000 н.
0000007768 00000 н.
0000008307 00000 н.
0000008353 00000 п.
0000008399 00000 н.
0000008445 00000 н.
0000008490 00000 н.
0000008535 00000 н.
0000008571 00000 н.
0000008617 00000 н.
0000008662 00000 н.
0000008708 00000 н.
0000008754 00000 н.
0000008800 00000 н.
0000008846 00000 н.
0000008892 00000 н.
0000008938 00000 п.
0000008984 00000 п.
0000009030 00000 н.
0000009076 00000 н.
0000009122 00000 н.
0000009168 00000 п.
0000009214 00000 н.
0000009260 00000 н.
0000009306 00000 н.
0000009351 00000 п.
0000009397 00000 н.
0000009443 00000 п.
0000009489 00000 н.
0000009535 00000 п.
0000009581 00000 п.
0000009626 00000 н.
0000009672 00000 н.
0000009718 00000 н.
0000009764 00000 н.
0000009810 00000 п.
0000009856 00000 н.
0000009901 00000 н.
0000009946 00000 н. 0000010883 00000 п.
0000010933 00000 п.
0000011332 00000 п.
0000011701 00000 п.
0000011997 00000 п.
0000012265 00000 п.
0000012492 00000 п.
0000012568 00000 п.
0000012881 00000 п.
0000013790 00000 п.
0000014211 00000 п.
0000014262 00000 п.
0000014568 00000 п.
0000014699 00000 п.
0000015058 00000 п.
0000015952 00000 п.
0000016205 00000 п.
0000016631 00000 п.
0000016856 00000 п.
0000016992 00000 п.
0000017829 00000 п.
0000018582 00000 п.
0000019075 00000 п.
0000019440 00000 п.
0000019827 00000 н.
0000020321 00000 п.
0000021104 00000 п.
0000025011 00000 п.
0000031366 00000 п.
0000045396 00000 п.
0000045588 00000 п.
0000046421 00000 п.
0000046653 00000 п.
0000048455 00000 п.
0000050409 00000 п.
0000053980 00000 п.
0000054032 00000 п.
0000065855 00000 п.
0000068524 00000 п.
0000069316 00000 п.
0000069429 00000 п.
0000069902 00000 н.
0000069979 00000 п.
0000070238 00000 п.
0000070348 00000 п.
0000070862 00000 п.
0000070957 00000 п.
0000071618 00000 п.
0000010883 00000 п.
0000010933 00000 п.
0000011332 00000 п.
0000011701 00000 п.
0000011997 00000 п.
0000012265 00000 п.
0000012492 00000 п.
0000012568 00000 п.
0000012881 00000 п.
0000013790 00000 п.
0000014211 00000 п.
0000014262 00000 п.
0000014568 00000 п.
0000014699 00000 п.
0000015058 00000 п.
0000015952 00000 п.
0000016205 00000 п.
0000016631 00000 п.
0000016856 00000 п.
0000016992 00000 п.
0000017829 00000 п.
0000018582 00000 п.
0000019075 00000 п.
0000019440 00000 п.
0000019827 00000 н.
0000020321 00000 п.
0000021104 00000 п.
0000025011 00000 п.
0000031366 00000 п.
0000045396 00000 п.
0000045588 00000 п.
0000046421 00000 п.
0000046653 00000 п.
0000048455 00000 п.
0000050409 00000 п.
0000053980 00000 п.
0000054032 00000 п.
0000065855 00000 п.
0000068524 00000 п.
0000069316 00000 п.
0000069429 00000 п.
0000069902 00000 н.
0000069979 00000 п.
0000070238 00000 п.
0000070348 00000 п.
0000070862 00000 п.
0000070957 00000 п.
0000071618 00000 п. 0000071725 00000 п.
0000072246 00000 п.
0000072365 00000 п.
0000073033 00000 п.
0000073128 00000 п.
0000073515 00000 п.
0000073634 00000 п.
0000074391 00000 п.
0000074510 00000 п.
0000075223 00000 п.
0000075336 00000 п.
0000075943 00000 п.
0000076029 00000 п.
0000076257 00000 п.
0000076370 00000 п.
0000076822 00000 п.
0000076941 00000 п.
0000077757 00000 п.
0000077867 00000 п.
0000078389 00000 п.
0000078490 00000 п.
0000079056 00000 п.
0000079175 00000 п.
0000079737 00000 п.
0000079829 00000 п.
0000080202 00000 п.
0000080371 00000 п.
0000080451 00000 п.
0000080686 00000 п.
0000080763 00000 п.
0000081027 00000 п.
0000081110 00000 п.
0000081424 00000 п.
0000081504 00000 п.
0000081747 00000 п.
0000081818 00000 п.
0000082036 00000 п.
0000082110 00000 п.
0000082382 00000 п.
0000082501 00000 п.
0000083193 00000 п.
0000083312 00000 п.
0000084118 00000 п.
0000084237 00000 п.
0000084902 00000 п.
0000085012 00000 п.
0000085614 00000 п.
0000085730 00000 п.
0000071725 00000 п.
0000072246 00000 п.
0000072365 00000 п.
0000073033 00000 п.
0000073128 00000 п.
0000073515 00000 п.
0000073634 00000 п.
0000074391 00000 п.
0000074510 00000 п.
0000075223 00000 п.
0000075336 00000 п.
0000075943 00000 п.
0000076029 00000 п.
0000076257 00000 п.
0000076370 00000 п.
0000076822 00000 п.
0000076941 00000 п.
0000077757 00000 п.
0000077867 00000 п.
0000078389 00000 п.
0000078490 00000 п.
0000079056 00000 п.
0000079175 00000 п.
0000079737 00000 п.
0000079829 00000 п.
0000080202 00000 п.
0000080371 00000 п.
0000080451 00000 п.
0000080686 00000 п.
0000080763 00000 п.
0000081027 00000 п.
0000081110 00000 п.
0000081424 00000 п.
0000081504 00000 п.
0000081747 00000 п.
0000081818 00000 п.
0000082036 00000 п.
0000082110 00000 п.
0000082382 00000 п.
0000082501 00000 п.
0000083193 00000 п.
0000083312 00000 п.
0000084118 00000 п.
0000084237 00000 п.
0000084902 00000 п.
0000085012 00000 п.
0000085614 00000 п.
0000085730 00000 п. 0000086445 00000 п.
0000086564 00000 п.
0000087366 00000 п.
0000087473 00000 п.
0000087913 00000 п.
0000087968 00000 н.
0000088155 00000 п.
0000088256 00000 п.
0000088739 00000 п.
0000088855 00000 п.
0000089409 00000 п.
0000089528 00000 п.
00000
0000086445 00000 п.
0000086564 00000 п.
0000087366 00000 п.
0000087473 00000 п.
0000087913 00000 п.
0000087968 00000 н.
0000088155 00000 п.
0000088256 00000 п.
0000088739 00000 п.
0000088855 00000 п.
0000089409 00000 п.
0000089528 00000 п.
00000
00000 п. 00000
00000 п. 0000090715 00000 п. 0000094518 00000 п. 0000094742 00000 п. 0000094929 00000 п. 0000095223 00000 п. 0000103646 00000 п. 0000103876 00000 н. 0000106889 00000 н. 0000107178 00000 п. 0000108365 00000 н. 0000108587 00000 п. 0000118844 00000 н. 0000003736 00000 н. трейлер ] >> startxref 0 %% EOF 291 0 obj> поток xb«f` {ȀИзвлечение серебра из отработанного хлористого серебра для системы MEO (Технический отчет)
Хсу, П.К., Чиба, З., Шумахер, Б.Дж., Мургуя, Л.К., и Адамсон, М.Г. Извлечение серебра из отработанного хлористого серебра для системы MEO . США: Н. П., 1996.
Интернет. DOI: 10,2172 / 250506.
Хсу, П. К., Чиба, З., Шумахер, Б. Дж., Мургуя, Л. К., и Адамсон, М. Г. Извлечение серебра из отработанного хлористого серебра для системы MEO . Соединенные Штаты. https://doi.org/10.2172/250506
Хсу, П.К., Чиба, З., Шумахер, Б.Дж., Мургуя, Л.К., и Адамсон, М.Г.Чт.
«Восстановление серебра из отработанного хлористого серебра для системы МЭО». Соединенные Штаты. https://doi.org/10.2172/250506. https://www.osti.gov/servlets/purl/250506.
@article {osti_250506,
title = {Извлечение серебра из отработанного хлористого серебра для системы MEO},
author = {Хсу, П. К. и Чиба, З. и Шумахер, Б. Дж. и Мургуя, Л. К. и Адамсон, М. Г.},
abstractNote = {Опосредованное электрохимическое окисление (MEO) обрабатывает смешанные отходы путем окисления органических компонентов до CO2 и воды с помощью химически активных ионов металлов (медиаторов).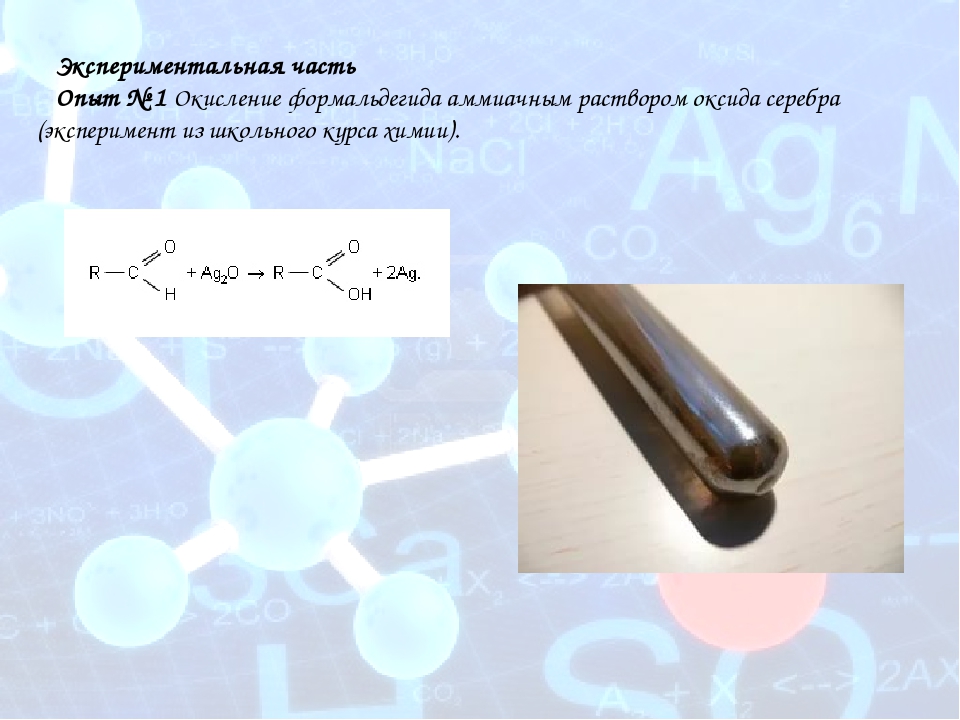 В случае хлорированных органических отходов хлор связывается с медиатором (серебром) в растворе с образованием нерастворимого AgCl, который затем отделяется центрифугированием. В лабораторных условиях был разработан эффективный процесс преобразования AgCl в нитрат с эффективностью преобразования> 90%. Процесс нетоксичен и экономичен, требует только недорогих реагентов NaOH и перекиси водорода. Образование вторичных отходов невелико.},
В случае хлорированных органических отходов хлор связывается с медиатором (серебром) в растворе с образованием нерастворимого AgCl, который затем отделяется центрифугированием. В лабораторных условиях был разработан эффективный процесс преобразования AgCl в нитрат с эффективностью преобразования> 90%. Процесс нетоксичен и экономичен, требует только недорогих реагентов NaOH и перекиси водорода. Образование вторичных отходов невелико.},
doi = {10.2172 / 250506},
url = {https: // www.osti.gov/biblio/250506},
journal = {},
number =,
объем =,
place = {United States},
год = {1996},
месяц = {2}
}


Leave A Comment