Химические свойства солей — реакции, определение и примеры
Поможем понять и полюбить химию
Начать учиться
107.1K
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.

Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.
 В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака:NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.

Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Татьяна Сосновцева
К предыдущей статье
Изомеры
К следующей статье
Качественные реакции
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Химия — 8
7. Соли—состав, классификация, наименование и методы получения
Соли—состав, классификация, наименование и методы получения
По своему составу соли подразделяются в основном на 5 групп: нормальные, кислые, основные, двойные и смешанные соли.
Наименование солей. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов (или же сложными ионами, например, ионом аммония NH4+ ), называются нормальными солями. При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем — название металла.
| Нормальная соль | Название | Нормальная соль | Название | |
|---|---|---|---|---|
| Al2(SO4)3 | сульфат алюминия | Na2ZnO2 | цинкат натрия | |
| Ca(NO3)2 | нитрат кальция | KMnO4 | перманганат калия | |
| Na3PO4 | ортофосфат натрия | KClO3 | хлорат калия |
Если металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
|---|---|---|---|---|
| FeSO4 | сульфат железа (II) | Cu(NO3)2 | нитрат меди(II) | |
| FeCl3 | хлорид железа(III) | Cr2(SO4)3 | сульфат хрома(III) |
Соли, полученные в результате частичного замещения атомов водорода, относяшихся к основности кислот, атомами металлов (или сложными ионами, например, ионами аммония), называются кислыми солями. При наименовании кислых солей пользуются теми же правилами, как и при наименовании нормальных солей. Разница лишь в том, что вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, не замещенных металлом, с приставкой «гидро-», так, при двухатомах водорода, не замещенных металлом, «дигидро-», а следом дается название металла. При одном атоме водорода приставка «моно» не употребляется.
При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
|---|---|---|---|---|
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| NaHCO3 | гидрокарбонат натрия | NaH2PO4 | дигидроортофосфат натрия | |
| Fe(HSO4)2 | гидросульфат железа(II) | Ca(H2PO4)2 | дигидроортофосфат кальция | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония | |
Соли, полученные в результате частичного замещения кислотными остатками гидроксильных групп, относящихся к кислотным основаниям, называются основными солями.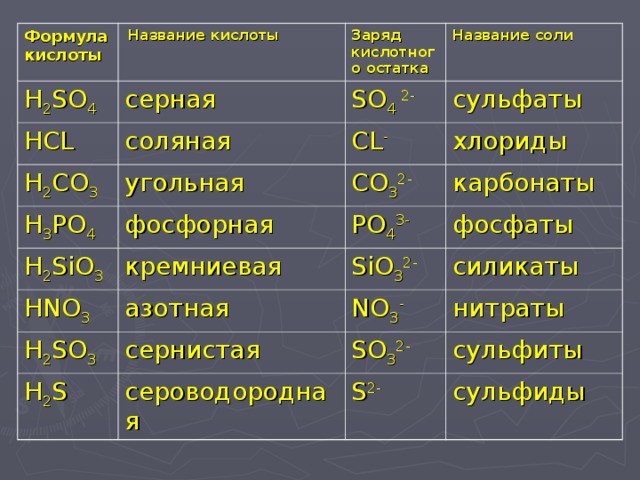 Основные соли называют так же, как и нормальные соли. К кислотным остаткам здесь добавляется приставка «гидроксо-» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно-» не употребляется.
Основные соли называют так же, как и нормальные соли. К кислотным остаткам здесь добавляется приставка «гидроксо-» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно-» не употребляется.
| Основные соли | ||||
|---|---|---|---|---|
| Гидроксосоли | Дигидроксосоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксодихлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия | |
| Cu(OH)NO3 | гидроксонитрат меди(II) | Fe(OH)2NO3 | дигидроксонитрат железа(III) | |
| Fe(OH)Cl | гидроксохлорид железа(II) | Cr(OH)2Br | дигидроксобромид хрома(III) | |
Регистрационное досье — ECHA
При низких значениях pH растворенный алюминий
присутствует в основном в водной форме (Al 3+ ). Происходит гидролиз
по мере повышения pH, что приводит к ряду менее растворимых гидроксидных комплексов
(например, Al(OH) 2+ , Al(OH) 2 + ). Алюминий
растворимость минимальна около pH 6,5 при 20 °C, а затем увеличивается по мере
анион Al(OH) 4 — начинает образовываться при более высоком pH.
(Дрисколл и Шехер, 19 лет.90; Виттерс и др., 1996). Так, при 20 °С и
pH <5,7, алюминий присутствует в основном в форме Al 3+ и
Al(OH) 2+ . В диапазоне pH от 5,7 до 6,7 гидроксид алюминия
преобладают виды, в том числе Al(OH) 2+ и Al(OH) 2 + ,
а затем Al(OH) 3 . Обычно при pH примерно 6,5
Al(OH) 3 преобладает над всеми остальными видами. В этом
диапазон, растворимость алюминия низкая и доступность для водной биоты
также должен быть низким. При pH > 6,7 Al(OH) 4 – становится
доминирующий вид.
Происходит гидролиз
по мере повышения pH, что приводит к ряду менее растворимых гидроксидных комплексов
(например, Al(OH) 2+ , Al(OH) 2 + ). Алюминий
растворимость минимальна около pH 6,5 при 20 °C, а затем увеличивается по мере
анион Al(OH) 4 — начинает образовываться при более высоком pH.
(Дрисколл и Шехер, 19 лет.90; Виттерс и др., 1996). Так, при 20 °С и
pH <5,7, алюминий присутствует в основном в форме Al 3+ и
Al(OH) 2+ . В диапазоне pH от 5,7 до 6,7 гидроксид алюминия
преобладают виды, в том числе Al(OH) 2+ и Al(OH) 2 + ,
а затем Al(OH) 3 . Обычно при pH примерно 6,5
Al(OH) 3 преобладает над всеми остальными видами. В этом
диапазон, растворимость алюминия низкая и доступность для водной биоты
также должен быть низким. При pH > 6,7 Al(OH) 4 – становится
доминирующий вид.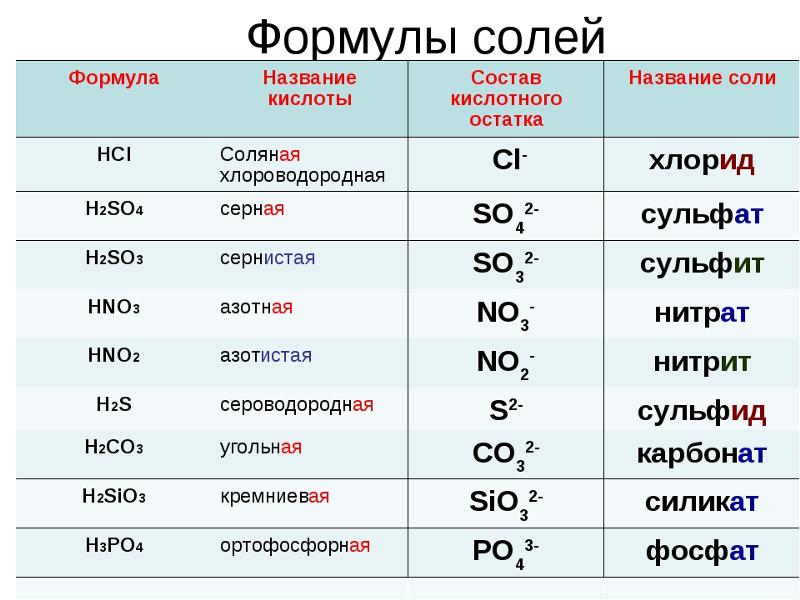 Важно отметить, что различные алюминиевые
виды, описанные выше, всегда присутствуют одновременно при любом рН
ценить. Влияние рН в водных системах в основном заключается в изменении
доля всех видов при изменении pH (электронное письмо от 2008 г.
Канадская ассоциация по очистке сточных вод – Дж. Пастернаку, Министерство охраны окружающей среды Канады;
без ссылки).
Важно отметить, что различные алюминиевые
виды, описанные выше, всегда присутствуют одновременно при любом рН
ценить. Влияние рН в водных системах в основном заключается в изменении
доля всех видов при изменении pH (электронное письмо от 2008 г.
Канадская ассоциация по очистке сточных вод – Дж. Пастернаку, Министерство охраны окружающей среды Канады;
без ссылки).
Моноядерный алюминий гидролизный продукты объединяются, образуя в растворе многоядерные частицы (Берч и Паркер 1996). Алюминий начинает полимеризоваться, когда рН кислой среды решение заметно возрастает более 4,5:
2 Al(OH)(H 2 O) 5 2+ → Al 2 (OH) 2 (H 2 8 O) 003 4+
+ 2
Н 2 О
Полимеризация постепенно переходит в
более крупные структуры, что в конечном итоге привело к образованию Al 13 поликатион
(Паркер и Берч, 1992а, 1992б).
Дрисколл, Коннектикут, Шехер В.Д. 1990. Химия алюминия в окружающей среде. Дж. Environ Perspect Health 12: 28–49.
Виттерс Х.Е., Ван Пуимбрук С., Стаутхарт AJHX, Bonga SEW. 1996. Физико-химический изменения алюминия в зонах смешения: смертность и физиологическая нарушения у кумжи ( Salmo trutta L.). Окружающая среда Токсикол Химия 15: 986–996.
Берч ПМ, Паркер Др. 1996. Водные многоядерные формы алюминия. Вышел: Спозито Г., редактор, Экологическая химия алюминия. 2-е издание. Бока Ратон, Флорида: CRC Press, с. 117–168.
Паркер Д.Р., Берч ПМ. 1992а. Идентификация и количественная оценка «Al13» тридекамерный поликатион с использованием феррона. Environ Sci Technol 26: 908–914.
Паркер Д.Р.,
Берч ПМ. 1992б. Образование тридекамерного поликатиона «Al13» в условиях
различные условия синтеза. Окружающая среда
Научные технологии 26: 914–921.
Окружающая среда
Научные технологии 26: 914–921.
Осаждение Al(OH)3 (Ksp) = 1,3×10-33) иногда используется…
Последние каналы
- Общая химия
Химия
908072 Общая химия 0087 Органическая химия
Биология
- Общая биология
- Микробиология
- Анатомия и физиология
- Генетика
- Клеточная биология
Математика
- Колледжская алгебра
- Тригонометрия
- Предварительный анализ
Физика 33 88
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Общественные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.



 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу: В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака: Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:
Leave A Comment