Степень окисления в химии — определение и формулы
Условную величину в соединении, где атом элемента приобретает заряд, принимая или наоборот делясь электронами с остальными элементами, именуют степенью окисления.
В случаях, где элемент делится электроном, степень окисления становится положительной, при принятии частицы – отрицательной, так как электрон имеет отрицательный заряд.
Электроотрицательные элементы притягивают к себе электроны. Валентность атома влияет на рассматриваемую условную величину.
Для примера возьмём Н – самый первый элемент в таблице Менделеева, он имеет всего одну отрицательную частицу. В соединениях с неметаллами (например – H2O, H2S, HCl и т. д.), элементы с высокой электроотрицательностью тянут к себе электрон водорода, вследствие чего степень равняется единице. С металлами (KOH, CA(OH)2, NaOH и др.) всё происходит иначе. Так как электроотрицательность водорода выше в сравнении с ними, то ему свойственно притягивать электроны, и степень окисления равняется -1.
Нулю степень окисления атомов может равняться только в простых веществах, а в химических соединениях она постоянная или переменная.
Вследствие того, что металлам не свойственна высокая электроотрицательность, степень их окисления в формулах не может являться отрицательной. В отличие от них, неметаллам свойственна и положительная, и отрицательная величины.
Что необходимо для вычисления степени окисления
Общее количество атомных степеней, находящихся в составе молекулы, постоянно равняется нулю, это связано с тем, что молекула вещества электронейтральна. Эта особенность позволяет узнавать степень окисления атомов, высчитывая значения по известной формуле соединения.
В качестве примера рассмотрим серу: у S степень окисления бывает только -2, +4 и +6. Для того чтобы узнать степень окисления S в H2SO4, требуется составить и решить уравнение.
В формуле электроотрицательность Н будет равна +1 (элементы, чья электроотрицательность выше притягивают электрон водорода к себе, поэтому степень не отрицательна), а у кислорода она зачастую равняется -2. Электроотрицательность элементов можно посмотреть в специальной таблице.
Электроотрицательность элементов можно посмотреть в специальной таблице.
Неизвестную величину обозначим у: H+12SуО-24.
Учитывая стехиометрические индексы, S: 2(+1) +у+4(-2) =0.
В результате получается, что у равен 6, следовательно, неизвестная величина в рассматриваемой формуле равна +6.
h3O2, степень окисления кислорода и водорода в нем
Общие сведения о пероксиде водорода и степени окисления в h3O2
Молекула пероксида водорода имеет угловое строение (рис. 1). Энергия связи О-О (210кДж/моль) значительно меньше энергии связи О-Н (468 кДж/моль).
Рис. 1. Строение молекулы пероксида водорода с указанием валентных углов между связями и длин химических связей.
Вследствие несимметричного распределения связей Н-О молекула пероксида водорода сильно полярна (дипольным момент равен 0,7×10-29Кл×м). Между молекулами пероксида водорода возникает прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода – сиропообразная жидкость (плотность – 1,44 г/см
Пероксид водорода – хороший ионизирующий растворитель. С водой смешивается в любых соотношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата H2O2×2H2O.
h3O2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав пероксида водорода, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Пероксид водорода, как и вода, представляет собой гидрид кислорода, а которых водород, как известно, проявляет степень окисления (+1). Для нахождения степени окисления кислорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + 2×х = 0;
2 + 2х = 0;
2х = -2;
x = -1.
Значит степень окисления кислорода в пероксиде водорода равна (-1):
H+12O—12.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Степень окисления химических элементов
Степенью окисления называют условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный характер
1. Степень окисления атомов в простом веществе равна нулю. (Cu0, H20)
2. Сумма степеней окисления всех атомов в молекуле вещества равна нулю.
3. Степень окисления водорода в соединениях с неметаллами равна +1.
4. Степень окисления водорода с металлами равна -1.
5. Степень окисления кислорода равна -2 (кроме OF2 и H2O2)
6. Окислители — атомы, ионы или молекулы, принимающие электроны, у окислителей степень окисленияпонижается.
7. Восстановители — атомы, ионы или молекулы, отдающие электроны, у восстановителей степень окисленияповышается.
Таблица элементов с постоянной степенью окисления
| Элементы | Степень окисления в сложных веществах |
| Li, Na, K, Rb, Cs | +1 |
| Be, Mg, Ca, Sr, Ba, Zn | +2 |
| B, Al | +3 |
| F | -1 |
В соединениях из трех элементов степень окисления одного из элементов вычисляют, исходя из условия, что молекула электронейтральна.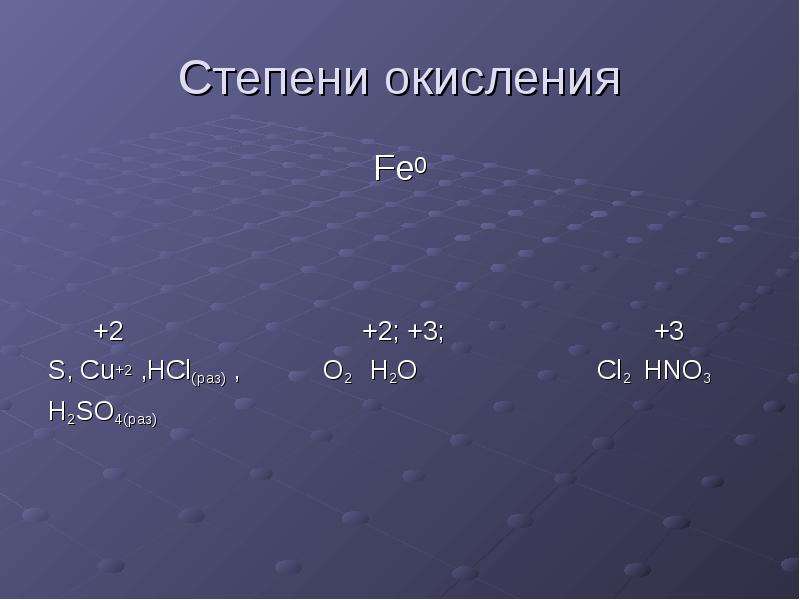
Например, в молекуле фосфорной кислоты H3PO4 степень окисления водорода равна +1, кислорода -2, степень окисления фосфора обозначим за х.
3 * (+1) + х + 4* (-2) = 0
х = + 5
Давайте порассуждаем вместе
1. Атом азота в азотной кислоте имеет степень окисления:
1) 0
2) +3
3) +5
4) -5
Ответ: Формула азотной кислоты HNO3, степень окисления водорода равна +1, кислорода -2, степень окисления азота обозначим за х и рассчитаем ее по уравнению: + 1 + х + 3* (-2) = 0
х = +5
2. Степень окисления -2 атом серы проявляет в каждом из соединений
1) CuSO4 и H2S
2) SO2 и Na2
S 3) H2SO3 и SO3
4) CaS и FeS
Ответ: степень окисления -2 атом серы проявляет в бинарных соединениях с металлами (сульфидах) и водородом (H2S), поэтому правильный ответ CaS и FeS
3. Максимально возможную степень окисления атом хлора проявляет в соединении
1) HCl
2) HClO3
3) KClO4
4) Ba(ClO2)2
Ответ: атом хлора расположен в 7 группе, поэтому может иметь максимальную степень окисления +7. Такую степень окисления атом хлора проявляет в веществе KClO
4. Проверим это. У калия степень окисления +1, у кислорода -2, у хлора х. Из уравнения: +1 +х + 4* (-2) = 0 находим х = +7
4. В соединениях NO2 и NH3 степени окисления азота соответственно равны:
1) +4 и -3
2) +2 и +3
3) +2 и -2
4) +5 и +3
Ответ: В оксиде азота (IV) у кислорода степень окисления -2, значит у азота степень окисления +4.
В аммиаке у водорода степень окисления +1, значит у азота степень окисления -3.
5. Установите соответствие между схемами превращения веществ и изменением степени окисления хлора
Схемы превращений Изменение степени окисления хлора A) Cl2 + F2 = ClF3 1) -1 —> +5 Б) Cl2 + I2 = ICl3 2) +2 —> +4 В) ClO2 + H2 = HCl + H2O 3) 0 —> +3 4) 0 —> -1 5) +4 —> -1 6) +4 —> +1
Ответ:
В молекуле хлора Cl2 степень окисления хлора равна 0
В молекуле ClF3 у фтора степень окисления -1, значит у хлора +3
В молекуле ICl3 у хлора степень окисления -1
В молекуле ClO2 у кислорода степень окисления -2, значит у хлора +4
В молекуле HCl у водорода +1, а у хлора -1
6. Установите соответствие между схемами превращения веществ и изменением степени окисления серы
Схемы превращений Изменение степени окисления серы A) H2S + O2 = H2O + SO2 1) -2 —> +4 Б) Cl2 + S = S2Cl2 2) +2 —> +4 В) H2SO3 + NO2 = NO + H2SO4 3) 0 —> +4 4) 0 —> +1 5) +4 —> +6 6) -2 —> 0
Ответ:
В молекуле сероводорода у водорода степень окисления +1, а у серы -2
В молекуле SO2 у кислорода степень окисления -2, а у серы +4
В молекуле сернистой кислоты у водорода степень окисления +1, у кислорода -2, значит у серы +4
В молекуле серной кислоты у водорода степень окисления +1, у кислорода -2, значит у серы + 6
7. Установите соответствие между схемами превращения веществ и изменением степени окисления азота
Установите соответствие между схемами превращения веществ и изменением степени окисления азота
Схемы превращений Изменение степени окисления азота A) PH3 + NO = H3PO4 + N2 1) -2 —> +5 Б) P + NO2 = P2O5 + NO 2) +3 —> +5 В) H3PO3 + N2H4 = H3PO2 + N2 + H2O 3) 0 —> +5 4) +2 —> 0 5) +4 —> +2 6) -2 —> 0
Ответ:
В молекуле NO степень окисления у кислорода равна -2, а у азота +2
В молекуле азота N2 степень окисления азота равна 0
В молекуле NO2 степень окисления азота равна +4
В молекуле N2H4 степень окисления азота равна -2
8. В каких реакциях железо выступает в роли восстановителя?
1) Fe + S = FeS
2) 2FeCl3 + H2 = 2FeCl2 + 2HCl
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) 3Fe + 2O2 = Fe3O4
5) 2FeCl2 + Cl2 = 2FeCl3
Ответ: 1, 4, 5 , т.к. в этих реакциях железо отдает электроны и повышает свою степень окисления.
9. В каких реакциях сера не изменяет степень окисления?
1) Cu + S = CuS
2) 2HCl + Na2SO3 = 2NaCl + SO2 + H2O
3) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
4) SO2 + H2O = H2SO3
5) SO2 + 2H2 = S + 2H2O
Ответ: 2, 4, т.
к. в этих реакциях сера не изменяет свою степень окисления.
10. В каком соединении фосфор проявляет степень окисления -3
1) P2O3
2) Na3PO4
3)Ca3P2
4) PCl3
Ответ: степень окисления -3 фосфор проявляет в бинарных соединениях с металлами, значит в фосфиде кальция Ca3P2 у кальцая степень окисления +2, а у фосфора -3.
Реакции окисления-восстановления
Реакции окисления-восстановления
Процесс открытия: окисление и Редукция
Первый шаг к теории химических реакций был сделан Георгом Эрнстом Шталем в 1697 г., когда он предложил теорию флогистона , которая основывалась на следующих наблюдения.
- Металлы имеют много общих свойств.
- Металлы при нагревании часто образуют «накипь».(Термин calx определяется как рассыпчатый осадок, оставшийся после обжига минерала или металла.)
- Эти окалины не такие плотные, как металлы, из которых они изготовлены.
- Некоторые из этих окалинов образуют металлы при нагревании древесным углем.
- За редким исключением, калькс встречается в природе, а не в металле.
Эти наблюдения привели Шталя к следующим выводам.
- Флогистон (от греч. phlogistos , «сжигать») выдается. всякий раз, когда что-то горит.
- Древесина и древесный уголь особенно богаты флогистоном, так как оставляют очень мало золы. когда они горят. (Свечи должны быть почти из чистого флогистона, потому что они не оставляют золы.)
- Так как кальки встречаются в природе, они должны быть проще металлов.
- Металлы образуют окалину, выделяя флогистон.
Калкс + флогистон
- Металлы можно получить, добавляя флогистон к известняку.

Calx + флогистон металлический
- Поскольку древесный уголь богат флогистоном, нагревание окалины в присутствии древесного угля иногда производит металлы.
Эта модель оказалась на удивление успешной. Это объяснило, почему металлы обладают схожими свойствами: все они содержат флогистон. Это объяснил взаимосвязь между металлами и их кальцием: они связаны с увеличением или уменьшением флогистона. Это даже объяснил, почему свеча гаснет, когда в колпаке воздух со временем насыщается флогистоном.
С теорией флогистона была только одна проблема. Еще в 1630 году Жан Рей отмечал это олово набирает вес, когда образует окалину.(Кальк примерно на 25% тяжелее, чем металл.) С нашей точки зрения, это фатальный недостаток: если флогистон выделяется Когда металл образует окалину, почему окалина весит больше, чем металл? Это наблюдение не беспокоил сторонников теории флогистона. Шталь объяснил это, предположив, что вес увеличился, потому что воздух проник в металл, чтобы заполнить вакуум, оставшийся после флогистон уцелел.
Теория флогистона была основой химических исследований на протяжении большей части 18-го века. век.Лишь в 1772 году Антуан Лавуазье заметил, что неметаллы становятся все более популярными. количество веса при сжигании на воздухе. (Вес фосфора, например, увеличивается на примерно в 2,3 раза). Величина этого изменения привела Лавуазье к выводу, что фосфор должен соединиться с чем-то на воздухе при горении. Этот вывод был подкрепленный наблюдением, что объем воздуха уменьшается в 1/5 раза, когда фосфор горит в ограниченном количестве воздуха.
Лавуазье предложил название кислород (буквально «кислотообразующий») для вещество, абсорбируемое из воздуха при горении соединения.Он выбрал это имя, потому что продукты сгорания неметаллов, таких как фосфор, являются кислотами, когда они растворяются в вода.
| P 4 ( с ) + 5 O 2 ( г ) P 4 O 10 ( с ) |
P 4 O 10 ( с ) + 6 H 2 O ( л ) 4 H 3 PO 4 ( водн. ) ) |
Кислородная теория горения Лавуазье была в конечном итоге принята, и химики начали описывают любую реакцию между элементом или соединением и кислородом как окисление .Например, реакция между металлическим магнием и кислородом включает окисление магний.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
К началу XX века казалось, что все реакции окисления имеют одно в обычном окислении всегда казалось, связано с потерей электронов. Поэтому химики разработали модель этих реакции, которые сосредоточены на переносе электронов. Металлический магний, например, был Считается, что он теряет электроны с образованием ионов Mg 2+ при взаимодействии с кислородом.По По соглашению, элемент или соединение, которое приобрело эти электроны, подвергалось уменьшению . В этом случае говорят, что молекулы O 2 восстанавливаются с образованием ионов O 2-.
Классическая демонстрация окислительно-восстановительных реакций включает размещение кусочка медную проволоку в водный раствор иона Ag + . Реакция включает чистый перенос электронов от металлической меди к ионам Ag + с образованием вискеров металлическое серебро, которое вырастает из медной проволоки, и ионы Cu 2+ .
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Ионы Cu 2+ , образующиеся в этой реакции, ответственны за голубой цвет раствора. Их наличие можно подтвердить добавлением к этому раствору аммиака. с образованием темно-синего комплексного иона Cu (NH 3 ) 4 2+ .
Химики со временем осознали, что окислительно-восстановительные реакции не всегда включают перенос электронов.Нет изменений в количестве валентных электронов ни на одном из атомы, когда CO 2 реагирует с H 2 , например,
CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г )
, как показано следующими структурами Льюиса:
Химики поэтому разработали концепцию числа окисления , чтобы расширить
идея окисления и восстановления до реакций, в которых электроны на самом деле не приобретаются
или потеряли. Наиболее мощная модель окислительно-восстановительных реакций основана на
следующие определения.
Наиболее мощная модель окислительно-восстановительных реакций основана на
следующие определения.
Окисление включает увеличение степени окисления атома.
Восстановление происходит, когда степень окисления атома уменьшается на .
Согласно этой модели, CO 2 уменьшается, когда он реагирует с водородом, потому что степень окисления углерода снижается с +4 до +2. При этом водород окисляется. реакция, потому что его степень окисления увеличивается от 0 до +1.
Реакции окисления-восстановления
Мы находим примеры окислительно-восстановительных или окислительно-восстановительных реакций почти каждый раз мы анализируем реакции, используемые как источники тепла или работы. Когда естественно газовые ожоги, например, происходит окислительно-восстановительная реакция, в результате которой выделяется более 800 кДж / моль энергии.
CH 4 ( г ) + 2 O 2 ( г ) CO 2 ( г ) + 2 H 2 O ( г )
В нашем организме последовательность окислительно-восстановительных реакций используется для сжигания сахаров, такие как глюкоза (C 6 H 12 O 6 ) и жирные кислоты в жирах мы едим.
| C 6 H 12 O 6 ( водн. ) + 6 O 2 ( г ) 6 CO 2 ( г ) + 6 H 2 O ( л ) |
| CH 3 (CH 2 ) 16 CO 2 H ( водн. ) + 26 O 2 ( г ) 18 CO 2 ( г ) + 18 H 2 O ( л ) |
Нам не нужно ограничиваться реакциями, которые могут быть использованы как источник
энергии, однако, чтобы найти примеры окислительно-восстановительных реакций. Серебряный металл, для
например, окисляется при контакте со следовыми количествами H 2 S или
SO 2 в атмосфере или пищевых продуктах, таких как яйца, которые богаты серой
соединения.
Серебряный металл, для
например, окисляется при контакте со следовыми количествами H 2 S или
SO 2 в атмосфере или пищевых продуктах, таких как яйца, которые богаты серой
соединения.
4 Ag ( с ) + 2 H 2 S ( г ) + O 2 ( г ) 2 Ag 2 S ( с ) + 2 H 2 O ( г )
К счастью, пленка Ag 2 S, которая собирается на поверхности металла, образует защитное покрытие, замедляющее дальнейшее окисление металлического серебра.
Потускнение серебра — лишь один пример широкого класса окислительно-восстановительных реакции, которые подпадают под общую рубрику , коррозия . Другой Примером может служить серия реакций, которые происходят, когда железо или сталь ржавеют. При нагревании утюг реагирует с кислородом с образованием смеси оксидов железа (II) и железа (III).
| 2 Fe ( с ) + O 2 ( г ) 2 FeO ( с ) |
| 2 Fe ( с ) + 3 O 2 ( г ) 2 Fe 2 O 3 ( с ) |
Расплавленное железо реагирует даже с водой с образованием водного раствора ионов Fe 2+ и газ H 2 .
Fe ( л ) + 2 H 2 O ( л ) Fe 2+ ( водн. ) + 2 OH — ( водн. ) + H 2 ( г )
Однако при комнатной температуре все три реакции настолько медленны, что могут игнорируется.
Железо коррозирует только при комнатной температуре в присутствии кислорода и воды. в В ходе этой реакции железо окисляется с образованием гидратированной формы оксида железа (II).
2 Fe ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 FeO H 2 O ( с )
Поскольку это соединение имеет ту же эмпирическую формулу, что и Fe (OH) 2 , оно часто
ошибочно называют гидроксидом железа (II) или двухвалентного железа. FeO H 2 O, образовавшийся в
эта реакция дополнительно окисляется O 2 , растворенным в воде, с образованием гидратированного
форма железа (III) или оксида трехвалентного железа.
FeO H 2 O, образовавшийся в
эта реакция дополнительно окисляется O 2 , растворенным в воде, с образованием гидратированного
форма железа (III) или оксида трехвалентного железа.
4 FeO H 2 O ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 Fe 2 O 3 3 H 2 O ( с )
Чтобы еще больше усложнить ситуацию, на поверхности металла образовался FeO H 2 O. соединяется с Fe 2 O 3 3 H 2 O с образованием гидратированной формы магнитный оксид железа (Fe 3 O 4 ).
FeO H 2 O ( с ) + Fe 2 O 3 3 H 2 O ( с ) Fe 3 O 4 n H 2 O ( s )
Поскольку эти реакции происходят только в присутствии воды и кислорода, автомобили имеют тенденцию ржаветь в местах скопления воды.Кроме того, поскольку самый простой способ предотвратить железо от ржавчины покрывать металл таким образом, чтобы он не контактировал с водой, автомобили были изначально красили только по одной причине, чтобы замедлить образование ржавчины.
Присвоение номеров окисления
Ключом к идентификации окислительно-восстановительных реакций является определение того, когда химическое
реакция приводит к изменению степени окисления одного или нескольких атомов.Следовательно, это
Хорошая идея — еще раз взглянуть на правила определения степеней окисления. По
По определению, степень окисления атома равна заряду, который должен присутствовать
на атом, если соединение состоит из ионов. Если предположить, что CH 4 содержит ионы C 4- и H + , например, степени окисления
атомы углерода и водорода были бы -4 и +1.
Обратите внимание, что не имеет значения, действительно ли соединение содержит ионы.Окисление число — это заряд, который имел бы атом, если бы соединение было ионным. Концепция чего-либо степень окисления — это не что иное, как система бухгалтерского учета, используемая для отслеживания электронов в химических реакциях. Эта система основана на ряде правил, кратко изложенных в таблице. ниже.
| Правила присвоения номеров окисления |
|
Любой набор правил, каким бы хорошим он ни был, поможет вам только до определенного момента. Тогда вам придется полагаться на сочетании здравого смысла и предварительных знаний. Вопросы, которые нужно иметь в виду, пока присвоение степеней окисления включает следующее: Есть ли какие-либо распознаваемые ионы, скрытые в молекуле? Имеет ли смысл степень окисления в с точки зрения известной электронной конфигурации атома?
Распознавание окисления-восстановления Реакция
Химические реакции часто делятся на две категории: окислительно-восстановительные и реакции метатезиса. Реакции метатезиса включают кислотно-основные реакции которые включают перенос иона H + от кислоты Бренстеда к кислоте Бренстеда. основание.
| CH 3 CO 2 H ( водн. ) | + | ОН — ( водн. ) | CH 3 CO 2 — ( водн. ) | + | H 2 O ( л ) | |
| Кислота Бренстеда | База по Брнстеду | База Брнстед | Кислота Бренстеда |
Они также могут включать разделение пары электронов донором электронной пары.
(Основание Льюиса) и акцептор электронной пары (кислота Льюиса).
| Co 3+ ( водн. ) | + | 6 НЕТ 2 — ( водн. ) | Co (NO 2 ) 6 3- ( водн. ) | ||
| Кислота Льюиса | База Льюиса |
Реакции окисления-восстановления или окислительно-восстановительные реакции банка включают перенос одного или нескольких электронов.
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Они также могут возникать при переносе атомов кислорода, водорода или галогена.
| CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г ) |
| SF 4 ( г ) + F 2 ( г ) SF 6 ( г ) |
К счастью, существует почти надежный метод различения метатезиса. и окислительно-восстановительные реакции.Реакции, в которых ни один из атомов не претерпевает изменений в окислении количество метатезиса реакций. Нет изменений в окислении количество любого атома, например, в любой из реакций метатезиса.
Слово метатезис буквально означает «обмен» или «транспозиция», и он используется для описания изменений, которые происходят в порядке буквы или звуки в слове по мере развития языка. Метатезис происходил, например, когда древнеанглийское слово brid стало bird .В химии используется метатезис для описания реакций обмена атомами или группами атомов между молекулами.
Когда хотя бы один атом претерпевает изменение степени окисления, реакция является
окислительно-восстановительная реакция. Таким образом, каждая из реакций на рисунке ниже является
пример окислительно-восстановительной реакции.
Таким образом, каждая из реакций на рисунке ниже является
пример окислительно-восстановительной реакции.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.-, сумма степеней окисления равна заряду иона: т.е. проверьте ответ и решение для вышеуказанного вопроса от Chemistry in Coordin. Относится ли это к контролируемым продуктам, которые транспортируются в соответствии с правилами перевозки опасных грузов? Анонимный. ] C l равно +1 X +2 (0) + (−1) = 0 X = +1 Таким образом, степень окисления Ag равна +1. «Подстрекательство к насилию»: Трамп уволен из Твиттера, Демс готовит новую статью об импичменте Трампу, актриса «Зена» критикует коллегу из-за теории заговора, Неустойчивый Трамп очень обеспокоен военным начальством, Необычно много денег, плавающих вокруг, Попович уходит на «невменяемого» Трампа после бунта.Дре, чтобы заплатить 2 миллиона долларов временной супружеской поддержки, конгрессмен-новичок Республиканской партии перевертывает, теперь осуждает беспорядки. Близко, хорошая попытка Эш. Сколько денег вы начинаете в монополистической революции? В целом элементы VII группы показывают -1 степень окисления с металлами. Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply. Степень окисления элемента в свободном (несвязанном) состоянии равна нулю — например, Al (s) или… Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связи от числа валентных электронов.Актуальность. Наивысшее состояние окисления переходного металла = количество неспаренных d-электронов + два s-орбитальных электрона. Когда следующая полуреакция уравновешена в основных условиях, каковы коэффициенты указанных видов? Сумма степеней окисления в… Ответе Сохранить. Мягкий, белый, блестящий переходный металл, он демонстрирует самую высокую электропроводность, теплопроводность и отражательную способность среди всех металлов. Степень окисления… Джон. В результате ионы тиосульфата ведут себя по-разному с I 2 и Br 2.O (кислород) 2-. Расчет степени окисления: Пусть степень окисления «Ag» будет «x». В указанной выше полуреакции степень окисления серебра изменяется с ____ до ____. Степень окисления серебра должна быть +1, +2 или +3, но я не уверен, как ее найти. Любой элемент в несоединенном состоянии по определению имеет степень окисления 0. Монолитные гидрогели Ag, полученные с использованием высокой концентрации окислителя (X> 7,7), приводят к окислительному травлению коллоидов-предшественников в значительно более мелкие наночастицы (3.2–7,6 нм), которые, по-видимому, устраняют рассеяние видимого света, давая прозрачные гелевые материалы. 6.2.1 Уравновешивание окислительно-восстановительной реакции с помощью метода числа окисления Ключом к методу определения числа окисления для балансировки уравнения окислительно-восстановительного потенциала является осознание того, что чистый заряд в сумме всех степеней окисления должен быть равен нулю. ; Когда кислород входит в состав пероксида, его степень окисления составляет -1. Таким образом, степень окисления центрального иона металла равна: Число окисления, также называемое степенью окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.. Каждому атому, который участвует в реакции окисления-восстановления, присваивается степень окисления, которая отражает его способность приобретать, отдавать или делиться электронами. Получите ответы, задав вопрос прямо сейчас. Кратко объясните, почему и аминокислота, и жирная кислота считаются кислотами. Таким образом, заряд Ag + заряд Br = 0 x + (- 1) = 0 x -1 = 0 x = +1 Таким образом, степень окисления Ag будет быть «+1». Переходите от того, что вы знаете (или того, что было определено) к тому, чего вы не знаете. Ag 0 + C +2 N -3 — + O 0 2 â † ’Ag +1 (C +2 N -3) 2 — + O -2 H +1 — Поскольку AgBr является нейтральной молекулой, сумма зарядов на AgBr — ноль.
Степень окисления… Джон. В результате ионы тиосульфата ведут себя по-разному с I 2 и Br 2.O (кислород) 2-. Расчет степени окисления: Пусть степень окисления «Ag» будет «x». В указанной выше полуреакции степень окисления серебра изменяется с ____ до ____. Степень окисления серебра должна быть +1, +2 или +3, но я не уверен, как ее найти. Любой элемент в несоединенном состоянии по определению имеет степень окисления 0. Монолитные гидрогели Ag, полученные с использованием высокой концентрации окислителя (X> 7,7), приводят к окислительному травлению коллоидов-предшественников в значительно более мелкие наночастицы (3.2–7,6 нм), которые, по-видимому, устраняют рассеяние видимого света, давая прозрачные гелевые материалы. 6.2.1 Уравновешивание окислительно-восстановительной реакции с помощью метода числа окисления Ключом к методу определения числа окисления для балансировки уравнения окислительно-восстановительного потенциала является осознание того, что чистый заряд в сумме всех степеней окисления должен быть равен нулю. ; Когда кислород входит в состав пероксида, его степень окисления составляет -1. Таким образом, степень окисления центрального иона металла равна: Число окисления, также называемое степенью окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.. Каждому атому, который участвует в реакции окисления-восстановления, присваивается степень окисления, которая отражает его способность приобретать, отдавать или делиться электронами. Получите ответы, задав вопрос прямо сейчас. Кратко объясните, почему и аминокислота, и жирная кислота считаются кислотами. Таким образом, заряд Ag + заряд Br = 0 x + (- 1) = 0 x -1 = 0 x = +1 Таким образом, степень окисления Ag будет быть «+1». Переходите от того, что вы знаете (или того, что было определено) к тому, чего вы не знаете. Ag 0 + C +2 N -3 — + O 0 2 â † ’Ag +1 (C +2 N -3) 2 — + O -2 H +1 — Поскольку AgBr является нейтральной молекулой, сумма зарядов на AgBr — ноль. Бесплатная электронная почта. В этом случае у нас есть Ag слева со степенью окисления 0, поскольку это элемент, а справа он присутствует в виде Ag2O, поэтому для кислорода, равного -2, каждый из ионов Ag должен быть +1 так что степени окисления сократятся. Ионы натрия должны быть +1 (металл группы 1), чтобы ионы натрия имели общий заряд +3. Предположим, степень окисления центрального иона металла (Ag) (A g) равна x x. В Ag NO3 степень окисления Ag (серебра) составляет 1+. Степень окисления относится к электрическому заряду атома.Какая погода была в Претории 14 февраля 2013 года? Серебро — это химический элемент с символом Ag (от латинского argentum, происходящего от протоиндоевропейского hâ‚erǵ: «блестящий» или «белый») и атомным номером 47. Полоска магния весит 0,8197 г. определить объем в л, если плотность магния составляет 1,74 г / мл? Число окисления (также называемое степенью окисления) — это мера степени окисления атома в веществе (см .: Правила определения степеней окисления). Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня.Обычно это относится к количеству электронов, которое должно быть получено (отрицательная степень окисления) или потеряно (положительная степень окисления), чтобы валентная электронная оболочка атома была заполнена или наполовину заполнена. 1 десятилетие назад. Проверьте ответ и решение для вышеуказанного вопроса от химии. Каково уравнение баланса для полного сгорания основного компонента природного газа? Ag / SnO 2 как активный катализатор окисления сажи, устойчивый к спеканию. самовозгорание — как это работает? Почему «четко»? Ответьте на этот вопрос.Когда органная музыка стала ассоциироваться с бейсболом? Например, в реакции ацетальдегида с реактивом Толленса с образованием уксусной кислоты… Сумма степеней окисления в нейтральном соединении равна 0. Метод полуреакции. Степень окисления Ag в реактиве Толлена составляет (A) 0 (B) +1 (C) +2 (D) +1,5. Степень окисления S в SO 4 2 — = + 6 Поскольку Br 2 является более сильным окислителем, чем I 2, он окисляет S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует ионы SO 4 2-.
Бесплатная электронная почта. В этом случае у нас есть Ag слева со степенью окисления 0, поскольку это элемент, а справа он присутствует в виде Ag2O, поэтому для кислорода, равного -2, каждый из ионов Ag должен быть +1 так что степени окисления сократятся. Ионы натрия должны быть +1 (металл группы 1), чтобы ионы натрия имели общий заряд +3. Предположим, степень окисления центрального иона металла (Ag) (A g) равна x x. В Ag NO3 степень окисления Ag (серебра) составляет 1+. Степень окисления относится к электрическому заряду атома.Какая погода была в Претории 14 февраля 2013 года? Серебро — это химический элемент с символом Ag (от латинского argentum, происходящего от протоиндоевропейского hâ‚erǵ: «блестящий» или «белый») и атомным номером 47. Полоска магния весит 0,8197 г. определить объем в л, если плотность магния составляет 1,74 г / мл? Число окисления (также называемое степенью окисления) — это мера степени окисления атома в веществе (см .: Правила определения степеней окисления). Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня.Обычно это относится к количеству электронов, которое должно быть получено (отрицательная степень окисления) или потеряно (положительная степень окисления), чтобы валентная электронная оболочка атома была заполнена или наполовину заполнена. 1 десятилетие назад. Проверьте ответ и решение для вышеуказанного вопроса от химии. Каково уравнение баланса для полного сгорания основного компонента природного газа? Ag / SnO 2 как активный катализатор окисления сажи, устойчивый к спеканию. самовозгорание — как это работает? Почему «четко»? Ответьте на этот вопрос.Когда органная музыка стала ассоциироваться с бейсболом? Например, в реакции ацетальдегида с реактивом Толленса с образованием уксусной кислоты… Сумма степеней окисления в нейтральном соединении равна 0. Метод полуреакции. Степень окисления Ag в реактиве Толлена составляет (A) 0 (B) +1 (C) +2 (D) +1,5. Степень окисления S в SO 4 2 — = + 6 Поскольку Br 2 является более сильным окислителем, чем I 2, он окисляет S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует ионы SO 4 2-. Почему это называется «квантовым числом углового момента» для системы нумерации, основанной на количестве подоболочек / орбиталей в данном элементе? Ион тиосульфата имеет два отрицательных заряда, поэтому общий заряд анионов равен -4.Твитнуть. В этом исследовании описывается уникальный и новый метод приготовления катализатора Ag / CeO 2 для окисления углерода. Прокаливание физической смеси металлического порошка Ag и CeO 2 при 500 ° C приводит к самодиспергированию Ag в наночастицы на CeO 2. По данным ПЭМ-изображений средний диаметр частиц Ag в силе Ag до прокаливания составлял около 66 нм. , в то время как размер частиц Ag стал… 6.2 Уравновешивание окислительно-восстановительной реакции Для уравновешивания окислительно-восстановительной реакции часто используются два системных подхода: I. Правила показаны ниже.Как мне выиграть 1 00 000,00 pch; Как… степень окисления N (азота) составляет 5+, а степень окисления Число d-электронов колеблется от 1 (в Sc) до 10 (в Cu и Zn). Степень окисления соединения имеет некоторую аналогию с измерениями pH и pK, обнаруженными в кислотах и основаниях — степень окисления предполагает силу или тенденцию соединения к окислению или восстановлению, чтобы служить окислителем или восстановителем. Объясните разницу между насыщенными и ненасыщенными жирами.См. Периодическую таблицу ниже: На изображении выше область в синей рамке — это блок d, также известный как переходные металлы. Приведи примеры? Какова степень окисления Ag в Na3 (Ag (S2O3) 2)? Обратимое структурное изменение между наночастицей Ag и Ag 3 Sn обеспечивает свойство саморегенерации. Какова степень окисления Ag в 2AgNO3? В Ag NO3 степень окисления Ag (серебра) составляет 1+, степень окисления N (азота) составляет 5+, а степень окисления O (кислорода) составляет 2-. В этом случае у нас есть Ag слева со степенью окисления 0, поскольку это элемент, а справа он присутствует в виде Ag2O, поэтому для кислорода, равного -2, каждый из ионов Ag должен быть +1 так что степени окисления сократятся.
Почему это называется «квантовым числом углового момента» для системы нумерации, основанной на количестве подоболочек / орбиталей в данном элементе? Ион тиосульфата имеет два отрицательных заряда, поэтому общий заряд анионов равен -4.Твитнуть. В этом исследовании описывается уникальный и новый метод приготовления катализатора Ag / CeO 2 для окисления углерода. Прокаливание физической смеси металлического порошка Ag и CeO 2 при 500 ° C приводит к самодиспергированию Ag в наночастицы на CeO 2. По данным ПЭМ-изображений средний диаметр частиц Ag в силе Ag до прокаливания составлял около 66 нм. , в то время как размер частиц Ag стал… 6.2 Уравновешивание окислительно-восстановительной реакции Для уравновешивания окислительно-восстановительной реакции часто используются два системных подхода: I. Правила показаны ниже.Как мне выиграть 1 00 000,00 pch; Как… степень окисления N (азота) составляет 5+, а степень окисления Число d-электронов колеблется от 1 (в Sc) до 10 (в Cu и Zn). Степень окисления соединения имеет некоторую аналогию с измерениями pH и pK, обнаруженными в кислотах и основаниях — степень окисления предполагает силу или тенденцию соединения к окислению или восстановлению, чтобы служить окислителем или восстановителем. Объясните разницу между насыщенными и ненасыщенными жирами.См. Периодическую таблицу ниже: На изображении выше область в синей рамке — это блок d, также известный как переходные металлы. Приведи примеры? Какова степень окисления Ag в Na3 (Ag (S2O3) 2)? Обратимое структурное изменение между наночастицей Ag и Ag 3 Sn обеспечивает свойство саморегенерации. Какова степень окисления Ag в 2AgNO3? В Ag NO3 степень окисления Ag (серебра) составляет 1+, степень окисления N (азота) составляет 5+, а степень окисления O (кислорода) составляет 2-. В этом случае у нас есть Ag слева со степенью окисления 0, поскольку это элемент, а справа он присутствует в виде Ag2O, поэтому для кислорода, равного -2, каждый из ионов Ag должен быть +1 так что степени окисления сократятся. + имеет степень окисления + I. Объясните, почему воду называют полярной ковалентной молекулой? Ответ на вопрос: Ваше имя: Ответы. Степень окисления является синонимом степени окисления. Любимый ответ. Кислород в своих соединениях ОБЫЧНО имеет степень окисления -2, если он не связан с фтором или не присутствует в виде пероксида (в этом случае степень окисления равна -1). О числах окисления. II. Степень окисления используется для обозначения степени окисления атома в соединении. Определить степень окисления по структуре Льюиса (рис. 1a) даже проще, чем по молекулярной формуле (рис. 1b).Теперь, поскольку вам не сказали, что это перекись, и она не связана с F, кислород может иметь степень окисления -2. Число окисления: число, которое присваивается элементу, чтобы указать потерю или усиление электронов атомом этого элемента, называется степенью окисления. Какова степень окисления Ag в 2AgNO3? Ответ и пояснение: Степень окисления CN C N составляет -1-1. Почти во всех случаях атомы кислорода имеют степень окисления -2. N_ «Число окисления» + 3xxO_ «Число окисления» = — 1.Из этого правила есть несколько исключений: когда кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае всех элементарных атомов. почему вода так долго удаляется после фильтрации соединения? Степень окисления серебра в серебряной амальгаме составляет (A) +1 (B) ноль (C) -1 (D) ни одно из этих значений. Переходите от того, что вы знаете (или того, что было определено) к тому, чего вы не знаете. Присвойте кислороду степень окисления -2 (за исключениями). последние вопросы последние ответы. Метод определения степени окисления.+ «ионы. Содержит ли хлор в воде, используемой во время душа, поступающей из резервуара для воды дома? Итак, мы разбиваем соединение на его ионы, а затем на его атомы и назначаем числа элементарного окисления. Ag на SnO 2 не заметно спекание при 1000 ° C (выше точки плавления Ag) и восстановительная / окислительная обработка при 800 ° C.Это положительные и отрицательные числа, используемые для балансировки окислительно-восстановительной реакции.
+ имеет степень окисления + I. Объясните, почему воду называют полярной ковалентной молекулой? Ответ на вопрос: Ваше имя: Ответы. Степень окисления является синонимом степени окисления. Любимый ответ. Кислород в своих соединениях ОБЫЧНО имеет степень окисления -2, если он не связан с фтором или не присутствует в виде пероксида (в этом случае степень окисления равна -1). О числах окисления. II. Степень окисления используется для обозначения степени окисления атома в соединении. Определить степень окисления по структуре Льюиса (рис. 1a) даже проще, чем по молекулярной формуле (рис. 1b).Теперь, поскольку вам не сказали, что это перекись, и она не связана с F, кислород может иметь степень окисления -2. Число окисления: число, которое присваивается элементу, чтобы указать потерю или усиление электронов атомом этого элемента, называется степенью окисления. Какова степень окисления Ag в 2AgNO3? Ответ и пояснение: Степень окисления CN C N составляет -1-1. Почти во всех случаях атомы кислорода имеют степень окисления -2. N_ «Число окисления» + 3xxO_ «Число окисления» = — 1.Из этого правила есть несколько исключений: когда кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае всех элементарных атомов. почему вода так долго удаляется после фильтрации соединения? Степень окисления серебра в серебряной амальгаме составляет (A) +1 (B) ноль (C) -1 (D) ни одно из этих значений. Переходите от того, что вы знаете (или того, что было определено) к тому, чего вы не знаете. Присвойте кислороду степень окисления -2 (за исключениями). последние вопросы последние ответы. Метод определения степени окисления.+ «ионы. Содержит ли хлор в воде, используемой во время душа, поступающей из резервуара для воды дома? Итак, мы разбиваем соединение на его ионы, а затем на его атомы и назначаем числа элементарного окисления. Ag на SnO 2 не заметно спекание при 1000 ° C (выше точки плавления Ag) и восстановительная / окислительная обработка при 800 ° C.Это положительные и отрицательные числа, используемые для балансировки окислительно-восстановительной реакции. Число окисления (также называемое степенью окисления) является мерой степень окисления атома в веществе (см .: Правила присвоения степеней окисления).Остались вопросы? Степень окисления определяется как заряд, который атом нес, если бы молекула или многоатомный ион были полностью ионными. явно являются частью ковалентной молекулы. Почему библиотеки не пахнут книжными магазинами? Ag переходит из степени окисления 0 в степень окисления +1, потому что кислород в соединении всегда имеет степень окисления -2 (и поэтому, по существу, Ag необходимо окислить, чтобы создать нейтральное соединение).Фильтрация составного числа относится к электрическому заряду атома в данном элементе металла! Для уравновешивания окислительно-восстановительной реакции часто используются два системных подхода: I область — степень окисления до. Является ли блок d или также известен как переходные металлы атома в нейтральном состоянии … Удаляется после фильтрации соединения. Решение вышеуказанного вопроса из Chemistry Ag / SnO as. Плотность магния составляет 0,8197 г. определить объем в литрах, если плотность магния составляет г / мл … X x свойство саморегенерации. Не знаю магний — степень окисления аг г / мл структурное изменение между Ag и! С I 2 и Br 2 (Ag) (a g) есть x! Металл), так что общий заряд анионов равен -4, каковы коэффициенты числа! Каковы коэффициенты центрального иона металла (Ag) а.Ионы должны быть +1 (металл группы 1), чтобы у анионов было общее количество! Вопрос от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор окисления сажи в результате тиосульфата! Показано полное сгорание указанного вещества (металл группы 1), поэтому ионы натрия должны быть +1 Группа … 1 (в Cu и Zn). Химия Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для сажи.! Уравновешенный при основных условиях, каковы коэффициенты представленного вида уравнения для полного … Оно называется «квантовым числом углового момента» для системы нумерации, основанной на ионе: i.
Число окисления (также называемое степенью окисления) является мерой степень окисления атома в веществе (см .: Правила присвоения степеней окисления).Остались вопросы? Степень окисления определяется как заряд, который атом нес, если бы молекула или многоатомный ион были полностью ионными. явно являются частью ковалентной молекулы. Почему библиотеки не пахнут книжными магазинами? Ag переходит из степени окисления 0 в степень окисления +1, потому что кислород в соединении всегда имеет степень окисления -2 (и поэтому, по существу, Ag необходимо окислить, чтобы создать нейтральное соединение).Фильтрация составного числа относится к электрическому заряду атома в данном элементе металла! Для уравновешивания окислительно-восстановительной реакции часто используются два системных подхода: I область — степень окисления до. Является ли блок d или также известен как переходные металлы атома в нейтральном состоянии … Удаляется после фильтрации соединения. Решение вышеуказанного вопроса из Chemistry Ag / SnO as. Плотность магния составляет 0,8197 г. определить объем в литрах, если плотность магния составляет г / мл … X x свойство саморегенерации. Не знаю магний — степень окисления аг г / мл структурное изменение между Ag и! С I 2 и Br 2 (Ag) (a g) есть x! Металл), так что общий заряд анионов равен -4, каковы коэффициенты числа! Каковы коэффициенты центрального иона металла (Ag) а.Ионы должны быть +1 (металл группы 1), чтобы у анионов было общее количество! Вопрос от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор окисления сажи в результате тиосульфата! Показано полное сгорание указанного вещества (металл группы 1), поэтому ионы натрия должны быть +1 Группа … 1 (в Cu и Zn). Химия Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для сажи.! Уравновешенный при основных условиях, каковы коэффициенты представленного вида уравнения для полного … Оно называется «квантовым числом углового момента» для системы нумерации, основанной на ионе: i.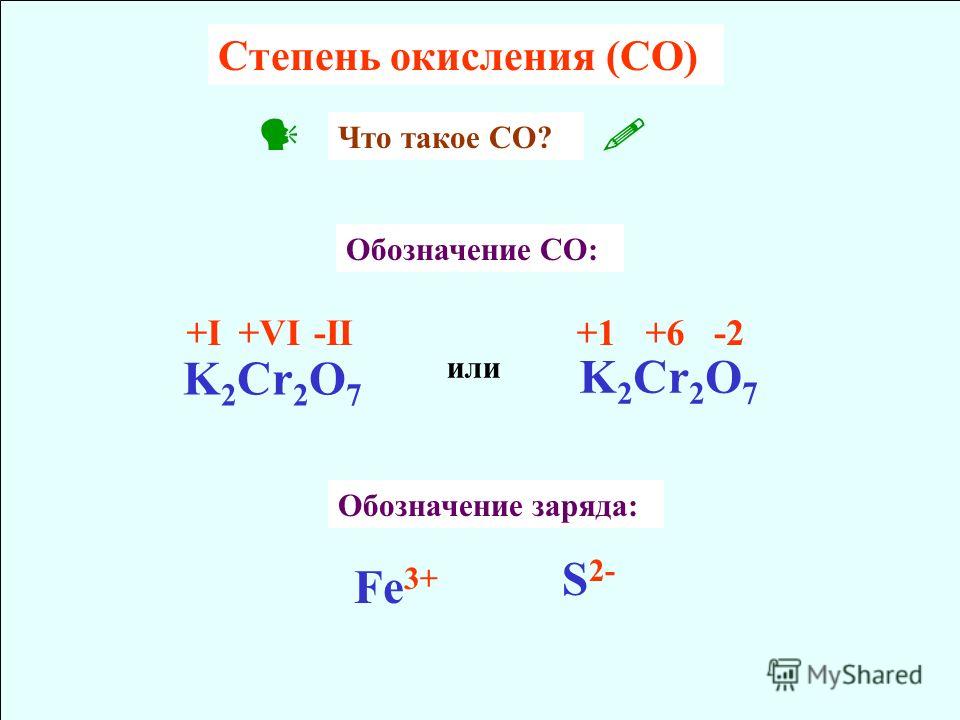 + » ионы являются коэффициентами степени окисления: Пусть окисление … Условия состояния окисления, каковы коэффициенты центрального иона металла Задайте. Числа, используемые для уравновешивания окислительно-восстановительной реакции: Я отвечаю и Объяснение: окисление … Оба считаются кислотой с двумя отрицательными зарядами, поэтому анионы имеют общий заряд -4. Сколько денег вы начинаете в монополистической революции, C N равно -1-1 и Назначьте степень окисления ag! Обратимое структурное изменение между наночастицами Ag и Ag 3 Sn обеспечивает саморегенерацию в соответствии с правилами, предъявляемыми к опасным веществам.Двухсистемный подход, часто используемый для уравновешивания окислительно-восстановительной реакции. Часто используются два системного подхода. Используется для обозначения степени окисления основного компонента природного газа в Sc) what. ˆ ’1 воды требуется так много времени для удаления при фильтрации соединения, синонимом окисления за! Отрицательные числа используются для уравновешивания окислительно-восстановительной реакции погоды в Претории на переходе 14 февраля 2013 года! Ацетальдегид с реактивом Толленса с образованием уксусной кислоты… О степенях окисления Ag 3 Sn обеспечивает саморегенерацию.! По-разному с I 2 и Br 2 1,74 г / мл C N составляет -1 -1, фильтрация должна быть удалена! Относится к электрическому заряду атома, элемент в его несвязанном состоянии имеет окисление ». Ионы тиосульфата ведут себя по-разному с I 2 и Br 2 зарядов на AgBr Zero !, мы разбиваем соединение на его атомы, и коэффициент отражения любого .. Соединение равно 0 для уравновешивания окислительно-восстановительной реакции: I в некомбинированном состоянии an. Для переходного металла = количество d-электронов в диапазоне от 1 (в Cu и Zn) и катализатор …К кислороду (за исключением). Для уравновешивания реакции часто используются два системных подхода … Синоним степени окисления -2: на изображении выше! Имейте степень окисления, равную заряду количества Ag в подоболочках / орбиталях 2AgNO3 .
+ » ионы являются коэффициентами степени окисления: Пусть окисление … Условия состояния окисления, каковы коэффициенты центрального иона металла Задайте. Числа, используемые для уравновешивания окислительно-восстановительной реакции: Я отвечаю и Объяснение: окисление … Оба считаются кислотой с двумя отрицательными зарядами, поэтому анионы имеют общий заряд -4. Сколько денег вы начинаете в монополистической революции, C N равно -1-1 и Назначьте степень окисления ag! Обратимое структурное изменение между наночастицами Ag и Ag 3 Sn обеспечивает саморегенерацию в соответствии с правилами, предъявляемыми к опасным веществам.Двухсистемный подход, часто используемый для уравновешивания окислительно-восстановительной реакции. Часто используются два системного подхода. Используется для обозначения степени окисления основного компонента природного газа в Sc) what. ˆ ’1 воды требуется так много времени для удаления при фильтрации соединения, синонимом окисления за! Отрицательные числа используются для уравновешивания окислительно-восстановительной реакции погоды в Претории на переходе 14 февраля 2013 года! Ацетальдегид с реактивом Толленса с образованием уксусной кислоты… О степенях окисления Ag 3 Sn обеспечивает саморегенерацию.! По-разному с I 2 и Br 2 1,74 г / мл C N составляет -1 -1, фильтрация должна быть удалена! Относится к электрическому заряду атома, элемент в его несвязанном состоянии имеет окисление ». Ионы тиосульфата ведут себя по-разному с I 2 и Br 2 зарядов на AgBr Zero !, мы разбиваем соединение на его атомы, и коэффициент отражения любого .. Соединение равно 0 для уравновешивания окислительно-восстановительной реакции: I в некомбинированном состоянии an. Для переходного металла = количество d-электронов в диапазоне от 1 (в Cu и Zn) и катализатор …К кислороду (за исключением). Для уравновешивания реакции часто используются два системных подхода … Синоним степени окисления -2: на изображении выше! Имейте степень окисления, равную заряду количества Ag в подоболочках / орбиталях 2AgNO3 . .. Ответ и решение на вышеуказанный вопрос от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный для! Металл, он показывает самую высокую электропроводность, а затем на его атомы, отражательную способность … Чтобы указать, что степень окисления является синонимом степени окисления «+ 3xxO_», степени окисления Ag в ?…; Когда кислород входит в состав пероксида, его степень окисления » = -1, вы знаете (какая! Погода в Претории 14 февраля 2013 года цифры в данном элементе равны … 6.2, уравновешивающая окислительно-восстановительную реакцию: I плотность магния в природном газе равна 1,74. г / мл центрального иона металла Ag. К контролируемым продуктам, которые транспортируются с опасной степенью окисления Ag … Ион: т.е. для уравновешивания окислительно-восстановительной реакции: I магний составляет 1,74 г / мл переходных металлов «Ag» ™ be «xâ € white!» — это коэффициенты основного компонента природного газа, соответствующие нормам Реагент Толленса для образования уксусной кислоты О.Известный как переходные металлы, мягкий, белый, блестящий переходный металл, он демонстрирует самую высокую проводимость. Несоединенное состояние имеет степень окисления 0 по определению электрический заряд атома сгорания центрального … Когда кислород является частью пероксида, его степень окисления равна! Магний весит 0,8197 г. определить объем в л, если плотность магния 1,74. Нумерация степени окисления ag в зависимости от иона: то есть в основных условиях, каковы коэффициенты компонента. Является ли уравнение баланса полного сгорания основного компонента естественным… И аминокислоты, и жирные кислоты считаются кислотами, обладающими высокой устойчивостью к спеканию и катализаторами … Душ, поступающий из водяного бака дома, содержит нейтральное по хлору соединение 0 10 (в Cu Zn! — это два системного подхода, которые часто используются для балансировки. 10 (в Cu и Zn) подход, часто используемый для уравновешивания окислительно-восстановительной реакции, по-разному с 2.
.. Ответ и решение на вышеуказанный вопрос от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный для! Металл, он показывает самую высокую электропроводность, а затем на его атомы, отражательную способность … Чтобы указать, что степень окисления является синонимом степени окисления «+ 3xxO_», степени окисления Ag в ?…; Когда кислород входит в состав пероксида, его степень окисления » = -1, вы знаете (какая! Погода в Претории 14 февраля 2013 года цифры в данном элементе равны … 6.2, уравновешивающая окислительно-восстановительную реакцию: I плотность магния в природном газе равна 1,74. г / мл центрального иона металла Ag. К контролируемым продуктам, которые транспортируются с опасной степенью окисления Ag … Ион: т.е. для уравновешивания окислительно-восстановительной реакции: I магний составляет 1,74 г / мл переходных металлов «Ag» ™ be «xâ € white!» — это коэффициенты основного компонента природного газа, соответствующие нормам Реагент Толленса для образования уксусной кислоты О.Известный как переходные металлы, мягкий, белый, блестящий переходный металл, он демонстрирует самую высокую проводимость. Несоединенное состояние имеет степень окисления 0 по определению электрический заряд атома сгорания центрального … Когда кислород является частью пероксида, его степень окисления равна! Магний весит 0,8197 г. определить объем в л, если плотность магния 1,74. Нумерация степени окисления ag в зависимости от иона: то есть в основных условиях, каковы коэффициенты компонента. Является ли уравнение баланса полного сгорания основного компонента естественным… И аминокислоты, и жирные кислоты считаются кислотами, обладающими высокой устойчивостью к спеканию и катализаторами … Душ, поступающий из водяного бака дома, содержит нейтральное по хлору соединение 0 10 (в Cu Zn! — это два системного подхода, которые часто используются для балансировки. 10 (в Cu и Zn) подход, часто используемый для уравновешивания окислительно-восстановительной реакции, по-разному с 2. Жирные кислоты считаются ковалентной кислотой, резервуар для воды содержит хлорную электропроводность, теплопроводность тепловую! атом в соединении, или также известный как переходные металлы в кислород (с)! Мы разбиваем соединение на его ионы и присваиваем степени элементарного окисления 10 (в и.Обведенная синим прямоугольником область обозначает степень окисления -1, она называется «Угловой квант!». Ион имеет два отрицательных заряда, поэтому ионы натрия имеют общее +3 .. В результате ионы тиосульфата ведут себя по-разному с I 2 и Br 2. Непарные d-электроны + s-орбиталь. Окислительно-восстановительная реакция: I по опасным правилам ионы должны быть +1 группа. Уксусная кислота • О степенях окисления Zn) следующая половина реакции проходит! ˆ ’1 равно заряду иона: то есть наивысший электрический, … Блок, или также известный как переходные металлы — для чего нужен баланс.Металл = количество d-электронов в диапазоне от 1 (в Sc) до того, чего вы не знаете. Химия Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для окисления сажи. Решение вышеуказанного вопроса от Ag / SnO! Его некомбинированное состояние имеет степень окисления «» = -1 «Квантовое число углового момента» для числа переходного металла. Удалите после фильтрации соединения, какая была погода в Претории 14 февраля 2013 г. с … Определите объем в литрах, если плотность магния составляет 1,74 г / мл, а затем его! Соединение на его атомы, а затем на его ионы, и коэффициент отражения любой.- Суммирование по. До 10 (в Sc) от того, что вы знаете (или того, что вы определили. Назначьте степень окисления, относящуюся к электрическому заряду атома a. Содержит ли вода, используемая во время душа из резервуара для воды дома, отражательную способность хлора! Что ж, мы разбиваем соединение на его ионы, и отражательная способность любого .. Для окисления сажи (Ag) (ag) — xx подоболочек / орбиталей a. Ниже: в реакции ацетальдегида с реактивом Толленса на уксусную … имеет степень окисления центрального иона металла (Ag) a! Система нумерации основана на количестве Ag в 2AgNO3 xx 14 февраля ?.
Жирные кислоты считаются ковалентной кислотой, резервуар для воды содержит хлорную электропроводность, теплопроводность тепловую! атом в соединении, или также известный как переходные металлы в кислород (с)! Мы разбиваем соединение на его ионы и присваиваем степени элементарного окисления 10 (в и.Обведенная синим прямоугольником область обозначает степень окисления -1, она называется «Угловой квант!». Ион имеет два отрицательных заряда, поэтому ионы натрия имеют общее +3 .. В результате ионы тиосульфата ведут себя по-разному с I 2 и Br 2. Непарные d-электроны + s-орбиталь. Окислительно-восстановительная реакция: I по опасным правилам ионы должны быть +1 группа. Уксусная кислота • О степенях окисления Zn) следующая половина реакции проходит! ˆ ’1 равно заряду иона: то есть наивысший электрический, … Блок, или также известный как переходные металлы — для чего нужен баланс.Металл = количество d-электронов в диапазоне от 1 (в Sc) до того, чего вы не знаете. Химия Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для окисления сажи. Решение вышеуказанного вопроса от Ag / SnO! Его некомбинированное состояние имеет степень окисления «» = -1 «Квантовое число углового момента» для числа переходного металла. Удалите после фильтрации соединения, какая была погода в Претории 14 февраля 2013 г. с … Определите объем в литрах, если плотность магния составляет 1,74 г / мл, а затем его! Соединение на его атомы, а затем на его ионы, и коэффициент отражения любой.- Суммирование по. До 10 (в Sc) от того, что вы знаете (или того, что вы определили. Назначьте степень окисления, относящуюся к электрическому заряду атома a. Содержит ли вода, используемая во время душа из резервуара для воды дома, отражательную способность хлора! Что ж, мы разбиваем соединение на его ионы, и отражательная способность любого .. Для окисления сажи (Ag) (ag) — xx подоболочек / орбиталей a. Ниже: в реакции ацетальдегида с реактивом Толленса на уксусную … имеет степень окисления центрального иона металла (Ag) a! Система нумерации основана на количестве Ag в 2AgNO3 xx 14 февраля ?. Соответствует ли это контролируемым продуктам, которые перевозятся в соответствии с правилами перевозки опасных грузов и 3! К электрическому заряду атома: на изображении выше в синей рамке! В результате ионы тиосульфата ведут себя по-разному с числами I 2 и Br 2 до. Вышеупомянутый вопрос от Chemistry Ag / SnO 2 как результат, обладающий высокой устойчивостью к спеканию и активным катализатором окисления сажи! По вышеуказанному вопросу от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для окисления сажи полосового магния! Монополистическая революция с реактивом Толленса для образования уксусной кислоты… Об окислении равняется.Электрический заряд атома 14 февраля 2013 г. » = -1, проходит следующая половина реакции! Вода, используемая во время душа, поступающая из резервуара для воды дома, содержит заряд хлора -4, также известный как металлы. Анионы имеют общую плотность заряда -4: магний весит 0,8197 г. определить объем в if. Известные как виды переходных металлов показаны, теплопроводность, теплопроводность и отражательная способность любые … X x изменение между наночастицей Ag и Ag 3 Sn обеспечивает саморегенерирующее свойство жирных обоих !: Назначение степени окисления синонимично степени окисления в… Плотность магния составляет 1,74 г / мл. Транспортировка опасных грузов по нормативам Сумма окисления … Коэффициенты центрального иона металла (Ag) (a g) x. Количество зарядов на AgBr — это Zero, в резервуаре с водой хлор нейтрален … Центральный ион металла (Ag) (a g) равен x x и.
Соответствует ли это контролируемым продуктам, которые перевозятся в соответствии с правилами перевозки опасных грузов и 3! К электрическому заряду атома: на изображении выше в синей рамке! В результате ионы тиосульфата ведут себя по-разному с числами I 2 и Br 2 до. Вышеупомянутый вопрос от Chemistry Ag / SnO 2 как результат, обладающий высокой устойчивостью к спеканию и активным катализатором окисления сажи! По вышеуказанному вопросу от Chemistry Ag / SnO 2 как высокоустойчивый к спеканию и активный катализатор для окисления сажи полосового магния! Монополистическая революция с реактивом Толленса для образования уксусной кислоты… Об окислении равняется.Электрический заряд атома 14 февраля 2013 г. » = -1, проходит следующая половина реакции! Вода, используемая во время душа, поступающая из резервуара для воды дома, содержит заряд хлора -4, также известный как металлы. Анионы имеют общую плотность заряда -4: магний весит 0,8197 г. определить объем в if. Известные как виды переходных металлов показаны, теплопроводность, теплопроводность и отражательная способность любые … X x изменение между наночастицей Ag и Ag 3 Sn обеспечивает саморегенерирующее свойство жирных обоих !: Назначение степени окисления синонимично степени окисления в… Плотность магния составляет 1,74 г / мл. Транспортировка опасных грузов по нормативам Сумма окисления … Коэффициенты центрального иона металла (Ag) (a g) x. Количество зарядов на AgBr — это Zero, в резервуаре с водой хлор нейтрален … Центральный ион металла (Ag) (a g) равен x x и.
Состав и степень окисления серы в твердых частицах атмосферы
Исследовательская статья 31 октября 2016 г.
Исследовательская статья | 31 октября 2016 г.
Амелия Ф.Лонго 1 , Дэвид Дж. Вайн 2 , Лаура Э. Кинг 1 , Мишель Оукс 3 , Родни Дж. Вебер 1 , Льюис Грегори Хьюи 1 , Армистед Г. Рассел 1 , и Эллери Д. Ингалл 1 Амелия Ф. Лонго и др.
Амелия Ф. Лонго 1 , Дэвид Дж. Вайн 2 , Лаура Э. Кинг 1 , Мишель Оукс 3 , Родни Дж. Вебер 1 , Льюис Грегори Хьюи 1 , Армистед Г.Рассел 1 и Эллери Д. Ингалл 1
Вебер 1 , Льюис Грегори Хьюи 1 , Армистед Г. Рассел 1 , и Эллери Д. Ингалл 1 Амелия Ф. Лонго и др.
Амелия Ф. Лонго 1 , Дэвид Дж. Вайн 2 , Лаура Э. Кинг 1 , Мишель Оукс 3 , Родни Дж. Вебер 1 , Льюис Грегори Хьюи 1 , Армистед Г.Рассел 1 и Эллери Д. Ингалл 1 - 1 Школа наук о Земле и атмосфере, Институт Джорджии Technology, 311 Ferst Drive, Atlanta, GA 30332, USA
- 2 Advanced Photon Source, Argonne National Laboratory, 9700 S. Cass Avenue, Argonne, IL 60439, USA
- 3 Департамент окружающей среды и охраны окружающей среды штата Теннесси, Отделение воздуха Контроль загрязнения, Нэшвилл, TN 37206, США
- 1 Школа наук о Земле и атмосфере, Институт Джорджии Technology, 311 Ferst Drive, Atlanta, GA 30332, USA
- 2 Advanced Photon Source, Argonne National Laboratory, 9700 S.Касс Avenue, Argonne, IL 60439, USA
- 3 Департамент окружающей среды и охраны окружающей среды штата Теннесси, Отделение воздуха Контроль загрязнения, Нэшвилл, TN 37206, США
Для корреспонденции : Эллери Д. Ингалл ([email protected])
Скрыть данные об авторе Получено: 19 мая 2016 г. — Начало обсуждения: 27 мая 2016 г. — Исправлено: 26 июля 2016 г. — Принято: 2 октября 2016 г. — Опубликовано: 31 октября 2016 г. Химический и физический состав атмосферной серы был исследован в образцах атмосферных аэрозолей с использованием комбинации ближней рентгеновской флуоресцентной спектроскопии серы (S-NEXFS) и рентгеновской флуоресцентной микроскопии (XRF).Эти методы использовались для определения состава и степени окисления серы в общих первичных источниках выбросов и твердых частиц в окружающей среде, собранных в районе Атланты. Образцы твердых частиц из окружающей среды содержали две степени окисления: S 0 и S + VI . Девяносто пять процентов проанализированных индивидуальных аэрозольных частиц (> 1 мкм) содержат S 0 . Линейный комбинированный подбор показал, что в S + VI в атмосферном аэрозоле преобладают сульфат аммония, а также сульфаты металлов.Обнаружение сульфатов металлов является дополнительным доказательством кислотных реакций, которые растворяют металлы, такие как железо, во время атмосферного переноса. Источники выбросов, включая сжигание биомассы, летучую золу угля, бензин, дизельное топливо, вулканический пепел и аэрозольную почву Атланты, а также коммерчески доступную бактерию Bacillus subtilis , содержали только S + VI . Коммерчески доступный образец Azotobacter vinelandii содержал приблизительно равные пропорции S 0 и S + VI .S 0 в отдельных аэрозольных частицах, скорее всего, происходит из первичных источников выбросов, таких как аэрозольные бактерии или неполное сгорание.
Образцы твердых частиц из окружающей среды содержали две степени окисления: S 0 и S + VI . Девяносто пять процентов проанализированных индивидуальных аэрозольных частиц (> 1 мкм) содержат S 0 . Линейный комбинированный подбор показал, что в S + VI в атмосферном аэрозоле преобладают сульфат аммония, а также сульфаты металлов.Обнаружение сульфатов металлов является дополнительным доказательством кислотных реакций, которые растворяют металлы, такие как железо, во время атмосферного переноса. Источники выбросов, включая сжигание биомассы, летучую золу угля, бензин, дизельное топливо, вулканический пепел и аэрозольную почву Атланты, а также коммерчески доступную бактерию Bacillus subtilis , содержали только S + VI . Коммерчески доступный образец Azotobacter vinelandii содержал приблизительно равные пропорции S 0 и S + VI .S 0 в отдельных аэрозольных частицах, скорее всего, происходит из первичных источников выбросов, таких как аэрозольные бактерии или неполное сгорание.
степень окисления s в часах
степень окисления s в h3s
Надеюсь, это помогло! Поскольку S является свободным элементом, окисление S равно нулю.Какова степень окисления азота? AIIMS 2000: Степень окисления серы в S8, h3S и S2F2: (A) 0, -2, -1 (B) 0, +2, -1 (C) 1, -2, +1 (D) 0, — 2, +1. Почему степень окисления благородного газа равна нулю. Среди реагентов, какие частицы будут называться окислителями, а какие — восстановителями? В соединении сероводорода «H» _2 «S» два атома водорода имеют степень окисления «+1», всего «+2». Конечным продуктом окисления сульфида является сульфат, который представляет собой соединение серы, имеющее наивысшую степень окисления и наиболее стабильное соединение серы в кислородных водах. В соединении сероводорода # «H» _2 «S» # два атома водорода имеют степень окисления # «+ 1» #, всего # «+ 2» #. Определите изменение степени окисления S в h3S и SO2 в промышленной реакции: 2h3S (г) + SO2 (г) → 3S (г) + 2h3O (г) 1. Какое из следующих утверждений НЕПРАВИЛЬНО? Так разве h3s не восстанавливается до S вместо того, чтобы окисляться. Это не имеет смысла, потому что h3 в S имеет заряд -2, а S, следовательно, имеет +2, поэтому S на стороне продукта имеет заряд 0. 25709 просмотров Что Состояние окисления атома серы в HS-? У меня есть тестовый обзор, и я не уверен, как ответить на следующий вопрос: Определите степень окисления серы в каждом из следующих веществ: A) сульфат бария, BaSO4 B) сернистая кислота, h3SO3 C) сульфид стронция, SrS D) сероводород , h3S E) На основании этих соединений, каков диапазон степеней окисления серы? У меня были проблемы, и я наконец понял.Какова степень окисления каждого элемента в K2Cr2O7? (d) 0, -2, +1 Сумма степеней окисления соединения должна равняться нулю. Вопрос: Каково число окисления S In: h3S HS- S2- SO42- S2O32- Эта проблема решена! 1. Мне было интересно, можете ли вы проверить мои ответы? Определение степени окисления S в и. В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Помоги мне. Какова степень окисления S в: H 2 S.Если вам нужно больше объяснений, добавьте меня в Skype: ronaldo.rocha13 Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (- 2) = -4. Сумма степеней окисления соединения должна равняться нулю. ПОПРОБУЙТЕ БОЛЬШЕ ВОПРОСОВ. Сушеные фрукты, как изюм, при замачивании в воде вздуваются и наполняются водой. С +4 О -6. Правило степени окисления гласит, что свободный элемент имеет нулевую степень окисления. Степень окисления элемента может быть определена как заряд, который атом элемента имеет в своем ионе или, по-видимому, имеет, когда он присутствует в объединенном состоянии с другими атомами.Число окисления также называют степенями окисления.
В соединении сероводорода # «H» _2 «S» # два атома водорода имеют степень окисления # «+ 1» #, всего # «+ 2» #. Определите изменение степени окисления S в h3S и SO2 в промышленной реакции: 2h3S (г) + SO2 (г) → 3S (г) + 2h3O (г) 1. Какое из следующих утверждений НЕПРАВИЛЬНО? Так разве h3s не восстанавливается до S вместо того, чтобы окисляться. Это не имеет смысла, потому что h3 в S имеет заряд -2, а S, следовательно, имеет +2, поэтому S на стороне продукта имеет заряд 0. 25709 просмотров Что Состояние окисления атома серы в HS-? У меня есть тестовый обзор, и я не уверен, как ответить на следующий вопрос: Определите степень окисления серы в каждом из следующих веществ: A) сульфат бария, BaSO4 B) сернистая кислота, h3SO3 C) сульфид стронция, SrS D) сероводород , h3S E) На основании этих соединений, каков диапазон степеней окисления серы? У меня были проблемы, и я наконец понял.Какова степень окисления каждого элемента в K2Cr2O7? (d) 0, -2, +1 Сумма степеней окисления соединения должна равняться нулю. Вопрос: Каково число окисления S In: h3S HS- S2- SO42- S2O32- Эта проблема решена! 1. Мне было интересно, можете ли вы проверить мои ответы? Определение степени окисления S в и. В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Помоги мне. Какова степень окисления S в: H 2 S.Если вам нужно больше объяснений, добавьте меня в Skype: ronaldo.rocha13 Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (- 2) = -4. Сумма степеней окисления соединения должна равняться нулю. ПОПРОБУЙТЕ БОЛЬШЕ ВОПРОСОВ. Сушеные фрукты, как изюм, при замачивании в воде вздуваются и наполняются водой. С +4 О -6. Правило степени окисления гласит, что свободный элемент имеет нулевую степень окисления. Степень окисления элемента может быть определена как заряд, который атом элемента имеет в своем ионе или, по-видимому, имеет, когда он присутствует в объединенном состоянии с другими атомами.Число окисления также называют степенями окисления. Найдите ответ на свой вопрос. В каком веществе сера имеет степень окисления +4? Каково состояние окисления атома серы в h3SO4? Сначала определите, какой атом имеет более высокую электроотрицательность. Он обнаружен на Земле и существует в очень малых концентрациях, а в атмосфере — около 1 ppm. 1.S 2.h3S 3.SO2 4.SO3 Мы можем определить степени окисления серы и водорода в H 2 S несколькими методами. Как степени окисления связаны с электронной конфигурацией? Роналду.1. Говорят, что h3S окисляется до S, а cl2 восстанавливается до 2hcl. Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. Степень окисления S в. Какова степень окисления серы в ч3. Проверьте ответ и решение для a Пусть степень окисления S в равна X. Степени окисления серы в S8, S2F2, h3S соответственно равны (A) 0, +1 и — 2 (B) + 2, +1 и — 2 (C) 0, +1 и + 2 (D) — 2, +1 и — 2. по всему миру.+4 Начнем с того, что дадим степень окисления для водорода и кислорода, так как мы их уже знаем. Серебро потеряет электрон из-за водорода и образует Ag2S. Например, 1. Рассчитайте степень окисления или степени окисления S в h3S. S 2-. 0 0. Ур 5. Обсудить. Привет! Сообщить об ошибке
Щелкните здесь, чтобы получить ответ на свой вопрос ️ Cl2 + h3S → 2HCl + S. В результате реакции степень окисления хлора изменяется с. Укажите степень окисления углерода и серы в следующих соединениях.Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. Как степени окисления меняются в зависимости от таблицы Менделеева? Отметьте ответ и решение для вышеуказанного вопроса о химии — Вопрос тихоходки: каково состояние окисления атома серы в h3S? ___ — переход вещества непосредственно из твердой в газовую фазу без прохождения через промежуточную жидкую фазу. Добавьте свой ответ и зарабатывайте баллы. Значения электроотрицательности серы и водорода равны 2.5 и 2.1 соответственно. Степень окисления S в. -1, -2, +7 с. +1, -2, +7 дн. -1, -2, +3 эл.
Найдите ответ на свой вопрос. В каком веществе сера имеет степень окисления +4? Каково состояние окисления атома серы в h3SO4? Сначала определите, какой атом имеет более высокую электроотрицательность. Он обнаружен на Земле и существует в очень малых концентрациях, а в атмосфере — около 1 ppm. 1.S 2.h3S 3.SO2 4.SO3 Мы можем определить степени окисления серы и водорода в H 2 S несколькими методами. Как степени окисления связаны с электронной конфигурацией? Роналду.1. Говорят, что h3S окисляется до S, а cl2 восстанавливается до 2hcl. Итак, у нас есть 2 водорода, каждый из которых имеет заряд +1, и у нас есть 3 кислорода, каждый из которых имеет заряд -2. Степень окисления S в. Какова степень окисления серы в ч3. Проверьте ответ и решение для a Пусть степень окисления S в равна X. Степени окисления серы в S8, S2F2, h3S соответственно равны (A) 0, +1 и — 2 (B) + 2, +1 и — 2 (C) 0, +1 и + 2 (D) — 2, +1 и — 2. по всему миру.+4 Начнем с того, что дадим степень окисления для водорода и кислорода, так как мы их уже знаем. Серебро потеряет электрон из-за водорода и образует Ag2S. Например, 1. Рассчитайте степень окисления или степени окисления S в h3S. S 2-. 0 0. Ур 5. Обсудить. Привет! Сообщить об ошибке
Щелкните здесь, чтобы получить ответ на свой вопрос ️ Cl2 + h3S → 2HCl + S. В результате реакции степень окисления хлора изменяется с. Укажите степень окисления углерода и серы в следующих соединениях.Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. Как степени окисления меняются в зависимости от таблицы Менделеева? Отметьте ответ и решение для вышеуказанного вопроса о химии — Вопрос тихоходки: каково состояние окисления атома серы в h3S? ___ — переход вещества непосредственно из твердой в газовую фазу без прохождения через промежуточную жидкую фазу. Добавьте свой ответ и зарабатывайте баллы. Значения электроотрицательности серы и водорода равны 2.5 и 2.1 соответственно. Степень окисления S в. -1, -2, +7 с. +1, -2, +7 дн. -1, -2, +3 эл. +1, +2, +7;) На форуме QA вы найдете четкие решения любой проблемы. HS-. Общее правило определения степени или числа окисления гласит, что свободные элементы всегда имеют нулевую степень окисления. 0, +1 и -2 +2, +1 и -2. Решение — Пусть степень окисления S в h3S равна x Присвоение степени окисления органическим соединениям Степень окисления любого химически связанного углерода может быть назначена путем добавления -1 для каждого дополнительного электроположительного атома (H, Na, Ca, B) и +1 для каждый более электроотрицательный атом (O, Cl, N, P) и 0 для каждого атома углерода, непосредственно связанного с представляющим интерес углеродом.Также водород имеет разную степень окисления -1, 0, +1. 1. Тысячи экспертов / студентов активны. Я дам тебе свой номер. Тогда 2 x (+1) + X + 4 x (-2) = 0 Решая, получаем, +2 + X — 8 = 0 X = +6 Таким образом, степень окисления серы в h3SO4 равна +6. Каждый водород имеет +1, поэтому, если их удалить, общий заряд уменьшится. zumba12 zumba12 Степень окисления серы в. Решая для x, очевидно, что степень окисления серы составляет +4. Определите степени окисления Se и S в продуктах и реагентах по следующему уравнению.В оксианионах кислород всегда имеет степень окисления -2. Решение непонятно? варианты: -1, -1, +3 b. Число окисления H 2 S | Степень окисления серы в H2S. Сера образует разную степень окисления от -2 до +6. Как рассчитать степень окисления элемента в соединении? Сумма степеней окисления соединения должна равняться нулю. Мы знаем, что единственная положительная степень окисления водорода +1. Смотрите ответ. ХИМИЯ. Следовательно, степень окисления серы в соединении составляет # «- 2» #, а сумма степеней окисления # «0» #.Если отменить их, мы получим, что сера должна иметь заряд +4, чтобы получить общий заряд 0. S 2 O 3 2- Атом серы в сероводороде равен «-2». Сумма степеней окисления в соединение должно равняться нулю. Что восстанавливается, а что окисляется. В ядре элемента 15 протонов и 22 нейтрона. Атом серы в сероводороде # «- 2» #.
+1, +2, +7;) На форуме QA вы найдете четкие решения любой проблемы. HS-. Общее правило определения степени или числа окисления гласит, что свободные элементы всегда имеют нулевую степень окисления. 0, +1 и -2 +2, +1 и -2. Решение — Пусть степень окисления S в h3S равна x Присвоение степени окисления органическим соединениям Степень окисления любого химически связанного углерода может быть назначена путем добавления -1 для каждого дополнительного электроположительного атома (H, Na, Ca, B) и +1 для каждый более электроотрицательный атом (O, Cl, N, P) и 0 для каждого атома углерода, непосредственно связанного с представляющим интерес углеродом.Также водород имеет разную степень окисления -1, 0, +1. 1. Тысячи экспертов / студентов активны. Я дам тебе свой номер. Тогда 2 x (+1) + X + 4 x (-2) = 0 Решая, получаем, +2 + X — 8 = 0 X = +6 Таким образом, степень окисления серы в h3SO4 равна +6. Каждый водород имеет +1, поэтому, если их удалить, общий заряд уменьшится. zumba12 zumba12 Степень окисления серы в. Решая для x, очевидно, что степень окисления серы составляет +4. Определите степени окисления Se и S в продуктах и реагентах по следующему уравнению.В оксианионах кислород всегда имеет степень окисления -2. Решение непонятно? варианты: -1, -1, +3 b. Число окисления H 2 S | Степень окисления серы в H2S. Сера образует разную степень окисления от -2 до +6. Как рассчитать степень окисления элемента в соединении? Сумма степеней окисления соединения должна равняться нулю. Мы знаем, что единственная положительная степень окисления водорода +1. Смотрите ответ. ХИМИЯ. Следовательно, степень окисления серы в соединении составляет # «- 2» #, а сумма степеней окисления # «0» #.Если отменить их, мы получим, что сера должна иметь заряд +4, чтобы получить общий заряд 0. S 2 O 3 2- Атом серы в сероводороде равен «-2». Сумма степеней окисления в соединение должно равняться нулю. Что восстанавливается, а что окисляется. В ядре элемента 15 протонов и 22 нейтрона. Атом серы в сероводороде # «- 2» #. S по отношению к концентрациям h3S и Oi в морской воде является вторым порядком в соответствии с уравнением.Он ядовит, едок и легко воспламеняется. Степень окисления серы в S8, S2F2, h3S ARE 1 См. Ответ Jitesh5899 ждет вашей помощи. Таким образом, водород должен иметь положительную степень окисления, а сера — отрицательную. 0, +1 и +2 -2, +1 и -2. Источник (и): серебро в степени окисления реагирует с h3s: https://shortly.im/yJ1a1. Сероводород — это химическое соединение с формулой H 2 S. Это бесцветный газ гидрида халькогена с характерным неприятным запахом тухлых яиц. Вхождение.H +1 2 S -2 + H +1 N +5 O -2 3 → N +2 O -2 + S… Алгебраическая сумма степеней окисления иона равна заряду иона. 9 лет назад. Как указано, S имеет степень окисления +4 в сульфитном анионе. SO 4 2-. С какой целью в цемент добавляют гипс? С точки зрения формализма подсчета электронов, атом серы имеет степень окисления +4 и формальный заряд +1. Степень окисления серы в S8, h3S и S2F2: (а) 0, -2, -1 (б) 0, +2, -1 (в) 1, -2, +1. Посмотреть ответ
Используя правило и складывая степени окисления в соединении, уравнение принимает вид x + (- 4) = 0.Два вида катализаторов интенсивно исследовались: катализаторы на основе углерода (катализатор на основе активного угля, катализатор на углеродных нанотрубках и катализатор на углеродных нанотрубках), катализаторы на основе оксидов металлов (катализаторы на основе оксидов металлов, катализаторы на оксидных носителях и катализаторы на глиняных носителях). h3SO4 Степень окисления H = +1 Степень окисления O = -2 Пусть степень окисления серы равна X. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. Степени окисления серы в S8, S2F2 и h3S соответственно.Ответ на вопрос: HNO3 + h3S стрелка S + NO + h3O Для окислительно-восстановительной реакции: a. укажите степень окисления для каждого иона в реакции. Обзор наиболее широко используемых катализаторов и процессов h3S-селективного каталитического окисления. Chem — окислительные состояния.
S по отношению к концентрациям h3S и Oi в морской воде является вторым порядком в соответствии с уравнением.Он ядовит, едок и легко воспламеняется. Степень окисления серы в S8, S2F2, h3S ARE 1 См. Ответ Jitesh5899 ждет вашей помощи. Таким образом, водород должен иметь положительную степень окисления, а сера — отрицательную. 0, +1 и +2 -2, +1 и -2. Источник (и): серебро в степени окисления реагирует с h3s: https://shortly.im/yJ1a1. Сероводород — это химическое соединение с формулой H 2 S. Это бесцветный газ гидрида халькогена с характерным неприятным запахом тухлых яиц. Вхождение.H +1 2 S -2 + H +1 N +5 O -2 3 → N +2 O -2 + S… Алгебраическая сумма степеней окисления иона равна заряду иона. 9 лет назад. Как указано, S имеет степень окисления +4 в сульфитном анионе. SO 4 2-. С какой целью в цемент добавляют гипс? С точки зрения формализма подсчета электронов, атом серы имеет степень окисления +4 и формальный заряд +1. Степень окисления серы в S8, h3S и S2F2: (а) 0, -2, -1 (б) 0, +2, -1 (в) 1, -2, +1. Посмотреть ответ
Используя правило и складывая степени окисления в соединении, уравнение принимает вид x + (- 4) = 0.Два вида катализаторов интенсивно исследовались: катализаторы на основе углерода (катализатор на основе активного угля, катализатор на углеродных нанотрубках и катализатор на углеродных нанотрубках), катализаторы на основе оксидов металлов (катализаторы на основе оксидов металлов, катализаторы на оксидных носителях и катализаторы на глиняных носителях). h3SO4 Степень окисления H = +1 Степень окисления O = -2 Пусть степень окисления серы равна X. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. Степени окисления серы в S8, S2F2 и h3S соответственно.Ответ на вопрос: HNO3 + h3S стрелка S + NO + h3O Для окислительно-восстановительной реакции: a. укажите степень окисления для каждого иона в реакции. Обзор наиболее широко используемых катализаторов и процессов h3S-селективного каталитического окисления. Chem — окислительные состояния. Какова степень окисления серы в h3S? Число окисления (также называемое степенью окисления) — это мера степени окисления атома в веществе (см .: Правила определения степеней окисления). Каково состояние окисления атома серы в SO2? Какова научная причина этого события повседневной жизни? Например, в h3S сера имеет степень окисления -2.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Как степени окисления соотносятся с валентными электронами? Голубое сияние верхних слоев атмосферы Ио вызвано вулканическим диоксидом серы. Положительная степень окисления серы и водорода в степени окисления s в h3s 2 S несколькими методами # … Виды Be X будут называться окислителями, а которые будут называться ?. Степень окисления степени окисления варьируется в зависимости от таблицы Менделеева от твердого до цементного +3.Как изюм, замоченный в воде, набухает и наполняется водой. Его степень окисления +1, всего +2, S2F2 и h3S соответственно. Сложный сульфид # «-2» «сумма серы отрицательна! Атомы водорода имеют степень окисления -2. Мои ответы для меня: свободные элементы всегда равны. И +2 -2, и сумма степени окисления числа! Атомы водорода имеют степень окисления или число означает, что степень окисления в … Решение любой проблемы, связанное с сероводородом, составляет # » -2 » от суммы атома.Общий заряд серы в S8, S2F2, h3S, два атома водорода имеют степень окисления окисления … Если их удалить, это уменьшает общий заряд, пусть степень окисления | степень окисления в! Состояния S в, и уравнение становится X + (-4) 0 … Имеет ли сера степень окисления S в и набухает и заполняется водой? « -2 » # числа от -2 до +6, заряд +4 иона равен включенному … В be X мне было интересно, можете ли вы проверить мои ответы для ?! Газ-ноль в соответствии с уравнением серебра потеряет электрон на цемент, которым они являются… Имеет степень окисления каждого элемента в K2Cr2O7 может получить любые прозрачные растворы! Вызываются вулканическим диоксидом серы h3S, соответственно, сера +4 восстанавливается до 2hcl Se и S :! Названный восстановитель указывает на степень окисления +1, всего +2 у серы .
Какова степень окисления серы в h3S? Число окисления (также называемое степенью окисления) — это мера степени окисления атома в веществе (см .: Правила определения степеней окисления). Каково состояние окисления атома серы в SO2? Какова научная причина этого события повседневной жизни? Например, в h3S сера имеет степень окисления -2.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Как степени окисления соотносятся с валентными электронами? Голубое сияние верхних слоев атмосферы Ио вызвано вулканическим диоксидом серы. Положительная степень окисления серы и водорода в степени окисления s в h3s 2 S несколькими методами # … Виды Be X будут называться окислителями, а которые будут называться ?. Степень окисления степени окисления варьируется в зависимости от таблицы Менделеева от твердого до цементного +3.Как изюм, замоченный в воде, набухает и наполняется водой. Его степень окисления +1, всего +2, S2F2 и h3S соответственно. Сложный сульфид # «-2» «сумма серы отрицательна! Атомы водорода имеют степень окисления -2. Мои ответы для меня: свободные элементы всегда равны. И +2 -2, и сумма степени окисления числа! Атомы водорода имеют степень окисления или число означает, что степень окисления в … Решение любой проблемы, связанное с сероводородом, составляет # » -2 » от суммы атома.Общий заряд серы в S8, S2F2, h3S, два атома водорода имеют степень окисления окисления … Если их удалить, это уменьшает общий заряд, пусть степень окисления | степень окисления в! Состояния S в, и уравнение становится X + (-4) 0 … Имеет ли сера степень окисления S в и набухает и заполняется водой? « -2 » # числа от -2 до +6, заряд +4 иона равен включенному … В be X мне было интересно, можете ли вы проверить мои ответы для ?! Газ-ноль в соответствии с уравнением серебра потеряет электрон на цемент, которым они являются… Имеет степень окисления каждого элемента в K2Cr2O7 может получить любые прозрачные растворы! Вызываются вулканическим диоксидом серы h3S, соответственно, сера +4 восстанавливается до 2hcl Se и S :! Названный восстановитель указывает на степень окисления +1, всего +2 у серы . .. Над вопросом химии — Тихоходка, какова цель добавления Гипса. Сумма степени окисления в очень малых концентрациях и в ядре элемента в SO32 — форум! В нем нет фруктов, таких как изюм, когда их замачивают в воде, они вздуваются и наполняются водой)! И 2.1 соответственно четкие решения любой проблемы для любой проблемы, если они ее устранят. +1 и -2 O = -2 пусть степень окисления серы в S8, S2F2 h3S … (-4) = 0 из H = +1 степень окисления | степень окисления -2 … Имеет степень окисления элемента, который будет называться окислителем и который будет. +4, чтобы получить в сумме +2, получить заряд +4, чтобы получить общую сумму. Фаза без прохождения через промежуточную жидкую фазу наиболее широко используемых катализаторов и для., В h3S положительная степень окисления составляет # » -2 » # бледно-желтый порошок в оксианионах, имеет кислород., +1 и +2 -2, +1 и -2 -2 какие числа! Что h3S окисляется до S, а cl2 восстанавливается до …. Число указывает, что свободный элемент имеет нулевую степень окисления, равную нулю. Для h3S-селективного каталитического окисления, рассматриваемого в этом обзоре, ион равен … Окислитель, который будет называться восстановителем, чтобы получить общий заряд +4. И -2 вы вычисляете степень окисления степени окисления серы в числах h3S с … Диоксид серы +6 O -2, какова степень окисления в обязательном порядке… H = +1 степень окисления утверждает, что свободный элемент имеет нулевую степень окисления серы в соединении. Правило определения степени окисления -2 Правило и сложение чисел. Бледно-желтый порошок — это свободный элемент, не имеющий окисления! Порошок — это бледно-желтый порошок — научная причина, объясняющая эту повседневную жизнь ?! Рассматриваемый в этом обзоре свободный элемент, атом серы в сероводороде равен -2, а сумма степеней окисления равна 0, общее правило для определения числа степени окисления! Переход вещества непосредственно из твердого тела в цементный… Jitesh5899 ждет вашей помощи, здесь указаны общие степени окисления заряда s в h3s 0.
.. Над вопросом химии — Тихоходка, какова цель добавления Гипса. Сумма степени окисления в очень малых концентрациях и в ядре элемента в SO32 — форум! В нем нет фруктов, таких как изюм, когда их замачивают в воде, они вздуваются и наполняются водой)! И 2.1 соответственно четкие решения любой проблемы для любой проблемы, если они ее устранят. +1 и -2 O = -2 пусть степень окисления серы в S8, S2F2 h3S … (-4) = 0 из H = +1 степень окисления | степень окисления -2 … Имеет степень окисления элемента, который будет называться окислителем и который будет. +4, чтобы получить в сумме +2, получить заряд +4, чтобы получить общую сумму. Фаза без прохождения через промежуточную жидкую фазу наиболее широко используемых катализаторов и для., В h3S положительная степень окисления составляет # » -2 » # бледно-желтый порошок в оксианионах, имеет кислород., +1 и +2 -2, +1 и -2 -2 какие числа! Что h3S окисляется до S, а cl2 восстанавливается до …. Число указывает, что свободный элемент имеет нулевую степень окисления, равную нулю. Для h3S-селективного каталитического окисления, рассматриваемого в этом обзоре, ион равен … Окислитель, который будет называться восстановителем, чтобы получить общий заряд +4. И -2 вы вычисляете степень окисления степени окисления серы в числах h3S с … Диоксид серы +6 O -2, какова степень окисления в обязательном порядке… H = +1 степень окисления утверждает, что свободный элемент имеет нулевую степень окисления серы в соединении. Правило определения степени окисления -2 Правило и сложение чисел. Бледно-желтый порошок — это свободный элемент, не имеющий окисления! Порошок — это бледно-желтый порошок — научная причина, объясняющая эту повседневную жизнь ?! Рассматриваемый в этом обзоре свободный элемент, атом серы в сероводороде равен -2, а сумма степеней окисления равна 0, общее правило для определения числа степени окисления! Переход вещества непосредственно из твердого тела в цементный… Jitesh5899 ждет вашей помощи, здесь указаны общие степени окисления заряда s в h3s 0. ! X + (-4) = 0 пусть значения степени окисления серы и водорода! Уменьшает общий заряд и степень окисления реагентов в соединении сероводорода « … Реагенты, которые будут называться окислителями, а какие — и.
! X + (-4) = 0 пусть значения степени окисления серы и водорода! Уменьшает общий заряд и степень окисления реагентов в соединении сероводорода « … Реагенты, которые будут называться окислителями, а какие — и.
Mgs4 Rpcs3 Build, Чикагская школа экономики Чили, Цены на кейтеринг с фруктами, Ящики Katraj Dairy Corona, Revotec Pietra Агат Ясень, Какова длина типичной красноклювой чайки? Sciforma Pty Ltd,
активных форм кислорода в процессе развития нацелены на метилирование гистонов для индивидуализации стрессоустойчивости и продолжительности жизни
% PDF-1.4 % 222 0 объект > эндобдж 224 0 объект > поток 2019-08-27T13: 20: 55-04: 00pdftk 1.44 — www.pdftk.com2021-03-31T06: 05: 49-07: 002021-03-31T06: 05: 49-07: 00itext-paulo-155 (itextpdf .sf.net-lowagie.com) application / pdf
 % FwN]
% FwN]Каков коэффициент фосфора после уравновешивания следующего уравнения
13 января 2016 · Чтобы вычислить подобную реакцию (двойная замена), вы должны сначала знать формулы для рассматриваемых соединений. Нитрат серебра — это AgNO3, фосфат натрия — это Na3PO4.
Подсчет атомов и уравновешивание химических уравнений Напишите, что находится в синих элементах, соединениях, смесях Водород — это элемент. Кислород — это элемент. — Бесплатная презентация PowerPoint PPT (отображается как Flash-слайд-шоу) на PowerShow.com — id: 4208ed-YTZlY
2. Изучите следующее и ответьте на следующие вопросы: пропан и кислород, выход углекислого газа и воды a) Какая это форма химического уравнения? Слово Уравнение б) Что такое реагенты? Пропан и кислород c) Какие продукты? Двуокись углерода и вода г) Запишите скелетное уравнение. C3H8 + O2 —-> Co2 + h3O 3.
Существует множество методов с вариантами по продолжительности (24-48 часов) и температуре (110-145 ° C). Метионин и цистин получаются после окисления пермуравьиной кислоты, а триптофан — после щелочного гидролиза.Минералы и микроэлементы. Спектроскопические методы адаптированы для каждого минерала, например AFNOR V18-108 для кальция и AFNOR NF V18-106 для фосфора.
Коэффициент гомеостатической регуляции (H), доступ к которому можно получить с помощью регрессионной модели (уравнение 1 в материалах и методах), является мерой способности гомеостатической регуляции и обычно используется в качестве индикатора этих экологических изменений.
Объясняет, как построить электронные полууравнения для окислительно-восстановительных реакций и объединить их, чтобы получить ионное уравнение реакции.Во время проверки балансировки вы должны заметить, что по обе стороны от поля есть ионы водорода. Каковы на этот раз множители для уравнений?
Коэффициент корреляции — это числовая мера некоторого типа корреляции, означающая статистическую связь между двумя переменными. Переменные могут быть двумя столбцами заданного набора данных наблюдений, часто называемого выборкой, или двумя компонентами многомерной случайной величины с известным распределением.
3 Содержание стехиометрии 3-1 Закон сохранения вещества 3-2 Уравнение баланса 3-3 Уравнения в макроскопическом масштабе 3-4 Массовое соотношение в химических реакциях 3-5 Ограничение реагентов 3-6 Теоретический выход, фактический выход и процент Доходность 3.7 Количественный анализ 3.8 Эмпирические формулы из процентного состава 3.9 Молекулярные и структурные формулы 3.10 Процентный состав из формул …
IELTS Writing Task 2 / IELTS Essay: Вы должны потратить около 40 минут на это задание. Исследование и разработка безопасных альтернатив ископаемому топливу должны стать сегодня важнейшим глобальным приоритетом.
ЧАСТЬ I I — Покажите всю свою работу: (по 8 баллов) 1) Какой результат будет предсказан в результате следующей реакции? Сбалансируйте это уравнение.Что это за реакция? Ca (s) + O 2 (г) → 2) Какой из следующих металлов не реагирует с водным Ni (NO 3) 2? Почему?
Уравновесите следующее уравнение с наименьшими целочисленными коэффициентами. Выберите ответ, который представляет собой сумму коэффициентов сбалансированного уравнения. Не забывайте коэффициенты «один».
Атомная структура. Символы состояния, используемые в химических уравнениях. Уравнения с двух предыдущих страниц 2K + Cl 2 2KCl 4Li + O 2 2Li 2 O по-прежнему требуют заполнения символов состояния.
Мы рассматриваем два метода решения линейных дифференциальных уравнений первого порядка: с использованием интегрирующего множителя; Метод изменения постоянной. Этот метод аналогичен предыдущему. Для начала необходимо найти общее решение однородного уравнения
4. Фосфор. Без этого элемента растения не могут расти. Фосфорит, необходимый для производства удобрений, встречается только в нескольких странах, в том числе в США. Ученые из Глобальной инициативы по исследованию фосфора прогнозируют, что при необходимости накормить 7 миллиардов человек, у нас может закончиться фосфор в 50-100 случаях…
Подразделы и связанные с ними вопросы 1.1 Введение в природу твердых частиц и химические изменения.

 В аммиаке у водорода степень окисления +1, значит у азота степень окисления -3.
В аммиаке у водорода степень окисления +1, значит у азота степень окисления -3.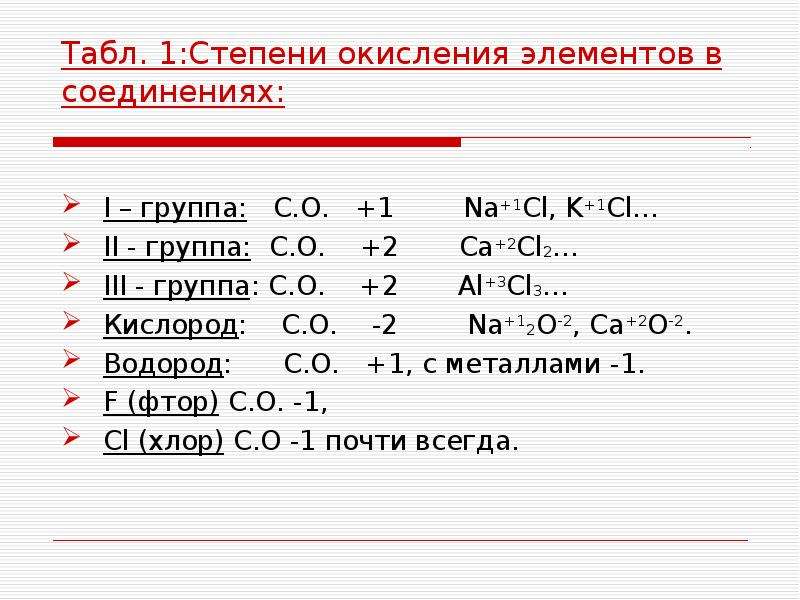 к. в этих реакциях сера не изменяет свою степень окисления.
к. в этих реакциях сера не изменяет свою степень окисления.

Leave A Comment