Ядро — атом — фосфор
Cтраница 1
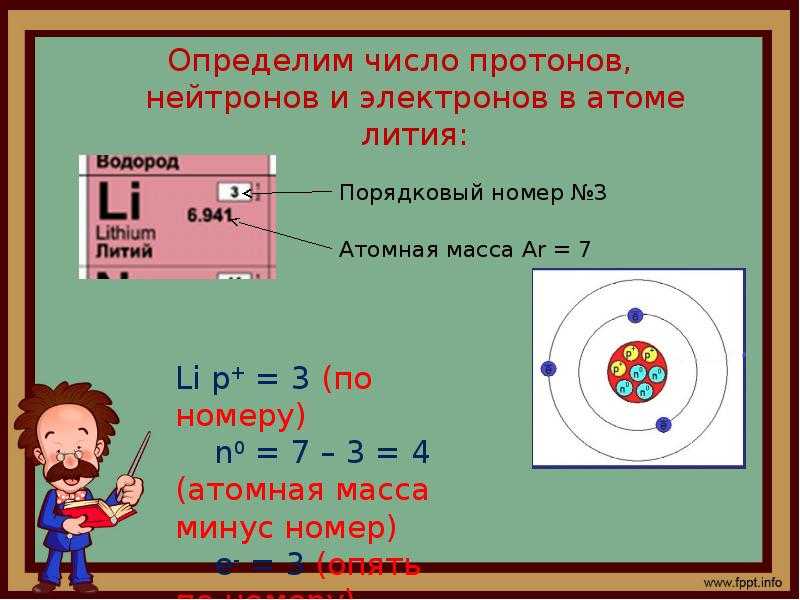
Ядро атома фосфора состоит из 15 протонов и 16 нейтронов. Существует общее правило, согласно которому в каждом атоме число протонов должно быть равно числу электронов. [1]
Ядро атома фосфора содержит 15 протонов и 16 нейтронов. Сколько электронов должно содержаться в электронном облаке атома фосфора. [2]
Ядро атома фосфора с массовым числом 31 содержит 15 протонов ( isP31) и 16 нейтронов. [3]
Ядро атома фосфора имеет 15 зарядов. [4]
| Баланс круговорота азота в биосфере. [5] |
Заряд ядра атома фосфора достаточно велик ( Z 15), чтобы вызывать магнитные силы, действующие даже при обычных температурах каталитически на химические процессы весьма замедленного действия, присущие молекулам таких легких атомов, как Н, С, N и О.
Фосфор находится в третьем периоде периодической системы. Ядро атома фосфора окружено тремя слоями электронов. [7]
Как видно из рисунка, спектр ЭПР состоит из трех групп линий, соответствующих каноническим ориентациям радикала. Хотя из приведенного спектра могут быть непосредственно измерены компоненты тензора — фактора, сверхтонкого взаимодействия неспаренного электрона с ядром атома фосфора обнаружить также не удалось. [8]
| Потенциальная ( а и энергетическая ( б диаграммы беспримесного полупроводника. [9] |
В случае донорной примеси четыре валентных электрона примесного атома, например фосфора ( рис. 9 — 3, я), образуют с валентными электронами четырех соседних атомов кремния парноэлект-ронные ковалентные связи. Поскольку ковалентная связь насыщенная, пятый валентный электрон не участвует ни Б ОДНОЙ КОВа-лентной связи; он связан с ядром атома фосфора кулоновским взаимодействием.
[10]
9 — 3, я), образуют с валентными электронами четырех соседних атомов кремния парноэлект-ронные ковалентные связи. Поскольку ковалентная связь насыщенная, пятый валентный электрон не участвует ни Б ОДНОЙ КОВа-лентной связи; он связан с ядром атома фосфора кулоновским взаимодействием.
[10]
| Схематическое двумерное изображение донорного центра в кристалле кремния.| Уровни энергии доноров и акцепторов. [11] |
Примесной атом фосфора, занимающий соседнюю ячейку в таблице Менделеева, имеет пять электронов во внешней оболочке. Четыре из них участвуют в образовании ковалентных связей с соседними атомами кремния. Пятый электрон фосфора оказывается лишним, он не нужен для образования ковалентных связей. Этот электрон не вполне свободен, потому что ядро атома фосфора обладает положительным зарядом, на единицу большим, чем ядро атома кремния. В результате этот электрон движется в кристалле по большой орбите вокруг примесного атома, подобно тому, как движется электрон вокруг ядра в атоме водорода.
Величину положительного заряда ядра атома элемента определяют опытным путем. Наименьшее ее значение, равное единице, получено для водорода. Следовательно, вокруг ядра атома водорода вращается один электрон. Определены заряды ядер атомов и других элементов. Так, величина положительного заряда ядра атома магния 12; следовательно, вокруг его ядра вращается 12 электронов. Величина положительного заряда
Страницы: 1
Характеристика химического элемента ФОСФОР | fizika-ili-himija.ru
Характеристика химического элемента ФОСФОРА по плану изложена в этой статье в двух вариантах.
Характеристика химического элемента ФОСФОР I. Химический элемент номер 15 — Фосфор.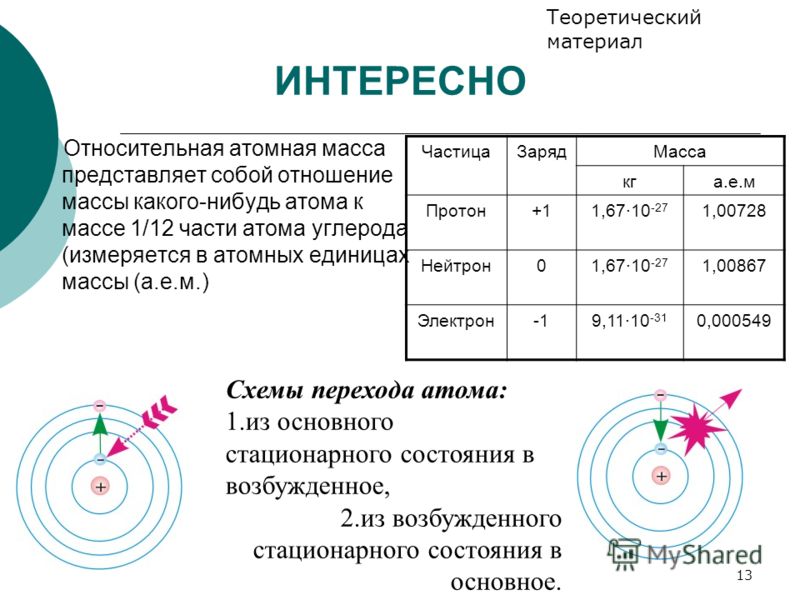 Его символ Р.
Его символ Р.
II. Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Заряд ядра атома фосфора равна +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16. Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Электронная формула атома фосфора: 1s 2 2s 2 2p 6 3s 2 3p 3
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровни находятся два электрона (в одной клетке записываются две стрелки, имеющих противоположное направление), на три р-подуровни находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющих одинаковое направление).

V. Определяем тип химического элемента (металл или неметалл, s-, p-, d- или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является г. подуровень, фосфор относится к семейству г. — элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P
P 2 O 5 + 3 Na 2 O = 2 Na 3 PO 4
H 3 PO4 + 3 h3O + 3 NaOH = Na 3 PO 4 + 3 h3O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора по периоду является кремний и серу. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем в кремния и менее выражены, чем в азота и серы.
Фосфор является более распространенным элементом на Земле, чем азот. Содержание фосфора в нашей планете равна 0,088% по массе. Фосфор образует некоторые важные минералы, такие как фторапатит Са5 (РО4) 3F и гидроксиапатит Са5 (РО4) зон.
Собственная характеристика фосфора как химического элемента можете быть добавлена каждым учеником через форму комментариев.
Фосфор — Key Stage Wiki
Содержимое
- 1 Ключевой этап 2
- 1.1 Значение
- 2 Ключевой этап 3
- 2.1 Значение
- 2.2 О фосфоре
- 2.2.1 Молекулярная структура
- 2.2.2 Атомная структура
- 2.2.3 Свойства
- 3 Ключевой этап 4
- 3.1 Значение
- 3.2 О фосфоре
- 3.2.1 Молекулярная структура
- 3.2.2 Атомная структура
- 3.2.3 Свойства
- 3.3 Ссылки
- 3.3.1 АКК
Ключевой этап 2
Значение
Фосфор является твердым веществом.
Key Stage 3
Химический символ фосфора.
Двухмерное изображение атома фосфора с 15 протонами и 16 нейтронами в ядре и 15 электронами, вращающимися вокруг ядра.
Значение
Фосфор — неметаллический элемент 5-й группы Периодической таблицы элементов с атомным номером 15.
О фосфоре
- Фосфор имеет химический символ P.
Молекулярная структура
- Химическая формула молекулы фосфора P 4 .
Атомная структура
- В ядре фосфора 15 протонов и 16 нейтронов, что дает ему атомный номер 15 и атомную массу 31.
- Фосфор находится в периоде 3 периодической таблицы, потому что он имеет 3 электронных оболочки.
Свойства
- Фосфор находится в твердом состоянии при комнатной температуре.
- Фосфор быстро реагирует в присутствии кислорода и используется в спичках.
Ключевой этап 4
Химический символ фосфора.
Двухмерное представление модели Бора изотопа фосфора-31 с 15 протонами и 16 нейтронами в ядре и 2 электронами в первой оболочке, 8 во второй и 5 во внешней оболочке.
Значение
Фосфор — неметаллический элемент 5-й группы Периодической таблицы элементов с 15 протонами в ядре.
О фосфоре
- Фосфор имеет химический символ P.
Молекулярная структура
- Химическая формула молекулы фосфора P 4 .
- Фосфор образует ковалентную связь с 3 другими атомами фосфора, образуя простую ковалентную молекулу.
Атомная структура
- Самый распространенный стабильный изотоп фосфора имеет 16 нейтронов в ядре, что дает ему атомную массу 31.
- Фосфор находится в периоде 3 Периодической таблицы, потому что он имеет 3 электронных оболочки.
- У фосфора 5 электронов на внешней оболочке, и ему нужно еще 3 электрона, чтобы получить полную внешнюю оболочку, чтобы он мог образовать 3 связи с другими атомами.
Свойства
- Фосфор находится в твердом состоянии при стандартной температуре и давлении.
- Фосфор очень активен в присутствии кислорода.

Ссылки
AQA
- Фосфор, страницы 35, 47, GCSE Химия; Студенческая книга, Коллинз, AQA
Фосфор — Key Stage Wiki
Содержимое
- 1 Ключевой этап 2
- 1.1 Значение
- 2 Ключевой этап 3
- 2.1 Значение
- 2.2 О фосфоре
- 2.2.1 Молекулярная структура
- 2.2.2 Атомная структура
- 2.2.3 Свойства
- 3 Ключевой этап 4
- 3.1 Значение
- 3.2 О фосфоре
- 3.2.1 Молекулярная структура
- 3.2.2 Атомная структура
- 3.2.3 Свойства
- 3.3 Ссылки
- 3.3.1 АКК
Ключевой этап 2
Значение
Фосфор является твердым веществом.
Key Stage 3
Химический символ фосфора.
Двухмерное изображение атома фосфора с 15 протонами и 16 нейтронами в ядре и 15 электронами, вращающимися вокруг ядра.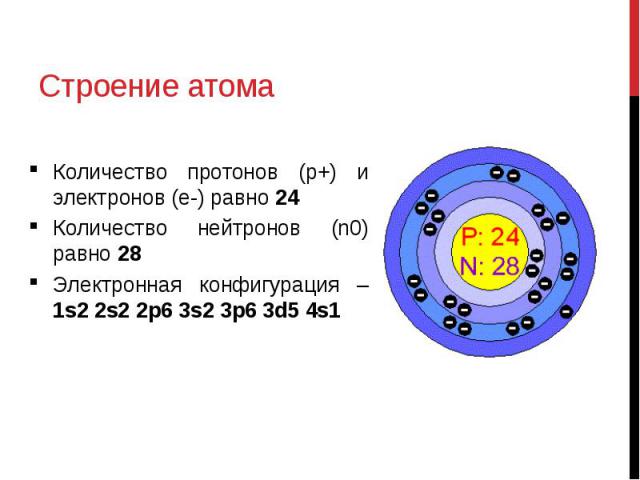
Значение
Фосфор — неметаллический элемент 5-й группы Периодической таблицы элементов с атомным номером 15.
О фосфоре
- Фосфор имеет химический символ P.
Молекулярная структура
- Химическая формула молекулы фосфора P 4 .
Атомная структура
- В ядре фосфора 15 протонов и 16 нейтронов, что дает ему атомный номер 15 и атомную массу 31.
- Фосфор находится в периоде 3 Периодической таблицы, потому что он имеет 3 электронных оболочки.
Свойства
- Фосфор находится в твердом состоянии при комнатной температуре.
- Фосфор быстро реагирует в присутствии кислорода и используется в спичках.
Ключевой этап 4
Химический символ фосфора.
Двухмерное представление модели Бора изотопа фосфора-31 с 15 протонами и 16 нейтронами в ядре и 2 электронами в первой оболочке, 8 во второй и 5 во внешней оболочке.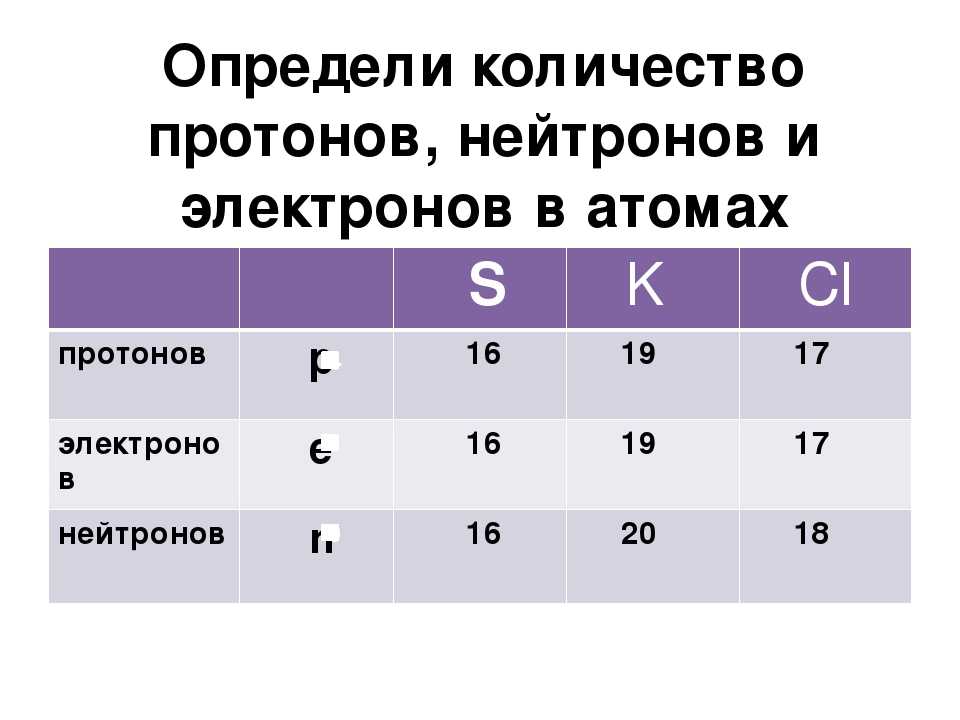
Значение
Фосфор — неметаллический элемент 5-й группы Периодической таблицы элементов с 15 протонами в ядре.
О фосфоре
- Фосфор имеет химический символ P.
Молекулярная структура
- Химическая формула молекулы фосфора P 4 .
- Фосфор образует ковалентную связь с 3 другими атомами фосфора, образуя простую ковалентную молекулу.
Атомная структура
- Самый распространенный стабильный изотоп фосфора имеет 16 нейтронов в ядре, что дает ему атомную массу 31.
- Фосфор находится в периоде 3 Периодической таблицы, потому что он имеет 3 электронных оболочки.
- У фосфора 5 электронов на внешней оболочке, и ему нужно еще 3 электрона, чтобы получить полную внешнюю оболочку, чтобы он мог образовать 3 связи с другими атомами.
Свойства
- Фосфор находится в твердом состоянии при стандартной температуре и давлении.
- Фосфор очень активен в присутствии кислорода.




Leave A Comment