Изменения в ЕГЭ по биологии 2019
- Изменился формат задания в линии 2 (раньше там было задание со множественным выбором, которое оценивалось максимум в два балла, теперь — задание на умение анализировать таблицу: ученик должен дополнить её, вставив подходящий термин. Получить за это задание можно будет только один балл).
- Как следствие, уменьшился на единицу максимальный балл: теперь он составляет не 59, а 58.
- В задании 6 появились новые варианты: ученику может достаться не текстовая задача, а работа с рисунком.
Об изменениях в остальных экзаменах ЕГЭ-2019 читайте в новостях. #ADVERTISING_INSERT#
Читайте также:
- Демоверсия ЕГЭ-2019 по биологии
- ЕГЭ по биологии-2018: задание 27, базовый уровень
- Готовимся к ЕГЭ по биологии. Задание 26
- Готовимся к ЕГЭ по биологии: текст с ошибками
 Задания с рисунками
Задания с рисунками
Хотите сохранить материал на будущее? Отправьте себе на почту
в избранноеТолько зарегистрированные пользователи могут добавлять в избранное.
Войдите, пожалуйста.
Учебные издания по теме
Агафонова И.Б., Сивоглазов В.И.
Биология. Общая биология. 11 класс. Базовый уровень.
960 Р
КупитьАгафонова И.Б., Сивоглазов В.И.
Биология. Общая биология. 11 класс. Базовый уровень. Рабочая тетрадь.
379 Р
КупитьАгафонова И.Б., Сивоглазов В.И.
Биология. 11 класс. Учебник.
996 Р
КупитьПасечник В.В., Швецов Г.Г.
Биология. Общая биология.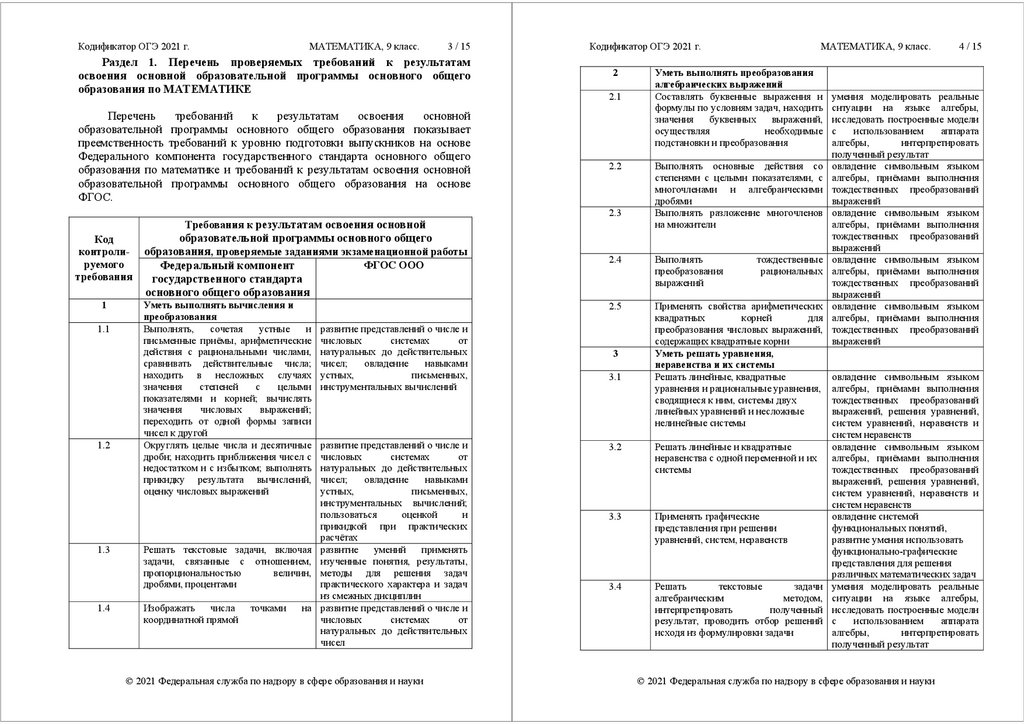 10-11 классы. Базовый уровень. Рабочая тетрадь
10-11 классы. Базовый уровень. Рабочая тетрадь
361 Р
КупитьПономарева И.Н., Корнилова О.А., Симонова Л.В.
Биология. 11 класс. Углубленный уровень. Учебник
Пономарёва И.Н., Корнилова О.А., Лощилина Т.Е. и др.; под ред. Пономарёвой И.Н.
Биология. Базовый уровень. 11 кл. Учебник.
Козлова Т.А., Кучменко В.С.
Биология. .6-11классы. Биология в таблицах. Справочное пособие
Каменский А.А., Криксунов Е.А., Пасечник В.В.
Биология. Общая биология. 10-11 классы. Базовый уровень
Оценка разработки
Для оценки работы вам необходимо авторизоваться на сайте
Войти или зарегистрироваться
Ограничение доступа
Для доступа к материалу требуется регистрация на сайте
Войти или зарегистрироваться
Нужна помощь?
ЕГЭ биология тренировочные варианты демоверсия ЕГЭ
ЕГЭ БиологияКомментарии: 0 Демонстрационный вариант ЕГЭ 2019 г. БИОЛОГИЯ, 11 класс. Разбор демоверсии ЕГЭ 2019 по биологии. скачать скачать Смотрите также: Демоверсия ЕГЭ 2019 по биологии с ответами
Демонстрационный вариант ЕГЭ 2019 г. БИОЛОГИЯ, 11 класс. Разбор демоверсии ЕГЭ 2019 по биологии. скачать скачать Смотрите также: Демоверсия ЕГЭ 2019 по биологии с ответамиЧитать далее
ЕГЭ БиологияКомментарии: 0Краткая теория по всему курсу биологии. Ботаника, Зоология, Анатомия и физиология человека, Общая биология Ботаника Растительная клетка, ее строение Корень Побег. Лист. Стебель Цветок — видоизмененный побег Размножение растений Опыление. Оплодотворение Строение семян. Прорастание и распространение Развитие растительного мира Водоросли Бактерии Лишайники …
Читать далее
ЕГЭ БиологияКомментарии: 0ЕГЭ по биологии 2019. Основная волна. Вопрос про изотопы азота. Доказательство гипотезы о полуконсервативном характере репликации. На мой взгляд вопрос завальный, но отличный урок для будущих выпускников. Постараюсь до конца лета снять как можно больше видео с самыми сложными вопросами этого года Смотрите также: ЕГЭ 2019 по биологии КИМы, задания, решения
Читать далее
ЕГЭ БиологияКомментарии: 0ЕГЭ 2019 по биологии КИМы, задания, решения.
Читать далее
ЕГЭ БиологияКомментарии: 0РАЗБОР ЕГЭ 2019 по биологии (13 июня 2019). Maria Semochkina. Разбор заданий второй части основной волны ЕГЭ по биологии (13 июня 2019) Смотрите также:
Читать далее
ЕГЭ БиологияКомментарии: 0ОТВЕТЫ НА ВОПРОСЫ РЕАЛЬНОГО ЕГЭ ПО БИОЛОГИИ 2019. Подробный разбор. Марина Брейн (Долженко) — репетитор по биологии. Какие были сложные вопросы на ЕГЭ по биологии 2019? Смотрите также: «ЭВОЛЮЦИЯ» — что нужно знать для ЕГЭ БИОЛОГИЯ Екатерина Лукомская
Читать далее
ЕГЭ БиологияКомментарии: 0«ЭВОЛЮЦИЯ» — что нужно знать для ЕГЭ БИОЛОГИЯ Екатерина Лукомская. Представляю вам видео, где рассказываю, как готовиться к теме «Эволюции» в ЕГЭ. Пройдемся по актуальным пособиям, сборникам, темам и заданиям. Актуально для тех, кто: — Начинает готовиться к ЕГЭ и не знает где взять информацию для подготовки; — Кто уже прошел тему «Эволюция», но ничего …
Представляю вам видео, где рассказываю, как готовиться к теме «Эволюции» в ЕГЭ. Пройдемся по актуальным пособиям, сборникам, темам и заданиям. Актуально для тех, кто: — Начинает готовиться к ЕГЭ и не знает где взять информацию для подготовки; — Кто уже прошел тему «Эволюция», но ничего …
Читать далее
ЕГЭ БиологияКомментарии: 0Тренировочный вариант ЕГЭ 2019 по биологии №20 с ответами от 27.05.2019 «ЕГЭ 100 БАЛЛОВ». Пробные варианты егэ по биологии 2019. В конце теста содержатся ответы ко всем заданиям, а также критерии для проверки сложной, второй части теста. Единый государственный экзамен, 2019 г. БИОЛОГИЯ. Смотрите также: Тренировочный вариант ЕГЭ 2019 по биологии №19 с ответами
Читать далее
ЕГЭ БиологияКомментарии: 0Тренировочный вариант ЕГЭ 2019 по биологии №19 с ответами от 13.05.2019 «ЕГЭ 100 БАЛЛОВ». Пробные варианты егэ по биологии 2019. В конце теста содержатся ответы ко всем заданиям, а также критерии для проверки сложной, второй части теста.
Читать далее
ЕГЭ БиологияКомментарии: 0Тренировочный вариант ЕГЭ 2019 по биологии №18 с ответами от 29.04.2019 «ЕГЭ 100 БАЛЛОВ». Пробные варианты егэ по биологии 2019. В конце теста содержатся ответы ко всем заданиям, а также критерии для проверки сложной, второй части теста. Единый государственный экзамен, 2019 г. БИОЛОГИЯ. Смотрите также: Разбор настоящего ДОСРОЧНОГО ВАРИАНТА ФИПИ ЕГЭ ПО БИОЛОГИИ 2019.
Читать далее
PLD-зависимые микродомены фосфатидной кислоты являются сигнальными платформами для формирования подосом
1. Burns S, Thrasher AJ, Blundell MP, Machesky LM, Jones GE. Конфигурация цитоскелета дендритных клеток человека с помощью Rho GTPases, белка WAS и дифференцировки. Кровь. 2001; 98: 1142–1149. [PubMed] [Google Scholar]
2. Marchisio PC, et al. Винкулин, талин и интегрины локализуются в специфических местах адгезии злокачественных В-лимфоцитов. Кровь. 1988; 72: 830–3. [PubMed] [Академия Google]
Кровь. 1988; 72: 830–3. [PubMed] [Академия Google]
3. Destaing O, Saltel F, Geminard J-C, Jurdic P, Bard F. Подосомы демонстрируют оборот актина и динамическую самоорганизацию в остеокластах, экспрессирующих актин-зеленый флуоресцентный белок. Мол. биол. … 2003; 14:407–416. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Tarone G, Cirillo D, Giancotti FG, Comoglio PM, Marchisio PC. Трансформированные вирусом саркомы Рауса фибробласты прилипают в основном к дискретным выступам вентральной мембраны, называемым подосомами. Эксп. Сотовый рез. 1985; 159: 141–57. [PubMed] [Академия Google]
5. Marchisio PC, Cirillo D, Teti A, Zambonin-Zallone A, Tarone G. Трансформированные вирусом саркомы Рауса фибробласты и клетки моноцитарного происхождения демонстрируют своеобразную точечную организацию белков цитоскелета, участвующих во взаимодействиях микрофиламент-мембрана. Эксп. Сотовый рез. 1987; 169: 202–214. [PubMed] [Google Scholar]
6. Gimona M, Kaverina I, Resch GP, Vignal E, Burgstaller G. Повторы кальпонина регулируют стабильность актиновых филаментов и формирование подосом в гладкомышечных клетках. Мол. биол. Клетка. 2003; 14: 2482–249.1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Повторы кальпонина регулируют стабильность актиновых филаментов и формирование подосом в гладкомышечных клетках. Мол. биол. Клетка. 2003; 14: 2482–249.1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Моро В., Татин Ф., Варон С., Ге Е. Актин может реорганизоваться в подосомы в эндотелиальных клетках аорты, процесс, контролируемый Cdc42 и RhoA. Актин может реорганизоваться в подосомы в эндотелиальных клетках аорты, процесс, контролируемый Cdc42 и RhoA. Мол. Клетка. биол. 2003; 23:6809–6822. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Sabri S, et al. Дефицит белка Wiskott-Aldrich вызывает преждевременное образование протромбоцитов и продукцию тромбоцитов в компартменте костного мозга. Кровь. 2006; 108: 134–140. [PubMed] [Академия Google]
9. Schachtner H, et al. Мегакариоциты собирают подосомы, которые разрушают матрикс и выпячиваются через базальную мембрану. Кровь. 2013; 121:2542–52. [PubMed] [Google Scholar]
10. Баранов М.В., и соавт. Подосомы дендритных клеток облегчают отбор антигена. Дж. Клеточные науки. 2014; 127:1052–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клеточные науки. 2014; 127:1052–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Banchereau J, Steinman RM. Дендритные клетки и регуляция иммунитета. Природа. 1998; 392: 245–252. [PubMed] [Академия Google]
12. Eddy RJ, Weidmann MD, Sharma VP, Condeelis JS. Инвадоподия опухолевых клеток: инвазивные выпячивания, которые организуют метастазирование. Тенденции клеточной биологии. 2017; 27: 595–607. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Патерсон, Э. К. и Кортнидж, С. А. Приближаются инвадосомы: новое понимание функции и значимости заболевания. ФЕБС J . 1–20, 10.1111/февраль 14123 (2017). [Бесплатная статья PMC] [PubMed]
14. van den Dries K, et al. Двухцветная микроскопия сверхвысокого разрешения выявляет наноразмерную организацию механосенсорных подосом. Мол. биол. Клетка. 2013;24:2112–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. van den Dries K, et al. Восприятие геометрии дендритными клетками диктует пространственную организацию и PGE(2)-индуцированное растворение подосом. Клетка. Мол. Жизнь наук. 2012; 69: 1889–901. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка. Мол. Жизнь наук. 2012; 69: 1889–901. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Schachtner H, Calaminus SDJ, Thomas SG, Machesky LM. Подосомы в адгезии, миграции, механосенсорном восприятии и ремоделировании матрикса. Цитоскелет (Хобокен). 2013;00:1–18. [PubMed] [Google Scholar]
17. Rafiq, NBM et al . Сборка подосом контролируется GTPase ARF1 и ее фактором обмена нуклеотидов ARNO. Дж . Cell Biol . 216 (2017). [Бесплатная статья PMC] [PubMed]
18. Svensson HG, et al. Роль ARF6 в формировании и миграции подосом дендритных клеток. Евро. Дж. Иммунол. 2008; 38: 818–828. [PubMed] [Google Scholar]
19. Selvy PE, Lavieri RR, Lindsley CW, Brown HA. Фосфолипаза D: энзимология, функциональность и химическая модуляция. хим. 2011; 111:6064–6119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Фроман М.А. Надсемейство фосфолипаз D как терапевтическая мишень. Тренды Фармакол. науч. 2015; 36: 137–144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Нельсон Р.К., Фроман М.А. Физиологическая и патофизиологическая роль фосфолипазы D. J. Lipid Res. 2015;56:2229–2237. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Henkels KM, Boivin GP, Dudley ES, Berberich SJ, Gomez-Cambronero J. Фосфолипаза D (PLD) стимулирует клеточную инвазию, рост опухоли и метастазирование в груди человека. Модель ксенографа рака. Онкоген. 2013;32:5551–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Bolomini-Vittori M, et al. Регуляция конформер-специфической активации интегрина LFA-1 сигнальным модулем Rho, запускаемым хемокинами. Нац. Иммунол. 2009 г.;10:185–94. [PubMed] [Google Scholar]
24. Speranza F, Mahankali M, Henkels KM, Gomez-Cambronero J. Молекулярная основа адгезии лейкоцитов с участием фосфатидной кислоты и фосфолипазы D. J. Biol. хим. 2014; 289:28885–28897. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Walker SJ, Wu WJ, Cerione RA, Brown HA. Для активации фосфолипазы D1 с помощью Cdc42 требуется область вставки Rho. Дж. Биол. хим. 2000; 275:15665–15668. [PubMed] [Google Scholar]
Для активации фосфолипазы D1 с помощью Cdc42 требуется область вставки Rho. Дж. Биол. хим. 2000; 275:15665–15668. [PubMed] [Google Scholar]
26. Гомес-Камбронеро Дж. Изысканная регуляция PLD2 множеством взаимодействующих белков: S6K, Grb2, Sos, WASp и Rac2 (и неожиданное открытие: PLD2 — это GEF) Cell. Сигнал. 2011; 23:1885–189.5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Stritt S, et al. Фосфолипаза D является центральным регулятором индуцированной коллагеном I перестройки цитоскелета и образования подосом в мегакариоцитах. Дж. Тромб. Гемост. 2014; 12:1–8. [PubMed] [Google Scholar]
28. Ali WH, et al. Дефицит липидных сигнальных ферментов фосфолипазы D1 и D2 изменяет организацию цитоскелета, фагоцитоз макрофагов и стимулированное цитокинами привлечение нейтрофилов. ПЛОС Один. 2013;8:e55325. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Capelluto, D.G.S. Липид-опосредованный белок Signalin г, 10.1007/978-94-007-6331-9 (2013).
30. Wang X, Devaiah SP, Zhang W, Welti R. Сигнальные функции фосфатидной кислоты. прог. Липид Рез. 2006; 45: 250–78. [PubMed] [Google Scholar]
31. Stace CL, Ktistakis NT. Белки, связывающие фосфатидную кислоту и фосфатидилсерин. Биохим. Биофиз. Акта — Мол. Клеточная биол. Липиды. 2006; 1761: 913–926. [PubMed] [Google Scholar]
32. Ито, С., Верт, Д., Ричерт, Н. и Пастан, И. Фосфорилирование винкулина киназой src. Взаимодействие винкулина с фосфолипидными везикулами. Дж . Биол . Химия . http://www.jbc.org/content/258/23/14626.short (1983). [PubMed]
33. Бхатия Т., Корнелиус Ф., Ипсен Дж. Х. Изучение гипотезы рафта путем исследования плоских двухслойных участков отдельно стоящих гигантских везикул с наноразмерным разрешением, с Na,K-АТФазой и без нее. Биохим. Биофиз. Акта — биомембрана. 2016; 1858:3041–3049. [PubMed] [Google Scholar]
34. Саймонс К., Иконен Э. Функциональные рафты в клеточных мембранах. Природа. 1997; 387: 569–572. [PubMed] [Академия Google]
[PubMed] [Академия Google]
35. Chakrabarti P, et al. Зависимый от dPIP5K пул фосфатидилинозитол-4,5-бисфосфата (PIP2) необходим для передачи сигнала, связанного с G-белком, в фоторецепторах дрозофилы. Генетика PLoS. 2015; 11:1–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. van den Bogaart G, et al. Секвестрация мембранных белков за счет ионных белок-липидных взаимодействий. Природа. 2011; 479: 552–555. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Gillooly DJ, Raiborg C, Stenmark H. Фосфатидилинозитол-3-фосфат обнаружен в микродоменах ранних эндосом. гистохим. Клеточная биол. 2003; 120:445–453. [PubMed] [Академия Google]
38. Роуч А.Н. и соавт. Регуляция PIPKI фосфатидной кислотой является критической для актиновой реорганизации цитоскелета. Дж. Липид Рез. 2012;53:2598–2609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Zeniou-Meyer M, et al. Продукция фосфатидной кислоты фосфолипазой D1 на плазматической мембране способствует экзоцитозу крупных гранул с плотным ядром на поздней стадии. Дж. Биол. хим. 2007; 282:21746–21757. [PubMed] [Google Scholar]
Дж. Биол. хим. 2007; 282:21746–21757. [PubMed] [Google Scholar]
40. Аммар М.Р., Кассас Н., Шассерот-Голаз С., Бадер М.Ф., Витале Н. Липиды в регулируемом экзоцитозе: что они делают? Передний. Эндокринол. (Лозанна). 2013; 4:1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Zhang F, et al. Временное производство сигнального липида фосфатидной кислоты фосфолипазой D2 определяет выход сигнала киназы, регулируемой внеклеточным сигналом, в раковых клетках. Мол. Клетка. биол. 2014; 34:84–95. [PMC free article] [PubMed] [Google Scholar]
42. Chalifa-Caspi V, Eli Y, Liscovitch M. Кинетический анализ в смешанных мицеллах частично очищенной активности фосфолипазы D мозга крысы и ее активация фосфатидилинозитол-4,5-бисфосфатом . Нейрохим. Рез. 1998;23:589–599. [PubMed] [Google Scholar]
43. Brown HA, Henage LG, Preininger AM, Xiang Y, Exton JH. Биохимический анализ фосфолипазы D. Методы Энзимол. 2007; 434:49–87. [PubMed] [Google Scholar]
44. Griera M, et al. Интегрин-связанная киназа (ILK) регулирует созревание и стабильность подосом в дендритных клетках. Междунар. Дж. Биохим. Клеточная биол. 2014;50:47–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Интегрин-связанная киназа (ILK) регулирует созревание и стабильность подосом в дендритных клетках. Междунар. Дж. Биохим. Клеточная биол. 2014;50:47–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Monypenny J, et al. Роль WASP в клеточной полярности и подосомной динамике миелоидных клеток. Евро. Дж. Клеточная биология. 2010;90: 198–204. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Chae YC, et al. Опосредованное протеинкиназой Cδ фосфорилирование фосфолипазы D контролирует опосредованное интегрином распространение клеток. Мол Селл Биол. 2010;30:5086–5098. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Chae YC, et al. Активность фосфолипазы D регулирует опосредованное интегрином распространение и миграцию клеток, индуцируя транслокацию GTP-Rac к плазматической мембране. Мол. биол. Клетка. 2008;19:3111–3123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Ду Г, Фрохман М.А. Всплеск миозинфосфатазы, сигнализируемый липидом, рассеивает корковую сократительную силу на ранней стадии распространения клеток. Мол. биол. Ячейка2. 2009; 20: 200–208. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол. биол. Ячейка2. 2009; 20: 200–208. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Lavieri RR, et al. Дизайн, синтез и биологическая оценка галогенированных N-(2-(4-оксо-1-фенил-1,3,8-триазаспиро[4.5]декан-8-ил)этил)бензамидов: открытие молекула ингибитора фосфолипазы D2. Дж. Мед. хим. 2010;53:6706–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Lewis JA, et al. Дизайн и синтез селективных по изоформе ингибиторов фосфолипазы D (PLD). Часть I: Влияние альтернативных галогенированных привилегированных структур на специфичность PLD1. биоорг. Мед. хим. лат. 2009; 19:1916–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Scott SA, et al. Дизайн селективных по изоформе ингибиторов фосфолипазы D, которые модулируют инвазивность раковых клеток. Nat Chem Biol. 2009; 5:108–117. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Colley WC, et al. Фосфолипаза D2, особая изоформа фосфолипазы D с новыми регуляторными свойствами, провоцирующая реорганизацию цитоскелета. Курс. биол. 1997;7:191–201. [PubMed] [Google Scholar]
Курс. биол. 1997;7:191–201. [PubMed] [Google Scholar]
53. Хаммонд С., Дженко Дж., Накашима С. и К. Характеристика двух альтернативно сплайсированных форм фосфолипазы D1. Дж. Биол. хим. 1997; 272:3860–3868. [PubMed] [Google Scholar]
54. Du GW, et al. Двойная потребность в rho и протеинкиназе C для прямой активации фосфолипазы D1 через передачу сигналов рецептора, связанного с G-белком. Мол. биол. Клетка. 2000; 11:4359–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Su W, et al. 5-фтор-2-индолилдесхлоргалопемид (FIPI), фармакологический ингибитор фосфолипазы D, который изменяет распространение клеток и ингибирует хемотаксис. Мол. Фармакол. 2009 г.;75:437–446. [Статья бесплатно PMC] [PubMed] [Google Scholar]
56. Shen B, Delaney MK, Du X. Изнутри-наружу, снаружи-внутрь и изнутри-снаружи-внутрь: передача сигналов G-белка в интегрин-опосредованной клеточной адгезии, растекание и втягивание. Курс. мнение Клеточная биол. 2012; 24:600–606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Линдер С., Хюфнер К., Винтергерст У., Эпфельбахер М. Зависимое от микротрубочек формирование структур подосомальной адгезии в первичных макрофагах человека. Дж. Клеточные науки. 2000; 113 (Pt 23): 4165–76. [PubMed] [Академия Google]
Линдер С., Хюфнер К., Винтергерст У., Эпфельбахер М. Зависимое от микротрубочек формирование структур подосомальной адгезии в первичных макрофагах человека. Дж. Клеточные науки. 2000; 113 (Pt 23): 4165–76. [PubMed] [Академия Google]
58. Meddens MBM, et al. Актомиозин-зависимые динамические пространственные паттерны компонентов цитоскелета управляют мезомасштабной организацией подосом. Нац. коммун. 2016;7:13127. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Linder S, et al. Макрофаги пациентов с Х-сцепленной тромбоцитопенией демонстрируют ослабленный фенотип синдрома Вискотта-Олдрича. Иммунол. Клеточная биол. 2003; 81: 130–6. [PubMed] [Google Scholar]
60. Sozzani S, et al. Миграция дендритных клеток в ответ на формилпептиды, C5a и определенный набор хемокинов. Дж. Иммунол. (Балтимор, Мэриленд, 1950) 1995;155:3292–3295. [PubMed] [Google Scholar]
61. Powner DJ, Pettitt TR, Anderson R, Nash GB, Wakelam MJO. Стабильная адгезия и миграция нейтрофилов человека требует опосредованной фосфолипазой D активации интегрина CD11b/CD18. Мол. Иммунол. 2007;44:3211–3221. [PubMed] [Google Scholar]
Мол. Иммунол. 2007;44:3211–3221. [PubMed] [Google Scholar]
62. Carrigan SO, Pink DBS, Stadnyk AW. Трансэпителиальная миграция нейтрофилов в ответ на хемоаттрактант fMLP, но не на C5a, зависит от фосфолипазы D и связана с использованием CD11b/CD18. Дж. Лейкок. биол. 2007; 82: 1575–1584. [PubMed] [Академия Google]
63. Brito de Souza L, Pinto da Silva LL, Jamur MC, Oliver C. Фосфолипаза D участвует в формировании связанных с аппаратом Гольджи везикул, покрытых клатрином, в клетках околоушных протоков человека. ПЛОС Один. 2014;9:e91868. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Wang Z, et al. Связывание фосфатидной кислоты, генерируемой PLD2, с KIF5B способствует проникновению MT1-MMP на поверхность и метастазированию в легкие клеток рака молочной железы мыши. Дев. Клетка. 2017;43:186–197.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. El Azzouzi K, Wiesner C, Linder S. Островки металлопротеиназы MT1-MMP действуют как устройства памяти для повторного появления подосом. Дж. Клеточная биология. 2016; 213:109–125. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клеточная биология. 2016; 213:109–125. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Park MH, Ahn BH, Hong YK, Min DS. Сверхэкспрессия фосфолипазы D усиливает экспрессию матриксной металлопротеиназы-2 и инвазию клеток глиомы посредством сигнальных путей, опосредованных протеинкиназой C и протеинкиназой A/NF-kappaB/Sp1. Канцерогенез. 2009; 30: 356–65. [PubMed] [Академия Google]
67. Элверс, М. и др. . Нарушенная активация интегрина IIb 3 и образование тромбов, зависящее от сдвига, у мышей, лишенных фосфолипазы D1. Наука . Сигнал . 3 , ra1-ra1 (2010). [Бесплатная статья PMC] [PubMed]
68. Thielmann I, et al. Избыточные функции фосфолипаз D1 и D2 при высвобождении альфа-гранул тромбоцитов. Дж. Тромб. Гемост. 2012;10:2361–2372. [PubMed] [Google Scholar]
69. Oude Weernink PA, Han L, Jakobs KH, Schmidt M. Динамическая передача сигналов фосфолипида с помощью рецепторов, связанных с G-белком. Биохим. Биофиз. Акта — биомембрана. 2007; 1768: 888–900. [PubMed] [Google Scholar]
Биофиз. Акта — биомембрана. 2007; 1768: 888–900. [PubMed] [Google Scholar]
70. Litosch I, Pujari R, Lee SJ. Фосфатидная кислота регулирует выход сигнала рецепторами, связанными с G-белком, посредством прямого взаимодействия с фосфолипазой C-beta(1) Cell. Сигнал. 2009;21:1379–84. [PubMed] [Google Scholar]
71. Браун, Х. А., Томас, П. Г. и Линдсли, К. В. Нацеливание на фосфолипазу D при раке, инфекциях и нейродегенеративных расстройствах. Нат . Ред. . Препарат Дисков ., 10.1038/nrd.2016.252 (2017). [Бесплатная статья PMC] [PubMed]
72. Chang LC, et al. Сигнальные механизмы ингибирования активации фосфолипазы D с помощью CHS-111 в нейтрофилах, стимулированных формилпептидом. Биохим. Фармакол. 2011; 81: 269–278. [PubMed] [Google Scholar]
73. Linder S, Nelson D, Weiss M, Aepfelbacher M. Белок синдрома Вискотта-Олдрича регулирует подосомы в первичных макрофагах человека. проц. Натл. акад. науч. 1999;96:9648–9653. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Ory S, Destaing O, Jurdic P. Динамика микротрубочек по-разному регулирует активность Rho и Rac и запускает образование Rho-независимого стрессового волокна в поликарионах макрофагов. Евро. Дж. Клеточная биология. 2002; 81: 351–362. [PubMed] [Академия Google]
Ory S, Destaing O, Jurdic P. Динамика микротрубочек по-разному регулирует активность Rho и Rac и запускает образование Rho-независимого стрессового волокна в поликарионах макрофагов. Евро. Дж. Клеточная биология. 2002; 81: 351–362. [PubMed] [Академия Google]
75. Cox D, et al. Требования как к Rac1, так и к Cdc42 при взъерошении мембран и фагоцитозе лейкоцитов. Дж. Эксп. Мед. 1997; 186:1487–94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Maeda T, et al. RhoA опосредует экспрессию мРНК матриксной металлопротеиназы-9, индуцированной кислотным внеклеточным pH, через фосфолипазу D1 в метастатических клетках меланомы B16-BL6 мыши. Междунар. Дж. Онкол. 2016;48:1251–1257. [PubMed] [Google Scholar]
77. Виллигер Б.Т., Хо В.Т., Экстон Дж.Х. Фосфолипаза D опосредует матриксную металлопротеиназу-9секреция в клетках фибросаркомы человека, стимулированных форболовым эфиром. Дж. Биол. хим. 1999; 274: 735–738. [PubMed] [Google Scholar]
78. Kang DW, Min DS. Тромбоцитарный фактор роста увеличивает экспрессию фосфолипазы D1, но не фосфолипазы D2 через сигнальный путь NFκB и усиливает инвазию клеток рака молочной железы. Рак Летт. 2010; 294:125–133. [PubMed] [Google Scholar]
Рак Летт. 2010; 294:125–133. [PubMed] [Google Scholar]
79. Horchani H, De Saint-Jean M, Barelli HL, Antonny B. Взаимодействие мотива мембранного сенсора Spo20 с фосфатидной кислотой и другими анионными липидами и влияние мембранного окружения. ПЛОС Один. 2014;9: 1–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Yu C-H, et al. Кластеры интегрин-матрицы образуют подосомоподобные адгезии в отсутствие сил тяги. Cell Rep. 2013; 5:1456–1468. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Sánchez-Barrena MJ, et al. Bin2 представляет собой белок N-BAR, моделирующий мембрану, который влияет на подосомы лейкоцитов, их подвижность и фагоцитоз. ПЛОС Один. 2012;7:e52401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Oikawa T, et al. IRSp53 опосредует формирование подосом через VASP в клетках NIH-Src. ПЛОС Один. 2013; 8: 1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Sztacho M, et al. Белки BAR PSTPIP1/2 регулируют динамику подосом и резорбционную активность остеокластов. ПЛОС Один. 2016; 11:1–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2016; 11:1–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. van den Dries K, et al. Взаимодействие между myosin IIA-опосредованной сократимостью и целостностью актиновой сети управляет составом подосом и колебаниями. Нац. коммун. 2013;4:1412. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Spuul, стр. и др. . Значение RhoGTPases в формировании, характеристиках и функциях инвадосом. Малые ГТФазы 5 (2014). [Бесплатная статья PMC] [PubMed]
86. Brandenburg LO, Pufe T, Koch T. Роль фосфолипазы D в функции рецептора, связанного с G-белком. Мембраны (Базель). 2014;4:302–318. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Oude Weernink PA, López de Jesús M, Schmidt M. Передача сигналов фосфолипазы D: оркестровка с помощью PIP2 и малых GTPases. Наунин. Шмидебергс. Арка Фармакол. 2007;374:399–411. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. van Helden SFG, Hordijk PL. Регуляция подосом с помощью Rho GTPases в миелоидных клетках. Евро. Дж. Клеточная биология. 2011;90:189–97. [PubMed] [Google Scholar]
Евро. Дж. Клеточная биология. 2011;90:189–97. [PubMed] [Google Scholar]
89. Hanna, S., Miskolci, V., Cox, D. & Hodgson, L. Новый генетически кодируемый одноцепочечный биосенсор для Cdc42 на основе FRET, полезный для визуализации живых клеток. . PLoS One 9 (2014 г.). [Бесплатная статья PMC] [PubMed]
90. Spurrell DR, et al. Vav1 регулирует миграцию и адгезию дендритных клеток. Дж. Иммунол. 2009 г.;183:310–318. [PubMed] [Google Scholar]
91. van Helden SFG, et al. Опосредованная PGE2 потеря подосом в дендритных клетках зависит от сокращения актомиозина ниже оси RhoA-Rho-kinase. Дж. Клеточные науки. 2008; 121:1096–106. [PubMed] [Google Scholar]
92. Chellaiah MA, et al. Rho-A имеет решающее значение для организации подосом остеокластов, подвижности и резорбции костей. Дж. Биол. хим. 2000; 275:11993–2002. [PubMed] [Google Scholar]
93. Ishihara H, et al. Фосфатидилинозитол-4-фосфат-5-киназы I типа. Клонирование третьей изоформы и анализ делеций/замен членов этого нового семейства липидкиназ. Дж. Биол. хим. 1998;273:8741–8748. [PubMed] [Google Scholar]
Дж. Биол. хим. 1998;273:8741–8748. [PubMed] [Google Scholar]
94. Шульга Ю.В., Андерсон Р.А., Топхэм М.К., Эпанд Р.М. Изоформы фосфатидилинозитол-4-фосфат-5-киназы проявляют селективность ацильной цепи как в отношении субстрата, так и активатора липидов. Дж. Биол. хим. 2012; 287:35953–35963. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Divecha, N. et al . Взаимодействие PIP-киназы типа Iα с фосфолипазой D и роль местного образования фосфатидилинозитол-4,5-бисфосфата в регуляции активности PLD2. 19 (2000). [Бесплатная статья PMC] [PubMed]
96. Zhu T, et al. Фосфотидилинозотол-4-фосфат-5-киназа типа I регулирует остеокласты бифункциональным образом. Дж. Биол. хим. 2013; 288:5268–5277. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. de Vries IJM, et al. Фенотипическая и функциональная характеристика дендритных клеток клинической степени тяжести. Дж. Иммунотер. 2002; 25: 429–438. [PubMed] [Google Scholar]
98. Bowden ET, Coopman PJ, Mueller SC. Invadopodia: уникальные методы измерения деградации внеклеточного матрикса in vitro . Методы клеточной биологии. 2001; 63: 613–627. [PubMed] [Google Scholar]
Bowden ET, Coopman PJ, Mueller SC. Invadopodia: уникальные методы измерения деградации внеклеточного матрикса in vitro . Методы клеточной биологии. 2001; 63: 613–627. [PubMed] [Google Scholar]
99. Schindelin J, et al. Фиджи: Платформа с открытым исходным кодом для анализа биологических изображений. Нац. Методы. 2012; 9: 676–682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Войти
Эта статья
Опубликовано заранее 15 сентября 2022 г., дои: 10.1101/гр.2768390,122 Геном Res. 2022. 32: 1862-1875 гг.
.
- Исследования
- Загрузить со ссылкой на информацию о статье
- Ссылки на статьи через Web of Science
- Статьи Ruggieri, A. A.
- Статьи Ван Беллегема, С. М.
- Ссылка на PubMed
- Статьи Ruggieri, A.

- Статьи Ван Беллегема, С. М.
- Профиль для Ruggieri, A. A. http://orcid.org/0000-0003-1427-2667
- Профиль Ливраги, Л.http://orcid.org/0000-0002-2597-7550
- Профиль Льюиса, Дж. Дж. http://orcid.org/0000-0002-4170-9118
- Профиль Чикконарди, F.http://orcid.org/0000-0001-6509-6179
- Профиль Montgomery, S.H.http://orcid.org/0000-0002-5474-5695
- Профиль Ghezzi, A.


 Задания с рисунками
Задания с рисунками 


Leave A Comment